-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Idiopatické střevní záněty – predikce průběhu a včasná léčba*
Idiopathic inflammatory bowel disease – prediction and treatment
Currently the strongest predictors of disease course in Crohn’s disease and ulcerative colitis are the age at diagnosis, disease location and smoking habit. Younger age at the onset is associated with more aggressive disease both in Crohn’s disease and ulcerative colitis. Disease location in Crohn’s disease is associated with different types of complications: surgery and recurrence in upper gastrointestinal and proximal small bowel disease; and surgery in distal small bowel disease and peri-anal lesions in rectal disease. In ulcerative colitis, extensive colitis is clearly associated with more severe disease. Active smoking globally increases disease severity in Crohn’s disease but decreases it in ulcerative colitis. In Crohn’s disease, proximal small bowel and upper gastrointestinal tract location is associated with risk of recurrence and surgery; small bowel disease with risk of surgery; and colonic disease, and particularly rectal disease, is associated with increased risk of peri-anal lesions. In ulcerative colitis, extensive colitis is associated with increased risk of colorectal cancer and colectomy. Individual treatment of patients with inflammatory bowel disease depends on disease location and severity. There is increasing evidence that early intervention with immunosuppressives or biologic agents aimed at tumor necrosis factor-α usually has rapid and prolonged benefits, including steroid sparing, reductions in hospitalizations and, reductions in the need for surgery.
Key words:
inflammatory bowel disease, Crohn’s disease, ulcerative colitis, predict, therapy.
Autori: Karel Lukáš
Pôsobisko autorov: Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 315-320
Kategória: Přehledový článek
Súhrn
Nejsilnějšími prediktory průběhu nemoci jsou u Crohnovy nemoci a ulcerózní kolitidy věk v čase diagnózy, lokalizace nemoci a kouření. Mladý věk v začátku je spojen s agresivnějším průběhem jak Crohnovy nemoci, tak ulcerózní kolitidy. Lokalizace Crohnovy nemoci je spojena s odlišnými typy komplikací – při lokalizaci v horním trávicím traktu a v proximálním tenkém střevě je to častý chirurgický výkon a rekurence nemoci, při lokalizaci v distálním tenkém střevě je to operace a u rektálního postižení jsou to perianální léze. Extenzivní ulcerózní kolitida je spojena obvykle s těžkým průběhem. Aktivní kouření zhoršuje Crohnovu nemoc, ale zmenšuje tíži ulcerózní kolitidy. Individuální léčba pacientů s idiopatickými střevními záněty je závislá na lokalizaci a tíži onemocnění. Je prokázáno, že časné nasazení léčby imunosupresivy nebo biologické léčby zaměřené na tumory nekrotizující faktor-α, rychle zlepší stav nemocného, šetří dávku kortikosteroidů, zmenší počet hospitalizací a sníží nutnost chirurgických výkonů.
Klíčová slova:
idiopatické střevní záněty, Crohnova nemoc, ulcerózní kolitida, predikce, léčba.Úvod
Hned na počátku vyslovím svou zkušenost: idiopatické střevní záněty jsou nemoci, u kterých je předvídání průběhu, komplikací, relapsů a úspěšnosti léčby zcela nepředvídatelné. Spíše lze prorokovat u ulcerózní kolitidy (UC), než u nemoci Crohnovy a zcela beznadějné je to u kolitidy intermediální. U Crohnovy nemoci (CN) si lze tipovat a výsledek lze očekávat v kurzu 1 : 1. V následujících řádcích je pokus o shrnutí literárních údajů z posledních let, kdy je uváděna možnost předvídání podle klinických faktorů, sérologických markerů, laboratorních ukazatelů, genetiky, endoskopie (hojení slizničních změn), histologie a odpovědi na léčbu, jejímž základním cílem musí být včasnost! Předpověď průběhu a chování idiopatického střevního zánětu těsně souvisí s léčbou, zejména s léčbou včasnou.
Idiopatické střevní záněty jsou autoimunitní chronickou zánětlivou nemocí, která postihuje v USA kolem 1,4 milionu osob a 2,2 milionu osob v Evropě (1, 2).
CN je heterogenní jednotka, je klasifikována podle: 1. věku v čase diagnózy, 2. podle lokalizace a 3. podle chování nemoci (tab. 1) (3, 4). U UC počítá Montrealská klasifikace se třemi typy dle rozsahu (tab. 2) (3).
Tab. 1. Vídeňská a Montrealská klasifikace Crohnovy nemoci 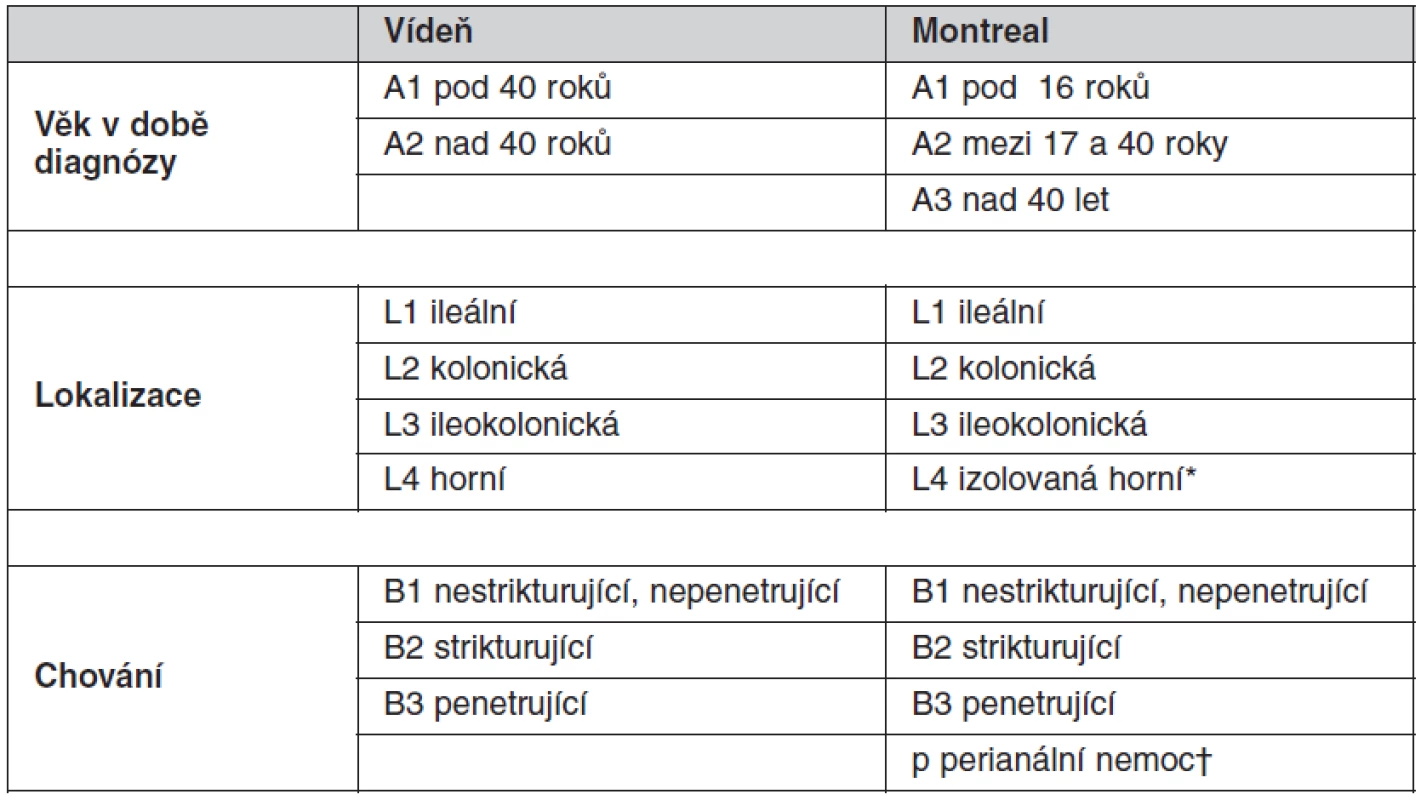
*L4 modifikovat – může být přidána k L1–L3, je-li přítomno konkomitující postižení horního trávicího traktu. †“p” je přidáno k B1–B3, je-li přítomna konkomitující perianální nemoc. (dle Satsangi J, Silverberg MS, Vermeire S, Colombel JF. The Montreal classification of inflammatory bowel disease: controversies, consensus, and implications. Gut 2006; 55(6): 749–753. doi: 10.1136/gut.2005.082909). Tab. 2. Montrealská klasifikace rozsahu ulcerózní kolitidy (UC) 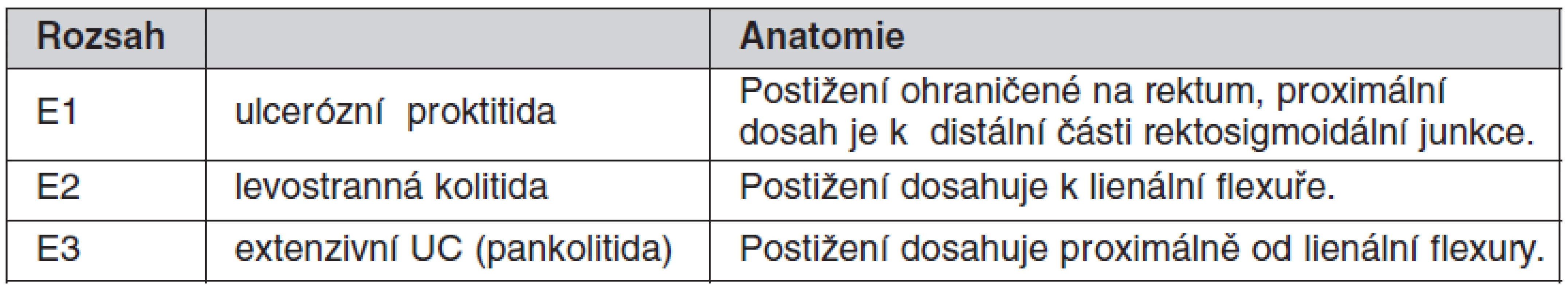
(dle Satsangi J, Silverberg MS, Vermeire S, Colombel JF. The Montreal classification of inflammatory bowel disease: controversies, consensus, and implications. Gut 2006; 55(6): 749–753. doi: 10.1136/gut.2005.082909). Progresivní průběh a rozvoj komplikací je nacházen u více než 2/3 pacientů s Crohnovou nemocí (CN) (5, 6) a u méně než 1/3 pacientů s ulcerózní kolitidou (UC) (7, 8).
Lokalizace
Co lze očekávat v průběhu CN při určitých lokalizacích? Je-li CN lokalizována v terminálním ileu jde o větší riziko striktur a penetrací (9, 10) a zvýšený počet chirurgických zásahů (11, 12).
Chirurgická rekurence je definována jako epizoda zvýšení aktivity nemoci, která vyžaduje chirurgickou intervenci jak se změnou, tak beze změny medikace. Chirurgická rekurence je klasifikována na resekční (část střeva je odstraněna) a ostatní typy (drenáž abscesu, operace píštěle atd.) (13).
Při postižení proximálního tenkého střeva a horní části trávicího traktu je popisováno zvýšené riziko rekurence u 72,3 % (13) a zvýšení četnosti chirurgických zásahů – první chirurgickou rekurenci má 31,6 % operovaných pacientů v průběhu 10 let po stanovení diagnózy (14). Více než polovina všech pacientů s CN má 1 až 2 rekurence během prvních 10 let od stanovení diagnózy. Fenotyp a postižení horní části trávicího traktu jsou zřejmě důležité pozitivní prediktory rekurence nemoci (13). Při CN tračníku, zejména se současným postižením rekta, lze očekávat rozvoj perirektální nemoci (15).
Stav Crohnovy nemoci v čase diagnózy
Predikce chronicity a průběhu onemocnění dle věku v čase diagnózy – jak u CN, tak u UC – čím dříve nemoc začne, tím má agresivnější průběh! Tato předpověď je částečně možná i dle primární lokalizace nemoci. Je-li CN postiženo terminální ileum, je zvýšené riziko striktur a penetrací a zvýšená potřeba chirurgických zásahů. Při postižení tenkého střeva horní části trávicího traktu je zvýšeno riziko rekurence nemoci.
Jaké chování lze očekávat dle stavu CN v čase diagnózy? Je-li při stanovování diagnózy zjišťován již jasný typ ať fibrostenózující, tak perforující, je možné očekávat komplikace a nutný časný chirurgický zákrok, eventuálně nutnost podání imunosuprese (16). Jen 12 % nemocných nemá podle některých autorů relaps do 10 let po stanovení diagnózy. Nemocní vyžadující chirurgický zákrok jsou nepoddajní ke konzervativní léčbě, mají vnitřní píštěle, střevní obstrukci, krvácí, nebo mají toxické megakolon nebo akutní perforaci. Na pooperační rekurence mohou mít pravděpodobně vliv věk, pohlaví, lokalizace nemoci, trvání a chování nemoci před operací a nález granulomů. Ale je známo, že jen kouření je definitivně spojeno se zvýšeným rizikem pooperační rekurence. Je-li při prvních vyšetřeních a stanovení diagnózy již nalezena perianální léze, je zvýšené riziko pro nutnost chirurgické resekce s pooperační rekurencí (17).
Ve studiích s 361 a 1123 pacienty s CN je do 5 let od stanovení diagnózy invalidizováno neskutečných 57,9 %, resp. 85,2 % nemocných! Těžký průběh se vyskytuje u 37,4 % pacientů s CN. K předpokladům rozvoje CN do těžkého komplikovaného a devastujícího onemocnění patří: věk pod 40 let a nízký věk v čase diagnózy, spíše postižení střeva tenkého než tlustého, ileokolonická lokalizace, perianální postižení, výrazný úbytek na váze, horečky provázející exacerbaci onemocnění, tvorba striktur, penetrující onemocnění, iniciální potřeba kortikosteroidů, imunosuprese a anti-TNF-α, časná potřeba hospitalizace a chirurgického zásahu s časnou pooperační rekurencí, vysoké hladiny trombocytů a pochopitelně kouření. I extraintestinální manifestace signalizují komplikovanější průběh (18, 19).
Rozvoj komplikovaného a devastujícího onemocnění lze očekávat u pacientů s CN, kteří jsou často hospitalizováni a potřebují aplikaci glukokortikosteroidů již při počátečním vzplanutí, nebo vyžadují brzké podání imunosuprese a biologické léčby (20).
Předpověď průběhu podle chirurgických zásahů
Těžký průběh lze očekávat v případech, kdy je provedena resekce dvou segmentů střeva, nejméně v délce 70 cm, nebo části tračníku, nebo je-li chirurgicky ošetřovaná perianální nemoc, nebo je provedena definitivní stomie (20).
Sérologické markery
Roli v predikci hrají i sérologické markery. Dlouhodobé markery predikují účinnost a/nebo vedlejší účinek konzervativní léčby, patří k nim thiopurinmethyltransferáza (TPMT), anti--Saccharomyces cerevisiae antibodies (ASCA) – protilátky proti Saccharomyces cerevisiae, anti-neutrophilic cytoplasmic antibodies (p-ANCA) – což je skupina autoprotilátek, zejména IgG, proti antigenům v cytoplazmě neutrofilních granulocytů a monocytů, NOD2/CARD15 (nucleotide-binding oligomerization domain containing 2), ATG16L1 (autophagy-related protein 16-1), IL23R (interleukin 23 receptor). Poslední tři patří zatím spíše do oblasti výzkumu, nejsou užívány rutinně. Stejně jsou zatím užívány i další sérologické biomarkery: Anti-OmpC (IgA protilátka proti porinu C proteinu Escherichia coli), porin (integrální protein ve vnější cytoplazmatické membráně G-bakterií a vnějších membránách plastidů a mitochondrií), který je pozitivní v 55 % u CN a jen v 5–11 % u UC a u zdravých kontrol je přítomen v pozitivní formě v 5 %. Anti-12 IgA je bakteriální sekvence odvozená od Pseudomonas fluorescens a je pozitivní ve 30–50 % u CN a jen v 10 % u UC. PAB jsou antipankreatické protilátky a bývají pozitivní u CN ve 30 % a u UC jen v 2–6 %. Výhledově je zvažováno užití CBir1 flagelinu, což je dominantní antigen střevní mikrobiální myší flóry (colitic mice).
Krátkodobé sérologické markery predikují relaps a patří k nim zejména C-reaktivní protein (CRP), který je markerem systémového zánětu. Jedná se o protein produkovaný hepatotycy stimulací interleukinu-6, interleukinu 1ß a TNF-α. CRP je hodnocen jako pozitivní obvykle od hodnoty > 20 mg/l. U relapsu CN je zvýšen v 70–100 % a je považován za velmi důležitý prognostický faktor, u relapsu UC je zvýšen v 50–70 %.
Stále má velkou výpovědní hodnotu sedimentace červených krvinek (FW – podle Fåhræuse-Westergrena), která bývá v těchto případech hodnocena jako pozitivní, je-li vyšší (jen!) než 15 mm/hodinu (21–23).
Fekální markery
Fekální calprotectin (36 kDa calcium-and zinc-binding protein) ukazuje migraci neutrofilů do GIT, zvýšení nad 50 μg/g predikuje 13× zvýšené riziko relapsu (21–24). Calprotectin není specifický pro střevní zánět, může být při: užití nesteroidních antiflogistik, střevní infekci a střevní malignitě. Pro diagnózu idiopatického střevního zánětu pro dospělé i děti je senzitivita 95% a specificita 91% (25, 26). Calprotectin je silnějším prediktivním markerem pro relaps u UC než u CN (26).
Pro laktoferrin je pro diagnózu idiopatického střevního zánětu senzitivita 80% a specificita 82% (28, 29). Přítomnost p-ANCA u levostranné UC signalizuje špatnou odpověď na konzervativní léčbu a predikuje možnost kolektomie. Přítomnost p-ANCA u CN levého tračníku ukazuje na příznivou odpověď na léčbu. ASCA jsou pozitivní nejčastěji u CN s postižením ilea, u nemocných, u kterých nemoc začne v mladém věku nebo u dětí, u fibrostenózující nebo penetrující formy, při opakovaných chirurgických zákrocích, při lokalizaci ileokolonické a tam, kde je nutná resekce v této oblasti. Jsou pozitivní u 50–60 % pacientů s CN a jen u 10–15 % nemocných s UC. C-reaktivní protein je markerem systémového zánětu. Jedná se o protein akutní fáze produkovaný hepatocyty stimulací interleukinu-6, interleukinu 1ß a tumory nekrotizujícího faktoru-α (TNF-α). Je považován za důležitý prognostický faktor u CN, kde v relapsu je pozitivní v 70–100 %, kdežto u UC v relapsu jen u 50–60 % (24).
Endoskopická predikce
Tíže a rozsah slizničních lézí přímo odráží aktivitu nemoci, a přímo může napomoci předpovědět agresivní chování nemoci, což je pravda známá mnoho let. Závažné léze u CN definované jako hluboké a rozsáhlé nejméně v jedné části tračníku jsou spojovány se zvýšeným rizikem penetrujících komplikací a nutným následným chirurgickým výkonem. Závažné endoskopicky prokazatelné léze v průběhu těžké ataky UC jsou spojovány se zvýšeným rizikem kolektomie jak v průběhu krátkodobém, tak dlouhodobém. Dosažení slizničního hojení pomocí konzervativní léčby je spojeno s menší potřebou chirurgických výkonů a hospitalizace (30).
Crohnova nemoc a věk
Začátek v mládí je spojen obvykle s velkou tíží onemocnění a dokonce s velkým rizikem devastujícího onemocnění (20). Časný začátek onemocnění s rychlým úbytkem na váze v době diagnózy je spojen s těžkým onemocněním a ireverzibilním poškozením tkáně (20).
Začátek onemocnění ve vysokém věku bývá spojen jen s lehkým zvýšením mortality (13).
Crohnova nemoc a obezita
Produkce TNF-α v tukové tkáni je zvýšená. Z tohoto důvodu mají obézní nemocní s CN těžší onemocnění. Do studie týkající se této problematiky bylo zařazeno 148 pacientů. Z nich 32,4 % mělo BMI 25 kg/m2 nebo vyšší v době diagnózy. Tito nemocní byli starší (35 let) než druhá skupina s BMI menším než 25 kg/m2 (22 let). Počet chirurgických výkonů, navyšování léčby a distribuce onemocnění ve skupinách nejsou odlišné. Signifikantní rozdíl byl nalezen v čase potřeby prvního chirurgického výkonu (24 měsíců pro pacienty s vyšším BMI vs. 252 měsíců pro pacienty s nižším BMI). CN u obézních pacientů má kratší interval pro první chirurgický výkon (31).
Idiopatické střevní záněty a fertilita
U pacientek s UC je fertilita normální. Počet těhotenství u těchto pacientek je podobný jako ve zdravé populaci (32).
U CN je situace komplikovanější. Při inaktivitě nemoci je fertilita normální, u aktivní CN jsou popisovány poruchy fertility a hraje zde roli i stav výživy. Po stanovení diagnózy CN byla zjištěn významně nižší počet dětí ve srovnání s kontrolami. Důležitou roli hrají údajně vlivy psychosociální (33–35).
Na mužskou fertilitu mají při léčbě ISZ pravděpodobně vliv následující látky: sulfasalazin, metotrexát, 6-merkaptopurin (6‑MP). Je zjišťován nepříznivý průběh u těhotenství počatých muži s ISZ léčenými 6-MP nejméně 3 měsíce před početím (36). Všechny výše uvedené léky by měly být vynechány 3 měsíce před plánovaným početím (36–39), protože nová spermiogeneze trvá 72 dní (40). TNF-α podporuje přežívání buněk během spermatogenézy v krysím varleti a logicky anti-TNF-α tento účinek blokuje (41). Proto je doporučováno vynechat anti-TNF-α 3 měsíce před plánovaným početím.
Idiopatické střevní záněty a těhotenství
Nejdůležitějším prediktem průběhu ISZ v těhotenství je aktivita nemoci v čase koncepce. Je-li nemoc inaktivní, procento vzplanutí v těhotenství se neliší od „netěhotných“ (42). Je-li nemoc aktivní, je 60% šance, že nemoc zůstane aktivní nebo se zhorší (43).
Otěhotněním v aktivní fázi UC se výrazně zvyšuje riziko relapsu. U UC zůstává nemoc aktivní v 70 %, ke zlepšení nebo i k remisi dojde ve 30 %. U CN ke zhoršení dojde v 65 % a dokonce se vyskytují názory podporující ukončení těhotenství (44). Pokud se ISZ objeví v těhotenství poprvé, tak je to obvykle v I. nebo ve II. trimestru. Relaps střevního zánětu v těhotenství nastává v případě UC nejčastěji v I. trimestru a v případě CN ve III. trimestru.
Kolektomie a ileostomie provedené před těhotenstvím nemají vliv na průběh střevního zánětu. Průběh dalších těhotenství nemusí být stejný, i když obvykle tomu tak je. Spekulace o sezonním výskytu ISZ v těhotenství se nepotvrdily (45). Většina těhotenství u ISZ končí porodem zdravého dítěte.
Riziko léčby aminosalicyláty a kortikosteroidy v těhotenství je menší než riziko, že by nemoc zůstala neléčena. Pokud je nutné v léčbě užít anti-TNFα, je známo, že prochází placentou ve III. trimestru a doporučení jsou následující: u aktivního onemocnění aplikovat poslední infuzi infliximabu před 22. týdnem těhotenství, a při léčení adalimumabem jej nepodávat 6–8 týdnů před porodem. Dojde-li do porodu k relapsu, který vyžaduje léčbu, pak podávat kortikosteroidy. V léčbě anti‑TNF‑α je vhodné pokračovat co nejdříve po porodu (40).
Idiopatické střevní záněty a kouření
Aktivní kouření je spojeno s aktivitou CN (46), s rozvojem striktur a píštělí (47) a s nutností časté hospitalizace (48, 49).
U UC je tomu naopak, kouření je spojeno se snížením agresivity onemocnění (50, 51), snížením potřeby kolektomie (52).
Extenzivní ulcerózní kolitida
Pankolitida je spojena se zvýšeným rizikem kolektomie (49, 53), za dekádu trvání s 20% rizikem rozvoje kolorektálního karcinomu, což ale platí až ve druhé dekádě trvání kolitidy. Rozvoj karcinomu tračníku je při pankolitidě větší než jen při postižení rekta (54). Pacienti s ulcerózní proktitidou, levostrannou kolitidou a pankolitidou mají lehce zvýšenou mortalitu (98%, 96%, a 93%). Přežití se neliší od přežití nemocných s CN. Obstrukční respirační onemocnění, zejména bronchitida, emfyzém a astma mají u UC zvýšenou mortalitu (95% CI = 1,1–2,2) (55).
Distální proktitida
Možná je extenze do proximálních partií tračníku při vzniku v mladém věku a zejména při přítomné primární sklerózující cholangitidě (56).
Předpověď kolektomie u ulcerózní kolitidy
U extenzivní kolitidy je předpokládána kolektomie ve 35 %, u levostranné kolitidy < 20 %, u proktitidy < 10 % (53).
Včasná léčba idiopatických střevních zánětů
Aminosalicyláty jsou obvykle prvním lékem, který je pacientům podáván. Gastroenterologové s nimi mají dobré zkušenosti, znají jejich účinnost a většinou jsou dobře tolerovány, protože jsou minimálně toxické, bezpečné a mají nízký výskyt vedlejších účinků. Jsou-li aminosalicyláty bez efektu, vyžadují časné podání kortikosteroidů (2).
Dlouhodobá léčba kortikosteroidy může mít, jak je obecně známo, vedlejší účinky. Kortikodependence vzniká pravděpodobně po 12 měsících jejich podávání. Proto je zásadou podat imunosupresiva včas, protože jsou „steroidy šetřící“. Užívání azathioprinu není spojeno ani se zvýšeným ani se sníženým rizikem rizika rekurence (13).
ISZ lépe reaguje a rychle odpoví na léčbu časnou. Rezistence k léčbě se zvyšuje s přibývajícím časem (56, 57), ale to všechno směřuje k léčbě „top-down“ (58).
Včasná aplikace kombinované léčby anti-TNF-α a imunosupresivy má zásadní vliv na indukci a udržení remise u luminální i fistulizující CN a je prevencí komplikací. Tato léčba změní přirozený průběh nemoci a je prevencí pozdních komplikací. U nemocných s nedostatečnou odpovědí na tuto léčbu nebo u těch, kteří jsou intolerantní, je doporučeno zvýšení dávky nebo změna na alternativní biologické agens (59). Prospěšná je pak volba adalimumabu u pacientů s CN: dosud neléčených biologickými agens, neodpovídajících na léčbu infliximabem, netolerujících infliximab INF, nekuřáků s krátce trvající CN a u extraintestinálních manifestací (60).
Včasné nasazení léčby (anti-TNF-α a imunosupresiv) snižuje riziko chirurgického zákroku a prodlužuje čas, než je chirurgický zákrok potřebný nebo nutný. Ale! Neprodlouží čas k reoperaci u kuřáků i nekuřáků s CN. Ale kouření snižuje riziko kolektomie u UC (61).
Anti-TNF-α hojí slizniční léze, uzavírají píštěle a tak snižují potřebu chirurgických výkonů a hospitalizací. Časná aplikace kombinované léčby má vliv na dlouhodobý průběh CN (62, 63, 64)! Při imunosupresivní léčbě před podáním anti-TNF α nedojde po vysazení imunosupresiv, po 6 měsících podávání kombinované léčby, k ovlivnění výsledků. Ale pro konečné výsledky je důležitá ještě před nasazením léčby biologické: 1. předchozí léčba a 2. tíže onemocnění (65, 66). Ale proti tomu je uváděno, že je-li CN v klinické remisi při kombinaci azathioprin a infliximab, je po vysazení azathioprinu vysoké riziko relapsu u pacientů s dlouhodobou kombinační léčbou (< 27 měsíců) a se známkami zánětu (CRP > 5 mg/l a trombo > 298) (67).
Predikce průběhu idiopatických střevních zánětů a léčba chirurgická
Chirurgický zákrok je obvyklý u ISZ refrakterního ke konzervativní léčbě a komplikovaného (obstrukce, septikémie). UC je daleko lépe ovlivnitelná konzervativní léčbou; ve dvacetiletém průběhu je operováno 20 % nemocných. CN je daleko refrakternější k medikamentózní léčbě; ve třicetiletém průběhu je operováno 90 % nemocných. U CN je pravděpodobnost operačního řešení v 1. roce nemoci 20–40 %, do 10 let nemoci je 30–70 % a po 15. roce nemoci je dokonce 70–90 % (17, 68–74).
Retrospektivní studie z let 1955–1989 u 907 pacientů ukázala následující výsledky. U pacientů s primární ileocékální CN je procento resekce 61 %, 77 % a 83 % v 1., 5. a 10. roce po stanovení diagnózy. Relapsy se vyskytují v 28 % a 36 % v 5 a 10 letech po první resekci. Přítomnost perianální CN a dlouhý resekovaný segment zvyšují incidenci rekurence a resekce pro palpovatelnou rezistenci a/nebo pro absces snižují procento rekurence (70).
Chirurgický zákrok při CN není obvykle definitivně kurativní, protože nastává rekurence endoskopická: v 1. roce po resekci se objeví jako nová léze v neoterminálním ileu v 70 %, jako rekurence klinická po 5 letech ve 20–60 % a jako rekurence chirurgická v 15–60 %, což znamená, že tito nemocní potřebují další resekci pro komplikaci nebo refrakternost (17, 75–77). Tíže pooperační rekurence u CN může napomoci v předpovědi rizika klinického relapsu a potřeby dalšího nutného chirurgického zákroku (30).
Včasná chirurgická resekce zlepší kvalitu života, sníží pooperační morbiditu a je při ní kratší resekát (78–80). Ještě není k dispozici prospektivní studie ke zhodnocení prospěšnosti časného chirurgického zákroku vs. konvenční konzervativní léčba (81).
Závěr
Predikce vývoje ISZ je ovlivněna: 1. odpovědí na konzervativní léčbu a závislostí na ní; 2. potřebou prolongované konzervativní léčby; 3. spontánními remisemi, jejich frekvencí, délkou a udržením; 4. nutností chirurgického výkonu a rekurencí po operaci; 5. komplikacemi a extraintestinálními manifestacemi; 6. extenzí zánětu a 7. rizikem vzniku nádorů.
Neexistuje jednoduchý test (s oblibou nazývaný „zlatý standard“) k určení diagnózy ISZ, který by nemoc jasně zařadil pomocí: anamnestických dat, vyšetření fyzikálního nebo laboratorního a zánětu zjištěného endoskopicky, histologicky nebo radiodiagnosticky. Obtížné bývá často i zhodnocení relapsu i remise (82).
V posledních dekádách jsou za tzv. zlatý standard pro diagnózu aktivního idiopatického střevního zánětu pokládány endoskopicky prokazatelné změny potvrzené histologickým vyšetřením!
„Pravý čas“ k zahájení účinné a včasné léčby je před rozvojem slizničního poškození a následné poruchy funkce (83). Čím dříve se začne léčit, tím lépe (84). Protože, čím dříve CN začne, tím má agresivnější průběh. Čím dříve nemoc začne, tím hůře pro další vývoj a léčení nemoci.
Závěry a poučení jsou uvedeny v tabulce 3.
Zkratky
6-MP – 6-merkaptopurin
ASCA – anti-Saccharomyces cerevisiae antibodies
ATG16L1 – autophagy-related protein 16-1
BMI – body mass index
CN – Crohnova nemoc
CRP – C-reaktivní protein
IL23R – interleukin 23 receptor
ISZ – idiopatický střevní zánět
NOD2/CARD15 – skupina autoprotilátek proti antigenům v cytoplazmě neutrofilních granulocytů a monocytů
p-ANCA – protilátky proti Saccharomyces cerevisiae (anti-neutrophilic cytoplasmic antibodies)
TNF-α – tumor necrosis factor alfa
TPMT – thiopurinmethyltransferáza
UC – ulcerózní kolitida
Podpořeno VZ MSM 0021620820.
*Předneseno dne 3. listopadu 2010 na pravidelném sympóziu Gastroenterologického oddělení IV. interní kliniky 1. LF UK a VFN v Praze o idiopatických střevních zánětech na téma „Včasná diagnóza a léčba idiopatických střevních zánětů“.
Adresa pro korespondenci:
MUDr. Karel Lukáš, CSc.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
e-mail: klukas@vfn.cz
Zdroje
1. Loftus EV. Jr. Clinical epidemiology of inflammatory bowel disease: incidence, prevalence, and environmental influences. Gastroenterology 2004; 126 : 1504–1517.
2. Engel MA, Neurath MF. New pathophysiological insights and modern treatment of IBD. J. Gastroenterol 2010; 45 : 571–583.
3. Satsangi J, Silverberg M S, Vermeire S, Colombel J-F. The Montreal classification of inflammatory bowel disease: controversies, consensus, and implications. Gut 006; 55(6): 749–753.
4. Gasche C, cholmerich J, rynskov J, et al. A simple classification of Crohn‘s disease: report of the Working Party for the World Congresses of Gastroenterology, Vienna 1998. Inflamm Bowel Dis 000; 6(1): 8–15.
5. Louis E, ollard A, ger AF, egroote E, boul Nasr El Yafi FA, elaiche J. Behaviour of Crohn‘s disease according to the Vienna classification: changing pattern over the course of the disease. Gut 001; 49(6): 777–782.
6. Cosnes J, Cattan S, Blain A, et al. Long-term evolution of disease behavior of Crohn‘s disease. Inflammatory Bowel Diseases 2002; 8(4): 244–250.
7. Michener WM, Whelan G, Greenstreet RL, Farmer RG. Comparison of the clinical features of Crohn‘s disease and ulcerative colitis with onset in childhood or adolescence. leve Clin Q 1982; 49 : 13–16.
8. Hoie O, Wolters FL, Riis L, et al. Low colectomy rates in ulcerative colitis in an unselected European cohort followed for 10 years. astroenterology 007; 132 : 507–515.
9. Louis E, Michel V, Hugot JP, Reenaers C, et al. Early development of stricturing or penetrating pattern in Crohn‘s disease is influenced by disease location, number of flares, and smoking but not by NOD2/CARD15 genotype. ut 2003; 52 : 552–557.
10. Lakatos PL, Czegledi Z, Szamosi T, et al. Perianal disease, small bowel disease, smoking, prior steroid or early azathioprine/biological therapy are predictors of disease behavior change in patients with Crohn‘s disease. orld J Gastroenterol 009; 15 : 3504–3510.
11. Henckaerts L, Van Steen K, Verstreken I, et al. Genetic risk profiling and prediction of disease course in Crohn‘s disease patients. lin Gastroenterol Hepatol 009; 7 : 972–980.
12. Romberg-Camps MJ, Dagnelie PC, Kester AD, et al. Influence of phenotype at diagnosis and of other potential prognostic factors on the course of inflammatory bowel disease. m J Gastroenterol 009; 104 : 371–383
13. Wolters FL, Russel MG, Sijbrandij J, et al. Phenotype at diagnosis predicts recurrence rates in Crohn‘s disease. ut 2006; 55 : 1124–1130.
14. Chow DK, Sung JJ, Wu JC, Tsoi KK, Leong RW, Chan FK. Upper gastrointestinal tract phenotype of Crohn‘s disease is associated with early surgery and further hospitalization. Inflamm Bowel Dis 2009; 15 : 551–557.
15. Hellers G. Occurrence and outcome after primary treatment of anal fistulae in Crohn‘s disease. Gut 980; 21 : 525–527.
16. Louis E, ollard A, ger AF, egroote E, boul Nasr El Yafi FA, elaiche J. Behaviour of Crohn‘s disease according to the Vienna classification: changing pattern over the course of the disease. Gut 001; 49(6): 777–782.
17. Bernell O, et al. Risk factors for surgery and postoperative recurrence in Crohn‘s disease. Ann Surg January 2000; 231 : 38–45.
18. Loly C, Belaiche J, Louis E. Predictors of severe Crohn‘s disease. cand J Gastroenterol 2008; 43 : 948–954.
19. Beaugerie L, eksik P, ion-Larmurier I, endre JP, osnes J. Predictors of Crohn‘s disease. Gastroenterology 2006; 130(3): 650–656.
20. Loly C, Belaiche J, Louis E. Predictors of severe Crohn‘s disease. cand J Gastroenterol 2008; 43 : 948–954.
21. Tibble JA, igthorsson G, ridger S, agerhol MK, jarnason I. Surrogate markers of intestinal inflammation are predictive of relapse in patients with inflammatory bowel disease. Gastroenterology 000; 119(1): 15–22.
22. Tibble J, Teahon K, Thjodleifsson B, et al. A simple method for assessing intestinal inflammation in Crohn‘s disease. ut 000; 47 : 506–513.
23. Gisbert JP, ermejo F, érez-Calle JL, et al. Fecal calprotectin and lactoferrin for the prediction of inflammatory bowel disease relapse. Inflamm Bowel Dis 009; 15(8): 1190–1198.
24. Zisman TL. Novel diagnostic and prognostic modalities in inflammatory bowel disease. Med clin north Am January 2010; 94(1): 155–157.
25. von Roon AC, Karamountzos L, Purkayastha S, t al. Diagnostic precision of fecal calprotectin for inflammatory bowel disease and colorectal malignancy. m J Gastroenterol 2007; 102 : 803–813.
26. Wagner M, Peterson C GB, Ridefelt P, Sangfelt P, Carlson M. Fecal markers of inflammation used as surrogate markers for treatment outcome in relapsing inflammatory bowel disease. World J astroenterol 2008 September 28; 14(36): 5584–5589.
27. Costa F, Mumolo MG, Ceccarelli L, et al. Calprotectin is a tronger predictive marker of relapse in ulcerative colitis than in Crohn‘s disease. ut 005; 54 : 364–368.
28. Gisbert JP, ermejo F, érez-Calle JL, et al. Fecal calprotectin and lactoferrin for the prediction of inflammatory bowel disease relapse. Inflamm Bowel Dis 009; 15(8): 1190–1198.
29. D‘Inca R, Dal Pont E, Di Leo V, t al. Calprotectin and lactoferrin in the assessment of intestinal inflammation and organic disease. nt J Colorectal Dis 007; 22 : 429–437.
30. Allez M, Lemann M. Role of endoscopy in predicting the disease course in inflammatory bowel disease. World J Gastroenterol 010; 16(21): 2626–2632.
31. Hass DJ, Brensinger CM, Lewis JD, Lichtenstein GR. The impact of increased body mass index on the clinical course of Crohn‘s disease. lin Gastroenterol Hepatol 006; 4(4): 482–488.
32. Ida A, Koyama K. Ulcerative colitis and pregnancy. Nippon Rinsho 1999; 57(11): 2603–2607.
33. Alstead EM. Inflammatory bowel disease in pregnancy. Postgrad Med J 2002; 78 (923): 572.
34. Mayberry JF, Weterman IT. European survey of fertility and pregnancy in women with Crohn‘s disease: a case control study by European collaborative group. Gut 1986; 27 (7): 821–825.
35. Zimmermann EM. Approach to Gastrointestinal Disease in the Female Patiens. In: Textbook of Gastroenterology. Yamada T. (ed.) Lippincott: Williams & Wilkins 1999;1059–1080.
36. Rajapakse RO, Korelitz BI, Zlatanic J, Baiocco PJ, Gleim GW. Outcome of pregnancies when fathers are treated with 6‑mercaptopurine for inflammatory bowel disease. Am J Gastroenterol 2000; 95(3): 684–688.
37. Korelitz BI. Inflammatory bowel disease and pregnancy. Gastroenterol Clin N Amer 1998; 27(1): 213–224.
38. Heetun ZS, Byrnes C, Neary P, O‘Morain C. Review article: Reproduction in the patient with inflammatory bowel disease. Aliment Pharmacol Ther 2007; 26(4): 513–518.
39. Hinkes E, Plotkin D. Reversible drug-induced sterility in a patient with acute leukemia. JAMA 1973; 223(13): 1490–1491.
40. Lukáš K, ařízek A, otlas J, ovotný A. Idiopatické střevní záněty a těhotenství. Čas Lék čes 2010; 149 : 163–172.
41. Suominen JS, Wang Y, Kaipia A, Toppari J. Tumor necrosis factor-alpha (TNF-alpha) promotes cell survival during spermatogenesis, and this effect can be blocked by infliximab, a TNF-alpha antagonist. Eur J Endocrinol 2004; 151(5): 629–640.
42. Mogadam M, Korelitz BI, Ahmed SW, Dobbins WO 3rd, Baiocco PJ. The course of inflammatory bowel disease during pregnancy and postpartum. Am J Gastroenterol 1981; 75(4): 265–269.
43. Miller JP. Inflammatory bowel disease in pregnancy: a review. J R Soc Med 1986; 79(4): 221–225.
44. Reddy D, Murphy SJ, Kane SV, Present DH, Kornbluth AA. Relapses of inflammatory bowel disease during pregnancy: in-hospital management and birth outcomes. Am J Gastroenterol 2008; 103(5): 1203–1209.
45. Sonnenberg A. Date of birth in the occurrence of inflammatory bowel disease. Inflamm Bowel Dis 2009; 15(2): 206–211.
46. Cosnes J, Beaugerie L, Carbonnel F, Gendre JP. Smoking cessation and the course of Crohn‘s disease: an intervention study. astroenterology 001; 120 : 1093–1099.
47. Brant SR, Picco MF, Achkar JP, et al. Defining complex contributions of NOD2/CARD15 gene mutations, age at onset, and tobacco use on Crohn‘s disease phenotypes. nflamm Bowel Dis 003; 9 : 281–289.
48. Seksik P, Nion-Larmurier I, Sokol H, Beaugerie L, Cosnes J. Effects of light smoking consumption on the clinical course of Crohn‘s disease. nflamm Bowel Dis 009; 15 : 734–741.
49. Gower-Rousseau C, Dauchet L, Vernier-Massouille G, et al. The natural history of pediatric ulcerative colitis: a population-based cohort study. m J Gastroenterol 009; 104 : 2080–2088
50. Beaugerie L, Massot N, Carbonnel F, Cattan S, Gendre JP, Cosnes J. Impact of cessation of smoking on the course of ulcerative colitis. m J Gastroenterol 001; 96 : 2113–2116.
51. Boyko EJ, Perera DR, Koepsell TD, Keane EM, Inui TS. Effects of cigarette smoking on the clinical course of ulcerative colitis. cand J Gastroenterol 988; 23 : 1147–1152.
52. Szamosi T, Banai J, Lakatos L, et al. Early azathioprine/biological therapy is associated with decreased risk for first surgery and delays time to surgery but not reoperation in both smokers and nonsmokers with Crohn‘s disease, while smoking decreases the risk of colectomy in ulcerative colitis. ur J Gastroenterol Hepatol 2010; 22(7): 872–879.
53. Langholz E, Munkholm P, Davidsen M, Binder V. Colorectal cancer risk and mortality in patients with ulcerative colitis.Gastroenterology 992; 103 : 1444–1451.
54. Devroede GJ, Tailor WF, Bauer WG, Jackman RJ, Stickler GB. Cancer Risk and Life Expectancy of Children with Ulcerative Colitis. N Engl J Med 1971; 285 : 17–21.
55. Ekbom A, elmick CG, ack M, olmberg L, dami HO. Survival and causes of death in patients with inflammatory bowel disease: a population-based study. Gastroenterology 992; 103(3): 954–960.
56. Etchevers MJ, Aceituno M, García-Bosch O, Ordás I, Sans M, Ricart E, Panés J. Risk factors and characteristics of extent progression in ulcerative colitis. nflamm Bowel Dis 009; 15 : 1320–1325.
57. Oldenburg B, ommes D. Biological therapies in inflammatory bowel disease: top-down or bottom-up? Curr Opin Gastroenterol 007; 23 : 395–399.
58. Orchard T. NICE guidance for anti tumour necrosis factor therapy in Crohn’s disease: Chat does it mean for the inflammatory bowel disease. Frontline Gastroenterology 2010; 1(3): 144–146.
59. Krygier DS, o HH, ressler B. How to manage difficult Crohn‘s disease: optimum delivery of anti-TNFs. Expert Rev Gastroenterol Hepatol 2009; 3(4): 407–415.
60. Triantafillidis JK, Mantzaris G, Karagiannis J, et al. Similar response to adalimumab in patients with active Crohn‘s disease either naive to biologic agents or with prior loss of response or intolerance to infliximab. Rev Med Chir Soc Med Nat Iasi 2010; 114(1): 85–90.
61. Szamosi T, Banai J, Lakatos L, et al. Early azathioprine/biological therapy is associated with decreased risk for first surgery and delays time to surgery but not reoperation in both smokers and nonsmokers with Crohn‘s disease, while smoking decreases the risk of colectomy in ulcerative colitis. European Journal of Gastroenterology & Hepatology 2010; 22(7): 872–879.
62. Hanauer SB. Positioning biologic agents in the treatment of Crohn‘s disease. Inflamm Bowel Dis 2009; 15 : 1570–1582.
63. Colombel JF, Sandborn WJ, Reinisch W, et al. Infliximab, Azathioprine, or Combination Therapy for Crohn’s Disease. N Engl J Med 2010; 362 : 1383–1395.
64. D’Haens G, aert , an Assche G, et al. Early combined immunosuppression or conventional management in patients with newly diagnosed Crohn‘s disease: an open randomised trial. Lancet 2008; 371(9613): 660–667.
65. Van Assche G, Vermeire S, Rutgeerts P. Safety issues with biological therapies for inflammatory bowel disease. Curr Opin Gastroenterol 2006; 22 : 370–376.
66. Van Assche G Vermeire S, Rutgeerts P. Immunosuppression in inflammatory bowel disease: traditional, biological or both? Current Opinion in Gastroenterology 009; 25(4): 323–328.
67. Oussalah A, Chevaux JB, Fay R, Sandborn WJ, Bigard MA, Peyrin-Biroulet L. Predictors of infliximab failure after azathioprine withdrawal in Crohn‘s disease treated with combination therapy. Am J Gastroenterol 2010; 105(5): 1142–1149.
68. Shivananda S, Hordijk ML, Pena AS, Mayberry JF. Crohn‘s disease: risk of recurrence and reoperation in a defined population. Gut 1989; 30(7): 990–995.
69. Hellers G. Crohn‘s disease in Stockholm county 1955–1974. A study of epidemiology, results of surgical treatment and long-term prognosis. Acta Chir Scand Suppl 1979; 490 : 1–84.
70. Bernell O, Lapidus A, Hellers G. Risk factors for surgery and recurrence in 907 patients with primary ileocaecal Crohn‘s disease. Br J Surg 2000; 87(12): 1697–1701.
71. Munkholm P, Langholz E, Davidsen M, Binder V. Disease activity courses in a regional cohort of Crohn‘s disease patients. Scand J Gastroenterol 1995; 30(7): 699–706.
72. Moum B, Ekbom A, Vatn MH, et al. Inflammatory bowel disease: re-evaluation of the diagnosis in a prospective population based study in south eastern Norway. Gut 1997; 40(3): 328–332.
73. Moum B, Ekbom A, Vatn MH, et al. Clinical course during the 1st year after diagnosis in ulcerative colitis and Crohn‘s disease. Results of a large, prospective population-based study in southeastern Norway, 1990–1993. Scand J Gastroenterol 1997; 32(10): 1005–1012.
74. Witte J, Shivananda S, Lennard-Jones JE, et al. Disease outcome in inflammatory bowel disease: mortality, morbidity and therapeutic management of a 796-person inception cohort in the European Collaborative Study on Inflammatory Bowel Disease (EC-IBD). Scand J Gastroenterol 2000; 35(12): 1272–1277.
75. Rutgeerts P, Geboes K, Vantrappen G, et al. Natural history of recurrent Crohn‘s disease at the ileocolonic anastomosis after curative surgery. Gut 1984; 25 : 665–672.
76. Borley NR, Mortensen NJ, Jewell DP. Preventing post-operative recurrence of Crohn‘s disease. Br J Surg 1997; 84 : 1493–1502.
77. Cottone M, Orlando A, Viscido A, Calabrese E, Cammą C, Casą A. Review article: prevention of postsurgical relapse and recurrence in Crohn‘s disease. Aliment Pharmacol Ther 2003; 17(Suppl 2): 38–42.
78. Hulten L. Surgical management and strategy in classical. Crohn‘s disease. Int Surg 1992; 77 : 2–8.
79. Hulten LA. Long-term follow-up in Crohn‘s disease. World J Surg 1988; 12 : 180–185.
80. Hulten L. Surgical treatment of Crohn‘s disease of the small bowel or ileocecum. World J Surg 1988; 12 : 185–188.
81. Aratari A, Papi C, Leandro G, Viscido A, Capurso L, Caprilli R. Early versus late surgery for ileo-caecal Crohn‘s disease. Aliment Pharmacol Ther 2007; 26(10): 1303–1312.
82. Zisman TL, Rubin DT. Novel Diagnostic and Prognostic Modalities in Inflammatory Bowel Disease. In: Challenges in Inflammatory Bowel Disease. Regueiro M, Barrie III AM (eds.) Med Clin N Amer 2009; 94(1): 155–178.
83. Peyrin-Biroulet L, Loftus EV Jr, Colombel JF, Sandborn WJ. Early Crohn disease: a proposed definition for use in diseease-modification trials. Gut 2010; 59 (2): 141–147.
84. Peyrin-Biroulet, L. Crohn’s disease: early may already be too late. Gastroenterology 2008; 135 : 1420–1422.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Janskolázeňské sympoziumČlánek Problémy s impakt faktoremČlánek KnihyČlánek Laureáti Nobelovy ceny
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Idiopatické střevní záněty – predikce průběhu a včasná léčba*
- Vyšetření mutačního statutu genu KRAS jako součást algoritmu léčby metastatického kolorektálního karcinomu
- Plánované akce odborných složek ČLS JEP
- Vliv víry na prožívání nemoci u seniorů, dotazníky spirituality
- Tuberkulóza v České republice v roce 2009
- Plánované akce odborných složek ČLS JEP
- Onemocnění vyvolané Clostridium difficile u geriatrických nemocných
- Alkohol, tabák a jiné návykové látky a reprodukční rizika
- Variabilita hlubokých žil stehna
- Sto let od založení první psychologické laboratoře v českých zemích
- Janskolázeňské sympozium
- Problémy s impakt faktorem
- Knihy
- 15. hradecké gastroenterologické a hepatologické dny
- Konference Human Genome Meeting 2011
- XXXII. imunoanalytické dny, XI. mezinárodní konference CECHTUMA (Central European Tumor Markers) a II. workshop prediktivní, preventivní a personalizované medicíny
- Profesor MUDr. František Boudík, DrSc. (1927–2011)
- K životnímu jubileu prof. MUDr. Jany Pařízkové, DrSc.
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Variabilita hlubokých žil stehna
- Onemocnění vyvolané Clostridium difficile u geriatrických nemocných
- Vyšetření mutačního statutu genu KRAS jako součást algoritmu léčby metastatického kolorektálního karcinomu
- Alkohol, tabák a jiné návykové látky a reprodukční rizika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




