-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Opakované potrácení – přehledový článek
Reccurent pregnancy loss – review
Objective:
Informative review of possible causes and therapy of habitual pregnancy loss and infertility.Design:
Review.Settings:
Department of Gynecology and Obstetrics, General Faculty Hospital of Charles University, Prague.Subject and method:
The repeated (habitual) loss of pregnancy is defined by three or more spontaneous abortions. Approximately 0,4 to 1% of women are affected. The pregnancy loss is more frequent in women younger than 20 and older than 35 years. The frequency of spontaneous abortions parallels the number of previous pregnancies. The causative treatment of women with recurring abortions is not available, however, it is recommended that such women are evaluated by available methods to eliminate etiological causes of repeated pregnancy losses.Conlusions:
Effective therapy is possible when the diagnostic reason for repeated abortions is determined. Nevertheless, the causes leading to repeated pregnancy losses are identified only in approximately 12% of women. However, alleged and unexplained infertility, resulting in habitual pregnancy losses has a favorable prognosis.Keywords:
reccurent pregnancy loss – age of the mother – genetic factors – antiphospholipid syndrome – inherited trombophilia – endometriosis
Autoři: R. Jarošová 1,2; J. Mašata 1; D. Stejskal 2; M. Brandejská 2
Vyšlo v časopise: Ceska Gynekol 2013; 78(2): 200-205
Souhrn
Cíl studie:
Informační přehled problematiky (možných příčin a terapie) opakovaného potrácení.Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha.Předmět a metoda studie:
Opakované (habituální) potrácení je definováno třemi a více konsekutivními spontánními potraty. Postihují 0,4–1 % žen. K potrácení jsou náchylnější ženy ve věku nižším než 20 let a ve věku vyšším než 35 let. S počtem proběhlých gravidit narůstá frekvence spontánních abortů. Není známá kauzální léčba žen s opakovanými aborty. Vždy je vhodné tyto ženy vyšetřit dostupnými metodami a vyloučit etiologickou podstatu potrácení.Závěr:
Při diagnostikování příčiny vedoucí k potrácení máme možnosti terapie. K odhalení vyvolávající příčiny však dojde pouze asi ve 12 %. Takzvaná nevysvětlitelná infertilita vedoucí k habituálnímu potrácení má quad fertilitatem dobrou prognózu.Klíčová slova:
habituální těhotenské ztráty – věk matky – genetické faktory – antifosfolipidový syndrom – trombofilní mutace – endometriózÚVOD
Opakované (habituální potrácení) je definováno třemi a více spontánními potraty. Postihují 0,4–1 % žen. Může jít o primární nebo o sekundární habituální potrácení. V prvním případě jde o stavy, kdy všechna těhotenství skončila neúspěšně. Ve druhém případě žena již alespoň jednou porodila. Statistiky uvádějí zánik gravidity v 10–50 % [22]. Ve skutečnosti je toto procento mnohem vyšší. Přibližně 40 % gravidit skončí v době před jejich zjištěním, mluvíme o tzv. preklinických těhotenských ztrátách. Často jsou diagnostikovány pouze elevací těhotenského biomarkeru hCG, tzv. biochemická gravidita [19]. Při stanovení diagnózy habituálního potrácení je nutno pátrat po příčině, stanovit prognózu, a pokud možno zavést účinnou léčbu.
PŘÍČINY HABITUÁLNÍHO POTRÁCENÍ
K potrácení jsou náchylnější ženy ve věku nižším než 20 let a ve věku vyšším než 35 let. S počtem proběhlých gravidit narůstá frekvence spontánních abortů. U žen nad 35 let věku klesá přirozená fertilita. Snižuje se počet ovulačních cyklů. Dochází k exponenciálnímu nárůstu hlavně nondisjunkčních (početních) chromozomálních aberací při finálních fázích oogeneze. Velmi důležitý je i uterinní faktor (myomatóza, snížená vaskularizace endometria, porucha syntézy prostaglandinů, luteální insuficiencie), jenž se výrazně podílí na nižší implantaci a vyšší incidenci spontánních potratů u žen nad 40 let 41–62 % [11]. Specifická kumulativní rizika spontánního potratu do 28. týdne těhotenství jsou: 8 % pro věkovou skupinu 20–24 let, 25,5 % pro skupinu 35–39 let a 52,5 % pro matky nad 40 let [21]. Při nezávislém trojím opakování by to znamenalo apriorní riziko 0,5% habituálního potrácení pro věkovou skupinu 20–24 let, 1,5% riziko pro skupinu 35–39 let a (teoreticky) 14% pro matky nad 40 let [18].
Genetické příčiny
Genetické faktory jsou dominantní příčinou habituálního potrácení. Jde především o chromozomální aberace rodičů (balancované translokace, mozaiky), aneuploidie (autozomální trizomie) a molekulární mutace (mutace genů, metabolické vady, mutace v hlavním histokompatibilním systému, vrozené koagulopatie). Dalším predisponujícím faktorem opakovaného potrácení jsou podobné HLA haplotypy partnerů. Zdá se, že rozdíly HLA ochraňují plod od „odvrhnutí matkou.“ V literatuře se objevují zprávy o úloze polymorfismu genu pro androgenní receptor nebo mutace genů pro HLA-G [18]. U více než 5 % habituálně potrácejících párů je jeden z partnerů (častěji žena) nosičem vrozené strukturální balancované chromozomální aberace. Kontinuita struktury určitého chromozomu byla při gametogenezi některého z předků nosiče porušena a úsek DNA, obyčejně delší než 1 kilobase (>1000 basí DNA ) je přenesen (translokován) na jiný chromozom. Pokud si úseky DNA z různých chromozomů navzájem vymění svou pozici, jde o reciprokou translokaci. V místech porušené kontinuity chromozomu a v nově vzniklých spojeních můžeme očekávat submikroskopické chromozomální ztráty (delece). Vrozené balancované chromozomální aberace většinou vznikají de novo při gametogenezi v rodičovské generaci, ale část z nich (asi 20 %) je familiárních, a tedy vznikly minimálně při gametogenezi některého z prarodičů potrácejícího páru. Klinické známky u přenašečů s malou nebo nevýznamnou změnou genetického materiálu jsou diskrétní. Mohou se projevit nevýraznou dysmorfií nebo sníženou kvalitou semene. Na familiární chromozomální aberace mohou upozornit opakované potraty v genealogii [18]. Při redukčním dělení vrozeně asymetrické pohlavní buňky s balancovanou chromozomální aberací mohou vznikat nebalancované gamety. Při fertilizaci tímto druhem gamety vzniká nebalancovaný koncept s pesimistickou prognózou. Pokud je matka přenašečka balancované translokace, riziko pro plod je asi čtyřikrát vyšší, než když je přenašečem otec. Riziko potratu v jednotlivém těhotenství přenašečů balancovaných translokací může být až 80 %. Nicméně i v případě takto vysokého rizika splní kritérium habituálního potrácení (3 potraty) asi 50 % párů [18]. Přirozená selekce proti nebalancovaným plodům snižuje empirické riziko porodu dítěte s nebalancovanou chromozomální vadou spojenou často s multiorgánovým postižením na 4–6 %. Chromozomální aberace pohlavních buněk, vedoucí k nebalancované translokaci a potratu, vznikají také de novo při gametogenezi chromozomálně normálních jedinců, a především u starších žen. Příkladem jsou časté aneuploidie (trizomie chromozomu 21, 18, 13) končící v 50 až 80 % případů spontánním potratem. Nejčastější a prakticky již v prvním trimestru letální de novo aneuploidií je trizomie chromozomu 16. Časté jsou trizomie chromozomů 15 a 22, monozomie chromozomu X (Turnerův syndrom) nebo triploidie, vzniklé nejčastěji dispermií. Predispozice k opakovaným genomickým poruchám gametogeneze může být ovlivněna genotypem nebo epigeneticky. Není známo, jak velká část opakovaně potrácejících patří do této etiologické kategorie [18].
Tab. 1. Příčiny habituálního potrácení 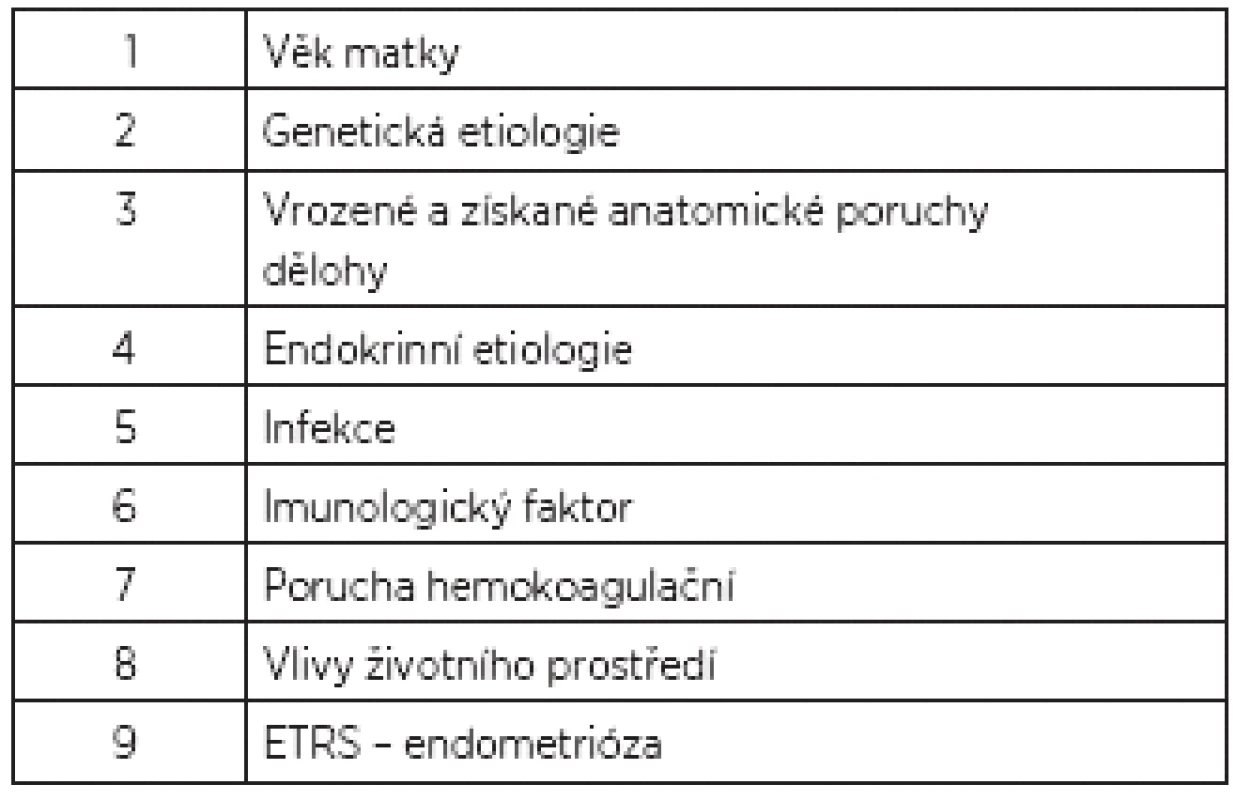
Chromozomy X a Y primárně určují typ pohlaví [14]. Y hraje rozhodující roli při normálním vývoji mužských gonád a sekundárních pohlavních znaků. X má výrazně nižší vliv. Prenatálně letální choroby vázané na pohlaví (většinou na chromozom X) se projeví většinou jen u plodů mužského pohlaví (letální hemizygot). Pokud je matka bezpříznakovou přenašečkou, je riziko koncepce letálního hemizygota mužského pohlaví, a tedy i potratu 25% a apriorní riziko tří opakovaných potratů z této etiologie je asi 1,5%. U heterozygotních plodů pohlavně vázaných letálních chorob ženského pohlaví záleží na tom, který chromozom X je aktivní. Pokud je v buňkách klíčových orgánů aktivní chromozom X s mutací, je tento náhodný stav letální i pro plod ženského pohlaví. Byly popsány i případy nenáhodné aktivace chromozomu X s mutací, které vedly k opakovanému potrácení plodů obojího pohlaví [18].
Vrozené a získané anatomické poruchy dělohy
Anatomické vady dělohy jsou dalšími příčinami habituálního potrácení (15–30 %), a to zejména ve II. trimestru těhotenství [12]. Vrozené děložní malformace jsou následkem poruch spojení Müllerových vývodů v embryonálním vývoji (0,1 % ženské populace). VV dělohy dělíme na jednoplášťové a dvouplášťové. Mezi získané abnormality řadíme – inkompetenci čípku, intrauterinní adheze vzniklé po předchozím zánětu či zákroku (Aschermanův syndrom) a děložní myomatózu. Ashermanův syndrom se projevuje poruchou menstruačního cyklu (amenorea, hypomenorea) a sekundární sterilitou, jejíž příčinou bývají intrauterinní adheze. Tyto adheze často vznikají po intrauterinních výkonech, a to především po RCUI prováděné na těhotné děloze do 24 hodin po porodu pro silné sekundární děložní krvácení [6, 7].Děložní myomatóza patří ke klasicky uváděným příčinám spontánních i opakovaných potratů (sekundární anatomický faktor), a to zejména v II. trimestru gravidity, kdy se podílí až na 1/3 všech abortů. Na druhou stranu je známo, že se myomy vyskytují v 1–4 % všech donošených gravidit. Existují práce, které uvádějí, že až v 80 % případů během těhotenství nemění svou velikost, nebo se dokonce zmenšují. Literární údaje jsou natolik protichůdné [12], že není jasné, zda je děložní myomatóza skutečnou příčinou těhotenských ztrát nebo zda se jedná o pouhou koincidenci. Inkompetence hrdla se podílí na vzniku předčasného porodu ve 3–12 % [16]. Nejčastější příčinou inkompetence hrdla bývá konizace (zkrácení hrdla pro nález přednádorových změn).
Endokrinní příčiny
K endokrinním příčinám gynekologického původu patří defekt luteální fáze, kdy je zkráceno II. období menstruačního cyklu [2]. Tím následně dochází k nedostatečné sekreci progesteronu. Vhodná je pak dostatečná suplementace progesteronem. Dále je to syndrom polycystických ovarií (PCO), jehož prevalance je u opakovaně potrácejících mezi44 a 82 % [20]. Mezi negynekologické endokrinologické poruchy patří poruchy štítné žlázy, a to především hypofunkce, diabetes mellitus a zvýšená hladina prolaktinu [19].
Infekce reprodukčních orgánů
Byla potvrzena příčinná souvislost infekce reprodukčních orgánů a potratu plodového vejce. Může jít o chronickou asymptomatickou neléčenou infekci nebo o přestup floridní poševní a cervikální infekce na plodové vejce, ale i o akutní infekci. U infekčních agens (ureaplazmata, mykoplazmata, neisserie, treponema, herpes, cytomegalovirus) nikdy nebyla jasně prokázaná jejich souvislost s potratem. Jediný patogen, u něhož byl potvrzen vliv na vývoj embrya a plodu, byla Chlamydia trachomatis. Při chronické chlamydiové infekci se zvyšují IgG protilátky (anti-chlamydiové, zvláště pak protilátky proti anti-heat-shock proteinům). Podle studie Deponteho byly protilátky IgG anti-CT Hsp60 výrazně zvýšeny ve skupině pacientek s AB nebo GEU (35 %) oproti skupině zdravých IU gravidit (16 %) [ 3]. Heat-shot proteins je označení pro skupinu proteinů, které zajišťují univerzální stresovou odpověď buněk. Chrání tzv. rozbalené bílkoviny buňky a dávají jim čas na její reparaci (cheparonová aktivita). Tyto bílkoviny jsou první, které začíná produkovat zygota krátce po fertilizaci a jsou přítomny v rané fázi gravidity i v decidue [13]. Protilátky proti heat-shock proteinům jsou zodpovědné za změnu lokální imunitní odpovědi, a tím ovlivňují i implantaci a vývoj embrya [4].
Imunologické příčiny
Odhady v současné literatuře kolísají mezi 10 a 50 % případů. Přesné číslo lze sotva stanovit, neboť většina těhotenských ztrát je podmíněna několika patologickými mechanismy působícími současně. Jsou-li terčem mateřské imunity tkáně embryonálního původu (působí přímo proti embryo-blastu nebo tvoří s jeho antigeny toxické imunitní komplexy), jde o imunologicky podmíněné potraty aloimunitní [9]. Při potratech autoimunitních jsou cílovými antigeny komponenty plodového lůžka mateřského původu, zejména cévní endotel a placenta. Dochází tak k aktivaci kaskády komplementu a protisrážlivých proteinů.
V graviditě nejde o jednostrannou supresi, ale o citlivou rovnováhu [21]. U potrácejících se prokazuje zmnožení leukocytů, zvláště makrofágů a NK buněk. Výrazně bývá zvýšen poměr mezi pomocnými a tlumivými T-lymfocyty. Velmi nežádoucí účinek na blastocystu mají embryotoxické cytokiny produkované aktivovanými makrofágy, lymfocyty a granulocyty (INFγ, TNF a IL-1). Podobná aktivace buněčné imunologie nastává i u žen s intrauterinní infekcí. Spouštěcím momentem může být IL-1 tvořený v makrofázích aktivovaných už stopovým množstvím endotoxinu. Rozhodujícími faktory jsou buněčné mediátory – cytokiny a interleukiny. Jsou produkovány převážně (nikoli však výlučně) buňkami imunitní soustavy (T-lymfocyty, makrofágy, NK buňkami). Obecně a zjednodušeně lze cytokiny rozdělit na stimulační (jsou typicky produkovány buňkami Thl) a tlumivé (produkty Th2 buněk). Jejich vzájemná souhra zajišťuje zdárný rozvoj a funkci placenty, a tím i prosperitu zárodku od nidace až k porodu.
Samostatnou jednotku pak tvoří antifosfolipidový syndrom (APS). Jde o systémové auto-imunitní onemocnění [10], které se klinicky může projevovat těmito symptomy: recidivujícími trombózami, opakovanými spontánními aborty, trombocytopenií. Laboratorně se prokazuje: výskytem antifosfolipidových protilátek nebo průkazem lupusového antikoagulans, protilátkami proti anexinu. Lupus antikoagulans (LA) je název pro imunoglobuliny (IgG, IgM, IgA či jejich směs), které in vivo zasahují do procesu hemokoagulace. Výskytuje se de novo (primární) bez průkazu systémového auto-imunitního onemocnění nebo sekundárně u pacientů s jiným systémovým či orgánově specifickým autoimunitním onemocněním – SLE, revmatoidní artritidou, temporální arteritidou, Sjögrenovou nemocí apod.).
Antifosfolipidové protilátky – protilátky proti buněčným membránám (proti kardiolipinu, 32-glykoproteinu I, ph-serinu, ph-fosfatidyletanolaminu, ph-glycerolu, ph-inozitolu, kyselině fosfátové). Jsou to protilátky v krevním řečišti orientované proti záporně nabitým částem fosfolipidů buněčné membrány. Uvedené protilátky se vážou na antigeny plodu nebo s trofoblastickými antigeny vytvářejí toxické imunokomplexy, které poškozují časný zárodek. Anebo antifosfolipidové protilátky poškozují cévy placenty, kdy vznikají mikrotromby, které vedou k potratu, hypotrofizaci či úmrtí plodu (APS).
Protilátky proti anexinu. Anexin je protein na povrchu syncytiotrofoblastu, působí jako placentární antikoagulační faktor, a tím zabraňuje reprodukčním ztrátám. Nachází se i na povrchu trofoblastu, kde vytváří antitrombotické pole kolem prokoagulačního anionického fosfatidyl-serinu na povrchu trofoblastu, a tím zabraňuje účasti obnažených struktur BM koagulačních reakcí. Protilátky navazující se na anexin jsou spojovány s potraty i s opakovanými neúspěchy při IVF. Anexin má tedy schopnosti vázat se k zevním membránám fosfatidyl serinu, a tím je ochraňovat.
Trombofilní mutace
Opakované potraty mohou být v souvislosti s poruchou krevního srážení, která vede ke zvýšené náchylnosti k trombóze s trombofilií. Těhotenství samo o sobě navozuje hyperkoagulační stav a je spojeno až s 200% nárůstem koncentrací fibrinogenu a faktoru II, VII, VIII, X a XII, zatímco koncentrace faktoru V a IX zůstávají na stejné úrovni. U žen s opakovanými poruchami reprodukce je doporučeno screeningově geneticky vyšetřovat trombofilní mutace. Vrozené koagulopatie totiž mohou indukovat tvorbu trombóz v uteroplacentárním a intervilózním prostoru, čímž mohou vést k intrauterinní růstové retardaci, intrauterinní smrti plodu či opakovaným časným těhotenským ztrátám.
Mutace genu pro faktor V, leidenská mutace, vzniká v důsledku záměny DNA báze guaninu za adenin v genu koagulačního faktoru V, což vede k záměně aminokyseliny argininu za glutamin na pozici 506 polypeptidového řetězce. Důsledkem je vyšší odolnost FV vůči štěpení aktivovaným proteinem C a laboratorně se pak prokazuje elevace hladin cirkulujícího protrombinu na 150 až 200 % původní hodnoty [8]. Heterozygotní výskyt mutace v české populaci je asi 5%, v homozygotní formě 1/5000 obyvatel. Bylo prokázáno vyšší riziko habituálního potrácení u nositelek této mutace. Vyšší četnost potrácení bylo prokázáno u pacientek s mutací genu v homozygotní konstituci. APC rezistence – rezistence vůči aktivovanému proteinu C – mohou být příčinou opakovaného potrácení. Protrombinová mutace – faktor II – výskyt v populaci je mezi 1–2 %. Je zde zaznamenán vyšší výskyt těhotenských ztrát. Hyperhomocysteinémie a mutace MTHFR – polymorfismy genu pro metylentetrahydrofolátreduktázy souvisí s eventuálním zvyšováním hladin homocysteinu zejména při deficitu vitaminu B6, B12 a kyseliny listové. Hyperhomocysteimémie byla zjištěna u 26 % pacientek s abrupcí placenty, 11 % pacientek s intrauterinní smrtí a 38 % pacientek s IUGR plodu. Hyperhomocysteinémie je rizikovým faktorem pro habituální potrácení a jedním z rizikových faktorů rozvoje aterosklerózy, KVO, ale i trombózy. Mutace genu pro MTHFR však ani v homozygotní formě výskyt těhotenských ztrát nezvyšuje. Deficit antitrombinu III je přirozeně se vyskytující antikoagulans. Deficit AT III patří mezi heterogenní poruchy, je zapříčiněný více než 80 mutacemi. Jeho deficit je spojen se zvýšeným rizikem TEN v graviditě a šestinedělí a je zřejmá i asociace časných těhotenských ztát. Kombinované trombofilní mutace a ostatní trombofilie: Deficit proteinů S, C, deficit heparin-kofaktoru II, zvýšení plazminogen aktivátoru inhibitoru 1, PAI-1.
Faktory životního prostředí
Vlivy životního prostřední [15] mají pravděpodobně negativní vliv na fertilitu ženy, nicméně kauzální vztah mezi opakovaným potrácením a nepříznivým životním prostředím nebyl prokázán, pokud nebereme v úvahu práce hodnotící izolované faktory špatného životního prostředí, jako je přítomnost těžkých kovů aj. Otazníkem zůstávají příčiny psychologické, zejména životní stres jakékoliv etiologie.
Endometrióza
Samostatnou otázkou je vztah opakovaného potrácení a endometrióza. Jde o benigní onemocnění, charakterizované atypickým výskytem endometriální tkáně mimo dutinu děložní. Klíčovým faktorem je retrográdní flow menstruační krve přes tuby do dutiny břišní, což je ovšem fyziologický jev, ke kterému dochází téměř u všech žen. Reflux spontánně eliminuje 90 % žen [1]. U endometriózy se předpokládá, že je v popředí imunitní defekt [21]. Konkrétně snížená cytotoxicita T-lymfocytů, v jejímž důsledku není peritoneum od refluxního endometriózního materiálu očišťováno, a tím může implantovat. Endometrium vyvolává na peritoneu zánětlivou reakci, při níž vznikají prostaglandiny, které cestou cAMP aktivují P-450 aromatázu. Ta pak konvertuje androgeny na estrogeny, které podporují růst implantované tkáně díky interakci s přítomnými estrogenovými receptory. Dále byly prokázány defekty cytokinů a tkáňových metaloproteináz. Endometrióza je estrogendependentní choroba. U žen trpících endometriózou jsou zjišťovány poruchy funkce peritoneálních makrofágů, přirozených zabíječů (NK buněk) a imunoregulačních lymfocytů T. Je doprovázená posuny v rovnováze mezi prozánětlivými a protizánětlivými cytokiny.
VYŠETŘENÍ
Gynekologické vyšetření
Vyšetřovací schéma zahájíme gynekologickým vyšetřením a dále následuje vyšetření ultrazvukové, hormonální, pohlavně přenosných chorob včetně chlamydií a antropozoonóz.
Doporučuje se vyšetření hysteroskopické k vyloučení morfologické patologie dutiny děložní. Tato vyšetření bývají dostupná všem praktikujícím gynekologům. Následující vyšetření poté většinou indikuje gynekolog-specialista, zabývající se problematikou reprodukční medicíny.
Genetické vyšetření
Genealogické vyšetření a genetická konzultace
Podstatou je podrobná rodinná a osobní anamnéza, kdy pátráme po onemocnění u partnerů samých i v jejich široké rodině (to minimálně u tří generací).
Cytogenetické vyšetření
Klinická cytogenetika se zabývá studiem chromozomů, jejich strukturou a dědičností. Mikroskopicky pozorovatelné změny počtu nebo struktury chromozomů se mohou podílet na mnoha případech poruch reprodukce, vrozených malformacích, mentálních retardacích a hrají důležitou roli v patogenezi nádorových onemocněních. Mezi základní identifikační postupy patří barvení chromozomů (pruhování) a fluorescenční in situ hybridizace (FISH), která slouží ke zjištění přítomnosti či absence určitých sekvencí DNA nebo ke studiu počtu, popř. uspořádání chromozomů či chromozomálních oblastí.
Molekulárně-genetické a biochemické vyšetření
Podstatou je studium struktury a funkce genů – analýza DNA [13]. Při zkoumání molekulární podstaty genetických chorob je nutno získat dostatečné množství příslušných sekvencí DNA nebo RNA k samotné analýze a očištění vyšetřované sekvence od všech ostatních segmentů DNA nebo RNA obsažených v dané buňce. Příkladem využití molekulárně-genetického vyšetření je analýza monogenně podmíněných chorob. Monogenní onemocnění jsou způsobená mutacemi jednotlivých genů. Mutace může být přítomna na jednom či obou chromozomech. Vzácněji může být mutace přítomna v mitochondriálním genomu. Jde o kritickou chybu v genetické informaci jednoho genu. Monogenní choroby jsou primárně, avšak nikoli výlučně chorobami dětského věku. Odpovídají za významné množství dětských chorob a úmrtí (např. CF, enzymové defekty, syndrom fragilního X, Huntingtonova chorea ).
Imunologické vyšetření
Základním vyšetřením je detekce protilátek proti spermiím, anexinu, antizonální protilátky, antifosfolipidové protilátky a specifické buněčné imunity.
TERAPIE
Terapie při opakovaném idiopatickém potrácení není jednoznačně definovaná. Často se však využívá schéma kombinací léků, které se doporučují při terapii APS. Zároveň však neexistují přesvědčivá data dokumentující, že je tato léčba jednoznačně přínosná [10, 17]. V léčbě se často vzájemně kombinuje antitrombogenní účinek nízkomolekulárního heparinu nebo kyseliny acetylsalicylové s imunosupresivním účinkem glukokortikoidů. Doporučené postupy prevence TEN v gynekologii a porodnictví upravují užívání nízkomolekulárního heparinu nosičkám trombofilních mutací po celou dobu gravidity (od inseminace nebo od embryotransferu až do 10. dne po porodu). Nízkomolekulární heparin (LMWH) je možné podávat i u pacientek s opakovanými reprodukčními ztrátami [5, 17]. Rizika vyplývající z dlouhodobého užívání nebyla jasně potvrzena (peri - a postpartální krvácení, snížení kostní denzity a heparinem indukované trombocytopenie). Doporučují se však průběžné laboratorní kontroly krevního obrazu (trombocytů).
Při průkazu aktivovaných T-lymfocytů a makrofágů se doporučuje podávání pentoxifilinu.
ZÁVĚR
Je možné vést terapii ženy s habituálním potrácení při idiopatické etiologii dvěma směry. Jeden je jednodušší a spočívá v terapeutickém nihilismu [15]. Vychází z vysoké pravděpodobnosti úspěšného dalšího těhotenství po proběhlých potratech. Po dvou konsekutivních potratech je naděje na úspěšnou následnou graviditu 80%. Po 3 spontánních potratech zůstává tato možnost 55–75%. K odhalení vyvolávající příčiny dojde pouze přibližně ve 12 %. Tak zvaná nevysvětlitelná infertilita vedoucí k habituálnímu potrácení má quad fertilitatem dobrou prognózu. Je tedy nasnadě, že v těchto případech je expektační přístup gynekologa metodou volby.
MUDr. Radka Jarošová
Gynekologicko-porodnická klinika
1. LF UK a VFN
Apolinářská 18
128 53 Praha 2
e-mail: jarosovara@seznam.cz
Zdroje
1. Buyalos, RP., Agarwal, SK. Endometriosis associted infertility. Curr Opin Obstet Gyn, 2000, 12, p. 377.
2. Cibula, D., Henzl, M., Živný, J. Základy gynekologické endokrinologie. Praha: Grada, 2002.
3. Deponte, A., Pournaras, S., Deligeoroglou, E. Serum IL-1beta, IL-8 and anti-heat shock 60 (Hsp60) Chlamydia trachomatis antibodies as markers of ectopic pregnancy. J Reprod Immunol, 2012, 93(2), p. 102–108.
4. Gardner, D. Textbook of assisted reproductive technologies,32rd ed. Sheepe Place, Colchester: Informa UK Ltd., 2009.
5. Hajšmanová, Z., Šlechtová, J., a kol. Průběh těhotenství při dlouhodobém podávání nízkomolukárního heparinu pro opakované těhotenské ztráty. Čes Gynek, 2008, 5, s. 278–283.
6. Hrazdírová, L., Švabik, K., Žižka, Z., et al. Should hysteroscopy be provided for patients who have undergone instrumental intrauterine intervention after delivery? Acta Obstet Gynecol Scand, 2012, 91(4), p. 514–517.
7. Hrazdírová, L., Kužel, D., Žižka, Z. Je hysteroskopie správná volba pro řešení reziduí těhotenských tkání? Čes Gynek, 2012, 77, 1, s. 35–38.
8. Kašparová, D., Fait, T. Časné těhotenské ztráty a vrozené trombofilní stavy. Čes Gynek, 2009, 74, 5, s. 360–364.
9. Madar, J., et al. Immunopathological mechanisms in recurrent miscarriage and preeclampsia. Amer J Reprod Immunol, 2001, 46, p. 96.
10. Malíčková, K., Fučíková, T. Antifosfolipidový syndrom a antifosfolipidové protilátky. Čas Lék čes, 2001, 140, 15, p. 465–468.
11. Mardešič, T. Mimotělní oplodnění. Praha: Galén, 1998.
12. Mára, M. Moderní gynekologie a porodnictví. Levret, 2002, 11.
13. Mašata, J., Jedličková, A., a kol. Infekce v gynekologii a porodnictví. Praha: Maxdorf, 2004.
14. Nussbaum, R., McInnes, R., Willard Huntington, F. Thompson and Thompson: Klinická genetika. Praha: Triton, 2004, 426 s.
15. Roztočil A. Vyšetření páru s opakovaným potrácením. Levret, Mod Gynek Porod, 2002, 11, 4.
16. Roztočil, A., a kol. Moderní porodnictví Praha: Grada Publishing, 2008.
17. Salmon, JE. Are heparins effective in some patiens with recurrent pregnancy because they inhibit complement activation?J Thromb Haemost, 2005, 3, p. 783–784.
18. Stejskal, D., et al. Plodnost a reprodukční rizika starších žen v ČSR. Čes Gynek, 1989, 54, 3, s. 161–167.
19. Šulová, L., Fait, T., a kol. Výchova k sexuálně reprodukčnímu zdraví. Maxdorf, 2011.
20. Tulppala, M., Stenman, UH., Cacciatore, B., Ylikorkala, O. Polycystic ovaries and levels of gonadotropins and androgens in recurrent miscarriage: prospective study in 50 women. Br J Obstet Gynecol, 1993, 100, p. 348–352.
21. Ulčová-Gallová, Z. Neplodnost – Útok imunity. Praha: Grada Publishing, 2006.
22. Wilcox, AJ., et al. Incidence of early loss of pregnancy. N Engl J Med, 1988, 319, p. 189–194.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2013 Číslo 2- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- … předvolební a povolební rybníček
- Doporučení k provádění prevence RhD aloimunizace u RhD negativních žen
- Pravidelná ultrazvuková vyšetření v průběhu prenatální péče –doporučený postup
- Ultrazvuková vyšetření v průběhu prenatální péče o vícečetná těhotenství – doporučený postup
- Péče o těhotenství s intrauterinní růstovou retardací plodu –doporučený postup
-
Vedení porodu u těhotné s císařským řezem v anamnéze
Ultrazvukové vyšetření před stanovením taktiky vedení porodu – doporučený postup - Těhotenství a roztroušená skleróza – analýza výsledků z let 2003–2011
- Hyperlipidémie v těhotenství
-
Psychosociální klima porodnice očima rodiček I.
Výsledky celorepublikového průzkumu spokojenosti s perinatální péčí v ČR u reprezentativního souboru 1195 rodiček -
Kmenové buňky a karcinom ovaria
Charakteristika, význam a potenciální aplikacev klinické praxi - Selektivní modulátory progesteronového receptoru a jejich terapeutické využití
- L-arginin v prevenci a léčbě preeklampsie
- Systémová enzymoterapie v léčbě recidivující vulvovaginální kandidózy
- Význam stanovení proteinu p16 v managementu prekanceróz děložního hrdla
- Opakované potrácení – přehledový článek
- Retroperitoneálna lymfangioleiomyomatóza – kazuistiky
- Transfusion-related acute lung injury (TRALI) – přehledový článek
- Blokáda vápníkových kanálů – perspektiva mužské antikoncepce?
- Moje zkušenosti z ENTOG exchange, Estonsko, 2012
- Atlas gamét a embryí niektorých živočichov a človeka
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Transfusion-related acute lung injury (TRALI) – přehledový článek
- Opakované potrácení – přehledový článek
- Význam stanovení proteinu p16 v managementu prekanceróz děložního hrdla
- Hyperlipidémie v těhotenství
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy