-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
L-arginin v prevenci a léčbě preeklampsie
L-arginin in prevention and treatment of pre-eclampsia
Objective:
It is to show the possible relationship between the patofysiology of pre-eclampsia in the body of a human with a relative lack of L-arginine and its potential connection with a nitrogen metabolism. This study also suggests the further utilization of above mentioned knowledges in a prevention and a treatment of pre-eclampsia.Design:
Literary overview.Setting:
Gynaecology and Obstetric Department of the Hospital Kromeriz, Inc., Kromeriz.Methods:
The background research of studies and issues published already in medical professional journals, bulletins and medical web databases.Conclusion:
To provide L-arginine to pregnant women as a dietary supplement concerns no risk and is an easy precaution. L-arginine can reduce the occurrance of pre-eclampsia in women with a potential high risk of its developement. The most important transmitter substance that makes L-arginine work is the dioxide nitrogen. So far, it has been the outmost possibility how to influence the patofysiology of Pre-eclampsia The lack of L-arginine and its influence on the nitrogen metabolism is likely, but there is also a great need for further research.Keywords:
pre-eclampsia – L-arginine – dioxide nitrogen – NO synthase – dysfunction of endothelium – urea cycle
Autoři: L. Vacula
Působiště autorů: Gynekologicko-porodnické oddělení, Kroměřížská nemocnice, a. s., Kroměříž, primář MUDr. J. Přibík
Vyšlo v časopise: Ceska Gynekol 2013; 78(2): 181-186
Souhrn
Cíl studie:
Poukázat na souvislost mezi patofyziologií preeklampsie v lidském organismu s relativním nedostatkem L-argininu a jeho možnou souvislost s metabolismem dusíku. Navrhnout využití těchto souvislostí v prevenci a léčbě preeklampsie.Typ studie:
Literární přehled.Název a sídlo pracoviště:
Gynekologicko-porodnické oddělení, Kroměřížská nemocnice, a.s., Kroměříž.Metodika:
Rešerše studií a publikací z medicínských odborných publikací, časopisů a medicínských webových databází.Závěr:
Zařazení L-argininu u těhotných jako doplňku stravy je bezpečné a jednoduché. U žen s vysokým rizikem preeklampsie L-arginin snižuje riziko jejího vzniku. Mediátorem jeho účinků je oxid dusnatý. Jde zatím o nejzazší možnost zásahu do patofyziologie preeklampsie. Vliv nedostatku L-argininu na metabolismus dusíku je pravděpodobný, bude jej ale ještě třeba probádat.Klíčová slova:
preeklampsie – L-arginin – oxid dusnatý –NO syntáza – dysfunkce endotelu – močovinový cyklusÚVOD
Preeklampsie je velmi závažné onemocnění se závažným zdravotním rizikem pro matku i plod. Pro definici preeklampsie odkazuji čtenáře na příslušnou kapitolu v porodnické literatuře. Přestože je teorií vzniku preeklampsie více, lze všeobecně akceptovat hypotézu uteroplacentární ischemie. Ta sama o sobě nevylučuje teorie ostatní a dobře vysvětluje patofyziologii vzniku tohoto onemocnění, jejímž základem je generalizovaná endoteliální dysfunkce. Současné možnosti léčby tohoto závažného onemocnění, kromě ukončení těhotenství, nejsou kauzální, a v podstatě vždy jsou aplikovány až po manifestaci příznaků tohoto onemocnění. Objevují se proto snahy o zásah do patofyziologických pochodů předcházejících klinickou manifestaci preeklampsie. Jde o ovlivnění dějů, které následují v organismu těhotné po nedostatečné trofoblastické invazi, která způsobí v následující fázi gravidity ischemizaci placenty, a tím uvolnění celého spektra působků popsaných v článku, ovlivňujících další patofyziologii daného těhotenství. Studie vlivu podávání L-argininu na rozvoj preeklampsie u žen s vysokým rizikem tohoto onemocnění prokázaly, že podávání této aminokyseliny snižuje riziko propuknutí preeklampsie u žen s vysokým rizikem. Účinky L-argininu (ARG) jsou zprostředkovány oxidem dusnatým (NO), jehož je ARG prekurzorem. Mechanismy a místa působení NO jsou podrobněji popsány v článku. Dále je v článku zvažováno možné toxické působení glutamátu při preeklampsii způsobené právě nedostatkem ARG.
ETIOLOGIE A PATOGENEZE PREEKLAMPSIE
Hypotéza uteroplacentární ischemie
Předpokladem je nedostatečná invaze trofoblastu do děložních spirálních arterií. Následkem je nedostatečná přestavba těchto arterií a podstatné snížení uteroplacentární perfuze. Důsledkem je snížený průtok krve placentou, její ischemizace a postupné poškozování cévního endotelu, který pak uvolňuje regulační a toxické látky do krevního oběhu. Poškozený endotel může indukovat intravaskulární hemokoagulační pochody [13, 15]. Porucha cévní přestavby je vysvětlována nerovnováhou mezi sekrecí proangiogenních a antiangio-genních faktorů: placentární protein 13 (PP13) – je syntetizován zejména syncytiotrofoblastem a váže se k proteinům extracelulární matrix mezi placentou a deciduou a pravděpodobně hraje úlohu při implantaci placenty a remodelaci spirálních děložních arterií [5]. Vaskulární endotelový růstový faktor (VEGF), mimo jiné, je mediátorem dilatačního efektu NO a placentární růstový faktor (PLGF) patří mezi proangiogenní faktory. Podílejí se na správné proliferaci trofoblastu a na jeho nidaci. PLFG potencuje angiogenní odpověď VEGF. Tyto faktory působí v souhře se svými receptory – receptor pro VEGF-1 (VEGFR-1, též fms-like tyrozin kináza nebo Flt-1) a receptor pro VEGF-2 (VEGFR-2, aktivuje proliferaci, migraci a přežití endoteliálních buněk). Syntetizovány jsou v placentě [11].
Antiangiogenní sVEGFR-1, produkován hypoxickou placentou při abnormální placentaci, je solubilní izoforma VEGFR-1 a neutralizuje účinky PLGF a VEGF [6]. Další placentární a endotelové faktory mající úlohu při preeklampsii: TNFα, IL-6, endotelin 1, neurokinin B [7], solubilní endoglin (s-Eng) – endoglin (Eng) je koreceptor transformujícího růstového faktoru β (angiogeneze a regulace cévního tonu) – zvýšená hladina s-End při preeklampsii narušuje formaci kapilár, čímž působí negativně na angiogenezi [25].
Hypotéza působení kyslíkových radikálů a protektivní funkce jejich zametačů
Při preeklampsii vzniká oxidační stres zprostředkovaný vznikem kyslíkových radikálů, které pak poškozují různé buněčné i mimobuněčné struktury: peroxidací lipidů poškozují buněčné membrány, fragmentací cukrů i se vznikem kyseliny hyaluronové, která podporuje penetraci imunitního systému k místu poškození. Dále kyslíkové radikály poškozují DNA – s tím souvisí nadměrná tvorba purinu, vzniká nerovnováha mezi xantindehydrogenázou a xantinoxidázou ve prospěch xantinoxidázy, a tím dochází i ke zvýšené tvorbě kyseliny močové. Dochází také k poškození kyseliny arachidonové v buněčných membránách, což způsobuje potlačení vzniku prostacyklinu ve prospěch tromboxanu A2 a serotoninu s vazokonstrikčními a agregačními vlastnostmi [15, 16].
Hypotéza porušení imunologické adaptace, genetická hypotéza, hypotéza abnormálního lipidového metabolismu
Pro definici těchto hypotéz odkazuji čtenáře na příslušnou kapitolu v porodnické literatuře.
Ani jedna z nich se nevylučuje s teorií uteroplacentární ischemie.
ENDOTELIÁLNÍ DYSFUNKCE PŘI PREEKLAMPSII
Endotel je jedna vrstva buněk vystýlající cévní lumen. Celkový povrch endotelu má plochu 500–1000 m2, jeho hmotnost je asi 1,5–3 kg.
Tvoří buněčnou bariéru mezi cévní stěnou a krví a zajišťuje nesmáčivý povrch cévního lumen. Endotel je metabolicky aktivní orgán s řadou funkcí. Mimo jiné řídí propustnosti cévní stěny pro buňky a nebuněčné součásti krve. Prostup krevních buněk, zejména leukocytů, je uskutečňován pomocí vazoadhezivních molekul, exprimovaných endotelem na svém povrchu. Další funkcí endotelu je kontrola optimálního krevního průtoku cévou produkcí vazoaktivních látek. Mezi nejvýznamnější vazoaktivní látky produkované endotelem patří NO a prostacyklin [4].
Jednou z hlavních příčin rozvoje klinických i laboratorních příznaků preeklampsie je, nejdříve lokalizovaná a následně generalizovaná, endoteliální dysfunkce odstartovaná chemickými působky z ischemické placenty.
Na počátku tedy stojí nedostatečné prokrvení až ischemie placentární tkáně. Na toto placenta reaguje produkcí působků, které aktivují další kaskády patofyziologických dějů. Antiangiogenní účinek: s-Eng (inhibice transformujícího růstového faktoru β, sVEGRF-1 (neutralizuje placentární růstový faktor-PLGF, který normálně v průběhu gravidity stoupá, zároveň ale neutralizuje také VEGF, což působí antiangiogenně).
Vazoaktivní účinek: endotelin-1 (vazokonstriktor), asymetrický dimetyl-argininu (kompetitivní inhibitor NO syntázy [25]), neurokinin B (stimulace NO syntázy), prostacyklin (vazodilatace).
Jestliže nastane převaha antiangiogenních a vazokonstrikčních faktorů, dochází k dysfunkci endotelu.
Endoteliální dysfunkce je definována zvýšenou propustností cévní stěny, nerovnováhou mezi vazoaktivními, hemokoagulačními a proliferaci inhibujícími, resp. stimulujícími působky. Mimo selektivní zvýšení permeability se projevuje sklonem k vazospazmu, tendencí k trombóze a nedostatečnou inhibicí subendoteliální proliferace. Hraje důležitou roli také v patogenezi hypertenze a renálního selhání. Nedostatečná produkce NO, prostacyklinu a dalších působků inhibujících adhezi a agregaci destiček, a naopak zvýšená exprese von Willebrandova a tkáňového faktoru navozují protrombogenní stav. Von Willebrandův faktor prostřednictvím destičkových receptorů aktivuje adhezi trombocytů na subendoteliální vlákna kolagenu. Poté dochází k jejich aktivaci a degranulaci, což vede k uvolnění řady dalších proagregačně a vazokonstrikčně působících látek. Primární, destičková fáze hemokoagulace je doprovázena sekundární hemostázou, na jejímž konci je přeměna fibrinogenu trombinem v nerozpustný fibrin [4, 19].
Dysfunkce endotelu při preeklampsii tedy vysvětluje i hlavní příznaky tohoto onemocnění: otoky – zvýšená propustnost cévní stěny, hypertenze – nerovnováha mezi vazoaktivními působky, proteinurie – poškození ledvin (vazokonstrikce, sekundární hemostáza, infarkty, tromby parenchymu), cefalea – vazospazmy, mikroinfarkty, fibrinoidní nekrózy, petechie a edémy v CNS, epigastrická bolest – periportální hemoragie, ischemické infarkty, fibrinové tromby v kapilárách, arteriolách periportálních vénách, vzácně subkapsulární hematom jater [17].
L-ARGININ
L-arginin (ARG) je bazická, semiesenciální aminokyselina. Je intermediárním metabolitem ureosyntetického cyklu. Je prekurzorem biosyntézy polyaminů (spermidinu a sperminu), které jsou nezbytné pro proliferaci lymfocytů, stabilizaci subcelulárních organel a membrán. Polyaminy spermin a spermidin stimulují syntézu DNA a RNA a stabilizaci DNA u některých virů – proto se nemá ARG podávat u herpetické infekce). Hydrolýzou ARG v močovinovém cyklu (za katalýzy enzymem arginázou) vzniká ornitin a močovina. Spolu s glycinem je prekurzorem syntézy kreatinu. Za katalýzy NO syntázy je z ARG v cytosolu téměř všech buněk syntetizován NO spolu s L-citrulinem. Mezi potraviny s největším zastoupením ARG patří: různé druhy ořechů, mléčné výrobky, zelenina, česnek, žen-šen, sója, různá semínka, mořské plody, bílé maso [3, 17]. Lze předpokládat, že při zvýšených nárocích na organismus v graviditě bude argininémie spíše při dolní hranici rozmezí. Norma je 6,0 až 140,0 μmol/l. Šíře fyziologické hladiny L-argininu je tedy poměrně velká [2].
OXID DUSNATÝ
Oxid dusnatý (NO) je nejmenším bioaktivním produktem savčích buněk. Je endogenně produkován téměř ve všech savčích tkáních a hraje celou řadu důležitých biologických úloh, zejména v regulaci hemodynamiky, v neurotransmisi a zánětu.
NO je v savčích tkáních syntetizován spolu s L-citrulinem z L-argininu a molekulárního kyslíku za katalýzy enzymu NO syntázy.
Účinek NO v organismu je zprostředkován prostřednictvím aktivace solubilní izoformy enzymu guanylát cyklázy. Tím se zvyšuje v cílové buňce koncentrace cyklického guanozin-3‘,5‘-monofosfátu (cGMP).
NO má mohutný vazodilatační účinek, inhibuje expresi adhezivních molekul, adhezi a agregaci trombocytů a apoptózu endoteliálních buněk.
Brzdí též migraci myocytů z médie, jejich proliferaci a transformaci v sekreční buňky. NO tedy zasahuje do téměř všech fyziologických i patologických pochodů v savčím organismu (infekce, regulace hladiny některých hormonů, vliv na uvolňování některých neuromediátorů z presynaptických zakončení, interakce s některými neuromediátorovými receptory, mezibuněčný mediátor, modulace iontových kanálů atd. [4, 12, 17, 29, 20].
NO SYNTÁZY (NOS)
V savčích buňkách je NO tvořen pětielektronovou oxidací terminálního guanidinodusíku L-argininu molekulárním kyslíkem; kromě NO vzniká L-citrulin
L-arginin + O2 --> NO + L-citrulin
(za přítomnosti NADPH-redukovaná forma nikotinamid adenin dinukleotid fosfátu, BH4 – tetrahydrobiopterin, kofaktor hydroxyláz).
NOS se vyskytuje ve třech známých izoformách označovaných jako NOS I (neuronální, nNOS, lokalizovaná v cytosolu), NOS II (inducibilní, iNOS, lokalizovaná v cytosolu) a NOS III (endotelová, eNOS, lokalizovaná na buněčné membráně). NOS I se vyskytuje v neuronech konstitutivně, v některých buňkách epitelu, cévního hladkého svalu a v kosterním svalu. NOS II se vyskytuje: makrofágy, glie, hepatocyty, endotel, epitel, srdeční myocyty, hladký sval, a zřejmě v každé jaderné buňce. Většinou je inducibilní po transkripční indukci cytokiny (v případě placentární ischemie neurokininem B), a tvoří NO mnohem rychleji, než druhé dva typy NOS. NOS III se vyskytuje v endotelových buňkách, plicním a renálním epitelu, trombocytech, srdečních myocytech, hipokampu. Je exprimována konstitutivně. Expresi moduluje smykové napětí krevního proudu (shear-stress) [10, 12, 17, 19, 20].
CYKLUS MOČOVINY
Je to metabolický cyklus dusíku, odehrávající se v mitochondriích a cytosolu hepatocytů. Bývá nazýván ornitin-argininový cyklus. Primárně slouží k eliminaci přebytečného dusíku z lidského těla. Produktem cyklu je močovina, která je dobře rozpustná a méně toxická než amoniak. Každá ze dvou aminoskupin molekuly močoviny je jiného původu. První přináší do močovinového cyklu L-glutamát – deaminací uvolňuje do cyklu amo-niak, druhou L-aspartát – vstupuje přímo do močovinového cyklu. Do L-glutamátu se dusík dostává transaminací z většiny ostatních aminokyselin. Celý cyklus je kontrolován jednak změnami v hladinách enzymů, jednak prostřednictvím aktivity karbamoyfosfátsyntetázy. Ta vyžaduje pro svoji činnost Mg2+ a jejím alosterickým aktivátorem je N-acetylglutamát, syntetizovaný z glutamátu a acetyl-CoA. Aktivitu enzymů ovlivňuje také pH (při acidóze katalyzují pomaleji) a teplota. Celý cyklus je ukončen rozštěpením ARG na močovinu a ornitin (ten vstupuje zpět do cyklu (obr. 1). Tato reakce je katalyzována enzymem arginázou (ARG1) [17].
Obr. 1. Obr. 1 Cyklus močoviny; 1 – ornithin, 2 – karbamoylfosfát, 3 – citrulin, 4 – argininosukcinát, 5 – fumarát, 6 – arginin, 7 – močovina, L-Asp – L-aspartát, CPS-1 – karbamoylfosfátsyntetáza, OTC – ornitinkarbamoyltransferáza, ASS – argininsukcinátsyntetáza, ASL – argininsukcináza, ARG1 – argináza. Zdroj: http://upload.wikimedia.org/wikipedia/commons/b/be/Urea_cycle.svg 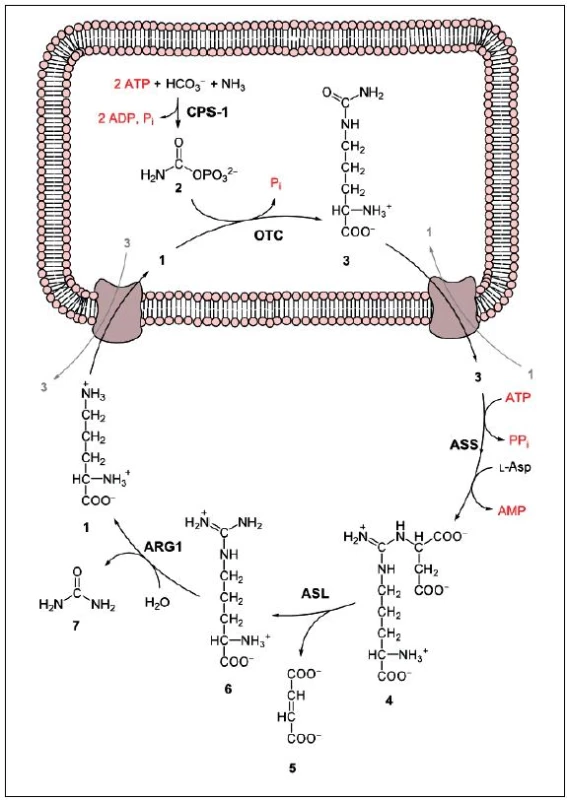
NEUROTOXICITA L-GLUTAMÁTU
Glutamát je hlavním excitačním neurotransmiterem, umožňujícím přenos signálu na 40 až 60 % všech synapsí v CNS. Glutamát se váže na ionotropní receptory, které umožňují rychlý vstup kationtů (Na+, K+,Ca2+) do nitra buněk a na pomaleji působící metabotropní receptor, vázaný na G protein v membráně. Ionotropní receptory jsou rozděleny na NMDA (N-metyl-D-aspartát), AMPA (α-amino-3-hydroxy-5-metyl-4-izoxazopropionová kyselina) a kainatový typ podle svých selektivních agonistů. Iontový kanál NMDA receptorů je za fyziologického stavu blokován Mg2+ a po uvolnění glutamátu z presynapse dojde k depolarizaci membrány a Mg2+ iont opustí kanál. Vysoká expozice glutamátu aktivuje neuronální smrt, tento proces je známý jako excitotoxicita. Zvýšené uvolňování a snížené odbourávání glutamátu vede k chronické hyperexcitaci NMDA receptorů a excesivnímu influxu Ca2+ do neuronů. Kalcium aktivuje Ca2+ dependentní enzymy a tvorbu kyslíkových radikálů, vedoucí nakonec k poškození až smrti neuronů jak glutamatergních, tak cholinergních [9, 18, 21].
STUDIE O VLIVU SUPLEMENTACE L-ARGININU NA SNÍŽENÍ VÝSKYTU PREEKLAMPSIE
Byly publikovány závěry různých studií hodnotících vliv suplementace L-argininu na snížení rizika vzniku preeklampsie. Zmíním alespoň tři z nich. Jedna zahrnovala ženy mezi 14. a 32. týdnem gravidity s rizikem preeklampsie. V jedné skupině (228 žen) byly ženám podávány tyčinky s 6,6 g L-argininu a antioxidační vitaminy (C, E a beta karoten), ve druhé skupině (222 žen) pouze vitaminy a v kontrolní skupině (222 žen) placebo. Ze závěru studie vyplývá, že dlouhodobá suplementace 6,6 g L-argininu a antioxidačními vitaminy denně významně snižuje výskyt preeklampsie oproti placebu. Sekundárním zjištěním bylo, že suplementace L-argininu s antioxidačními vitaminy vedlo k výraznému snížení rizika předčasného porodu. Ochranný účinek proti vzniku preeklampsie se potvrdil jen u žen, které tyčinky začaly užívat před 24. týdnem těhotenství [27]. V jiné studii bylo těhotným dlouhodobě podáváno 0,8 mg kyseliny listové a 1 g L-argininu denně od 16. t.g. I zde se prokázal snížený výskyt preeklampsie u suplementovaných žen s vysokým rizikem oproti kontrolní skupině [26]. Jiná studie se zabývá antihypertenzním účinkem L-argininu u žen s gestační hypertenzí v 24. až 36. t.g. L-arginin byl podáván krátkodobě (po dobu 5 dní) v intravenózní infuzi (20 g/500 ml). Zde došlo k významnému snížení systolického i diastolickéko tlaku u žen užívajících L-arginin [14]. Ani v jedné ze studií nebyly zaznamenány žádné nežádoucí vedlejší účinky [14, 26, 27].
DISKUSE
Preeklampsie se zakládá již v období invaze trofoblastu. Míra poruchy tohoto děje a míra patologické endoteliální reakce pravděpodobně určuje obraz klinické manifestace preeklampsie. Může dojít k úplnému propuknutí onemocnění a dojít až k eklampsii (nebo k HELLP syndromu při extrémním poškození endotelu a aktivaci koagulace). Může zůstat jen u IUGR (intrauterine growth restriction), s žádnými nebo mírnými dalšími příznaky, v nejlepším případě dojde jen k málo významné růstové retardaci plodu. Docílit co nejmírnějšího projevu nemoci je cílem preventivního zásahu do její patofyziologie. Výsledky výše uvedených studií potvrzují vliv na snížení manifestace preeklampsie v rizikových slupinách. To jak při středních dávkách (6,6 g/den) užívaných po dobu několika týdnů, tak při nízkých dávkách (1 g/den) užívaných de facto po celou graviditu (od 16. t.g.). Studie krátkodobé aplikace vysokých dávek (20 g po dobu 5 dní, i.v.) potvrdila vliv jen na snížení krevního tlaku. Působení L-argininu se však neomezuje jen na snižování krevního tlaku vyšší dostupností NO, ale včasná suplementace pravděpodobně zasahuje přímo do patofyziologie vzniku preeklampsie působením proti antiangiogenním, vazokonstrikčním a protrombogenním působkům. L-arginin je semiesenciální aminokyselina a argininémie má široký rozptyl fyziologických plazmatických hladin (6,0 až 140,0 μmol/l), lze tedy předpokládat u části populace jeho relativní nedostatek. Další část článku probírá močovinový cyklus. Vzhledem k tomu, že cyklus je v podstatě regulován jen jedním enzymem (karbamoyfosfátsyntetáza) umožňujícím vstup dusíku do cyklu a ostatní enzymy již pracují na obecných biochemických principech (množství substrátu, teplota, pH aj.), vystupuje otázka, zda relativní nedostatek L-argininu a současná aktivace NOS může negativně ovlivňovat průběh cyklu močoviny. Pokud ano, docházelo by ke kompetici mezi arginázou a NOS o dostupný L-arginin. Vzhledem k faktu, že NOS je při preeklampsii přímo aktivována neurokininem B a aktivita arginázy je regulována jen množstvím substrátu a vlastnostmi prostředí (pH, teplota), lze předpokládat přesun rovnováhy v neprospěch arginázy, tedy dostupný L-arginin bude využit k syntéze NO. Tak by došlo ke zpomalení močovinového cyklu a k relativnímu nadbytku glutamátu a vzestupu glutamátémie, tedy zpomalenému odbourávání dusíku z těla a hyperazotémii. Při endotelové dysfunkci je také více či méně poškozena hematoencefalická bariéra. To by umožnilo usnadněný přestup glutamátu z plazmy do mozku. Neurotoxicita a excitotoxicita glutamátu pak může významně přispět k neurologickým příznakům preeklampsie, podpořit vznik otoku mozku vlivem odumírání neuronů (zvýšením osmotického tlaku v mozku vlivem rozpadu buněk).
ZÁVĚR
Je velmi pravděpodobné, že nedostatek přijímaného L-argininu má nezanedbatelný vliv na rozvoj preeklampsie žen, u kterých dochází ke snížení uteroplacentární perfuze. Fyziologické účinky založené na tvorbě NO jsou již vědecky potvrzené a všeobecně uznávané. Podávání 6,6 g L-argininu denně je bezpečné a zároveň má protektivní vliv na rozvoj preeklampsie. Z dostupných informací vyplývá, že důležitější než denní dávka je pravděpodobně včasnost zahájení suplementace ve vztahu k začátku gravidity. Zde v článku navrhovaný vliv na dostatečně efektivní průběh cyklu močoviny by bylo třeba ověřit podobnou studií, jako jsou výše uvedené, s několika modifikacemi: podávanou účinnou látkou by měl být jen L-arginin, nikoliv další přísady, L-arginin by byl podáván již od samého počátku gravidity (např. 2 g/den), u všech skupin by, kromě klinických známek onemocnění, měla být sledována L-argininémie, azotémie, L-glutamátémie popř. glutaminémie.
MUDr. Lukáš Vacula
Gynekologicko-porodnické oddělení
Kroměřížská nemocnice, a.s.
Havlíčkova 660/69
767 01 Kroměříž
lukasvacula@email.cz
Zdroje
1. American College of Obstetricians and Gynecologists. ACOG practice bulletin. Diagnosis and management of preeclampsia and eclampsia. Int J Gynaecol Obstet, 2002, 77, 33, p. 67–75.
2. Argininemia, hyperargininemia, arginase deficiency, Metabolic Information Center [on line]. Dostupný na www: <http://www.metagene.de/program/d.prg?mp=ARGININEMIA.%20HYPERARGININEMIA,%20ARGINASE%20DEFICIENCY>
3. Arginin – Wikipedia [on line], dostupný na www: <http://en.wikipedia.org/wiki/Arginine>
4. Bultas, J., Cífková, R., Češka, R., et al. Od endoteliální dysfunkce k ischemické chorobě srdeční. Praha: Galén 1999. 127 s.
5. Burger, O., Pick, E., Zwickel, J. Placental protein 13 (PP-13): Effect on cultured trophoblasts and its detection in human body fluids in normal and pathological pregnancies. Placenta, 2004, 25, p. 608–622.
6. Chaiworapongsa, T., Romero, R., Espinosa, J., et al. Evidence supporting a role for blockade of the vascular endothelial growth factor system in the pathophysiology of preeclampsia. Am J Obstet Gynecol, 2004, 190, p. 1541–1550.
7. D´Anna, R., Baviera, G., Corrado, F., et al. Neurokinin B and nitric oxide plasma levels in pre-eclampsia and isolated intrauterine growth restriction. BJOG, 2004, 111, p. 1046–1050.
8. De Vivo, A., Baviera, G., Giordano, D., et al. Endoglin, PlGF and sFlt-1 as markers for predicting pre-eclampsia. Acta Obstet Gynecol Scand, 2008, 87, 8, p. 837–842.
9. Glutamat – Human pathology [on line] 2004-5-3, dostupný na www: <http://www.humpath.com/spip.php?article3229>
10. Griffith, OW., Stuehr, DJ. Ann Rev Physiol, 1995, 57, p. 707–736.
11. Grill, S., Rusterholz, C., Zanetti-Dällenbach, R. Potential markers of preeclampsia – a review. Reprod Biol Endocrinol, 2009, 14, 7, p. 70.
12. Habilitační práce Václava Hampla Úloha oxidu dusnatého v normálním plicním oběhu a při plicní hypertenzi, Praha 1997, [on line]. Dostupný na www: <http://fyziologie.lf2.cuni.cz/hampl/habilit/index.htm>
13. Holthe, MR., Staff, AC., Berge, LN., Lyberg, T. Different levels of platelet activation in preeclamptic, normotensive pregnant, and nonpregnant women. Am J Obstet Gynecol, 2004, 190, p. 1128–1134.
14. Isabella Neri, Jasonni, VM., Gori, GF., et al. Effect of l-arginine on blood pressure in pregnancy-induced hypertension: A randomized placebo-controlled trial. J Mater Fetal Neonatal Med, 2006, 19, 5, p. 277–281.
15. Měchurová, A. Preeklampsie. In Hájek, Z., a kol. Rizikové a patologické těhotenství. Praha: Grada Publishing, 2004, s. 95–107.
16. Moretii, M., Phillips, M., Abdouzeid, A., et al. Increasedbreath markers of oxidative stress in normal pregnancy and in preeclampsia. Am J Obstet Gynecol, 2004, 190, p. 1184–1190.
17. Murray, RK., et al. Harperova biochemie. Z angl. 23. vyd. přel. Lenka Fialová et. al. 4. vyd. v ČR. Praha: H & H, 2002. 872 s.
18. Parsons, CG., Danysz, W., Quack, G. Memantine is a clinically well tolerated N-methyl-D-aspartate (NMDA) receptor antagonist – a review of preclinical data. Neuropsychopharmacology, 1999, 38, p. 735–767.
19. Piťha, J., Roztočil, K., Cífková, R., et al. Endoteliální dysfunkce a její hodnocení. Cor Vasa, 2001, 43, s. 452–456.
20. Poznámky k přednášce Václava Hampla – Oxid dusnatý [on line]. 2000-03-23, dostupný na www: <http://fyziologie.lf2.cuni.cz/hampl/teach_mat/nitricox/index.htm>
21. Rogawski, MA., Wenk, GL. The neuropharmacological basis for the use of memantine in the treatment of Alzheimer ´s disease. CNS Drugs Reviews, 2003, 9, p. 275–308.
22. Romero, R., Kusanovic, JP., Than, NG., et al. First-trimester maternal serum PP13 in the risk assessment for preeclampsia.Am J Obstet Gynecol, 2007, 14, 2, p. 46–54.
23. Savvidou, MD., Hingorani, AD., Tsikas, D., et al. Endothelial dysfunction and raised plasma concentrations of asymmetric dimetylarginine in pregnant women who subsequently develop pre-eclampsia. Lancet, 2003, 361, p. 1511–1517.
24. Stepan, H., Unversucht, A., Wessel, N., et al. Predictive value of maternal angiogenic factors in second trimester pregnancies with abnormal uterine perfusion. Hypertension, 2007, 49, 4, p. 818–824.
25. St-Jacques, S., Forte, M., Lye, SJ., et al.: Localization of endoglin, a transforming growth factor-beta binding protein, and of CD44 and integrins in placenta during the first trimester of pregnancy. Biol Reprod, 1994, 51, p. 195, p. 255–259.
26. Suzuki, Y., Yamamoto, T., Matsuura, A.: PP049. Could the supplementation of L-arginine plus folic acid T improve reduced endothelial function seen in preeclampsia? Pregnancy Hypertension, 2012; 2, 3, p. 268.
27. Vadillo-Ortega, F., et al. Effect of supplementation during pregnancy with L-arginine and antioxidant vitamins in medical food on preeclampsia in high risk population: randomized controlled trial, 2011-19-05, [on line], dostupný na www: <http://www.bmj.com/content/342/bmj.d2901>
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2013 Číslo 2- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- … předvolební a povolební rybníček
- Doporučení k provádění prevence RhD aloimunizace u RhD negativních žen
- Pravidelná ultrazvuková vyšetření v průběhu prenatální péče –doporučený postup
- Ultrazvuková vyšetření v průběhu prenatální péče o vícečetná těhotenství – doporučený postup
- Péče o těhotenství s intrauterinní růstovou retardací plodu –doporučený postup
-
Vedení porodu u těhotné s císařským řezem v anamnéze
Ultrazvukové vyšetření před stanovením taktiky vedení porodu – doporučený postup - Těhotenství a roztroušená skleróza – analýza výsledků z let 2003–2011
- Hyperlipidémie v těhotenství
-
Psychosociální klima porodnice očima rodiček I.
Výsledky celorepublikového průzkumu spokojenosti s perinatální péčí v ČR u reprezentativního souboru 1195 rodiček -
Kmenové buňky a karcinom ovaria
Charakteristika, význam a potenciální aplikacev klinické praxi - Selektivní modulátory progesteronového receptoru a jejich terapeutické využití
- L-arginin v prevenci a léčbě preeklampsie
- Systémová enzymoterapie v léčbě recidivující vulvovaginální kandidózy
- Význam stanovení proteinu p16 v managementu prekanceróz děložního hrdla
- Opakované potrácení – přehledový článek
- Retroperitoneálna lymfangioleiomyomatóza – kazuistiky
- Transfusion-related acute lung injury (TRALI) – přehledový článek
- Blokáda vápníkových kanálů – perspektiva mužské antikoncepce?
- Moje zkušenosti z ENTOG exchange, Estonsko, 2012
- Atlas gamét a embryí niektorých živočichov a človeka
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Transfusion-related acute lung injury (TRALI) – přehledový článek
- Opakované potrácení – přehledový článek
- Význam stanovení proteinu p16 v managementu prekanceróz děložního hrdla
- Hyperlipidémie v těhotenství
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



