-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Stanovení anti-Müllerova hormonu u žen
Determination of anti-Müllerian hormone in women
Anti-Müllerian hormone (AMH) is a glycoprotein and belongs to the TGF-β growth factors family. Our review describes the method of AMH determination in serum and follicular fluid. The reference values and changes in AMH levels during a woman‘s life are also discussed. In addition, it is also presented the relationship between AMH, obesity, smoking and use of hormonal contraceptives. The focus of the work is the importance of the determination of AMH in clinical practice. In assisted reproduction has become its determination one of the tools to detect ovarian reserve. It helps not only predict reduced response to stimulation with gonadotropins but also the risk of the ovarian hyperstimulation syndrome. Benefits of the ovarian reserve detection using AMH serum levels are discussed in comparison with the antral follicle count (AFC) determined by ultrasound. Several clinical indications of AMH determination are mentioned in the next section. These are primarily the polycystic ovary syndrome (PCOS), which is a great challenge not only for the AMH testing, but there is an open space for further interdisciplinary cooperation. Endometriosis has no direct effect on ovarian reserve and AMH levels in serum. AMH is very sensitive tumor marker in the diagnostics and monitoring of ovarian granulosa cells tumors. Treatment of cancer disease burdens entire body, including healthy cells. Ovarian follicles are very sensitive to chemotherapy and radiation. AMH is a good predictor of ovarian reserve damage during radio - and chemotherapy.
Keywords:
AMH – ART – antral follicle count – endometriosis – chemotherapy – IVF – granulosa cell tumor – OHSS – PCOS
Autoři: R. Kučera 1; O. Topolčan 1; T. Rumpíková 2; D. Rumpík 2; J. Dostál 3
Působiště autorů: Imunoanalytická laboratoř ONM Fakultní nemocnice, Plzeň, vedoucí pracoviště prof. MUDr. O. Topolčan, CSc. 1; Klinika reprodukční medicíny a gynekologie, Zlín, vedoucí pracoviště prof. MUDr. L. Pilka, DrSc. 2; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 3
Vyšlo v časopise: Ceska Gynekol 2013; 78(3): 282-288
Souhrn
Anti-Müllerův hormon (AMH) je glykoprotein patřící do skupiny růstových faktorů TGF-β. V našem přehledovém článku je popsána metoda jeho stanovení v séru a folikulární tekutině, diskutuje se o referenčních hodnotách a změnách jeho hladin v průběhu života ženy. Kromě toho je popsán vztah mezi AMH, obezitou, kouřením a užíváním hormonální antikoncepce. Těžiště práce je v prezentaci významu stanovení AMH v klinické praxi. V asistované reprodukci se stalo jeho stanovení jedním z nástrojů ke zjišťování ovariální rezervy. Pomáhá nejen predikovat sníženou odpověď na stimulaci gonadotropiny, ale i nebezpečí vzniku ovariálního hyperstimulačního syndromu. V rámci zjišťování ovariální rezervy se diskutuje o vzájemném vztahu mezi sérovými hladinami AMH a počtem antrálních folikulů (AFC) určovaným ultrazvukem. V následující části jsou zmíněny další klinické stavy, u kterých je v současné době vyšetření AMH často indikováno. Jde především o syndrom polycystických ovarií, který je velkou výzvou nejen pro vyšetřování AMH, ale je v něm otevřen prostor i pro další mezioborovou spolupráci. Endometrióza nemá přímý vliv na ovariální rezervu a hladiny AMH v séru. AMH je velmi citlivý nádorový marker a používá se k diagnostice a sledování nádorů z buněk ovariální granulózy. Kromě toho je v onkologii prediktorem stupně poškození ova-riálních folikulů radio - a chemoterapií.
Klíčová slova:
anti-Müllerův hormon – ART – antrální folikuly – endometrióza – chemoterapie – IVF – nádor buněk granulózy – ovariální hyperstimulační syndrom – syndrom polycystických ovariíÚVOD
Anti-Müllerův hormon (anti-Müllerian hormone, AMH) je glykoproteinový dimer tvořený dvěma monomery o molekulové hmotnosti 72 kDa [43]. AMH řadíme do skupiny růstových faktorů transforming growth factor-β (TGF-β). Gen pro AMH je umístěn na krátkém raménku chromozomu 19 [49]. Při účinku na buňky využívá AMH dvou typů receptorů: MIS receptor type I (MISRI) a MIS receptor type II (MISRII), které jsou přítomny v cílových tkáních (gonády a Müllerův duktus) [27]. Produkce AMH je soustředěna u plodů mužského pohlaví v Sertoliho buňkách, u žen pak v granulózových buňkách vaječníků. AMH hraje důležitou roli v pohlavní diferenciaci plodu. Produkce AMH způsobuje u plodu regresi Müllerova vývodu a spolu s testosteronem podporuje vývoj plodu mužského pohlaví. Pokud není AMH přítomen v prenatálním období, vyvíjí se plod ženského pohlaví [30]. V našem článku jsme se snažili zmapovat současnou úroveň poznatků o měření AMH u žen.
ZPŮSOBY MĚŘENÍ AMH
AMH je možné stanovit v séru pomocí imuno-analytických metod, které jsou založeny na principu reakce antigenu a protilátky. V současné době jsou na trhu diagnostické soupravy na bázi systému Enzyme-Linked ImmunoSorbent Assays (ELISA). Princip ELISA metod ukazuje schéma 1.
Schéma 1 Princip stanovení AMH metodou ELISA 
AMH je detekováno pomocí dvou monoklonálních protilátek, z nichž první, záchytná protilátka, je pevně vázána na stěnu reakční jamky. Po přidání vzorku s antigenem, kterým je v tomto případě AMH, je vzorek zachycen protilátkou vázanou na pevné fázi. Po promytí se přidá roztok s druhou detekční protilátkou, která je namířena proti další antigenní determinantě molekuly AMH. Detekční protilátka se naváže na již vzniklý komplex záchytné protilátky a AMH. Detekční protilátka je označena enzymem. Po odmytí nezreagované detekční protilátky se do reakční jamky přidá enzymatický substrát. Enzym zpracuje přidaný substrát za vzniku barevné reakce. Výsledné zabarvení vyhodnotíme fotometricky. Intenzita zabarvení je úměrná koncentraci AMH.
AMH V SÉRU
Metoda stanovení AMH v séru systémem ELISA byla vyvinuta v druhé polovině 80. let minulého století. První práce byly zveřejněny v roce 1990 a týkaly se vztahu AMH a normálního či narušeného pohlavního vývoje dětí [1, 21, 23]. Kolem roku 2000 se objevily práce, které zkoumaly vztah AMH a ovariální rezervy na zvířecím modelu [8, 9]. Od roku 2002 se pak začíná hovořit o AMH jako o novém markeru ovariální rezervy u žen [6, 47, 59]. V souvislosti s ovariální rezervou je dnes indikována většina vyšetření sérových hladin AMH.
AMH VE FOLIKULÁRNÍ TEKUTINĚ
Po nabytí zkušeností s měřením koncentrací AMH v séru přitáhl pozornost výzkumných týmů folikul samotný, resp. folikulární tekutina. Princip stanovení ve folikulární tekutině je shodný s principem stanovení v séru. Bylo zjištěno, že produkce AMH v rostoucím folikulu klesá. Nejvyšší koncetrace AMH se nachází v preantrálních a malých antrálních folikulech, menších než 4 mm. Ve větších folikulech (4–8 mm) se koncentrace AMH postupně snižuje a ve folikulech větších než 8 mm je již hladina AMH velmi nízká nebo úplně chybí [61]. Hladina AMH je v malých folikulech přibližně třikrát vyšší než ve folikulech velkých. Hladiny AMH naměřené v malých i velkých folikulech pozitivně korelovaly s počtem časných antrální folikulů před řízenou ovariální hyperstimulací (COH, controlled ovarian hyperstimulation), počtem rostoucích folikulů v den aplikace hCG a počtem získaných oocytů. Navíc byly hladiny AMH ve folikulární tekutině významně vyšší u žen, které v příslušném cyklu in vitro fertilizace (IVF) otěhotněly. AMH ve folikulární tekutině může být tedy rozhodujícím faktorem při výběru oocytů, které budou oplodněny [60].
AMH V PRŮBĚHU ŽIVOTA ŽENY
Hladiny AMH jsou u dívek po narození velice nízké. První malý vzestup hladin zaznamenáváme ve dvou letech života. Tento věk se nazývá obdobím minipuberty [31]. Další malý vzestup přichází kolem osmého roku života a do dvanáctého roku hladiny AMH klesají. Poté nastává postupné zvyšování hladin až do dosažení životního maxima mezi dvaceti pěti až dvaceti sedmi lety. Následně hladiny AMH klesají až do neměřitelných hodnot v období menopauzy [25].
REFERENČNÍ HODNOTY AMH
Referenční sérové hladiny AMH se mění s věkem ženy. Průměrné maximální hodnoty dosahované asi ve 25. roku života se pohybují kolem 5 ng/ml. Poté hladiny spolu s ovariální rezervou postupně klesají. Průběh průměrných hodnot AMH ve fertilním věku ženy ukazuje graf 1. Při tvorbě grafu jsme vycházeli především ze dvou největších studií provedených ve Velké Británii [25, 39].
Graf 1. Průměrné koncentrace AMH ve fertilním věku u žen 
Další typ referenčních hodnot se používá v souvislosti s IVF. Zde jde o predikci odpovědi na hormonální stimulaci na při známé hladině AMH před zahájením stimulace. V tabulce 1 uvádíme příklad referenčních hodnot AMH, které jsou nastaveny tak, aby kladly důraz na minimalizaci rizika ovariálního hyperstimulačního syndromu (OHSS). Zkušenosti jednotlivých pracovišť se mohou v tomto směru lišit. Každé pracoviště by si mělo pro tento účel stanovit své vlastní referenční hodnoty.
Tab. 1. Referenční hodnoty AMH v souvislosti s IVF 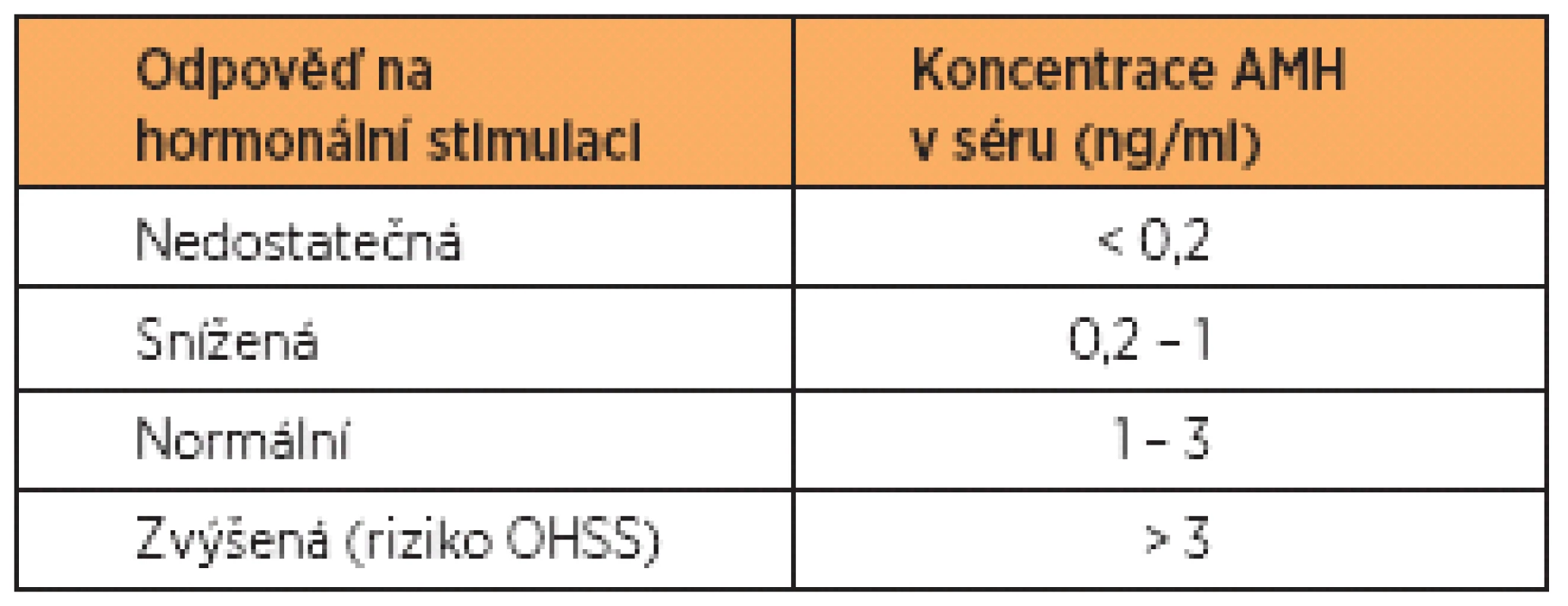
AMH A OBEZITA
Studie zabývající se vztahem mezi indexem tělesné hmotnosti (BMI) a sérovou koncentrací AMH dospěly k závěrům, že mezi sérovou hladinou AMH a BMI neexistuje žádná korelace. Podobně nebyla prokázána žádná závislost mezi BMI a dalšími sérovými markery ovariální rezervy (FSH, LH, inhibin B) [52] a nepodařilo se prokázat ani žádný vztah mezi BMI a ultrazvukem stanoveným počtem antrálních folikulů (AFC, antral follicle count) [17]. Lze tedy konstatovat, že obezita nemá vztah k ultrazvukovému markeru AFC, ani k sérovým markerům ovariální rezervy.
AMH A KOUŘENÍ
Ženy kuřačky mají ve srovnání s ženami nekuřačkami nižší sérovou hladinu AMH, než by bylo obvyklé pro jejich věk, a zároveň u nich dochází v průběhu celého reprodukčního života k rychlejšímu poklesu hladin AMH [55].
Měření hladin AMH ve folikulární tekutině a hodnocení AFC u aktivních kuřaček prokázalo ve srovnání se ženami nekuřačkami snížení hladin AMH ve folikulární tekutině a menší velikost folikulů při hodnocení AFC [13]. Mechanismy, kterými kouření indukuje tyto změny, jsou prozatím neznámé [14].
AMH A HORMONÁLNÍ ANTIKONCEPCE
Názory podložené výsledky studií o vlivu užívání hormonální antikoncepce (HAK) na hladinu AMH v séru nejsou zcela jednotné. Studie publikovaná v roce 2012 poukazuje na rozdíl v koncentracích sérového AMH u žen užívajících HAK a žen, které HAK nikdy neužívaly. Ženy, které HAK užívaly, měly hladiny AMH o 30 % nižší a stejné snížení bylo nalezeno i u AFC. Závislost mezi dávkou hormonů a mírou poklesu AMH se nepodařilo prokázat [2]. Dřívější studie přitom neprokázaly žádné snížení hladin AMH u uživatelek HAK, a tudíž ve svých závěrech doporučují AMH jako spolehlivý marker ovariální rezervy i při užívání hormonální antikoncepce [34]. Závěry další studie popisují u žen užívajících HAK snížení počtu folikulů větších než 6 mm při stimulaci gonadotropiny v porovnání s ženami, které HAK neužívaly. Počet malých antrálních folikulů 2–6 mm a hladiny AMH však nebyly ovlivněny [5].
AMH JAKO MARKER OVARIÁLNÍ REZERVY
Počet folikulů klesá s věkem a v období menopauzy je jejich zásoba prakticky vyčerpána. Na rozdíl od jiných hormonálních markerů, sérová koncentrace AMH odráží počet folikulů během časné folikulární fáze, a je tedy dobrým parametrem pro sledování ovariální rezervy [24]. AMH v séru klesá v průběhu let a na rozdíl od FSH, LH, estradiolu a inhibinu B lépe reflektuje snižující se ovariální rezervu. Hladina AMH kromě toho pozitivně koreluje s počtem oocytů získaných po COH v programu asistované reprodukce (ART) [12].
AMH A AFc
Vztah mezi AMH a AFC je stále předmětem velmi intenzivní diskuse. AMH, AFC a další parametry ovariální rezervy byly testovány ve vztahu ke snižování ovariální rezervy ověřené histologicky. Pouze AMH a AFC přímo korelovaly s pozorovaným snížením počtu folikulů [20, 51]. Koncentrace AMH v séru koreluje s AFC, ale informace poskytovaná oběma markery je kvalitativně poněkud odlišná [62]. Na základě měření koncentrace AMH ve folikulární tekutině lze konstatovat, že AMH je více produkován v menších folikulech (menších než 2–4 mm) než ve folikulech větších. Ve folikulech větších než 8 mm je pak jeho produkce velice nízká. Pomocí ultrazvuku můžeme rozlišit folikuly větší než 2 mm. AFC nám tedy dává informaci o přítomnosti počtu folikulů o velikosti 2 mm a větších. Mnoho center reprodukční medicíny využívá proto v současné době při hodnocení ovariální rezervy rutinně oba tyto parametry.
SNÍŽENÁ OVARIÁLNÍ ODPOVĚĎNA STIMULACI GONADOTROPINY
Stimulace folikulogeneze vyvolává růst folikulů, ale čím větší je folikul, tím méně AMH produkuje. Hladiny AMH v průběhu COH tedy postupně klesají. Údaje z mnoha studií přitom poukazují na pozitivní korelaci mezi bazální hladinou AMH před stimulací a počtem získaných oocytů u žen podstupujících COH. Přitom počet vytvořených folikulů a počet získaných oocytů jsou dvě hlavní kritéria pro vymezení dobré a špatné odpovědi na stimulaci. Koncentrace AMH v séru u žen se ziskem 11 a více oocytů byla 2,5krát vyšší ve srovnání s těmi, u kterých bylo získáno šest a méně oocytů. Bylo zjištěno, že AMH je lepším markerem pro predikci ovariální odpovědi na COH než věk ženy, sérová hladina FSH, estradiolu nebo inhibinu B. Z klinického hlediska tedy správná predikce nedostatečné odpovědi na COH pomocí stanovení AMH napomáhá snížit riziko předčasného ukončení léčebného cyklu, snižuje léčebné náklady a psychickou zátěž pro neplodný pár. Absence výkyvů koncentrace AMH v průběhu menstruačního cyklu staví tento parametr do pozice markeru ovariální rezervy, který může být vyšetřen nezávisle na dni cyklu [26].
AMH A SYNDROM POLYCYSTICKÝCH OVARIÍ
Evropská společnost pro lidskou reprodukci a embryologii (ESHRE) a Americká společnost reprodukční medicíny (ASRM) na společném workshopu v Rotterdamu v roce 2004 zpřesnily diagnostická kritéria sydromu polycystických ovarií (PCOS). Klinická diagnóza PCOS je potvrzena, pokud jsou přítomny alespoň dvě z následujících tří kritérií: chronické oligo - nebo anovulace, biochemicky potvrzená hyperandrogenémie anebo ultrazvukovým vyšetřením potvrzená morfologie polycystických ovarií (PCO) [58]. Mezi klinické projevy PCOS patří poruchy menstruačního cyklu spojené s anovulací, hyperandrogenismus, hirsutismus a mužský typ alopecie [41]. PCOS je diagnostikován u 5–10 % žen v reprodukčním věku a bývá spojen s metabolickými poruchami. Výskyt diabetes mellitus 2. typu je u žen s PCOS desetkrát vyšší než u zdravých žen. U 30–50 % žen s PCOS se po dosažení věku 30 let rozvíjí poruchy glukózové tolerance nebo diabetes mellitus 2. typu [32]. Ženy s PCOS mají oproti zdravým ženám ve vaječníku až šestkrát větší počet folikulů. Produkce AMH je až u 75 % žen s PCOS v porovnání se zdravými kontrolami zvýšena [41]. Podle některých autorů jsou vysoké hladiny AMH u žen s PCOS připisovány vysokému výskytu počtu malých antrálních folikulů o průměru do 2 mm, neboť koncentrace AMH pozitivně koreluje právě s počtem folikulů tohoto typu [18, 22]. Zvýšené koncentrace AMH hrají zásadní roli v potlačení procesu zrání folikulů [42].
Je známo, že hladiny AMH u žen s normálním ovulačním cyklem klesají s věkem. Podobně, ale pomaleji, klesají koncentrace AMH u žen s PCOS [44]. U dívek s PCOS ve věku 12–18 roků byly pozorovány v porovnání se zdravými kontrolami vysoké hladiny AMH [3]. Zvýšené hladiny AMH byly též nalezeny u dívek narozených matkám s PCOS [53]. Koncentrace AMH u žen s PCOS pozitivně korelovaly s hladinou testosteronu a androstendionu [45]. Metformin podáváný anovulačním pacientkám s PCOS působí snížení hladiny AMH ve folikulární tekutině a tato změna by u nich mohla hrát významnou roli v navození ovulačních cyklů [10, 24].
OVARIÁLNÍ HYPERSTIMULAČNÍ SYNDROM
OHSS je potenciálně život ohrožující stav, který se projevuje přehnanou odpovědí vaječníků na řízenou stimulaci (COS). Syndrom má široké spektrum klinických projevů, od mírné formy vyžadující pouze sledování až po těžkou formou vyžadující hospitalizaci a intenzivní péči. Mírné a středně těžké formy OHSS se mohou vyskytnout u 15–20 % všech cyklů. Těžké formy syndromu byly pozorovány u 1–3 % [48]. Cestou k prevenci OHSS je správné vyhodnocení rizikových faktorů OHSS vedoucí k individuálně upravené počáteční dávce gonadotropinů, která je nezbytná pro dosažení optimální folikulární odpovědi. I tak zůstává predikce přesné odpovědi na stimulaci v IVF cyklu nadále velmi složitou záležitostí. Hlavním rizikovým faktorem pro OHSS je PCOS. Ten je přítomen u 20 % žen podstupujících COH a je morfologickým podkladem u 20 % žen s příznaky rozvíjejícího se OHSS. Vztah mezi OHSS a sérovou hladinou AMH naznačuje, že vysoká bazální hladina AMH je spojena se zvýšeným rizikem vzniku OHSS. Měření hladin AMH před stimulací gonadotropiny tedy dává možnost upravit stimulační protokol s cílem předejít OHSS [58].
AMH A KVALITATIVNÍ HLEDISKA OVARIÁLNÍ ODPOVĚDI
Šance na úspěšné provedení IVF je více závislá na kvalitativních parametrech než na pouhém množství získaných oocytů. Vzhledem k tomu, že stav ovariální rezervy zahrnuje množství i kvalitu folikulů, může AMH odrážet nejen kvantitativní, ale i kvalitativní charakteristiky ovariální odezvy na stimulaci [11]. V současné době není vztah sérové hladiny AMH a kvalitativních parametrů ovariální odpovědi zcela jednoznačný. Někteří autoři našli významnou pozitivní korelaci mezi sérovou koncentrací AMH, kvalitou oocytů a morfologií embryí [33], jiní však tento vztah nepotvrdili [54]. Prozatím byla prokázána korelace mezi sérovou hladinou AMH, počtem získaných oocytů a otěhotněním v konkrétním cyklu IVF [38]. Za účelem objasnění komplikovaného vztahu mezi sérovou hladinou AMH na straně jedné a kvalitou oocytů a embryí na straně druhé je třeba vyčkat výsledků dalších studií [35].
AMH V PROGRAMU DÁRCOVSTVÍ OOCYTŮ
Program darování vajíček je jednou z možností ART a je v současné době využíván v řadě zemí celého světa. Ve většině zemí je základním kritériem pro zařazení dárkyň do programu darování oocytů jejich věk [37]. Podle výsledků mnoha studií je možné říci, že AMH má prediktivní schopnost rozlišovat ženy s nedostatečnou či nadměrnou odpovědí na stimulaci gonadotropiny [46]. AMH je v tomto ohledu lepší marker ovariální rezervy než jiné biomarkery (FSH, LH, inhibin B) a věk dárkyně [50]. Přesné posouzení ovariální rezervy, predikce odezvy na stimulaci, predikce počtu a kvality získaných oocytů jsou přitom významná kritéria pro výběr vhodných dárkyň, takže AMH patří mezi parametry s vysokým potenciálem pro jeho zlepšení [15].
AMH A ENDOMETRIÓZA
U žen s endometriózou oproti zdravým ženám nedochází ke snížení ovariální rezervy ani ke změnám hladin AMH [56]. Zajímavým faktem je ovšem zjištění, že hladina AMH významně klesá půl roku po provedení chirurgického zákroku v souvislosti s léčbou endometriózy [4]. Tento fakt by měl být vzat v úvahu u žen fertilního věku s endometriózou, které ještě plánují těhotenství.
AMH U NÁDORŮ Z BUNĚK GRANULÓZY
AMH je u žen produkován v granulózových buňkách ovarií od narození až do menopauzy. AMH je tedy možné použít jako citlivý nádorový marker u tumorů vycházejících z buněk granulózy. Zvýšení AMH bylo zjištěno u 85 % žen postižených nádorem vycházejícím z granulózových buněk [29]. Průměrné zvýšení sérových koncentrací AMH bylo přibližně desetkrát vyšší než u zdravých žen. AMH je velmi citlivý a specifický marker pro sledování žen po ovarektomii a zvýšení sérových hladin AMH předchází detekci recidivy jinými metodami průměrně o 16 měsíců [36]. Přitom včasné odhalení recidivy má velký význam v systému dispenzarizace pacientek s nádory z granulózových buněk, neboť výskyt recidiv byl pozorován 10–20 let po resekci primárního tumoru [19, 28].
AMH U CHEMOTERAPIE A OZAŘOVÁNÍ
Všechny studie jasně prokázaly statisticky významné změny sérových hladin AMH v průběhu chemoterapie a po ozáření pánve. Poškození ova-riální rezervy a snížení hladiny AMH závisí na typu použitých chemoterapeutik a počtu terapeutických cyklů. Nejvíce destruktivní s ohledem na ovariální rezervu jsou alkylující látky [16]. Po chemoterapii bylo pozorováno obnovování hladin AMH, přičemž rychlost obnovení hladiny AMH pozitivně korelovala s koncentrací AMH v séru před chemoterapií. Při hladinách AMH před terapií, které byly vyšší než 2 ng/ml, docházelo po chemoterapii k obnově hladin rychlostí nárůstu o 11,9 % za měsíc. U žen s hladinou AMH nižší než 2 ng/ml před zahájením léčby docházelo k obnovení hladin po léčbě rychlostí nárůstu pouze o 2,6 % za měsíc [7].
ZÁVĚR
Při současném trendu snižující se reprodukční schopnosti naší populace vnímáme problematiku vyšetřování AMH jako velmi aktuální. Možnosti klinického využití AMH se neustále rozšiřují, a proto jsme se kromě dnes již obecně známého využití AMH při provedení IVF snažili zaměřit na indikace k vyšetření AMH, o nichž se široce diskutuje v zahraniční literatuře. Jde zejména o problematiku PCOS a souvisejícího metabolického syndromu. Dále jsme chtěli upozornit na AMH jako citlivý nádorový marker, neboť jakkoli patří nádory z granulózových buněk k méně frekventním, ohrožují zdraví a životy pacientek zejména pozdními relapsy. AMH hraje rovněž významnou úlohu při plánování ochrany reprodukčních funkcí před chemoterapií, radioterapií či chirurgickými výkony, které všechny ohrožují budoucí plodnost ženy.
Podpořeno MZ ČR - RVO (Fakultní nemocnice Plzeň - FNPl, 00669806).
PharmDr. Radek Kučera, Ph.D.
FN Plzeň, Imunoanalytická laboratoř
Oddělení nukleární medicíny
Dr. E. Beneše 13
305 99 Plzeň
e-mail: kuucera@seznam.cz
Zdroje
1. Baker, ML, Metcalfe, SA, Hutson, JM. Serum levels of müllerian inhibiting substance in boys from birth to 18 years, as determined by enzyme immunoassay. J Clin Endocrinol Metab, 1990, 70, 1, p. 11–15.
2. Bentzen, JG., Forman, JL., Pinborg, A., et al. Ovarian reserve parameters: a comparison between users and non-users of hormonal contraception. Reprod Biomed Online, 2012, 25, 6, p. 612–619.
3. Carlsen, SM., Vanky, E., Fleming, R. Anti-Müllerian hormone concentrations in androgen suppressed women with polycystic ovary syndrome. Hum Reprod, 2009, 24, 7, p. 1732–1738.
4. Celik, HG., Dogan, E., Okyay, E., et al. Effect of laparoscopic excision of endometriomas on ovarian reserve: serial changes in the serum antimüllerian hormone levels. Fertil Steril, 2012, 97, 6, p. 1472–1478.
5. Deb, S., Campbell, BK., Pincott-Allen, C., et al. Quantifying effect of combined oral contraceptive pill on functional ovarian reserve as measured by serum anti-Müllerian hormone and small antral follicle count using three-dimensional ultrasound. Ultrasound Obstet Gynecol, 2012, 39, 5, p. 574–580.
6. de Vet, A., Laven, JS., de Jong, FH., Themmen, AP.,Fauser, BC. Anti-Müllerian hormone serum levels: A putative marker for ovarian aging. Fertil Steril, 2002, 77, 2, p. 357–362.
7. Dillon, KE., Sammel, MD., Prewitt, M., et al. Pretreatment antimüllerian hormone levels determine rate of posttherapy ovarian reserve recovery: acute changes in ovarian reserve during and after chemotherapy. Fertil Steril, 2012, 12, 2, p. 2258–2263.
8. Durlinger, AL., Gruijters, MJ., Kramer, P., et al. Anti-müllerian hormone attenuates the effects of FSH on follicle development in the mouse ovary. Endocrinology, 2001, 142, 11, p. 4891–4899.
9. Durlinger, AL., Kramer, P., Karels, B., et al. Control of primordial follicle recruitment by anti-Müllerian hormone in the mouse ovary. Endocrinology, 1999, 140, 12, p. 5789–5796.
10. Falbo, A., Rocca, M., Russo, T., et al. Serum and follicular anti-Müllerian hormone levels in women with polycystic ovary syndrome (PCOS) under metformin. J Ovarian Res, 2010, 21, p. 3–16.
11. Fanchin, R., Mendez Lozano, DH., Frydman, N., et al. Anti-Müllerian hormone concentrations in the follicular fluid of the preovulatory follicle are predictive of the implantation potential of the ensuing embryo obtained by in vitro fertilization. J Clin Endocrinol Metab, 2007, 92, 5, p. 1796–1802.
12. Fanchin, R., Schonäuer, LM., Righini, C., et al. Serum anti-Müllerian hormone is more strongly related to ovarian follicular status than serum inhibin B, estradiol, FSH and LH on day 3. Hum Reprod, 2003, 18, 2, p. 323–327.
13. Freour, T., Masson, D., Dessolle, L., et al. Ovarian reserve and in vitro fertilization cycles outcome according to women smoking status and stimulation regimen. Arch Gynecol Obstet, 2012, 285, 4, p. 1177–1182.
14. Fuentes, A., Muñoz, A., Pommer, R., et al. Decreased anti-Müllerian hormone concentration in follicular fluid of female smokers undergoing artificial reproductive techniques. Chemosphere, 2012, 88, 4, p. 403–406.
15. Gleicher, N., Weghofer, A., Barad, DH. Can egg donor selection be improved? A pilot study. Reprod Biol Endocrinol, 2010, 24, 8, p. 76.
16. Gracia, CR., Sammel, MD., Freeman, E., et al. Impact of cancer therapies on ovarian reserve. Fertil Steril, 2012, 97, 1, p. 134–140.
17. Halawaty, S., ElKattan, E., Azab, H., et al. Effect of obesity on parameters of ovarian reserve in premenopausal women.J Obstet Gynaecol Can, 2010, 32, 7, p. 687–690.
18. Hart, R., Doherty, D., Norman, R., et al. Serum anti-Müllerian hormone (AMH) levels are elevated in adolescent girls with polycystic ovaries and the polycystic ovarian syndrome (PCOS). Feril Steril, 2010, 94, 3, p. 1118–1121.
19. Healy, DL., Burger, HG., Mamers, P., et al. Elevated serum inhibin concentrations in postmenopausal women with ovarian tumors. N Engl J Med, 1993, 329, 21, p. 1539–1542.
20. Hendriks, DJ., Mol, BW., Bancsi, LF., et al. Antral follicle count in the prediction of poor ovarian response and pregnancy after in vitro fertilization: a meta-analysis and comparison with basal follicle-stimulating hormone level. Fertil Steril, 2005, 83, 2, p. 291–301.
21. Hudson, PL., Dougas, I., Donahoe, PK., et al. An immunoassay to detect human müllerian inhibiting substance in males and females during normal development. J Clin Endocrinol Metab, 1990, 70, 1, p. 16–22.
22. Jonard, S., Dewailly, D. The follicular excess in polycystic ovaries, due to ovarian hyperandrogenism, may be the culprit for the follicular arrest. Hum Reprod Update, 2004, 10, 2, p. 107–117.
23. Josso, N., Legeai, L., Forest, MG., et al. An enzyme linked immunoassay for anti-müllerian hormone: a new tool for the evaluation of testicular function in infants and children. J Clin Endocrinol Metab, 1990, 70, 1, p. 23–27.
24. Karkanaki, A., Vosnakis, C., Panidis, D. The clinical significance of anti-Müllerian hormone evaluation in gynecological endocrinology. Hormones, 2011, 10, 2, p. 95–103.
25. Kelsey, TW., Wright, P., Nelson, SM., et al. A validated model of serum anti-müllerian hormone from conception to menopause. PLoS One, 2011, 6, 7, p. 22024.
26. La Marca, A., Sighinolfi, G., Radi, D., et al. Anti-Mullerian hormone (AMH) as a predictive marker in assisted reproductive technology (ART). Hum Reprod Update, 2010, 16, 2, p. 113–130.
27. La Marca, A., Volpe, A. Anti-Müllerian hormone (AMH) in female reproduction: is measurement of circulating AMH a useful tool? Clin Endocrinol, 2006, 64, 6, p. 603–610.
28. La Marca, A., Volpe, A. The anti-Mullerian hormone and ovarian cancer. Hum Reprod Update, 2007, 13, 3, p. 265–273.
29. Lane, AH., Lee, MM., Fuller, AF. Jr., et al. Diagnostic utility of Müllerian inhibiting substance determination in patients with primary and recurrent granulosa cell tumors. Gynecol Oncol, 1999, 73, 1, p. 51–55.
30. Lee, MM., Misra, M., Donahoe, PK., MacLaughlin, DT. MIS/AMH in the assessment of cryptorchidism and intersex conditions. Mol And Cell Biotechnology, 2003, 211, 1–2, p. 91–98.
31. Lee, MM. Reproductive hormones in infant girls–a harbinger of adult reproductive function? J Clin Endocrinol Metab, 2003, 88, 8, p. 3513–3514.
32. Legro, RS., Gnatuk, CL., Kunselman, AR., Dunaif, A. Changes in glucose tolerance over time in women with polycystic ovary syndrome: a controlled study. J Clin Endocrinol Metab, 2005, 90, 6, p. 3236–3242.
33. Lekamge, DN., Barry, M., Kolo, M., et al. Anti-Müllerian hormone as a predictor of IVF outcome. Reprod Biomed Online, 2007, 14, 5, p. 602–610.
34. Li, HW., Wong, CY., Yeung, WS., et al. Serum anti-müllerian hormone level is not altered in women using hormonal contraceptives. Contraception, 2011, 83, 6, p. 582–585.
35. Lie Fong, S., Baart, EB., Martini, E., et al. Anti-Müllerian hormone: a marker for oocyte quantity, oocyte quality and embryo quality? Reprod Biomed Online, 2008, 16, 5, p. 664–670.
36. Long, WQ., Ranchin, V., Pautier, P., et al. Detection of minimal levels of serum anti-Müllerian hormone during follow-up of patients with ovarian granulosa cell tumor by means of a highly sensitive enzyme-linked immunosorbent assay. J Clin Endocrinol Metab, 2000, 85, 2, p. 540–544.
37. Nakhuda, GS., Douglas, NC., Thornton, MH., et al. Anti-Müllerian hormone testing is useful for individualization of stimulation protocols in oocyte donors. Reprod Biomed Online, 2011, 22, 1, p. 88–93.
38. Nelson, SM., Yates, RW., Fleming, R. Serum anti-Müllerian hormone and FSH: prediction of live birth and extremes of response in stimulated cycles–implications for individualization of therapy. Hum Reprod, 2007, 22, 4, p. 2414–2421.
39. Nelson, SM., Yates, RW., Lyall, H., et al. Anti-Müllerian hormone-based approach to controlled ovarian stimulation for assisted conception. Hum Reprod 2009, 24, 4, p. 867–875.
40. Nestler, JE. Metformin for the treatment of the polycystic ovary syndrome. N Engl J Med, 2008, 358, 1, p. 47–54.
41. Norman, RJ., Dewailly, D., Legro, RS., Hickley, T. Polycystic ovary syndrome. Lancet, 2007, 370, 9588, p. 685–697.
42. Pellat, L., Hanna, L., Brinmat, M., et al. Granulosa cell production of anti-Müllerian hormone is increased in polycystic ovaries. J Clin Endocrinol Metab, 2007, 92, 1, p. 240–245.
43. Picard, JY., Josso N. Purification of testicular AMH allowing direct visualization of the pure glycoprotein and determination of the yield and purification factor. Mol Cell Endocrinol, 1984, 34, 1, p. 17–30.
44. Piltonen, T., Morin-Papunen, L., Koivunen, R., et al. Serum AMH levels remain high until late reproductive age and decrease during metformin treatment in women with polycystic ovary syndrome. Hum Reprod, 2005, 20, 7, p. 1820–1826.
45. Piouka, A., Farmakiotis, D., Macut, D., et al. Anti-Müllerian hormone levels are increased in women with classical PCOS and are negatively influenced by obesity. Am J Physiol Endocrinol Metab, 2009, 296, 2, p. 238–243.
46. Polyzos, NP., Stoop, D., Blockeel, C., et al. Anti-Müllerian hormone for the assessment of ovarian response in GnRH-antagonist-treated oocyte donors. Reprod Biomed Online, 2012, 24, 5, p. 532–539.
47. Seifer, DB., MacLaughlin, DT., Christian, BP., et al. Early follicular serum müllerian-inhibiting substance levels are associated with ovarian response during assisted reproductive technology cycles. Fertil Steril, 2002, 77, 3, p. 468–471.
48. Practice Committee of American Society for Reproductive Medicine. Ovarian hyperstimulation syndrome. Fertil Steril, 2008, 90, 5, p. 188–193.
49. Rey, R., Lukas-Croisier, C., Lasala, C., Bedecarras, P. AMH/MIS: what we know already about the gene, the protein and its regulation. Mol And Cell Endocrinol, 2003, 211, 1–2, p. 21–31.
50. Riggs, R., Kimble, T., Oehninger, S., et al. Anti-Müllerian hormone serum levels predict response to controlled ovarian hyperstimulation but not embryo quality or pregnancy outcome in oocyte donation. Fertil Steril, 2011, 95, 1, p. 410–412.
51. Rosen, MP., Johnstone, E., McCulloch, CE., et al. A characterization of the relationship of ovarian reserve markers with age. Fertil Steril, 2012, 97, 1, p. 238–243.
52. Sahmay, S., Usta, T., Erel, CT., et al. Is there any correlation between amh and obesity in premenopausal women? Arch Gynecol Obstet, 2012, 286, 3, p. 661–665.
53. Sir Petermann, T., Conder, T., Mliqueo, M., et al. Increased anti-Müllerian hormone serum concentrations in prepubertal daughters of women with polycystic ovary syndrome. J Clin Endocrinol Metab, 2006, 91, 8, p. 3105–3109.
54. Smeenk, JM., Sweep, FC., Zielhuis, GA., et al. Antimüllerian hormone predicts ovarian responsiveness, but not embryo quality or pregnancy, after in vitro fertilization or intracytoplasmic sperm injection. Fertil Steril, 2007, 87, 1, p. 223–226.
55. Sowers, MR., McConnell, D., Yosef, M., et al. Relating smoking, obesity, insulin resistance, and ovarian biomarker changes to the final menstrual period. Ann N Y Acad Sci, 2010, 1204, p. 95–103.
56. Streuli, I., de Ziegler, D., Gayet, V., et al. In women with endometriosis anti-Müllerian hormone levels are decreased only in those with previous endometrioma surgery. Hum Reprod, 2012, 27, 11, p. 3294–3303.
57. The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group Revised 2003 consensus on diagnostic criteria and long term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod, 2004, 19, 1, p. 41–47.
58. Tummon, I., Gavrilova-Jordan, L., Allemand, MC.,Session, D. Polycystic ovaries and ovarian hyperstimulation syndrome: a systematic review. Acta Obstet Gynecol Scand, 2005, 84, 7, p. 611–616.
59. van Rooij, IA., Broekmans, FJ., te Velde, ER., et al. Serum anti-Müllerian hormone levels: a novel measure of ovarian reserve. Hum Reprod, 2002, 17, 12, p. 3065–3071.
60. Wunder, DM., Bersinger, NA., Yared, M., et al. Statistically significant changes of antimüllerian hormone and inhibin levels during the physiologic menstrual cycle in reproductive age women. Fertil Steril, 2008, 89, 4, p. 927–933.
61. Weenen, C., Laven, JS., Von Bergh, AR., et al. Anti-Müllerian hormone expression pattern in the human ovary: potential implications for initial and cyclic follicle recruitment. Mol Hum Reprod, 2004, 10, 2, p. 77–83.
62. Yang, YS., Hur, MH., Kim, SY., Young, K. Correlation between sonographic and endocrine markers of ovarian aging as predictors for late menopausal transition. Menopause, 2011, 18, 2, p. 138–145.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Oznámení
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2013 Číslo 3- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Oznámení
- Dysfunkce endotelu u těhotných s chronickou formou hypertenze
- Vliv ohřátých infuzních roztoků při plánovaném císařském řezu na matku a plod – pilotní randomizovaná prospektivní studie
- Chirurgická léčba gynekologických onemocnění u Svědkyň Jehovových
- Výskyt latentní asymptomatické celiakie u žen se sníženou plodností
- Perzistence užívání léčby hyperaktivního močového měchýře v České republice
- Radioterapie v léčbě karcinomu vulvy
- Expresia karbonickej anhydrázy IX v karcinómoch prsníka
-
Psychosociální klima porodnice očima rodiček II.
Prediktory spokojenosti s perinatální péčí v České republice - Intrahepatální cholestáza v těhotenství
- Stanovení anti-Müllerova hormonu u žen
- Karcinom cervixu – možnosti detekce lidského papilomaviru
- Profylaktické užití antiinfekčních léčiv v porodnictví
- Solitární fibrózní tumor endometria – kazuistika
- Peripartální kardiomyopatie po císařském řezu – kazuistika
- Vzpomínka na profesora MUDr. et RNDr. Miloslava Talaše, DrSc.
- Prof. MUDr. Milan Kudela, CSc. – sedmdesátiletý
-
Olomouc course, autumn 2013
Publishing a scientific medical article
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Intrahepatální cholestáza v těhotenství
- Stanovení anti-Müllerova hormonu u žen
- Prof. MUDr. Milan Kudela, CSc. – sedmdesátiletý
- Profylaktické užití antiinfekčních léčiv v porodnictví
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



