-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cévní anatomie aortopelvického retroperitonea a její abnormality v souvislosti s radikální onkogynekologickou operativou – vlastní zkušenosti
Vascular anatomy and abnormalities of retroperitoneal pelvic and paraaortic area in relation to the radical oncogynecological surgery – individual experiences
Objective:
The overview of vascular anatomy and abnormalities of retroperitoneal pelvic and paraaortic area in relation to the radical oncogynecological surgery.Design:
Retrospective study.Setting:
Gynecologic Oncology Center, Department of Obstetrics and Gynecology, Faculty of Medicine, Masaryk University and University Hospital Brno.Material and methods:
The overview of visualized vascular anatomy of retroperitoneal pelvic, infrarenal suprapelvic and subhepatic area in relation to the radical oncogynecological surgery. Presentation of physiological vascular anatomy. Summary of the most common abnormalities and potential complications in terms of vascular injury. Basic management of these complications from the viewpoint of oncogynecologist.Conclusion:
The perfect knowledge of vascular anatomy and its possible abnormalities has represented an absolute necessity for uncomplicated course and sufficient extent of radical surgery.Keywords:
pelvic and paraaortic retroperitoneal area, vascular anatomy, vascular abnormality, vascular injury
Autoři: Luboš Minář
; Vít Weinberger
; Michal Felsinger
Působiště autorů: Onkogynekologické centrum, Gynekologicko-porodnická klinika LF MU a FN, Brno přednosta prof. MUDr. P. Ventruba, DrSc., MBA
Vyšlo v časopise: Ceska Gynekol 2017; 82(2): 100-107
Souhrn
Cíl studie:
Přehled cévní anatomie a jejích abnormalit v oblasti aortopelvického retroperitonea v souvislosti s radikální onkogynekologickou operativou.Typ studie:
Původní práce – retrospektivní studie.Pracoviště:
Onkogynekologické centrum FN Brno, Gynekologicko-porodnická klinika LF MU a FN Brno.Materiál a metodika:
Přehled vizualizovatelné cévní anatomie retroperitonea v oblasti pelvické, infrarenální suprapelvické a subhepatální v rámci radikální onkogynekologické operativy. Prezentace fyziologické cévní anatomie, přehled nejčastějších abnormit a potenciálních komplikací ve smyslu poranění cévních struktur a základní nástin jejich řešení z pohledu onkogynekologického operatéra.Závěr:
Dokonalá znalost anatomie včetně cévních struktur a jejich možných abnormit je naprostou nezbytností pro nekomplikovaný průběh a suficientní rozsah radikální onkogynekologické operace.Klíčová slova:
aortopelvické retroperitoneum, cévní anatomie, cévní abnormita, poranění cévyÚVOD
Systematická aortopelvická lymfadenektomie představuje stále nedílnou součást radikální onkogynekologické operativy i přes jednoznačnou snahu směřující k zavedení konceptu lymfatického mapování s biopsií sentinelové uzliny u řady gynekologických malignit. Stav regionálních lymfatických uzlin představuje zásadní prognostický faktor a rozhodující kritérium pro aplikaci adjuvantní terapie [23]. Systematická lymfadenektomie je prováděna v indikovaných případech v rámci kompletního chirurgického stagingu, předmětem diskusí je rovněž její terapeutický význam [28]. Systematická aortopelvická lymfadenektomie je určena pro epiteliální malignity ovaria, vejcovodu, primárně peritoneální karcinom, high risk typy karcinomu endometria, karcinosarkomy a high grade sarkomy děložního těla [1, 9]. Může být provedena (v těchto případech smysluplně vždy s využitím miniinvazivního přístupu) rovněž u primárně inoperabilních karcinomů děložního hrdla v předléčebném stagingu lymfatických uzlin. Izolovaná paraaortální lymfadenektomie je indikována v některých případech germinálních ovariálních malignit (např. dysgerminom) [19]. U karcinomu děložního hrdla je možné doplnit paraaortální výkon jako jednu z možností dalšího léčebného postupu při pozitivitě pánevních uzlin [21], pelvická oblast je svodnou lymfatickou oblastí rovněž pro karcinomy proximální pochvy.
Systematická aortopelvická disekce tukově-lymfatické tkáně je výkon standardně prováděný onkogynekologickými operatéry na úrovni regionálních onkogynekologických center. Rutinní provedení výkonu vyžaduje určitou learning curve podloženou dokonalou znalostí anatomických struktur inkriminované oblasti. Vždy je nutno počítat s nejrůznějšími úskalími, která se mohou v průběhu výkonu vyskytnout. Mezi ně patří i různé variety a abnormality uspořádání magistrálních cévních svazků a jejich větví [10], které přitom představují jeden ze základních orientačních bodů při vlastním provedení výkonu.
Kromě provedení systematické aortopelvické lymfadenektomie by měla k základní erudici onkogynekologického operatéra patřit rovněž schopnost orientace v oblasti horního břicha, která je nezbytná pro adekvátní rozsah operačních výkonů u karcinomů vycházejících zejména z děložních adnex nebo peritonea. I zde jsou oblasti patřící sice historicky do erudice břišních chirurgů, nicméně znalost jejich existence a anatomie je faktorem, který může výraznou měrou přispívat k dosažení kýženého cíle, tedy makroskopicky nulového rezidua na konci operace [13].
VLASTNÍ POZOROVÁNÍ
Pelvická oblast
Při pánevní lymfadenektomii je při systematickém výkonu odstraňována tukově-lymfatická tkáň podél vasa iliaca communis, vasa iliaca externa, vasa iliaca interna, z obturatorní fossy a z oblasti presakrální. Distální hranici disekce představuje oblast přechodu externích ilických cév do tříselného kanálu, konkrétně úroveň přemosťující žíly, tj. vena circumflexa ilium profunda, kterou doprovází stejnojmenná arterie (obr. 1). V oblasti obturatorní fossy je tukově lymfatická tkáň oddělena od stydké kosti, zde je zpravidla při disekci patrná varikózní větev, která dále běží po horním raménku stydké kosti, tzv. corona mortis Hesselbachi. Alespoň malá žíla se na tomto místě vyskytuje téměř konstantně. Přichází z canalis obturatorius, podle anatomické nomenklatury se jedná o vena obturatoria accessoria. Tepna se zde nachází asi ve 25 % případů jako spojka mezi arteria iliaca externa (resp. pubickou větví arteria epigastrica profunda) a pubickou větví arteria obturatoria [7]. Kaudálně se tkáň odstraňuje z oblasti kolem obturatorního nervově cévního svazku a směrem proximálním od interního ilického cévního svazku. Na vytvoření mediální hranice v obturatorní fosse se podílí kmen umbilikální arterie odstupující z arteria iliaca interna.
Obr. 1. Distální hranice pánevní lymfadenektomie ve vztahu k externím ilickým cévám vpravo (veškerá fotodokumentace z archivu autora) 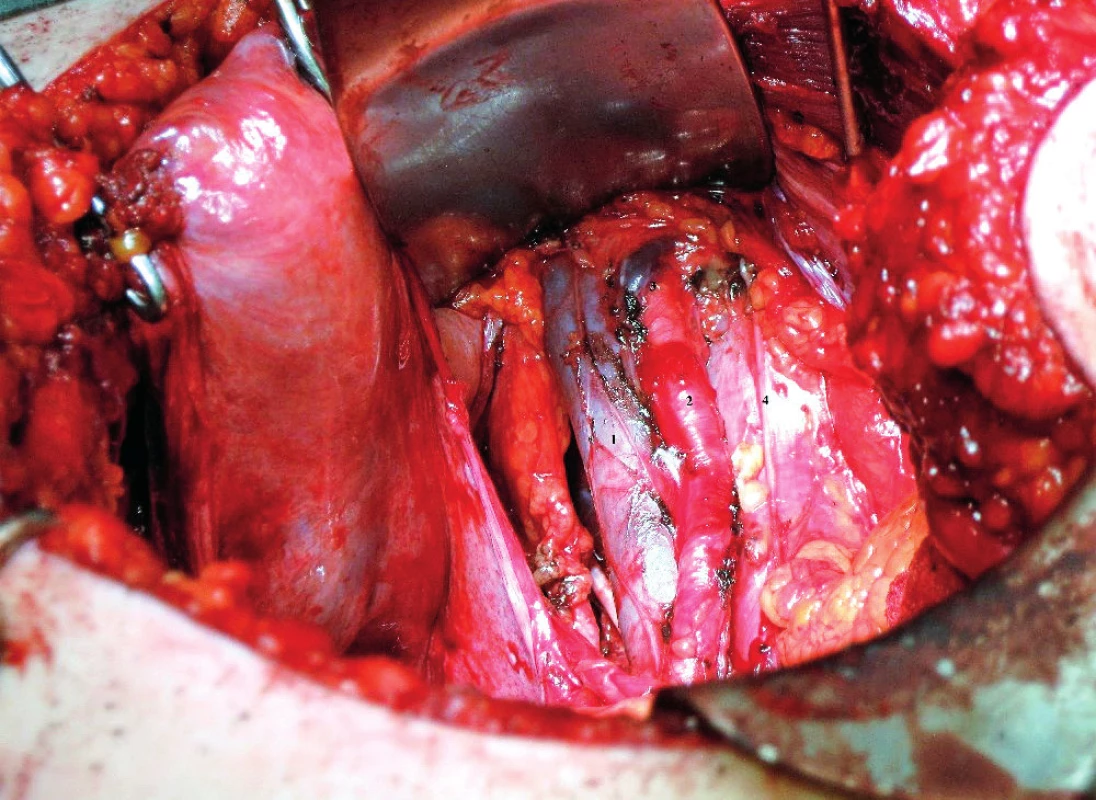
1 – v. iliaca externa, 2 – a. iliaca externa, 3 – v. circumflexa ilium profunda, 4 – n. genitofemoralis Při preparaci tkáně je riziko poranění variabilních žilních anastomóz v oblasti obturatorní fossy [14], které lze zpravidla vyřešit kombinací komprese horkou rouškou a koagulace, ev. založením ligatury, alternativou je užití lokálně působících hemostatických prostředků s obsahem fibrinogenu a trombinu [25]. Závažnější je poranění kmene vnitřní ilické žíly, které je nutno zpravidla řešit opichem, někdy i úplnou resekcí žíly [20]. Resekce vnitřní ilické tepny (obr. 2) je v onkogynekologii vyhrazena pro případy jinak peroperačně neřešitelného arteriálního krvácení z větvení tohoto cévního kmene [20], je prováděna rovněž při laterálně extendované radikální hysterektomii typu D [6]. Při odsunutí externího a společného ilického cévního svazku mediálně odstraňujeme tkáň kolem gluteálních žil, kde je při preparaci nutno postupovat s adekvátní obezřetností, neboť při jejich poranění je tato oblast anatomicky velmi špatně přístupná (obr. 3). Proximální hranici pánevní lymfadenektomie představuje oblast aortální bifurkace vznikající spojením společných ilických arterií. Distálně od bifurkace se nachází oblast presakrální. Při preparaci této oblasti může dojít k drobnějším lézím přední stěny společných ilických žil řešitelných zpravidla kompresí horkou rouškou nebo cíleným opichem, centrálně po periostu probíhá venózní pleteň vena sacralis mediana, která může být varikózně změněna (obr. 4). Abnormality v utváření magistrálních ilických svazků se týkají dominantně společných ilických žil [17], z naší klinické praxe uvádíme příklad duplikatury levostranné vena iliaca communis (obr. 5).
Obr. 2. Oblast resekce arteria iliaca interna vpravo 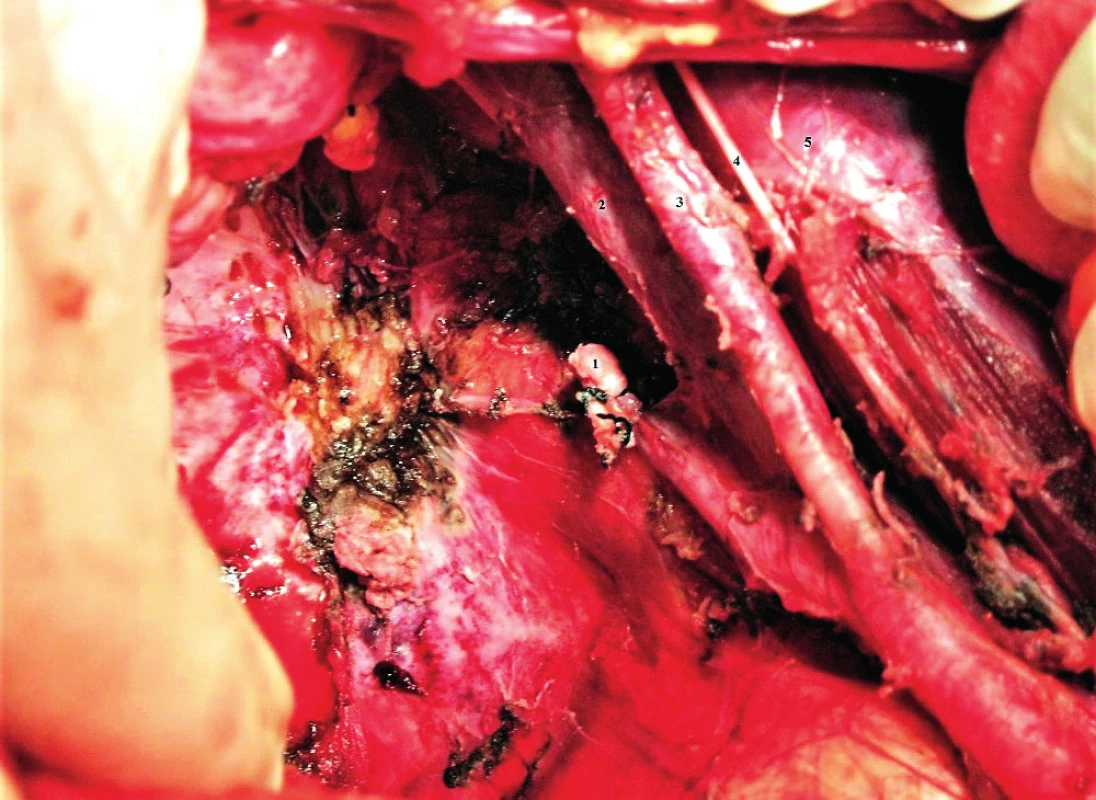
1 – resekovaný pahýl a. iliaca interna, 2 – v. iliaca externa, 3 – a. iliaca externa, 4 – n. genitofemoralis, 5. – m. psoas major Obr. 3. Oblast bifurkace vena iliaca communis vpravo (laparoskopický pohled) 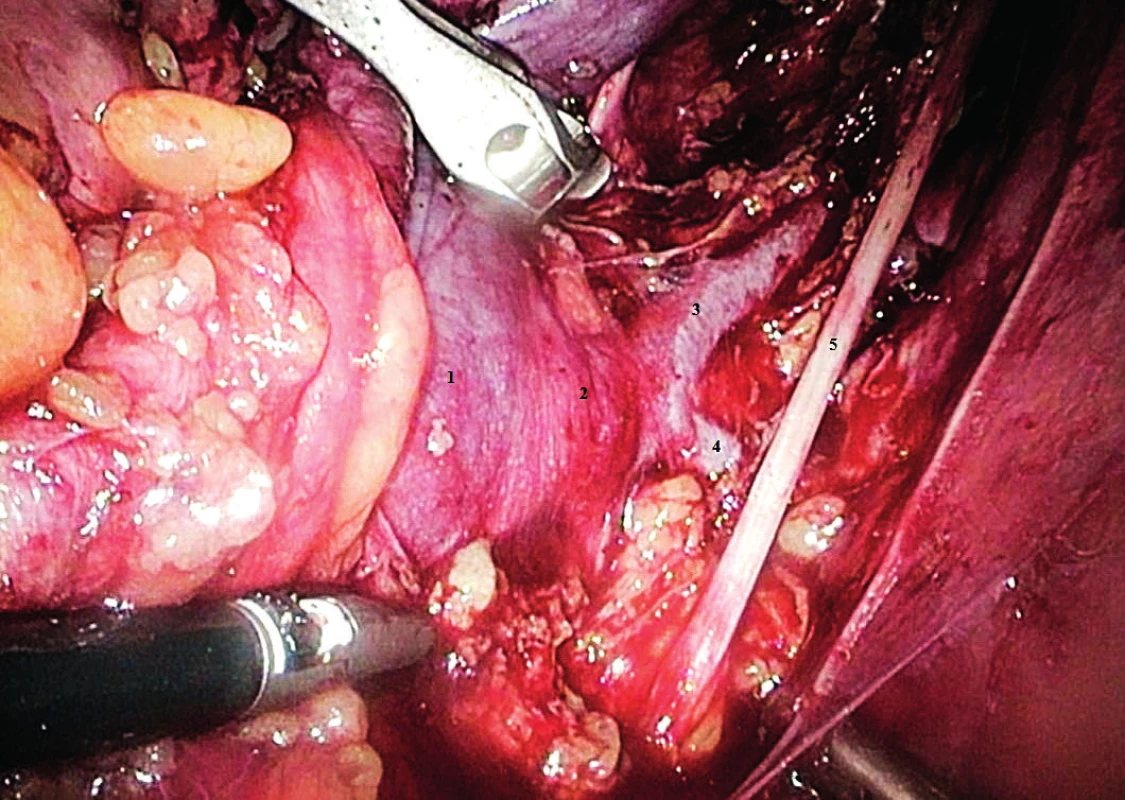
1 – bifurkace v. iliaca communis, 2 – odstup kmene v. iliaca interna, 3 – v. obturatoria, 4 – v. glutea superior, 5 – n. obturatorius Obr. 4. Presakrální oblast 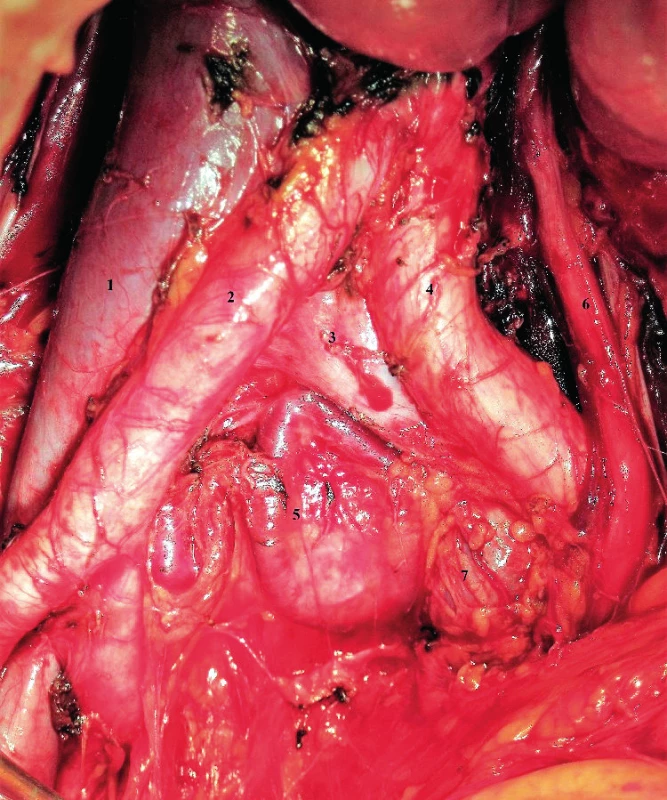
1 – v. iliaca communis dx., 2 – a. iliaca communis dx., 3 – v. iliaca communis sin., 4 – a. iliaca communis sin., 5 – v. sacralis mediana, 6 – ureter sin., 7 – lymphonodus Obr. 5. Duplicita vena iliaca communis vlevo 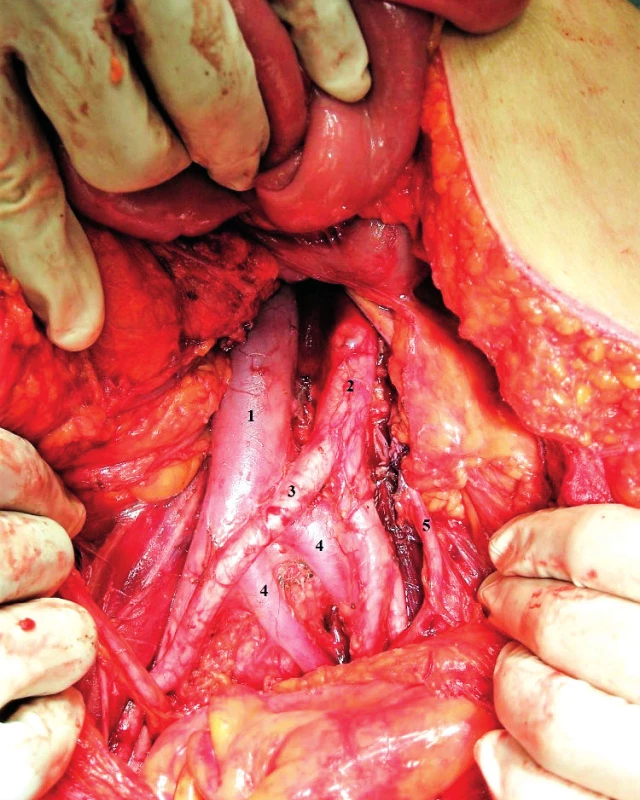
1 – v. cava inferior, 2 – aorta, 3 – a. iliaca communis dx., 4 – duplexní v. iliaca communis sin., 5 – ureter sin. Suprapelvická oblast
Oblast suprapelvické lymfadenektomie je ohraničena distálně bifurkací aorty a proximálně průběhem levostranné renální žíly. Tukově lymfatická tkáň by měla být disekována z oblasti preaortální, paraaortální a retroaortální, z identických lokalit kolem dolní duté žíly a z oblasti interaortokavální. Typická anatomie této oblasti v žilním řečišti je dána pravostranným průběhem vena cava inferior. Tato žíla má díky složitému embryonálnímu vývoji četné variety vyskytující se v asi 1,5–4,4% případů [17, 26]. Při lymfadenektomii této oblasti se tedy podstatně častěji vyskytuje možnost poranění infrarenálního úseku dolní duté žíly. Mezi velké žilní anomálie týkající se suprapelvické oblasti patří levostranná vena cava inferior [2, 12, 15] zpravidla ve spojení se situs viscerum inversus nebo duplikace dolní duté žíly, kdy žíla vede vpravo i vlevo od páteře [4, 24]. Odstupuje v tomto případě od spojení vena iliaca interna dextra s vena iliaca communis sinistra [3]. Její průměr může být prakticky stejný jako průměr fyziologicky vpravo uložené dolní duté žíly. V literatuře popisovanou anomálií je rovněž perzistence tzv. vena cavalis, která spojuje vena iliaca communis dextra a vena renalis dextra [11].
Další anomálie se týkají větví ústících do dolní duté žíly, zejména se jedná o anomální utváření a průběh ledvinných cév, zatímco ovariální cévy zpravidla zachovávají typickou anatomickou morfologii [7, 27]. Pravá ovariální žíla zpravidla ústí do dolní duté žíly přibližně šest až sedm centimetrů proximálně od jejího kořene a zpravidla jeden centimetr distálně od pravé renální žíly, vzácněji může také ústit přímo do pravé renální žíly. Levá ovariální žíla obvykle sleduje průběh levého ureteru a vlevo od aorty ústí do stejnostranné renální žíly. Obdobný průběh mají arteriální ovariální kmeny, pravý odstupuje z přední stěny aorty přibližně pět až šest cm nad bifurkací aorty, levý zpravidla z levé renální arterie (obr. 6). Při lymfadenektomii přerušujeme vždy pravostranný cévní svazek, který je možno celý disekovat v rámci ponechaného rezidua infundibulopelvického vazu po jeho přerušení při adnexektomii.
Obr. 6. Fyziologie infrarenální suprapelvické oblasti 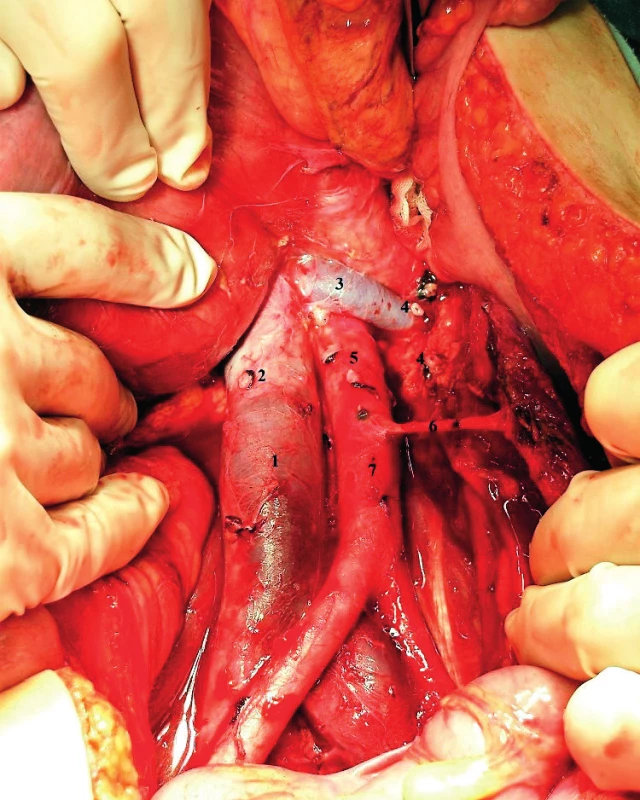
1 – v. cava inferior, 2 – ústí v. ovarica dx., 3 – v. renalis sin., 4 – pahýly v. ovarica sin., 5 – odstup a. ovarica dx., 6 – a. mesenterica inferior, 7 – aorta Rizikovou lokalitou z hlediska poranění je oblast kořene dolní duté žíly a úsek přibližně dva až tři cm proximálně s konstatně se vyskytujícími perforátory, tzv. fellow veins. Ty drénují tukově lymfatickou tkáň adherující k dolní duté žíle. V literárních zdrojích je možno najít práce popisující distribuci a strukturu těchto drobných žil ústících do přední stěny dolní duté žíly. Průměrný počet udávaných žil je 3,33 s rozdělením do tří úrovní, přičemž v úrovni I bylo nalezeno 20 % žil a v úrovních II a III bylo nalezeno 40 % drobných žil. Z hlediska morfologie je popisováno neobvyklé uspořádání cévní stěny dolní duté žíly, do které vstupují drobné žíly preformovaným rukávovitým kanálem a v níž jsou ukotveny v blízkosti jejího lumen. Tento poznatek je klíčovým mechanismem objasňujícím snadné vytržení těchto žil během operačních výkonů [26]. Ošetření těchto lézí zpravidla nečiní výraznější potíže, bodovou lézi lze často vyřešit pouhou kompresí horkou rouškou, v případě větší léze je nutný cílený opich, alternativou je přiložení hemostatického preparátu [25]. Zvýšené riziko traumatu žilní stěny je přítomno rovněž v případě metastatické lymfadenopatie doprovázené patologickou neovaskularizací a pevnou adhezí paketu na cévní stěnu (obr. 7).
Obr. 7. Inframezenterická oblast s exstirpovanou bulky metastázou 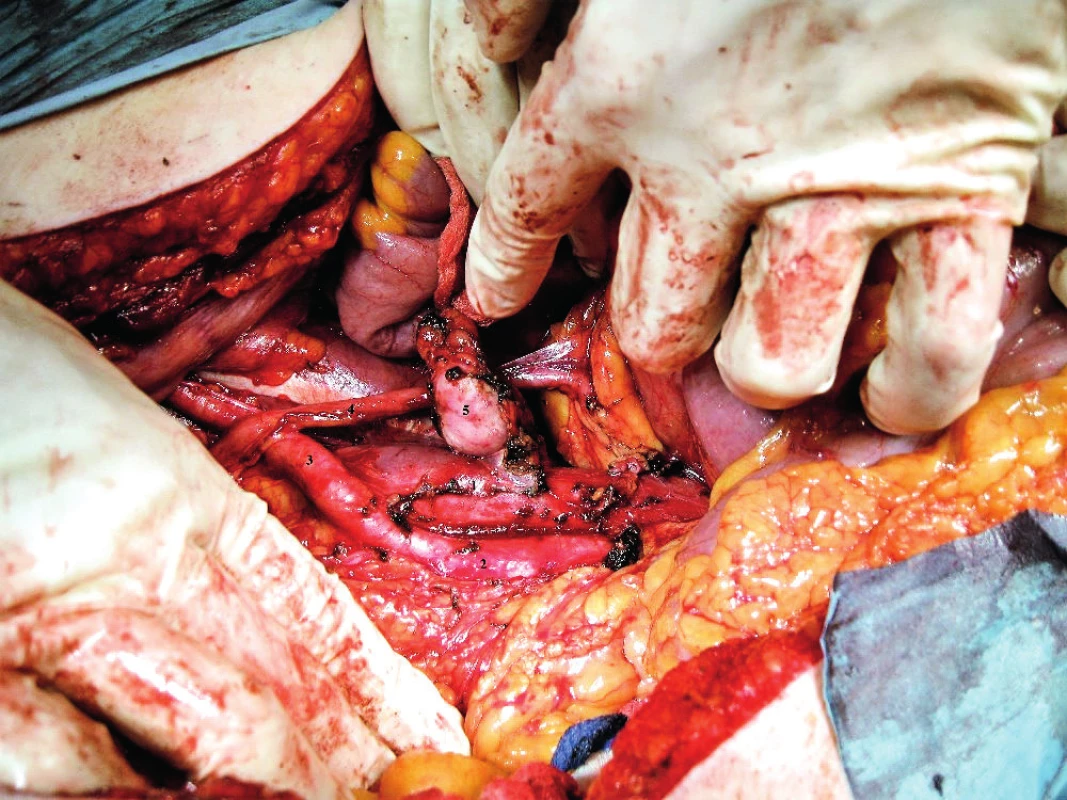
1 – v. cava inferior, 2 – aorta, 3 – a. iliaca communis dx., 4 – ureter dx., 5 – bulky uzlinová metastáza Ze zadní stěny aorty a dolní duté žíly vycházejí tři až čtyři páry lumbálních cév, proto disekce v retroprostoru obou magistrálních kmenů musí být prováděna s náležitou opatrností při znalosti této skutečnosti, stejně tak exstirpace hlubokých interartokaválních uzlin [5]. Probíhající lumbální cévy je možno preventivně koagulovat a přerušit, čímž snižujeme riziko disrupce cévní stěny na jiném místě při tahu za disekovanou tkáň. V případě poranění zadní cévní stěny je léze velmi obtížně dostupná, je nutné odsunutí a částečné přetočení cévní stěny za podmínky dostatečné mobilizace dolní duté žíly, v případě aorty se pro adekvátní naložení stehu neobejdeme bez aplikace cévních svorek nad místo poranění a pod něj při její současné dostatečné mobilizaci. Alternativou může být v případě poranění žilní stěny aplikace hemostatických preparátů obsahujících komponenty fibrinogenu a trombinu [25].
Při preparaci v oblasti preaortální je nutno věnovat pozornost odstupu arteria mesenterica inferior. Tento kmen odstupuje z přední stěny aorty tři až čtyři centimetry nad aortální bifurkací (obr. 8). Navazuje krevním zásobením na horní mezenterickou tepnu, přičemž anastomózou s arteria colica dextra vytváří tzv. anastomosis magna Haleri. Tepna přivádí krev prostřednictvím dalšího větvení pro zbytek colon transversum, pro colon descendens, sigma a jako arteria rectalis superior pro rektum, přičemž zde anastomózuje s párovou arteria rectalis media odstupující z arteria illiaca interna [7]. To umožňuje částečnou (ne však zcela dostačující) kompenzaci v případě obstrukce některé z předcházejících tepenných větví. V případě iatrogenního přerušení odstupu dolní mezenterické arterie je vždy nutno zvážit reimplantaci tepny cévním chirurgem.
Obr. 8. Fyziologie infrarenální suprapelvické oblasti (laparoskopický pohled) 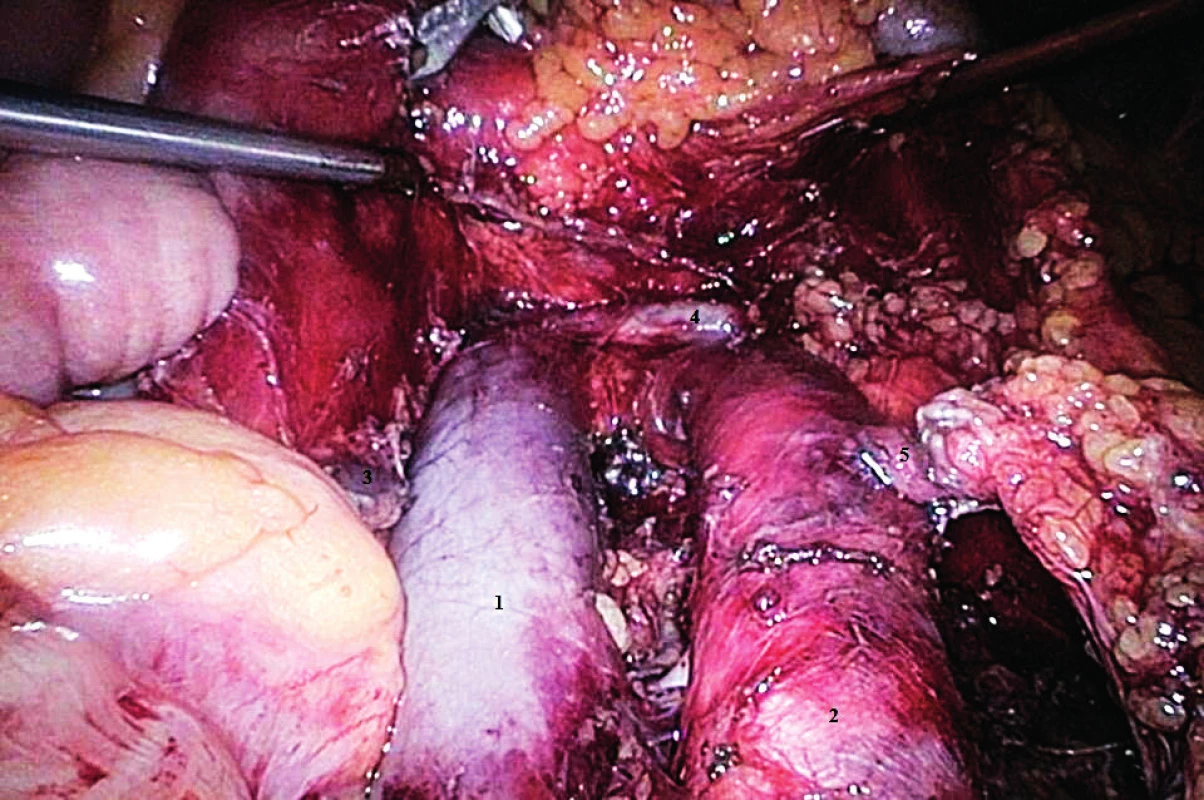
1 – v. cava inferior, 2 – aorta, 3 – v. ovarica dx., 4 – v. renalis sin., 5 – a. mesenterica inferior Hlavní úskalí s rizikem poranění žilních kmenů suprapelvicky se týká anomálního utváření odstupu renálních žil, zejména žíly levostranné [14, 16]. Typická anatomie je představována preaortálním průběhem levé renální žíly, která bývá v průměru dvojnásobné délky ve srovnání s pravou renální větví. Kaudálně žílu doplňuje tepenný kmen. Poměrně častou varietou je však retroaortální průběh levé renální vény, na nějž je nutno při preparaci kraniální hranice suprapelvické lymfadenektomie vždy myslet [22]. Retroaortální průběh může být doplněn i současnou žilní duplicitou (obr. 9), v tepenném systému se na úrovni dolního pólu ledviny objevuje odstup akcesorních renálních tepen, které mohou být při preparaci rovněž poraněny, zejména vpravo vzhledem k prekaválnímu průběhu (obr. 10). Poranění může rezultovat v ischemii části ledviny [8, 18].
Obr. 9. Duplicita levostranné vena renalis s retroaortálním soutokem 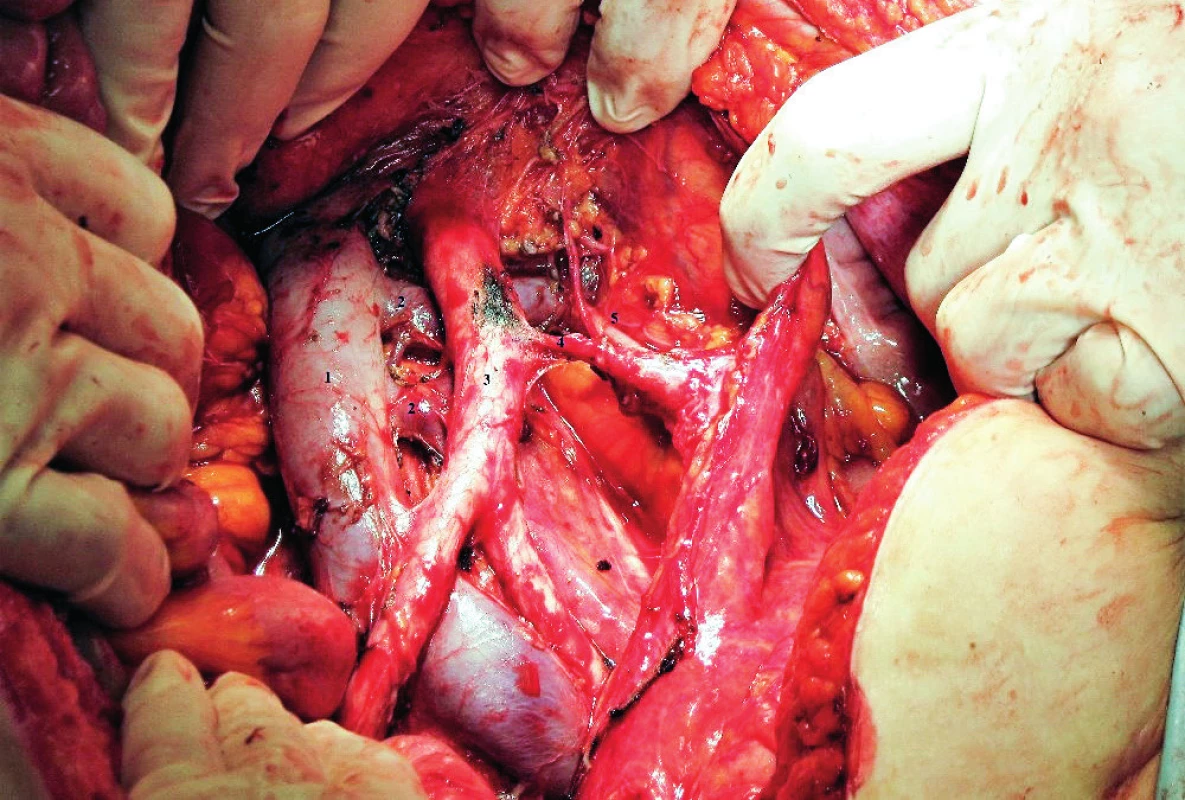
1 – v. cava inferior, 2 – v. renalis sin. duplex, 3 – aorta, 4. – a. mesenterica inferior, 5 – v. ovarica sin. Obr. 10. Akcesorní pravá pólová arteria renalis při současném retroaortálním průběhu levostranné vena renalis 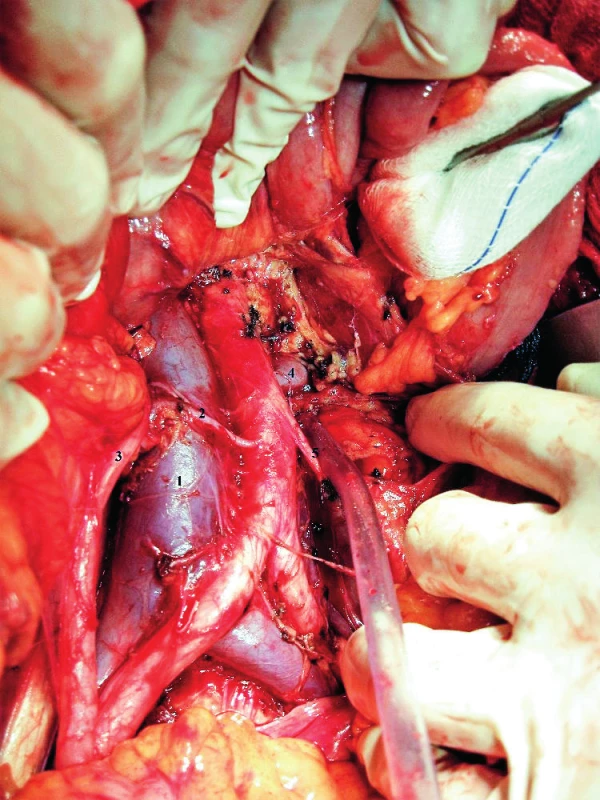
1 – v. cava inferior, 2 – a. renalis accesoria dx., 3 – ureter dx., 4 – v. renalis sin., 5 – a. mesenterica inferior Dalším komplikujícím faktorem vzhledem k možnosti poranění renálních cév je přítomnost ptózy ledvin, kdy odstup cév z aorty a dolní duté žíly může být lokalizován až pod úrovní dolní mezenterické arterie (obr. 11). Z tohoto důvodu je nutná znalost popisu zobrazovacích metod předoperačně, při laparotomickém operačním přístupu pak ještě ev. doplněná palpační kontrolou uložení ledvin před zahájením suprapelvické lymfadenektomie.
Obr. 11. Anatomie suprapelvické oblasti při ptóze pravé ledviny 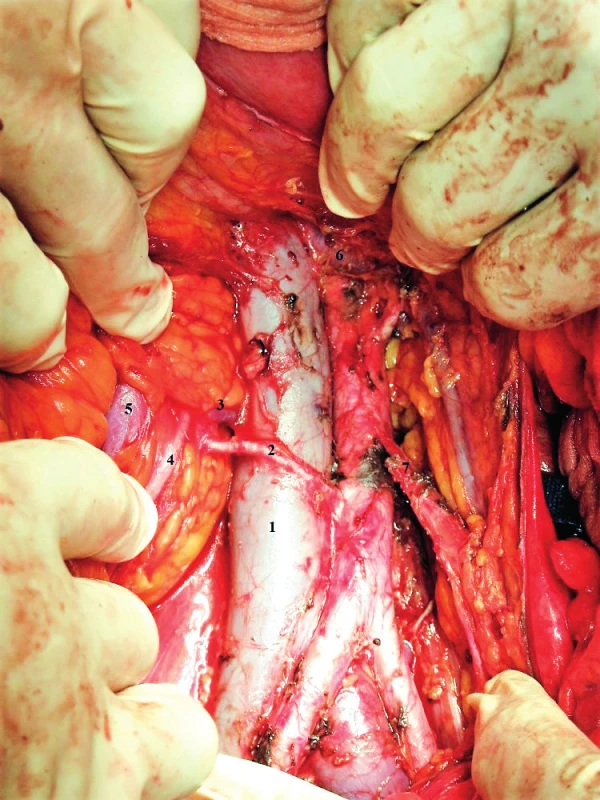
1 – v. cava inferior, 2 – a. renalis dx., 3 – v. renalis dx., 4 – ureter dx., 5 – ren dx., 6 – v. renalis sin., 7 – a. mesenterica inferior Poranění magistrálních tepen je méně časté. Komplikujícím faktorem kromě anomálií typu akcesorních ledvinných tepen však může být např. ateroskleróza objevující se u pacientek vyššího věku. Ta může být někdy příčinou poměrně výrazné deviace tepny od jejího klasického průběhu, rovněž je při manipulaci s cévou zvýšené riziko uvolnění sklerotických plátů (obr. 12).
Obr. 12. Deviace průběhu magistrálních tepen v souvislosti s aterosklerózou 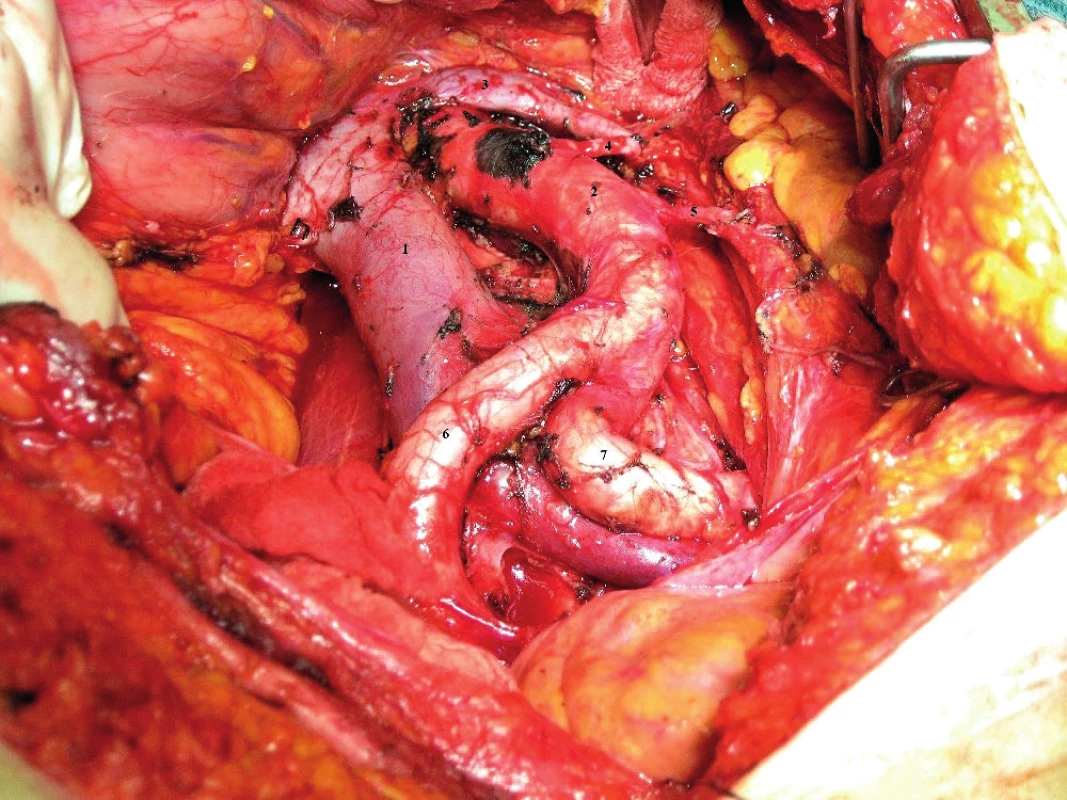
1 – v. cava inferior, 2 – aorta, 3 – v. renalis sin., 4 – a. renalis sin., 5 – a. mesenterica inferior, 6 – a. iliaca communis dx., 7 – a. iliaca communis sin. Subhepatální oblast
Při radikální onkogynekologické operativě diseminovaného karcinomu ovaria, vejcovodu nebo primárně peritoneálního karcinomu je základním cílem dosažení makroskopicky nulového rezidua, přičemž nádorová diseminace může být přítomna kdekoliv na peritoneálním povrchu nebo retroperitoneálně v oblasti celé pánve a dutiny břišní. Nezbytností je tedy rovněž orientace v oblasti horního břicha nad úrovní renálních cév a to se týká i oblasti retroperitonea [13]. Při kompletní peritonektomii včetně subhepatální krajiny při ev. doplnění cholecystektomie v rámci výkonu se tak dostáváme např. k anatomickému prostoru oblasti hepatoduodenálního ligamenta, které může být rovněž postiženo maligní lymfadenopatií. Jedná se o strukturu rozprostírající se mezi játry a duodenem a kromě četných lymfatik majících význam v nádorové diseminaci obsahuje žlučovod, vlákna nervus vagus a důležité cévní struktury, tj. jaterní tepnu a portální žílu (obr. 13) [7].
Obr. 13. Anatomie subhepatálního retroperitonea 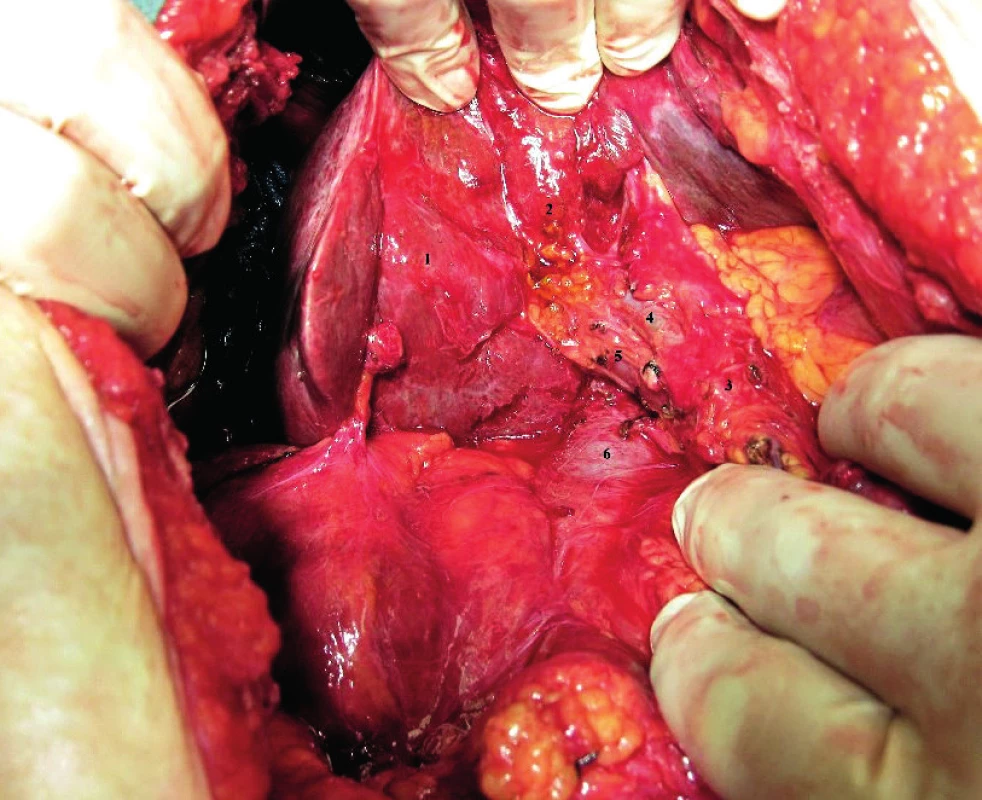
1 – hepar, 2 – lůžko po cholecystektomii, 3 – lig. hepatoduodenale, 4 – ductus choledochus, 5 – v. portae, 6 – v. cava inferior Možnosti řešení cévní léze z pohledu onkogynekologa
Zvládnutá technika operačních výkonů na základě dokonalé znalosti anatomie je základní prevencí vzniku možných komplikací. Cílem je udržet maximální přehlednost operačního pole s vyvarováním se iatrogenního poranění a pečlivou zástavou krvácení v průběhu operace. Při laparotomickém přístupu je neocenitelný i vlastní palpační vjem, při laparoskopii je důležitým pomocníkem rovněž tlak vytvořeného kapnoperitonea „napomáhající“ disekci tkání. V případě vzniku léze je nutná okamžitá orientace v možnostech řešení vzniklého krvácení podle rozsahu a typu poranění cévních struktur. Při žilním poranění při laparotomickém přístupu přichází v úvahu komprese horkou rouškou, užití bipolární koagulace, opich monofilamentózním prolenovým stehem nebo zajištění lokální hemostázy pomocí preparátů s obsahem fibrinogenu a trombinu [25], u arteriálních poranění zpravidla vystačíme s koagulací a případnou pojistnou ligaturou jen v případě poranění nástěnných drobných větví, v ostatních případech je nutný opich, někdy i s užitím cévních svorek umožňujících přechodnou lokální kontrolu krvácení a přípravu operačního pole pro suturu léze. Při laparoskopickém přístupu je hlavní zásadou šetrná disekce s udržením „nekrvavého“ operačního pole. V případě vzniknuvšího poranění je nutno zvážit podle okolností schopnost ošetření léze laparoskopickým přístupem nebo přistoupit ke konverzi v laparotomii. Při laparoskopii dominuje použití bipolární koagulace, je možná komprese pomocí tamponu a lokální hemostáza pomocí „předrolovaných“ hemostatických preparátů [25] s možnou inzercí do dutiny peritoneální cestou laparoskopického portu. V případě adekvátní erudice v laparoskopické sutuře je při příznivých anatomických podmínkách možné i řešení endoskopické se zachycením místa léze určeného k sutuře pomocí atraumatického úchopového instrumentu, ev. i s využitím cévních svorek (např. při lézi v oblasti externích ilických cév).
ZÁVĚR
Dokonalá znalost anatomie retroperitoneálních prostor majících vztah k možné diseminaci gynekologických malignit je základním předpokladem pro rozvoj operační erudice onkogynekologa. Cévní struktury jsou přitom jedním ze základních vodicích bodů pro orientaci v operačním poli a jejich rutinní znalost vytváří předpoklad pro suficientní rozsah radikální operace. Velice důležité je rovněž povědomí o přítomnosti možných cévních abnormit, které se mohou stát zdrojem závažných peroperačních i pooperačních komplikací. Rovněž je nutné se zaměřit na rozvoj erudice v řešení těch komplikací, které forenzně nevyžadují intervenci cévní nebo jiné chirurgické subspecializace.
Práce vznikla za podpory MZ ČR – RVO (FNBr, 65269705).
as. MUDr. Luboš Minář, Ph.D.
vedoucí Onkogynekologického centra FN Brno
Gynekologicko-porodnická klinika
LF MU a FN
Obilní trh 11
602 00 Brno
e-mail: lubosminar@seznam.cz
Zdroje
1. Aletti, GD., Powless, C., Bakkum-Gamez, J., et al. Pattern of retroperitoneal dissemination of primary peritoneum cancer: basis for rational use of lymphadenectomy. Gynecol Oncol, 2009, 114, 1, p. 32–36.
2. Allen, C., Sauerland, E., Sievert C, Bardin J. Left-sided inferior vena cava. J Vasc Surg Venous Lymphat Disord, 2014, 2, 2, p. 206.
3. Aljabri, B., MacDonald, PS., Satin, R., et al. Incidence of major venous and renal anomalies relevant to aortoiliac surgery as demonstrated by computed tomography. Ann Vasc Surg, 2001, 15, 6, p. 615–618.
4. Babu, CS., Lalwani, R., Kumar, I. Right double inferior vena cava with preaortic iliac confluence – case report and review of literature. J Clin Diagn Res, 2014, 8, 2, p. 130–132.
5. Bubb, K., du Plessis, M., Hage, R., et al. The internal anatomy of the inferior vena cava with specific emphasis on the entrance of the renal, gonadal and lumbar veins. Surg Radiol Anat, 2016, 38, 1, p. 107–114.
6. Cibula, D., Abu-Rustum, NR., Benedetti-Panici, P., et al. New classification system of radical hysterectomy: emphasis on a three-dimensional anatomic template for parametrial resection. Gynecol Oncol, 2011, 122, 2, p. 264–268.
7. Čihák, R. Anatomie. 3. ed. Praha: Grada Publishing, 2016, 832 s.
8. Eitan, R., Abu-Rustum, NR., Walker, JL., Barakat, RR. Ligation of an anatomic variant of renal vasculature during laparoscopic periaortic lymph node dissection: a cause of postoperative renal infarction. Gynecol Oncol, 2003, 91, 2, p. 416–420.
9. Fotopoulou, C., El-Balat, A., du Bois, A., et al. Systematic pelvic and paraaortic lymphadenectomy in early high-risk or advanced endometrial cancer. Arch Gynecol Obstet, 2015, 292, 6, p. 1321–1327.
10. Gyimadu, A., Salman, MC., Karcaaltincaba, M., Yuce, K. Retroperitoneal vascular aberrations increase the risk of vascular injury during lymphadenectomy in gynecologic cancers. Arch Gynecol Obstet, 2012, 286, 2, p. 449–455.
11. Honma, S., Tokiyoshi, A., Kawai, K., et al. Preureteric inferior vena cava with possible rudiment of the proper inferior vena cava. Ann Anat, 2007, 189, 2, p. 191–195.
12. Chang, SJ., Ryu, HS. Laparoscopic para-aortic lymphadenectomy in endometrial cancer patient with left-sided inferior vena cava. Gynecol Oncol, 2012, 126, 1, p. 147–148.
13. Chiva, LM., Castellanos, T., Alonso, S., Gonzalez-Martin, A. Minimal macroscopic residual disease (0.1–1 cm). Is it still a surgical goal in advanced ovarian cancer? Int J Gynecol Cancer, 2016, 26, 5, p. 906–911.
14. Christison-Lagay, ER., Fishman, SJ. Vascular anomalies. Surg Clin North Am, 2006, 86, 2, p. 393–425.
15. Khamanarong, K., Woraputtaporn, W., Teerakul, S., et al. Left sided inferior vena cava: a case report. J Med Assoc Thai, 2010, 93, 8, p. 998–1000.
16. Klemm, P., Fröber, R., Köhler, C., Schneider, A. Vascular anomalies in the paraaortic region diagnosed by laparoscopy in patients with gynaecologic malignancies. Gynecol Oncol, 2005, 96, 2, p. 278–282.
17. Kose, MF., Turan, T., Karasu, Y., et al. Anomalies of major retroperitoneal vascular structure. Int J Gynecol Cancer, 2011, 21, 7, p. 1312–1319.
18. Lee, YS., Lee, JH., Choi, JS., et al. Accessory polar renal artery encountered in transperitoneal systemic laparoscopic paraaortic lymphadenectomy. Eur J Gynaecol Oncol, 2011, 32, 1, p. 87–90.
19. Li, J., Wu, X. Current strategy for the treatment of ovarian germ cell tumors: role of extensive surgery. Curr Treat Options Oncol, 2016, 17, 8, p. 44.
20. Oderich, GS., Panneton, JM., Hofer, J., et al. Iatrogenic operative injuries of abdominal and pelvic veins: a potentially lethal complication. J Vasc Surg, 2004, 39, 5, p. 931–936.
21. O‘Hanlan, KA. Comprehensive, therapeutic retroperitoneal pelvic and infrarenal aortic lymphadenectomy for advanced cervical carcinoma. Gynecol Oncol, 2013,130, 3, p. 634–635.
22. Shindo S., Kubota K., Kojima A., et al. Anomalies of inferior vena cava and left renal vein: risks in aortic surgery. Ann Vasc Surg, 2000, 14, 4, p. 393–396.
23. Sláma, J., Kocián, R. Technika pánevní a paraaortální lymfadenektomie. Čes Gynek, 2016, 81, 4, s. 253–264.
24. Strauss, A., Kuehnle, E., Hilpert, F., et al. Double inferior vena cava: a crucial finding complicating para-aortic lymphadenectomy. Eur J Obstet Gynecol Reprod Biol, 2011, 154, 2, p. 228–229.
25. Takagi, T., Tsujimoto, H., Torii, H., et al. Two-layer sheet of gelatin: A new topical hemostatic agent. Asian J Surg, 2016, Nov 2, pii: S1015-9584(16)30118-X.
26. Turyna, R., Kachlik, D., Kucera, E., et al. Complications inright-sided paraaortic lymphadenectomy: ventral tributaries of the inferior vena cava. J Anat, 2013, 223, 1, p. 69–73.
27. Uflacker, R. Atlas of vascular anatomy: an angiographic approach. Philadelphia: Lippincott Williams & Wilkins, 2007, 905 p.
28. Zivanovic, O., Sheinfeld, J., Abu-Rustum, NR. Retroperitoneal lymph node dissection. Gynecol Oncol, 2008, 111(2 Suppl), p. S66–69.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Ultrazvuková diagnostika syndromu fetální zánětlivé odpovědi u žen s předčasným odtokem plodové vodyČlánek Jsou nutné změny v regulaci přístupu žen bez partnera a homosexuálních osob k asistované reprodukci?Článek Abdominální těhotenství u pacientky po císařském řezu, oboustranné salpingektomii a embryotransferuČlánek Inverze dělohy
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2017 Číslo 2- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Cévní anatomie aortopelvického retroperitonea a její abnormality v souvislosti s radikální onkogynekologickou operativou – vlastní zkušenosti
- Těhotenství a porod žen s idiopatickými střevními záněty
- INFORMACE PRO LÉKAŘE VE SPECIALIZAČNÍ PŘÍPRAVĚ
- Trojčetné těhotenství se smíšenou chorionicitou po léčbě IVF: je fetoredukce vhodná?
- Abdominální těhotenství u pacientky po císařském řezu, oboustranné salpingektomii a embryotransferu
- Karcinoid apendixu v těhotenství
- Český překlad a validace dotazníku kvality pohlavního života u žen s prolapsem pánevních orgánů či inkontinencí moči nebo stolice – PISQ-IR
- Inverze dělohy
- Ultrazvuková diagnostika syndromu fetální zánětlivé odpovědi u žen s předčasným odtokem plodové vody
- Současné využití technik v diagnostice recidivujícího vulvovaginálního dyskomfortu
- Jsou nutné změny v regulaci přístupu žen bez partnera a homosexuálních osob k asistované reprodukci?
-
Spontánní předčasný porod
Doporučený postup -
Předčasný odtok plodové vody před termínem porodu
Doporučený postup -
Intrahepatální cholestáza v těhotenství
Doporučený postup - Doc. MUDr. Věra Rokytová, CSc.
- Osobní vzpomínka na prof. MUDr. Jiřího Skřivana, DrSc., k jeho nedožitým 90. narozeninám
- Zemřel doc. MUDr. Karel Janků, CSc.
-
Profesor MUDr. Jan Hořejší, DrSc.
6. 5. 1940 – 18. 11. 2016 - Vliv pooperačního podání oktreotidu na redukci lymforey a následně vzniku lymfocyst, lymfedému a lymfatického ascitu po lymfadenektomii u gynekologických malignit
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Intrahepatální cholestáza v těhotenství
Doporučený postup -
Spontánní předčasný porod
Doporučený postup - Inverze dělohy
-
Předčasný odtok plodové vody před termínem porodu
Doporučený postup
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



