-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Role hormonální terapie u pacientek s karcinomem děložního těla
The role of hormonal therapy in patients with uterine carcinoma
Objective: The aim of the study was to describe the role of hormonal therapy in the treatment of malignant uterine tumors, indications, the effect of the treatment and to verify its safety in our study cohort. We also present an overview of recent studies on that topic.
Design: Unicentric retrospective observational study and review of recent literature.
Setting: Department of Obstetrics and Gynecology, Masaryk University, University Hospital Brno.
Methods: The results of recent relevant studies and reviews published in English until December 2017 were used for the review. The publications were searched using the PubMed server. All patients diagnosed in our oncogynecological center between 2010 and 2016 and who were treated hormonally – either in primary therapy or in relapse settings, were included in our study. We were interested in age, BMI, stage of disease, histological type and grade of tumor, occurrence of adverse effects, duration of survival, reasons for choosing hormonal therapy. Medroxyprogesterone-acetate or megestrol-acetate was used in the treatment.
Results: Between 2010 and 2016, 415 malignant tumors of the uterus were diagnosed in our oncology center. Recurrence of the disease occurred in 31 patients (8%), on average 16 months after primary treatment. Primary hormonal therapy was used in only 19 patients (5%), mostly because of contraindications of another treatment due to high age, comorbidities or obesity. Median age of patients was 83 years, mean BMI 41, median survival of patients who died was 8 months. Five patients (16%) were treated hormonally for the recurrence. Median survival from diagnosis of recurrence was 20 months. One patient (4%) experienced partial pulmonary embolism.
Conclusion: Hormonal therapy plays an irreplaceable role in uterine cancer patients, especially in primary non-operable patients, in treatment of a relapse, or in a fertility-sparing procedure. This treatment option is safe, with minimal adverse effects.
Keywords: endometrial carcinoma, hormone therapy, medroxyprogesterone-acetate, megestrol-acetate, palliative therapy, fertility-sparing treatment
Autoři: Petra Bretová 1
; Luboš Minář 1
; Michal Felsinger 1
; Matěj Anton 1
; P. Ventruba 1; Markéta Bednaříková 2
; J. Hausnerová 3; E. Jandáková 3; M. Číhalová 3; Vít Weinberger 1
Působiště autorů: Gynekologicko-porodnická klinika LF MU a FN, Brno, npřednosta prof. MUDr. P. Ventruba, DrSc., MBA 1; Interní hematologická a onkologická klinika LF MU a FN, Brno, přednosta prof. MUDr. J. Mayer, CSc. 2; Ústav patologie LF MU a FN, Brno, přednosta doc. MUDr. L. Křen, Ph. D. 3
Vyšlo v časopise: Ceska Gynekol 2018; 83(4): 263-270
Kategorie: Retrospektivní studie a přehled
Souhrn
Cíl studie: Záměrem práce bylo popsat roli hormonální terapie v léčbě zhoubných nádorů děložního těla, indikace, efekt léčby a ověřit její bezpečnost na vlastním souboru pacientek. Rovněž prezentujeme přehled recentních studií na dané téma.
Typ studie: Unicentrická retrospektivní observační studie a přehled recentní světové literatury.
Název a sídlo pracoviště: Gynekologicko-porodnická klinika LF MU a FN Brno.
Metodika: Pro přehledovou část byly použity výsledky relevantních studií a review publikovaných v anglickém jazyce do prosince roku 2017. Publikace byly vyhledány pomocí serveru PubMed. Do vlastní studie byly zařazeny všechny pacientky diagnostikované v našem onkogynekologickém centru v letech 2010 až 2016, které byly léčeny hormonálně – ať už v rámci primární terapie, nebo při léčbě recidivy. Sledovali jsme věk, BMI, stadium onemocnění, histologický typ a grade nádoru, výskyt nežádoucích účinků, délku přežití, důvody ke zvolení hormonální terapie. V léčbě byl použit medroxyprogesteron-acetát nebo megestrol-acetát.
Výsledky: V letech 2010 až 2016 bylo v našem onkologickém centru diagnostikováno 415 zhoubných nádorů děložního těla. Recidiva onemocnění se vyskytla u 31 pacientek (8 %), průměrně za 16 měsíců od primární léčby.
Primární hormonální terapie byla nasazena pouze u 19 pacientek (5 %), nejčastěji pro kontraindikaci jiné varianty léčby z důvodu vysokého věku, komorbidit či obezity. Medián věku pacientek byl 83 let, průměrné BMI 41, medián přežití zemřelých pacientek osm měsíců. Pro recidivu bylo pět pacientek (16 %) léčeno hormonálně. Medián přežití od diagnózy recidivy byl 20 měsíců. U jedné pacientky (4 %) se vyskytla parciální plicní embolie.
Závěr: Hormonální terapie u nádorů děložního těla má svou nezastupitelnou roli především u primárně inoperabilních pacientek, v léčbě recidivy, případně v rámci fertilitu šetřícího postupu. Jedná se o léčbu bezpečnou, s minimem nežádoucích účinků.
Klíčová slova: karcinom endometria, hormonální terapie, medroxyprogesteron-acetát, megestrol-acetát, paliativní terapie, fertilitu šetřící léčba
ÚVOD
Zhoubný nádor dělohy je po karcinomu prsu nejčastější gynekologickou malignitou v České republice vykazující incidenci 36 na 100 000 žen/rok. Obvykle je diagnostikován ve věkové skupině žen 65–69 let [7]. U většiny pacientek je onemocnění zachyceno v počátečních stadiích s vynikající prognózou pětiletého přežití kolem 80 %. U jedné pětiny pacientek je v době stanovení diagnózy přítomné lokální šíření tumoru do okolních struktur, postižení lymfatických uzlin a/nebo vzdálené metastázy. V takových případech dosahuje pětiletého přežití pouze 15–50 % pacientek [4, 21]. Chirurgie je zásadní modalitou léčby u časných i pokročilých stadií, u kterých pak hrají důležitou roli i chemoterapie a radioterapie [1]. Hormonální terapie je alternativou pro ženy žádající zachovat fertilitu nebo pro ty, kterým jejich zdravotní stav neumožňuje podstoupit jinak plánovanou operaci. Recidiva onemocnění je s výhodou opět léčena primárně chirurgicky [1]. Rozsáhlá chirurgicky neodstranitelná ložiska mohou být léčena chemoterapií nebo hormonální terapií [1]. V případě rekurentního tumoru u pacientky, která nebyla dříve léčena chemoterapií, dosahuje odpověď na léčbu 57 %, naopak u předléčených pacientek zaznamenáváme odpověď na chemoterapii jen u 20 % z nich. Neurotoxické účinky chemoterapie se objevují až u 40 % pacientek [13, 25]. Odpověď na hormonální léčbu se udává v rozmezí 20–40 % se závažnými vedlejšími účinky (plicní embolie, infarkt myokardu) u méně než 5 % pacientek [5, 9].
Cílem našeho článku je poskytnout aktuální přehled užití hormonální terapie u karcinomu děložního těla, identifikovat indikace, popsat její bezpečnost a upozornit na stálé místo této léčebné modality v současné době vyznačující se snahou o maximální individualizaci onkologické léčby. Zároveň prezentujeme vlastní soubor a výsledky pacientek léčených v našem onkogynekologickém centru hormonálními preparáty jak pro primární záchyt, tak pro recidivu onemocnění.
METODIKA A SOUBOR PACIENTEK
Jedná se o přehledový článek světové literatury doplněný o vlastní soubor pacientek. Pro přehledový článek byly použity výsledky relevantních studií a přehledových článků publikovaných v anglickém jazyce do prosince roku 2017. Tyto publikace byly vyhledány pomocí serveru PubMed za použití klíčových slov: „hormon/hormonal therapy/treatment“, „endometrial cancer/carcinoma“, „fertility-sparing therapy/treatment“, „ER/PR“.
Do vlastní studie byly zařazeny retrospektivně všechny pacientky s karcinomem dělohy s pozitivní expresí estrogenních a progesteronových receptorů (ER/PR), které byly diagnostikovány a hormonálně léčeny v našem centru v letech 2010 až 2016. Pacientky byly rozděleny do dvou skupin. V první skupině obdržely hormonální terapii jako primární léčbu a ve druhé skupině byly pacientky léčené pro recidivu onemocnění. V první skupině jsme sledovali věk pacientek v době diagnózy, BMI, stadium onemocnění podle předoperačních vyšetření dle klasifikace FIGO (International Federation of Gynecology and Obstetrics) z roku 2009, histologický typ a grade nádoru. Dále nás zajímaly důvody k indikaci hormonální terapie, medián přežití, výskyt nežádoucích účinků. Ve druhé skupině jsme sledovali medián přežití pacientek s recidivou karcinomu dělohy léčenou pouze hormonální terapií. Pozitivitu hormonálních receptorů jsme znovu nestanovovali, ale vycházeli z původního histologického vzorku, který byl případně dotestován na přítomnost ER/PR. U obou skupin byl použit medroxyprogesteron-acetát (Provera) v dávce 500 mg nebo megestrol-acetát (Megace) v dávce 320 mg denně.
V rámci následné dispenzarizace byly pacientky sledovány v našem Centru onkologické prevence. V prvních dvou letech probíhaly kontroly každé tři až čtyři měsíce, poté kontroly po šesti měsících, v případě obtíží přišla pacientka na vyšetření mimo stanovený interval. Recidiva byla stanovena na základě objektivního vyšetření a zobrazovacích metod – ultrazvukem nebo pomocí počítačové tomografie, kde byla léze popsána podle kritérií RECIST (Response Evaluation Criteria In Solid Tumors). Všechny pacientky podepsaly informovaný souhlas s hormonální léčbou. Veškerá klinická data byla shrnuta a vyjádřena pomocí absolutních a relativních četností výskytu, v případě spojitých dat pak pomocí mediánu nebo průměru. Vzhledem k malému souboru pacientek je naše studie pouze popisná, statistické srovnání nebylo provedeno.
PŘEHLED INDIKACÍ HORMONÁLNÍ TERAPIE U KARCINOMU DĚLOŽNÍHO TĚLA
Role hormonoterapie ve fertilitu zachovávajícím postupu
Více než 90 % případů nádorů děložního těla je diagnostikováno postmenopauzálně, nicméně existuje i malé procento pacientek, které onemocní v reprodukčním věku a které si přejí zachovat možnost otěhotnění [22]. Představují zvláštní skupinu s dobrou prognózou, vzhledem k mladšímu věku a obvykle málo pokročilému nálezu. Jediným možným způsobem, jak zachovat fertilitu ve smyslu ponechání dělohy i vaječníků je nasazení hormonální léčby. Mezi nejčastěji používané preparáty patří perorální gestageny a IUS (intrauterinní systém) s levonorgestrelem (Mirena), případně analoga GnRH (gonadotropine-releasing hormone) [19, 26, 28, 29]. Další léčebné modality (inhibitory aromatáz, selektivní estrogenové modulátory, perorální kontraceptiva) vykazovaly v minulosti menší úspěšnost léčby a nové relevantní studie nebyly v posledních letech publikovány [38].
Nejčastěji je tento postup zvažován u pacientek s dobře diferencovaným karcinomem bez invaze do myometria podle MRI nebo expertního UZ [30], který má jasně daná pravidla pro popis nálezu [14]. V případě perorálních gestagenů je doporučován medroxyprogesteron-acetát v dávce 400–600 mg nebo megestrol-acetát 160–320 mg denně [30]. Délka léčby není pevně stanovena a vykazuje široké rozmezí tří až 36 měsíců podle zvyklostí pracoviště, s mediánem šest měsíců [10, 17]. Odpověď na léčbu se u těchto pacientek pohybuje podle nejnovějších studií mezi 67 až 87 % a recidiva onemocnění se vyskytuje u 6–30 % případů (1) [6, 10, 16, 26]. Největší studii publikovali v roce 2013 Park et al., kde ve skupině 148 pacientek s dobře diferencovaným endometroidními karcinomem stadia FIGO IA bez invaze do myometria bylo dosaženo remise onemocnění u 78 % pacientek, recidiva se pak vyskytla u 30 % z nich [26]. Léčba pomocí Mireny může být doplněna perorálními gestageny nebo analogem GnRH a vykazuje srovnatelné výsledky. Pronin et al. publikovali v roce 2015 soubor 32 pacientek léčených IUS s levonorgestrelem doplněným o perorální GnRH, u kterých bylo dosaženo kompletní odpovědi na léčbu v 72 % případů [29]. V menší prospektivní studii (Kim et al., 2013), dosáhlo remise onemocnění dokonce 14 z 16 pacientek (88 %) léčených IUS s levonorgestrelem v kombinaci s medroxyprogesteron-acetátem [15].
Byly publikovány studie do velikosti pouze několika desítek pacientek, kterým byla nasazena hormonoterapie pro karcinom děložního těla s prokázanou invazí do myometria stadia FIGO IA bez ohledu na diferenciaci tumoru. Dosud největší studii publikovali opět Park et al. v roce 2013, kam bylo retrospektivně zařazeno 48 pacientek s karcinomem grade 2–3 bez invaze do myometria, grade 1 s povrchovou invazí a karcinomy grade 2–3 s povrchovou invazí myometria. Odpověď na léčbu byla v těchto skupinách srovnatelná (74–88 %), ale výrazně se lišilo procento recidiv (23 % vs. 47 % vs. 71 %) [27]. Autoři studie doporučují zvážit hormonální terapii u pacientek vyžadujících fertilitu šetřící postup s karcinomem omezeným na endometrium nehledě na jeho diferenciaci, nicméně ke standardizaci takového doporučení je potřeba dalších studií potvrzujících bezpečnost této praxe.
Každá pacientka by měla být sledována v tříměsíčních intervalech, včetně transvaginálního ultrazvuku nebo MRI. Po šesti měsících terapie je doporučeno zopakovat biopsii endometria k histologickému vyšetření pomocí hysteroskopie a v případě neuspokojivé odpovědi pak zvolit standardní chirurgickou léčbu [3, 27]. V případě dosažení remise a bez podezření na recidivu onemocnění nejsou další konsekutivní biopsie endometria doporučovány z důvodu rizika vzniku Ashermanova syndromu, který by zásadně negativně ovlivnil možnost otěhotnění [20]. Po dosažení remise onemocnění je doporučeno co nejdříve naplnit reprodukční přání ženy, s výhodou za pomoci metod asistované reprodukce [26]. Při recidivě onemocnění a přetrvávající touze pacientky po zachování fertility lze uvažovat i o dalším pokusu o léčbu hormony. Dosavadní publikované výsledky jsou srovnatelné s primárním fertilitu šetřícím postupem, avšak největší z těchto studií (Park et al., 2013) zahrnovala pouhých 33 pacientek [28].
Primární hormonální léčba časného karcinomu
Standardním postupem u pacientek s časným karcinomem endometria v menopauze je operační léčba. Nicméně právě rizikové faktory vzniku tohoto nádoru (např. obezita, cukrovka, hypertenze) jsou často shodné s rizikovými faktory vysoké pooperační morbidity a mortality a u určité vysoce rizikové skupiny žen je operace z těchto důvodů kontraindikovaná. Pro tyto pacientky je hormonální léčba vhodnou a bezpečnější alternativou než toxická chemoterapie či radioterapie. Větší studie zaměřené na léčbu časného karcinomu endometria v postmenopauze pomocí gestagenů ovšem dosud nebyly publikovány, vždy se jednalo o studie maximálně o několika desítkách pacientek [2, 19]. Obecně dobře tolerována je Mirena. Největší studii publikovali v roce 2017 Baker et al. Bylo do ní zařazeno 41 pacientek s atypickou hyperplazií nebo časným karcinomem endometria. Kompletní odpověď na léčbu byla zaznamenána u 50 %, progrese onemocnění u 19 % a recidiva u 22 % pacientek [2]. Autoři studie doporučují pravidelné kontroly včetně biopsie endometria i u asymptomatických žen, jelikož absence krvácení je pro léčbu Mirenou typická a riziko recidivy poměrně vysoké.
Hormonální terapie pokročilého karcinomu endometria a recidivy
Mezi nejčastěji užívané preparáty v léčbě pokročilého a recidivujícího karcinomu endometria patří perorální gestageny – medroxyprogesteron-acetát a megestrol-acetát v dávkách 200–600 mg, respektive 160–320 mg/den. Od roku 2016 pak platí doporučení užití dávek 200 mg, respektive 160 mg [3]. Vyšší dávky gestagenů nepřinášejí lepší efekt léčby, pouze zvyšují riziko nežádoucích účinků [34]. Odpověď na terapii se udává v širokém rozmezí 11–56 % (tab. 2), ale je velmi závislá na stupni diferenciace nádoru a také na přítomnosti ER/PR [5]. Největší studii se souborem 299 pacientek publikovali již v roce 1999 Thigpen et al. a demonstrovali kompletní odpověď na léčbu u 37 % karcinomů grade I, 23 % grade II a u pouhých 9 % grade III [34]. Rozdíl v úspěšnosti léčby při pozitivitě a negativitě hormonálních receptorů byl taktéž značný (25–37 % vs. 7–8 %). Pozitivita hormonálních receptorů se může mezi primárním nádorem a recidivou lišit, a proto je jednoznačně doporučeno před zahájením hormonální léčby stanovit přítomnost receptorů z recidivy [2, 5, 34]. Tangen et al. publikovali v roce 2014 prospektivní studii zahrnující 686 nádorů endometria a 178 metastatických lézí. Při progresi onemocnění došlo u 23 % případů ke ztrátě pozitivity hormonálních receptorů a v případě metastáz dokonce u 76 % [33]. Srovnatelnou účinnost jako užívané perorální gestageny má také jejich kombinace s antiestrogeny (tamoxifen) [10]. Monoterapie tamoxifenem ovšem stejně jako terapie některými inhibitory aromatáz (letrozol, anastrozol) dosahovala v minulosti klinického účinku maximálně u 10 % pacientek [24, 31, 35], stejně neuspokojivých výsledků pak bylo dosaženo při nověji publikovaném klinickém testování jiného inhibitoru aromatáz (exemestane) [23] nebo fulvestrantu [7].
Tab. 1. Hormonální léčba karcinomu endometria stadia IA bez invaze do myometria v rámci fertilitu šetřícího postupu – výběr největších recentních studií 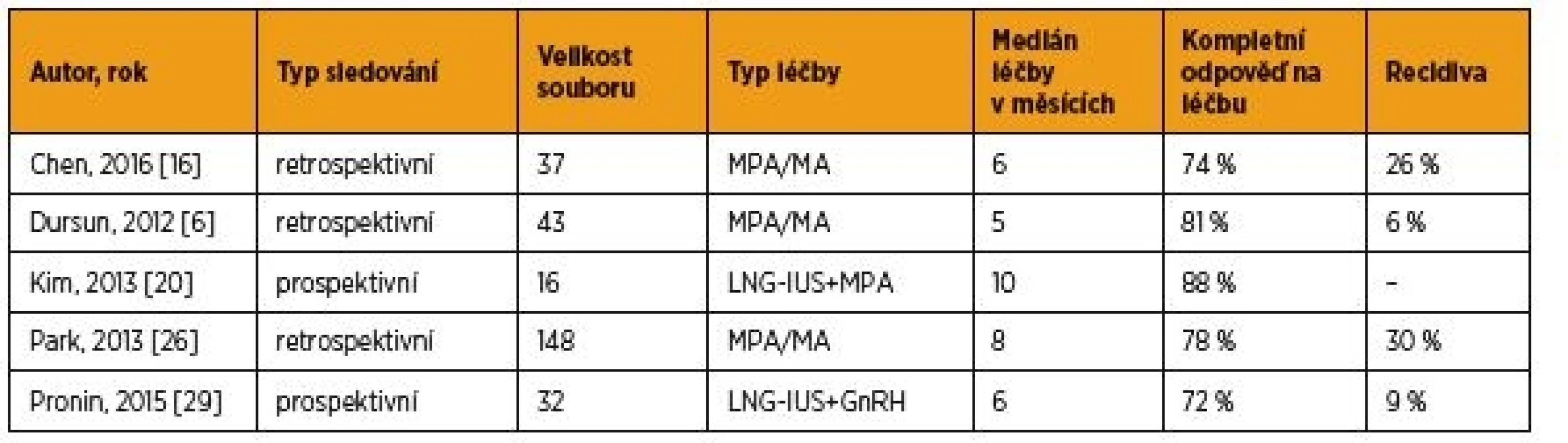
MPA – medroxyprogesteron-acetát; MA – megestrol-acetát; LNG-IUS – intrauterinní systém s levonorgestrelem; GnRH – gonadotropiny uvolňující hormon Tab. 2. Hormonální léčba pokročilého a recidivujícího karcinomu endometria – výběr největších recentních studií 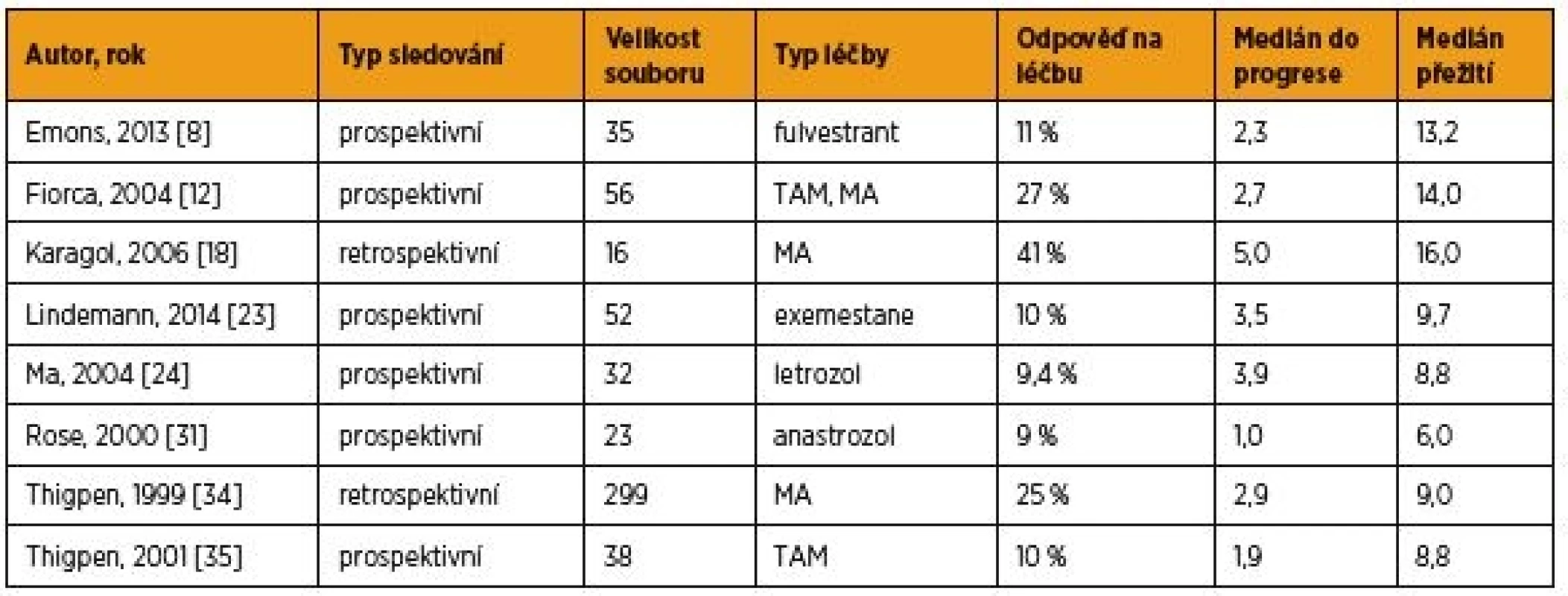
TAM – tamoxifen; MA – megestrol-acetát VÝSLEDKY NAŠÍ STUDIE
V letech 2010–2016 byl v Onkogynekologickém centru FN Brno a LF MU diagnostikován karcinom dělohy celkem u 415 pacientek. Naprostá většina pacientek (n = 370, 89 %) podstoupila primárně chirurgickou léčbu, v indikovaných případech s následnou adjuvantní radioterapií, případně chemoterapií.
Hormonální terapie jako primární léčba karcinomu dělohy byla nasazena u 19 pacientek (5 %) (graf 1). Nejčastějším důvodem kontraindikace operace a nasazení primární hormonální léčby byl vysoký věk pacientky (n = 9; 48 %), polymorbidita (n = 5; 26 %) nebo obezita (n = 4; 21 %). V jednom případě (5 %) byl zvolen fertilitu zachovávající postup (graf 2). Medián věku celé skupiny v době diagnózy byl 83 let, průměrné BMI ve skupině bylo 41. V souboru bylo 12 pacientek (63 %) ve stadiu FIGO I (jedenáct endometroidních, jeden serózní karcinom) (obr. 1–3), jedna pacientka (5 %) ve stadiu FIGO II (endometroidní karcinom), FIGO III čtyři (21 %) pacientky (tři endometroidní a jeden karcinosarkom) a ve stadiu FIGO IV byly dvě (11 %) pacientky (obě endometroidní karcinom). U pacientek s endometroidním karcinomem se dobře diferencovaný tumor (grade I) vyskytoval u čtyř (24 %) pacientek, grade II u jedenácti (65 %) a grade III u dvou (12 %). Tři pacientky s endometroidním karcinomem ve stadiu I grade I jsou stále naživu bez progrese onemocnění, zbylých 16 pacientek zemřelo a medián přežití byl osm měsíců (rozmezí 2–47). U pacientek diagnostikovaných ve stadiu FIGO I byl medián přežití 14 měsíců (rozmezí 2–29), FIGO II 31 měsíců, FIGO III osm měsíců (rozmezí 4–47), FIGO IV pět měsíců. Medián přežití u endometroidního karcinomu byl jedenáct měsíců (rozmezí 2–47), u non-endometroidního karcinomu šest měsíců (rozmezí 4–8). Pacientky s dobře diferencovaným tumorem (grade I) dosáhly mediánu přežití sedm měsíců (rozmezí 5–8), u grade II to bylo 13 měsíců (rozmezí 2–47), u grade III a non-endometroidních karcinomů 19 měsíců (rozmezí 4–47) (tab. 3).
Graf 1. Primární léčba karcinomu těla děložního 
Graf 2. Důvody k volbě hormonální terapie 
Tab. 3. Délka přežití pacientek s primární hormonální terapií 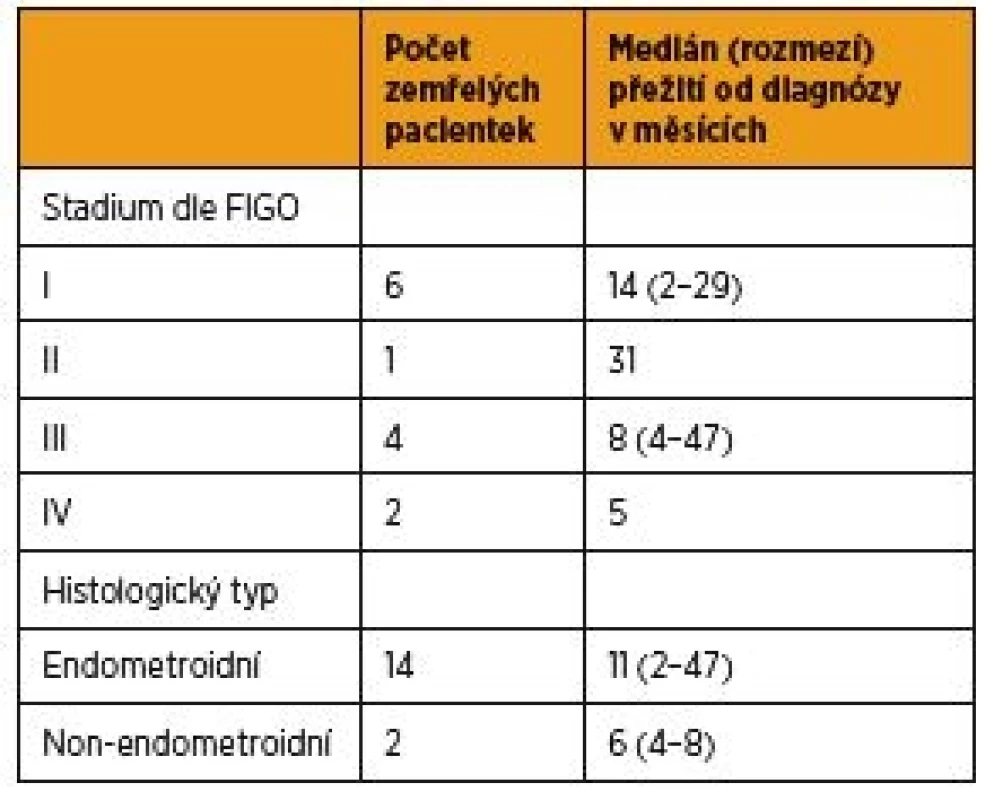
Obr. 1. Karcinom děložního těla bez invaze do myometria (FIGO IA) 
Obr. 2. Karcinom děložního těla s povrchovou invazí do myometria (FIGO IA) 
Obr. 3. Karcinom endometria s hlubokou invazí do myometria (FIGO IB) 
Recidiva základního onemocnění byla diagnostikována u 31 (8 %) pacientek z celkového počtu 415 případů. Průměrná doba od ukončené primární léčby ke vzniku recidivy byla v celé skupině recidiv 16 měsíců (rozmezí 4–48). Hormonální léčba byla nasazena u sedmi pacientek, u pěti (16 %) jako primární léčba recidivy (graf 3). Histologicky se jednalo o jeden endometroidní karcinom grade II (20 %) a čtyři karcinomy grade III (80 %). Medián přežití pacientek s hormonálně léčenou recidivou od její diagnózy byl 20 měsíců (rozmezí 3–26) (tab. 4). Dvě pacientky (7 %), které podstoupily nejprve chemoterapii a až následně pro progresi recidivy hormonální terapii, byly ze studie vyřazeny. U jedné pacientky (4 %) se vyskytla parciální plicní embolie a od hormonoterapie bylo následně ustoupeno. Další vážné nežádoucí účinky nebyly zaznamenány.
Graf 3. Léčba recidivy karcinomu těla děložního 
Tab. 4. Délka přežití pacientek s recidivou léčenou hormonální terapií 
DISKUSE
Podle nejnovějšího společného doporučení ESMO (European Society of Medical Oncology), ESGO (European Society of Gynaecological Oncology), ESTRO (European Society for Radiotherapy and Oncology) lze hormonální terapii zvážit u pacientek požadujících zachování fertility, v počátečních stadiích onemocnění při kontraindikaci dalších léčebných modalit a také u pokročilých nebo recidivujících karcinomů endometria. V našem souboru se vyskytla pouze jedna pacientka, která splňovala kritéria a přála si zachovat fertilitu. Po šesti měsících terapie byla provedena kontrolní biopsie endometria hysteroskopicky. Histologie potvrdila již jen prostou hyperplazii bez atypií a nález byl vyhodnocen jako remise onemocnění. U pacientky je zatím pokračováno v udržovací hormonální terapii, neboť z rodinných důvodů nyní přerušila aktivní snahu o těhotenství. Vzhledem k současné tendenci odsouvat mateřství do vyššího věku je pravděpodobné, že se s takovými pacientkami budeme v onkogynekologii setkávat stále častěji a hormonální terapie najde své místo vedle dalších fertilitu šetřících postupů [11].
Nejúčinnější je hormonální léčba u dobře a středně diferencovaných endometroidních nádorů, s pozitivními hormonálními receptory [3, 12, 30]. Před nasazením léčby je nutné imunohistochemicky vyšetřit tumor na přítomnost ER/PR. U recidivy je rovněž vhodné provést biopsii a znovu otestovat přítomnost hormonálních receptorů, jelikož ta se může od původního nádoru lišit [33]. V našem onkogynekologickém centru jsme stanovovali receptory z původních vzorků získaných při primární léčbě nádoru. Hormonální terapie byla taktéž podána v rámci paliativní péče i u pacientek s nádory špatně diferencovanými, případně non-endometroidního typu. Výrazně déle přežívaly pacientky, u kterých byl karcinom diagnostikován a léčen v počátečním stadiu, a pacientky s endometroidním karcinomem na rozdíl od non-endometroidního typu. Podle diferenciace nádoru jsme neprokázali delší přežití u karcinomů grade I a II, což nelze vzhledem k velikosti souboru považovat za významné. Dalším důvodem může být prognostická síla samotného gradingu, která může být menší než prognostický význam samotné pokročilosti tumoru, což dokumentuje i malá série publikovaná Parkerem et al. v roce 2013, kdy recidiva onemocnění endometroidního karcinomu grade 2–3 bez invaze do myometria se výrazně lišila od recidivy s invazí do myometria v rámci klinického stadia FIGO IA (23 % versus 71 %) [27].
Důvodem k primárnímu nasazení hormonální terapie u pacientek v menopauze byla v našem souboru kontraindikace jiné léčebné modality. V léčbě jsme použili obecně doporučený medroxyprogesteron-acetát a megestrol-acetát v dávkování 500 mg respektive 320 mg denně. S dalšími preparáty, které lze využít (tamoxifen, fulvestrant, anastrozol, letrozol), ale které vykazují nižší účinnost, nemáme v léčbě karcinomu endometria osobní zkušenosti. U takto rizikových pacientek je výhodou při zachování doporučeného dávkování nízká toxicita a vynikající bezpečnostní profil hormonální terapie při srovnání s hojně využívanou chemoterapií. V našem souboru se vyskytl pouze jeden případ parciální plicní embolie, který vedl k ukončení hormonální terapie. Další nežádoucí účinky jsme nepozorovali.
Slabinou naší studie je, že se jedná o retrospektivní soubor pacientek z jednoho onkogynekolgického centra. Studie je zatížena malým počtem zařazených pacientek vzhledem k spíše raritnímu užití hormonální terapie. Určitou výhodou a sílou souboru jsou dostupná komplexní klinická i patomorfologická data a následné údaje o dispenzarizaci pacientek v našem Centru onkologické prevence. Do budoucna by bylo vhodné rozšířit sledovanou skupinu pacientek i o případy z jiných onkogynekologických center v České republice a srovnat účinnost hormonální terapie s dalšími léčebnými modalitami. Zároveň by bylo vhodné zachytit nejnovější trendy výzkumu v oblasti hormonální terapie jako součásti personalizované medicíny pacientek s karcinomem dělohy. Nejnovější výzkumy ukazují, že odpověď na hormonální terapii je vysoce závislá na přítomnosti ER/PR [5, 34]. Prozatím nebyl popsán význam exprese AR (androgenové receptory) ve vztahu k odpovědi na léčbu, ale ztráta těchto receptorů stejně jako ER/PR je asociována se špatnou prognózou. Přítomnost AR by tak mohla vykazovat podobnou souvislost s odpovědí na léčbu [32]. Exprese steroidního receptoru na nádorové buňce však hodnotí pouze konečný produkt signální dráhy bez jakýchkoliv dalších informací o tom, zda je tato cesta funkčně normální, nebo zda je signální dráha nadměrně aktivní kvůli nadbytku steroidních hormonů. Měření aktivity dráhy by proto mohlo přinést více informací k predikci reakce. Například nedávné studie aktivity nádorové signální dráhy u rakoviny prsu prokázaly, že aktivace signální cesty estrogenu je silně propojená s klinickou odpovědí na adjuvantní hormonální léčbu žen s rakovinou prsu a lépe předpovídá terapeutický přínos v porovnání se samotnou expresí estrogenového receptoru [37]. Pro karcinom endometria však nic podobného dosud nebylo publikováno [36].
ZÁVĚR
Hormonální terapie se u zhoubných nádorů děložního těla využívá jen zřídka, přesto má nezastupitelnou roli u inoperabilních, polymorbidních pacientek, nebo naopak u mladších žen s přáním zachovat fertilitu. Právě s těmito pacientkami se jistě v budoucnu budeme setkávat stále častěji, vzhledem k trendu odsouvání rodičovství do vyššího věku. Při dodržování doporučeného dávkování vykazuje hormonální terapie jen nízkou toxicitu a minimum nežádoucích účinků. Nové studie zabývající se funkčností signální dráhy steroidních receptorů by mohly v budoucnu zásadně přispět k další personalizaci onkologické léčby u pacientek se zhoubným nádorem děložního těla.
Práce vznikla za podpory Ministerstva zdravotnictví ČR – RVO (FNBr 65269705).
Korespondující autor
Prim. MUDr. Vít Weinberger, Ph.D.
Gynekologicko-porodnická klinika LF MU a FN
Obilní trh 11
602 00 Brno
e-mail: vit.weinberger@gmail.com
Zdroje
1. Amant, F., Mirza, MR., Koskas, M., Creutzberg, CL. Cancer of the corpus uteri. In J Gynaecol Obstet, 2015, 131, 2, p. 96–104.
2. Baker, WD., Pierce, SR., Mills, AM., et al. Nonoperative management of atypical endometrial hyperplasia and grade 1 endometrial cancer with the levonorgestrel intrauterine device in medically ill post-menopausal women. Gynecol Oncol, 2017, 146, 1, p. 34–38.
3. Colombo, N., Creutzberg, C., Amant, F., et al. ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer: diagnosis, treatment and follow-up. Ann Oncol, 2016, 27, p. 16–41.
4. Creasman, WT., Odicino, F., Maisonneuve, P., et al. Carcinoma of the corpus uteri. FIGO 6th annual report on the results of treatment in gynecological cancer. Int J Gynaecol Obstet, 2006, 95, p. 105–143.
5. Decruze, SB., Green, JA. Hormone therapy in advanced and recurrent endometrial cancer: a systematic review. Int J Gynecol Cancer, 2007, 17, p. 964–978.
6. Dursun, P., Erkanli, S., Güzel, AB., et at. A Turkish Gynecologic Oncology Group study of fertility-sparing treatment for early-stage endometrial cancer. Int J Gynaecol Obstet, 2012, 119, 3, p. 270–273.
7. Dušek, L., Mužík, J., Kubásek, M., et al. Epidemiologie zhoubných nádorů v České republice [online]. http://www.svod.cz. [cit. 2018-02-01].
8. Emons, G., Gunthert, A., Thiel, FC., et al. Phase II study of fulvestrant 250 mg/month in patients with recurrent or metastatic endometrial cancer: a study of the Arbeitsgemeinschaft Gynakologische Onkologie. Gynecol Oncol, 2013, 129, p. 495–499.
9. Ethier, JL., Desautels, DN., Amir, E., MacKay, H. Is hormonal therapy effective in advanced endometrial cancer? A systematic review and meta-analysis. Gynecol Oncol, 2017, 147, 1, p. 158–166.
10. Erkanli, S., Ayhan, A. Fertility-sparing therapy in young women with endometrial cancer: 2010 update. Int J Gynecol Cancer, 2010, 20, p. 1170–1187.
11. Felsinger, M., Minář, L., Weinberger, V., Hudeček, R. Radikální fertilitu zachovávající operační výkony u gynekologických maginit – pětiletý soubor. Čes Gynek, 2015, 80, 5, s. 339–344.
12. Fiorica, JV., Brunetto, VL., Hanjani, P., et al. Phase II trial of alternating courses of megestrol acetate and tamoxifen in advanced endometrial carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol, 2004, 92, 1, p. 10–14.
13. Fleming, GF., Brunetto, VL., Cella, D., et al. Phase III trial of doxorubicin plus cisplatin with or without paclitaxel plus filgrastim in advanced endometrial carcinoma: a Gynecologic Oncology Group Study. J Clin Oncol, 2004, 22, 11, p. 2159–2166.
14. Frühauf, F., Dvořák, M., Haaková, L., et al. Ultrazvukový staging karcinomu endometria – doporučená metodika vyšetření. Čes Gynek, 2014, 79, 6, s. 466–476.
15. Gunderson, CC., Fader, AN., Carson, KA., et al. Oncologic and reproductive outcomes with progestin therapy in women with endometrial hyperplasia and grade 1 adenocarcinoma: A systematic review. Gynecol Oncol, 2012, 125, p. 477–482.
16. Chen, M., Jin, Y., Li, Y., et al. Oncologic and reproductive outcomes after fertility-sparing management with oral progestin for women with complex endometrial hyperplasia and endometrial cancer. Int J Gynaecol Obstet, 2016, 132, 1, p. 34–38.
17. Chiva, L., Lapuente, F., González-Cortijo, L., et al. Sparing fertility in young patients with endometrial cancer. Gynecol Oncol, 2008, 111, p. 101–104.
18. Karagol, H., Saip, P., Uygun, K., et al. Evaluation of prognostic factors and comparison of systemic treatment modalities in patients with recurrent or metastatic endometrial carcinoma. Med Oncol, 2006, 23, 4, p. 543–548.
19. Kim, MK., Seong, SJ. Conservative treatment for atypical endometrial hyperplasia: What is the most effective therapeutic method? J Gynecol Oncol, 2014, 25, p. 164–165.
20. Kim, MK., Seong, SJ., Song, T., et al. Comparison of dilatation & curettage and endometrial aspiration biopsy accuracy in patients treated with high-dose oral progestin plus levonorgestrel intrauterine system for early-stage endometrial cancer. Gynecol Oncol, 2013, 130, p. 470–473.
21. Kitchener, H., Swart, AM., Qian, Q., et al. Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): a randomized study. Lancet, 2009, 373, 9658, p. 125–136.
22. Lee, NK., Cheung, MK., Shin, JY., et al. Prognostic factors for uterine cancer in reproductive-aged women. Obstet Gynecol, 2007, 109, p. 655–662.
23. Lindemann, K., Malander, S., Christensen, RD., et al. Examestane in advanced or recurrent endometrial carcionoma: prospective phase II study by the Nordic Society of Gynecologic Oncology (NSGO). BMC Cancer, 2014, 5, 14, p. 68.
24. Ma, BB., Oza, A., Eisenhauer, E., et al. The activity of letrozole in patients with advanced or recurrent endometrial cancer and correlation with biological markers – a study of the National Cancer Institute of Canada Clinical Trials Group. Int J Gynecol Cancer, 2004, 14, p. 650–658.
25. Moore, TD., Phillips, PH., Nerenstone, SR., Cheson, BD. Systemic treatment of advanced and recurrent endometrial carcinoma: current status and future directions. J Clin Oncol, 1991, 9, 6, p. 1071–1088.
26. Park, JY., Kim, DY., Kim, JH., et al. Long-term oncologic outcomes after fertility-sparing management using oral progestin for young women with endometrial cancer (KGOG 2002). Eur J Cancer, 2013, 49, p. 868–874.
27. Park, JY., Kim, DY., Kim, TJ., et al. Hormonal therapy for women with stage IA endometrial cancer of all grades. Obstet Gynecol, 2013, 122, p. 7–14.
28. Park, JY., Lee, SH., Seong, SJ., et al. Progestin retreatment in patients with recurrent endometrial adenocarcinoma after successful fertility-sparing management using progestin. Gynecol Oncol, 2013, 129, p. 7–11.
29. Pronin, SM., Novikova, OV., Andreeva, JY., et al. Fertility-sparing treatment of early endometrial cancer and complex atypical hyperplasia in young women of childbearing potential. Int J Gynecol Cancer, 2015, 25, p. 1010–1014.
30. Rodolakis, A., Biliatis, I., Morice, P., et al. European Society of Gynecological Oncology Task Force for Fertility Preservation: clinical recommendations for fertility-sparing management in young endometrial cancer patients. Int J Gynecol Cancer, 2015, 25, p. 1258–1265.
31. Rose, PG., Brunetto, VL., VanLe, L., et al. A phase II trial of anastrozole in advanced recurrent or persistent endometrial carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol, 2000, 78, p. 212–216.
32. Tangen, IL., Onyango, TB., Kopperud, R., et al. Androgen receptor as potential therapeutic target in metastatic endometrial cancer. Oncotarget, 2016, 7, 31, p. 49289–49298.
33. Tangen, IL., Werner, HM., Berg, A., et al. Loss of progesterone receptor links to high proliferation and increases from primary to metastatic endometrial cancer lesions. Eur J Cancer, 2014, 50, p. 3003–3010.
34. Thigpen, JT., Brady, MF., Alvarez, RD., et al. Oral medroxyprgesterone acetate in the treatment of advanced or recurrent endometrial carcinoma: a dose-response study by the Gynecologic Oncology Group. J Clin Oncol, 1999, 17, 6, p. 1736–1744.
35. Thigpen, JT., Brady, MF., Homesley, HD., et al. Tamoxifen in the treatment of advanced or recurrent endometrial carcinoma: a Gynecologic Oncology Group study. J Clin Oncol, 2001, 15, 19, p. 364–367.
36. van der Putten, LJM., van Weelden, WJ., de Inda, MA., et al. Estrogen receptor pathway activity in endometrial carcinomas and its relation to tumor grade and recurrence. Abstract submitted to AACR, manuscript in progress.
37. Verhaegh, W., van Ooijen, H., Inda, MA., et al. Selection of personalized patient therapy through the use of knowledge-based computational models that identify tumor-driving signal transduction pathways. Cancer Res, 2014, 74, 11, p. 2936–2945.
38. Wang, CB., Wang, CJ., Huang, HJ., et al. Fertility preserving treatment in young patients with endometrial adenocarcinoma. Cancer, 2002, 94, p. 2192–2198.Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Jak přesní jsme v hodnocení mobility uretry? Porovnání subjektivního a objektivního hodnoceníČlánek Akutní enterovirová meningoencefalitida jako neobvyklá příčina diplopie v těhotenství a šestinedělí
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2018 Číslo 4- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Srovnání souborů uměle ukončených těhotenství farmakologickou a chirurgickou metodou
- Vaginální rekonstrukce prolapsu pánevních orgánů: efekt, komplikace, vliv na močové a pohlavní funkce a kvalitu života ve dvouletém follow-up Část III – komplikace gastrointestinální, muskuloskeletální, celkové, sexuální funkce a kvalita života
- Jak přesní jsme v hodnocení mobility uretry? Porovnání subjektivního a objektivního hodnocení
- Role hormonální terapie u pacientek s karcinomem děložního těla
- Raritní komplikace dlouhodobého vaginálního prolapsu
- Nerozpoznaná preeklampsie, která se rozvinula do eklamptického záchvatu s fatálním koncem
- Akutní enterovirová meningoencefalitida jako neobvyklá příčina diplopie v těhotenství a šestinedělí
- Zoonova vulvitida – vzácná forma chronického zánětu vulvy
- Implantace a diagnostika receptivity endometria
- Pozdní morbidita u syndromu jizvy po císařském řezu
- Možnosti a praktický význam stanovení ovariální rezervy
- Stížnosti a žaloby na lékaře v oboru gynekologie a porodnictví – výsledky dotazníkového průzkumu
- Zápis z jednání volební komise pro volby výboru Sekce pro endometriózu České gynekologické a porodnické společnosti ČLS JEP
- 6th International Video Workshop on Radical Surgery in Gynecologic Oncology
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Pozdní morbidita u syndromu jizvy po císařském řezu
- Implantace a diagnostika receptivity endometria
- Zoonova vulvitida – vzácná forma chronického zánětu vulvy
- Možnosti a praktický význam stanovení ovariální rezervy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



