-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Idiopatická retroperitoneální fibróza: Méně častá příčina bolestí dolní části zad. Použití tamoxifenu v terapii onemocnění
Idiopathic retroperitoneal fibrosis: Less common cause of low back pain. Use of tamoxifen in the treatment of the diesease
Retroperitoneal fibrosis (RPF) is a rare inflammatory disease which is characterized by the development of a fibrous process that surrounds the major vessels and organs located within the retroperitoneum. About two-thirds of all cases of RPF are idiopathic and are thought to be immunological in origin. Diagnosis of RPF should be considered in patients with unexplained abdominal and low back pain and retroperitoneal lesions. We present a case report of 59-year-old white male with idiopathic RPF with history of low back pain and weight loss as only symptoms, treated by tamoxifen, corticosteroids, and by insertion of JJ endoureteric catheters due to the obstruction of the upper urinary tract.
Key words:
low back pain, retroperitoneal fibrosis, tamoxifen, treatment
Autoři: P. Němec 1; S. Rybníčková 2; P. Fabian 3; Z. Fojtík 4; M. Souček 1
Působiště autorů: Revmatologická ambulance II. interní kliniky, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta Masarykovy Univerzity, 2Oddělení radiologie Masarykův onkologický ústav, 3Oddělení patologie Masarykův onkologický ústav, 4Revmatologická ambulance Intern 1
Vyšlo v časopise: Čes. Revmatol., 16, 2008, No. 1, p. 23-29.
Kategorie: Kazuistiky
Souhrn
Retroperitoneální fibróza (RPF) je vzácné onemocnění charakterizované vývojem fibrotizujícího procesu obklopujícího velké cévy a orgány retroperitonea. Idiopatická RPF tvoří přibližně dvě třetiny případů. Předpokládaný je imunopatogenetický základ tohoto onemocnění. Na diagnózu RPF je nutno pomýšlet v případě přítomnosti jinak nevysvětlitelné bolesti dolní části zad a při současném nálezu ložiskového procesu postihujícího retroperitoneum. Předkládáme případ 59letého muže s idiopatickou RPF, která se v úvodu onemocnění diskrétně manifestovala bolestmi v dolní části zad a váhovým úbytkem. Pacient byl léčen tamoxifenem, glukokortikoidy a inzercí JJ stentů do obou ureterů z důvodu obstrukce močového traktu retroperitoneálním procesem.
Klíčová slova:
bolesti dolní části zad, retroperitoneální fibróza, tamoxifen, terapieÚvod
Retroperitoneální fibróza (RPF) představuje vzácné zánětlivé onemocnění charakterizované fibrotizujícím procesem obklopujícím velké cévy a orgány retroperitonea. RPF byla poprvé popsána v roce 1948 (1). Idiopatická RPF je rovněž označována jako morbus Ormond, podle autora prvního popisu případu idiopatické RPF. Onemocnění se vyskytuje dvakrát častěji u mužů než u žen nejčastěji mezi 30. a 60. rokem (2). Idiopatická RPF tvoří přibližně dvě třetiny případů. Předpokládá se imunopatogenetický mechanismus jejího vzniku (3).Zbývající jedna třetina případů RPF je asociovaná s chronickými zánětlivými procesy, malignitami, použitím některých léků nebo s procesy postihujícími retroperitoneum, jako je infekce, trauma, aneuryzma abdominální aorty nebo akutní pankreatitida (2, 4).Idiopatická RPF býváspolu se zánětlivým aneuryzmatem abdominální aorty a perianeuryzmální retroperitoneální fibrózou řazena k tzv. chronickým periaortitidám (CP) (5, 6). V časném stadiu onemocnění se v bioptických vzorcích prokazuje ztráta kolagenní sítě se zvýšeným obsahem buněčných elementů, zejména fibroblastů a zánětlivých buněk a proliferace kapilár (4). Vyzrálé retroperitoneální plaky jsou tvořeny hustě hyalinizovanou kolagenní tkání s minimem buněčných elementů (4).
V roce 1983 Kinzbrunner a kol. poprvé popsal případ úspěšného použití antiestrogenního preparátu tamoxifenu (1-4 β dimethylaminoethoxyphenyl) v terapii desmoidu, který představuje jiný typ benigního fibrotického procesu (7). Následně Clark a kol. úspěšně použili tamoxifen v terapii idiopatické RPF u dvou svých pacientů (8). O té doby bylo v literatuře publikováno několik případů použití tamoxifenu v terapii RPF (9 – 17).
Předkládáme případ idiopatické RPF léčené tamoxifenem a glukokortikoidy. Jedinými příznaky v úvodu onemocnění byla bolest v dolní části zad a hmotnostní úbytek.
Kazuistika
59letý muž, kuřák, byl vyšetřován pro bolesti v dolní části zad a hmotnostní úbytek 10 kg během předcházejících 8 měsíců. Pacient své bolesti popisoval jako tupé, kontinuální, vystřelující symetricky do oblasti hýždí, třísel a zadních ploch stehen. Bolesti se zhoršovaly během chůze. V úvodu vzniku těchto potíží pacient popisoval dvoudenní epizodu febrilií přes 38 °C doprovázených bolestí v krku. V posledních měsících před vyšetřením se objevovaly občasné febrilie a noční pocení. Pacient byl doposud sledován pro diabetes mellitus 2. typu, hypertenzi, hypercholesterolemii a ischemickou chorobu srdeční manifestující se anginou pectoris. V roce 1995 prodělal infarkt myokardu. Pacient byl léčen antihypertenzivy (acebutolol, amlodipin a metipamid), užíval anopyrin, nitráty (glyceryl trinitrát) a hypolipidemika (fenofibrát). V pacientově anamnéze nebyl údaj o dlouhodobé expozici toxickým látkám.
Klinické vyšetření prokázalo vyšší hodnoty krevního tlaku na horních i dolních končetinách (155/100 mmHg). Vyšetření kardiovaskulárního a respiračního systému nevykazovalo abnormální nález. Vyšetření břicha prokázalo tichý systolický šelest slyšitelný v obou tříslech. Pulzace nad tepnami obou dolních končetin byly hmatné.
Laboratorní vyšetření krve prokázalo následující: mírně zvýšenou sérovou hladinu kreatininu (118 μmol/l); systémovou zánětlivou aktivitu (sedimentace erytrocytů (FW) 72 mm/h, C-reaktivní protein (CRP) 62,3 mg/l, CIK C1q 54 μg/ml); krevní obraz vykazoval normální počet erytrocytů (4,84x1012/l); lehce zvýšený počet leukocytů (10,7x109/l) s lymfopenií; lehce snížený počet krevních destiček (139x109/l); glykemie 6,1 mmol/l; kyselina močová 546 μmol/l; celkový cholesterol 5,18 mmol/l; normální jaterní testy (transaminázy, celkový bilirubin, alkalická fosfatáza, gammaglutamyltranspeptidáza a albumin). Sérologické testy virových hepatitid, CMV, ASLO a HIV byly negativní. Sérologické testy EBV infekce prokazovaly přítomnost protilátek ve třídě IgG. Imunologické testy neprokázaly přítomnost autoprotilátek včetně revmatoidních faktoru, antinukleárních protilátek, autoprotilátek anti ds-DNA, ANCA a antikardiolipinových autoprotilátek. Hladiny C3, C4 složek komplementu byly v normě. Odchylky od normy byly zaznamenány v hladinách imunoglobulinů (IgG 16,4 g/l (norma 7,5 – 15,6), IgE 744 IU/ml (norma 0 – 100) a IgM 0,392 g/l (norma 0,460–3,040). Biochemické a mikroskopické vyšetření moči a močového sedimentu bylo negativní. Kožní tuberkulinový test byl negativní.
Ultrasonografické vyšetření prokázalo lehkou dilataci dutého systému levé ledviny a dilataci proximální části levého ureteru s kolénkovitým ohybem přibližně 20 mm pod odstupem ureteru z ledvinné pánvičky s mediálním posunem obou ureterů. Vyšetření neprokázalo přítomnost retroperitoneálního infiltrátu.
Vyšetření počítačovou tomografií (CT) s použitím kontrastní látky prokázalo rozsáhlý infiltrát s denzitou odpovídající měkké tkáni obklopující v retroperitoneu abdominální aortu, obě iliické arterie, dolní dutou žílu a levý ureter.
Magnetická rezonance (MRI) prokázala fibrózní hmoty obklopující abdominální aortu, dolní dutou žílu, obě iliické tepny a oba uretery s intenzitou signálu srovnatelnou se svalem v obou T1W1 a T2W1 vyšetřovaných modech. Nebylo nalezeno aneuryzma abdominální aorty, kostní léze, ani paraaortální či mesenterická lymfadenopatie (obr. 1).
Obr. 1. MRI prokazuje retroperitoneální fibrotické hmoty obklopující abdominální aortu, dolní dutou žílu, iliické cévy a oba uretery intenzity odpovídající svalové tkáni v obou T1W1 and T2W1 módech. 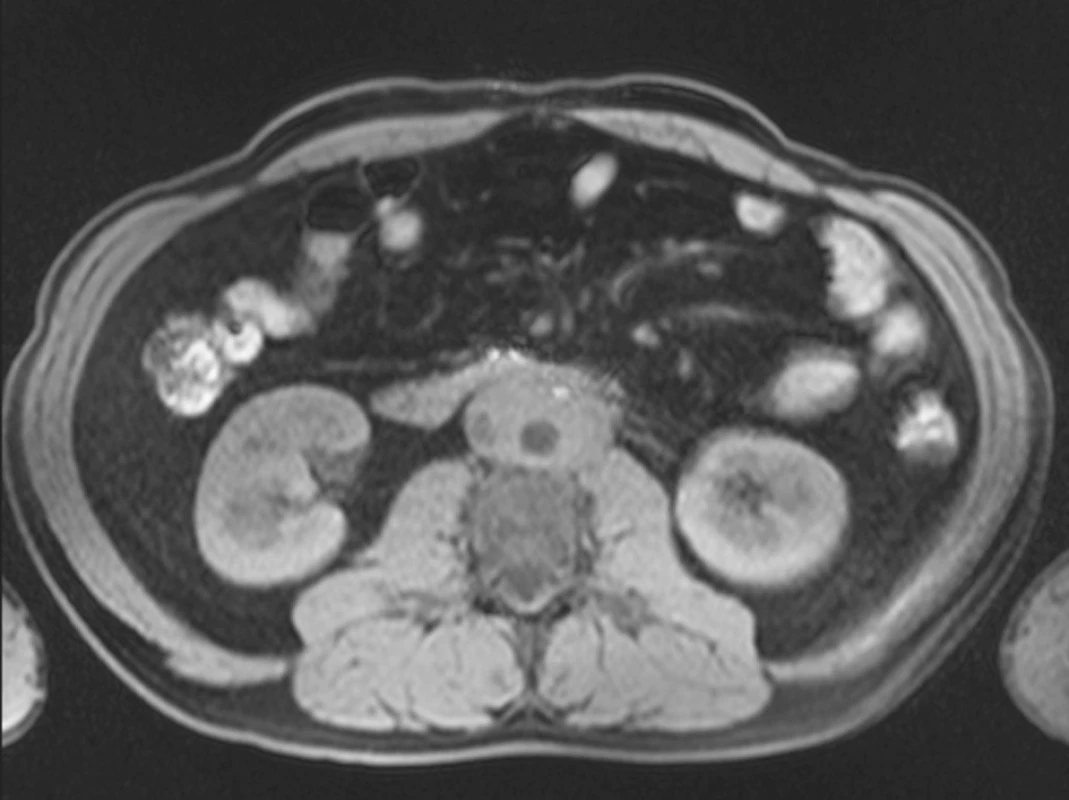
Byla provedena CT asistovaná jehlová biopsie (20 G) retroperitoneálního infiltrátu. Histologické vyšetření prokázalo fibrotizovanou tkáň s bohatým zastoupením buněčných elementů, se zbytky tukové tkáně, se smíšeným zánětlivým infiltrátem (obr. 2A). Dominujícími buňkami byly T-lymfocyty (obr. 2B). B-lymfocyty byly zastoupeny v malém počtu (obr. 2C). Poněkud početněji byly zastoupeny plazmatické buňky (obr. 2D). Většina infiltrujících buněk, fibroblasty a makrofágy exprimovaly na svém povrchu znak CD68 (obr. 2E). Nebyla prokázána přítomnost estrogenního receptoru alfa (obr. 2F). Histologický nález odpovídal diagnóze idiopatické RPF.
Obr. 2. Histopatologický nález: Vzorek je tvořen buněčnou fibrotizovanou tkání s bohatým zastoupením buněčných elementů se zbytky tukové tkáně se smíšeným zánětlivým infiltrátem (A). Dominujícím buňkami jsou T-lymfocyty (B). B-lymfocyty jsou zastoupeny v malém počtu (C). Poněkud početněji jsou zastoupeny plazmatické buňky (D). Většina infiltrujících buněk, fibroblasty a makrofágy exprimují na svém povrhu CD68 (E). Estrogenního receptory alfa nejsou přítomny (F). 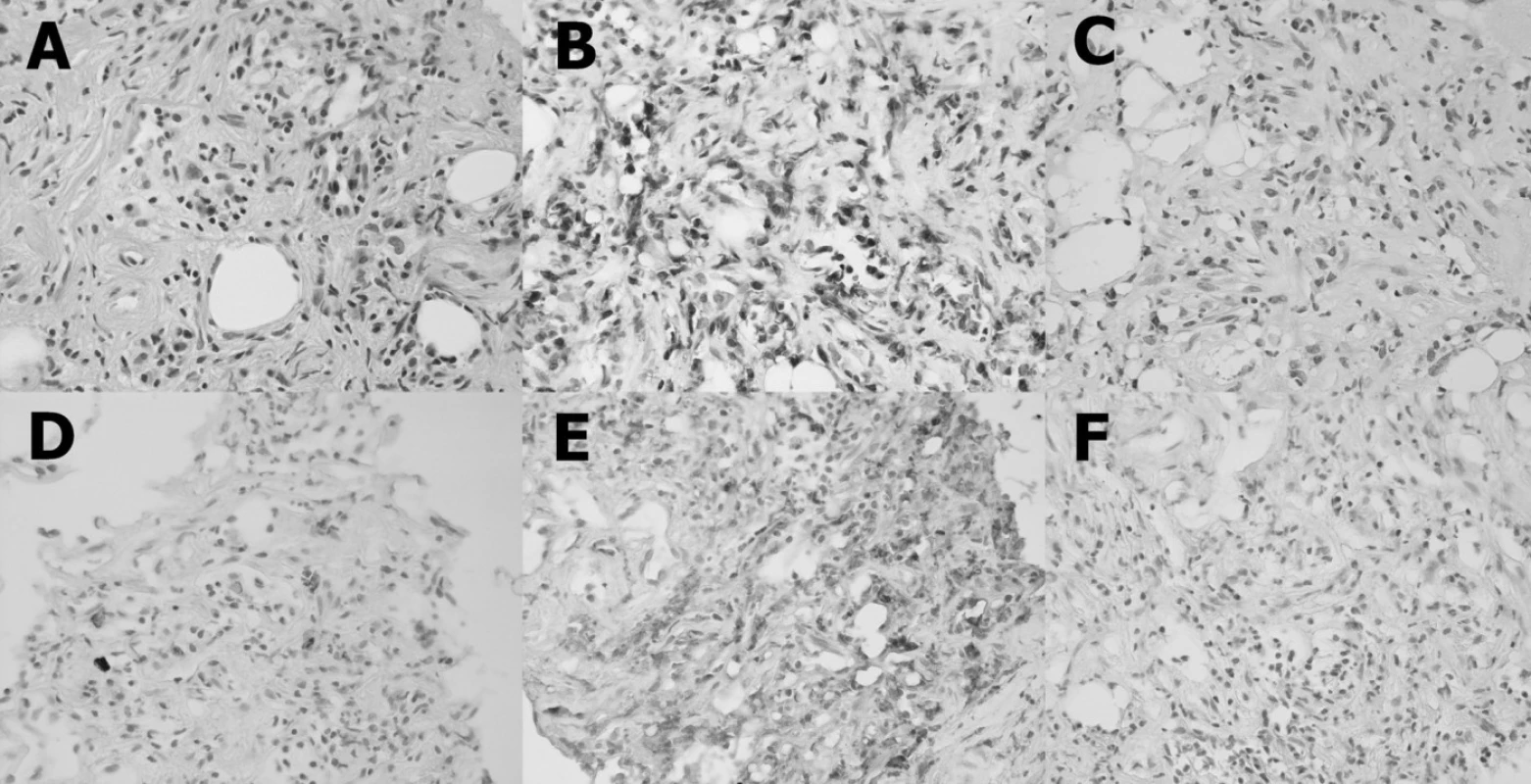
Po stanovení diagnózy idiopatické RPF byla zahájena terapie tamoxifenem v úvodní dávce 10 mg/den. Tato dávka byla postupně zvýšena během 3 týdnů na 20 mg/den. Při této léčbě nebyl zaznamenán výskyt nežádoucí účinků. Zejména z důvodu vlivu na metabolismus glukózy nebyly v terapii v úvodu použity glukokortikoidy.
Laboratorní vyšetření, které bylo provedeno 4 týdny po zahájení léčby tamoxifenem, prokázalo přetrvávající zánětlivou aktivitu (CRP 29,1 mg/l), ale především zvýšení sérové hladiny kreatininu na 267 μmol/l. Bylo provedeno ultrasonografické vyšetření, které prokázalo oboustrannou hydronefrózu a hydroureter (pravá ledvinná pánvička 20 mm, kalichy do 12 mm; levá pánvička 25 mm, kalichy do 15 mm). Obstrukce na úrovni ureterů byla řešena inzercí JJ stentů (Ch7/ 26 cm) do obou ureterů. Následné laboratorní vyšetření prokázalo pokles sérové hladiny kreatininu (176 μmol/l). 11 týdnů po zahájení terapie tamoxifenem byla jeho dávka zvýšena na 40 mg/den.
MRI vyšetření, provedené 5 měsíců od zahájení terapie tamoxifenem, neprokázalo redukci rozsahu retroperitoneálního infiltrátu. Přetrvávala dilatace dutého systému obou ledvin (obr. 3). V laboratorním vyšetření přetrvávala zánětlivá aktivita (FW 60 mm/h, CRP 23,8 mg/l). Sérová hladina kreatininu byla 183 μmol/l. Nebyly zaznamenány odchylky od normy v krevním obrazu (erytrocyty 4,39x1012/l, leukocyty 9,8x109/l, trombocyty 167x109/l). Z těchto důvodů jsme se rozhodli rozšířit terapii o glukokortikody. Byla zahájena terapie orálním methylprednisolonem v úvodní dávce 0,5 mg/kg/den po dobu 3 měsíců a následně byla dávka methylprednisolonu postupně redukována. Laboratorní vyšetření, provedené 3 týdny od zahájení terapie glukokortikoidy, prokázalo pokles zánětlivé aktivity (FW 8 mm/h; CRP 0,8 mg/l). Sérová hladina kreatininu mírně klesla na hodnotu 138 μmol/l.
Obr. 3. MRI prokazuje oboustrannou dilataci dutého systému obou ledvin a obou ureterů. 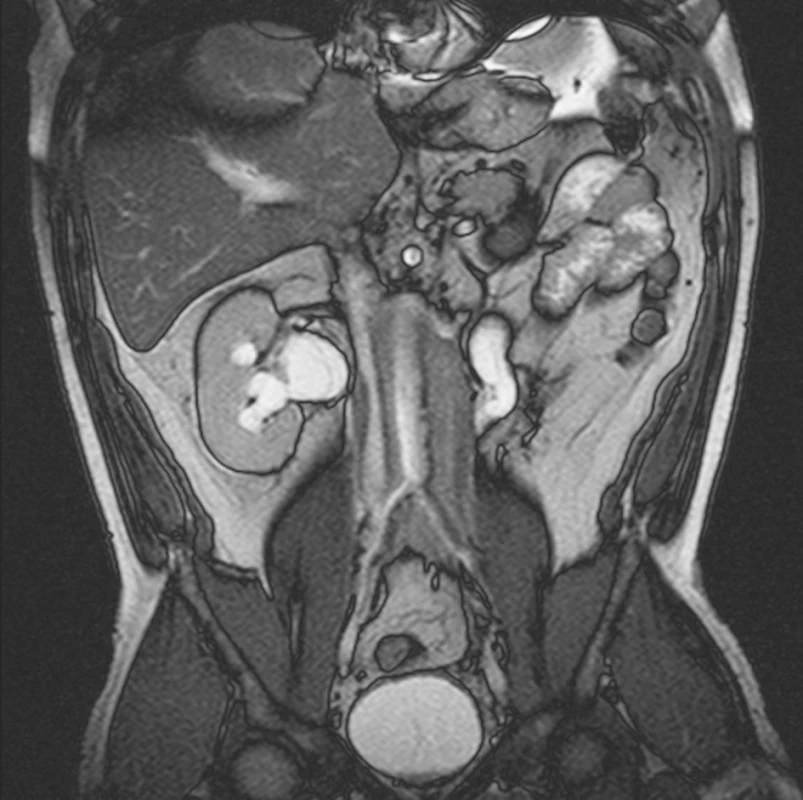
12 měsíců od zahájení terapie tamoxifenem bylo provedno MRI vyšetření, které prokázalo zmenšení rozsahu retroperitoneálního infiltrátu. Byla rovněž patrná regrese dilatace dutého systému obou ledvin (obr. 4). Současně provedené laboratorní vyšetření prokázalo absenci zánětlivé aktivity (FW 6 mm/h, CRP 4,1 mg/l ); pokles sérové hladiny kreatininu (125 μmol/l), ale současně prokázalo i odchylky v krevním obrazu, pokles počtu trombocytů (92x109/l), normální počet erytrocytů (4,98x1012/l) a leukocytózu (13,0x109/l). Ultrasonografické vyšetření prokázalo přetrvávající mírnou dilataci dutého systému levé ledviny (pánvička 24 mm, kalichy do 16 mm) a ústup dilatace dutého systému pravé ledviny. Redukce parenchymu ledvin nebyla patrná. JJ stenty byly zavedeny v obou ureterech ve správném postavení. Pokles počtu trombocytů mohl souviset s terapií tamoxifenem a proto byla jeho dávka snížena na 10 mg/den. Nadále pokračovala terapie methylprednisolonem v dávce 8 mg/den. Další laboratorní vyšetření prokazovala stacionární stav krevního obrazu. Počet trombocytů se dále nesnižoval a zůstával na hodnotě kolem 90x109/l. Nadále nebyly přítomny známky systémové zánětlivé aktivity.
Obr. 4. MRI vyšetření provedené 12 měsíců po zahájení terapie tamoxifenem prokazuje regresi rozsahu retroperitoneální fibrotické tkáně. Současně prokazuje ústup dilatace dutého systému obou ledvin a obou ureterů. 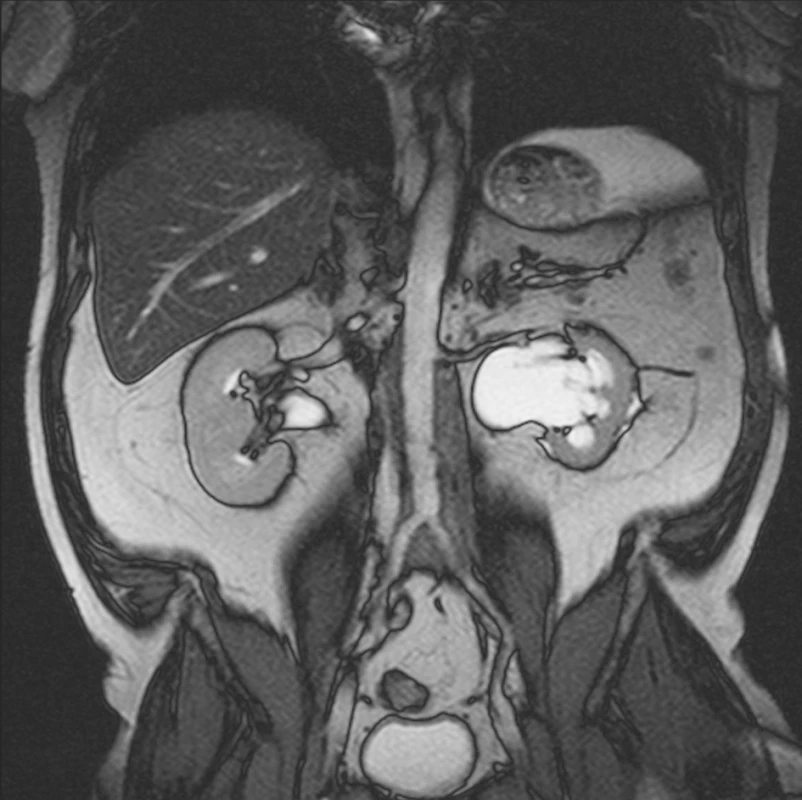
Diskuse
RPF je méně časté onemocnění charakterizované chronickým zánětlivým procesem pojivové tkáně retroperitonea. U dvou třetin případů RPF není prokazatelná vyvolávající příčina. Ačkoliv příčina vzniku idiopatické RPF nebyla dosud odhalena, předpokládá se imunopatogenetický mechanismus vzniku a vývoje tohoto onemocnění. Toto tvrzení podporuje častá asociace RPF s řadou zánětlivých chorob, přítomnost laboratorních známek zánětu, zánětlivý buněčný infiltrát v histologických nálezech, případná detekce autoprotilátek a odpověď na imunosupresivní terapii. Jak již bylo uvedeno, idiopatická RPF býváspolu se zánětlivým aneuryzmatem abdominální aorty a perianeuryzmální retroperitoneální fibrózou řazena k CP. Tato onemocnění jsou charakterizovaná fibrotizujícím zánětlivým procesem obklopujícím abdominální aortu a iliické tepny, šířícím se retroperitoneem. CP obvykle postihuje pacienty s pokročilou aterosklerózou. Je pravděpodobně důsledkem lokální autoimunitní zánětlivé odpovědi na některé antigeny aterosklerotických plátů nachazejících se v abdominální aortě, jako jsou oxidované low density lipoproteiny (LDL) nebo tukový pigment ceroid. Protilátky proti oxidovanému LDL jsou častěji prokazovány u pacientů s CP než u zdravých mladých kontrol (18). Podle některých autorů je CP výsledkem systémového autoimunitního procesu s vaskulitidou postihující aortální vasa vasorum a retroperitoneální cévy středního a malého kalibru (19). Prevalence vaskulitidy postihující cévy malého a středního kalibru u pacientů s CP je udávána mezi 10 až 80 % (19). Představu o autoimunitní povaze onemocnění podporují mimo jiné nálezy asociace CP s řadou systémových autoimunitních chorob, např.: systémovým lupus erythematodes, revmatoidní artritidou, ankylozující spondylitidou, Wegenerovou granulomatózou, polyarteritis nodózou nebo velkobuněčnou arteritidou a rovněž dobrá odpověď na terapii glukokortikoidy a jinými imunosupresivními léky (20 – 25). K rizikovým faktorů vývoje CP patří kouření (26, 27), viry (Herpes simplex, CMV) (28) a rovněž genetické rizikové faktory (association s HLA-DRB1*03) (29, 30). Histologicky bývá CP charakterizovaná chronickým zánětlivým infiltrátem v adventicii abdominální aorty, který tvoří zejména B-lymfocyty a plazmatické buňky zformované v lymfoidních foliklech a aktivních germinálních centrech a CD4+ T-lymfocyty (31).
Na diagnózu RPF je nutno pomýšlet u pacientů s jinak nevysvětlitelnou bolestí dolní části zad a břicha a s nálezem retroperitoneálního infiltrátu při vyšetřeních zobrazovacími metodami. Subjektivní stesky pacientů a klinické projevy choroby jsou způsobeny útlakem retroperitoneálních struktur, zejména aorty, dolní duté žíly a často útlakem ureterů. Ze zobrazovacích metod se k diagnostice RPF využívá ultrasonografie, pozitronová emisní tomografie, CT nebo MRI, ačkoliv ani jedna z těchto metod není schopna jednoznačně odlišit RPF od maligního procesu postihujícího retroperitoneum (4). Tyto metody tedy poskytují sice sugestivní výsledky, ale nikoliv specifické pro idiopatickou RPF (32–36). V takovém případě je přínosným vyšetřením, potvrzujícím diagnózu idiopatické RPF, jehlová biopsie retroperitoneálních hmot prováděna nejčastěji pod CT kontrolou. V některých případech je nevyhnutelné provedení laparotomie s odběrem bioptických vzorků.
Terapie idiopatické RPF je závislá na stadiu onemocnění. Doporučení pro léčbu idiopatické RPF doposud nebyla vytvořena. Provedení katetrizace močových cest s inzercí JJ stentů je vyžadováno v případě obstrukce močových cest. Pro použití moderních imunosupresivních léků svědčí případy regrese retroperitoneálního procesu po použití těchto preparátů (37). K dispozici je rovněž několik případů prokazujících efekt glukokortikoidů na zmírnění projevů choroby a zmenšení rozsahu RPF (38). Neexistuje však shoda v dávce a délce trvání terapie glukokortikoidy. Kardar a kol. uspořádali prospektivní studii zahrnující 12 pacientů s idiopatickou RPF léčených glukokortikoidy (39). Pacienti byli léčeni prednisonem v úvodní dávce 60 mg podávaným každý druhý den po dobu 2 měsíců. Následně byla dávka prednisonu postupně redukována na 5 mg podávaných denně. Celková doba terapie prednisonem byla 2 roky. 11 z 12 pacientů, kteří dokončili léčbu, bylo sledováno po dobu 26 až 132 měsíců (medián 63,1 měsíců) po skončení léčby. Dobrá odpověď na terapii, v podobě ústupu projevů choroby a v podobě regrese rozsahu RPF, byla zaznamenána v 9 případech. Selhání léčby bylo zaznamenáno ve zbylých 2 případech idiopatické RPF. V jednom případě nedošlo k regresi retroperitoneálního procesu a muselo být provedeno chirurgické uvolnění a zprůchodnění ureterů. Ve druhém případě došlo k relapsu retroperitoneálního procesu po přerušení léčby prednisonem, což si vyžádalo další podávání nízké dávky glukokortikoidů. Nebyl zaznamenán výskyt žádné závažné nežádoucí příhody v souvislosti s léčbou prednisonem. Autoři na základě získaných výsledků doporučují použití glukokortikoidů jako léků první volby u většiny pacientů s idiopatickou RPF. Tato léčba není zatížena zvýšeným výskytem nežádoucích příhod.
Existuje rovněž několik případů prokazujících efekt léčby idiopatické RPF azatioprinem, cyklofosfamidem, D-penicilaminem a chlorambucilem (2, 40). Maillart a kol. provedli analýzu databáze Medline s cílem získat data prokazující účinnost různých léčebných postupů v léčbě idiopatické RPF (41). Nenalezli žádnou klinickou studii zabývající se hodnocením účinnosti léčby idiopatické RPF. Autoři analyzovali celkem osm prací, které zahrnovaly 177 pacientů s idiopatickou RPF. Dva pacienti byli léčeni endoskopickou desobliterací ureterů nebo derivací moči nefrostomií, 45 pacientům byla provedena chirurgická ureterolýza, 65 pacientů bylo léčeno glukokortikoidy a 64 pacientů kombinací chirurgického postupu a terapie glukokortikoidy. Celkem 38 pacientů bylo léčeno kromě glukokortikoidů i jinými imunosupresivy (azatioprinem, cyklofosfamidem nebo D-penicilaminem). Délka terapie glukokortikoidy kolísala. Průměrná doba sledování byla 56 měsíců. Uspokojivého výsledku léčby bylo dosaženo v 73 % případů použití chirurgických technik, v 86 % případů použití pouze farmakoterapie a v 73 % případů použití kombinace obou postupů. Kombinace glukokortikoidů s jinými imunosupresivy byla úspěšná v 97 % případů. Uvedená práce obsahovala nejednoznačné informace týkající se výskytu nežadoucích příhod. Autoři uzavírají, že terapie idiopatické RPF je stále převážně empirická a je nejčastěji založena na kombinaci chirurgické léčby a použití glukokortikoidů.
Dalším lékem používaným v terapii idiopatické RPF je tamoxifen. Rovněž pro jeho použití v terapii idiopatické RPF neexistuje přesvědčivá evidence. Tamoxifen je antiestrogenním preparátem používaným především v terapii rakoviny prsu s prokazatelnou přítomností estrogenních receptorů. Terapie tamoxifenem je však účinná přibližně u 10 % karcinomů prsu bez prokazatelných estrogenních receptorů, což může ukazovat na jiný, na estrogenních receptorech nezávislý, mechanismů jeho působení. Myšlenka použití tamoxifenu v terapii idiopatické RPF je založena na průkazu jeho efektu na sekundární obstrukci močových cest metastazujícím karcinomem prsu postihujícím retroperitoneum (42). Jak již bylo uvedeno, adjuvantní terapie karcinomu prsu tamoxifenem je účinná v časných stadiích onemocnění nezávisle na přítomnosti estrogenních receptorů. Tento fakt vede k úvahám o jiném mechanismu působení tamoxifenu nezávislém na estrogenních receptorech, například možné působení tamoxifenu cestou specifických intracelulárních estradiolových receptorů. V literatuře se objevují informace i o jiných nehormonálních mechanismech působení tamoxifenu a jeho schopnosti redukovat buněčnou proliferaci (8, 9). Benson a Baum popsali regresi desmoidu po použití tamoxifenu a toremifenu (43). Autoři upozorňují na fakt, že RPF a desmoidní tumor sdílejí jisté společné znaky, jako je zvýšená aktivita mesenchymálních buněčných elementů. Autoři ve své práci sledovali, zda fibroblasty izolované z desmoidního tumoru produkují TGFβ v odpovědi na stimulaci in vitro. K dalším možným mechanismům účinku tamoxifenu patří možná inhibice produkce některých růstových faktorů a cytokinů (44, 45).
V roce 1991 popsal Clark a kol. poprvé případ úspěšného použití tamoxifenu v terapii dvou případů idiopatické RPF. Efekt léčby byl potvrzen poté, co došlo ke vzplanutí procesu po ukončení terapie tamoxifenem. Léčebný efekt se opět dostavil poté, co byla terapie tamoxifenem obnovena. Navíc efekt léčby byl patrný navzdory faktu, že u jednoho z léčených pacientů nebyla prokázána přítomnost estrogenních receptorů v retroperitoneální fibrotické tkáni. Přítomnost estrogenních receptorů nebyla rovněž prokázána ani v našem případě idiopatické RPF. Neschopnost detekovat přítomnost estrogenních receptorů může být zapříčiněna malou citlivostí použitých detekčních metod, případně nízkou denzitou estrogenních receptorů v retroperitoneální fibrotické tkáni. Tento fakt a skutečnost, že převážnou většinu pacientů s idiopatickou RPF tvoří muži, vede k názoru, že estrogenní receptory nehrají významnou roli v patogenezi a v léčbě tohoto onemocnění. Mechanismus účinku tamoxifenu v terapii idiopatické RPF tedy nebyl doposud odhalen. Jedním ze zvažovaných účinků tamoxifenu je i jeho možný vliv na inhibici proteinkinázy C, enzymu který katalyzuje fosforylaci proteinů nezbytnou pro proliferaci buněk myšího lymfomu (46, 47). Efekt tamoxifenu se obvykle dostavuje pomalu, ale byly popsány případy kompletní regrese. Předčasné ukončení terapie tamoxifenem může vést ke vzplanutí procesu. Proto by měla být terapie idiopatické RPF tamoxifenem dlouhodobá.
V námi popisovaném případu idiopatické RPF byly prvními a diskrétními projevy onemocnění přítomnost bolestí dolní části zad a hmotnostní úbytek. V případě výskytu těchto symptomů a při současném nálezu ložiskového procesu postihujícího retroperitoneum je nutno pomýšlet na diagnózu RPF. Z důvodu vyloučení autoimunitního onemocnění nebo malignity postihující retroperitoneum musí být k diagnostice využity postupy zahrnující zobrazovací metody a zejména ověření diagnózy histologickým vyšetřením. Terapie idiopatické RPF je závislá na stadiu onemocnění. Doporučení pro léčbu idiopatické RPF doposud nebyla vytvořena. Existují však případy úspěšného použití některých léků, jako jsou glukokortikoidy, imunosupresiva a tamoxifen. Retroperitoneální proces v našem případě regredoval po použití léčby kombinující tamoxifen s glukokortikoidy. Z důvodu obstrukce močových cest musela být terapie doplněna o inzerci JJ stentu do obou ureterů.
MUDr. Petr Němec, Ph.D.
Revmatologická ambulance II. interní kliniky
Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta Masarykovy Univerzity
Pekařská 53
656 91 Brno
e-mail: petr.nemec@fnusa.cz
Zdroje
1. Ormond J. Bilateral ureteral obstruction due to envelopment and compression by an inflammatory retroperitoneal process. J Urol 1948; 1072-9.
2. McDougal WS, MacDonell RC Jr. Treatment of idiopathic retroperitoneal fibrosis by immunosuppression. J Urol 1991; 145 : 112–4.
3. Hoffman WW, Trippel OH. Retroperitoneal fibrosis: etiological considerations. J Urol 1961; 86 : 222–31.
4. Amis ES Jr. Retroperitoneal fibrosis. AJR Am J Roentgenol 1991; 157 : 321 – 9.
5. Mitchinson MJ. Chronic periaortitis and periarteritis. Histopathology 1984; 8 : 589–600.
6. Parums DV. The spectrum of chronic periaortitis. Histopathology 1990; 16 : 423–31.
7. Kinzbrunner B, Ritter S, Domingo J, Rosenthal CJ. Remission of rapidly growing desmoid tumors after tamoxifen therapy. Cancer 1983; 52 : 2201–4.
8. Clark CP, Vanderpool D, Preskitt JT. The response of retroperitoneal fibrosis to tamoxifen. Surgery 1991; 109 : 502–6.
9. Loffeld RJ, van Weel TF. Tamoxifen for retroperitoneal fibrosis. Lancet 1993; 341 : 382.
10. Frankart L, Lorge F, Donckier J. Tamoxifen for retroperitoneal fibrosis. Postgrad Med J 1997; 73 : 653–4.
11. Owens LV, Cance WG, Huth JF. Retroperitoneal fibrosis treated with tamoxifen. Am Surg 1995; 61 : 842–4.
12. Bourouma R, Chevet D, Michel F, Cercueil JP, Arnould L, Rifle G. Treatment of idiopathic retroperitoneal fibrosis with tamoxifen. Nephrol Dial Transplant 1997; 12 : 2407–10.
13. Ozener C, Kiris S, Lawrence R, Ilker Y, Akoglu E. Potential beneficial effect of tamoxifen in retroperitoneal fibrosis. Nephrol Dial Transplant 1997; 12 : 2166–8.
14. Chambers JC, McGovern K. Tamoxifen for retroperitoneal fibrosis. Palliat Med 2005; 19 : 163–4.
15. Ergun I, Keven K, Canbakan B, Ekmekci Y, Erbay B. Tamoxifen in the treatment of idiopathic retroperitoneal fibrosis. Int Urol Nephrol 2005; 37 : 341–3.
16. van Bommel EF, Hendriksz TR, Huiskes AW, Zeegers AG. Brief communication: tamoxifen therapy for nonmalignant retroperitoneal fibrosis. Ann Intern Med 2006; 144 : 101–6.
17. Vaglio A, Greco P, Buzio C. Tamoxifen therapy for retroperitoneal fibrosis. Ann Intern Med 2006; 144 : 619. author reply 619–20.
18. Parums DV, Brown DL, Mitchinson MJ. Serum antibodies to oxidized low-density lipoprotein in chronic periaortitis. Arch Pathol Lab Med 1990; 114 : 383–7.
19. Vaglio A, Corradi D, Manenti L, Ferretti S, Garini G, Buzio C. Evidence of autoimmunity in chronic periaortitis: a prospective study. Am J Med 2003; 114 : 454–62.
20. Littlejohn JO, Keystone EC. The association of retroperitoneal fibrosis with systemic vasculitis and HLA-B27: a case report and review of literature. J Rheumatol 1981; 8 : 665–9.
21. De La Iglesia Martinez F, Grana Gil J, Gomez Veiga F, et al. The association of retroperitoneal fibrosis and ankylosing spondylitis. J Rheumatol 1992; 19 : 1147–9.
22. Ter Maaten JC, Franssen CFM, Daenekkindt AA, Hoorntje SJ. Triple Wegener‘s granulomatosis in the urogenital tract. Nephron 1993; 63 : 358–9.
23. De Roux-Serratrice C, Serratrice J, Granel B, et al. Periaortitis heralding Wegener‘s granulomatosis. J Rheumatol 2002; 29 : 392–4.
24. Hautekeete ML, Babany G, Marcellin P, et al. Retroperitoneal fibrosis after surgery for aortic aneurysm in a patient with periarteritis nodosa: successful treatment with corticosteroids. J Intern Med 1990; 228 : 533–6.
25. Machado EBV, Michet CJ, Ballard D, et al. Trends in incidence and clinical presentation of temporal arteritis in Olmsted County, Minnesota,1950–1985. Arthritis Rheum 1988; 31 : 745–9.
26. Rasmussen TE, Hallet JW Jr. Inflammatory aortic aneurysm—a clinical review with new perspectives in pathogenesis. Ann Surg 1997; 225 : 155–64.
27. Nitecki SS, Hallett JW Jr, Stanson AW, et al. Inflammatory abdominal aortic aneurysm: new clinical implication from a case–control study. J Vasc Surg 1996; 23 : 860–9.
28. Tanaka S, Komori K, Okadome K, et al. Detection of active cytomegalo virus infection in inflammatory aortic aneurysms with RNA polymerase chain reaction. J Vasc Surg 1994; 20 : 235–43.
29. Rasmussen TE, Hallett JW Jr, Metzger RLM, et al. Genetic risk factors in inflammatory abdominal aortic aneurysms: polymorphic residue 70 in the HLA-DRB1 gene as a key genetic element. J Vasc Surg 1997; 25 : 356–64.
30. Martorana D, Vaglio A, Greco P. et al. Chronic periaortitis and HLA-DRB1*03: another clue to an autoimmune origin. Arthritis Rheum 2006; 55 : 126-30.
31. R. N. Jois, K. Gaffney, T. Marshall and D. G. I. Scott Chronic periaortitis. Rheumatology 2004; 43 : 1441–1446
32. Degesys GE, Dunnick NR, Silverman PM, Cohan RH, Illescas FF, Castagno A. Retroperitoneal fibrosis: use of CT in distinguishing among possible causes. AJR Am J Roentgenol 1986; 146 : 57–60.
33. Glazer HS, Lee JK, Levitt RG et al. Radiation fibrosis: differentiation from recurrent tumor by MR imaging. Radiology 1985; 156 : 721–6.
34. Yuh WT, Barloon TJ, Sickels WJ, Kramolowsky EV, Williams RD. Magnetic resonance imaging in the diagnosis and followup of idiopathic retroperitoneal fibrosis. J Urol 1989; 141 : 602–5.
35. Dixon AK, Mitchinson MJ, Sherwood T. Computed tomographic observations in periaortitis. a hypothesis. Clin Radiol 1984; 35 : 39–42.
36. Hricak H, Higgins CB, Williams RD. Nuclear magnetic resonance imaging in retroperitoneal fibrosis. AJR Am J Roentgenol 1983; 141 : 35–8.
37. Artom A, Gandolfo N. Idiopathic retroperitoneal fibrosis: a case report without increased levels of acute-phase reactants. Noninvasive diagnosis and treatment Ann Ital Med Int 2004; 19 : 50–3.
38. Kubota Y, Nomura Y, Tamaki M, Maeda S, Deguchi T. Four cases of idiopathic retroperitoneal fibrosis markedly responsive to steroid therapy. Hinyokika Kiyo 2005; 51 : 315–9.
39. Kardar AH, Kattan S, Lindstedt E, Hanash K. Steroid therapy for idiopathic retroperitoneal fibrosis: dose and duration J Urol 2002; 168 : 550–5.
40. Hollingworth P, Denman AM, Gumpel JM. Retroperitoneal fibrosis and polyarteritis nodosa successfully treated by intensive immunosuppression. J R Soc Med 1980; 73 : 61–4.
41. Maillart E, Laueriere L, Kassis S, Moulonguet-Doleris L, Prinseau J, Baglin A, Hanslik T. Is there an evidence-based management of idiopathic retroperitoneal fibrosis? Rev Med Interne 2006; 27 : 854–7.
42. Recloux P, Weiser M, Piccart M, Sculier JP. Ureteral obstruction in patients with breast cancer. Cancer 1988; 61 : 1904–7.
43. Benson JR, Baum M. Tamoxifen for retroperitoneal fibrosis. Lancet 1993; 341 : 836.
44. Vignon F, Bouton MM, Rochefort H. Antiestrogens inhibit the mitogenic effect of growth factors on breast cancer cells in the total absence of estrogens. Biochem Biophys Res Commun 1987; 146 : 1502–8.
45. Ramshaw AL, Parums DV. The distribution of adhesion molecules in chronic periaortitis. Histopathology 1994; 24 : 23–32.
46. Horgan K, Cooke E, Hallett MB, Mansel RE. Inhibition of protein kinase C mediated signal transduction by tamoxifen. Importance for antitumour activity. Biochem Pharmacol 1986; 35 : 4463–5.
47. Greengard P. Phosphorylated proteins as physiologic effectors. Science 1978; 199 : 146–52.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článek AbstraktaČlánek Abstrakta - pokračováníČlánek Abstrakta - pokračováníČlánek Abstrakta - pokračování
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2008 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Protilátky proti složkám komplementového systému a systémový lupus erythematodes
- Idiopatická retroperitoneální fibróza: Méně častá příčina bolestí dolní části zad. Použití tamoxifenu v terapii onemocnění
- Gitelmanův syndrom s chondrokalcinózou v dospělosti - kazuistika
- EULAR 2007 v Barceloně – zpráva z kongresu
- Abstrakta
- Vliv pohybové terapie na pohyblivost páteře a subjektivní vnímání bolesti u jedinců s ankylozující spondylitidou
- Abstrakta - pokračování
- Abstrakta - pokračování
- Abstrakta - pokračování
- Cytokiny BAFF (B-cell activating factor) a APRIL (a proliferation-inducing ligand) a jejich role u autoimunitních onemocnění
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Protilátky proti složkám komplementového systému a systémový lupus erythematodes
- Idiopatická retroperitoneální fibróza: Méně častá příčina bolestí dolní části zad. Použití tamoxifenu v terapii onemocnění
- Vliv pohybové terapie na pohyblivost páteře a subjektivní vnímání bolesti u jedinců s ankylozující spondylitidou
- Cytokiny BAFF (B-cell activating factor) a APRIL (a proliferation-inducing ligand) a jejich role u autoimunitních onemocnění
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



