-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kožní manifestace revmatoidní artritidy
(Kazuistický případ pyoderma gangrenosum)
Cutaneous manifestations of rheumatoid arthritis
(Case report: pyoderma gangrenosum)Cutaneous manifestations in rheumatoid arthritis (RA) can be divided into two groups – nonspecific and specific. Atrophy and skin fragility, colour changes and involvement of nails belong to the nonspecific manifestations. Rheumatoid nodules and nodulosis, rheumatoid vasculitis and less frequently neutrophilic dermatosis belong to the disease-specific manifestations, as well as Sweet’s syndrome and pyoderma gangrenosum (PG). This report discusses nonspecific as well as specific cutaneous manifestations of RA with focus on neutrophilic dermatosis; a case report of pyoderma gangrenosum is also included. Recently, cases of successful treatment of PG, as a cutaneous manifestation of RA, by TNF-α blockers have been described, as well as contrary cases with occurrence of a cutaneous manifestation of RA during anti TNF-α treatment as an adverse event. Description of such a patient is reported in the end of this article.
Key words:
rheumatoid arthritis, rheumatoid nodules, rheumatoid vasculitis, neutrophilic dermatosis
Autori: K. Hviščová; K. Pavelka
Pôsobisko autorov: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 18, 2010, No. 3, p. 125-131.
Kategória: Kazuistiky
Súhrn
Kožní projevy u revmatoidní artritidy (RA) můžeme rozdělit do dvou skupin - na nespecifické a specifické. K nespecifickým patří atrofie a fragilita kůže, barevné změny a možné je také postižení nehtů. Ke specifickým manifestacím pak patří revmatoidní uzly a nodulóza, revmatoidní vaskulitida a méně časté neutrofilní dermatózy. K nim řadíme Sweetův syndrom a pyoderma gangrenosum (PG). V článku jsou rozebrány jak nespecifické tak specifické kožní příznaky RA, podrobněji pak neutrofilní dermatózy z nichž pyoderma gangrenosum je doplněno i kazuistikou. V poslední době se stále častěji objevují jak případy úspěšné léčby PG jako kožního projevu RA blokátory TNF-α, tak i případy opačné, kdy se PG objevilo právě během léčby anti TNF-α jako nežádoucí účinek. To je i případ pacienta, kterého popis je uvedený v závěru článku.
Klíčová slova:
revmatoidní artritida, revmatoidní uzly, revmatoidní vaskulitida, neutrofilní dermatózyÚvod
Revmatoidní artritida (RA) je chronické zánětlivé autoimunitní onemocnění s kloubními i mimokloubními projevy, které postihuje asi 0,5-1 % evropské a severoamerické populace s lokálními rozdíly (1, 2). Vede k deformitám a destrukcím postižených kloubů, které spolu s dalšími projevy nemoci způsobují funkční omezení a mohou výrazně zhoršovat kvalitu života pacientů. Je známé, že onemocnění zkracuje život přibližně o 7–10 let (3). Etiologie nemoci je doposud neznámá, ale předpokládá se genetická predispozice jedince a vliv faktorů prostředí (bakterie, viry, kouření), které spouštějí autoimunitní mechanismy.
V posledních letech se výrazně změnila strategie léčby RA, při které se důraz klade na časnou diagnostiku, časné zahájení léčby s potlačením zánětu, navozením remise a zpomalením rentgenové progrese. Nové poznatky o patogenezi a zavedení biologické léčby nám umožnily více se přiblížit těmto cílům. Agresivnější léčba by měla být zvažována hlavně u pacientů s přítomnými negativními prognostickými faktory, které predikují těžší průběh nemoci. Mezi prediktory kloubního poškození a funkčního omezení u časné artritidy patří pozitivita revmatoidních faktorů (RF), vysoká hladina anti-CCP protilátek, vysoké reaktanty akutní fáze, přítomnost „sdíleného epitopu“ (HLA-DRB1*0401), vyšší počet oteklých a bolestivých kloubů, přítomnost erozí, ženské pohlaví a horší funkční skóre (HAQ) (4, 5, 6). Je důležité si také uvědomit, že kloubní eroze vznikají velmi časně a to již v prvních 3 letech od vzniku nemoci (7).
Kromě klasických systémových klinických příznaků (únava, subfebrilie, hubnutí) a kloubních příznaků (otok, bolest a ztuhlost s vývojem deformit), může mít nemoc také extraartikulární projevy. K nim řadíme postižení plicní, kardiální, oční, renální, hematologické, neurologické a kožní, které bude podrobně rozebráno.
Kožní manifestace revmatoidní artritidy
Kožní projevy u RA můžeme rozdělit do dvou skupin – na nespecifické a specifické.
1. Nespecifické kožní projevy
Mezi nespecifické kožní změny patří atrofie kůže, která vede k větší fragilitě a k lehké tvorbě hematomů. Za tyto projevy obvykle může chronická terapie glukokortikoidy. Kůže prstů může být bledá a průhledná. Vaskulární změny mohou vést k palmárnímu erytému a konečky prstů mohou mít namodralou barvu podobně jako u Raynaudova fenoménu (8). Naopak zarudnutí nad postiženým kloubem není typické pro RA a mohlo by svědčit spíše pro septickou nebo pro krystalovou artritidu.
U pacientů s RA není neobvyklé ani postižení nehtů, ale pro dané onemocnění není specifické, jako je např. pro psoriatickou artritidu dolíčkování nehtů, hyperkeratóza a onycholýza, která patří dokonce k diagnostickým kritériím této choroby. U RA se popisuje podélné rýhování (onychorhexis), paličkovité prsty (clubbing nails), periunguální erytém s teleangiektaziemi a onycholýza (9). Třískovité hemoragie a infarkty nehtového lůžka jsou již projevem vaskulitidy asociované s RA.
2. Specifické kožní projevy
Ke specifickým kožním manifestacím patří:
a. Revmatoidní uzly
Klasické revmatoidní uzly jsou nejčastějším extraartikulárním projevem RA a vyskytují se přibližně u 25 % pacientů. Výrazně vyšší incidence (75 %) je přítomná u pacientů s Feltyho syndromem asociovaným s RA. Uzly jsou častější u bílé rasy, postihují více muže než ženy a častější je výskyt u séropozitivní RA. Haplotyp HLA-DR4 (který zahrnuje heterogenní skupinu alel HLA-DRB1) je prediktorem vzniku subkutánních revmatoidních uzlů a také těžšího průběhu RA. Obecně uzly vznikají pozdě v průběhu choroby, ale výjimečně mohou předcházet kloubnímu postižení (10). Mohou být solitární i mnohočetné, obvykle jsou nebolestivé a nevyžadují specifickou léčbu, ale nepříjemná může být lokalizace na ploskách nohou a v tom případě se chirurgicky odstraňují (11). Po výkonu ale nelze vyloučit riziko infekce či znovuvytvoření. Uzly leží buď hluboko v podkoží, kde často přiléhají ke šlaše, burze, nebo k periostu anebo se nacházejí povrchově v epidermis, kde jsou volně pohyblivé. Postižená jsou často místa vystavená většímu tlaku nebo opakovanému dráždění, např. extenzorové části předloktí, klouby na rukou, plosky nohou, Achillovy šlachy, okcipitální oblast a sakrální prominence (11).
Uzly jsou většinou benigní záležitostí, ale když dojde k porušení kožního krytu, může následně vzniknout infekce, ulcerace nebo dokonce gangréna uzlu (10). Při úspěšné léčbě chorobu modifikujícími léky (DMARDs) mohou revmatoidní uzly regredovat, ale paradoxně může také docházet k potenciaci jejich vzniku během léčby methotrexátem a to i přes snížení celkové aktivity nemoci (11). Termín, který se používá pro vznik uzlů během terapie methotrexatem je akcelerovaná revmatoidní nodulóza. Častěji jsou postiženy séropozitivní muži a uzly často vznikají zcela nově i když nebyly přítomné před zahájením léčby methotrexátem. Tvoří se nejvíce v oblasti šlach prstů rukou nad MCP a PIP klouby (10).
Histologicky je pro revmatoidní uzly typická centrální fibrinoidní nekróza, která je obklopená palisádovitými podlouhlými histiocyty a periferie je konečně tvořená pojivovou tkání s chronickými zánětlivými buňkami (10). Tento nález bývá označován jako nekrobiotický granulom.
V rámci diferenciální diagnostiky podkožních uzlů je potřeba pomýšlet také na tofózní dnu, sarkoidózu, amyloidózu, cystický ganglion, fibrom, xanthom atd. (10).
b. Revmatoidní nodulóza
Tento pojem je vymezený pro mnohočetné subkutánní uzly u pacientů s intermitentním mírným klinickým průběhem artritidy, které bývají asociované s minimálními nebo žádnými systémovými projevy a jen s minimálním rentgenovým postižením (často s přítomností cystických kostních lézí). Nemocní jsou typicky muži ve středním věku, u nichž se většinou nevyvine klasická forma RA (10).
c. Revmatoidní vaskulitida (RV)
Vaskulitida je klinicky nejzávažnějším mimokloubním projevem RA a projevuje se pestrými kožními i systémovými příznaky. I když prevalence RV je nízká, systémové projevy revmatoidní vaskulitidy jsou častější než jiné vaskulitidy (Wegenerova granulomatóza – WG či polyarteritis nodosa – PAN) (10). Vaskulitida se objevuje obvykle u séropozitivních pacientů, častěji u mužů, kuřáků, s dlouholetým průběhem nemoci (v průměru 10–14 let od vzniku RA) (10). Možný je vznik vaskulitidy u nemocných s dobře kontrolovanou kloubní aktivitou. Podobně jako u revmatických uzlů i zde byla prokázána genetická souvislost mezi HLA-DRB1 a těžším průběhem RA s možnou vaskulitidou (11). Mezi faktory asociované se vznikem RV patří vysoký titr RF, kloubní eroze, přítomnost jiných extraartikulárních manifestací a revmatoidních uzlů, mužské pohlaví a vyšší počet DMARDs použitých při léčbě RA (hlavně předchozí použití D-penicilaminu a azathioprinu) (10). Nejsilnější asociaci vykazuje séropozitivita.
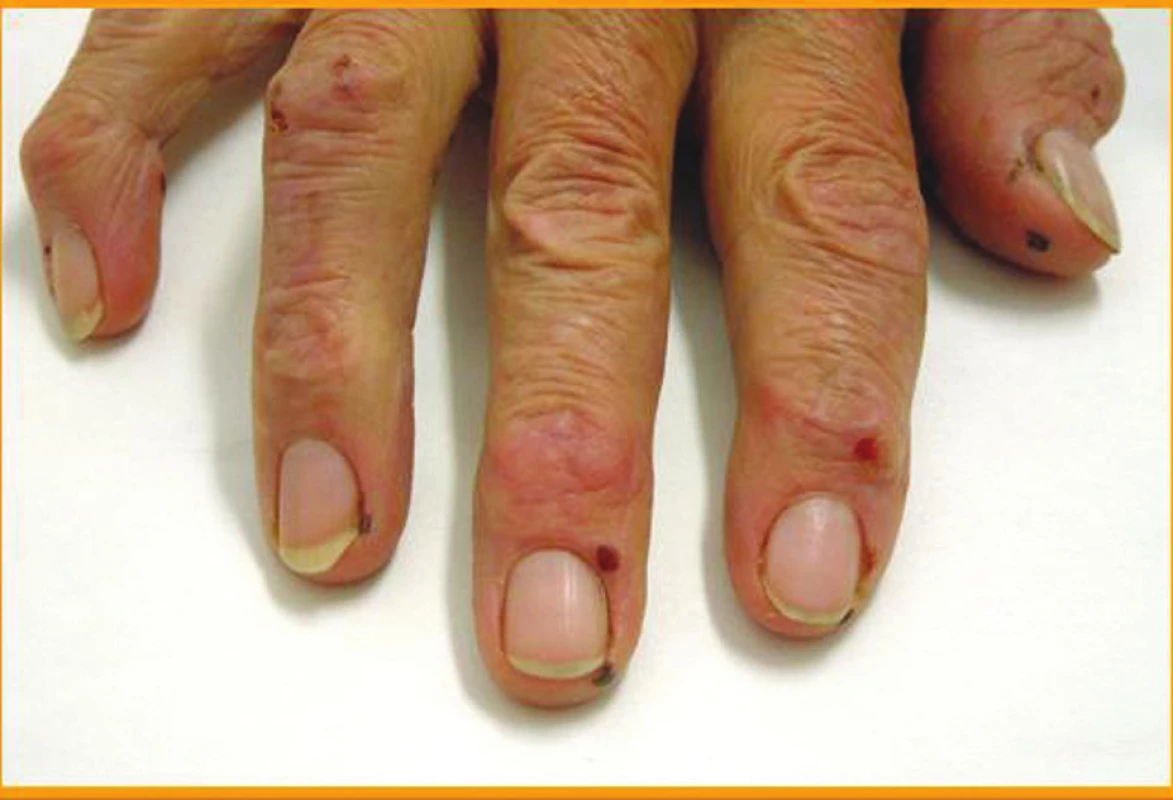
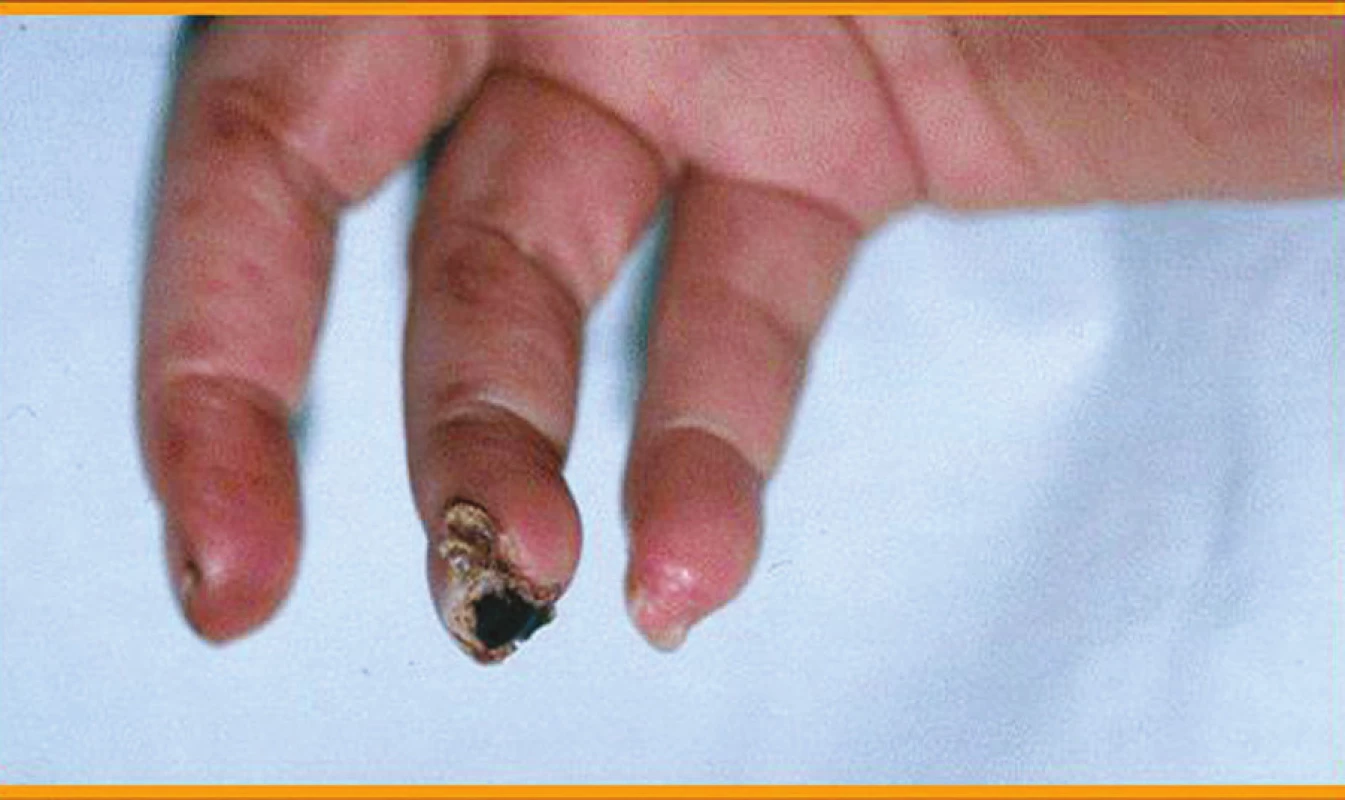
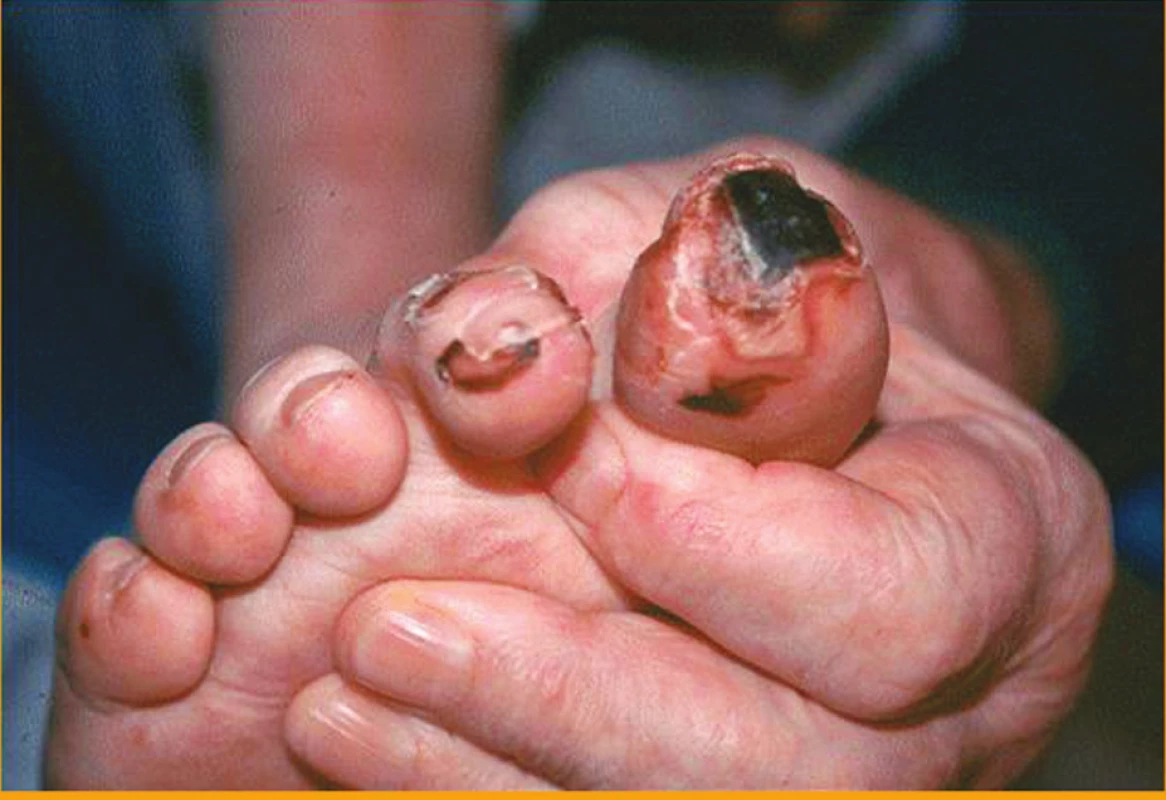
Klinické kožní nálezy související s vaskulitidou jsou nejčastěji ischemické kožní vředy (hlavně v oblasti dolních končetin) (obr. 1), petechie nebo purpura, třískovité hemoragie (obr. 2) a infarkty nehtového lůžka, gangrény konečků prstů (obr. 3 a 4), nespecifický makulopapulózní nebo nodulární erytém, livedo reticularis (10).
Obr. 1. Vaskulitické kožní vředy DK. 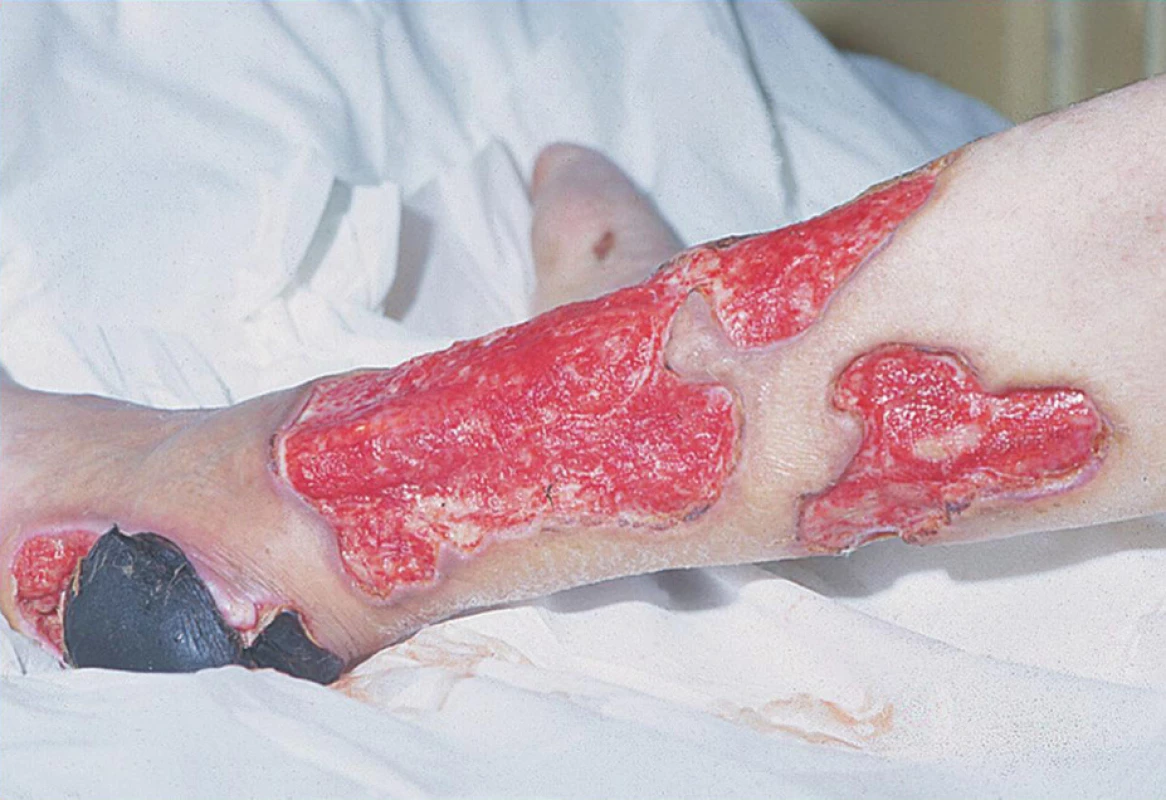
Mezi systémové klinické projevy patří únava, hubnutí a horečky. Asi u čtvrtiny pacientů bývá splenomegalie, hepatomegalie, méně časté jsou perikarditida, pleuritida, alveolitida. Oční postižení (skleritida, keratitida) je některými kliniky považována za první projev vaskulitidy a může předcházet vývoji fatální vaskulitidy. Postižení gastrointestinálního traktu se vyskytuje asi u 10 % nemocných a projevit se může perforací střeva s náhlou příhodou břišní. Renální postižení se objevuje také asi u desetiny pacientů a zaznamenány jsou smíšené močové nálezy s proteinurií a hematurií. Naopak častými jsou projevy neurologické, které se vyskytují až u 50 % nemocných s RV. Nejčastěji se jedná o mononeuritis multiplex nebo senzorickou a motorickou periferní neuropatii (13).
Revmatoidní vaskulitida představuje spojitý proces cévního postižení a probíhajícího zánětu u pacienta s RA. Proces začíná proliferací intimy, která způsobí zúžení cévy. Po depozici imunokomplexů a vychytávání komplementu dochází k intravaskulární trombóze (s možnou rekanalizací), která pak vede k fibrinoidní nekróze stěny cévy (10, 11). Škála postižení u RA sahá od postkapilární venulitidy, přes leukocytoklastickou vaskulitidu postihující malé a střední cévy až po obraz nekrotizující granulomatózní vaskulitidy charakteru PAN (polyarteritis nodosa) (10, 13). Různé typy postižení se mohou objevit i u jednoho pacienta zároveň (10).
Postižení drobných cév se na kůži může klinicky projevit jako tzv. hmatná purpura, petechie, třískovité hemoragie, makuly, papuly, urtikaria ale také jako periunguální infarkty, vředy a periferní neuropatie (10).
Leukocytoklastická vaskulitida, která kromě depozice imunokomplexů je typická také neutrofilní infiltrací, se obvykle manifestuje jako čistě kožní projev purpury a urtikarie, obvykle na dolních končetinách a může být i zcela asymptomatická. Vzácně může být spojena i se systémovými projevy (10, 12).
Nekrotizující granulomatózní vaskulitida, která má na rozdíl od předešlé formy špatnou prognózu, může predikovat následnou infarzaci střeva či jiných vnitřních orgánů. Obvykle jsou pak přítomné i další extraartikulární projevy (10).
Z laboratorních nálezů je přítomná pozitivita RF, hypokomplementémie, vysoké hladiny cirkulujících imunokomplexů a často i kryoglobuliny. Dále je zvýšená sedimentace, častá je anémie, leukocytóza s eozinofilií nebo leukopenie a trombocytóza (10, 13).
Terapie revmatoidní vaskulitidy musí být přísně individuální v závislosti na typu projevů (11). Některé nevyžadují žádný terapeutický zásah (např. infarkty nehtového lůžka), leukocytoklastickou vaskulitidu obvykle zmírní střední dávky glukokortikoidů a agresivní terapii naopak vyžadují infarkty prstů, mononeuritis multiplex a těžké systémové projevy (10). Standardně se u systémové manifestace podávají vysoké dávky glukokortikoidů a cyklofosfamid, nejlépe v pulzní formě (10). V některých případech je možné použít methotrexát (polyneuropatie), plazmaferézu (mononeuritis multiplex, gangrény a vředy dolních končetin).
Diferenciálně diagnosticky je někdy těžké odlišit polyarteritis nodosa a je nutné myslet i na vaskulitidu při jiných onemocněních (SLE, WG, hepatitida C atd.) (10).
d. Feltyho syndrom
Feltyho syndrom je triáda definovaná jako kombinace revmatoidní artritidy, splenomegalie a leukopenie, u které se často objevují také kožní projevy. Konkrétně to jsou revmatoidní uzly (u 76 % pacientů), nebo hyperpigmentace a ulcerace na dolních končetinách (22 %) (10). Jejich příčina je multifaktoriální, ale nejčastěji vznikají v terénu žilní insuficience, na který nasedá vaskulitida. Vředy jsou chronické, hluboké, hlavně v oblasti kotníků a holení a obvykle jim předchází jen hyperpigmentace způsobená extravazací erytrocytů (10). Často je u Feltyho syndromu přítomná hepatomegalie s portální hypertenzí a lymfadenopatie (14).
Asi 1 % nemocných s RA vyvine tento syndrom. Jedná se obvykle o pacienty s dlouholetou destruktivní séropozitivní RA, u nichž kloubní aktivita v době vzniku může být nízká a častěji jsou u nich přítomné mimokloubní projevy. Nejzávažnější komplikací Feltyho syndromu jsou těžké bakteriální infekce, které jsou až 20x četnější než u jiných pacientů s RA (14) a jsou zodpovědné za vysokou mortalitu těchto nemocných. Až 25 % jich umírá na sepsi (10). Za zmínku stojí i to, že nemocní s Feltyho syndromem mají vyšší riziko vzniku kožního melanomu (hlavně v prvním roce manifestace) a 13x vyšší je riziko non-Hodgkinských lymfomů (10). Přibližně 80 % pacientů má pozitivní antinukleární protilátky, z dalších laboratorních zjištění jsou přítomné vyšší hladiny cirkulujících imunokomplexů, trombocytopenie a popsána byla i genetická asociace s HLA-DR4 (10).
Leukopenie je hlavně na vrub neutropenie a v případě hodnot polymorfonukleárů pod 1000 mm3 je jasná korelace s vyšším výskytem závažných infekčních komplikací (11). Terapeuticky může být tehdy podáván G-CSF (kolonie stimulující faktor granulocytů – Neupogen®), ale po zvýšení hodnot leukocytů, nelze vyloučit zhoršení artritidy či vaskulitidy (14). V minulosti byla při významné leukopenii s recidivujícími bakteriálními infekcemi, nehojícími se vředy a nedostatečnou odpovědí na terapii indikována splenektomie. Ne vždy ale po ní došlo k vzestupu hodnot neutrofilů. To svědčí pro multifaktoriální etiologii leukopenie, která nekoreluje s velikostí sleziny.
e. Neutrofilní dermatózy
Do této skupiny jsou řazeny neinfekční kožní poruchy, histologicky charakterizované neutrofilním zánětlivým buněčným infiltrátem bez přítomnosti primární leukocytoklastické vaskulitidy (12).
Sweetův syndrom
Je to vzácný stav, nazývaný také „akutní febrilní neutrofilní dermatóza“, který byl poprvé popsán v roce 1964. Základní jeho rysy, jak vyplývá již z popisného názvu jsou febrilie, zvýšený počet neutrofilů a bolestivé erytematózní kožní léze v horní části dermis s převahou neutrofilů. Typická je také promptní odpověď na léčbu glukokortikoidy. Klinické varianty popisované v literatuře jsou tyto tři (15):
- klasický typ – asociovaný nejčastěji s infekcí horních dýchacích cest či GI traktu, s nespecifickým střevním zánětem (IBD – inflammatory bowel disease) nebo s těhotenstvím
- typ asociovaný s malignitou – kde kožní léze může být prvním projevem nádorového onemocnění nebo také předzvěstí recidivy nádoru u již léčeného pacienta (týká se hematologických malignit i solidních tumorů)
- léky indukovaný typ – nejčastěji navazující na podání G-CSF (kolonie stimulující faktor granulocytů) (12, 15)
Další nemoci, které mohou být spojené se Sweetovým syndromem jsou Behćetova nemoc, erythema nodosum, relabující polychondritida, revmatoidní artritida, sarkoidóza a autoimunitní nemoci štítné žlázy (15).
Klinicky jsou přítomné ojedinělé nebo vícečetné bolestivé a zarudlé papuly, pustuly nebo noduly. Větší léze mohou splývat. Častý je výrazný edém kůže. Lokalizace je nejčastěji na horních nebo dolních končetinách (extenzorové části), také na obličeji nebo na trupu. Kromě kožní symptomatologie mohou být přítomné i doprovázející artralgie nebo artritidy, myalgie, bolesti hlavy a únava. Zaznamenány byly i orální ulcerace a oční léze a z ostatních orgánů můžou být postiženy i uši, ledviny, plíce, játra, slezina, svaly, kosti a CNS (15).
Lékem první volby jsou glukokortikoidy (GK) ve vyšších dávkách (Prednison 1 mg/kg/den), po kterém je obvyklá rychlá terapeutická odpověď a terapie může být po detrakci úplně ukončena po několika týdnech. U rezistentních případů byly podávány pulzy GK (1000 mg/den, 3–5 dnů) s dobrým efektem. GK byly použity také lokálně ve formě injekcí nebo mastí či gelů. Z dalších medikamentů se uvádějí také kalium jodid či kolchicin, méně často pak indomethacin, cyklosporin, dapson. V případě sekundární infekce jsou na místě antibiotika. Recentní jsou data o účinnosti terapie antagonisty TNF-α (infliximab, etanercept) a antagonistem receptoru IL-1 (anakinra) (15).
Pyoderma gangrenosum
Jedná se o vzácný stav, kterého přesná roční incidence není známá, ale odhaduje se na 3–10 případů na milion obyvatel (16). Poprvé byla tato klinická jednotka popsaná v roce 1930 na Mayo klinice. Tento stav může být idiopatický nebo je často asociovaný s jiným základním onemocněním (15) – nejčastěji s nespecifickými střevními záněty, revmatoidní artritidou a lymfoproliferativními malignitami (tab. 1). Klinicky se může objevit několik variant pyoderma gangrenosum (tab. 2).
Tab. 1. Systémová onemocnění asociovaná s pyoderma gangrenosum (17). 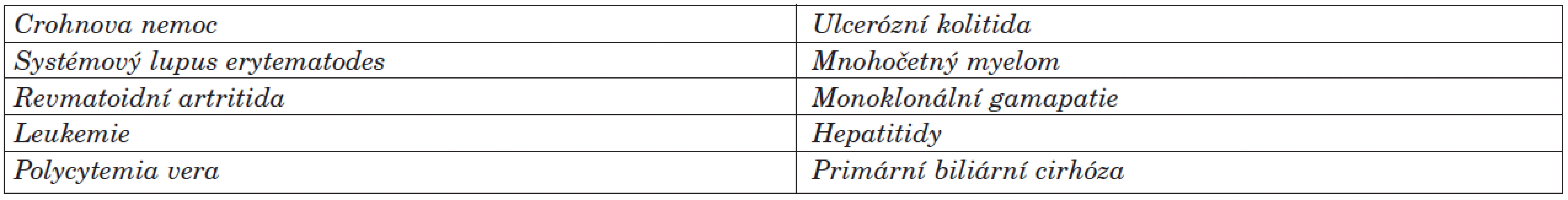
Tab. 2. Klinické varianty pyoderma gangrenosum (15). 
Nejčastější forma – ulcerózní je asociovaná právě s RA. Častěji se vyskytuje u žen, u kterých je nález obvykle těžší. V jednotlivých pracích je asociace s RA popisována v průměru asi ve 12 % (od 4 do 50 %). Výskyt nesouvisí s aktivitou RA a byl prezentován i názor, že se jedná o nezávislou chorobní jednotku, ne o kožní manifestaci jiných nemocí včetně RA (10).
Klasická ulcerózní léze začíná jako bolestivá erytematózní nebo nafialovělá papula či pustula, nejčastěji na dolních končetinách, která se rychle vyvine do vředu s centrální nekrózou a s nepravidelnými navýšenými (podminovanými) okraji. Periferie léze je výrazně zarudlá až fialová a indurovaná. Spodina vředu je nekrotická, rozbředlá a může zasahovat přes celou dermis až do podkožní tkáně. Hojení pak vyústí do vytvoření kribriformní jizvy (15). Morfologicky podobně vypadá i peristomální léze. Na rozdíl od nich pak pustulózní, bulózní a vegetativní forma je obecně více povrchová. Při vzniku nových lézí je popsaný fenomén patergie (vznik nových ulcerací po minimálním traumatu), proto chirurgický debridement vředů je kontraindikovaný (15) a sporná je tedy také injekční aplikace léčiv přímo do ulcerací. Extrakutánní projevy (celkové a orgánové) jsou podobné jako u Sweetova syndromu (únava, febrilie, artralgie, myalgie, postižení sliznice dutiny ústní, očí, plic, srdce, kostí, jater, sleziny, CNS).
Diagnóza je stanovena na podkladě (18):
- odpovídajícího klinického obrazu
- histopatologického nálezu
- vyloučení jiné etiologie vzniku vředů
- negativní kultivace z defektu.
- Laboratorně je přítomná leukocytóza s převahou neutrofilů a zvýšená sedimentace erytrocytů.
Histologický nález není specifický a závisí od trvání léze a od místa odběru materiálu. Kožní biopsie z erytematózního okraje v časné fázi ulcerozní varianty prokazuje perivaskulární zánětlivý infiltrát lymfocytů s otokem endoteliálních buněk. Později po odběru materiálu přímo z ulcerace je nález charakterizován denzním infiltrátem s polymorfonukleárními leukocyty a s centrální nekrózou. Na okraji léze už pak nejsou jen perivaskulárně uložené lymfocyty, ale také trombóza cév s extravazovanými erytrocyty (15).
Vztah mezi neutrofily a TNF-α (tumor necrosis factor-α) není doposud jasný, ale popsaná je zvýšená aktivace neutrofilů v souvislosti s jeho produkcí. Dále je známá zvýšená exprese adhezních molekul a uvolňování chemokinů a cytokinů z fibroblastů, za které může také TNF-α. Ten má pak silný chemotaktický účinek na neutrofily, které mají u pyoderma gangrenosum klíčovou roli v místě zánětu (17).
Terapeuticky jsou lékem první volby podobně jako u Sweetova syndromu glukokortikoidy a to lokálně i systémově (Prednison 0,5–1 mg/kg/den, při nedostatečné účinnosti 2 mg/kg/den), u rezistentních případů také v podobě i.v. pulzů 1000 mg metylprednisolonu několik dnů po sobě (15). Z ostatních medikamentů byly v jednotlivých pracích uváděny nejčastěji cyklosporin (2–5 mg/kg/den), tacrolimus (i v lokální formě), dapson, azathioprin, cyklofosfamid, methotrexát, mykofenolát mofetil, chlorambucil, minocyklin (10, 15, 17, 18, 19). Pomocnými metodami mohou být i hyperbarická oxygenoterapie a plazmaferéza (15). V poslední době se stále častěji objevují také případy úspěšné léčby blokátory TNF-α a to s výhodou u pacientů, kde je pyoderma gangrenosum asociovaná s IBD nebo s RA (20, 21, 22, 23, 24). Naopak jsou popsané i případy, kdy se pyoderma gangrenosum objevila právě během léčby anti TNF-α (infliximab, adalimumab) (22, 25). Nabízí se tedy otázka, na kterou zatím neexistuje v literatuře jasná odpověď a to jestli vznik pyoderma gangrenosum je lékově specifickým nežádoucím účinkem nebo je to „class“ efekt celé skupiny TNF-α antagonistů. Kromě toho nelze vyloučit ani možnost, že v uvedených kazuistických případech léčba infliximabem a adalimumabem selhala v rámci prevence vzniku pyoderma gangrenosum asociované s RA.
Pro větší pravděpodobnost „class efektu“ celé skupiny anti TNF-α léků by mohla svědčit i následující kazuistika pacienta.
Popis případu
Jedná se o 68letého muže, nekuřáka se séronegativní revmatoidní artritidou, která mu byla diagnostikována v roce 1992 v 50 letech věku. Po interní stránce nikdy nestonal, v rodinné anamnéze nebyly revmatické nemoci. Po stanovení diagnózy RA byla zahájená terapie Tauredonem, ale pro proteinurii byla tato léčba po 2 letech ukončena. Nasazena pak byla terapie methotrexátem (MTX) v postupně se zvyšující dávce až do 17,5 mg týdně v kombinaci s glukokortikoidy. V úvodu byl pozorován dobrý klinický efekt, ale později došlo znovu ke zvýšení aktivity, proto byl asi na půl roku přidán do kombinace k MTX i cyklosporin A, ale bez dostatečného efektu. Pro přetrvávající vysokou aktivitu, klinickou i humorální (hodnoty FW a CRP dlouhodobě 50–100), byl nemocný v rámci studie 6 měsíců léčený interferonem-beta, nadále v kombinaci s MTX. Tato terapie také neměla dostatečný efekt.
Již v prvních 5 letech trvání nemoci došlo i přes intenzivní imunosupresivní léčbu k rentgenové progresi na III. stadium v oblasti nohou a III.–IV. stadium v oblasti rukou. Přibližně po 10 letech trvání choroby (v letech 2000–2004) dospěl pacient k implantaci totálních endoprotéz postupně všech čtyř nosných kloubů dolních končetin, z indikace koxitidy a sekundární gonartrózy.
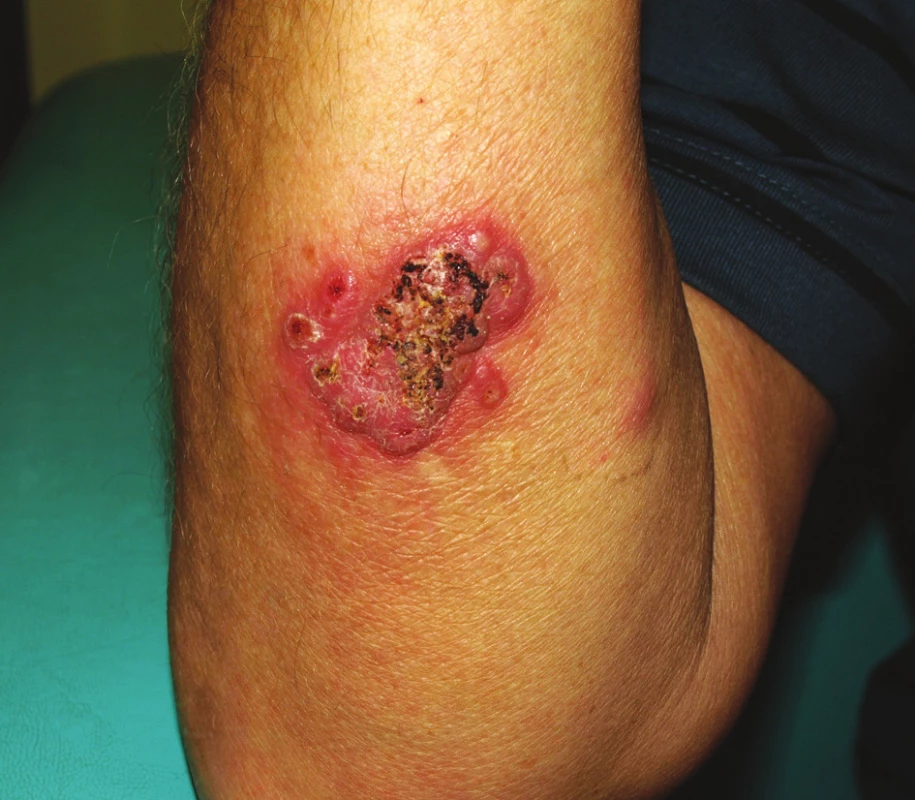
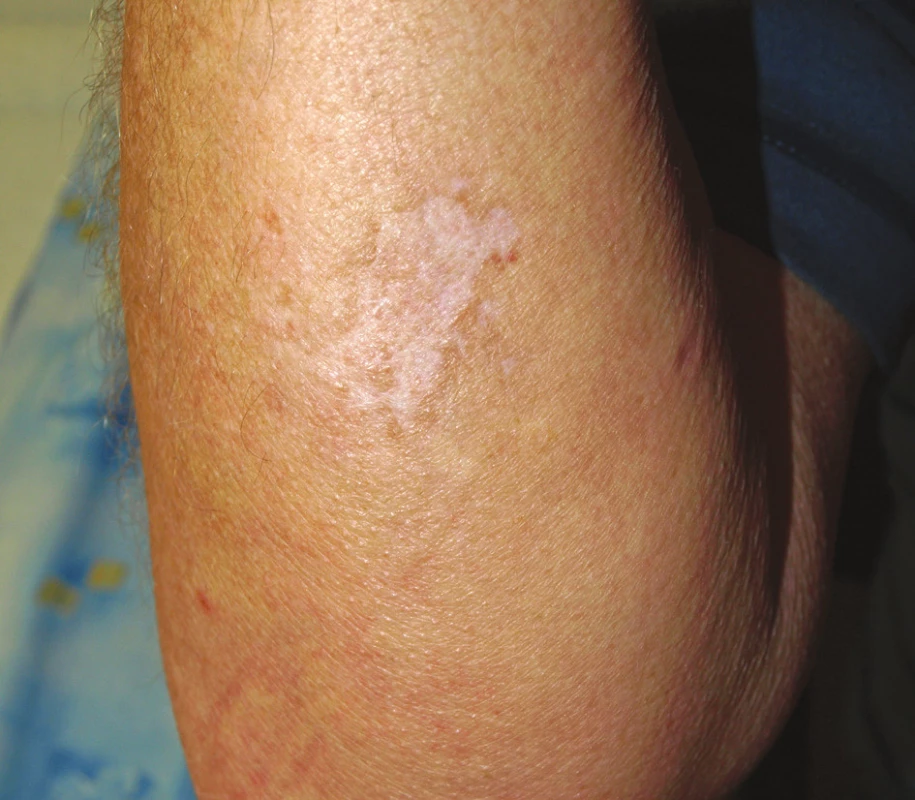
V roce 2003 byla u pacienta v rámci klinického hodnocení zahájená biologická léčba přípravkem certolizumab pegol (Cimzia), který je monoklonální protilátkou proti TNF-α. Léčba byla podávána v kombinaci s MTX nejprve ve 24 týdnů trvající zaslepené fázi, poté byl nemocný zařazen do otevřené extenze. Při této terapii došlo postupně k potlačení laboratorní aktivity nemoci, klinicky se intermitentně v prvních měsících extenze objevovala artritida zápěstí, pravého lokte nebo některých MCP kloubů. Postupně byla artritida zachycena při vyšetření jen výjimečně. Po 6 letech této léčby došlo v dubnu 2009 ke vzniku erytematózních pustul hlavně v oblasti pravého předloktí, menší léze byly na levé paži a v oblasti pravého ústního koutku. K jejich vzniku došlo bez předchozí anamnézy traumatu v uvedených lokalizacích. Po několika dnech zvětšování se lézí došlo k jejich splynutí a k spontánní poruše kožního krytu (obr. 5). Nemocný se dostavil k dermatologickému vyšetření již s ulcerací velikosti asi 5 cm v nejdelším průměru a provedené byly jednak stěry z defektů na kultivaci, které byly negativní a také biopsie ze všech ložisek. Podle dostupné dokumentace histologické nálezy podporovaly diagnózu pyoderma gangrenosum a na podkladě doporučení z literatury byly terapeuticky zvoleny kortikoidy. Konkrétně byly opakovaně aplikovány intramuskulární injekce Diprophosu a lokálně kortikoidní mast. Vzhledem k tomu, že se v poslední době objevily údaje o možnosti vzniku pyoderma gangrenosum jako nežádoucího účinku anti TNF-α léčby, byla terapie certolizumabem ukončena. Léze se zhojily jizvou (obr. 6) a během dalšího roku sledování nedošlo u pacienta k recidivě kožních ulcerací ani nedošlo ke vzplanutí aktivity RA, která je doposud léčená střední dávkou MTX (12,5 mg týdně p.o.) a nízkou dávkou glukokortikoidu (Prednison 5 mg denně).
Závěr
Na základě uvedeného případu lze tedy předpokládat, že u našeho pacienta se mohlo jednat o nežádoucí účinek anti TNF léčby, podobně jako prezentují i další autoři v kazuistických případech popisovaných v literatuře v posledních letech také u jiných anti TNF-α preparátů. Zdá se být více pravděpodobné, že půjde o „class“ efekt celé skupiny léků, ale nutné je další sledování a postupné zpracovávání údajů u narůstajícího počtu pacientů objevujících se v kazuistických sděleních.
MUDr. Katarína Hviščová
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Zdroje
1. Hochberg MC. Adult and juvenile rheumatoid arthitis: current epidemiological concepts. Epidemiol Ref 1981; 3 : 27-44.
2. Alamanos Y, Voulgari PV, Drosos AA. Incidence and prevalence of rheumatoid arthritis, based on the 1987 American College of Rheumatology criteria: a systematic review. Semin. Arthritis Rheum 2006; 36 : 182-8.
3. Harris ED jr. Rheumatoid arthritis: pathophysiology and implications for therapy. N Engl J Med 1990; 322 : 1277-84.
4. ĮdegĆrd S, Landewé R, van der Heijde D; Kvien TK, Mowinckel P, Uhlig T. Association of Early Radiographic Damage With Impaired Physical Function in Rheumatoid Arthritis. A Ten-Year, Longitudinal Observational Study in 238 Patients. Arthritis Rheum 2006; 54 : 68-75.
5. Syversen SW, Gaarder PI, Goll GL, et al. High anti-CCP levels and an algorithm of four variables predict radiographic progression in patients with rheumatoid arthritis: results from a 10-year longitudinal study. Ann Rheum Dis 2008; 67(2): 212-7.
6. Vencovsky J, Machacek S, Sedova L, et al. Autoantibodies can be prognostic markers of an erosive disease in early rheumatoid arthritis. Ann Rheum Dis 2003; 62 : 427-30.
7. van der Heijde DM, van Leeuwen MA, van Riel PL, van de Putte LB. Radiographic progression on radiographs of hands and feet during the first 3 years of rheumatoid arthritis measured according to Sharp’s method (van der Heijde modification). The Journal of rheumatology. 1995; 22(9): 1792-6.
8. Harris ED jr: Clinical features of rheumatoid arthritis. In: Hartus ED jr, Budd RC, Firestein GS, Genovese MC, Sergent JS, Ruddy S, Sledge CB. Kelleyęs textbook of rheumatology. 7th ed. Philadelphia: W.B. Saunders; 2005, 1055.
9. Michel C, Cribier B, Sibilia J, Kuntz Jl, Grosshans E. Nail abnormalities in rheumatoid arthritis. Br J Dematol 1997; 137 : 958-62.
10. Sayah J, English JC 3rd. Rheumatoid arthritis: A rewiev of the cutaneous manifestations. J Am Acad Dermatol 2005; 53 : 191-209.
11. Pavelka K, Rovenský J, Szilasiová A, et al. Revmatoidní artritida in: Klinická revmatologie. Galén 2003;181-197.
12. Levin J, Werth VP. Skin disorders with arthritis. Best Pract Res Clin Rheumatol 2006; 20 : 809-26.
13. Bečvář R, Tesař V, Rychlík I. Vaskulitidy v klinické praxi – diagnostika a terapie. Medprint 1994; 111-6.
14. Pinals RS: Feltyęs syndrome. In: Harris ED jr, Budd RC, Firestein GS, Genovese MC, Sergent JS, Ruddy S, Sledge CB. Kelleyęs textbook of rheumatology. 7th ed. Philadelphia: W.B. Saunders; 2005, 1101-4.
15. Cohen PR. Neutrophilic dermatoses: a review of current treatment options. J Am Acad Dermatol 2009;10 : 301-12.
16. Ruocco E, Sangiuliano S, Gravina AG, Miranda A, Nicoletti G. Pyoderma gangrenosum: an update review. J Eur Acad Dermatos Venereol 2009; 23(9): 1008-1017.
17. Powell FC, Su WP, Perry HO. Pyoderma gangrenosum: clasiffication and management. J Am Acad Dermatol 1996; 34 : 395-409.
18. Hasselmann DO, Bens G, Tilgen W, Reichrath J. Pyoderma gangrenosum: Clinical presentation and outcome in 18 cases and review of the literature. J Dtsch Dermatol Ges 2007; 5(7): 560-4.
19. Reichrath J, Bens G, Bonowitz A, Tilgen W. Treatment recommendations for pyoderma gangrenosum: an evidence-based review of the literature based on more than 350 patients. J Am Acad Dermatol 2005; 53 : 273-83.
20. Roy DB, Conte ET, Cohen DJ. The treatment of pyoderma gangrenosum using etanercept. J Am Acad Dermatol 2006; 54(3 Suppl 2): S128-34.
21. Brooklyn TN, Dunnill MG, Shetty A et al. Infliximab for treatment of PG: a randomised double blind placebo controlled trial. Gut 2006; 55(4): 505-9.
22. Stichenwirth M, Riedl E, Pehamberger H, Tappeiner G. Arch Dermatos 2008; 144 : 817-8.
23. Disla E, Quayum B, Cuppari GG, Pancorbo R. Successful use of etanercept in a patient with pyoderma gangrenosum complicating rheumatoid arthritis. J Clin Rheumatol 2004; 10(1): 50-2.
24. Pastor N, Betlloch I, Pascual JC, Blanes M, BaĖuls J, Silvestre JF. Pyoderma gangrenosum treated with anti-TNF alpha therapy (etanercept). Clin Exp Dermatol 2006; 31(1)152-3.
25. Vandevyvere K, Luyten FP, Verschueren P, Lories R, Segaert S, Westhovens R. Pyoderma gangrenosum developing during therapy with TNF-alpha antagonists in a patient with rheumatoid arthritis. Clin Rheumatol 2007; 26 : 2205-6.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2010 Číslo 3- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Léčba revmatoidní artritidy a játra
- Využití sonografie při diagnostice a léčbě revmatoidní artritidy
-
Kožní manifestace revmatoidní artritidy
(Kazuistický případ pyoderma gangrenosum) - 54. VÝROČNÍ SJEZD ČESKÝCH A SLOVENSKÝCH REVMATOLOGŮ, 12. – 15. 5. 2010 PLZEŇ
- 54. VÝROČNÍ SJEZD ČESKÝCH A SLOVENSKÝCH REVMATOLOGŮ, 12. – 15. 5. 2010 PLZEŇ
- 54. VÝROČNÍ SJEZD ČESKÝCH A SLOVENSKÝCH REVMATOLOGŮ, 12. – 15. 5. 2010 PLZEŇ
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Kožní manifestace revmatoidní artritidy
(Kazuistický případ pyoderma gangrenosum) - Léčba revmatoidní artritidy a játra
- Využití sonografie při diagnostice a léčbě revmatoidní artritidy
- 54. VÝROČNÍ SJEZD ČESKÝCH A SLOVENSKÝCH REVMATOLOGŮ, 12. – 15. 5. 2010 PLZEŇ
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy