-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučení České revmatologické společnosti pro léčbu systémové sklerodermie
Recommendations of the Czech Society for Rheumatology for the treatment of systemic sclerosis.
Systemic sclerosis (SSc) involves skin, blood vessels and different visceral organs and leads to sclerotisation and fibrosis which results in development of irreversible functional and structural changes. EUSTAR/EULAR group which addresses basic and clinical research of SSc has formulated recommendations for the treatment of SSc based on data that can be used in clinical practice. Management of SSc should be complex including early diagnostics of visceral organ involvement, selection of patients with high risk of progression and also non-pharmacological methods. In 2009 14 recommendations for therapy of different SSc organ manifestations were published and later in 2016 these recommendations were updated to 16 items. In 2016 more comprehensive recommendations of British Society for Rheumatology together with British Health Professionals In Rheumatology were published, which have in total 39 items. The main purpose of this article is to offer to clinical rheumatologists practical recommendations for treatment of SSc patients in current conditions of Czech Republic.
Keywords:
Systemic sclerosis, organ manifestations, recommendation, treatment, clinical trial.
Autoři: R. Bečvář 1; T. Soukup 2; M. Tomčík 1; P. Jansa 3
Působiště autorů: Revmatologický ústav, Revmatologická klinika 1. LF UK 1; II. interní gastroenterologická klinika, Fakultní nemocnice LF UK, Hradec Králové 2; II. interní klinika kardiologie a angiologie a Všeobecná fakultní nemocnice, 1. LF UK, Praha 3
Vyšlo v časopise: Čes. Revmatol., 25, 2017, No. 2, p. 68-84.
Kategorie: Doporučení
Souhrn
Systémová sklerodermie (SSc) postihuje kůži, cévy a řadu vnitřních orgánů a vede k fibrotizaci a sklerotizaci s následným rozvojem nevratných funkčních a morfologických změn. Skupina EUSTAR/EULAR zabývající se základním a klinickým výzkumem SSc vytvořila doporučení pro léčbu SSc založená na důkazech, která by bylo možné použít v klinické praxi. Léčba SSc musí být komplexní a zahrnuje otázky časné diagnózy postižení vnitřních orgánů, určení pacientů s rizikem progrese nemoci a také nefarmakologickou léčbu. V roce 2009 bylo vypracováno 14 doporučení pro léčbu různých orgánových manifestací SSc a v 2016 byla tato doporučení upravena na 16 bodů. V roce 2016 byla také publikována obsažnější doporučení Britské revmatologické společnosti spolu s Britskou asociací nelékařských pracovníků v revmatologii, která zahrnují celkem 39 bodů. Hlavním cílem těchto předkládaných doporučení je poskytnout praktický návod revmatologům, jak přistupovat k léčbě nemocných se SSc v současných podmínkách České republiky.
Klíčová slova:
Systémová sklerodermie, orgánové manifestace, doporučení, léčba, klinické hodnoceníÚvod
Systémová sklerodermie (SSc), také označovaná jako progresivní systémová skleróza, je chronické celkové onemocnění pojivové tkáně postihující kůži, pohybové ústrojí a některé vnitřní orgány. Je charakterizována fibrotickou sklerotizací periferních a viscerálních cév, fibroproduktivními změnami v pojivových tkáních, změnami mikrovaskularizace a poruchami humorální a celulární imunity. Postihuje třikrát až osmkrát častěji ženy než muže a manifestuje se častěji v mladším a středním věku, může se však vyskytnout v dětství i v pokročilém věku. Prevalence činí 4–253 případů na milión a roční incidence 3 až 19 nových případů na milión obyvatel (1, 2, 3). V klinickém obraze dominuje Raynaudův fenomén (RAF) s trofickými změnami, tuhnutí kůže a postižení gastrointestinálního traktu (GIT), plic, srdce a ledvin. Časná diagnostika této choroby je obtížná, pokud se prezentuje nespecifickými příznaky. Ke stanovení diagnózy SSc a zařazení do klinického hodnocení (KH) nyní slouží nová klasifikační kritéria Americké revmatologické společnosti a Evropské ligy pro revmatismu (American College for Rheumatolgy a The European League Against Rheumatism, ACR a EULAR) z roku 2013, která byla popsána v Doporučeních ČRS pro diagnostiku SSc (4).
Jelikož dosud neexistuje univerzální účinná léčba SSc, farmakologická terapie tohoto onemocnění je pouze orgánově specifická a symptomatická. EULAR a skupina zabývající se klinickým a základním výzkumem SSc (EULAR Scleroderma Trials and Research group, EUSTAR) si uvědomily potřebu vytvořit doporučení pro léčbu SSc založená na důkazech, která by bylo možné použít v klinické praxi. Podle standardních postupů EULAR byla pro tento účel vytvořena skupina odborníků. Již se objevují nové léčebné postupy vedle již několika užívaných terapií, které nebyly dosud dostatečně ověřeny, aby mohly být zařazeny do současných doporučení, ale mohou být přínosné v individuálních případech.
Hlavním cílem předkládaných doporučení je poskytnout návod revmatologům, jak přistupovat k nemocným se SSc. Nejsou zde uvedena žádná doporučení, co neprovádět a jaké jsou kontraindikace některých léčebných postupů. Právě tak nebyly zařazeny žádné farmakoekonomické úvahy, neboť se náklady na léčbu v různých zemích zásadně liší. Tato doporučení nemohou nikdy nahradit klinický úsudek ošetřujícího lékaře. Měla by být vnímána v souvislosti s individuálním zhodnocením lékaře rovnováhou mezi účinností a toxicitou léčení určitého jedince (5). Aktualizace těchto doporučení vytvořená stejným kolektivem autorů byla publikována v roce 2016 (6) (tabulka 1). Tato doporučení jsou založena na nových datech, a tak došlo k rozšíření původní verze na 17 bodů.
Tab. 1. Aktualizovaná doporučení EULAR pro léčbě systémové sklerodermie 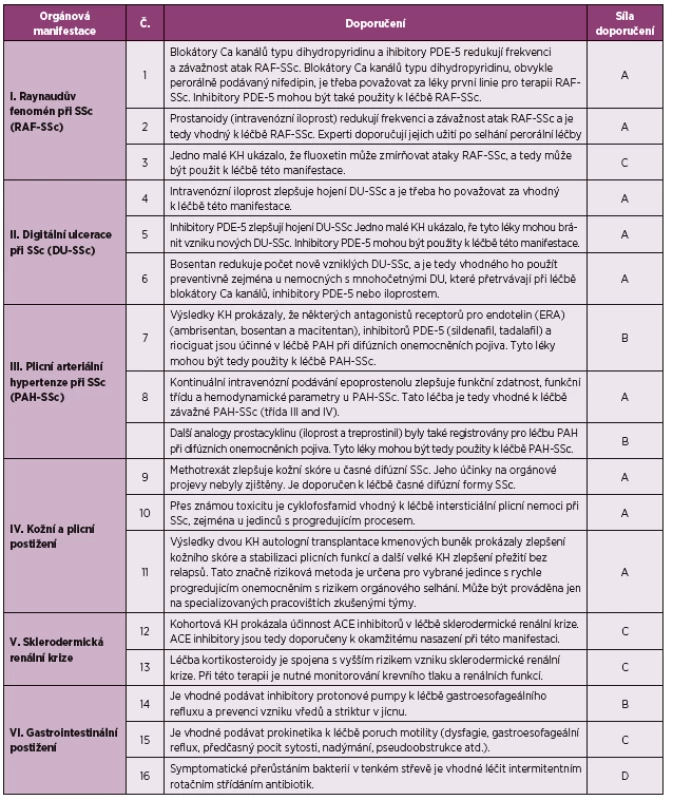
ACE angiotenzin konvertující enzym (upraveno podle Kowal-Bielecké O et al.) (2) Denton a spolupracovníci publikovali v roce 2016 doporučení Britské revmatologické společnosti (BSR) a Britské asociace zdravotníků v revmatologii (BHPR) pro léčbu SSc (tabulka 2) (7). Ta zahrnují také celkový přístup k léčbě SSc věnovaný léčbě časné kožně difúzní formy SSc (dsSSc). Druhá část se zabývá léčbou jednotlivých orgánových systémů a zahrnuje celkem 9 okruhů, kde oproti doporučením EULAR/EUSTAR má zvláštní okruh pro léčbu srdeční manifestace, muskuloskeletálních projevů, kalcinózy, autologní transplantace kmenových buněk (HSCT) a nefarmakologické přístupy.
Tab. 2. Doporučení BSR a BHPR pro léčbu systémové sklerodermie 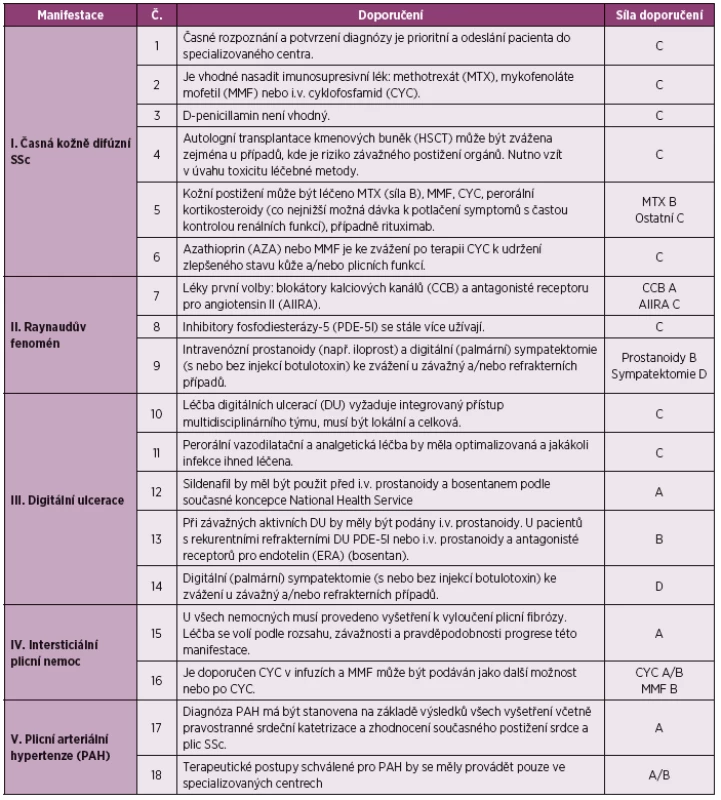

(upraveno dle Dentona et al.) (1) Oběhový systém
Vaskulární poškození je nejčasnějším a pravděpodobně i primárním procesem v patogenezi SSc a je histopatologicky prokazatelné před rozvojem fibrózy a objevením se prvního klinického příznaku, kterým obvykle bývá, RAF. Je charakterizován epizodickými barevnými změnami aker vyvolanými chladem nebo stresem. Progresivní strukturální změny v malých cévách vedou k rozvoji ischemických změn – digitální ulcerace (DU), nekrózy a gangrény prstů. K dalším manifestacím vaskulopatie u SSc patří teleangiektázie a typické změny kapilár nehtových valů. Postižení větších cév u SSc se může manifestovat jako plicní arteriální hypertenze (PAH), sklerodermická renální krize (SRC) a antrální vaskulární ektázie (8,9). K postižení srdce dochází u 50 % nemocných se SSc častěji sekundárně v důsledku PAH než primárně na podkladě fibrózy myokardu (postihující zejména převodní systém). Častým, ale subklinickým nálezem bývá perikarditida. K nejčastějším klinickým manifestacím patří palpitace, dušnost a atypické bolesti na hrudi (9).
Nová doporučení EULAR jsou zaměřena pouze na léčbu RAF a DU, ale nikoli pro nízkou sílu důkazů na kardiální postižení (tabulka 1). Přes menší sílu důkazů se tomuto orgánovému postižení věnují doporučení BSR/BHPR (tabulka 2) (7). Farmakologické léčbě RAF by vždy měla předcházet režimová opatření, nefarmakologické postupy a správná edukace pacienta. Z režimových opatření má zcela zásadní význam minimalizace expozice vlivům, které ho vyvolávají nebo zhoršují, a snaha redukovat frekvenci atak, jejich intenzitu a délku trvání. Je nutné upozornit pacienta, aby si před chladem chránil jak periferii (teplé rukavice, elektrické vyhřívání do rukavic a bot, gelové ohřívače, čepice atd.), tak tělesné jádro a aby se nevystavoval náhlým změnám teploty a chladnému větru. Důležitý je pohyb ke zvýšení průtoku periferním řečištěm (tření rukou, krouživé pohyby paží, ponoření do teplé vody a další) a omezení stresu a úzkosti. Nutné je zanechat kouření (škodí i pasivní) a vyhýbat se vibracím a látkám s vazokonstrikčním účinkem (agonisté serotoninu, alfa-sympatomimetika, beta-blokátory, kofein, léky podporující redukci hmotnosti a návykové látky). V současné době neexistují důkazy z kvalitních randomizovaných klinických hodnocení (RCT), které by podporovaly účinnost behaviorální terapie nebo výživových doplňků či různých prostředků alternativní medicíny na snížení frekvence a intenzity atak RAF. Při selhání anebo nedostatečné účinnosti režimových opatření je na místě zahájení farmakoterapie (10, 11).
V prvním doporučení EULAR doporučuje panel expertů na základě několika metaanalýz RCT k léčbě RAF-SSc použití blokátorů kalciových kanálů (CCB, dihydropyridinového typu) a v případě závažného RAF-SSc a/nebo nedostatečné odpovědi na CCB nasadit inhibitory fosfodiesterázy-5 (PDE-5i). U primárního RAF i u RAF-SSc byl prokázán mírný účinek v redukci počtu a závažnosti atak RAF oproti placebu (12–14). Odborníci doporučují nasazení CCB s prodlouženým uvolňováním, zahájených v nízké dávce, s postupným navýšením do maximálních tolerovaných dávek: nifedipin (s prodlouženým uvolňováním 20–60 mg 2x denně; s řízeným uvolňováním 40–80 mg 1x denně), amlodipin (5–10 mg 1x denně), felodipin (s prodlouženým uvolňováním 2,5–10 mg 1x denně) a isradipin (s prodlouženým uvolňováním 5 mg 1x denně). Limitací použití CCB je častý výskyt nežádoucích účinků (hypotenze, závratě, flush, otoky, cefalea).
PDE-5i podporují vazodilatační efekt NO prostřednictvím inhibice degradace cyklického guanosinmonofosfátu. Metaanalýza 6 RCT (dvou se sildenafilem, 3 s tadalafilem a 1 s vardenafilem) u RAF asociovaného se systémovým onemocněním pojiva prokázala, že PDE-5i snižují frekvenci, délku a závažnost atak RAF (15). Mezi častými nežádoucími účinky byly různé formy vazomotorických reakcí, myalgie, alergické reakce, bolesti na hrudi, dyspepsie, ucpaný nos a poruchy zraku. V ČR jsou dostupné PDE-5i preparáty indikované pouze k léčbě erektilní dysfunkce a PAH II. /III. funkční třídy dle WHO, a tak pro léčbu RAF-SSc je nutno žádost o souhlas revizního lékaře zdravotní pojišťovny (RL-ZP).
Ve druhém doporučení EULAR se uvádí, že i.v. iloprost by měl být zvážený pro léčbu závažného SSc-RF v případě selhání perorálních preparátů (CCB a PDE-5i) (6). Analoga prostacyklinu mají vazodilatační a antiagregační účinek a mohou mít vliv i na remodelaci cév. Metaanalýza 5 RCT s i.v. iloprostem, 1 RCT s p. o. iloprostem a 1 RCT s p.o. cisaprostem prokázala účinnou redukci frekvence a závažnosti RAF-SSc u iloprostu (16). Perorální preparáty iloprostu jsou obecně méně účinné než intravenózní (5). Dle výsledků dvou RCT je však i.v. iloprost jen mírně účinnější než nifedipin ve zmírnění atak RAF-SSc (16,17).
Třetí doporučení EULAR se zakládá pouze na výsledcích jednoho malého klinického hodnocení, kde se v subanalýze u nemocných s SSc srovnávala účinnost fluoxetinu s nifedipinem u SSc-RF. Fluoxetin blokuje vychytávání serotoninu, který má vazokonstrikční účinky. Fluoxetin (20 mg 1x denně) ve srovnání s nifedipinem účinněji snížil závažnost atak RAF a vedl méně často k ukončení léčby pro nežádoucí účinky (apatie, letargie, porucha koncentrace) (18). Dle panelu expertů přes nízkou kvalitu důkazů je fluoxetin používán v praxi a věří, že představuje alternativu u těch, kteří netolerují nebo neodpovídají na léčbu vazodilatační (6). V ČR jsou preparáty fluoxetinu schváleny pouze k léčbě depresivních epizod, obsedantně kompulzivní poruchy a mentální bulimie.
I přes výrazně menší kvalitu důkazů zahrnuje BSR/BHPR ve svých doporučeních pro léčbu SSc další alternativy pro terapii RAF. V případě intolerance nebo nedostatečného efektu výše uvedených postupů lze zvážit použití blokátoru receptorů pro angiotenzin II (ARB, losartan 50–100 mg 1x denně), selektivního alfa1-sympatolytika (prazosin – v ČR nedostupný), statinů (atorvastatin 10–40 mg denně; simvastatin 20 mg denně) a u závažných forem digitální sympatektomii anebo lokální injekce botulotoxinu (7, 19–24). Odborníci dále doporučují zkusit další alternativy, jako jsou antiagregační preparáty (kyselina acetylsalicylová 100 mg denně), vazoaktivní preparáty (pentoxifylin 400 mg 3x denně) nebo topické přípravy s nitrogylcerinem (gely, krémy, masti – v ČR nedostupné) (11).
Čtvrté doporučení vychází z metaanalýzy 4 RCT s analogy prostacyklinu, která prokázala u všech prostanoidů ve srovnání s placebem trend k účinnému hojení DU (nejvýraznější u i.v. iloprostu), ale nebyly účinné v prevenci tvorby nových DU (25). Dále zohledňuje výsledek 1 RCT s i. v. epoprostenolem podávaným pro závažnou SSc-PAH, ve které byl prokázaný trend k redukci počtu nových DU (26). Z toho vyšlo doporučení, že i. v. iloprost by měl být zvážený pro léčbu DU zejména u pacientů se SSc, kteří neodpověděli na p.o. preparáty (CCB, PDE-5i (6). Doporučené dávky dle odborníků jsou u i.v. iloprostu 0,5–2,0 ng/kg/min a u i.v. epoprostenolu 0,5–6,0 ng/kg/min po dobu 6–24 hodin celkem 2–5 dnů (8). Indikací v ČR dostupných preparátů je však léčba primární plicní hypertenze (PH) s funkčním stupněm III dle NYHA nebo III/IV dle WHO. Odborníky v ČR často využívanou variantou je i. v. alprostadil (analog prostacyklinu, PGE1), který je indikován k léčbě ischemické choroby dolních končetin III. /IV. stadia dle Fontainea (Prostavasin i.v. 40 μg 2x denně po dobu 2 hodin, nebo 60 μg 1x denně po dobu 3 hodin anebo Alprostan 50–200 μg 1–2x denně po dobu 2 hodin, celkem 2–4 týdny).
Páté doporučení EULAR o účinnosti PDE-5i v léčbě DU-SSc, se zakládá na metaanalýze 3 RCT, která potvrdila, že PDE-5i významně zlepšují hojení DU-SSc ve srovnání s placebem (25). Dále zohledňuje výsledky 1 RCT s tadalafilem, kdy tento PDE-5i nejen účinně zlepšuje hojení DU-SSc, ale i významně snižuje riziko tvorby nových DU (27). Panel odborníku tedy doporučuje, že PDE-5i mohou být účinné v léčbě DU-SSc (6).
V šestém doporučení o účinnosti antagonistů receptorů pro endotelin-1 (ERA) vychází panel odborníků z výsledků 2 RCT s bosentanem a z recentní metaanalýzy. Bosentan je duální antagonista receptorů A a B pro endotelin, který je silný vazokonstrikční, prozánětlivý a profibrotický mediátor. Zmíněné práce ukázaly, že bosentan ve srovnání s placebem sice nesnížil frekvenci atak RAF, ani nezlepšil hojení aktivních DU, ale významně snížil počet nových DU, zejména u vícečetných DU. K nežádoucím účinkům bosentanu patří hepatotoxicita, teratogenicita a snížení účinnosti současně podávané hormonální antikoncepce (25,28,29). Dvě RCT s macicentanem (také duální ERA) neprokázaly větší účinnost macicentanu v prevenci nových DU-SSc ve srovnání s placebem (30). Jedno prospektivní otevřené, nekontrolované pilotní klinická hodnocení (KH) s ambrisentanem prokázalo významně zlepšení hojení DU, ale neovlivnilo tvorbu nových DU (30). Na základě uvedených výsledků doporučuje panel odborníků použití bosentanu u pacientů se SSc s četnými DU i přes léčbu CCB, PDE-5i a iloprostem, za účelem prevence tvorby nových DU (6). Preparáty ERA dostupné v ČR jsou všechny indikované k léčbě PAH funkční třídy II/III dle WHO, ale pouze bosentan má indikaci pro snížení počtu nových a perzistujících DU.
Jak je uvedeno v tabulce 2, experti z BSR/BHPR doporučují další možnosti léčby DU. Terapie DU-SSc vyžaduje mezioborovou spolupráci, která zahrnuje lokální i systémovou léčbu s použitím dostatečně účinné analgezie, i.v. antibiotické terapie v případě infekce a chirurgické intervence (většinou debridement nekrotické tkáně anebo evakuace hnisu) za účelem předcházení šíření infekce v měkkých tkáních a rozvoji osteomyelitidy. Tito autoři dále doporučují zvážení sympatektomie a lokální aplikace botulotoxinu. I přes ještě menší kvalitu důkazů další možností podpory hojení DU-SSc je hyperbarická oxygenoterapie (9).
Pro léčbu manifestací kardiálního postižení u SSc existuje jen minimum důkazů. Jak je uvedeno v tabulce 2, pro srdeční selhání se systolickou dysfunkcí je vhodné zvážit imunosupresivní terapii s nebo bez kardiostimulátoru, potenciální prospěch zavedení implantabilního kardioverter-defibrilátoru a nasazení ACEi a selektivních. U srdečního selhání s diastolickou dysfunkcí se zachovalou ejekční frakcí levé komory doporučují léčbu diuretiky a CCB (6). Pro skrínink kardiovaskulárních rizik a prevenci a léčbu ATS u SSc se zatím musíme řídit doporučení EULARu pro kontrolu kardiovaskulárního rizika u pacientů se zánětlivými artropatiemi (32). Příprava specifických doporučení pro SSc je již plánovaná. Terapie tradičních kardiovaskulárních rizikových faktorů u SSc se většinou řídí národními doporučeními pro běžnou populaci. U SSc je navíc k prevenci a kontrole kardiovaskulárního rizika nutná farmakologická kontrola aktivity základního onemocnění (33).
Kůže
Postižení kůže je charakteristickou manifestací SSc, s výjimkou přibližně 10 % případů SSc, které označujeme jako tzv. SSc sine scleroderma (ssSSc) (34). Dle rozsahu kožního postižení klasifikujeme SSc na kožně limitovanou formu (lcSSc, s postižením kůže distálně od loktů a kolen, případně i s postižením tváře a krku) a na kožně difúzní formu (dcSSc), u které bývá postižen celý kožní kryt. Tyto dvě formy se liší v nástupu, rychlosti progrese, často i závažnosti orgánového postižení a zejména v prognóze (35). Rozsah a závažnost kožního postižení se však může měnit v průběhu času – většinou dosahuje vrchol v průběhu 2–5 let od nástupu onemocnění, následuje pak fáze stabilizace a pozvolného zmírnění. Kožní postižení u SSc se projevuje indurací a ztrátou pružností kůže. Zvláštní postavení u SSc má podkožní kalcinóza (8).
V časné fázi dcSSc je zvýšené riziko rychlého rozvoje orgánového postižení a cílem imunosupresivní léčby je snaha o zpomalení progrese těchto změn a následných komplikací. Ze všech klinických projevů SSc má však kožní postižení historicky nejmenší odpověď na protizánětlivou nebo imunosupresivní léčbu v dosud prováděných RCT. V současnosti neexistuje dostatek důkazů, na základě kterých by odborníci doporučovali užívání imunosupresivních léků k ovlivnění pouhého kožního postižení u pacientů s lcSSc bez orgánového postižení (36). Vzhledem k tomu se nová doporučení zabývají pouze ovlivněním kožní fibrózy u pacientů s dcSSc, navíc jen ve společném rámcovém okruhu s ILD, vzhledem k podobné patogenezi a svá doporučení věnují pouze dvěma terapeutickým přístupům – methotrexát (MTX) a autologní transplantaci kmenových buněk (HSCT) (6).
Na základě výsledků dvou RCT s MTX u nemocných s převážně časnou dcSSc (37,38), ve kterých byl demonstrován trend ke zlepšení kožního skóre (hodnoceno pomocí modifikovaného Rodnanova kožního skóre (mRSS) a/nebo kožního skóre Kalifornské univerzity (UCLA) ve srovnání s placebem. Proto konstatuje panel odborníků EULAR, že MTX může být použit pro léčbu kožního postižení u časné dcSSc. Je nutné poznamenat, že v těchto RCT nebyly zaznamenány žádné významné pozitivní účinky na další orgánové manifestace SSc při dávce do 15 mg týdně. Není však známo, zdali vyšší dávky MTX mohou mít větší účinnost v ovlivnění kožního postižení u SSc bez současného zvýšení rizika nežádoucích účinků (6).
K dalším imunosupresivním preparátům, konvenčním syntetickým chorobu modifikujícím lékům (csDMARD) a biologickým DMARDs (bDMARDs, jako je rituximab (RTX) a jejich účinnosti u kožního postižení u SSc se panel expertů EULARu vzhledem k nedostatku kvalitních důkazů nevyjadřuje. Odlišný postoj k těmto farmakologickým přístupům, zaujímá BSR/BHPR, jak uvedeno v tabulce 2 (7). V souladu s doporučeními EULAR by dle doporučení BSR/BHPR měli být pacienti s časnou dcSSc léčeni MTX nebo v indikovaných případech pomocí HSCT. Navíc BSR/BHPR doporučuje jako alternativu k MTX imunosupresivní terapii MMF anebo CYC i.v. U kožního postižení dále BSR/BHPR doporučuje po ukončení léčby CYC i.v., za účelem udržení efektu CYC na zmírnění kožního postižení, udržovací léčbu AZA nebo MMF. Mezi další možnosti terapie kožního postižení pak uvádí terapii glukokortikoidy (GK, co nejnižšími možnými dávkami) a RTX. Většina důkazů o účinnosti výše zmíněných imunosupresivních preparátů v léčbě kožního postižení u SSc je však nedostatečná a pochází z retrospektivních, observačních a nekontrolovaných KH, sérií případů anebo kazuistik (7).
GK jsou rutinně užívány v běžné klinické praxi, čehož dokladem je až 41 % pacientů se SSc v německém registru. Své místo dle odborníků mají GK i přes limitované důkazy v léčbě perikarditidy, myokarditidy, myozitidy a artritidy u SSc. Existuje však jen málo solidních důkazů o redukci mRSS a dávky nad 30 mg/den prednisonu by neměly být u SSc používány vzhledem ke zvýšenému riziku rozvoje SRC (39).
Několik nerandomizovaných a nekontrolovaných KH prokázalo, že CYC ve formě infuzí 0,5–2 g/m2 anebo p. o. 2 mg/kg denně po dobu ne déle než 2 roky) kromě stabilizace plicních funkcí účinně zmírňuje i kožní postižení. Tyto studie se staly podkladem dvou RCT, ve které se rovněž tyto účinky potvrdily (40, 41). Nicméně pozitivní účinky CYC odeznívají do 6–12 měsíců po ukončení léčby a proto je na místě udržovací terapie AZA (2-3 mg/kg denně) nebo MMF (2 g/den). Odborníci tedy doporučují zvážení nasazení CYC u dcSSc se závažným nebo rychle progredujícím kožním postižením, neodpovídajícím na konvenční imunosupresivní terapii, anebo u dcSSc s aktivním ILD (7).
AZA (většinou 2–3 mg/kg/den) je sice často užíván v běžné praxi u pacientů se SSc jako GK šetřící preparát, zejména u artritidy a myozitidy a dále jako již zmíněná udržovací léčba po indukční léčbě CYC u časné dcSSc a aktivní ILD (42,43). V přímé srovnávací randomizované studii s CYC však byla prokázána nižší účinnost AZA jak ve zmírnění kožního postižení, tak ve stabilizaci plicních funkcí (44). Četná observační anebo retrospektivní kontrolovaná KH s MMF (většinou 2 g/den, někdy i v kombinovaných režimech s GK nebo ATG) zkoumající jeho účinnost převážně u dcSSc s aktivním ILD potvrdila nejenom účinnou stabilizaci nebo zlepšení plicních funkcí ale i významný pokles mRSS. U MMF byl prokázán příznivý poměr účinnosti a nežádoucích účinků a relativní bezpečnost při dlouhodobém podávání (45–47). Chybí však přesvědčivé důkazy, zdali je MMF účinnější v léčbě kožního postižení (než MTX a CYC) anebo aktivního ILD (než CYC) (7).
Účinnost RTX (většinou 1 g intravenózně 2x po 14 dnech) v léčbě kožního postižení (zejména u dcSSc) a aktivního ILD byla hodnocena v několika menších otevřených nekontrolovaných KH, v jedné malé RCT a v zatím největším observačním KH z registru EUSTAR. Tato KH demonstrovala významný pokles mRSS v průběhu léčby RTX a/nebo výraznější pokles oproti kontrolní skupině a stabilizaci plicních funkcí u aktivní ILD (48, 49). Vzhledem k podání MMF a RTX u SSc mimo schválenou indikaci je v ČR nutné podat žádost reviznímu lékaři o schválení v případě intolerance nebo kontraindikací MTX nebo CYC. Příznivé, klinicky významné ale statisticky nevýznamné zlepšení kožního postižení a plicních funkcí demonstrovala první RCT fáze 2 s inhibitorem interleukinu-6, tocilizumabem (50). Tato další možnost je vítaná, ale definitivní závěry a doporučení lze dělat až po potvrzení těchto výsledků v RCT fáze 3.
Další možností léčby orgánového postižení u pacientů s aktivní, rychle progredující dcSSc, neodpovídajících na konvenční imunosupresivní léčbu, je podávání intravenózních globulinů (většinou 1–2 g/kg v 2–5 dnech). Většina KH demonstrovala příznivé účinky na postižení kůže, svalů, kloubů a trávicího traktu (51).
BSR/BHPR ještě doporučuje pravidelné promazávání suché kůže hydratačním krémem s obsahem lanolinu, užívání běžných antihistaminik v případě pruritu a použití make-upu a laseru anebo intenzivního pulzního světla v případě teleangiektázií (tabulka 2). U kalcinózy byla vyzkoušena řada farmakologických postupů s nepřesvědčivými výsledky a důkazy účinnosti. BSR/BHPR doporučuje včasnou antibiotickou léčbu kalcinózy komplikované infekcí a zvážení chirurgické intervence v případě refrakterní kalcinózy, která závažně omezuje funkci a kvalitu života (7).
Plicní hypertenze
PH je v současnosti definována jako zvýšení středního tlaku v plicnici ≥ 25 mm Hg. Plicní cévní rezistence není součástí obecné definice syndromu PH. Naopak je součástí hemodynamické definice PAH, která zahrnuje střední tlak v plicnici ≥ 25 mm Hg, tlak v zaklínění ≤ 15 mm Hg, plicní cévní rezistenci ≥ 3 Woodovy jednotky a současně normální nebo nižší srdeční výdej. Hodnoty středního tlaku v plicnici 21–24 mm Hg představují hraniční tlaky. Zejména u pacientů s SSc jejich nález představuje významný rizikový faktor progrese do plicní hypertenze (53). Výskyt známek PH u pacientů se SSc je relativně častý. K hlavním příčinám patří postižení plicního intersticia nebo levého srdce při základním onemocnění a dále PAH. PAH je vedle vlastního kardiálního postižení klíčovou příčinou mortality u nemocných se SSc (54). K rizikovým faktorům rozvoje této manifestace SSc patří kožně limitovaná forma onemocnění, trvání choroby 10–15 let a začátek onemocnění ve vyšším věku. Ve srovnání s idiopatickou PAH se mívá PAH-SSc závažnější prognózou.
Pozdní diagnóza PAH je významnou skutečností, která nepříznivě ovlivňuje účinnost léčby a prognózu nemocných. Pravděpodobně jediným způsobem, jak dosáhnout diagnózy v časnějším stadiu onemocnění, je skrínink. Klíčovým vyšetřením v detekci PH je transtorakální echokardiografie (55). Echokardiografický skrínink PH je indikován u nemocných se SSc každý rok. S cílem zvýšit výtěžnost skríninku a snížit zbytečné indikace srdečních katetrizací se proto doporučuje kombinace vyšetřovacích metod – dopplerovská echokardiografie, natriuretické peptidy a DLCO (53). Definitivní diagnóza PAH, včetně katetrizační verifikace, patří do rukou expertních center.
Farmakologické léčbě PAH-SSc je věnován také samostatný okruh v doporučeních EULAR. Sedmé doporučení je věnováno preparátům ERA – bosentanu, ambrisentanu a macicentanu, které byly testovány v několika RCT. Dvě vysoce kvalitní RCT ukázala, že bosentan zlepšuje výkonnost, funkční třídu a některé hemodynamické parametry u nemocných s PAH (56, 57). Proto je bosentan doporučen Americkou společnost hrudní medicíny pro léčbu těžké PAH při funkční třídě III/IV dle WHO (58, 59). Klinické zkušenosti u nemocných s PAH-SSc ukazují, že monoterapie bosentanem bývá nedostačující a je třeba jej kombinovat s prostanoidy (60) nebo i dalšími léky. Podobné výsledky jako u bosentanu byly zjištěny u macicentanu (61). K nežádoucím účinkům léčby ERA v těchto RCT patřila hepatotoxicita, periferní otoky, palpitace, bolest hlavy a na prsou, ucpaný nos a anémie, přičemž bezpečnostní profily jednotlivých léků se lišily.
Kvalitní RCT zahrnující nemocné s difúzními chorobami pojiva (PAH-CTD) ukázala, že selektivní PDE-5i (sildenafil a tadalafil) zlepšují funkční kapacitu nemocných a snižují riziko zhoršení (62, 63, 64). Nejčastější nežádoucí účinky zahrnovaly návaly, dyspepsie, průjem, bolest hlavy a svalů. Další RCT s riociguatem (solubilní stimulátor guanylátcyklázy) ukázalo, že zlepšuje funkční kapacitu, prodlužuje čas ke klinickému zhoršení i hemodynamických parametrů (65). K nežádoucím účinkům riociguatu patří synkopy, vzestup jaterních enzymů, nevolnost, akutní renální selhání a hypotenze. Všechny tyto léky je vhodné použít k léčbě PAH-SSc.
Osmé doporučení EULAR vychází z výsledků jednoho vysoce kvalitní RCT, které ukázaly, že intravenózně podávaný epoprostenol zlepšuje funkční kapacitu, funkční třídu dle WHO a hemodynamické ukazatele u SSc-PAH (66). Náhlé vysazení léku může ohrozit život nemocného. Tento lék je tedy vhodný k léčbě závažné PAH-SSc. Deváté doporučení vzniklo na základě výsledků vysoce kvalitní RCT s pacienty s PAH-CTD léčených analogy prostacyklinu jako je treprostinil (intravenózní, subkutánní nebo inhalační) (67, 68) a iloprost (inhalační) (68). Tyto léky byly schváleny k léčbě PAH-CTD. Nežádoucí účinky byly stejné jako u epoprostenolu. Přestože je nedostatek RCT věnovaných pouze PAH-SSc, experti doporučují užití analogů prostacyklinu v této indikaci.
V ČR současný terapeutický algoritmus PAH vychází z uvedených RCT. Při definitivním rozhodování o způsobu léčby je nutno brát v potaz registraci, úhradu a cenu přípravku, způsob aplikace, spektrum nežádoucích účinků, preference pacienta a zkušenosti lékaře. Léčebné možnosti u PAH zahrnují v první řadě režimová opatření (psychosociální podpora, prevence infekcí, očkování proti chřipce a pneumokokovi, spolehlivá antikoncepce) a podpůrnou léčbu (diuretická léčba, oxygenoterapie, rehabilitace). K režimovým opatřením patří dodržování fyzické zátěže podle individuální tolerance s možností lehkého aerobního cvičení (především chůze). Není vhodný pobyt ve vyšších nadmořských výškách (nad 2000 m). Těhotenství je kontraindikováno, neboť mortalita během gravidity a porodu dosahuje 30–50 %. Podpůrnou léčbou rozumíme diuretika, oxygenoterapii, antikoagulaci a léčbu pravostranného srdečního selhání.
Před zahájením specifické léčby PAH je nezbytné vyšetření ve specializovaném centru včetně invazivního hemodynamického vyšetření s testováním akutní vazoreaktivity. Nemocní se zachovalou vazoreaktivitou (5–10 % nemocných) jsou indikováni k léčbě vysokými dávkami BCC za pečlivého monitorování efektu (69). U nemocných bez vazodilatační rezervy je indikována specifická farmakoterapie. U symptomatických nemocných má být léčba zahájena bezprostředně po stanovení diagnózy. Cílem je u pacientů ve funkční třídě NYHA II zabránit progresi onemocnění, u nemocných ve funkční třídě NYHA III a IV dosáhnout zlepšení. U nemocných ve funkčním stadiu NYHA II je indikována léčba ERA nebo PHD-5i (53, 69). U nemocných ve funkčním stadiu NYHA III je indikována léčba perorální: ambrisentan, bosentan, sildenafil, nebo inhalační prostanoid iloprost (53). U nemocných s pokročilou NYHA III je indikována léčba parenterálními prostanoidy: treprostinil, epoprostenol, případně léčba kombinační (69, 70). U nemocných ve funkčním stadiu NYHA IV je lékem volby intravenózní analog prostacyklinu epoprostenol, případně kombinační léčba.
Efekt imunosupresivní léčby základního revmatického onemocnění na PAH nelze prakticky očekávat. Vzhledem k malému efektu samotné vazodilatační léčby se zdá smysluplné kombinovat imunosupresivní terapii se specifickou léčbou PAH. Při selhání farmakoterapie je indikována léčba nefarmakologická (atriální septostomie a transplantace plic. Jak již bylo uvedeno, nemocné s SSc-PAH je nutné sledovat pouze ve specializovaných centrech, která jsou např. ve Všeobecné fakultní nemocnici v Praze, IKEM, Fakultní nemocnici v Brně a Fakultní nemocnici v Olomouci.
Intersticiální plicní nemoc
ILD se projevuje se difúzní plicní fibrózou s predilekční lokalizací v bazálních částech plic, případně ztluštěním pleury. Histologický nález není patognomonický. Je přítomna intersticiální plicní fibróza se ztluštěním alveolárních sept a relativně malou buněčnou infiltrací, v pokročilém stadiu jsou alveolární struktury nahrazeny fibrózním vazivem a vznikem voštinovité přestavby (71). U části nemocných se může objevit PH, která vede k pravostrannému srdečnímu selhání. Hlavními příznaky ILD jsou dušnost a kašel, zpravidla bez větší expektorace. Diagnóza se stanoví na základě anamnézy, fyzikálního vyšetření, skiagramu hrudníku, HRCT hrudníku, podrobného funkčního vyšetření včetně vyšetření difúzní plicní kapacity. Nezbytné je doplnění HRCT hrudníku. Nejčastějším HRCT obrazem je nespecifická intersticiální pneumonie následovaná obvyklou intersticiální pneumonií (72). Za extenzivní onemocnění lze považovat podle některých studií rozsah HRCT abnormalit > 20 % a/nebo FVC < 70 % náležitých hodnot. Podle některých autorů mléčné opacity na HRCT hrudníku u nemocných se SSc nereprezentují zánětlivé postižení, ale počínající fibrózu. Obraz plicní fibrózy u nemocných s SSc bývá natolik charakteristický, že není důvod indikovat plicní biopsii (73).
Léčba ILD je v doporučení EULAR zařazena do společného okruhu s kožním postižením (tabulka 1). Účinnost a bezpečnost CYC v léčbě ILD při SSc byla sledována ve dvou RCT (43, 74). První RCT zahrnovalo pacienty s aktivní alveolitidou při podání CYC perorálně 1–2 mg/kg a ukázalo po roce významné zlepšení plicních funkčních testů, ale nikoli DLCO. CYC vedl ke zlepšení indexu dušnosti, dotazníků kvality života. V druhém RCT byl CYC aplikován v intravenózních pulzech v měsíčních intervalech a následně AZA nebo placebo. U skupiny s aktivním léčivem byl podáván prednisolon 20 mg obden. U skupiny s CYC došlo ke hraničnímu zlepšení plicních funkcí, ale DLCO se nezlepšila (75). Na základě těchto dvou RCT podle expertů přes svou známou toxicitu je CYC vhodný k léčbě ILD při SSc (6).
AZA, jak bylo uvedeno výše, byl užíván jako udržovací léčba po indukční léčbě CYC u časné dcSSc s aktivní ILD (42, 43). Ve srovnávacím KH s CYC však byla prokázána nižší účinnost AZA ve stabilizaci plicních funkcí (44). KH s MMF (většinou 2 g/den, někdy i v kombinovaných režimech s GK nebo ATG) zkoumající jeho účinnost převážně u dcSSc s aktivním ILD potvrdila stabilizaci nebo zlepšení plicních funkcí.
Byla prokázána účinnost RTX (1 g 2x po 14 dnech) u aktivní ILD v několika KH, kdy největší byla z registru EUSTAR. Toto KH demonstrovalo stabilizaci plicních funkcí u aktivní ILD (48, 49). Klinicky významné ale statisticky nevýznamné zlepšení plicních funkcí demonstrovala první RCT fáze 2 s tocilizumabem (5). Co se týká užití GK, došli experti Americké společnost pro onemocnění hrudníku/Evropské plicní asociace k tomuto závěru. I když v RCT byly užívány střední dávky GK, nejsou zatím k dispozici žádné důkazy o jejich účinnost u ILD a naopak stoupá riziko vzniku SRC (76). Proto se jejich podávání v této indikaci nedoporučuje.
Z výsledků RCT vyplývá, že léčba může být účinná pouze při aktivní alveolitidě. Je jednoznačná shoda, že dávky a doba léčení pomocí CYC musí být individuální v závislosti na aktivitě onemocnění a klinické odpovědi. Vždy musíme brát v úvahu potenciální riziko útlumu kostní dřeně, teratogenity, selhání gonád a hemoragické cystitidy. Obvykle se CYC aplikuje se ve formě šestiměsíčních cyklů intravenózních pulzů obvykle v dávce 500 mg/m2 v intervalu jednoho měsíce. K omezení urotoxicity CYC je vždy nutné současné podání uromitexanu. U fertilních žen, které plánují v budoucnu graviditu, je třeba před zahájením terapie nechat odebrat oocyty ke zmražení. Efekt léčby se hodnotí kontrolou funkčního vyšetření plic a DLCO po 3–4 měsících a po roce HRCT hrudníku. Při přetrvávající aktivitě ILD se cykly opakují maximálně třikrát, obvykle k dosažení toxické kumulativní dávky léku.
Pokud je tato léčba neúčinná, je nutno zvolit jiný preparát, obvykle MMF v dávce 2–3 g denně, případně RTX 2 infuze po 1 g v odstupu 14 dnů. U těchto léků se jedná o podání mimo indikaci a je tedy nutno požádat revizního lékaře o schválení. Při regresi zánětlivých změn se doporučuje udržovací léčba AZA (2–3 mg na kg a den). Vždy je nutná úzká spolupráce s pneumologem.
Při léčbě SSc je snaha ovlivnit současně několik orgánových manifestací. Jedna z perspektivních metod určených zejména pacientům s rychle progredující dcSSc je autologní transplantace kmenových buněk (HSCT). Proto další doporučení EULAR pro léčbu kožního postižení a ILD popisuje tuto metodu a je založeno na důkazech ze dvou RCT (5). Předpokládaným mechanismem HSCT je „restartování“ imunitního systému pomocí vysokodávkované imunoablační chemoterapie, která vede následně k obnovení imunologické tolerance. Uvedené dvě RCT s demonstrovaly významné zlepšení mRSS a plicních funkcí (nikoliv však DLCO) ve srovnání se skupinou s CYC (77, 78). HSCT je dosud spojena s větším množstvím nežádoucích účinků než konvenční imunosupresivní léčba u SSc. V současnosti se periprocedurální mortalita pohybuje mezi 5,5–10 %. Periprocedurální mortalita u HSCT však byla vyšší než u větve s CYC a její příčinou byla reaktivace EBV, lymfom, srdeční selhání, infarkt myokardu a ARDS (79). Na základě těchto dat experti doporučují tuto metodu u jedinců s rychle progredující SSc s rizikem časného orgánového selhání. Jedná se o komplexní proceduru, která patří do vysoce specializovaných center s transplantační jednotkou a bohatými zkušenostmi (80). Výsledek léčení značně závisí na výběru vhodných kandidátů. V ČR byla zatím tato metoda použita zcela ojediněle a není hrazena z veřejného zdravotního pojištění.
Sklerodermická renální krize
SRC je vzácným a velmi závažným projevem ledvinného postižení při SSc, v současnosti je incidence okolo 2,5 % nemocných s SSc. Podstatou SRC je porucha mikrocirkulace v ledvinách a zvýšená aktivita renin-angiotensinové osy (81). SRC je typicky spojena s náhle vzniklou arteriální hypertenzí a rychle progredujícím renálním selháním s oligurií nebo anurií. Klinicky bývají přidruženy: hypertenzní encefalopatie, akutní srdeční selhání, mikroangiopatická hemolytická anemie a trombocytopenie. Jde o vážný, život ohrožující stav (82). V kontextu SRC je třeba zmínit zásadní vliv dvou lékových skupin, negativní roli systémových GK pro rozvoj SRC a naopak pozitivní efekt inhibitorů angiotenzin konvertujícího enzymu (ACEi) v léčbě SRC. Existuje více literárních důkazů pro vliv GK na rozvoj SRC. Nejdříve byl tento fakt známý z provedených retrospektivních KH (83–86). Dvě novější KH potvrzují expozici systémovými GK jako nezávislého prediktoru SRC (85, 87). Vše shrnuje metaanalýza 44 KH a 93 kazuistik, která zjistila, že střední až vysoké dávky GK (prednison ≥15 mg za den) byly spojeny se zvýšeným rizikem SRC. Toto riziko se dále zvyšuje, pokud se ve spojení s GK používají nefrotoxické léky (88). Klinicky překvapivým a důležitým faktem je, že vysoké dávky prednisonu nad 30 mg/den nebo jeho ekvivalentu mohou být příčinou SRC spojeného s normotenzí (83), v tomto případě tedy chybí důležitý varovný příznak.
Obecně lze konstatovat, že pozice GK při léčbě kožních, plicních a kloubních projevů SSc je podle současných důkazů velmi limitovaná. Současná literatura již použití GK u SSc nedoporučuje. V doporučeních EULAR je SRC věnován V. okruh a tam se konstatuje, že léčba GK zvyšuje riziko SRC. Proto je při jejich podávání třeba pečlivě monitorovat krevní tlak a renální funkce V praxi je třeba redukovat dávku GK na možné minimum nebo lépe tuto léčbu bezpečně ukončit.
Analýza literárních dat v současnosti neopodstatňuje podávání ACEi v prevenci SRC. Dokonce jsou dostupná data ukazující zvýšené riziko nutné dialýzy nebo i úmrtí spojené s léčbou ACEi před rozvojem prvních příznaků SRC (náhlým nástupem zvýšeného krevního tlaku a stoupající sérovou koncentrací kreatininu (85, 90, 91). V rámci prospektivního multicentrického observačního KH s pacienty se SRC byla část z nich léčena ACEi před rozvojem SRC. Tito nemocní měli 2,5krát zvýšené riziko úmrtí (90). Přesto je u pacientů s SSc v prevenci SRC nutné včas zahájit léčbu arteriální hypertenze již při zvýšení nad 140/90 mm Hg. Jestliže máme podezření na rozvoj SRC projevy popsanými výše, zahajujeme ACEi. Jestliže se SRC nepotvrdí, vhodnými antihypertenzivy jsou BCC, jak to doporučeno u jiných projevů SSc (RAF, PAH), nebo centrálně působící antihypertenziva a diuretika (88, 92, 93).
Několik nekontrolovaných KH ukázalo příznivý vliv ACEi při léčbě SRC (83-86,91,94,95) a jedna prospektivní analýza 108 pacientů se SRC ukázala velmi příznivý vliv ACEi na přežívání. Studovány byly zejména ACEi původní (starší) generace (kaptopril a enalapril). Dvě retrospektivní KH také potvrdily vliv ACEi na přežívání (86, 91). Pacienti se SRC, kteří nevykazují žádné známky renální funkční regenerace navzdory včasné kontrole krevního tlaku, jsou kandidáty pro léčbu metodami náhrady funkce ledvin (dialýza, transplantace).
Přestože není možné tvrzení podpořit daty z RCT, je podle doporučeních EULAR třeba používat ACEi v léčbě SRC s cílem ovlivnit funkci ledvin a přežívání pacientů. Toho by mělo být dosaženo dlouhodobým podáváním ACEi (6). Je předpoklad, že jde o příznivý efekt celé skupiny ACEi. Pro dobrou prognózu nemocného je zásadní včasné nasazení těchto léků a okamžité předání do péče odborného centra. Léčba ACEi není účinná v prevenci SRC a může zvyšovat letalitu spojenou se SRC, zejména u normotenze.
Gastrointestinální postižení
Gastrointestinální (GI) postižení je nejčastější orgánovou manifestací SSc. Více než 90 % pacientů se SSc má potíže odpovídající postižení GI traktu (95). Postižení se může objevit v kterékoli části trávicího traktu. V první fázi dochází k časným vaskulárním lézím sliznice a submukózy, neurálnímu postižení, později k atrofii hladkého svalstva a fibróze. Následkem je dysmotilita jícnu, žaludku a celého střeva. Konkrétní manifestací je extraesofageální reflux, gastroesofageální reflux, porucha evakuace žaludku, syndrom bakteriálního přerůstání v tenkém střevě (small intestine bacterial overgrowth SIBO) s malabsorpcí, pseudo-obstrukce, pomalý průchod kolon s komplikacemi, anorektální dysfunkce, např. fekální inkontinence (96).
Léčba dysmotility horní části gastrointestinálního traktu
Cílem léčby je zmírnění symptomů a léčba komplikací. Celková léčba SSc nevede ke zlepšení GI dysfunkce. Úprava životního stylu a dietní opatření spočívají v omezení čokolády, citrusů, rajčat, máty, cibule, česneku, tučného jídla, čerstvého kynutého pečiva a kofeinu. Vhodný je malý objem jídla, doporučuje se snížení hmotnosti při nadváze, ukončení kouření, vyvarování se alkoholu (zejména bílého vína), podložení hlavy a trupu vleže, spaní na levém boku, nejíst 3–5 hodin před ulehnutím (97). Pokud se současně léčí RAF, diltiazem patří mezi léky s menším vlivem na tlak dolního jícnového svěrače než jiná relaxancia hladkých svalů (98, 99). Farmakoterapie s cílem snížit aciditu pomocí inhibitorů protonové pumpy (PPI) je dlouhodobě považována za pilíř léčby refluxní choroby jícnu, prevenci jícnových vředů a striktur u pacientů se SSc. Na obecné populaci je efekt PPI na refluxní chorobu jícnu dobře dokumentován v metaanalýzách RCT (100–102). Dnes je 75 % pacientů se SSc léčeno PPI pro refluxní potíže, ale u mnoha z nich potíže přetrvávají (97).
Vzhledem k informacím o nežádoucích účincích PPI není situace zcela jednoznačná. U asymptomatických nemocných by měly být užívány PPI s opatrností, protože existují doklady, že dlouhodobá léčba PPI může být také příčinou malabsorpce. Jedním z mechanismů je vznik SIBO (103), další pak jsou infekce ve smyslu komunitních pneumonií (104) klostridiové kolitidy (105) a riziko vzniku prekancerózy Barretova jícnu (106) a případně karcinomu jícnu (107), již tak zvýšené u SSc (108). Otázkou je vliv PPI na riziko kostních fraktur (109) a vliv na mikrocirkulaci (110). Blokátory histaminových H2 receptorů byly v těchto indikacích použity také s efektem, ale data jsou ještě méně robustní než u PPI (111,112).
V souladu s doporučeními EULAR a BSR/BHPR a přes nedostatek RCT by měly být PPI podávány u pacientů se SSc v prevenci refluxní choroby jícnu, jícnových vředů a striktur (5,100). V tomto ohledu je účinnost PPI pro běžnou populaci dobře dokumentována. Vzhledem k údajům o možných nežádoucích účincích by měly být PPI užívány u asymptomatických SSc nemocných s opatrností. Náhradou mohou být blokátory histaminových H2 receptorů. Naopak pozornost by měla být věnována extraesofageálnímu refluxu projevujícímu se kašlem zejména po ulehnutí, kde jsou PPI indikována.
Druhým krokem po supresi produkce kyseliny chlorovodíkové je přidání prokinetik. Obecně je u této léčby pozorováno zvýšení tonu dolního jícnového svěrače a akcelerace vyprazdňování žaludku. RCT s malým počtem pacientů prokázaly účinnost u cisapridu (113-115). Vzhledem k negativnímu působení léčiva na prodloužení QT intervalu a riziko smrtících srdečních arytmií byl ve Spojených státech amerických a následně i v Evropě lék stažen z distribuce. Pro další prokinetika jsou data velmi limitována. Léčba metoklopramidem má data pro akutní efekt, ale chybí KH dlouhodobé účinnosti a má určité riziko tardivní dyskinézy a psychických depresí (116-118). Erytromycin není vhodný pro dlouhodobé užití. Domeperidon s menšími nežádoucími účinky než předchozí prokinetika je další možností léčby pro SSc pacienty v ČR, přestože nejsou data u pacientů se SSc (119).
Přes nedostatek specifických klinických dat experti doporučují užití dostupných prokinetik v léčbě poruch motility GI traktu při SSc zahrnujících zejména gastroesofageální reflux, časný pocit sytosti, nadýmání, syndrom pseudoobstrukce a další. Rozhodnutí o použití této léčby musí být učiněno s individuálním přístupem a zvážením benefitů a rizik.
Syndrom bakteriálního přerůstání v tenkém střevě
Dysmotilita a stáza střevního obsahu může být příčinou SIBO, a to má za následek malabsorpci a maldigesci (120). SIBO je charakterizován zvýšeným počtem a/nebo abnormálním druhem bakterií v tenkém střevě. K dispozici není žádná optimální léčba SIBO. Terapie by měla být komplexní (postihující všechny aspekty vzniku, projevů a komplikací) a musí být přísně individualizována. Patří sem změna životního stylu a dieta. Nutriční podpora je zásadně důležitá u SIBO spojeného s malnutricí a deficitem mikronutrientů. Zpravidla je používá individualizovaná dieta, enterální výživa nazojejunální sondou nebo perorální nutriční podpora formou sippingu polymerními přípravky. V řadě případů je třeba vyřadit laktózu, omezit jednoduché cukry, zvýšit energetické krytí tuky a podávat mastné kyseliny se středně dlouhým řetězcem (121).
Prokinetická léčba může být použita v obdobném schématu jako u poruchy evakuace žaludku při SSc. Antibiotika se používají ke snížení bakteriálního obsahu v tenkém střevě, může být použit ciprofloxacin, metronidazol nebo rifaximin na dva týdny (s dalším rozhodnutím o dalším opakování léčby podle jejího efektu) (122). Největší zkušenosti jsou v současné době s léčbou pomocí rifaximinu. Většina autorů doporučuje léčbu po dobu 7–10 dnů, a to buď jednorázově nebo cyklicky, například jedenkrát měsíčně v kombinaci s probiotiky po zbývající dobu (3 týdny v měsíci). Vyšší dávky (1200 nebo 1600 mg/den) jsou účinnější (123). Léčbu SIBO antibiotiky rovněž podporuje doporučení EULAR pro léčbu SSc (5, 6). Přes nedostatek RCT odborníci soudí, že pokud je malabsorpce při SSc vyvolána SIBO, je vhodné léčení střídáním (rotací) antibiotik, jak je uvedeno v tabulce 3. Pokud dochází k malasimilačnímu syndromu, je potřeba nemocného bez prodlevy odeslat do specializovaného centra.
Tab. 3. Přehled antibiotické léčby pro použití u syndromu bakteriálního přerůstání v tenkém střevě 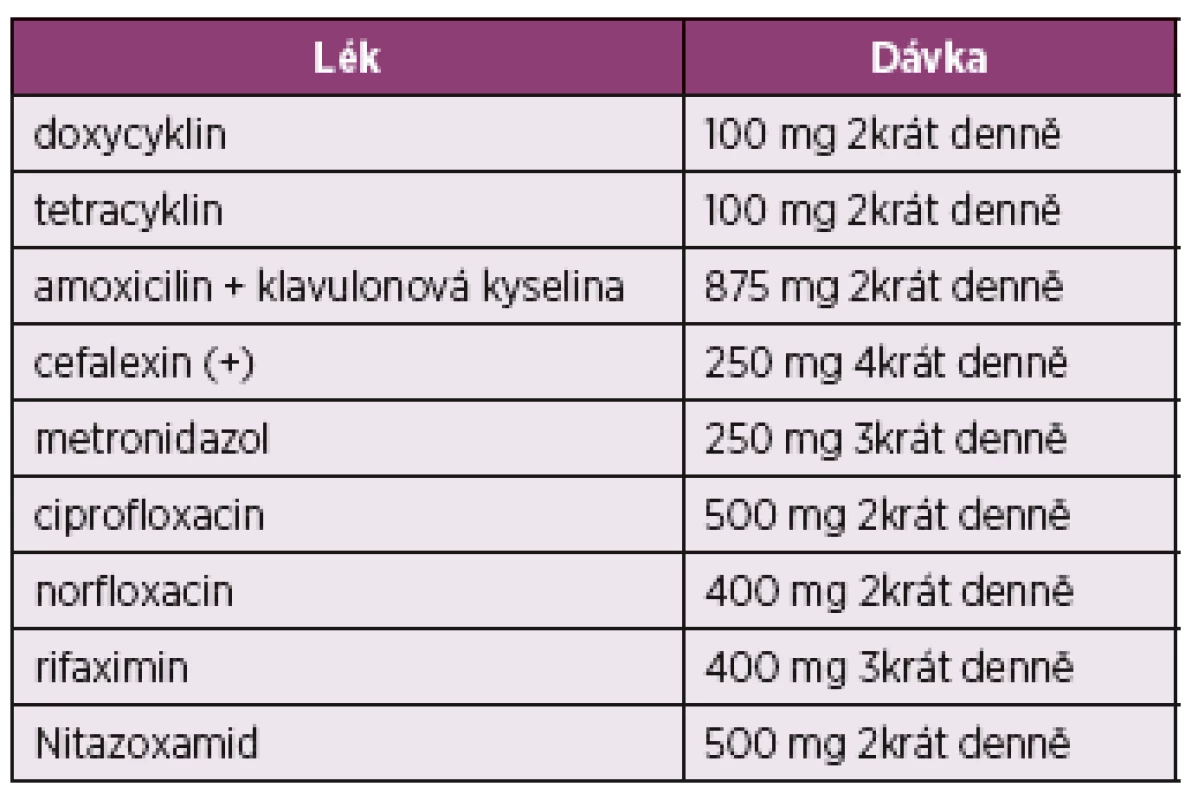
(upraveno podle Grace a spol.) (122). Dalším projevem postižení GIT u SSc bývá porucha vyprazdňování – častěji zácpa, nebo průjem, někdy střídavá stolice. Velmi nepříjemná je nemocné SSc anorektální inkontinence. V doporučeních BSR/BHPR experti konstatují, že protiprůjmové léky (např. loperamid) nebo naopak laxativa je vhodné u nemocných SSc použít k ovlivnění průjmů nebo zácpy.
Závěr
V léčbě SSc se běžně užívají další přístupy, které nejsou obsaženy v žádných vydaných doporučeních. Jedná se o různé nefarmakologické intervence, které tvoří neodmyslitelnou a nedílnou součást léčby pacientů se SSc. Limitací většiny z malého počtu existujících KH je však nízká metodologická kvalita, nedostatečný počet pacientů, absence kontrolní skupiny či nedostatečné sledování (tzv. „follow-up“) a krátká doba intervence. Patří k nim běžně užívané metody: parafínové zábaly, manuální lymfodrenáž, protahovací cvičení rukou a obličeje, masáž, cvičení k udržení kloubního rozsahu, mobilizace kloubů, aerobní cvičení a silový trénink (29). Předpokladem dlouhodobého přínosu pro pacienta je zkušený fyzioterapeut, erudovaný ve specifické problematice u pacientů se SSc, který je schopen individuálně navrhnout program pro konkrétního pacienta (13). V určitých stavech pak jsou indikovány speciální zákroky, jako jsou transplantace plic a nové experimentální metody.
Autoři doufají, že předkládaná doporučení pomohou zlepšit péči o nemocné SSc v podmínkách ČR. U vědomí složitosti a heterogenity tohoto onemocnění, obtížnosti diagnostického zhodnocení a volbě léčebných přístupů je vždy třeba pacienty s SSc odesílat do specializovaných center.
Tato doporučení byla vypracována za podpory projektu Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace č. 023728 (Revmatologický ústav) a výzkumných grantů AZV 16-33542A a AZV 16-33574A.
Doc. MUDr. Radim Bečvář, CSc.
Revmatologický ústav
Revmatologická klinika 1. LF UK
Na Slupi 4
128 50 Praha 2
e-mail: becvar@revma.cz
Zdroje
1. Štork J. Sklerodemie. Galen, Praha, 1996, 8–10.
2. D´Angelo W, Fries JF, Masi AR, Schulman LE. Pathologic observations in systemic sclerosis. Am J Med 1969; 46 : 428–39.
3. Ferri C, Valentini G, Cozzi F, et al. Systemic sclerosis: demographic, clinical, and serologic features and survival in 1,012 Italian patients. Medicine (Baltimore) 2002; 81 : 139–53.
4. Bečvář R, Soukup T, Štork J, Suchý D, Němec P, Jansa P, Fojtík Z, Horák P, Němcová D. Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie. Čes Revmatol 2014; 22 : 51–68.
5. Kowal-Bielecka O, Landewé R, Avouac R, and the EUSTAR co-authors EULAR recommendations for the treatment of systemic sclerosis: a report from the EULAR Scleroderma Trials and Research group (EUSTAR). Ann Rheum Dis 2009; 68 : 620–8.
6. Kowal-Bielecka O, Fransen J, Avouac J, and the EUSTAR co-authors. Update of EULAR recommendations for the treatment of systemic sclerosis. e-pub: http://dx.doi.org/10.1136/annrheumdis-2016-209909.
7. Denton CP, Hughes M, Gak N, Vila J, Buch MH, Chakravarty K, et al. BSR and BHPR guideline for the treatment of systemic sclerosis. Rheumatology. 2016; 55 : 1906–11.
8. Gabrielli A, Avvedimento EV, Krieg T. Mechanisms of Disease: Scleroderma. New Engl J Med 2009; 360 : 1989–2003.
9. Varga J, Abraham D. Systemic sclerosis: a prototypic multisystem fibrotic disorder. J Clin Invest 2007; 117 : 557 – 67.
10. Herrick AL. The pathogenesis, diagnosis and treatment of Raynaud phenomenon. Nat Rev Rheumatol 2012; 8 : 469 – 79.
11. Wigley FM, Flavahan NA. Raynaud's Phenomenon. New England J Med 2016; 375 : 556–65.
12. Thompson AE, Shea B, Welch V, Fenlon D, Pope JE. Calcium-channel blockers for Raynaud's phenomenon in systemic sclerosis. Arthritis Rheum 2001; 44 : 1841–7.
13. Thompson AE, Pope JE. Calcium channel blockers for primary Raynaud's phenomenon: a meta-analysis. Rheumatology 2005; 44 : 145–50.
14. Ennis H, Hughes M, Anderson ME, Wilkinson J, Herrick AL.Calcium channel blockers for primary Raynaud's phenomenon. The Cochrane database of systematic reviews 2016; 2: CD002069.
15. Roustit M, Blaise S, Allanore Y, Carpentier PH, Caglayan E, Cracowski JL. Phosphodiesterase-5 inhibitors for the treatment of secondary Raynaud's phenomenon: systematic review and meta-analysis of randomised trials. Ann Rheum Dis 2013; 72 : 1696–9.
16. Rademaker M, Cooke ED, Almond NE et al. Comparison of intravenous infusions of iloprost and oral nifedipine in treatment of Raynaud's phenomenon in patients with systemic sclerosis: a double blind randomised study. Brit Med J 1989; 298 : 561–4.
17. Scorza R, Caronni M, Mascagni B et al. Effects of long-term cyclic iloprost therapy in systemic sclerosis with Raynaud's phenomenon. A randomized, controlled study. Clin Exp Rheumatol 2001; 19 : 503–8.
18. Coleiro B, Marshall SE, Denton CP et al. Treatment of Raynaud's phenomenon with the selective serotonin reuptake inhibitor fluoxetine. Rheumatology 2001; 40 : 1038–43.
19. Dziadzio M, Denton CP, Smith R et al. Losartan therapy for Raynaud's phenomenon and scleroderma: clinical and biochemical findings in a fifteen-week, randomized, parallel-group, controlled trial. Arthritis Rheum 1999; 42 : 2646–55.
20. Pope J, Fenlon D, Thompson A, Shea B, Furst D, Wells G, et al. Prazosin for Raynaud's phenomenon in progressive systemic sclerosis. The Cochrane database of systematic reviews 2000: CD000956.
21. Ladak K, Pope JE. A review of the effects of statins in systemic sclerosis. Semin Arthritis Rheum 2016; 45 : 698–705.
22. Hartzell TL, Makhni EC, Sampson C. Long-term results of periarterial sympathectomy. J Hand Surg 2009; 34 : 1454–60.
23. Yee AM, Hotchkiss RN, Paget SA. Adventitial stripping: a digit saving procedure in refractory Raynaud's phenomenon. J Rheumatol 1998; 25 : 269–76.
24. Neumeister MW. The role of botulinum toxin in vasospastic disorders of the hand. Hand Clinics 2015; 31 : 23 – 37.
25. Tingey T, Shu J, Smuczek J, Pope J. Meta-analysis of healing and prevention of digital ulcers in systemic sclerosis. Arthritis Care & Res 2013; 65 : 1460–71.
26. Badesch DB, Tapson VF, McGoon MD et al. Continuous intravenous epoprostenol for pulmonary hypertension due to the scleroderma spectrum of disease. A randomized, controlled trial. Ann Intern Med 2000; 132 : 425–34.
27. Shenoy PD, Kumar S, Jha LK, Choudhary SK, Singh U, Misra R, et al. Efficacy of tadalafil in secondary Raynaud's phenomenon resistant to vasodilator therapy: a double-blind randomized cross-over trial. Rheumatology 2010; 49(12): 2420–8.
28. Korn JH, Mayes M, Matucci Cerinic M et al. Digital ulcers in systemic sclerosis: prevention by treatment with bosentan, an oral endothelin receptor antagonist. Arthritis Rheum 2004; 50 : 3985–93.
29. Matucci-Cerinic M, Denton CP, Furst DE et al. Bosentan treatment of digital ulcers related to systemic sclerosis: results from the RAPIDS-2 randomised, double-blind, placebo-controlled trial. Ann Rheum Dis 2011; 70 : 32–8.
30. Khanna D, Denton CP, Merkel PA et al. Effect of macitentan on the development of new ischemic digital ulcers in patients with systemic sclerosis: DUAL-1 and DUAL-2 Randomized Clinical Trials. JAMA 2016; 315 : 1975–88.
31. Moran ME. Scleroderma and evidence based non-pharmaceutical treatment modalities for digital ulcers: a systematic review. J Wound Care 2014; 23 : 510–6.
32. Agca R, Heslinga SC, Rollefstad S, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Ann Rheum Dis 2017; 76 : 17–28.
33. Atzeni F, Turiel M, Caporali R et al. The effect of pharmacological therapy on the cardiovascular system of patients with systemic rheumatic diseases. Autoimmunity Rev 2010; 9 : 835–9.
34. Poormoghim H, Lucas M, Fertig N, Medsger TA Jr. Systemic sclerosis sine scleroderma: demographic, clinical, and serologic features and survival in forty-eight patients. Arthritis Rheum 2000; 43 : 444–51.
35. LeRoy EC, Black CM, Fleischmajer R et al. Scleroderma (systemic sclerosis): classification, subsets and pathogenesis. J Rheumatol 1988; 15 : 202–5.
36. Pellar RE, Pope JE. Evidence-based management of systemic sclerosis: Navigating recommendations and guidelines. Semin Arthritis Rheum 2016 Dec 9. pii: S0049-0172(16)30464-4. doi: 10.1016
37. Van den Hoogen FH, Boerbooms AM, Swaak AJ, Rasker JJ, van Lier HJ, van de Putte LB. Comparison of methotrexate with placebo in the treatment of systemic sclerosis: a 24 week randomized double-blind trial, followed by a 24 week observational trial. Brit J Rheumatol 1996; 35 : 364–72.
38. Pope JE, Bellamy N, Seibold JR et al. A randomized, controlled trial of methotrexate versus placebo in early diffuse scleroderma. Arthritis Rheum 2001; 44 : 1351–8.
39. Takehara K. Treatment of early diffuse cutaneous systemic sclerosis patients in Japan by low-dose corticosteroids for skin involvement. Clin Exp Rheumatol 2004; 22 (Suppl 33): S87–9.
40. Tashkin DP, Roth MD, Clements PJ et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. Lancet Respir Med 2016; 4 : 708–19.
41. Tashkin DP, Elashoff R, Clements PJ et al. Cyclophosphamide versus placebo in scleroderma lung disease. New England J Med 2006; 354 : 2655–66.
42. Paone C, Chiarolanza I, Cuomo G et al. Twelve-month azathioprine as maintenance therapy in early diffuse systemic sclerosis patients treated for 1-year with low dose cyclophosphamide pulse therapy. Clin Exp Rheumatol 2007; 25 : 613–6.
43. Hoyles RK, Ellis RW, Wellsbury J et al. A multicenter, prospective, randomized, double-blind, placebo-controlled trial of corticosteroids and intravenous cyclophosphamide followed by oral azathioprine for the treatment of pulmonary fibrosis in scleroderma. Arthritis Rheum 2006; 54 : 3962–70.
44. Nadashkevich O, Davis P, Fritzler M, Kovalenko W. A randomized unblinded trial of cyclophosphamide versus azathioprine in the treatment of systemic sclerosis. Clin Rheumatol 2006; 25 : 205–12.
45. Stratton RJ, Wilson H, Black CM. Pilot study of anti-thymocyte globulin plus mycophenolate mofetil in recent-onset diffuse scleroderma. Rheumatology 2001; 40 : 84–8.
46. Derk CT, Grace E, Shenin M, Naik M, Schulz S, Xiong W. A prospective open-label study of mycophenolate mofetil for the treatment of diffuse systemic sclerosis. Rheumatology 2009; 48 : 1595–9.
47. Herrick AL, Lunt M, Whidby N et al. Observational study of treatment outcome in early diffuse cutaneous systemic sclerosis. J Rheumatol 2010; 37 : 116 – 24.
48. Jordan S, Distler JH, Maurer B et al. Effects and safety of rituximab in systemic sclerosis: an analysis from the European Scleroderma Trial and Research (EUSTAR) group. Ann Rheum Dis 2015; 74 : 1188–94.
49. Mc Queen FM, Solanki K. Rituximab in diffuse cutaneous systemic sclerosis: should we be using it today? Rheumatology 2015; 54 : 757–67.
50. Khanna D, Denton CP, Jahreis A et al. Safety and efficacy of subcutaneous tocilizumab in adults with systemic sclerosis (faSScinate): a phase 2, randomised, controlled trial. Lancet 2016; 87 : 2630–40.
51. Sanges S, Riviere S, Mekinian A et al. Intravenous immunoglobulins in systemic sclerosis: Data from a French nationwide cohort of 46 patients and review of the literature. Autoimmun Rev 2017; 16 : 377–384.
52. Willems LM, Vriezekolk JE, Schouffoer AA et al. Effectiveness of nonpharmacologic interventions in systemic sclerosis: A systematic review. Arthritis Care & Res 2015; 67 : 1426–39.
53. Galie N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J 2016; 37 : 67–119.
54. Mukerjee D, St George D, Coleiro B, et al. Prevalence and outcome in systemic sclerosis associated pulmonary arterial hypertension: application of a registry approach. Ann Rheum Dis 2003; 62 : 1088–93.
55. McGoon M, Gutterman D, Steen V, et al. Screening, early detection, and diagnosis of pulmonary arterial hypertension. Chest 2004; 126 : 14S–34S.
56. Channick RN, Simonneau G, Sitbon O, Robbins IM, Frost A, Tapson VF, et al. Effects of the dual endothelin-receptor antagonist bosentan in patients with pulmonary hypertension: a randomised placebo-controlled study. Lancet 2001; 358 : 1119–23.
57. Denton CP, Humbert M, Rubin L, Black CM. Bosentan treatment for pulmonary arterial hypertension related to connective tissue disease: a subgroup analysis of the pivotal clinical trials and their open-label extensions. Ann Rheum Dis 2006; 65 : 1336–40.
58. Rubin LJ, Badesch DB, Barst RJ, Galie N, Black CM, Keogh A, et al. Bosentan therapy for pulmonary arterial hypertension. N Engl J Med 2002; 346 : 896–903.
59. Galie N, Hinderliter AL, Torbicki A, Fourme T, Simonneau G, Pulido T, et al. Effects of the oral endothelin-receptor antagonist bosentan on echocardiographic and doppler measures in patients with pulmonary arterial hypertension. J Am Coll Cardiol 2003; 41 : 1380–6.
60. Humbert M, Barst RJ, Robbins IM, Channick RN, Galie` N, Boonstra A, et al. Combination of bosentan with epoprostenol in pulmonary arterial hypertension: BREATHE-2. Eur Respir J 2004; 24 : 353–9.
61. Pulido T, Adzerikho I, Channick RN et al. Macitentan and morbidity and mortality in pulmonary arterial hypertension. N Engl J Med 2013; 369 : 809–18.
62. Wilkins MR, Paul GA, Strange JW et al. Sildenafil versus Endothelin Receptor Antagonist for Pulmonary Hypertension (SERAPH) study. Am J Respir Crit Care Med 2005; 171 : 1292–7.
63. Galie N, Ghofrani HA, Torbicki A, Barst RJ, Rubin LJ, Badesch D, et al. Sildenafil Use in Pulmonary Arterial Hypertension (SUPER) Study Group. Sildenafil citrate therapy forpulmonary arterial hypertension. N Engl J Med 2005; 353 : 2148–57.
64. Galiè N, Denton CP, Dardi F et al. Tadalafil in idiopathic or heritable pulmonary arterial hypertension (PAH) compared to PAH associated with connective tissue disease. Int J Cardiol 2017; 235 : 67–72.
65. Humbert M, Coghlan JG, Ghofrani HA et al. Riociguat for the treatment of pulmonary arterial hypertension associated with connective tissue disease: results from PATENT-1 and PATENT-2. Ann Rheum Dis 2017; 76 : 422–426.
66. Badesch DB, Tapson VF, McGoon MD et al. Continuous intravenous epoprostenol for pulmonary hypertension due to the scleroderma spectrum of disease. A randomized, controlled trial. Ann Intern Med 2000; 132 : 425–34.
67. Simonneau G, Barst RJ, Galie N, Naeije R, Rich S, Bourge RC, et al. Treprostinil Study Group. Continuous subcutaneous infusion of treprostinil, a prostacyclin analogue, in patients with pulmonary arterial hypertension: a double-blind, randomized, placebo-controlled trial. Am J Respir Crit Care Med 2002; 165 : 800–49.
68. Oudiz RJ, Schilz RJ, Barst RJ, Galie N, Rich S, Rubin LJ, et al. Treprostinil Study Group. Treprostinil, a prostacyclin analogue, in pulmonary arterial hypertension associated with connective tissue disease. Chest 2004; 126 : 420–7.
69. Badesch DB, Abman SH, Simonneau G, Rubin LJ, McLaughlin VV. Medical therapy for pulmonary arterial hypertension: updated ACCP evidence-based clinical practice guidelines. Chest 2007; 131 : 1917–28.
70. Sitbon O, Humbert M, Nunes H, et al. Long-term intravenous epoprostenol infusion in primary pulmonary hypertension: prognostic factors and survival. J Am Coll Cardiol 2002; 40 : 780–8.
71. Steen VD, Conte C, Owens GR, Medsger TA Jr. Severe restrictive lung disease in systemic sclerosis. Arthritis Rheum 1994; 37 : 1283–9.
72. Cappelli S, Bellando Randone S, Camiciottoli G et al. Interstitial lung disease in systemic sclerosis: where do we stand? Eur Respir Rev 2015; 24 : 411–9.
73. Fan MH, Feghali-Bostwick CA, Silver RM. Update on scleroderma-associated interstitial lung disease. Curr Opin Rheumatol 2014; 26 : 630–6.
74. Goldin J, Elashoff R, Kim HJ et al. Treatment of scleroderma-interstitial lung disease with cyclophosphamide is associated with less progressive fibrosis on serial thoracic high-resolution CT scan than placebo: findings from the scleroderma lung study. Chest 2009; 136 : 1333–40.
75. Tashkin DP, Elashoff R, Clements PJ et al. Effects of 1-year treatment with cyclophosphamide on outcomes at 2 years in scleroderma lung disease. Am J Respir Crit Care Med 2007; 176 : 1026–34.
76. American Thoracic Society. Idiopathic pulmonary fibrosis. diagnosis and treatment. International consensus statement. American Thoracic Society and the European Respiratory Society. Am J Respir Crit Care Med 2000; 161 : 646–64.
77. Burt RK, Shah SJ, Dill K et al. Autologous non-myeloablative haemopoietic stem-cell transplantation compared with pulse cyclophosphamide once per month for systemic sclerosis (ASSIST): an open-label, randomised phase 2 trial. Lancet 2011; 378 : 498–506.
78. Van Laar JM, Farge D, Sont JK et al. Autologous hematopoietic stem cell transplantation vs intravenous pulse cyclophosphamide in diffuse cutaneous systemic sclerosis: a randomized clinical trial. JAMA 2014; 311 : 2490–8.
79. Sullivan KM, Shah A, Sarantopoulos S, Furst DE. Review: Hematopoietic Stem Cell Transplantation for Scleroderma: Effective Immunomodulatory Therapy for Patients With Pulmonary Involvement. Arthritis Rheum 2016; 68 : 2361–71.
80. Del Papa N, Onida F, Zaccara E et al. Autologous hematopoietic stem cell transplantation has better outcomes than conventional therapies in patients with rapidly progressive systemic sclerosis. Bone Marrow Transplant 2017; 52(1): 53–58.
81. Denton CP, Hudson M. Renal cisis and other renal manifestations of scleroderma. In: Varga J, Denton CP, Wigley FM, Allanore Y, Kulana M eds. Scleroderma from pathogenesis to compherensive management. 2nd ed. Springer New York 2017 : 317–31.
82. Steen VD, Medsger TA Jr. Long-term outcomes of scleroderma renal crisis. Ann Intern Med 2000; 133 : 600–3.
83. Helfrich DJ, Banner B, Steen VD et al. Normotensive renal failure in Systemic sclerosis. Arthritis Rheum 1989; 32 : 1128–34.
84. Teixeira L, Mouthon L, Mahr A, et al. Mortality and risk factors of Scleroderma renal crisis: a French retrospective study of 50 patients. Ann Rheum Dis 2008; 67 : 110–16.
85. Guillevin L, Bérezné A, Seror R, et al. Scleroderma renal crisis: a retrospective multicentre study on 91 patients and 427 controls. Rheumatology (Oxford) 2012; 51 : 460–7.
86. Hesselstrand R, Scheja A, Wuttge DM. Scleroderma renal crisis in a Swedish systemic sclerosis cohort: survival, renal outcome, and RNA polymerase III antibodies as a risk factor. Scand J Rheumatol 2012; 41 : 39–43.
87. Montanelli, G., Beretta, L., Santaniello, A. & Scorza, R. Effect of dihydropyridine calcium channel blockers and glucocorticoids on the prevention and development of scleroderma renal crisis in an Italian case series. Clin Exp Rheumatol 2013; 31(Suppl.76): 135–9.
88. Iudici, M., van der Goes, M. C., Valentini, G., Bijlsma, J. W.Glucocorticoids in systemic sclerosis: weighing the benefits and risks – a systematic review. Clin Exp Rheumatol 2013; 31(Suppl.76): 157–165.
89. Hudson M, Baron M, Tatibouet S, et al. Exposure to ACE inhibitors prior to the onset of scleroderma renal crisis-results from the International Scleroderma Renal Crisis Survey. Semin Arthritis Rheum 2014; 43 : 666–72.
90. Penn H, Howie AJ, Kingdon EJ et al. Scleroderma renal crisis: patient characteristics and long-term outcomes. QJM 2007; 100 : 485–94.
91. Walker KM, Pope J; participating members of the Scleroderma Clinical Trials Consortium, (Canadian Scleroderma Research Group . Treatment of systemic sclerosis complications: what to use when first-line treatment fails - consensus of systemic sclerosis experts. Semin Arthritis Rheum 2012; 42 : 42–55.
92. Mann, J. F. et al. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTARGET study): a multicentre, randomised, double-blind, controlled trial. Lancet 2008; 372 : 547–53.
93. Lopez-Ovejero JA, Saal SD, D’Angelo WA, et al. Reversal of vascular and renal crises of scleroderma by oral angiotensin converting enzyme blockade. N Engl J Med 1979; 300 : 1417–19.
94. Steen VD, Costantino JP, Shapiro AP, et al. Outcome of renal crisis in Systemic sclerosis: relation to availability of angiotensin converting enzyme (ACE) inhibitors. Ann Intern Med 1990; 113 : 352–7.
95. Marie I. Gastrointestinal involvement in systemic sclerosis. Presse Med 2006; 35 : 1952–65.
96. Korn JH. Scleroderma: a treatable disease. Cleve Clin J Med 2003;70 : 954–8.
97. Denton CP, Clarke JO, Pandolfino JE, Harrison E, Murray C, Lal S. Gastrointestinal manifestation and management. In: Varga J, Denon CP, Wigley FM, Allanore Y, Kulana M eds. Scleroderma from pathogenesis to compherensive management. 2nd ed. Springer New York 2017 : 423–61.
98. Kahan A, Bour B, Couturier D, Amor B, Menkes CJ. Nifedipine and esophageal dysfunction in progressive systemic sclerosis. A controlled manometric study. Arthritis Rheum 1985; 28 : 490–5.
99. Jean F, Aubert A, Bloch F, Petite JP, Priollet P, Fiessinger JN, Husson JM, Billaud E. Effects of diltiazem versus nifedipine on lower esophageal sphincter pressure in patients with progressive systemic sclerosis. Arthritis Rheum 1986; 29 : 1054–5.
100. Chiba N, De Gara CJ, Wilkinson JM, Hunt RH. Speed of healing and symptom relief in grade II to IV gastroesophageal reflux disease: a meta-analysis. Gastroenterology 1997; 112 : 1798–810.
101. Donnellan C, Sharma N, Preston C, et al. Medical treatments for the maintenance therapy of reflux oesophagitis and endoscopic negative reflux disease. Cochrane Database Syst Rev 2005; (2): Cd003245.
102. Sigterman KE, van Pinxteren B, Bonis PA, et al. Short-term treatment with proton pump inhibitors, H2-receptor antagonists and prokinetics for gastro-oesophageal reflux disease-like symptoms and endoscopy negative reflux disease. Cochrane Database Syst Rev 2013; (5): Cd002095.
103. Fujiwara Y, Watanabe T, Muraki M, et al. Association between chronic use of proton pump inhibitors and small-intestinal bacterial overgrowth assessed using lactulose hydrogen breath tests. Hepatogastroenterology 2015; 62 : 268–72.
104. Sarkar M, Hennessy S, Yang YX. Proton-pump inhibitor use and the risk for community-acquired pneumonia. Ann Intern Med 2008; 149 : 391–8.
105. Kwok CS, Arthur AK, Anibueze CI, Singh S, Cavallazzi R, Loke YK. Risk of Clostridium difficile infection with acid suppressing drugs and antibiotics: meta-analysis. Am J Gastroenterol 2012; 107 : 1011–9.
106. Wippf J, Allanore Y, Soussi F et al. Prevalence of Barret´s esophagus in systemic sclerosis. Arthritis Rheum 2005; 52 : 2882–8.
107. García Rodríguez LA, Lagergren J, Lindblad M. Gastric acid suppression and risk of oesophageal and gastric adenocarcinoma: a nested case control study in the UK. Gut 2006; 55 : 1538–44.
108. Chatterjee S, Dombi GW, Severson RK, Mayes MD. Risk of malignancy in scleroderma: a population-based cohort study. Arthritis Rheum 2005; 52 : 2415–24.
109. Ito T, Jensen RT. Association of long-term proton pump inhibitor therapy with bone fractures and effects on absorption of calcium, vitamin B12, iron, and magnesium. Curr Gastroenterol Rep 2010; 12 : 448–57.
110. Schönhöfer PS. Safety of omeprazole and lansoprazole. Lancet 1994; 343 : 1369–70.
111. Hendel L, Aggestrup S, Stentoft P. Long-term ranitidine in progressive systemic sclerosis (scleroderma) with gastroesophageal reflux. Scand J Gastroenterol 1986; 21 : 799–805.
112. Petrokubi RJ, Jeffries GH. Cimetidine versus antacid in scleroderma with reflux esophagitis. A randomized double-blind controlled study. Gastroenterology 1979; 77 : 691–5.
113. Horowitz M, Maddern GJ, Maddox A, Wishart J, Chatterton BE, Shearman DJ. Effects of cisapride on gastric and esophageal emptying in progressive systemic sclerosis. Gastroenterology 1987; 93 : 311–5.
114. Kahan A, Chaussade S, Gaudric M, et al. The effect of cisapride on gastro-oesophageal dysfunction in systemic sclerosis: a controlled manometric study. Br J Clin Pharmacol 1991; 31 : 683–7.
115. Wang SJ, Lan JL, Lan JL, Chen DY, Chen YH, Hsieh TY, Lin WY. Effects of cisapride on colonic transit in patients with progressive systemic sclerosis. Clin Rheumatol 2002; 21 : 271–4.
116. Ramirez-Mata M, Ibañez G, Alarcon-Segovia D. Stimulatory effect of metoclopramide on the esophagus and lower esophageal sphincter of patients with PSS. Arthritis Rheum 1977; 20 : 30–4.
117. Johnson DA, Drane WE, Curran J, et al. Metoclopramide response in patients with progressive systemic sclerosis. Effect on esophageal and gastric motility abnormalities. Arch Intern Med 1987; 147 : 1597–601.
118. Drane WE, Karvelis K, Johnson DA, Curran JJ, Silverman ED. Scintigraphic detection of metoclopramide esophageal stimulation in progressive systemic sclerosis. J Nucl Med 1987; 28 : 810 – 5.
119. Sjogren RW. Gastrointestinal features of scleroderma. Curr Opin Rheumatol 1996; 8 : 569–75.
120. Baron M, Hudson M, Steele R, Canadian scleroderma group. Malnutrition is comon in systemie sclerosis: results from the Canadian scleroderma research group database. J Rheumatol 2009; 36 : 2737–43.
121. Bureš J, Cyrany J, Kohoutová D, Förstl M, Rejchrt S, Květina J, Voříšek V, Kopáčová M. Small intestinal bacterial overgrowth syndrome. World J Gastroenterol 2010; 16 : 2978–90.
122. Grace E, Shaw C, Whelan K et al. Review article: small intestinal bacterial overgrowth prevalence, clinical features, current and developing diagnostic tests, and treatment. Aliment Pharmacol Ther 2013; 38 : 674–88.
123. Scarpellini E, Gabrielli M, Luritano CE, Lupascu A, Merra G, Cammarota G, Cazzato IA, Gasbarrini G, Gasbarrini A. High dosage rifaximin for the treatment of small intestinal bacterial overgrowth. Aliment Pharmacol Ther 2007; 25 : 781–6.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2017 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
Najčítanejšie v tomto čísle- Reaktivní artritidy
- Doporučení České revmatologické společnosti pro léčbu systémové sklerodermie
- Spondyloartritidy: jejich genetická zátěž a dědičnost
-
XIV. seminář mladých revmatologů
Mikulov, 11. – 13. 5. 2017
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



