-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Tocilizumab v léčbě polymyalgia rheumatica
Tocilizumab in the treatment of polymyalgia rheumatica – a case report
Polymyalgia rheumatica is the most common inflammatory disorder of people over 50 years of age with peak occurrence in the eighth decene. The fact that the disease affects especially older people causes them to be often individuals with multiple comorbidities and at high risk of adverse effects of treatment. The gold standard for polymyalgia rheumatica treatment remains glucocorticoids. The treatment strategy of the disease should be determined individually so as to optimally balance the benefits and risks of the treatment. Relapses of the disease appear in the course of treatment in 23–55% of patients, depending on the length of their follow-up, and a considerable number of patients experience adverse effects of glucocorticoid therapy. In such patients, methotrexate may be considered. Current recommendations for treatment of polymyalgia rheumatica do not recommend the use of biological drugs, particularly due to lack of evidence of their efficacy, concerns about potential side effects and high treatment prices. However, there is a growing evidence in the literature about the positive effect of tocilizumab in the treatment of polymyalgia rheumatica. The positive effect and safety of tocilizumab in the treatment of polymyalgie rheumatica confirms also our experience.
Key words:
Polymyalgia rheumatica, therapy, glucocorticoids, tocilizuma
Autoři: P. Němec 1; Šprláková Puková; A 2; Z. Řehák 3
Působiště autorů: Revmatologická ambulance, II. interní klinika LF MU a FN u sv. Anny v Brně 1; Klinika radiologie a nukleární medicíny LF MU a FN Brno 2; Oddělení nukleární medicíny a Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav 3
Vyšlo v časopise: Čes. Revmatol., 26, 2018, No. 2, p. 88-98.
Kategorie: Kazuistika
Souhrn
Polymyalgia rheumatica je nejčastější zánětlivé onemocnění osob starších 50 roků s vrcholem výskytu v osmém decenniu. Skutečnost, že toho onemocnění postihuje zejména osoby vyššího věku způsobuje, že se často jedná o jedince s četnými komorbiditami a vysokým rizikem výskytu nežádoucích účinků léčby. Zlatým standardem v léčbě polymyalgia rheumatica zůstávají glukokortikoidy. Léčebná strategie onemocnění by měla být stanovena individuálně tak, aby byly optimálně vybalancovány přínosy a rizika léčby. Relapsy onemocnění se v průběhu léčby objevují u 23–55 % pacientů v závislosti na délce jejich sledování a značná část pacientů se potýká s nežádoucími účinky léčby glukokortikoidy. U takových pacientů může být zvažováno použití methotrexátu. Současná doporučení k léčbě polymyalgia rheumatica nedoporučují použití biologických léků zejména z důvodu nedostatku důkazů o jejich účinnosti, z důvodů obav z potenciálních nežádoucích účinků a z důvodu vysoké ceny léčby. V odborné literatuře však přibývá důkazů o pozitivním efektu tocilizumabu v léčbě tohoto onemocnění. Příznivý efekt a bezpečnost tocilizumabu v léčbě polymyalgia rheumatica potvrzují i naše zkušenosti.
Klíčová slova:
Polymyalgia rheumatica, terapie, glukokortikoidy, tocilizumab
Polymyalgia rheumatica (PMR) je nejčastějším zánětlivým onemocněním osob starších 50 let. Postihuje zejména kavkazskou rasu a přibližně 2–3x častěji ženy (1). Nejvyšší incidence PMR byla zaznamenána v severní Evropě, zejména ve Skandinávii (2). Naopak nízká incidence onemocnění byla pozorována v některých oblastech jižní Evropy – v severní Itálii, v severozápadním Španělsku a rovněž v Izraeli (3, 4). Etiologie tohoto onemocnění nebyla doposud objasněna, stejně jako vztah mezi PMR a obrovskobuněčnou arteriitidou (OBA) (5, 6). Asi 16–21 % pacientů s PMR má současně příznaky OBA nebo histologickou evidenci tohoto onemocnění. Naopak 40–60 % pacientů s OBA má současně příznaky PMR (5–8).
Charakteristickými projevy onemocnění jsou přetrvávající, symetrické, pletencové bolesti zejména v oblasti ramenních kloubů, krku a horních částí paží, méně často v oblasti pánve, stehen a dolní části zad spojené s ranní ztuhlostí trvající déle než 45 minut, která vede k problémům se vstáváním z lůžka a oblékáním (9). Bolesti v oblasti ramenních pletenců se často zhoršují při pohybu a mohou narušovat kvalitu spánku. Vznik obtíží může být náhlý nebo pozvolný. Přibližně u 25 % pacientů s objevují synovitidy periferních kloubů. Až u třetiny pacientů mohou být přítomny systémové příznaky onemocnění zahrnující zvýšenou tělesnou teplotu, slabost, nechutenství, váhový úbytek nebo horečku.
Diagnóza PMR se stanovuje primárně na základě klinických symptomů a je podpořena přítomností laboratorních známek zánětu. K diagnostice onemocnění lze využít některá z doposud vytvořených diagnostických a klasifikačních kritérií (2). V roce 2012 vytvořil tým odborníků Evropské ligy proti revmatismu (EULAR) a Americké koleje revmatologů (ACR) předběžná klasifikační kritéria pro PMR, která nově umožňují použít k diagnostice PMR rovněž ultrasonografii (USG) (10) (tab. 1).
Tab. 1. Klasifikační kritéria EULAR/ACR pro polymyalgia rheumatica z roku 2012. Skórovací algoritmus pro polymyalgia rheumatica s a bez použití ultrazvukového vyšetření. 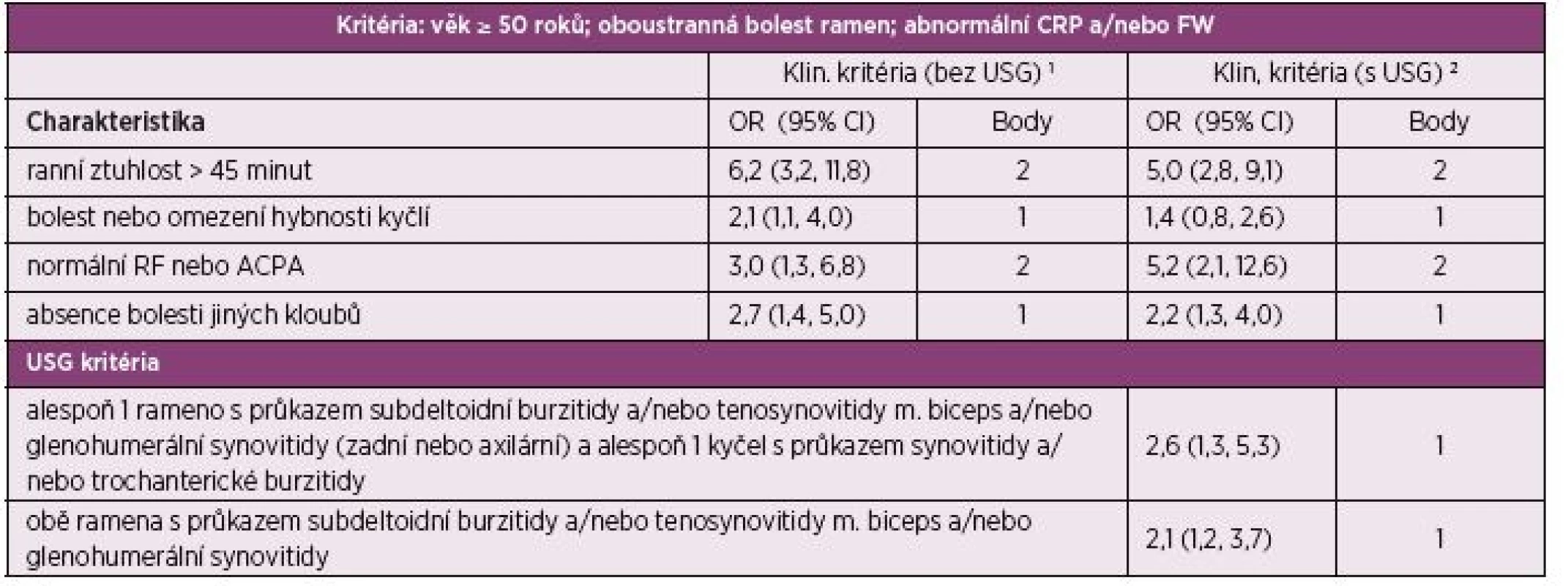
RF: revmatoidní faktor; ACPA: protilátky proti citrulinovaným peptidům; CI: interval spolehlivosti; FW: sedimentace erytrocytů; CRP: C-reaktivní protein.
1 Optimální hranice jsou 4 body. Skóre 4 a více je kategorizováno jako PMR. Senzitivita 72 %; specificita 65 %. Specificita je vyšší (79 %) pro odlišení postižení ramene od PMR a nižší (61 %) pro odlišení RA od PMR.
2 p = 0,008 a p = 0,009 pro dodatková kritéria. Optimální hranice je 5 bodů. Skóre 5 a více je kategorizováno jako PMR. Senzitivita 71 %; specificita 70 %. Specificita je vyšší (86 %) pro odlišení postižení ramene od PMR a nižší (65 %) pro odlišení RA od PMR.V časné diagnostice onemocnění nebo ke sledování aktivity onemocnění a odpovědi na léčbu lze využít moderní zobrazovací metody zahrnující USG, magnetickou rezonanci (MR) nebo pozitronovou emisní tomografii (PET) detekující distribuci radiofarmaka FDG (2-(18F)-fluoro-2-deoxy-D-glukózu) v organismu. V současnosti se PET vyšetření obvykle kombinuje se zobrazením struktury tkání pomocí počítačové tomografie (CT) nebo MR.
V roce 2003 byl vytvořen a následně validizován kompozitní index Polymyalgia rheumatica Activity Score (PMR-AS) jako nástroj vhodný k monitorování aktivity onemocnění v průběhu léčby (11, 12) (tab. 2).
Tab. 2. Kompozitní index k hodnocení aktivity polymylagia rheumatica – Polymyalgia Rheumatica Activity Score (PMR-AS). 
PMR-AS: Polymyalgia rheumatica Activity Score; CRP: C-reaktivní protein; pVAS: hodnocení bolesti pacientem na vizuální analogové škále; celkové hodnocení aktivity onemocnění lékařem na vizuální analogové škále; MST: délka ranní ztuhlosti; EUL: elevace horních končetin (3 – žádná, 2 – po úroveň ramene, 1 – do úrovně ramene, 0 – nad úroveň ramene). Popis případu
První klinické potíže se u 52leté pacientky s anamnézou astma bronchiale léčeného kombinací agonistů β2 adrenoreceptorů, inhalačních glukokortikoidů (GK), teofylinu a antagonisty leukotrienových receptorů a s anamnézou gastroezofageálního refluxu objevily bez zjevného spouštěcího momentu v březnu roku 2014. Pacientka je popisovala jako chronické bolesti dolní části zad šířící se do třísel a zadní plochy obou stehen. Postupně se začaly objevovat i bolesti v oblasti šíje, obou ramen a bolesti a otok v oblasti karpometakarpálních kloubů obou palců. Pacientka si stěžovala na výraznou kloubní ztuhlost, únavu, zvýšenou tělesnou teplotu s občasnými febrilními špičkami, které se objevovaly v nočních hodinách. Z těchto důvodu byla ambulantně vyšetřena na Klinice infekčních chorob Fakultní nemocnice Brno. Laboratorní vyšetření prokazovalo známky systémového zánětu. Hladina C-reaktivního proteinu (CRP) byla 126 mg/l. Imunologické vyšetření neprokázalo přítomnost orgánově nespecifických autoprotilátek. Celotělová scintigrafie skeletu detekující Technecium 99m metyldifosfonát (99mTc-HDP) prokázala pouze nespecifický nález zvýšené aktivity v oblasti ramenních a kyčelních kloubů a bederní páteře. Bylo doplněno FDG-PET/CT vyšetření, které prokázalo zvýšenou akumulaci FDG v kloubních synoviálních strukturách glenohumerálních, sternoklavikulárních a kyčelních kloubů a v extraartikulárních synoviálních strukturách mezi spinózními výběžky obratlů krční a bederní páteře, v oblastech pertrochanterických a ischiogluteálních burz a kolem zevních hran stydkých kostí. Vyšetření neprokázalo vaskulitidu velkých tepen ani ložiska malignity. Radiolog na základě nálezu vyslovil podezření na PMR a pacientka byla odeslána k vyšetření do revmatologické ambulance II. interní kliniky Fakultní nemocnice u sv. Anny v Brně. Diagnóza PMR byla potvrzena klinickým vyšetřením. Pro stanovení diagnózy byla použita předběžná klasifikační kritéria EULAR/ACR pro PMR z roku 2012.
V květnu roku 2014 byla zahájena terapie prednisonem v dávce 15 mg denně a současně profylaktická terapie vápníkem a vitamínem D3 (Caltrate 600 mg/ 400 IU D3). Z důvodu vyššího rizika komplikaci v horní části gastrointestinálního traktu byl do léčby přidán rovněž omeprazol. Při prvním kontrolním vyšetření v červnu 2014 nemocná udávala výrazné a rychle nastupující zmírnění subjektivních potíží, laboratorní vyšetření prokázalo pokles hladiny CRP (17,7 mg/l). Denzitometrické vyšetření (DEXA) zjistilo mírnou osteopenii v oblasti bederní páteře (T-skóre -1,1). Vzhledem k přetrvávající laboratorní zánětlivé aktivitě byla ponechána stávající dávka prednisonu 15 mg denně. Dva měsíce od zahájení léčby pacientka udávala mírnou bolest v oblasti paží a kolen a rovněž přetrvávající únavu a nově si stěžovala na nervozitu a podrážděnost jako možný nežádoucí efekt léčby glukokortikoidy (GK). Terapie byla rozšířena o perorální (p.o.) methotrexát (MTX) v dávce 10 mg 1x týdně se současným podáváním folátu. Po dvou dávkách však musela být léčba MTX přerušena z důvodu kožní vyrážky. Dávka prednisonu proto byla zvýšena na 20 mg denně. V srpnu 2014 pacientčiny potíže zcela odezněly, laboratorní vyšetření prokazovalo normální hodnoty CRP (4,67 mg/l), dávka prednisonu byla postupně redukována na 15 mg a následně na 10 mg denně. V říjnu 2014 pacienta prodělala akutní respirační infekci, po které došlo k relapsu PMR. Revmatolog navrhl změnu strategie léčby GK, ukončení p.o. prednisonu a zahájení léčby metylprednisolonem acetátem (MPA) aplikovaným intramuskulárně (i.m.) v dávce 120 mg každé 3 týdny. Protože nedošlo k ústupu potíží, pacientka se bez konzultace s revmatologem rozhodla přidat ke stávající léčbě MPA rovněž prednison v dávce 10 mg denně. Při této terapii odezněly subjektivní potíže. V následujícím období přetrvávala remise onemocnění. Kontrolní FDG-PET/CT vyšetření, provedené v březnu 2015, tento nález potvrdilo. Dávka parenterálního MPA byla postupně redukována vždy o 20 mg přibližně každé 2 měsíce a pokračovala terapie prednisonem 5 mg denně. V červenci 2015 byl stav komplikován frakturou obratového těla prvního bederního obratle (vznik při zvedání těžšího břemene). Následně provedené vyšetření DXA prokázalo pokles hustoty kostního minerálu (BMD) v bederní páteři a osteoporózu 4. bederního obratle (T-skóre -2,6). Byla zahájena terapie ibandronátem v dávce 150 mg p.o. 1x měsíčně. Při přetrvávající remisi PMR byla léčba i.m. MPA ukončena v červenci 2016, zatím co pokračovala léčba p.o. prednisonem v dávce 5 mg denně. V srpnu 2016 však došlo opět k relapsu onemocnění. Ošetřující lékař požádal příslušnou zdravotní pojišťovnu o úhradu léčby biologickým lékem tocilizumabem (TCZ) v souladu se splněním podmínek § 16 zákona č. 48/1997 sb. (Zákon o veřejném zdravotním pojištění), který umožňuje zdravotní pojišťovně hradit ve výjimečných případech zdravotní služby jinak zdravotní pojišťovnou nehrazené, a to v situacích, kdy je poskytnutí takových zdravotních služeb jedinou možností z hlediska zdravotního stavu nemocného. Úhrada TCZ byla pojišťovnou schválena.
Bezprostředně před zahájením léčby TCZ byla aktivita PMR ověřena USG a FDG-PET/CT vyšetřením. USG vyšetření prokázalo výpotek v obou subakromiálních burzách a oboustranně kolem šlachy dlouhé hlavy bicepsu a dále úponové změny při hrbolech sedacích kostí, při malém trochanteru směrem k iliopsoatické šlaše a přítomnost tekutiny v pertrochanterických burzách (obr. 1, 2, 3). FDG-PET/CT vyšetření potvrdilo aktivitu PMR průkazem synovitidy glenohumerálních, sternoklavikulárních a kyčelních kloubů a nálezem synovitidy extraartikulárních synoviálních struktur v interspinózních prostorách krční a bederní páteře, v pertrochanterických a ischiogluteálních burzách s naznačenou aktivitou prepubicky. Laboratorně byly patrny známy systémového zánětu (FW 47 mm/h, CRP 42,3 mg/l, interleukin-6 (IL-6) 164 ng/l). Pacientka si stěžovala na celkovou únavu, bolesti v oblasti ramenních pletenců, pánve a kolenních kloubů s ranní ztuhlostí trvající 180 minut. Aktivita onemocnění podle skóre PMR-AS byla vysoká (34, 4).
Obr. 1. Pravý ramenní kloub, longitudinální zobrazení šlachy dlouhé hlavy bicepsu s okolní tenosynovitidou. Vyšetření proběhlo na přístroji Philips iU22 povrchovou lineární sondou 12 MHz. 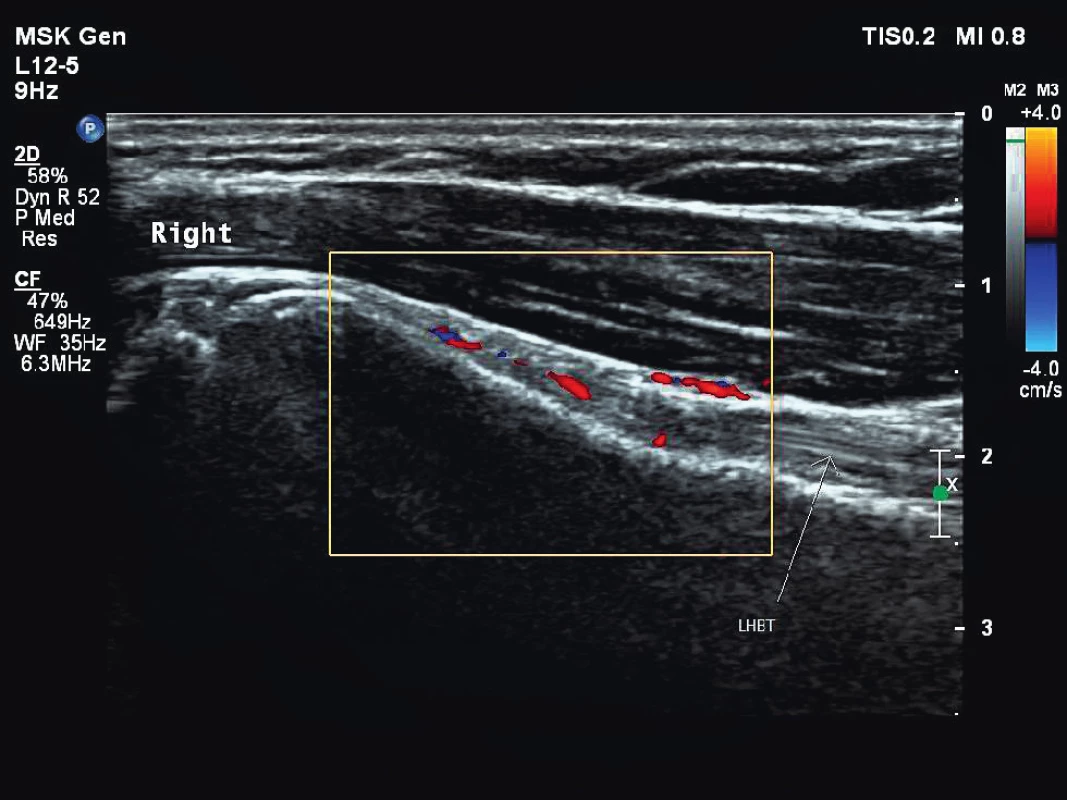
Obr. 2. Levý ramenní kloub, patologický zvýšená náplň v subakromiální burze, perfuze v rozšířené stěně burzy. Vyšetření proběhlo na přístroji Philips iU22 povrchovou lineární sondou 12 MHz. 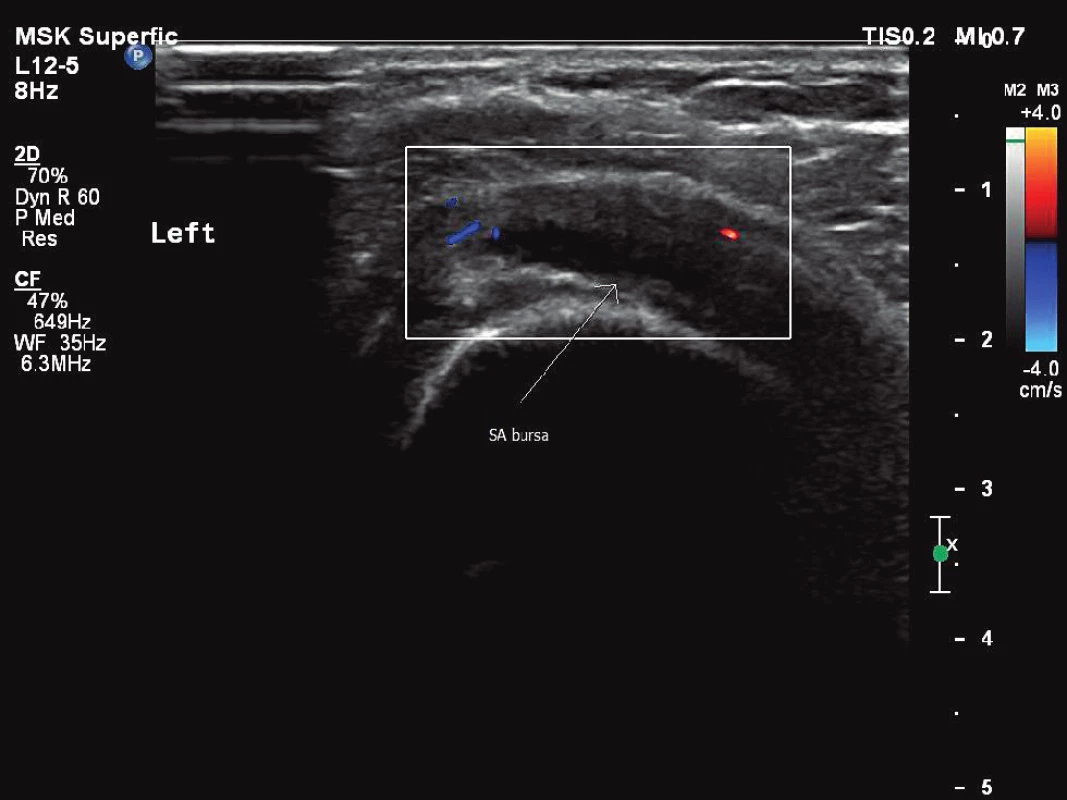
Obr. 3. Úponové změny s patologickou perfuzí v okolí šlach m. gluteus medius a minimus vpravo, jejich podélné zobrazení. Vyšetření proběhlo na přístroji Philips iU22 povrchovou lineární sondou 12 MHz. 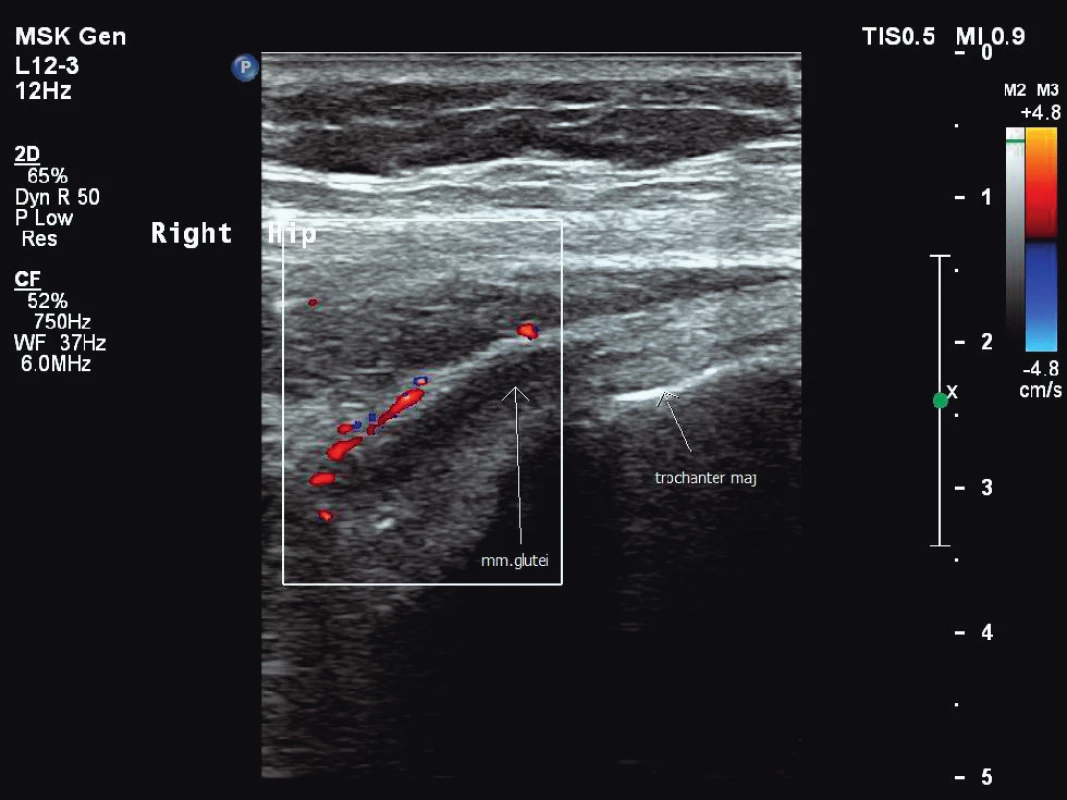
Dne 19. 9. 2016 byla při pokračující terapii p.o. prednisonem v dávce 5 mg denně podána první infuze TCZ v dávce 8 mg/kg (480 mg) intravenózně (i.v.). Již po první infuzi pacientka udávala výrazné zmírnění pletencových bolestí a zkrácení ranní ztuhlosti na 90 minut. PMR-AS kleslo na hodnotu 14,6 označující střední aktivitu onemocnění. Laboratorně byl rovněž patrný významný pokles hodnot reaktantů akutní fáze (FW 7 mm/h, CRP 0,3 mg/l). Kontrolní USG vyšetření, které bylo provedeno bezprostředně před podáním druhé infuze TCZ, prokázalo regresi dříve popisovaných nálezů v oblasti ramenních kloubů a pánve s ústupem aktivity zánětu a s přetrvávajícím zmnožením synoviální výstelky v popisovaných strukturách. Pokračovala terapie TCZ v dávce 8 mg/kg i.v. v intervalu 4 týdnů a prednisonem 5 mg denně.
V 16. týdnu léčby, před podáním 5. infuze TCZ, pacientka udávala ústup pletencových bolestí, ranní ztuhlost byla 30 minut, rovněž laboratorně přetrvávaly normální hodnoty reaktantů akutní fáze (FW 6 mm/h, CRP 0,4 mg/l, IL-6 36,4 ng/l). Podle PMR-AS byla přítomna remise onemocnění (3,14). USG vyšetření prokazovalo pouze zesílení synoviální výstelky glenohumerálních a kyčelních kloubů, subakromiálních a pertrochanterických burz bez známek aktivní synovitidy. FDG-PET/CT vyšetření prokazovalo normalizací nálezu s pouze diskrétní aktivitou v jednom z interspinózních prostorů bederní páteře a v pertrochanterických burzách. Dále pokračovala terapie TCZ. Jeho dávka byl snížena na 4 mg/kg (280 mg) i.v. každé 4 týdny a pokračovala terapie prednisonem v dávce 5 mg denně.
Remise onemocnění přetrvávala i po 6 měsících léčby (PMR-AS = 3,14, FW 6 mm/h, CRP 0,1 mg/l, IL-6 20,4 ng/l). Dávka prednisonu byla snížena na 2,5 mg denně. Po 9. měsících léčby a přetrvávající remisi onemocnění (PMR-AS = 2,51, FW 5 mm/h, CRP 0,1 mg/l, IL-6 27,3 ng/l) byla léčba prednisonem ukončena. Přehled terapie a vývoje onemocnění je uveden v grafu 1.
Graf 1. Průběh revmatické polymyalgie u 52leté pacientky od stanovení diagnózy v květnu 2014. Graf ukazuje vývoj hladiny CRP a IL-6 v průběhu léčby onemocnění a od září 2016 také vývoj skóre PMR-AS. Barevné šipky označuji průběh léčby jednotlivými léky. V červenci 2015 byl stav komplikován rozvojem osteoporotické fraktury prvního bederního obratle. Z důvodu relapsu onemocnění po snížení dávky prednisonu na 5 mg denně a ukončení léčby methylprednisolonem acetátem byla v září 2016 zahájena terapie tocilizumabem v dávce 8 mg/ kg tělesné hmotnosti i.v. á 4 týdny. 
Po roce léčby přetrvávala remise onemocnění. Pacientka si stěžovala jen na občasné krátkodobé bolesti zápěstí, loktů, kolen a hlezenních kloubů ve vazbě na změny počasí, ranní ztuhlost byla do 5 minut. Hodnota PMR-AS = 1,51. Laboratorní vyšetření rovněž neprokazovalo přítomnost zánětu (FW 5 mm/h, CRP 0,1 mg/l, IL-6 22,4 ng/l). FDG-PET/CT vyšetření prokazovalo pouze hraniční akumulaci radiofarmaka při hrbolu sedací kosti vpravo a v oblasti pravé pertrochanterické burzy. Přehled výsledků provedených FDG-PET/CT vyšetření je uveden na obrázku 4. Při kontrolním vyšetření DEXA byl patrný nárůst hodnot BMD ve všech vyšetřovaných oblastech, přetrvával nález osteopenie bederních obratlů a distální části zápěstí. Pokračovala terapie TCZ v dávce 4 mg/kg i.v. každé 4 týdny, substituce vápníku a vitamínu D3 a terapie ibandronátem v dávce 150 mg p.o. měsíčně.
Obr. 4. Vývoj nálezů FDG-PET/CT vyšetření u pacientky s polymyalgia rheumatica. A) Vyšetření prokazuje zvýšenou akumulaci FDG v glenohumerálních, sternoklavikulárních a kyčelních kloubech, v prostorách mezi spinózními výběžky obratlů krční a bederní páteře, v oblastech pertrochanterických a ischiogluteálních burz a kolem zevních hran stydkých kostí. B) Vyšetření prokazuje remisi onemocnění s pouze mírnou akumulací FDG v oblasti pravé pertrochanterické burzy. C) Vyšetření prokazuje relaps onemocnění s aktivní synovitidou glenohumerálních, sternoklavikulárních a kyčelních kloubů a nálezem synovitidy v interspinózních prostorách krční a bederní páteře, v pertrochanterických a ischiogluteálních burzách a s naznačenou aktivitou prepubicky. D) Vyšetření prokazuje remisi onemocnění. E) Vyšetření prokazuje remisi onemocnění s pouze mírnou akumulací FDG v oblasti pravé pertrochanterické a ischiogluteální burzy. 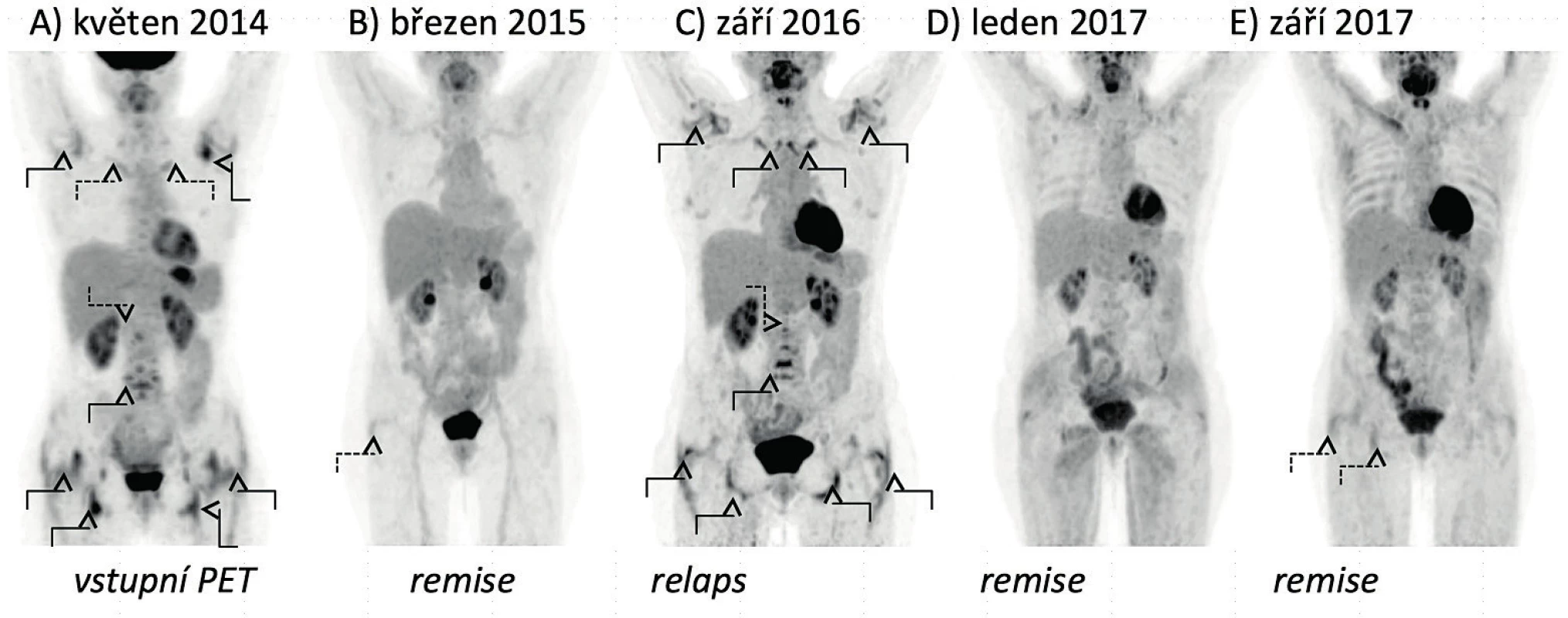
Zatím poslední vyšetření proběhlo v únoru letošního roku. Pacientka byla bez subjektivních potíží, hodnota PMR-AS = 0,8. V laboratoři přetrvávaly normální hodnoty FW 5 mm/h a CRP 0,2 mg/l, hladina IL-6 v séru byla 15,3 ng/l. Pokračovala terapie TCZ v dávce 4 mg/kg i.v. každé 4 týdny.
V průběhu terapie TCZ se vyskytly jen občasné nezávažné infekce horních cest dýchacích. Nebyl zaznamenán výskyt žádných závažných nežádoucích příhod spojených s léčbou. V průběhu terapie TCZ rovněž nebylo pozorováno zvýšení jaterních testů nebo pokles počtu neutrofilních granulocytů.
Léčba polymyalgia rheumatica
V roce 2015 byla publikována nová doporučení pro léčbu PMR vytvořená expertní skupinou EULAR a ACR (13). Tato doporučení byla vytvořena na základě principů medicíny založené na důkazech a rovněž s přihlédnutím na osobní názory expertů. Hlavní lékovou skupinou, používanou k terapii PMR, jsou GK. Strategii léčby GK je doporučeno volit individuálně tak, aby byl optimálně vybalancován přínos a rizika léčby. Individuální léčebná strategie by měla být zvolena po zhodnocení rizika léčby GK, přítomnosti komorbidit, doprovodné medikace a rizika relapsu onemocnění. GK by měly být podávány v jedné denní dávce. Minimální doporučená délka léčby GK je 12 měsíců. Iniciální dávka GK by se měla pohybovat v rozsahu 12,5–25 mg prednisonu nebo ekvipotentní dávky jiného perorálního GK denně. Vyšší dávky z uvedeného rozmezí by měly být použity u pacientů s vysokým rizikem relapsu onemocnění a s nízkým rizikem toxicity léčby. Naopak nižší dávky by měly být použity u pacientů s komorbiditami (např. diabetes mellitus, osteoporóza, glaukom atd.) a s vysokým rizikem toxicity léčby. Iniciální dávky prednisonu ≤ 7,5 mg/den nejsou doporučovány. Současně není doporučeno použití iniciální dávky > 30 mg/den, a to zejména z důvodu rizika spojeného s dlouhodobou léčbou vysokými dávkami GK a rovněž z důvodu nedostatku důkazu o účinnosti vysokých dávek GK u PMR (14–17). V situacích, kdy je vyžadována léčba vyššími dávkami GK, musí být zvažována možnost alternativní diagnózy.
Po vymizení symptomů a dosažení remise onemocnění je doporučeno zahájit redukci dávky GK. Konkrétní režim snižování dávky GK by měl být zvolen individuálně na základě pravidelného monitorování aktivity onemocnění, laboratorních parametrů a toxicity léčby. Je doporučeno snížit iniciální dávku prednisonu na 10 mg/den během 4–8 týdnů a dále snižovat dávku prednisonu o 1 mg každé 4 týdny až do ukončení léčby v případě, že trvá remise onemocnění. Redukce dávky může být v úvodu rychlejší, pokud byla iniciálně použita vyšší dávka prednisonu, a naopak pozvolnější, jestliže byla iniciálně použita nižší dávka prednisonu. V případě relapsu PMR je doporučováno zvýšení dávky prednisonu na poslední dávku předcházející vzniku relapsu a poté postupné snižování dávky během 4–8 týdnů na dávku, při které se relaps objevil.
Alternativně je možné zvážit použití parenterálního GK, zejména v situacích, kdy je žádoucí snížit celkovou kumulativní dávku GK, například u žen s obtížně kompenzovatelnou hypertenzí, diabetem mellitem, osteoporózou nebo glaukomem. Efekt MPA byl testován pouze v jedné randomizované, kontrolované klinické studii, do které bylo zařazeno 60 pacientů s PMR (18). Pacienti byli léčeni buď MPA podávaným i.m. v dávce 120 mg každé 3 týdny s následnou redukcí dávky, nebo p.o. prednisonem v dávce 15 mg denně s následnou redukcí dávky. Efekt obou způsobů léčby byl srovnatelný, ale kumulativní dávka byla nižší v případě MPA. Bezpečnost obou GK byla srovnatelná.
Dlouhodobá léčba PMR GK je spojena se zvýšeným rizikem nežádoucích příhod. Průměrná délka terapie se pohybuje mezi 20–28 měsíci. Přibližně u 50 % pacientů je možné ukončit terapii GK po 2 letech (24 % – 96 %). Až u 20 % pacientů je nutné v terapii GK pokračovat déle než 4 roky a u 10 % pacientů dokonce déle než 10 roků. V kohortě 232 pacientů s PMR, kteří byli sledováni průměrně 8 roků, byl pozorován výskyt minimálně jedné nežádoucí příhody u 65 % pacientů léčených GK a dokonce u 80 % pacientů léčených současně GK a nesteroidními antiflogistiky (19). Průměrná doba do vzniku první nežádoucí příhody byla 1,6 roků od zahájení léčby. Autoři identifikovali 3 faktory spojené se zvýšeným rizikem nežádoucích příhod: věk při diagnóze, kumulativní dávku prednisonu ≥ 1800 mg a ženské pohlaví. Riziko vývoje diabetu mellitu, vertebrálních zlomenin a zlomenin proximálního femuru bylo zvýšeno 2–5x ve srovnání se stejně starou zdravou populací.
Glukokortikoidy indukovaná osteoporóza (GIO) je nejčastější formou sekundární osteoporózy. GIO má specifické patofyziologické rysy a na rozdíl od postmenopauzální osteoporózy je riziko vzniku zlomenin zvýšeno již při méně výrazném poklesu BMD. Nízkotraumatické a často klinicky asymptomatické zlomeniny se zjišťují u třetiny až poloviny pacientů léčených GK. V posledních létech byla vytvořena řada doporučení a návodů k prevenci a léčbě GIO. Jednotlivá doporučení se však od sebe často v drobných nuancích liší a nezřídka jsou v rozporu s preskripčním omezením jednotlivých indikovaných léků (20–26). Prevence a léčba GIO by měla být zahájena v situaci, kdy je zahajována léčba GK v dávce ≥ 5 mg prednisonu denně a za předpokladu, že léčba GK bude trvat minimálně 3 měsíce, a zvláště u pacientů s vysokým rizikem vzniku zlomenin. Nefarmakologická opatření by měla zahrnovat úpravu životního stylu týkající se kouření, nadměrné konzumace alkoholu, sedavého způsobu života, nízké tělesné hmotnosti a pravidelné pohybové aktivity. Důležitou součástí farmakologické léčby by měla být adekvátní substituce vápníku a vitamínu D, zejména jeho aktivních forem (alfakalcidiol, kacitriol). Existují důkazy o tom, že podávání vápníku spolu s aktivními formami vitamínu D má pozitivní vliv na nárůst BMD. Dostupný je rovněž údaj o snížení rizika rozvoje vertebrálních zlomenin při léčbě vápníkem a alfakalcidiolem (27). K prevenci a léčbě GIO jsou dále indikovány bisfosfonáty. Klinická data jsou dostupná pro alendronát, risedronát a zolendronovou kyselinu (28–33). Bisfosfonáty prokazatelně zvyšují hodnotu BMD, ale důkaz o vlivu na snížení rizika vzniku vertebrálních zlomenin máme k dispozici pouze pro risedronát (29, 30). Při přímém srovnání zolendronové kyseliny a risedronátu byl zaznamenán významně lepší efekt zolendronové kyseliny na nárůst BMD páteře a krčku femuru (33). Výskyt nových zlomenin byl však v obou případech nízký a neumožnil hodnocení rozdílné účinnosti jednotlivých léků na snížení rizika vzniku zlomenin. Léčba GIO kyselinou zolendronovou je v České republice hrazena již při poklesu T-skóre pod hodnotu -1,5, u ostatních bisfosfonátů však až při poklesu T-skóre pod -2,5. Další možností léčby GIO je podávání osteoanabolického teriparatidu. Teriparatid v dávce 20 µg denně signifikantně zvyšuje BMD a snižuje riziko vertebrálních zlomenin (34–36).
Relapsy onemocnění se objevují v průběhu léčby u 23–55 % pacientů v závislosti na délce jejich sledování (37, 38). V prospektivní studii britských autorů, do které bylo zařazeno 129 pacientů s PMR, se během ročního sledování objevil relaps onemocnění u 33 % pacientů (39). Zvýšené hodnoty FW, CRP a IL-6 v době diagnózy korelují se zvýšeným rizikem relapsu a s nutností použít vyšší dávku GK, zvláště pokud abnormální hodnoty těchto parametrů přetrvávají i během léčby (40). Vysoká hladina hemoglobinu a nízké hodnoty FW jsou naopak spojeny s lepší odpovědí na léčbu GK (41). Ženy mívají ve srovnání s muži častěji refrakterní onemocnění, více relapsů, potřebu vyšší kumulativní dávky GK a dlouhodobé léčby GK, ale také více nežádoucích účinků léčby (42, 43). Riziko relapsu onemocnění je naopak snížené při dávce prednisonu vyšší než 10 mg denně a při opatrném snižování jeho dávky rychlostí méně než o 1 mg za měsíc. Údaje o využití USG nebo PET/CT v predikci rizika vývoje relapsů onemocnění zatím chybí.
U pacientů s vysokým rizikem relapsu onemocnění a rovněž u pacientů s rizikovými faktory, komorbiditami a doprovodnou terapií, u kterých lze očekávat zvýšený výskyt nežádoucích účinků GK, je doporučeno zvážit časné přidání MTX k terapii GK. Použití MTX by mělo být rovněž zvažováno u pa-cientů s relapsem onemocnění, a to nezávisle na léčbě GK a dále u pacientů s nedostatečnou odpovědí na léčbu GK nebo u pacientů s projevy toxicity léčby GK. MTX byl testován ve 4 randomizovaných, kontrolovaných studiích a jedné retrospektivní studii, ve kterých byl používán v dávkách 7,5–10 mg týdně (44–47). S výjimkou jedné méně kvalitní studie byl zaznamenán pozitivní efekt MTX, ale použití MTX nevedlo k redukci toxicity GK.
Použití ostatních léků ze skupiny konvenčních nebo cílených syntetických, chorobu modifikujících léků není doporučeno z důvodu chybění evidence o jejich účinnosti.
V odborné literatuře lze najít řadu retrospektivních údajů, ale i ojedinělé prospektivní, kontrolované studie prokazující efekt biologických léků v léčbě PMR, OBA nebo Takayasuovy arteriitidy (TA). Četné práce se věnují inhibitorům tumor nekrotizujícího faktoru α (TNFα), zejména infliximabu, etanerceptu nebo adalimumabu, a jejich efektu u PMR a TA (48–50). V recentní randomizované, placebem kontrolované studii, do které byly zařazováni pacienti s nově diagnostikovanou a relabující OBA, byl prokázán lepší efekt abataceptu přidaného ke standardní terapii prednisonem na dosažení a udržení remise onemocnění (51). Některé práce prokazují pozitivní efekt léčby ustekinumabem u pacientů s relabující OBA a rituximabem u pacientů s refrakterní TA (52, 53). Přesto autoři aktuálních doporučení k léčbě PMR nedoporučují použití biologických léků ze skupiny TNFα inhibitorů k léčbě PMR zejména z důvodu nedostatečné evidence o účinnosti a určitých obav o bezpečnost a vysokou nákladovost léčby (13). Výsledky některých již publikovaných nebo probíhajících prospektivních studií však mohou toto stanovisko v blízké budoucnosti změnit.
V poslední době narůstá evidence o roli IL-6 v patogenezi PMR a systémových vaskulitid postihující tepny velkého a středního kalibru. U pacientů s těmito chorobami byla prokázána zvýšená koncentrace IL-6 v séru a v zánětlivých tkáních a korelace jeho sérové hladiny s aktivitou onemocnění (54).
IL-6 je pleotropní cytokin produkovaný zejména T-lymfocyty a makrofágy, který má řadu prozánětlivých, metabolických, ale i protizánětlivých účinků. Účastní se regulace imunitní odpovědi, stimuluje produkci reaktantů akutní fáze, podílí se na hematopoeze a na metabolismu kostí a kosterních svalů (55). IL-6 zprostředkovává svůj efekt prostřednictvím vazby na IL-6 receptor (IL-6R). Ten existuje ve formě solubilní (sIL-6R) a membránové (mIL6-R) vázané na povrchu některých buněk, například neutrofilů, makrofágů nebo některých T-lymfocytů. IL-6R je tvořen dvěma řetězci, vlastním receptorem pro IL-6 o molekulové hmotnosti 80 kDa s krátkou cytoplazmatickou doménou a transmembránovým glykoproteinem gp130, který zajišťuje přenos signálu do buňky. Efekt IL-6 může být rovněž zprostředkován tzv. trans-signalizací po vazbě komplexu IL-6/sIL-6R na podjednotku gp130, která je exprimována na povrchu mnoha různých buněk lidského těla (56).
Recentně se v literatuře objevují zprávy o pozitivním efektu tocilizumabu (TCZ) v léčbě pacientů s PMR, OBA a rovněž TA. TCZ je humanizovaná monoklonální protilátka proti IL-6R, která inhibuje obě izoformy tohoto receptoru a blokuje tak účinky IL-6. Protizánětlivý efekt TCZ se uplatňuje v léčbě řady autoimunitních a zánětlivých onemocnění jako je revmatoidní artritida, juvenilní idiopatická artritida, Stillova choroba dospělých, Castlemanova nebo Crohnova choroba (57). V září loňského roku schválila European Medicines Agency (EMA) jeho použití i k léčbě OBA u dospělých pacientů. Podkladem pro toto rozhodnutí byly zejména výsledky roční randomizované, dvojitě zaslepené, placebem kontrolované studie GiACTA, do které bylo zařazeno celkem 251 pacientů s aktivní OBA. Pacienti byly v poměru 2 : 1:1 : 1 rozdělení do 4 skupiny léčených TCZ v dávce 162 mg s.c. 1x týdně nebo 1x za 14 dní v kombinaci s prednisonem, který byl postupně redukován a vysazen v intervalu 26 týdnů, nebo placebem opět v kombinaci s postupně se snižující dávkou prednisonu, a to buď v intervalu 26 nebo 52 týdnů. Primárním cílem studie bylo srovnání udržení remise onemocnění bez nutnosti léčby GK po 52 týdnech léčby mezi jednotlivými skupinami pacientů. Ve skupinách pacientů léčených TCZ v dávce 162 mg jednou týdně nebo jednou za 14 dnů se udržela remise onemocnění u 56 % respektive 53 % pacientů, v obou placebových skupinách to bylo u 14 % respektive 18 % pacientů. Rozdíl proti placebu byl v obou skupinách významný (p < 0,001). Kumulativní dávka prednisonu byla v obou skupinách léčených TCZ přibližně poloviční proti placebové skupině (1 862 vs. 3 296 mg resp. 3 818 mg, p < 0,001). Závažné nežádoucí příhody byly méně časté ve skupinách léčených TCZ (58).
V roce 2010 Hagihara a kol. poprvé reportovali o případu 71leté pacientky s relabující PMR léčené prednisonem v dávkách 8–10 mg denně s dekompenzovaným diabetem mellitem, hypertenzí a osteoporózou. Pětiměsíční léčba TCZ vedla k remisi PMR a po jedenácti měsících léčby mohl být dávka prednisonu redukována na 6 mg denně (59). V odborné literatuře lze nalézt řadu retrospektivních dat prokazující příznivý efekt TCZ v léčbě jednotlivců nebo malých sérií pacientů s PMR s nebo bez příznaků OBA (60–64).
Efekt a bezpečnost léčby TCZ v léčbě PMR byly dále testovány ve dvou otevřených prospektivních studiích. Do studie TENOR (Tolerance and Efficacy of tocilizumab iN pOlymyalgia Rheumatica) (NCT01713842) bylo zařazeno 20 pacientů s aktivní PMR (PMR-AS > 10) s trváním symptomů onemocnění do 1 roku, kteří nebyli doposud léčeni GK. V první fázi studie byl aplikován TCZ i.v. v dávce 8 mg/kg, v týdnech 0, 4 a 8 bez přidání GK (65). Ve 12. týdnu byla zahájena terapie prednisonem v dávce 0,15 mg/kg. Remise onemocnění ve 12. týdnu léčby byla dosažena u všech pacientů. V průběhu dalšího sledování nebyl zaznamenán žádný relaps onemocnění a nutnost záchranné léčby. Kumulativní dávka prednisonu ve 24. týdnu studie byla proti hypotetické skupině nemocných méně než poloviční (1 690,5 mg vs. 808,5 mg).
Do otevřené, prospektivní studie fáze IIa bylo zařazeno 10 pacientů s PMR, kteří byli léčeni prednisonem v dávce ≤ 20 mg denně ne déle než jeden měsíc (66). Pacientům ve studii byl aplikován TCZ i.v. v dávce 8 mg/kg každé 4 týdny. Hodnoceno bylo nakonec 9 pacientů. U všech pacientů byl splněn primární cíl studie, remise onemocnění po 6 měsících léčby TCZ bez nutnosti léčby GK. U všech pacientů mohla být ukončena terapie prednisonem během prvních 4 měsíců léčby. Remise u všech pacientů přetrvávala po celou dobu sledování (15 měsíců).
Diskuse
Popisujeme případ pacientky s refrakterní PMR, která byla dlouhodobě léčena GK. Iniciální dávka prednisonu 15 mg denně sice vedla k částečnému zmírnění příznaků onemocnění, ale nikoli k jeho úplné remisi. MTX, který byl přidán do léčby, musel být předčasně ukončen z důvodu nežádoucích účinků. Následně proto byla léčba GK upravena a pacientka byla dlouhodobě léčena kombinací parenterálního MPA a p.o. prednisonu. V tomto období byl pacientčin stav dále komplikován nízkotraumatickou frakturou prvního bederního obratle a diagnózou osteoporózy. K relapsu onemocnění došlo v situaci, kdy byla ukončena terapie MPA a pokračovala pouze terapie prednisonem v dávce 5 mg denně. Následně byla zahájena léčba TCZ v dávce 8 mg/kg i.v. každé 4 týdny. Již po první infuzi došlo k významnému poklesu klinické aktivity onemocnění. Po čtyřech infuzích TCZ byla dosažena remise onemocnění. V této situaci jsme se rozhodli pokračovat v terapii TCZ v redukované dávce 4 mg/ kg každé 4 týdny. Po 6 měsících léčby TCZ mohla být dávka prednisonu snížena na 2,5 mg denně a po 9 měsících léčby byl prednison vysazen. V průběhu léčby TCZ došlo k normalizaci hodnot FW a CRP. Hladina IL-6 při léčbě klesla, ale zůstávala po celou dobu léčby nad hranicí normy. Remise onemocnění přetrvávala i po roce léčby TCZ, což potvrdilo i FDG-PET vyšetření.
V souladu se současnými poznatky může být zvažováno použití TCZ v léčbě refrakterních forem PMR zejména při přítomnosti komorbidit, u pacientů s vysokým rizikem toxicity léčby GK nebo při výskytu nežádoucích účinků léčby a dále v situacích, kdy pacient netoleruje léčbu MTX. TCZ by měl být přidán ke stávající terapii GK a jejich dávka by neměla být v úvodu změněna, aby mohl být lépe zhodnocen efekt TCZ. Při terapii TCZ dochází často k normalizaci laboratorních známek zánětu, a proto může být hodnocení odpovědi na léčbu, případně hodnocení relapsu onemocnění na základě laboratorních hodnot zkreslené. Proto je nutné při terapii TCZ využít k hodnocení aktivity onemocnění nejen laboratorní parametry, ale především klinické vyšetření, případně moderní zobrazovací techniky. Také v našem případě došlo po zahájení léčby k normalizaci hodnot CRP a FW, ale přetrvávaly mírně zvýšené hodnoty sérové hladiny IL-6. V průběhu terapie TCZ dochází často k nárůstu hladiny IL-6. Důvodem není zvýšení jeho produkce, ale spíše léčbou navozená blokáda IL-6R indukované degradace tohoto cytokinu (67).
Jestliže je léčbou TCZ dosažena dlouhodobá remise onemocnění, může být zvážená redukce léčby buď snížením dávky TCZ, nebo prodloužením intervalu mezi jednotlivými aplikacemi. V současné době však nemáme dostatek informaci o tom, kdy a jakým způsobem by mělo k redukci léčby TCZ dojít. U pacientů s komorbiditami nebo s výskytem nežádoucích účinků GK by dalším cílem léčby mělo být co nejrychlejší ukončení léčby GK. Jestli může být redukce dávky GK rychlejší než je v současnosti doporučováno, tedy rychlostí o 1 mg za měsíc, není zcela jasné. Redukci dávky TCZ by zřejmě bylo vhodné zahájit až po ukončení léčby GK.
Závěr
PMR je nejčastější zánětlivé onemocnění osob starších 50 roků s vrcholem výskytu v osmém decenniu. Skutečnost, že toho onemocnění postihuje zejména osoby vyššího věku, vede k faktu, že se často jedná o jedince s četnými komorbiditami a s vysokým rizikem výskytu nežádoucích účinků léčby. Zlatým standardem v léčbě PMR zůstávají GK. Léčebná strategie onemocnění by měla být stanovena individuálně tak, aby byly optimálně vybalancovány přínosy a rizika léčby. Je doporučeno použití co nejnižší účinné dávky a co nejkratší účinné délky léčby GK. Přesto bývá průměrná délka léčby GK okolo 20–28 měsíců. Relapsy onemocnění se v průběhu léčby objevují u 23–55 % pacientů v závislosti na délce jejich sledování a značná část pacientů se potýká s nežádoucími účinky léčby GK. U takových pacientů může být zvažováno použití MTX. Současná doporučení k léčbě PMR nedoporučují použití biologických léků zejména z důvodu nedostatku důkazů o jejich účinnosti, ale rovněž z důvodů obav z potenciálních nežádoucích účinků a vysoké ceny léčby. V odborné literatuře přibývá důkazů o pozitivním efektu TCZ v léčbě PMR. Evidence o jeho účinnosti však zatím pochází pouze z retrospektivních a několika malých otevřených prospektivních studií. Příznivý efekt a bezpečnost TCZ v léčbě PMR potvrzují i naše zkušenosti. Aby však mohl být TCZ pevně zakotven v léčebných strategiích PMR, bude třeba získat pozitivní data z rozsáhlejších prospektivních, randomizovaných, kontrolovaných studií u pacientů s PMR.
adresa pro korespondenci:
Doc. MUDr. Petr Němec, Ph.D.
Revmatologická ambulance II. interní kliniky
FN u sv. Anny v Brně a LF MU
Pekařská 53
656 91 Brno
e-mail: petr.nemec@fnusa.cz
Zdroje
1. Smeeth L, Cook C, Hall AJ. Incidence of diagnosed polymyalgia rheumatica and temporal arteritis in the United Kingdom, 1990–2001. Ann Rheum Dis 2006 ;65(8): 1093 – 8.
2. Rooney PJ, Rooney J, Balint G, et al. Polymyalgia rheumatica: 125 years of epidemiological progress? Scott Med J 2015; 60(1): 50–7.
3. Sonnenblick M, Nesher G, Friedlander Y, et al. Giant cell arteritis in Jerusalem: a 12 year epidemiological study. Br J Rheumatol 1994; 33(10): 938–41.
4. Salvarani C, Gabriel SE, O‘Fallon WM, et al. Epidemiology of polymyalgia rheumatica in Olmsted County, Minnesota, 1970–1991. Arthritis Rheum 1995; 38(3): 369–73.
5. Gonzalez-Gay MA, Vasquez-Rodriguez TR, Lopez-Diaz MJ, et al. Epidemiology of giant cell arteritis and polymyalgia rheumatica. Arthritis Rheum (Arthritis Care Res) 2009; 61 : 1454–61.
6. Salvarani C, Cantini F, Boiardi L, et al. Polymyalgia rheumatica and giant cell arteritis. New Eng J Med 2002; 347 : 261–267.
7. Ross RT. From the Tadhkirat of Ali Ibn Isa of Baghdad (c 940–1010 AD)–an ancient description of what may be temporal arteritis. J Neurol Neurosurg Psychiatry 1988; 51 : 528.
8. Calvo-Romero JM. Giant cell arteritis. Postgrad Med J 2003; 79 : 511–15.
9. Gonzalez-Gay MA. Genetic epidemiology. Giant cell arteritis and polymyalgia rheumatica. Arthritis Res 2001; 3(3): 154–7.
10. Dasgupta B, Cimmino MA, Maradit-Kremers H, et al. 2012 provisional classification criteria for polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann Rheum Dis 2012; 71(4): 484–92.
11. Leeb BF, Bird HA. A disease activity score for polymyalgia rheumatica. Ann Rheum Dis 2004; 63(10): 1279–83.
12. Leeb BF, Rintelen B, Sautner J, Fassl C, et al. The polymyalgia rheumatica activity score in daily use: proposal for a definition of remission. Arthritis Rheum 2007;57(5):810-5.
13. Dejaco C, Singh YP, Perel P, et al. 2015 Recommendations for the management of polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann Rheum Dis 2015; 74(10): 1799–807.
14. Duru N, van der Goes MC, Jacobs JWG, et al. EULAR evidence-based and consensus-based recommendations on the management of medium to high-dose glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis 2013; 72 : 1905–13.
15. Grossman JM, Gordon R, Ranganath VK, et al. American College of Rheumatology 2010 recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Care Res (Hoboken) 2010; 62 : 151 5 – 26.
16. Van der Goes MC, Jacobs JWG, Boers M, et al. Monitoring adverse events of low-dose glucocorticoid therapy: EULAR recommendations for clinical trials and daily practice. Ann Rheum Dis 2010; 69 : 1913–19.
17. Hoes JN, Jacobs JWG, Boers M, et al. EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis. 2007; 66 : 1560–7.
18. Dasgupta B, Dolan AL, Panayi GS, et al. An initially double-blind controlled 96 week trial of depot methylprednisolone against oral prednisolone in the treatment of polymyalgia rheumatica. Br J Rheumatol 1998; 37 : 189–95.
19. Gabriel SE, Sunku J, Salvarani C, et al. Adverse outcomes of antiinflammatory therapy among patients with polymyalgia rheumatica. Arthritis Rheum 1997; 40(10): 1873–8.
20. Recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis: 2001 update. American College of Rheumatology Ad Hoc Committee on Glucocorticoid-Induced Osteoporosis. Arthritis Rheum. 2001; 44(7): 1496–503.
21. Adler RA, Hochberg MC. Suggested guidelines for evaluation and treatment of glucocorticoid-induced osteoporosis for the Department of Veterans Affairs. Arch Intern Med 2003; 163(21): 2619–24.
22. Geusens PP, de Nijs RN, Lems WF, et al. Prevention of glucocorticoid osteoporosis: a consensus document of the Dutch Society for Rheumatology. Ann Rheum Dis 2004; 63(3): 324–5.
23. Briot K, Cortet B, Roux C, et al. 2014 update of recommendations on the prevention and treatment of glucocorticoid-induced osteoporosis. Joint Bone Spine 2014; 81(6): 493–501.
24. Devogelaer JP, Goemaere S, Boonen S, et al. Evidence-based guidelines for the prevention and treatment of glucocorticoid-induced osteoporosis: a consensus document of the Belgian Bone Club. Osteoporos Int 2006; 17(1): 8–19.
25. Nawata H, Soen S, Takayanagi R, et al. Guidelines on the management and treatment of glucocorticoid-induced osteoporosis of the Japanese Society for Bone and Mineral Research (2004). J Bone Miner Metab 2005; 23(2): 105–9.
26. Grossman JM, Gordon R, Ranganath VK, et al. American College of Rheumatology 2010 recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Care Res (Hoboken) 2010; 62(11): 1515–26.
27. Ringe JD, Dorst A, Faber H, et al. Superiority of alfacalcidol over plain vitamin D in the treatment of glucocorticoid-induced osteoporosis. Rheumatol Int 2004; 24(2): 63–70.
28. Saag KG, Emkey R, Schnitzer TJ, Brown JP, Hawkins F, Goemaere S et al. Alendronate for the prevention and treatment of glucocorticoid-induced osteoporosis. N Engl J Med 1998; 339(5): 292–9.
29. Cohen S, Levy RM, Keller M, Boling E, Emkey RD, Greenwald M et al. Risedronate therapy prevents corticosteroid-induced bone loss: a twelve-month, multicenter, randomized, double-blind, placebo-controlled, parallel-group study. Arthritis Rheum 1999; 42(11): 2309–18.
30. Wallach S, Cohen S, Reid DM, Hughes RA, Hosking DJ, Laan RF et al. Effects of risedronate treatment on bone density and vertebral fracture in patients on corticosteroid therapy. Calcif Tissue Int 2000; 67(4): 277–85.
31. Black DM, Delmas PD, Eastell R, Reid IR, Boonen S, Cauley JA et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007; 356(18): 1809–22.
32. Lyles KW, Colón-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C et al. Zoledronic acid in reducing clinical fracture and mortality after hip fracture. N Engl J Med 2007; 357 : 1799–809.
33. Reid DM, Devogelaer JP, Saag K, et al. Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet 2009; 373(9671): 1253–63.
34. Saag KG, Shane E, Boonen S, et al. Teriparatide or alendronate in glucocorticoid-induced osteoporosis. N Engl J Med 2007; 357(20): 2028–39.
35. Saag KG, Zanchetta JR, Devogelaer JP, et al. Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of a randomized, double-blind, controlled trial. Arthritis Rheum 2009; 60(11): 3346–55.
36. Langdahl BL, Marin F, Shane E, et al. Teriparatide versus alendronate for treating glucorticoid-induced osteoporosis: an analysis by gender and menopausal status. Osteoporosis Int 2009; 20(12): 2095–104.
37. González-Gay MA, Garcia-Porrua C, Vazquez-Caruncho M, et al. The spectrum of polymyalgia rheumatica in north western Spain: incidence and analysis of variables associated with relapse in a 10 year study. J Rheumatol 1999; 26(6): 1326–32.
38. Narváez J, Nolla-Sole JM, Clavaguera MT, et al. Long-term therapy in polymyalgia rheumatica: effect of coexistent temporal arteritis. J Rheumatol 1999; 26(9): 1945–1952.
39. Hutchings A, Hollywood J, Lamping DL, et al. Clinical outcomes, quality of life, and diagnostic uncertainty in the first year of polymyalgia rheumatica. Arthritis Rheum 2007; 57(5): 803–9.
40+. Kremers HM, Reinalda MS, Crowson CS, et al. Relapse in a population based cohort of patients with polymyalgia rheumatica. J Rheumatol 2005; 32(1): 65–73.
41. +Myklebust G, Gran JT. Prednisolone maintenance dose in relation to starting dose in the treatment of polymyalgia rheumatica and temporal arteritis: a prospective two-year study in 273 patients. Scand J Rheumatol 2001; 30(5): 260–7.
42. +Cimmino MA, Parodi M, Caporali R, et al. Is the course of steroid-treated polymyalgia rheumatica more severe in women? Ann N Y Acad Sci 2006; 1069 : 315–21.
43. +Dasgupta B, Dolan AL, Panayi GS, et al. An initially double-blind controlled 96-week trial of depot methylprednisolone against oral prednisolone in the treatment of polymyalgia rheumatica. Br J Rheumatol 1998; 37(2): 189-95.
44. Caporali R, Cimmino MA, Ferraccioli G, et al. Prednisone plus methotrexate for polymyalgia rheumatica: a randomized, double-blind, placebo-controlled trial. Ann Intern Med 2004; 141 : 493–500.
45. Van der Veen MJ, Dinant HJ, van Booma-Frankfort C, et al. Can methotrexate be used as a steroid sparing agent in the treatment of polymyalgia rheumatica and giant cell arteritis? Ann Rheum Dis 1996;55 : 218–23.
46. Ferraccioli G, Salaffi F, De Vita S, et al. Methotrexate in polymyalgia rheumatica: preliminary results of an open, randomized study. J Rheumatol 1996; 23 : 624–8.
47. Nazarinia AM, Moghimi J, Toussi J. Efficacy of methotrexate in patients with polymyalgia rheumatica. Koomesh 2012; 14 : 265–70.
48. Kreiner F, Galbo H. Effect of etanercept in polymyalgia rheumatica: a randomized controlled trial. Arthritis Res Ther 2010; 12(5): R176.
49. Aikawa NE, Pereira RM, Lage L, et al. Anti-TNF therapy for polymyalgia rheumatica: report of 99 cases and review of the literature. Clin Rheumatol 2012; 31(3): 575–9.
50. Bejerano C, Blanco R, González-Vela C, et al. Refractory polymyalgia rheumatica as presenting manifestation of large-vessel vasculitis associated to sarcoidosis. Successful response to adalimumab. Clin Exp Rheumatol 2012; 30(1 Suppl 70): S94–7.
51. Langford CA, Cuthbertson D, Ytterberg SR, et al. A Randomized, Double-Blind Trial of Abatacept (CTLA-4Ig) for the Treatment of Giant Cell Arteritis. Arthritis Rheumatol 2017; 69(4): 837–45.
52. Conway R, O‘Neill L, O‘Flynn E, et al. Ustekinumab for the treatment of refractory giant cell arteritis. Ann Rheum Dis 2016; 75(8): 1578–9.
53. Samson M, Espígol-Frigolé G, Terrades-García N, et al. Biological treatments in giant cell arteritis & Takayasu arteritis. Eur J Intern Med. 2018; 50 : 12–9.
54. Martinez-Taboada VM, Alvarez L, RuizSoto M et al. Giant cell arteritis and poylymalgia rheumatica: role of cytokines in the pathogenesis and implication for treatment. Cytokine 2008; 44 : 207–20.
55. Naka T, Nishimoto N, Kishimoto T. The paradigm of OL-6 from basic science to medicine. Arthritis Re. 2002; 4(Suppl 3): S233–42.
56. Narazaki M, Yasukawa K, Saito T et al. Soluble forms of the interleukin-6 signal-transducing receptor component gp130 in human serum possessing a potential to inhibit signals through membrane-anchored gp130. Blood 1993; 82 : 1120–6.
57. Tanaka T, Narazaki M, Kishimoto T. Anti-interleukin-6 receptor antibody, tocilizumab, for the treatment of autoimmune diseases. FEBS Letters 2011; 585(23): 3699–709.
58. Stone JH, Tuckwel K, Dimonaco S, et al. Trial of tocilizumab in Giant-cell arteritis. NEJM 2017; 377(4): 317–28.
59. Hagihara K, Kawase I, Tanaka T et al. Tocilizumab ameliorates clinical symptoms in polymyalgia rheumatica. J Rheumatol 2010; 37 : 1075–6.
60. Christidis D, Jain S, Das Gupta B. Successful use of tocilizumab in polymyalgic onset biopsy positive GCA with large vessel involvement. BMJ Case Rep 2011; 2011: pii:bcr0420114135.
61. Unizony S, Arias-Urdaneta L, Miloslavsky E et al. Tocilizumab for the treatment of large-vessel vasculitis (giant cell arteritis, Takayasu arteritis) and polymyalgia rheumatica. Arthritis Care Res 2012; 64 : 1720–9.
62. Macchioni P, Boiardi L, Catanoso M et al. Tocilizumab for polymyalgia rheumatica: report of two cases and review of the literature. Semin Arthritis Rheum 2013; 43 : 113–18.
63. Al Rashidi A, Hegazi MO, Mohammad SA et al. Effective control of polymyalgia rheumatica with tocilizumab. J Clin Rheumatol 2013; 19 : 400–1.
64. Mori S, Koga Y. Glucocorticoid-resistant polymyalgia rheumatica: pretreatment characteristics and tocilizumab therapy. Clin Rheumatol 2016; 35(5): 1367–75.
65. Devauchelle V, Berthelot JM, Cornec D, et al. FRI0280 Efficacy and Safety of Tocilizumab as First Line Therapy in Patients with Recent Polymyalgia Rheumatica (PMR): Results of the First Longitudinal Prospective Study (Tenor). Ann Rheum Dis 2015; 74 : 526.
66. Lally L, Forbess L, Hatzis C, et al. Brief Report: A Prospective Open-Label Phase IIa Trial of Tocilizumab in the Treatment of Polymyalgia Rheumatica. Arthritis Rheumatol 2016; 68(10): 2550–4.
67. Uchiyama Y, Yoshida H, Koike N, et al. Anti-IL-6 receptor antibody increases blood IL-6 level via the blockade of IL-6 clearance, but not via the induction of IL-6 production. Int Immunopharmacol 2008; 8(11): 1595–601
Štítky
Dermatológia Detská reumatológia Reumatológia
Článek Úvodník
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2018 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Subkutánna imunoglobulínová terapia u pacientov so sekundárnou imunodeficienciou – dáta z reálnej klinickej praxe
- Výhody subkutánně podávaného methotrexátu
-
Všetky články tohto čísla
- Revmatologie v klinických scénářích
- Prof. MUDr. Zbyněk Hrnčíř, DrSc. – 85 let
- Úvodník
- Pyoderma gangrenosum a nekrotizující arteritida u pozdně začínající revmatoidní artritidy
-
Získaná hemofilie typu A – vzácná komplikace primárního Sjögrenova syndromu
Kazuistiky a literární přehled - Fertilita a revmatická onemocnění
- Revmatická polymyalgie jako komplikace léčby maligního melanomu nivolumabem
- Tocilizumab v léčbě polymyalgia rheumatica
- Seminář mladých revmatologů Špindlerův Mlýn, 15.–17. 5. 2018
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Revmatická polymyalgie jako komplikace léčby maligního melanomu nivolumabem
- Fertilita a revmatická onemocnění
- Prof. MUDr. Zbyněk Hrnčíř, DrSc. – 85 let
- Tocilizumab v léčbě polymyalgia rheumatica
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



