-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Lze ovlivnit strukturální progresi u pacientů s axiální spondyloartritidou?
Is it possible to modify structural progression in patients with axial spondyloarthritis?
Spondyloarthritides are chronic progressive inflammatory diseases with multiple and variable clinical symptoms. Exact pathophysiology of the diseases is currently unknown, but apparently key players are inflammatory cytokines such as tumour necrosis factor alpha (TNF-α) and interleukin 17 (IL-17). In treatment of patients with dominant axial involvement are besides traditional non-pharmacological procedures used nonsteroidal anti-inflammatory drugs (NSAID) and biological and biosimilar disease modifying drugs. Treatment targeted against main inflammatory cytokines is highly efficacious for disease symptoms and activity. Nevertheless, the question of whether we are currently able to slow or stop disease structural progression remains unanswered. This article focuses on current treatment options for axial spondyloarthritis (axSpA) in context of long-term radiographic progression.
Keywords:
ankylosing spondylitis – nonradiographic axial spondyloarthritis – structural progression – TNF-α inhibitors – nonsteroidal antiinflammatory drugs – secukinumab
Autoři: M. Gregová
Působiště autorů: Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha
Vyšlo v časopise: Čes. Revmatol., 27, 2019, No. 2, p. 50-56.
Kategorie: Přehledový článek
Souhrn
Spondyloartritidy jsou chronická progresivní zánětlivá onemocnění s širokou a pestrou škálou projevů. Přesná patofyziologie těchto onemocnění není doposud známa, klíčovou roli hrají zánětlivé cytokiny, jako je tumor nekrotizující faktor alfa (TNF-α) nebo interleukin 17 (IL-17). V terapii nemocných s dominantním axiálním postižením jsou vedle nefarmakologických postupů užívána nesteroidní antiflogistika (NSA) a biologické a biosimilární chorobu modifikující léky. Léčba cílená na prozánětlivě působící cytokiny je velice efektivní v ovlivnění projevů a aktivity onemocnění. Otázkou však zůstává, zda jsme v současné době schopni zastavit nebo zpomalit strukturální progresi onemocnění. Tento článek si klade za cíl zhodnotit současné možnosti léčby nemocných s axiální spondyloartritidou (axSpA) zejména v kontextu ovlivnění dlouhodobé radiografické progrese.
Klíčová slova:
ankylozující spondylitida – neradiografická axiální spondyloartritida – strukturální progrese – inhibitory TNF-α – nesteroidní antiflogistika – sekukinumab
ÚVOD
Spondyloartritidy (SpA) jsou skupinou chronických zánětlivých onemocnění s velice pestrými klinickými příznaky. Vzhledem k velké rozmanitosti projevů, které se často mezi jednotlivými onemocněními ze skupiny SpA překrývají, je v současnosti preferováno dělení dle dominantního kloubního postižení na formy axiální a periferní. Axiální spondyloartritidy (axSpA) lze dále rozdělit při využití klasifikačních kritérií Mezinárodní společnosti pro hodnocení spondyloartritid (Assessment of SpondyloArthritis international Society – ASAS) na neradiografickou axiální spondyloartritidu (nr-axSpA) a radiografickou axiální SpA, respektive ankylozující spondylitidu (AS) (1). Pro AS je charakteristická progredující ztráta hybnosti páteře doprovázená typickými erozivními a osteoproduktivními změnami patrnými při rentgenovém vyšetření. Pokroky v terapii i diagnostice onemocnění přinesly jasnější představu o patogenezi nemoci. Přesné patofyziologické pochody vedoucí k typickým strukturálním změnám nejsou stále zcela objasněné a otázka možnosti ovlivnění radiografické progrese onemocnění je tak stále horkým tématem současné revmatologie. V následujícím textu jsou předloženy aktuální poznatky týkající se této problematiky.
STRUKTURÁLNÍ LÉZE u axSpA
Axiální spondyloartritidy dělíme, jak již bylo uvedeno, na dva subtypy – radiografickou a neradiografickou axSpA. Pacienti s radiografickou formou onemocnění mají na prostém rentgenovém (RTG) snímku přítomny typické změny v oblasti sakroiliakálních skloubení (SI) a v pozdější fázi onemocnění i na páteři. Dle doporučení ASAS je k zobrazení SI skloubení pomocí RTG nejvhodnější snímek pánve v předozadní (AP) projekci, protože zachytí i abnormality kyčelních kloubů (2). Charakteristická je přítomnost kostních erozí, ale oproti například revmatoidní artritidě jsou velice typické i změny osteoproduktivní. V radiografickém obraze pokročilé AS jsou na RTG typicky zobrazeny syndesmofyty, gracilní kostěné návalky přemosťující dvě přilehlá obratlová těla, které se mohou vyskytovat v průběhu celé páteře. Na rozdíl od AS u pacientů s nr-axSpA tyto změny na RTG snímku nenacházíme, ale známky zánětu jsou jasné identifikované při vyšetření magnetickou rezonancí (MR). U obou subtypů axSpA není doposud jasné, zda se jedná o dvě formy onemocnění s významným překryvem projevů, nebo o jedno onemocnění zachycené v rozdílném časovém bodě (3). Zobrazení MR u pacientů s axSpA přineslo určité poznatky i v otázce patogeneze a progrese onemocnění. V současnosti převládá názor, že tvorba syndesmofytů souvisí přímo se zánětlivými a následnými reparativními procesy. Využitím dvou sekvencí může MR zachytit jak aktivní zánětlivé změny, které jsou popisovány jako edém kostní dřeně nebo osteitida, tak reparativní proces jako metaplazii tukové tkáně. Kostní novotvorba je pak nejlépe pozorovatelná na prostém RTG snímku nebo při vyšetření počítačovou tomografií (CT). Longitudinální studie využívající zobrazení páteře u pacientů s axSpA pomocí RTG i MR ukazují, že prvotní změnou je zánět (4). V místě zánětu cytokiny, jako je tumor nekrotizující faktor alfa (TNF-α) a interleukin 17 (IL-17), přímo nebo nepřímo aktivují prekurzorové buňky osteoklastů. Fáze aktivního zánětu je následována reparačním procesem (na páteři predilekčně v rozích obratlových těl) a následně se objevují známky kostní novotvorby ve formě syndesmofytů. Recentní studie ukazují, že kostní novotvorba se objevuje po vymizení aktivních zánětlivých změn v místech, kde je dle MR přítomna tuková metaplazie (5, 6). Na molekulární úrovni jsou osteoblasty diferencovány působením kostních morfogenních proteinů (bone morphogenic proteins – BMP) a Wnt signální cestou (7). V pokusu na hlodavčím modelu vedla inhibice Wnt antagonisty Dickkopf-1 ke změně fenotypu z destruktivní artritidy k ankylóze periferních kloubů i sakroiliakálního skloubení (8). Dalším mediátorem, který podporuje osteogenezi, predilekčně v místech tendoperiosteálního spojení, je interleukin 22 (IL-22) (9). Účast IL-17A na tomto procesu je stále otázkou výzkumu. Recentní práce Gravallese et al. ukazuje, že IL-17A jednak přispívá k aktivaci osteoklastogenze, ale také podporuje maturaci prekurzorových buněk v osteoblasty. I přes hlubší poznatky je přesná patogeneze strukturálních změn u axSpA stále nejasná a je předmětem dalšího výzkumu.
MOŽNOSTI HODNOCENÍ PROGRESE axSpA
Ankylozující spondylitida je progredující chronické onemocnění. Hlavním nástrojem a zlatým standardem v hodnocení strukturální progrese onemocnění je klasický rentgenový snímek, kterým se hodnotí rozsah a tíže postižení axSpA (10). Ke kvantifikaci páteřního poškození bylo vyvinuto několik skórovacích systémů. Nejvíce etablovaným skórovacím systémem je modifikované Stokesovo skóre (modified Stoke Ankylosing Spondylitis Spine Score – mSASSS) (11). K širšímu využívání přispívá i fakt, že skupiny ASAS a OMERACT doporučují používání mSASSS k hodnocení postižení páteře i v klinických studiích (12). Pomocí mSASSS jsou hodnoceny změny páteře jako kvadratizace obratlových těl, skleróza, eroze, syndesmofyty a přemosťující syndesmofyty na laterálních snímcích krční a bederní páteře. Výsledné skóre je pak v rozmezí 0 až 72 (11). Strukturální změny u SpA vznikají v závislosti na aktivitě onemocnění, nicméně rozvoj je spíše pozvolný. K možnosti zachycení signifikantních změn je doporučovaný interval RTG vyšetření páteře 2 roky (13). Progrese je nejčastěji hodnocena jako změna mSASSS o dvě jednotky za 2 roky nebo vznik nového syndesmofytu (14). Některými autory byla navržena ještě dodatečná klasifikace k určení rychlosti progrese onemocnění. Změna méně než 2 mSASSS jednotky nebo ne více než jeden syndesmofyt v průběhu 2 let je hodnoceno jako pomalá progrese, 2–5 mSASSS jednotek nebo ne více než 2 syndesmofyty za 2 roky středně rychlá progrese a více než 5 mSASSS jednotek nebo více než 2 syndesmofyty za 2 roky jako rychlá progrese (15). Strukturální progresi onemocnění je možné hodnotit také pomocí MR, kterou využívá tzv. Kanadské skóre neboli SPARCC (Spondyloarthritis Research Consortium of Canada MRI index). Pomocí SPARCC lze hodnotit jak změny na páteři, tak na sakroiliakálních kloubech. Hodnocena a bodována je přítomnost kostního edému ve STIR (Short-TI Inversion Recovery) sekvenci, kdy každá kostovertebrální jednotka je rozdělena na čtyři kvadranty a je hodnocena v šesti následujících sagitálních řezech. Maximální výsledné skóre je 72 (16).
MOŽNOSTI LÉČBY AXIÁLNÍ SPONDYLOARTRITIDY
V terapii axSpA se uplatňují jak farmakologické, tak nefarmakologické postupy. Hlavními cíli léčby axSpA jsou úleva od příznaků zánětlivého onemocnění, zejména ovlivnění bolesti, ztuhlosti a únavy. Dále zachování funkce, prevence komplikací v oblasti páteře a minimalizace a léčba mimokloubních projevů onemocnění a typických komorbidit. Základem terapie axSpA jsou edukace pacienta, režimová opatření a pravidelná pohybová aktivita. Ve farmakoterapii jsou stále první volbou nesteroidní antiflogistika (NSA), po jejich selhání nebo při existenci kontraindikací NSA je dalším terapeutickým krokem nasazení biologického nebo biosimilárního chorobu modifikujícího léku (biologic disease modifying antirheumatic drugs – bDMARD, biosimilar disease modifying antirheumatic drugs – bsDMARD). Jen omezené využití mají u axSpA konvenční chorobu modifikující léky (csDMARD), a to v léčbě extraspinálních projevů onemocnění. Systémové podávání glukokortikoidů není u pacientů s čistě axiální formou onemocnění indikováno. Přehled doporučeného postupu léčby axiální spondyloartritidy dle Evropské ligy proti revmatismu (EULAR) a ASAS z roku 2016 ukazuje obrázek 1 (17). Otázkou ale stále zůstává, zda dokážeme vlastní terapií ovlivnit strukturální progresi onemocnění.
Obr. 1. Doporučení pro léčbu axiální spondyloartritidy dle Evropské ligy proti revmatismu (EULAR) a Mezinárodní společnosti pro hodnocení spondyloartritid (ASAS) z roku 2016
axSpA – axiální spondyloartritida, NSA – nesteroidní antiflogistika, bDMARD – biologický chorobu modifikující lék, TNF-α – tumor nekrotizující faktor alfa, IL-17 – interleukin 17, i.a. – intraartikulární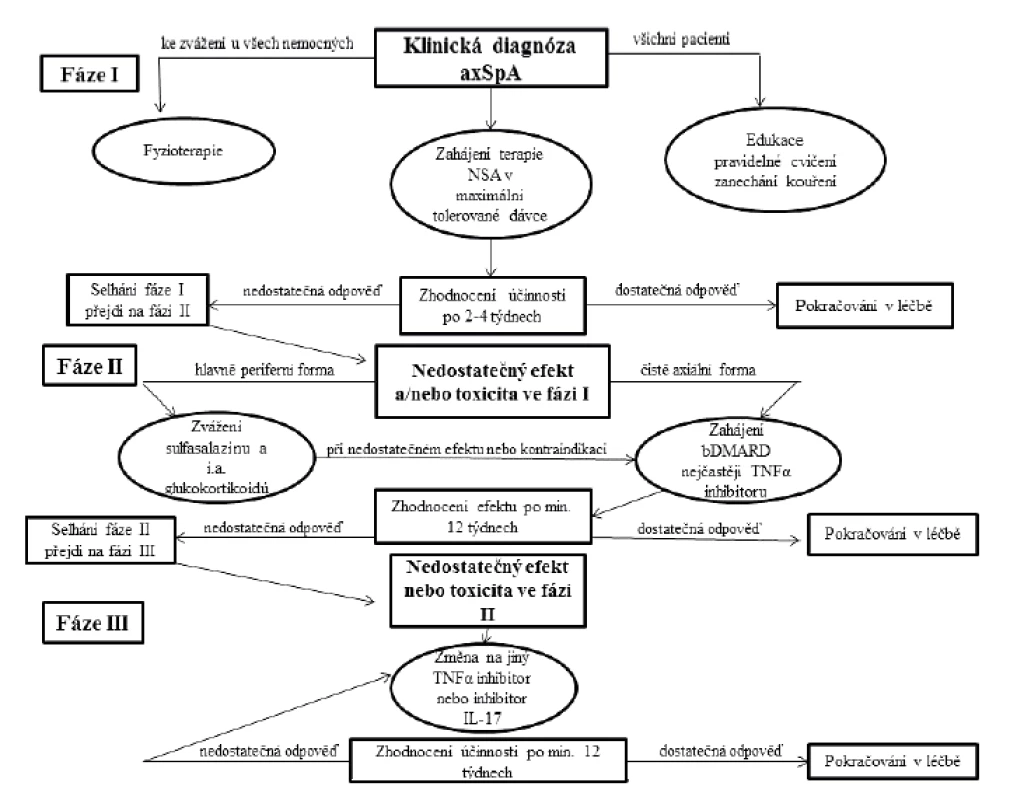
Nefarmakologické postupy a ovlivnění strukturální progrese onemocnění
Pravidelná pohybová aktivita a cvičení jsou základem léčby axSpA. Fyzioterapie a dlouhodobé samostatné cvičení vede k úlevě od příznaků onemocnění, jako je bolest a ztuhlost, ale také přispívá ke zlepšení funkčních parametrů a hybnosti páteře (18). Nicméně dlouhodobá sledování, která by vliv fyzioterapie na strukturální progresi onemocnění prokázala, chybí. Z nefarmakologických postupů je základem také úprava životního stylu, zejména zanechání kouření. Bylo zjištěno, že kouření má negativní vliv na průběh onemocnění. Spolu s mužským pohlavím, pozitivitou antigenu HLA-B27 a přítomností strukturálních změn v době diagnózy je kouření řazeno mezi rizikové faktory rychlé radiografické progrese (19). Obdobně ve studii pacientů s časnou formou axSpA bylo kouření nezávislým faktorem asociovaným s rychlou radiografickou progresí (20). Zpráva ze skotského SpA registru ukazuje, že kuřáci měli signifikantně vyšší aktivitu onemocnění, horší funkční výsledky a metrologii proti nekuřákům (21). Ve srovnání se současnými kuřáky měli bývalí kuřáci významně lepší kvalitu života a nižší aktivitu onemocnění. Zanechání kouření je tedy zcela základním krokem v ovlivnění průběhu onemocnění a je řazeno spolu s pohybovou aktivitou mezi doporučení EULAR pro terapii axSpA (17).
Farmakoterapie a strukturální progrese
V léčbě pacientů s dominantním axiálním postižením jsou užívána NSA, bDMARD a bsDMARD. Současné poznatky nesvědčí pro účinnost podávání konvenčních chorobu modifikujících léků u těchto nemocných. Existuje jen málo studií, které by hodnotily efekt csDMARD (zejména sulfasalazinu) na radiografickou progresi u axSpA. V historické studii Taylora et al. nevedlo roční podávání sulfasalazinu ke zpomalení radiografické progrese proti placebu (22). Otázka užití NSA nebo bDMARD jako skutečných chorobu modifikujících léků u axSpA je stále kontroverzní. Narůstající evidence však ukazuje, že ovlivnění aktivity onemocnění má vliv na strukturální progresi onemocnění.
Nesteroidní antiflogistika
NSA jsou stále léky první linie v léčbě axSpA, pokud nejsou přítomny kontraindikace. Významnou úlevu od bolesti a ztuhlosti při terapii NSA uvádí 70–80 % pacientů s AS (23). U části nemocných s axSpA se může jednat o jedinou dlouhodobě dostačující medikaci. Působí nejen analgeticky, ale i antiflogisticky a jejich účinnost u nemocných s axiální spondyloartritidou je tak významně lepší než u pacientů s mechanickou bolestí zad. Dobrá odpověď na NSA je tak i jedním z kritérií při klasifikaci axSpA dle ASAS (1). V souvislosti s terapií NSA je diskutováno několik problémů. Jedním z hlavních vedle bezpečnosti je možnost ovlivnění strukturální progrese onemocnění. Otázka využití NSA jako potenciálního chorobu modifikujícího léku byla předmětem několika studií. Nejstarší studie na toto téma pochází z roku 1976. Do studie bylo zahrnuto celkem 40 pacientů s AS, kteří byli rozděleni do tří skupin (kontinuální léčba, nepravidelné užívání a žádná terapie). Skupina pacientů užívající dlouhodobě pravidelně fenylbutazon vykazovala nižší rozsah páteřní osifikace (24). Výsledek randomizované studie Wanderse et al. z roku 2005 naznačoval, že pacienti s AS, kteří užívali kontinuálně celekoxib, měli po 2 letech menší strukturální progresi hodnocenou pomocí mSASSS než jedinci, kteří celekoxib užívali jen „on demand“, tedy dle potřeby (25). Post hoc analýza této studie dále ukázala, že efekt na zpomalení radiografické progrese při pravidelném užívání NSA byl pozorován zejména u pacientů se zvýšenými hladinami CRP (26). Retrospektivní analýza německé kohorty axSpA GESPIC (German Spondyloarthritis Inception Cohort) sledovala radiografickou progresi v závislosti na frekvenci užívání NSA. Skupina pacientů s AS a vysokou spotřebou NSA měla signifikantně nižší progresi onemocnění proti pacientům s nízkou spotřebou NSA (27). Výsledky však byly signifikantní jen pro pacienty, kteří měli již vstupně syndesmofyty páteře a zvýšené hodnoty CRP. Zajímavé je, že zmírnění radiografické progrese v závislosti na spotřebě NSA nebylo pozorováno u skupinys nr-axSpA. Randomizovaná studie Siepera et al. s akronymem ENRADAS neprokázala, že by léčba NSA ovlivňovala strukturální progresi onemocnění (28). Pacienti s AS byli rozděleni do dvou skupin. První užívali kontinuálně diklofenak v dávce 150 mg/den, pacienti ve druhé skupině užívali diklofenak jen dle potřeby. Mezi oběma skupinami nebyl signifikantní rozdíl v radiografické progresi, subanalýzy nepotvrdily ani rozdíly mezi vysokou a nízkou spotřebou NSA u obou skupin. Otázka přínosu dlouhodobé terapie NSA v ovlivnění radiografické progrese je tedy dále nejasná. Dostupná data podávají určitou evidenci pro kontinuální podávání NSA zejména pacientům se zvýšenými zánětlivými parametry. Vždy je nutné zvažovat individuální rizika spojená s léčbou NSA včetně jejich gastrotoxicity, opomíjena nesmí být ani možnost zvýšení kardiovaskulárního rizika u některých preparátů (zejména u diclofenaku). Proto v současnosti není doporučeno kontinuální užívání NSA jako prevence strukturální progrese u pacientů s AS, kteří jsou jinak dobře kompenzováni.
Biologické chorobu modifikující léky
Zavedení bDMARD u axSpA znamenalo skutečný průlom v léčbě těchto nemocných. Prvními bDMARD v terapii axSpA byly inhibitory tumor nekrotizujícího faktoru alfa (TNFi). Z TNFi jsou u AS indikovány infliximab, adalimumab, etanercept, certolizumab pegol, golimumab a biosimilární infliximab CT-P13 a etanercept SB4. Spektrum bsDMARD využívaných v terapii AS se recentně rozšířilo i o několik preparátů biosimilárního adalimumabu. Pro léčbu nr-axSpA nemá indikaci z výše uvedených jen infliximab a CT-P13. Recentně zavedeným bDMARD v léčbě axSpA je inhibitor IL-17A sekukinumab, který je indikován u nemocných s AS. Ve stadiu klinického zkoušení je v terapii pacientů s axSpA zkoušen i další inhibitor IL-17A ixekizumab (29, 30). Nadějná se zdá být i léčba inhibitorem Janusových kináz (JAKi) tofacitinibem u pacientů s AS (31). bDMARD velice účinně ovlivňují celé spektrum projevů axSpA včetně periferních a mimokloubních manifestací. Zejména TNFi mají účinnost v léčbě nespecifických střevních zánětů (idiopatic bowel disease – IBD), psoriázy a snižují rekurenci akutní přední uveitidy (32).
Inhibitory TNF-alfa
Vysoká účinnost TNFi v léčbě AS i nr-axSpA byla prokázána celou řadou klinických studií i metaanalýz (33–35). Možnost působení TNFi na rentgenovou progresi onemocnění byla dlouhodobě diskutována. Četné studie s využitím MR ukázaly, že léčba TNFi vede k regresi aktivních zánětlivých lézí v oblasti páteře a SI skloubení (36–38). Další studie ukazují, že iniciální dobrá odpověď na terapii hodnocená pomocí MR je udržena dlouhodobě, a to i po 3–4 letech léčby. U skupiny pacientů s axSpA léčených etanerceptem 3 roky ve studii ESTHER došlo ke kompletnímu vymizení osteitidy, tedy akutních zánětlivých změn, v oblasti SI skloubení i páteře (39). Studie z kohorty RAPID-axSpA ukázala, že léčba certolizumabem po 4 roky vedla k redukci zánětlivých změn o více než 50 % jak u pacientů s AS, tak s nr-axSpA (40). Léčba TNFi tedy vede k významnému potlačení aktivních zánětlivých lézí na páteři a SI skloubení u pacientů s axSpA. Vliv TNFi na rentgenovou progresi byl z původních studií nejasný. Až dlouhodobá prospektivní sledování ukázala, že podávání TNFi může vést až k 50% redukci radiografické progrese. Nejlepších výsledků bylo dosaženo u pacientů léčených minimálně po dobu 4 let, u kterých byla terapie TNFi zahájena v časné fázi onemocnění (41). Retrospektivní holandská studie na 210 pacientech s AS ukázala, že jedinci dlouhodobě léčení TNFi měli v prvních 4 letech lineární charakter radiografické progrese. V další periodě sledování již progrese nebyla lineární a celkově docházelo k jejímu zpomalení (42). Vypadá to tedy, že 2–4 roky léčby TNFi jsou minimální dobou ke zhodnocení přínosu terapie v kontextu radiografické progrese. Nutná delší časová léčebná perioda může být i důvodem, proč původní, nejčastěji dvouleté, studie s TNFi neukazovaly benefit zpomalení radiografické progrese.
Má smysl kombinovat bDMARD a NSA?
Další otázka, která vyvstává v kontextu terapie axSpA, je zda má smysl kombinovat léčbu TNFi s NSA preparáty. Na toto téma měla velmi zajímavou přednášku dr. Lianne Gensler ze Spojených států amerických na loňském kongresu EULAR v Amsterdamu (43). V prezentovaném souboru bylo sledováno 519 pacientů s AS po dobu 4 let na terapii NSA, TNFi nebo na kombinaci obou léků. Pacienti léčení NSA proti skupině na TNFi nevykazovali významnou redukci radiografické progrese hodnocené pomocí mSASSS ve 2 a 4 letech. Signifikantní rozdíly v radiografické progresi byly u skupiny, která současně užívala vysokou dávku NSA s TNFi po dobu 4 let. Nejlepší výsledky vykazovala podskupina pacientů, která současně užívala TNFi a plnou dávku COX-2 selektivního inhibitoru celekoxibu. Průměrné mSASSS skóre bylo u těchto nemocných v průměru až o 4,69 bodu nižší (hladina významnosti p < 0,001) než u ostatních. Výsledky naznačují, že přidání celekoxibu k TNFi může dále podpořit terapii ve smyslu snížení radiografické progrese. Pro jasný průkaz tohoto tvrzení však bude potřeba dalších studií na větších souborech pacientů.
Inhibitory IL-17A
Interleukin 17A je, jak již bylo zmíněno výše, jedním z klíčových cytokinů v patogenezi zánětlivých změn u pacientů s axSpA. Využití jeho blokády v léčbě axSpA tak přispělo k rozšíření portfolia účinné terapie u těchto pacientů. Inhibitor IL-17A sekukinumab je v léčbě pacientů s AS účinný jako TNFi (44). Vyvstala však otázka, zda dokáže podobně jako TNFi ovlivnit strukturální progresi onemocnění. Až výsledky recentně publikované studie MEASURE 1, která hodnotila dlouhodobou účinnost a bezpečnost sekukinumabu v léčbě pacientů s AS přinesla určité odpovědi (45). Ve studii bylo sledováno 274 pacientů léčených sekukinumabem v dávce 75 mg nebo 150 mg s.c. měsíčně po dobu 4 let. Strukturální radiografická progrese byla hodnocena pomocí mSASSS. Radiografická progrese (změna mSASSS o méně než dvě jednotky proti baseline) nebyla pozorována u 79 % pacientů. Numericky lepší výsledky měli pacienti léčení dávkou sekukinumabu 150 mg proti 75 mg měsíčně, nicméně tyto výsledky nebyly statisticky signifikantní. Výraznější radiografická progrese byla pozorována u pacientů s rizikovými faktory, tedy s vysokým CRP a na počátku již přítomnými strukturálními změnami. U pacientů léčených sekukinumabem byla během 2 let léčby pozorována numericky nižší rychlost progrese rentgenových strukturálních změn oproti kohortě pacientů neléčených biologickou léčbou (46). Pro pochopení dopadu inhibice IL-17A na progresi onemocnění páteře bude potřeba další klinický výzkum. Z tohoto hlediska mohou být jistě zajímavé výsledky aktuálně probíhající studie, která hodnotí vliv léčby sekukinumabem proti biosimilárnímu adalimumabu GP2017 na strukturální progresi u pacientů s AS po dobu 2 let (47).
ZÁVĚR
Léčba pacientů s axiální spondyloartritidou se v posledních dekádách dramaticky změnila. Dostupné a široce užívané jsou preparáty, které velice efektivně tlumí projevy onemocnění. Dlouhodobě je diskutováno, zda však dokážou tyto léky omezit nebo dokonce zastavit strukturální progresi onemocnění, podobně jako je tomu u jiných zánětlivých revmatologických onemocnění. Odpovědi na tyto otázky stále nejsou zcela jasné. Nicméně se zdá, že dlouhodobá terapie biologickými chorobu modifikujícími léky proti léčbě samotnými NSA vede k ovlivnění radiografické progrese u nemocných s aktivní axSpA. Zajímavá je také možnost synergického působení bDMARD se selektivními COX-2 inhibitory, respektive s celekoxibem. Jsou jistě nutná další dlouhodobá sledování, která tato pozorování potvrdí a přinesou jednoznačné odpovědi na dané otázky. K dalšímu poznání přispěje i hlubší pochopení patofyziologických procesů u těchto zánětlivých a komplexních onemocnění.
Konflikt zájmů: žádný.
MUDr. Monika Gregová, Ph.D.
Revmatologický ústav
Na Slupi 4, 128 50 Praha 2
e-mail: gregova@revma.cz
Zdroje
1. Rudwaleit M, van der Heijde D, Landewé R, Listing J, Akkoc N, Brandt J, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009; 68 : 777–783.
2. Sieper J, Rudwaleit M, Baraliakos X, Brandt J, Braun J, Burgos-Vargas R, et al. The Assessment of SpondyloArthritis international Society (ASAS) handbook: a guide to assess spondyloarthritis. Ann Rheum Dis 2009; 68: ii1–44.
3. Deodhar A, Strand V, Kay J, et al. The term ‘non-radiographic axial spondyloarthritis’ is much more important to classify than to diagnose patients with axial spondyloarthritis. Ann Rheum Dis 2016; 75 : 791–794.
4. Maksymowych WP, Chiowchanwisawakit P, Clare T, Pedersen SJ, Østergaard M, Lambert RG. Inflammatory lesions of the spine on magnetic resonance imaging predict the development of new syndesmophytes in ankylosing spondylitis: evidence of a relationship between inflammation and new bone formation. Arthritis Rheum 2008; 60 : 93–102.
5. Baraliakos X, Boehm H, Samir A, Schett G, Braun J. Which cells correspond to typical signals for fatty and inflammatory lesions seen on MRI on AS? Clin Exp Rheumatol 2016; 34 : 744.
6. Poddubnyy D, Sieper J. Mechanism of new bone formation in axial spondyloarthritis. Curr Rheumatol Rep 2017; 19 : 55.
7. Schett G, Lories RJ, D’Agostino MA, Elewaut D, Kirkham B, Soriano ER, et al. Enthesitis: from pathophysiology to treatment. Nat Rev Rheumatol 2017; 13 : 731–741.
8. Underhardt S, Diarra D, Katzenbeisser J, David JP, Zwerina J, Richards W, et al. Blockade of Dickkopf (DKK)-1 induces fusion of sacroiliac joints. Ann Rheum Dis 2010; 69 : 592–597.
9. Gravallese EM, Schett G. Effects of the IL-23-IL-17 pathway on bone in spondyloarthritis. Nat Rev Rheumatol 2018; 14 : 631–640.
10. Braun J, van der Heijde D. Imaging and scoring in ankylosing spondylitis. Best Pract Res Clin Rheumatol 2002; 16 : 573–604.
11. Creemers MC, Franssen MJ, van’t Hof MA, Gribnau FW, van de Putte LB, van Riel PL. Assessment of outcome in ankylosing spondylitis: an extended radiographic scoring system. Ann Rheum Dis 2005; 64 : 127–129.
12. van der Heijde D, Landewe R. Selection of a method for scoring radiographs for ankylosing spondylitis clinical trials, by the Assessment in Ankylosing Spondylitis Working Group and OMERACT. J Rheumatol 2005; 32 : 2048–2049.
13. Braun J, van der Berg R, Baraliakos X, Boehm H, Burgos-Vargas R, Collantes-Estevez E, et al. 2010 update of the ASAS/EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis 2011; 70 : 896–904.
14. Ramiro S, Stolwijk C, van Tubergen A, van der Heijde D, Dougados M, van den Bosch F, et al. Evolution of radiographic damage in ankylosing spondylitis: a 12 year prospective follow-up of the OASIS study. Ann Rheum Dis 2015; 74 : 52–59.
15. Baraliakos X, Listing J, von der Recke A, Braun J. The natural course of radiographic progression in ankylosing spondylitis: differences between genders and appearance of characteristic radiographic features. Curr Rheumatol Rep 2011; 13 : 383–387.
16. Maksymowych WP, Inman RD, Salonen D, Dhillon SD, Krishnananthan R, Stone M, et al. Spondyloarthritis Research Consortium of Canada Magnetic Resonance Imaging Index for Assessment of Spinal Inflammation in Ankylosing Spondylitis. Arthritis Rheum 2005; 53 : 502–509.
17. van der Heijde D, Ramiro S, Landewé R, Baraliakos X, Van den Bosch F, Sepriano A, et al. 2016 update of the ASAS-EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis 2017; 76 : 978–991.
18. Dagfinrud H, Kvien T, Hagen K. Physiotherapy interventions for ankylosing spondylitis. Cochrane Database Syst Rev 2008; (1): CD002822. doi: 0.1002/14651858.CD002822.pub3.
19. Ramiro S, Stolwijk C, van Tubergen A, van der Heijde D, Dougados M, van den Bosch F, et al. Evolution of radiographic damage in ankylosing spondylitis: a 12 year prospective follow-up of the OASIS study. Ann Rheum Dis 2015; 74 : 52–59.
20. Poddubnyy D, Haibel H, Listing J, Märker-Hermann E, Zeidler H, Braun J, et al. Baseline radiographic damage, elevated acute-phase reactant levels, and cigarette smoking status predict spinal radiographic progression in early axial spondyloarthritis. Arthritis Rheum 2012; 64 : 1388–1398.
21. Jones GT, Ratz T, Dean LE, Macfarlane GJ, Atzeni F. Disease severity in never smokers, ex-smokers, and current smokers with axial spondyloarthritis: results from the Scotland Registry for Ankylosing Spondylitis. Arthritis Care Res (Hoboken) 2017; 69 : 1407–1413.
22. Taylor HG, Beswick EJ, Dawes PT. Sulphasalazine in ankylosing spondylitis. A radiological, clinical and laboratory assessment. Clin Rheumatol 1991; 10 : 43–48.
23. Song IH, Poddubnyy AD, Rudwaleit M, Sieper J. Benefits and risks of ankylosing spondylitis treatment with nonsteroidal inflammatory drugs. Arthritis Rheumatol 2008; 58 : 929–938.
24. Boersma JW. Retardation of ossification of the lumbar vertebral column in ankylosing spondylitis by means of phenylbutazone. Scand J Rheumatol 1976; 5 : 60–64.
25. Wanders A, van der Heijde D, Landewe R, Béhier JM, Calin A, Olivieri I, et al. Nonsteroidal anti-inflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum 2005; 52 : 1756–1765.
26. Kroon F, Landewe R, Dougados M, van der Heijde D. Continuous NSAID use reverts the effects on inflammation on radiographic progression in patients with ankylosing spondylitis. Ann Rheum Dis 2012; 71 : 1623–1629.
27. Poddubnyy D, Rudwaleit M, Haibel H, Listing J, Märker-Hermann E, Zeidler H, et al. Effect of non-steroidal anti-inflammatory drugs on radiographic spinal progression in patients with axial spondyloarthritis: results from the German Spondyloarthritis Inception Cohort. Ann Rheum Dis 2012; 71 : 1616–1622.
28. Sieper J, Listing J, Poddubnyy D, Song IH, Hermann KG, Callhoff J, et al. Effect of continuous versus on-demand treatment of ankylosing spondylitis with diclofenac over 2 years on radiographic progression of the spine: results from randomised multicentre trial (ENRADAS). Ann Rheum Dis 2016; 75 : 1438–1443.
29. Deodhar A, Poddubnyy D, Pacheco-Tena C, Salvarani C, Lespessailles E, Rahman P, et al. Efficacy and safety of ixekizumab in the treatment of radiographic axial spondyloarthritis: sixteen-week results from a phase III randomized, double-blind, placebo-controlled trial in patients with prior inadequate response to or intolerance of tumor necrosis factor inhibitors. Arthritis Rheumatol 2019; 71 : 599.
30. van der Heijde D, Cheng-Chung Wei J, Dougados M, Mease P, Deodhar A, Maksymowych WP, et al. Ixekizumab, an interleukin-17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease-modifying anti-rheumatic drugs (COAST-V): 16 week results of a phase 3 randomised, double-blind, active-controlled and placebo-controlled trial. Lancet 2018; 392 : 2441.
31. van der Heijde D, Deodhar A, Wei JC, Drescher E, Fleishaker D, Hendrikx T, et al. Tofacitinib in patients with ankylosing spondylitis: a phase II, 16-week, randomised, placebo-controlled, dose-ranging study. Ann Rheum Dis 2017; 76 : 1340.
32. van Denderen JC, Visman IM, Nurmohamed MT, Suttorp-Schulten MS, van der Horst-Bruinsma IE. Adalimumab significantly reduces the recurrence rate of anterior uveitis in patients with ankylosing spondylitis. J Rheumatol 2014; 41 : 1843–1848.
33. Callhof J, Sieper J, Weiss A, Zink A, Listing J. Efficacy if TNF-α blockers in patients with ankylosing spondylitis and non-radiographic axial spondyloarthritis: a meta-analysis. Ann Rheum Dis 2015; 74 : 1241–1248.
34. Machado MA, Barbosa MM, Almeida AM, de Araújo VE, Kakehasi AM, Andrade EI, et al. Treatment on ankylosing spondylitis with TNF blockers: a meta-analysis. Rheumatol Int 2013; 33 : 2199–2213.
35. Maxwell LJ, Zochling J, Boonen A, Singh JA, Veras MM, Tanjong Ghogomu E, et al. TNF-alpha inhibitors for ankylosing spondylitis. Cochrane Database Syst Rev 2015; (4): CD005468
36. Dougados M, van der Heijde D, Sieper J, Braun J, Maksymowych WP, Citera G, et al. Symptomatic efficacy of etanercept and its effects on objective signs of inflammation in early nonradiographic axial spondyloarthritis: a multicentre randomized, double-blind, placebo-controlled trial. Arthritis Rheum 2014; 66 : 2091–2102.
37. Maksymowych WP, Salonen D, Inman RD, RahmanP, Lambert RG. Low-dose infliximab (3 mg/kg) significantly reduces spinal inflammation on magnetic resonance imaging in patients with ankylosing spondylitis: a randomized placebo-controlled study. J Rheumatol 2010; 37 : 1728–1734.
38. Lambert RG, Salonen D, Rahman P, Inman RD, Wong RL, Einstein SG, et al. Adalimumab significantly reduces both spinal and sacroiliac joint inflammation in patients with ankylosing spondylitis: a multicentre, randomized, double-blind, placebo-controlled study. Arthritis Rheum 2007; 56 : 4005–4014.
39. Song IH, Hermann KG, Haibel H, Althoff CE, Poddubnyy D, Listing J, et al. Prevention of new osteitis in magnetic resonance imaging in patients with early axial spondyloarthritis during 3 years of continuous treatment with etanercept: data of the ESTHER trial. Rheumatology (Oxford) 2015; 54 : 257–261.
40. van der Heijde D, Baraliakos X, Hermann KA, Landewé RBM, Machado PM, Maksymowych WP, et al. Limited radiographic progression and sustained reductions in MRI inflammation in patients with axial spondyloarthritis: 4-year imaging outcomes from the RAPID-axSpA phase III randomised trial. Ann Rheum Dis 2018; 77 : 699–705.
41. Haroon N, Inman RD, Learch TJ, Weisman MH, Lee M, Rahbar MH, et al. The impact of tumor necrosis factor α inhibitors on radiographic progression in ankylosing spondylitis. Arthritis Rheumatol 2013; 65 : 2645–2654.
42. Mass F, Arends S, Brouwer E, Essers I, van der Veer E, Efde M, et al. Reduction in spinal radiographic progression in ankylosing spondylitis patients receiving prolonged treatment with tumor necrosis factor inhibitors. Arthritis Care Res (Hoboken) 2017; 69 : 1011–1019.
43. Bosworth T. Ankylosing spondylitis progression slowed when NSAIDs added to TNFi. In: Evans J. The EULAR 2018 Report. Frontline Medical News. 2018 June 13–16; Amsterdam, Netherlands. Klichberg: Switzerland 2018; 31.
44. Beaten D, Sieper J, Braun J, Baraliakos X, Dougados M, Emery P. Secukinumab, an interleukin-17A inhibitor, in ankylosing spondylitis. N Engl J Med 2015; 373 : 2534–2548.
45. Braun J, Baraliakos X, Deodhar A, Poddubnyy D, Emery P, Delicha EM, et al. Secukinumab shows sustained efficacy and low structural progression in ankylosing spondylitis: 4-year results from the MEASURE 1 study. Rheumatlogy (Oxford) 2018. doi:10.1093/rheumatology/key375 (Epub ahead of print).
46. Baraliakos X, Braun J, Deodhar A, Poddubnyy D, Emery P, Delicha EM, et al. Secukinumab demonstrates low radiographic progression and sustained efficacy through 4 years in patients with active ankylosing spondylitis. EULAR Congress, June 13–16, 2018, Amsterdam, Netherlands, poster SAT 0268.
47. Effect of Secukinumab on Radiographic Progression in Ankylosing Spondylitis as Compared to GP2017 (Adalimumab Biosimilar) (SURPASS). http://clinicaltrails.gov/ct2/show/NCT03259074
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2019 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Výhody subkutánně podávaného methotrexátu
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
-
Všetky články tohto čísla
- Lze ovlivnit strukturální progresi u pacientů s axiální spondyloartritidou?
- Sarkoidóza muskuloskeletálního systému
- Sexuální dysfunkce u systémové sklerodermie
- Nový cíl v léčbě psoriatické artritidy: Proč interleukin 17?
- Abstrakta XVI. semináře mladých revmatologů 16.–18. května 2019, XVI. seminář mladých revmatologů
- „In viridi“ aneb Ve šlépějích Karla
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Sarkoidóza muskuloskeletálního systému
- Sexuální dysfunkce u systémové sklerodermie
- Nový cíl v léčbě psoriatické artritidy: Proč interleukin 17?
- Lze ovlivnit strukturální progresi u pacientů s axiální spondyloartritidou?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



