Národní registr biologické a cílené léčby revmatických onemocnění ATTRA – 20leté zkušenosti
National registry of biological and targeted therapy of rheumatic diseases ATTRA – 20 years of experience
The national registry of biological therapy of rheumatic diseases ATTRA was established 20 years ago. A total of 5324 patients diagnosed with rheumatoid arthritis were entered into the registry. The median follow-up is 5 years and the total patient exposure is 27,358 patient-years. The number of patients is increasing and in recent years there has been an annual increase of 621 patients. Analysis of patients at the beginning of the study shows that these are patients with long disease duration, already with significant functional impairment and high activity (DAS 28 ESR 6.3 ± 0.9). At baseline, 63% of patients were using glucocorticoids, and 82% conventional synthetic DMARDs (csDMARD). Adherence to treatment with the first biological drug was 77.4% after 12 months and 63.8% after 24 months. The most common reasons for discontinuation were secondary failure 37.3%, primary failure 28.3%, and adverse events 25.8%. The mean DAS 28 decreased from 6.3 ± 0.9 to 3.1 ± 1.4 after 24 months. Fifty-five % of patients were in low activity or remission after 2 years of treatment. When assessing the quality of life, there was a significant improvement in all aspects assessed by the SF-36 questionnaire. The ability to work has improved significantly as the values of presenteeism and absenteeism assessed using the WPAI questionnaires have improved. The incidence of adverse reactions is in line with international experience. Tuberculosis occurred in only 19 patients.
Conclusion: The ATTRA registry documents the means of treating rheumatoid arthritis with biological drugs in biological treatment centers. The results are very good but show that the T2T principle could be used more intensively in routine clinical practice. The incidence of adverse reactions is lower than in comparable registries, which may be due to insufficient reporting.
Keywords:
rheumatoid arthritis – biological treatment – ATTRA registry
Autori:
K. Pavelka 1; Z. Křístková 2; L. Dušek 3
Pôsobisko autorov:
Revmatologický ústav Praha
1; Institut biostatistiky a analýz, s. r. o., Brno
2; Ústav zdravotnických informací a statistiky ČR, Praha
3
Vyšlo v časopise:
Čes. Revmatol., 28, 2020, No. 3, p. 120-131.
Kategória:
Originální práce
Súhrn
Národní registr biologické léčby revmatických onemocnění ATTRA byl založen před 20 lety. Do registru bylo zavedeno celkem 5324 pacientů s diagnózou revmatoidní artritidy. Medián sledování je 5 let a celková expozice pacientů 27 358 paciento/roků. Počty pacientů se zvyšují a v posledních letech byl nárůst 621 pacientů ročně. Analýza pacientů na začátku studie ukazuje, že jde o pacienty s dlouhým trváním nemoci, již s významným funkčním postižením a vysokou aktivitou (DAS 28 FW 6,3 ± 0,9). Při zahájení léčby užívalo 63 % pacientů glukokortikoidy a 82 % s konvenčními syntetickými DMARD (csDMARD). Setrvání na léčbě prvním biologickým lékem bylo 77,4 % po 12 měsících a 63,8 % po 24 měsících. Nejčastějším důvodem přerušení bylo sekundární selhání 37,3 %, primární selhání 28,3 % a nežádoucí účinky 25,8 %. Průměrné DAS 28 kleslo z 6,3 ± 0,9 na 3,1 ± 1,4 po 24 měsících. Ve stavu nízké aktivity nebo remise bylo po 2 letech léčby 55 % pacientů. Při hodnocení kvality života došlo k výraznému zlepšení všech aspektů hodnocených dotazníkem SF-36. Výrazně se zlepšila práceschopnost, když se zlepšily hodnoty prezenteismu a absenteismu hodnocené pomocí dotazníky WPAI. Výskyt nežádoucích účinků odpovídá mezinárodním zkušenostem. Tuberkulóza se vyskytla pouze u 19 pacientů.
Závěr: Registr ATTRA dokumentuje způsoby léčby revmatoidní artritidy biologickými léky v centrech biologické léčby. Výsledky jsou velmi dobré, ale ukazují, že princip T2T by mohl být používán intenzivněji v běžné klinické praxi. Výskyt nežádoucích účinků je menší než ve srovnatelných registrech, což může být způsobeno nedostatečným hlášením.
Klíčová slova:
revmatoidní artritida – biologická léčba – registr ATTRA
ÚVOD
Biologická léčba autoimunitních, zánětlivých, revmatických onemocnění (AIRD) byla zavedena do klinické praxe na přelomu tisíciletí. Přinesla doslova revoluci do léčby AIRD. Aplikace biologické léčby spolu s přesnějším hodnocením aktivity nemoci, novými strategiemi jako léčba časné artritidy, kombinovaná léčba nebo léčba k cíli (T2T) (1) umožnila si stanovat ambiciózní cíle léčby, jako je klinická remise nebo stav nízké aktivity (2).
V éře tzv. medicíny založené na důkazech jsou pro průkaz účinnosti biologických léků zásadní výsledky randomizovaných, kontrolovaných, dvojitě slepých studií (RCT) fáze I až III Pro registraci léku je zpravidla potřeba několik těchto studií a ty zásadní bývají nazývány pivotální. Revmatoidní artritida je heterogenní onemocnění, a proto je potřeba předložit důkazy o účinnosti biologických léků celého spektra pacientů s RA tzn. pacientů naivních na léčbu MTX, pacientů se selháváním MTX, pacientů se selháváním i dalších csDMARD a pacientů selhávajících v první linii na léčbě anti-TNF. Stejně důležitá, jako je účinnost biologické léčby, je i její bezpečnost, která je v rámci těchto studií pečlivě monitorována. S cílem získat více bezpečnostních dat jsou pak dvojitě slepé části studií protaženy do tzv. otevřených extenzí (open label extensions). Nicméně od počátků biologické léčby bylo jasné, že biologické léky představují poměrně razantní zásah do imunitního systému pacienta, který může vyvolávat sice řídké, ale závažné nežádoucí účinky, a to především v oblasti závažných infekcí, oportunních infekcí, nádorů, demyelinizačních onemocnění a indukci jiných autoimunitních onemocnění. Ukázalo se, že pro detekci těchto relativně vzácných komplikací léčby je expozice pacientů ve fázi klinického zkoušení I až III, udávaná jako počet paciento/roků, nedostatečná. Proto již téměř od začátku zavedení biologické léčby do běžné klinické praxe byly zřizovány v rámci farmakovigilance registry biologické léčby. A že to bylo správné rozhodnutí, potvrdily registry již poměrně záhy, když teprve po expozici mnohem většího počtu pacientů v registrech bylo detekováno zvýšené riziko vzniku tuberkulózy, které vedlo k povinnému testování na přítomnost latentní tuberkulózy. Naopak důkaz o tom, že biologická léčba nezvyšuje riziko nádorů, s výjimkou kožních, trval více než 10 let.
Prvotním impulzem pro zřízení registrů bylo tedy monitorování bezpečnosti biologické léčby. Rychle se však ukázalo, že i účinnostní data z registrů jsou důležitá. Registry začaly poskytovat data např. o délce přežívání na léčbě, účinnostní data o různých subsetech onemocnění (např. RF pozitivní a negativní), genderové rozdíly, účinnost u seniorů, různá detrakční schémata, účinnost druhého biologického léku po závažné infekci při prvním, aplikace biologického léku po vzniku nádoru a mnoha dalších. Klinická data a vzorky v biobankách pak umožnily studium různých biomarkerů včetně imunogenetických. A v neposlední řadě data z registrů umožnila řadu studií z oblasti hodnocení dlouhodobé kvality života, celkového zdraví, ovlivnění komorbidit a celé oblasti farmakoekonomiky. Nicméně je nutné konstatovat, že zatímco pro hodnocení účinnosti léčby zůstává zlatým standardem léčby randomizovaná, klinická studie, pro hodnocení bezpečnosti jsou to data z registrů, otevřených extenzí, kohortových studií a jejich metaanalýzy.
REGISTR ATTRA (ANTI-TNF THERAPY OF RHEUMATOID ARTHRITIS)
Registr ATTRA jsme zakládali ve spolupráci se zástupci pojišťoven a MZ v roce 2000 a první pacienti byli zařazováni v roce 2001. Velmi šťastným rozhodnutím bylo navázání spolupráce s Masarykovou univerzitou v Brně, konkrétně s IBA vedenou nynějším profesorem L. Duškem. Logistiku z ATTRA vede s kolektivem spolupracovníků na světové úrovni již 20 let. Na začátku bylo v registru ATTRA 6 center a počet se zvýšil na nynějších 52. Iniciálně jsme sledovali jednu diagnózu, a to revmatoidní artritidu. Postupně přibyly spondyloartritidy, psoriatická artritida a juvenilní idiopatická artritida. Měnila se i forma monitorování dat, z původně papírové formy jsme přešli postupně na plně elektronickou. Získaná data z ATTRA byla opakovaně analyzována. Výstupy byly odesílány pojišťovnám pro potřeby hodnocení účinnosti financování a plánování rozpočtů na biologickou léčbu. Data byla použita i pro celou řadu vědeckých publikací, a to ve špičkových zahraničních časopisech (3–5). Již více než před 10 lety vznikla také spolupráce deseti evropských registrů, při které jsou sumárně hodnocena data z jednotlivých registrů. Spolupráce při hodnocení rituximabu se nazývala CERRERA (6, 7), při hodnocení tocilizumabu TOCERRA (8, 9), při hodnocení abataceptu MEDACTA (10) a nově probíhá hodnocení inhibitorů JAK pod názvem JAK-POT (11).
Vlastníkem a garantem registru ATTRA je Česká revmatologická společnost ČLS JEP. Řízení projektu zajišťuje tzv. Steering commitee. Financování je zajištováno společnými příspěvky farmaceutických firem. Při vstupu do registru pacienti podepisují informovaný souhlas.
REVMATOIDNÍ ARTRITIDA
Výsledky
Do registru ATTRA bylo celkem zařazeno 5324 pacientů s revmatoidní artritidou. Medián sledování je 5 let (95% CI 0,2–14,1). Celková expozice pacientů 27 358 paciento/rok. V posledních 2 letech byl průměrný roční nárůst 621 pacientů (obr. 1). Počet aktuálně léčených pacientů RA je 4207 (údaj k 2. 1. 2020). Současné používání jednotlivých preparátů je na obrázku 2. Na prvních místech jsou originální bDMARD, a to Humira (20 %), Enbrel (14,2 %) a RoActemra (10,5 %). Prvním biosimilárním lékem je Benepali (9,2 %). Celkový podíl biosimilárních je léků kolem 20 %. Inhibitory JAK byly zastoupeny v 6,4 %.
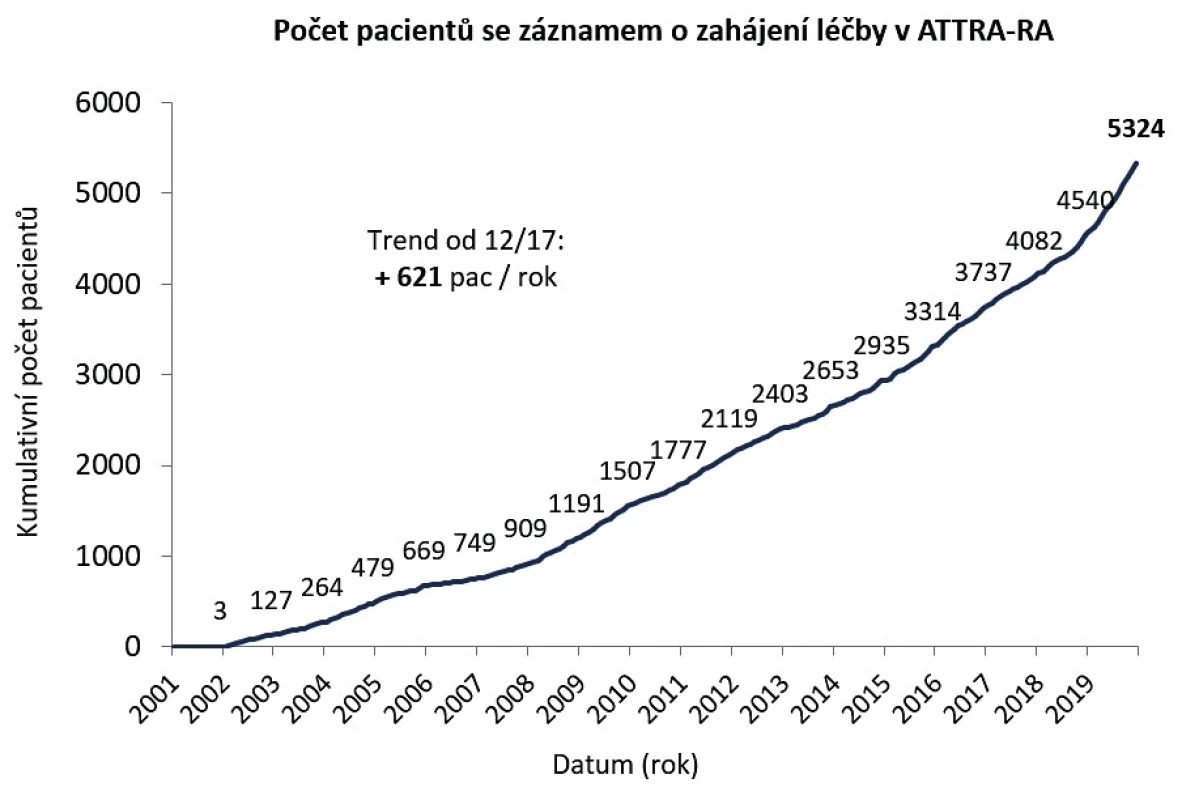
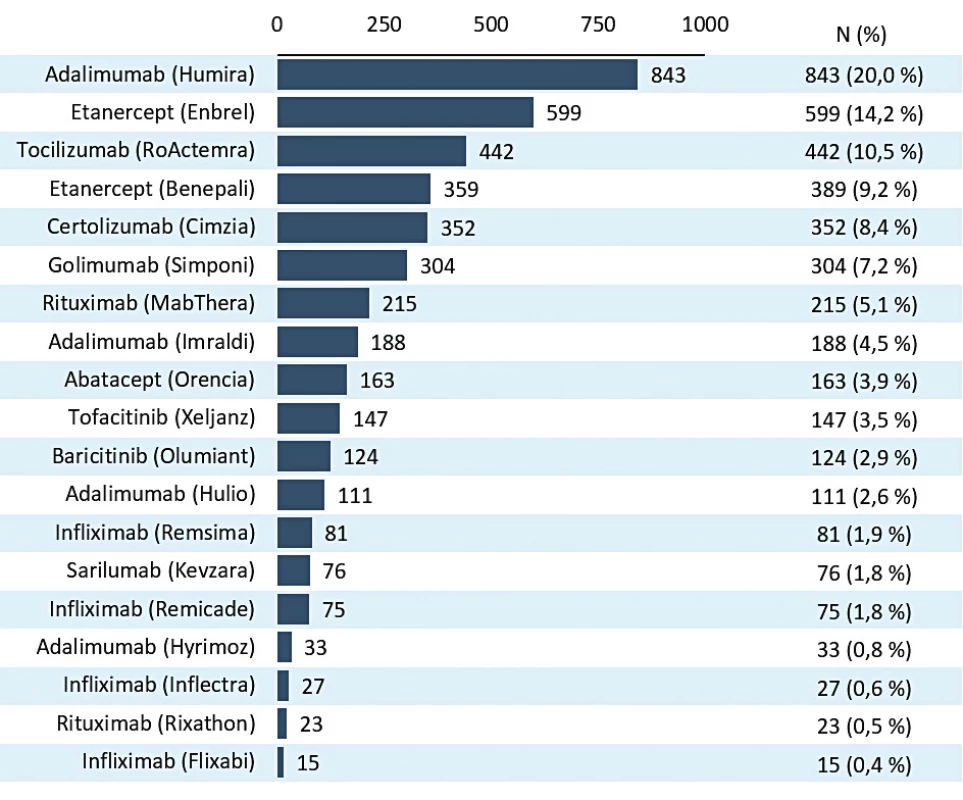
Charakteristika pacientů při zahájení léčby
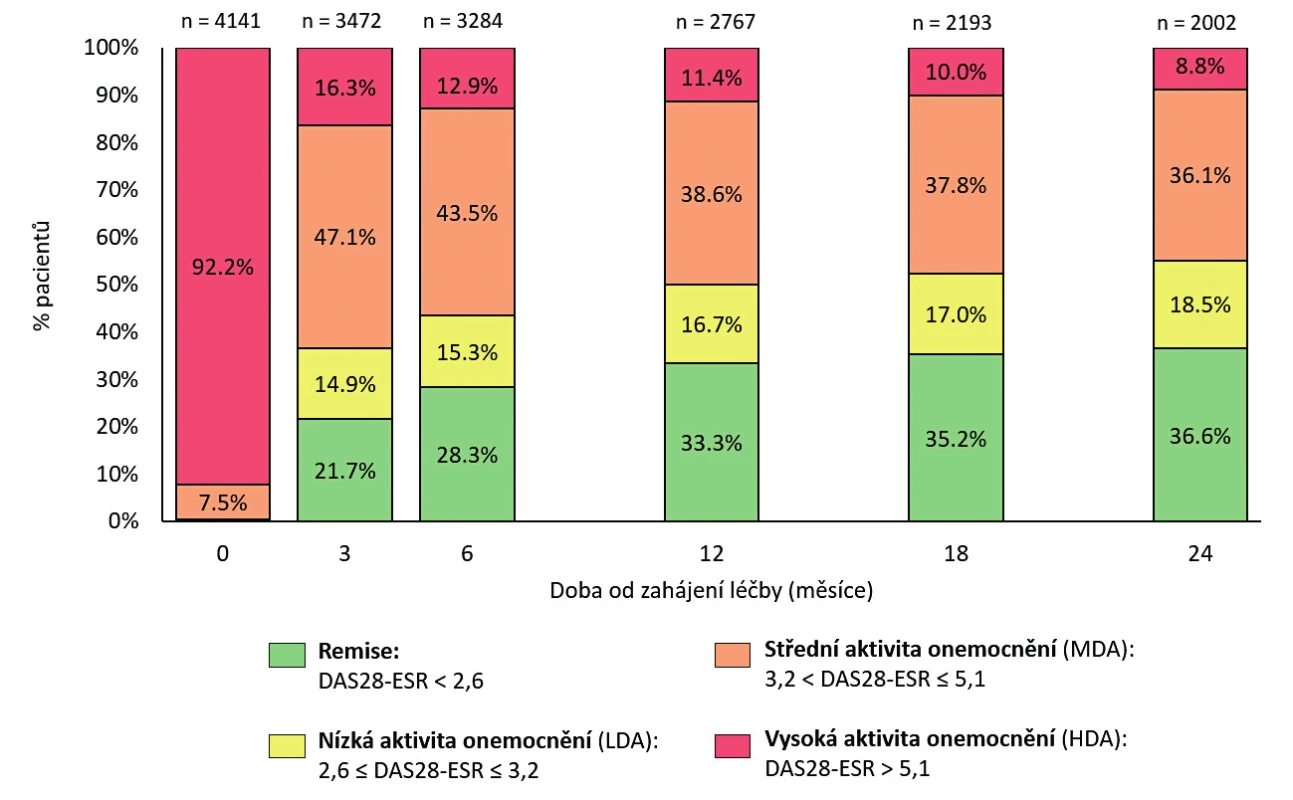
V registru bylo zařazeno 79 % žen a 21 % mužů (tab. 1).Průměrný věk při diagnóze byl 53 let a trvání nemoci kolem 9 let. Revmatoidní faktory byly pozitivní u 74,4 % pacientů, anti-CCP protilátky u 64,1 %. Aktivita onemocnění byla vysoká – průměrná sedimentace na začátku léčby 38 hod., CRP 25,0 mg/l, počet oteklých kloubů 10, počet citlivých kloubů 14, aktivita onemocnění dle pacienta 68 mm (na škále 0 až 100), průměrný DAS 28 FW 6,3. Při rozdělení pacientů podle aktivity nebyli žádní pacienti ve stavu remise ani stavu nízké aktivity, ve stavu střední aktivity (DAS 28 3,2–5,1) bylo 7,5 % a ve stavu vysoké aktivity pak 92,2 % pacientů. Při zahájení léčby užívalo 63 % pacientů glukokortikoidy. Celkem 82,4 % pacientů užívalo při zahájení léčby některé csDMARD, 17,6 % neužívalo žádné csDMARD a léčbu zahajovali jako monoterapii bDMARD. Nejčastěji používaným csDMARD byl MTX 65,7 %, dále leflunomid (18,5 %), sulfasalazin (11,5 %) a antimalarika (4,4 %). Kombinace více csDMARD na začátku léčby byla méně častá, přičemž nejvíce se používala kombinace MTX + leflunomid (5,7 %), MTX + sulfasalazin (3,7 %) a trojkombinace MTX + SAS + antimalarika (1,4 %).
Výsledky léčby
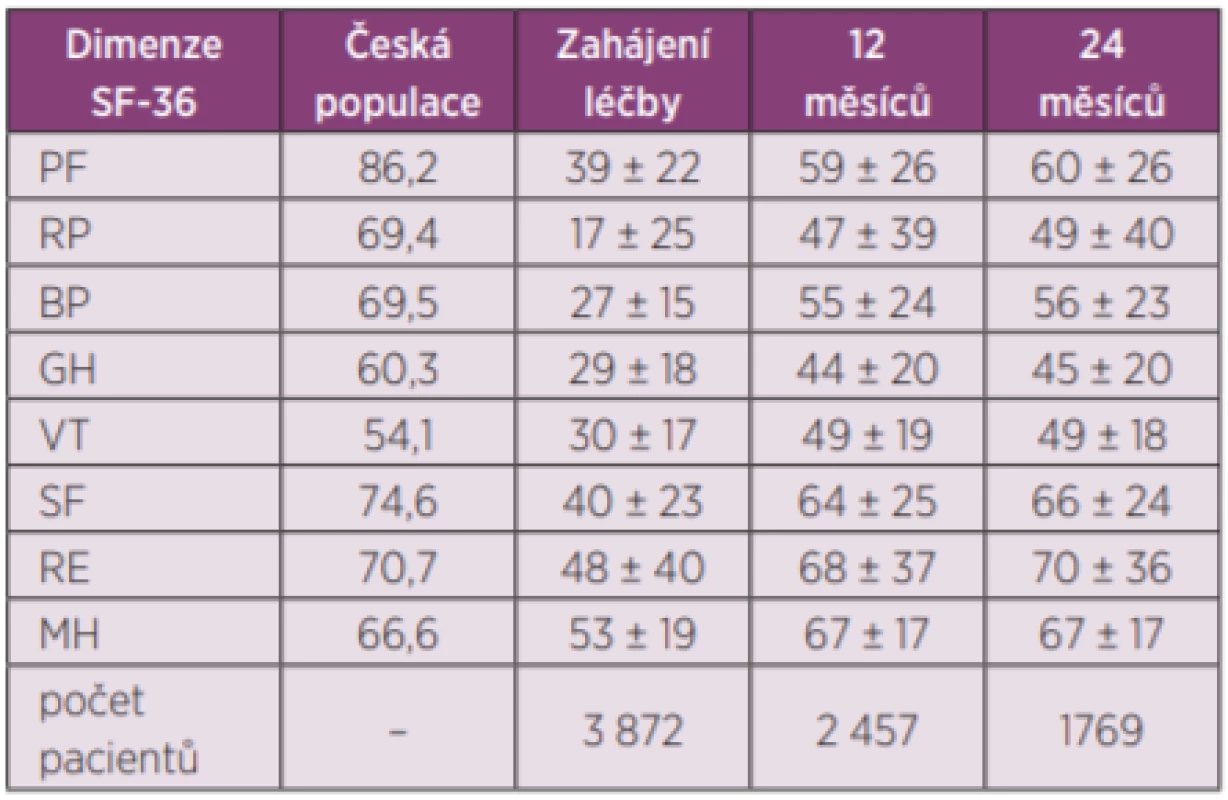
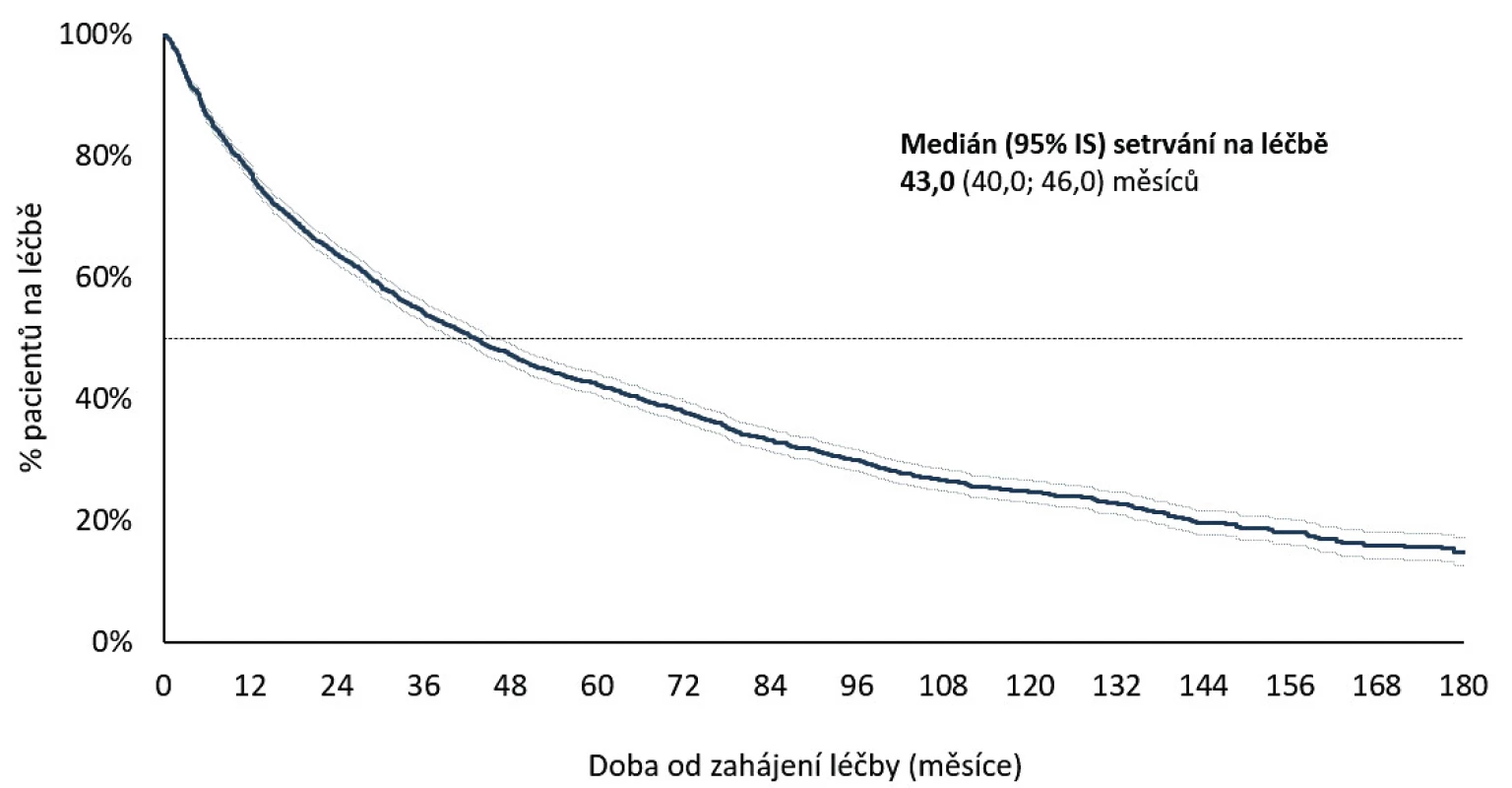
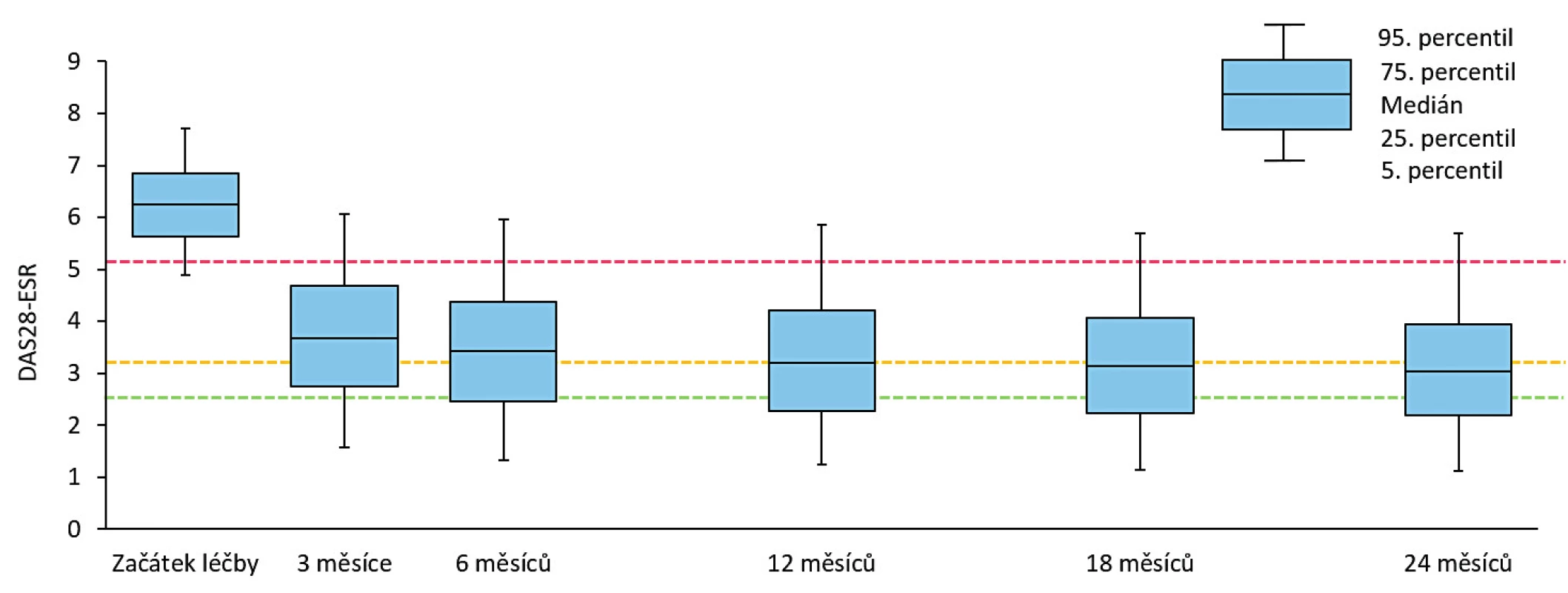
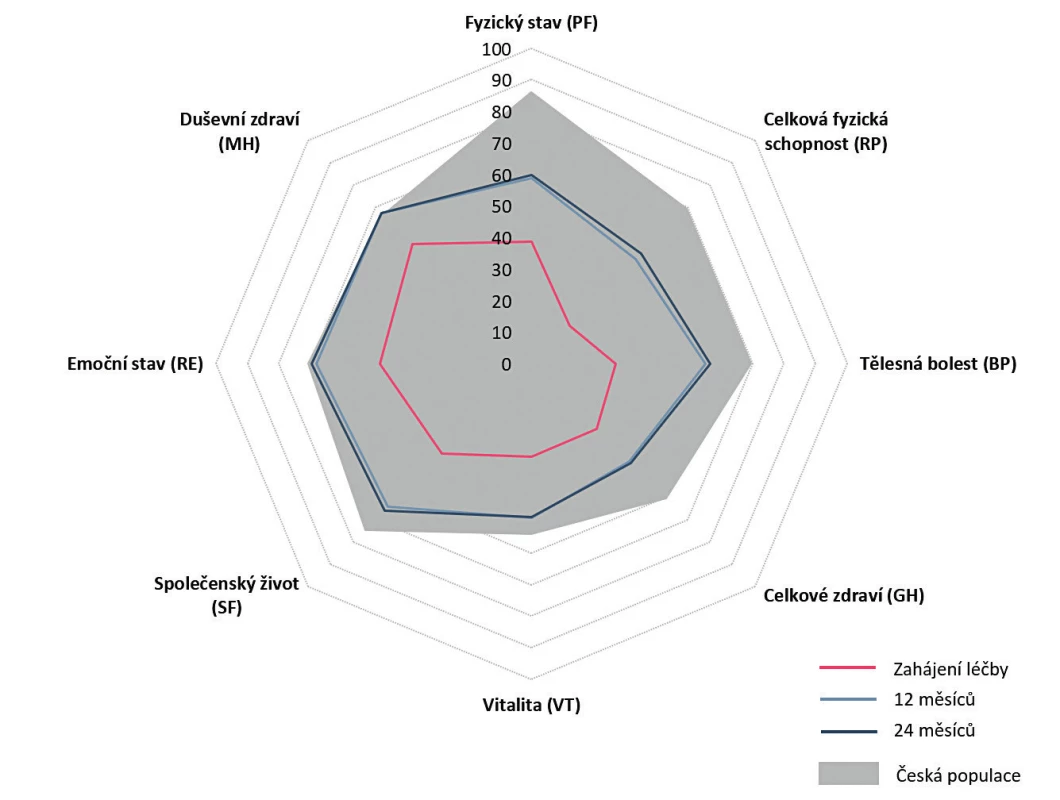
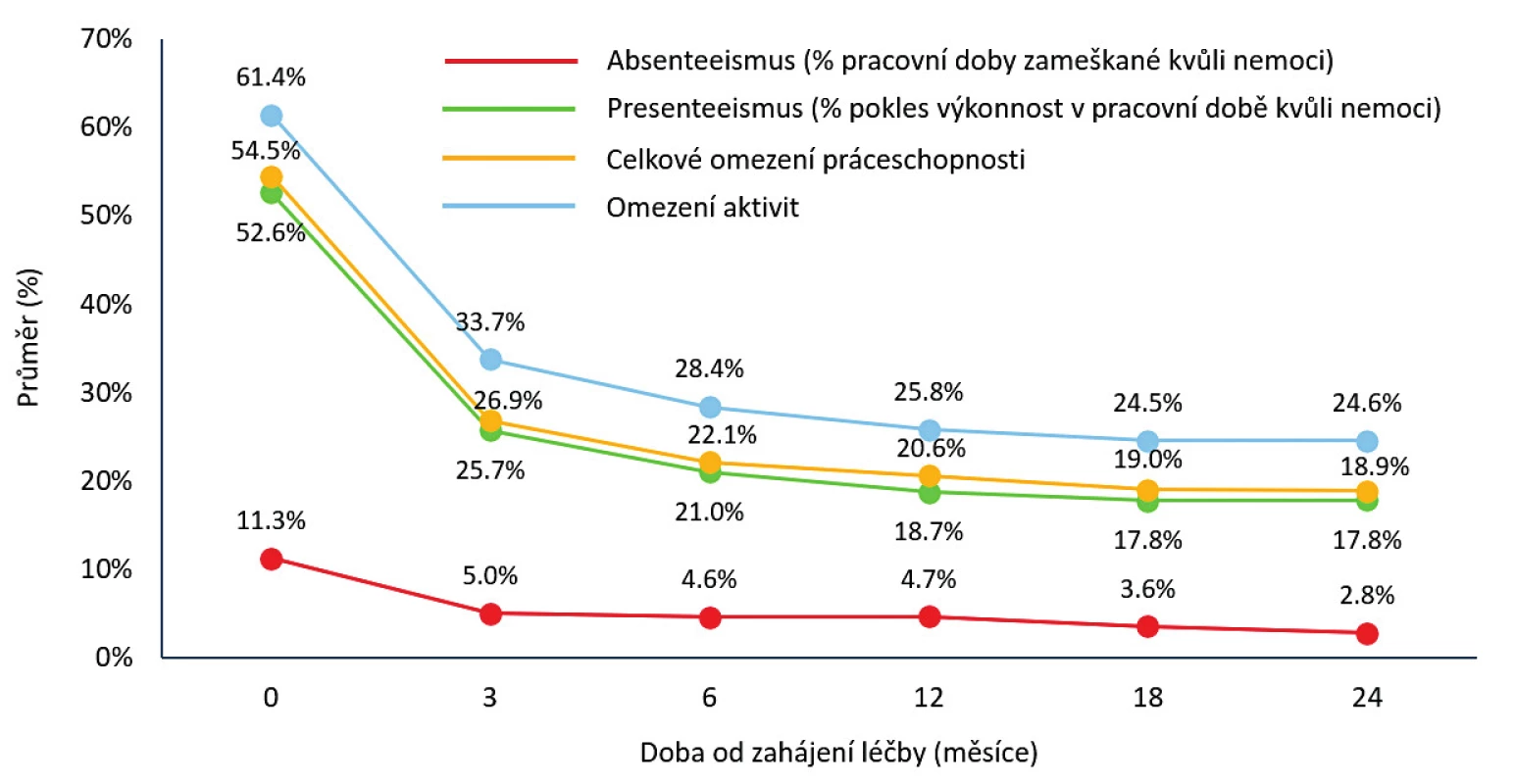
Setrvání na léčbě v 1. biologické léčbě bylo odhadem 77,4 % (95% CI 76,1–78,7) po 12 měsících, 63,8 % po 24 měsících (95% CI 62,2–65,3) a kolem 25 % po 10 letech léčby (obr. 3). Medián délky sledování v registru byl 43,0 (40,0, 46,0) měsíců. Nejčastějším důvodem přerušení léčby byla ztráta účinku – sekundární selhání (37,3 %), primární selhání (28,3 %), nežádoucí účinky (25,8 %), farmakoekonomické důvody (7,9 %), remise onemocnění (7,6 %) a úmrtí (2,7 %). Průměrné DAS 28 na začátku léčby 6,3 + 0,9 pokleslo po 3 měsících léčby na 3,7 + 1,4 a na 3,1 + 1,4 po 24 měsících léčby (p < 0,001) (obr. 4). Zatímco na začátku léčby bylo 92 % pacientů ve stavu vysoké aktivity (DAS 28 > 5,1) a 7,5 % ve stavu střední aktivity (DAS 28 3,2–5,1), po 24 měsících léčby bylo 36,6 % ve stavu remise (DAS 28 < 2,6), 55 % pak ve stavu nízké aktivity (DAS 28 < 3,2) a 45 % ve stavu střední (DAS 28 3,2–5,1) a vysoké aktivity (DAS 28 > 5,1) (obr. 5). Při hodnocení aktivity pomocí SDAI bylo remise docíleno ve 24 % a stavu nízké aktivity v 68,2 %. Při hodnocení odpovědi dle kritérií EULAR bylo dosaženo dobré odpovědi v 55 %, střední odpovědi v 39 % a žádné odpovědi v 6,4 %. Při hodnocení funkce pomocí skóre HAQ došlo k poklesu z iniciální hodnoty 1,5 + 0,6 na hodnotu po 2 letech 1,0 + 0,7 (p < 0,001) u pacientů, kteří dokončili léčbu. Při hodnocení kvality života pomocí dotazníku SF 36 došlo k signifikantnímu zlepšení všech hodnocených parametrů (obr. 6). Dále jsme v registru sledovali práceschopnost nemocných. V průběhu 24 měsíční léčby byla obnovena práceschopnost u 33,3 % (95% CI 30,2–36,5) pacientů a naopak práci ztratilo 21,9 % pacientů (95% CI 19,6–24,2). K přesnějšímu hodnocení práceschopnosti byl použit dotazník WPAI (12). Tento dotazník hodnotí jednak zameškané procento pracovní doby (absentismus) a omezení pracovní výkonosti (prezentismus). Průměrné hodnoty prezentismu na začátku léčby byly 15,4 % (+ 0,9) a poklesly na 3,0 % (+ 0,5) (obr. 7). Signifikantně se zlepšily i průměrné hodnoty pracovní výkonosti (pokles z 54,5 % na 23,8 %).
Nežádoucí účinky
Celková expozice biologickým lékům byla 21 453 pacientoroků. Nežádoucí účinky byly důvodem přerušení léčby asi u ¼ pacientů. Výčet všech nežádoucích účinků je v tabulce 2. Je patrné, že ve shodě s jinými registry jsou nejčastější infekce, kardiovaskulární projevy, kožní projevy, GIT nežádoucí účinky a alergické reakce.
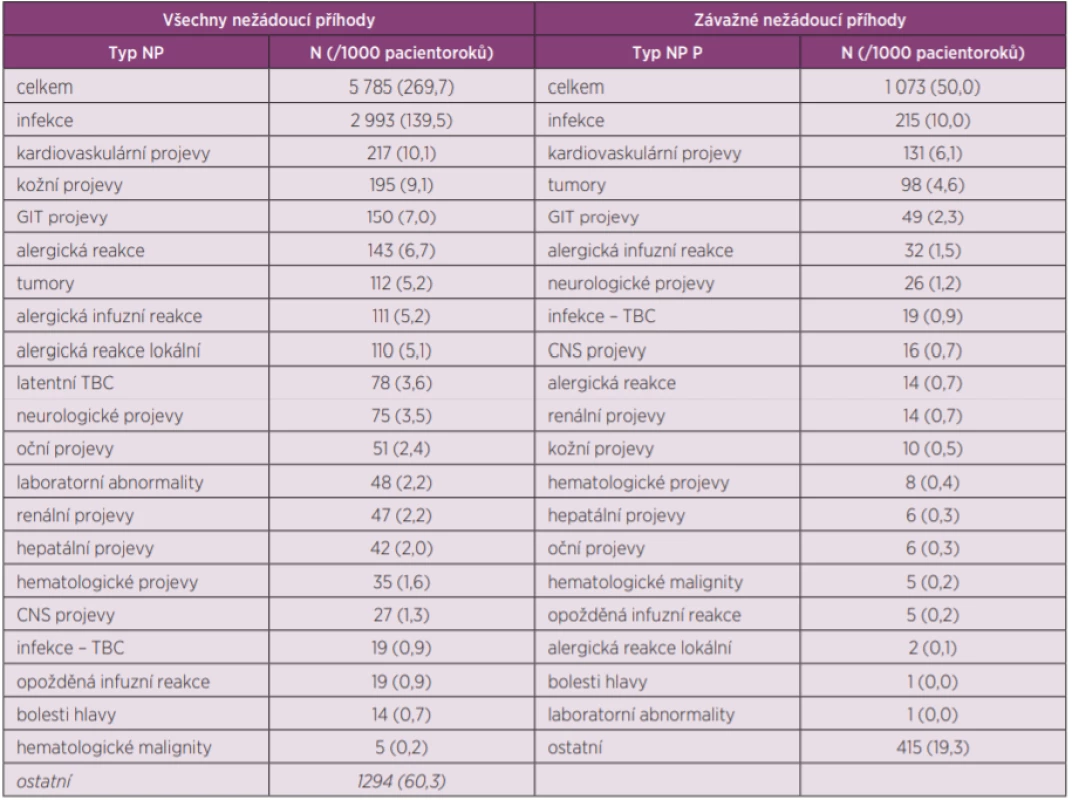
Důležité je ale především sledování výskytu závažných nežádoucích účinků. Výskyt závažných infekcí byl 21,5 na 100 na pacientoroků, což je mnohem více, než se udává běžně v registrech, kde je běžný výskyt 2 až 4 na 100 pacientoroků. V registru ATTRA byl problém v tom, že lékaři hodnotili infekci jako závažnou, i když nesplňovala obvyklá kritéria závažnosti (hospitalizace, nebo nutnost i.v. aplikace). Do registru bylo hlášeno celkem 19 případů vzniku klinicky manifestní tuberkulózy. Toto je velmi malý výskyt, který odráží jednak klesající incidenci tbc v populaci a jednak dodržování doporučení pro screening latentní tbc před zahájením léčby. Výskyt nádorů byl 9,8 na 100 pacientoroků. Přesné srovnání s výskytem nádorů v populaci bude předmětem dalších analýz. Žádný výraznější signál ale není patrný. Výskyt dalších závažných nežádoucích účinků je uveden v tabulce 2. Je ale nutné konstatovat, že je nízký, pravděpodobně následkem tzv. under-reportinku.
DISKUZE
Uvedená data charakterizují způsoby léčby pacientů s RA, kteří vyžadují biologickou či cílenou léčbu v České republice. Podívejme se strohý výskyt čísel perimetrem používání doporučení pro léčbu odborných společností a strategií T2T (1, 2).
V první řadě je důležité se podívat již na charakteristiku pacientů na začátku léčby a jejich prvního biologického léku. Průměrná doba od diagnózy RA byla 9 let. Tomu odpovídá i vysoké funkční postižení odpovídající průměrnému HAQ 1,5, což je v České republice prahová hodnota pro plný invalidní důchod. Průměrné trvání RA před léčbou biologiky kolem 9 let ukazuje velmi dlouhé zpoždění s nasazením biologické léčby. Rozhodně není ve shodě s principem časné léčby. Je však nutné konstatovat, že jsou prezentovány výsledky po celé trvání ATTRA, a bude důležité udělat analýzu, jestli se v posledních letech tento interval nezkrátil. Dlouhý interval byl také ovlivněn horší dostupností biologických léků v České republice, nedostatkem revmatologů obecně a dlouho platnou indikací bDMARD jen pro pacienty s vysokou aktivitou nemoci.
Biologická léčba je v České republice indikována u pacientů se selháním minimálně jednoho csDMARD, kterým je nejčastěji MTX. Před zahájením biologické léčby mělo v našem souboru selhání jednoho csDMARD 21,0 % pacientů, selhání dvou csDMARD 25,5 %, selhání tří csDMARD 22,8 % a selhání více než tří csDMARD kolem 30 % pacientů. Je přitom známo, že počet v minulosti selhaných csDMARD je z hlediska získání nepříznivé odpovědi na bDMARD asociovaným negativním faktorem.
Dle charakteristiky pacientů na začátku léčby šlo o nemocné s vysokou aktivitou nemoci, o čemž svědčí průměrné CRP 25 mg/l, deset oteklých kloubů a DAS 28 6,3. Naprostá většina pacientů byla ve stavu vysoké aktivity (92 %) a pouze 8 % ve střední aktivitě. Je to logické, protože získat indikaci pro střední aktivitu se podařilo získat až v roce 2019, a to ještě jen pro některé preparáty. Přitom je prokázáno, že je nutné pacienty se střední aktivitou léčit, protože jinak dále rentgenově progredují a funkčně se zhoršují (13).
Biologické i cílené syntetické léky jsou účinnější v kombinaci s csMTX. Nejvíce dat je o komedikaci MTX. V registru ATTRA mělo při zahájení léčby bDMARD komedikaci csDMARD v 82,4 % pacientů, což je nutné považovat za odpovídající mezinárodním zkušenostem. Zde je nutné ale uvést, že v indikačních omezeních SUKL se hovoří o kombinované léčbě MTX (nebo csDMARD) s bDMARD, takže v případě monoterapie (většinou vynucené) bDMARD by měl být požádán o souhlas revizní lékař. V každém případě je ale vhodné při zahajování monoterapie bDMARD či inhibitory JAK uvést do chorobopisu důvod monoterapie. Předejde se tím diskuzím s revizním lékařem při kontrole. Argumentovat SPC léku většinou nestačí.
Zajímavá je i analýza léků, které nemocní užívali na začátku léčby bDMARD. Glukokortikoidy užívalo celkem 63 % pacientů (je zajímavé že Medrol více než Prednison). EULAR sice doporučuje používání GK u pacientů s RA, přičemž ale by jejich aplikace měla být časově omezená, a to maximálně na 6 měsíců. Naši pacienti užívají evidentně GK dlouhodobě. Nové studie přitom ukazují, že osteoporózu zhoršuje jakákoliv dávka GK, i když rizika u dávek nižších než 5 mg prednisonu denně jsou přijatelná a zvláště při aktívní prevenci osteoporózy. Je nutné však myslet na to, že GK výrazně zvyšují riziko infekce (14) i kardiovaskulárních komplikací (15).
Podíl biosimilárních léků je 20 % aktuálně léčených pacientů. Je to menší zastoupení než třeba ve Skandinávii, ale vyšší než v jiných zemích centrální a východní Evropy. Řada biosimilárních léků však byla registrována až v roce 2019, takže lze očekávat zvyšující se podíl. Zvyšuje se také důvěra revmatologů v biosimilární léky, a to jak na základě vlastních zkušeností, tak publikovaných studií (16, 17). Diskuze přetrvávají pouze kolem tzv. nemedicínského přechodu z originálního na biosimilární přípravek. Termínem nemedicínský přechod se označuje situace, kde jediným důvodem změny preparátu je ekonomický důvod. Odborná společnost doporučuje, aby změna biologického léku byla vždy realizována jako společné rozhodnutí pacienta a lékaře v jeho ordinaci.
Zcela novou skupinu DMARD představují inhibitory JAK. Jde o malé molekuly, které vstupují do cytoplazmy buňky a inhibují zde enzymy ze skupiny tyrosinkináz, konkrétně januskinázy 1, 2, 3 a TYK 2. Blokují tím signální transdukci, která je podmínkou aktivace genů v jádře zodpovědných za expresi významných prozánětlivých cytokinů zavzatých do imunopatogeneze RA. V současné době jsou registrovány v České republice inhibitor JAK-1,3 tofacitinib a inhibitor JAK1, 2 baricitinib. V klinických studiích byly srovnatelně účinné jako biologické léky (18), baricitinib byl účinnější než adalimumab (19). Výhodou inhibitorů JAK je možnost perorální aplikace, žádná imunogenicita, účinnost napříč všemi formami RA a výborná účinnost v monoterapii. Potenciální nevýhodou mohou být některé aspekty bezpečnosti. Jde především o vyšší výskyt infekcí herpes zoster (20) a dále problematika vzniku trombózy a následné embolie, která se vyskytuje u osob s rizikem a zvláště starších 65 let. Aktuálně tvoří pacienti na inhibitorech JAK asi 6 % pacientů v registru ATTRA. Část z nich ale tvoří pacienti, kteří byli původně v klinických studiích a pokračují dále v běžné centrové péči. Širšímu použití inhibitorů JAK v České republice brání i cena, která je vyšší než u biosimilárních léků.
K účinnému potlačení aktivity RA hodnocené pomocí DAS 28 došlo již po 3 měsících léčby a tento efekt přetrvával i po 24 měsících. V registru ATTRA jsou dostupná i delší, až 10letá data, která ale nejsou předmětem této analýzy. Nicméně remise bylo dosaženo u 36,6 % pacientů a stavu nízké aktivity pak v 55 % případů. Je to hodně nebo málo? Vždyť dle strategií T2T by mělo být cíle dosaženo u všech pacientů (1). Zkušenosti z ostatních registrů ukazují podobné údaje a např. ve švédském registru, kde také autoři nacházeli vyšší procento remisí u časných než etablovaných forem RA (21). Samozřejmě je důležité, jaká definice se pro remisi a stav nízké aktivity užívá, ale u nás používaná definice dle DAS 28 patří mezi nejméně přísné. Dosažené hodnoty bohužel ukazují, že princip T2T není v běžné klinické praxi dostatečně aplikován. Armamentárium biologických léků bylo rozšířeno o tsDMARD, takže možností změny léčby a hledání optimálního léku pro každého pacienta je více. Argumentů, proč je důležité dosažení remise nebo alespoň stavu nízké aktivity, je celá řada. Docílení remise vede k totálnímu zastavení rentgenové progrese, dále k maximálně možnému zlepšení funkční disability, zlepšení kvality života a zvýšení schopnosti pracovat, což má i velký socioekonomický rozměr. Docílení remise je v z tohoto hlediska výhodnější než stav nízké aktivity (22).
V poslední době se stále více diskutuje význam hodnocení tzv. ukazatelů hodnocených pacientem (PRO). Řadíme mezi ně hodnocení bolesti, ztuhlosti, deprese, funkčních schopností, práceschopnosti, celkového pocitu zdraví. Pacient zlepšení těchto ukazatelů upřednostňuje před např. laboratorními či zobrazovacími ukazateli. Data z registru ukazují robustní zlepšení všech těchto ukazatelů, které je navíc rychlé a trvalé.
Biologická léčba je i po snížení cen stále relativně drahá s průměrnými náklady kolem 200 000 na pacientorok. Nicméně je nutné říci, že principiálně je velmi drahá RA jako choroba. Kromě přímých nákladů na léky a léčbu musíme přičíst nepřímé náklady spojené s invalidními důchody, různými sociálními dávkami, náklady na hospitalizace, operacemi, lázeňskou léčbou a samozřejmě i neplacení daní. Tyto nepřímé náklady jsou dle údajů ze západních zemí vyšší než náklady přímé. Z výsledků registru ATTRA lze dokumentovat, že dochází k výraznému zlepšení schopnosti pracovat. V období 2 let byl rozdíl v získání a ztracení práceschopnosti téměř 12 %. Počet zameškaných dní v práci poklesl z 15 na 3. Výkonnost v práci se zlepšila téměř o 30 %. Tato data bude potřeba analyzovat z hlediska vyčíslení redukce nákladů, ale lze předpokládat, že se potvrdí závěry z podobných studií v zahraničí, které považují biologickou léčbu RA za vysoce efektivní.
ZÁVĚR
Výsledky z hodnocení účinnosti biologické léčby RA v národním registru ATTRA potvrzují velmi dobrý poměr účinnosti a rizika biologické léčby a jsou v souladu s mezinárodními zkušenostmi. V registru jsou již údaje o více než 5000 pacientech a dokladují zvyšující se proléčenost populace, přestože zatím nedosahuje hodnot ve vyspělých zemích západní Evropy. Výsledky také dokumentují, že princip léčba k cíli není vždy dostatečně implementován.
Poděkování patří všem lékařům i sestrám v centrech biologické léčby, kteří zadávají data do ATTRA a přispívají tím k dobré znalosti a zlepšování péče o pacienty s revmatoidní artritidou.
Centra biologické léčby dospělých pacientů přispívajících do registru ATTRA
1. Revmatologický ústav, Praha
prof. MUDr. Karel Pavelka, DrSc.
2. FN Olomouc – III. interní klinika
prof. MUDr. Pavel Horák, CSc.
3. FN Motol Praha – Oddělení revmatologie dětí a dospělých
doc. MUDr. Rudolf Horváth, Ph.D.
4. Thomayerova nemocnice, Revmatologické oddělení, Praha
MUDr. Petr Kopsa
5. FN Hradec Králové – II. interní klinika
doc. MUDr. Petr Bradna, CSc.
6. FN Brno – Revmatologická ambulance
MUDr. Zdeněk Fojtík, Ph.D.
7. FN u sv. Anny v Brně – II. interní klinika, Revmatologická ambulance
doc. MUDr. Petr Němec, Ph.D.
8. FN Ostrava – Interní klinika
MUDr. Iva Kielkowská
9. FN Plzeň – Oddělení klinické farmakologie
MUDr. Hana Brabcová
10a. ART MEDI UPD I, s.r.o., Hostivice
MUDr. Tomáš Zitko
10b. ART MEDI UPD II – ISCARE, s.r.o., Praha
MUDr. Pavla Vavřincová, CSc.
11. Krajská nemocnice Liberec, a.s., Revmatologické oddělení
MUDr. Ivana Součková
12. Krajská zdravotní, a.s. – Masarykova nemocnice Ústí nad Labem, o.z. – Interní oddělení, Revmatologická ambulance
MUDr. Zdeňka Burianová
13. EUC Klinika s.r.o., Ústí nad Labem
MUDr. Jana Mikulicová
14. Revmatologická ambulance Sokolov
MUDr. Alena Tichá
15. Revmatologie Mariánské Lázně, s.r.o.
MUDr. Vlastimil Novotný
16. REVMA CV, s.r.o., Interní a revmatologická ambulance, Chomutov
MUDr. Vít Kuba
17. MEDIPONT PLUS, s.r.o. – Oddělení revmatologie, České Budějovice
MUDr. Sevda Augustinová
18. Nemocnice České Budějovice, a.s – Interní oddělení
MUDr. Jiřina Vítová
19a. EUC Klinika, a.s. – Revmatologické oddělení Pardubice
MUDr. Zdeněk Dvořák, Ph.D.
19b. EUC Klinika, a.s. – Revmatologické oddělení Jičín
MUDr. Markéta Tomášová
20. Revmacentrum MUDr. Mostera s.r.o., Brno
MUDr. Erik Moster
21. BORMED s.r.o. – Revmatologická ambulance, Ostrava
MUDr. Ladislav Bortlík
22. Revmatologie MUDr. Klára Šírová, s.r.o., Ostrava
MUDr. Klára Šírová
23. ReDIam s.r.o., Havířov
MUDr. Jarmila Korbielová
24. L.K.N. ARTHROCENTRUM s.r.o., Hlučín
MUDr. Libor Novosad
25. Revmatologie Bruntál, s.r.o.
MUDr. Dagmar Galatíková
26. PV – MEDICAL, s.r.o., lékařský dům REVMAVITA, Zlín
MUDr. Petr Vítek
27. MEDICAL PLUS, s.r.o. – Revmatologická a osteologická ambulance, Uherské Hradiště
MUDr. Eva Dokoupilová
28. Revmatologie Kroměříž – Centrum biologické léčby
MUDr. Olga Janušková
29. Nemocnice Jihlava – Interní oddělení
MUDr. Andrea Houzarová
30. AFFIDEA Praha, s.r.o.
MUDr. Petr Kasalický, CSc.
31. RESMÉ, s.r.o., Brno
MUDr. Martina Dvořáková
32. INREVAG, s.r.o., Prostějov
MUDr. Ivo Vágner
33. Sagena, s.r.o., Frýdek-Místek
Ing. Lubomír Němeček
34. Nemocnice ve Frýdku-Místku, o.p., Interní oddělení – revmatologická ambulance
MUDr. David Havrlant
35. INREA s.r.o., Ostrava
MUDr. Martina Malcová
36. MUDr. Rosypalová, s.r.o., Ostrava
MUDr. Miroslava Rosypalová
37. RevmaClinic, s.r.o., Brno
MUDr. Vlastimil Ráček
38. REVMATOLOGIE KV s.r.o., Karlovy Vary
MUDr. Helena Ptáčková
39. REVMA s.r.o., Ostrava
MUDr. Mojmír Šugárek
40. Revmatologie Opava, s.r.o.
MUDr. Jiří Gebauer
41. Revmatologické centrum, s.r.o., Mikulov
MUDr. Daniela Šustrová
42. Rheuma s.r.o., Břeclav
MUDr. Jaroslava Spěváková
43. Interní a revmatologická ordinace, Přerov
MUDr. Marie Václavíková
44. Revmatologická a interní ambulance, Poliklinika „Čtyřobvod“ Kladno
MUDr. Gabriela Šimková
45. Interní a revmatologická ordinace, Plzeň
MUDr. Judita Machová
46. Nemocnice Kadaň, s.r.o. – Revmatologická ambulance
MUDr. Vlastimil Novotný
47. Osteomed, s.r.o., Revmatologická a osteologická ambulance, Trutnov
MUDr. Roman Tyl
48. Revmatologická ambulance MUDr. Marian Tošovský, Hradec Králové
MUDr. Marian Tošovský
49. Nemocnice s poliklinikou Havířov – Revmatologická ambulance
MUDr. Miroslava Řihošková
50. Revmatologie s.r.o., Brno
doc. MUDr. Petr Němec, Ph.D.
51. Krajská zdravotní, a.s., Nemocnice Most, o.z. – Revmatologická ambulance
MUDr. Ivana Malecká
52. Ústřední vojenská nemocnice, Vojenská FN Praha – Revmatologická ambulance
MUDr. Lenka Franeková
Práce byla podpořena projektem Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace 00023728 Revmatologický ústav.
Konflikt zájmů: žádný.
adresa pro korespondenci:
prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav
Na Slupi 4, 128 50 Praha 2
e-mail: pavelka@revma.cz
Zdroje
1. Smolen JS, Aletaha D, Bijlsma W, et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis 2010; 69: 631–637.
2. Thiele K, Huscher D, Bischoff S, et al. Performance of the 2011 ACR/EULAR preliminary remission criteria compared with DAS 28 remission in unselected patients with rheumatoid arthritis. Ann Rheum Dis 2013; 72: 1194–1199.
3. Mann HF, Závada J, Šenolt L, Bubová K, Nekvindová L, Křístková Z, Horák P, Vencovský P, Pavelka K and the ATTRA Registry. Real world use of secukinumab for treatmentof axial spondyloarthritis and psoriatic arthritis: nationwide results from the ATTRA registry. Clin Exp Rheumatol 2019; 342–343.
4. Pavelka K, Forejtová Š, Štolfa J, Chroust K, Burešová L, Mann H, Vencovský J. Anti-TNF therapy of ankylosing spondylitis in clinical practice. Results from the Czech national registry ATTRA. Clin Exp Rheum 2009; 27: 964–969
5. Horák P, Skácelová M, Hejduk K, Smržová A, Pavelka K. Abatacept and its use in the treatment of rheumatoid artritis in the Czech Republic – data from the ATTRA registry. Clin Rheumatol 2013; 32: 1451–1458.
6. Chatzidionysiou K, Lie E, Nasonov E, et al. Effectiveness of disease-modifying antirheumatic drug co-therapy with methotrexate and leflunomide in rituximab-treated rheumatoid arthritis patients: results of a 1-year follow-up study from the CERERRA collaboration. Ann Rheum Dis 2012; 71: 374–377.
7. Chatzidionysiou K, Lie E, Nasonov E, Lukina G, et al., on behalf of the Rheumatic Disease Portuguese Register. Effectiveness of two different doses of rituximab for the treatment of rheumatoid arthritis in an international cohort: data from the CERERRA collaboration. Arthritis Res Ther 2016. doi:10.1186/s13075-016-0951-z
8. Lauper K, Nordström DC, Pavelka K, Hernández MV, et al. Comparative effectiveness of tocilizumab versus TNF inhibitors as monotherapy or in combination with conventional synthetic disease-modifying antirheumatic drugs in patients with rheumatoid arthritis after the use of at least one biologic disease-modifying antirheumatic drug: analyses from the pan-European TOCERRA register collaboration. Ann Rheum Dis 2018; 77: 1276–1282.
9. Courvoisier DS, Chatzidionysiou K, Mongin D, et al. The impact of seropozitivity on the effectiveness of biologic antirheumatic agents. Abstrakt EULAR 2018.
10. Finckh A, Neto D, Iannone F, et al. The impact of patient heterogeneity and socioeconomic factors on abatacept retention in rheumatoid arthritis across nine European countries. RMD Open 2015; 1: e000040. doi:10.1136/rmdopen-2014-000040
11. Lauper K, Mongin D, Bergstra SA, et al. Comparative effectiveness of JAK-inhibitors, TNF-inhibitors, abatacept and IL-6 inhibitors in an international collaboration of regisers of rheumatoid arthritis patients (the “JAK-pot” study). Abstrakt EULAR 2020.
12. Reilly Associates, Work Productivity and Activity Impairment Questionnaire: http://www.reillyassociates.net/WPAI General.html
13. Smolen JS, Han C, van der Heide D, et al. Radiographic joint progression in sustained remission is determined by disease activity levels preceding the period of radiographic assessment. Arthritis Rheum 2009; 60: 1242–1249.
14. Kay J, Schoels MM, Dorner T, et al. Consensus – based recommendations for the use of biosimilars to treat Rheumatological diseases. ARD Online first, published October 3,2017 as 10.1136/annrehumdis-2017-211937
15. Agca R, Heslinga C, M Rollefstad S, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorder2015/2016 update Ann Rheum Dis 2017; 76: 17–28.
16. Glintborg G, Loit AG, Omerovic E, et al. To switch or not to switch results of a nationwide guideline of mandatory switching from originator to biosimilar etanercept. One year treatment outcomes in 2061 patients with inflammatory arthritis from the DANBIO registry. Ann Rheum Dis 2018; 0: 1–9. doi:10.1136/annrheumdis-2018-213474
17. van Vollenhoven RF, Fleischmann R, Cohen S. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis. N Engl J Med 2012; 36: 508–519.
18. Taylor PC, Keystone EC, van der Heijde D. et al. Baricitinib versus placebo or adalimumab in rheumatoid arthritis. N Engl J Med 2017; 376: 652–662.
19. Kang EH, Liao KP, Kim SC, et al. Cardiovascular safety of biologics and JAK inhibitors in patients with rheumatoid arthritis. Current Rheumatology Reports 2018; 20: 42. https://doi.org/1007/s1196-018-07522-2
20. Einarson JT, Willim M, Ernestam S, et al. Prevalence of sustained remission in rheumatoid arthritis“ impact of criteria sets and disease duration. A Nationwide study in Sweden. Rheumatology 2019; 58: 227–236.
21. Radner H, Smolen JS, Aletaha D. Remission in rheumatoid arthritis benefit over low disease activity in patients – reported outcomes and costs. Arthritis Research Ther 2014; 16: R56.
Štítky
Dermatológia Detská reumatológia ReumatológiaČlánok vyšiel v časopise
Česká revmatologie

2020 Číslo 3
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- Výhody subkutánně podávaného methotrexátu
Najčítanejšie v tomto čísle
- Současný význam séronegativní revmatoidní artritidy
- Validace české verze dotazníků hodnotících únavu a pohybovou aktivitu u pacientů s revmatickými onemocněními: Fatigue Impact Scale (FIS), Multidimensional Assessment of Fatigue Scale (MAF), Human Activity Profile (HAP)
- Úloha virů při vzniku autoimunitních onemocnění
- Dieta u dny – máme omezit puriny?
