-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Místo sorafenibu v léčbě hepatocelulárního karcinomu
Place of sorafenib in the treatment of hepatocellular carcinoma
The advancement in the systemic treatment of hepatocellular carcinoma (HCC) has improved prospects for the overall survival rate in patients with the advanced form of the tumour. In this overview, the new targeted therapy is set in the context of both traditional and the latest therapeutical methods, which include – besides liver transplant, partial hepatectomy, radiofrequency ablation and alcoholization – also radiotherapy, immunotherapy, chemotherapy and biological therapy. Local therapy is usually preferred to systemic therapy. Patients for whom locoregional therapy is not suitable due to advanced disease can benefit from systemic therapy. The targeted therapy with sorafenib, a multiple tyrosine kinase inhibitor, which was proven in the SHARP study to produce a statistically significant improvement in the overall survival rate of patients with advanced HCC, has become a new standard in systemic therapy of advanced HCC. Sorafenib demonstrated high efficacy in monotherapy compared to the placebo and is the first and so far only drug which has significantly improved the overall survival rate in patients with HCC. Other biological drugs include bevacizumab, sunitinib and erlotinib. To conclude, current recommendations on HCC treatment are presented.
Key words:
hepatocellular carcinoma – liver cirrhosis – sorafenib
Autori: P. Tesařová
Pôsobisko autorov: Onkologická klinika 1. LF UK a VFN Praha
Vyšlo v časopise: Gastroent Hepatol 2010; 64(5): 15-21
Kategória: IBD: Aktuální přehled
Súhrn
Pokroky v systémové léčbě hepatocelulárního karcinomu (HCC) zlepšily vyhlídky nemocných s pokročilou formou nádoru na prodloužení celkového přežití. V tomto přehledu je zasazena nová cílená léčba do kontextu tradičních i novějších léčebných metod, mezi něž patří kromě transplantace jater, parciální hepatektomie, radiofrekvenční ablace a alkoholizace také radioterapie, imunoterapie, chemoterapie a biologická léčba. Lokální terapie je zpravidla upřednostňována před léčbou systémovou. Pacienti, kteří nejsou vhodní pro lokoregionální léčbu pro pokročilé onemocnění, mohou profitovat z léčby systémové. Cílená terapie sorafenibem, multityrosinkinázovým inhibitorem, u něhož bylo prokázáno statisticky významné prodloužení celkového přežití nemocných s pokročilým HCC ve studii SHARP, se stala novým standardem systémové léčby pokročilého HCC. Sorafenib prokázal vysokou účinnost v monoterapii ve srovnání s placebem a je prvním a zatím i jediným léčivem, které signifikantně zlepšilo celkové přežívání pacientů s HCC. Z dalších biologických léčiv je znám bevacizumab, sunitinib a erlotinib. V závěru jsou podána současná doporučení k léčbě HCC.
Klíčová slova:
hepatocelulární karcinom – cirhóza jater – sorafenibÚvod
Hepatocelulární karcinom (HCC) je zhoubný nádor jater, který se nejčastěji objevuje v souvislosti s chronickými jaterními onemocněními, především cirhózou. Úmrtí na toto onemocnění představuje čtvrtou nejčastější příčinu smrti na zhoubný nádor ve světě a třetí u mužů. Mortalita a incidence se téměř překrývají, což dokumentuje fatální prognózu této choroby. Incidence významně kolísá podle geografické lokality. Přibližně 80 % veškerých případů pochází z Asie a Afriky, pravděpodobně v důsledku infekce virem hepatitidy B a C. V České republice jsou méně častým nádorovým onemocněním a tvoří asi 1,3 % všech zhoubných nádorů s incidencí a mortalitou pohybující se kolem 8,5 případů na 100 tisíc obyvatel. Více než polovina, až tři čtvrtiny pacientů s hepatocelulárním karcinomem, trpí cirhózou. Významným etiologickým faktorem je hepatitida B a C a hemochromatóza. Známým rizikovým faktorem je potrava nebo voda kontaminovaná aflatoxinem. V poslední době se diskutuje i protektivní vliv kofeinu a statinů. Vyšší incidence HCC je spojena s deficitem alfa1-antitrypsinu a polymorfizmem genu pro epidermální růstový faktor. Jaterní adenokarcinom je popisován jako hepatocelulární, cholangiocelulární, smíšený nebo nediferencovaný [1].
Staging a prognóza
Stadia onemocnění je možné popsat pomocí TNM systému, i když prognózu zásadně ovlivňuje především přítomnost cévní invaze a fibrózy okolní jaterní tkáně. Přežití nemocných ovlivňuje také hodnota AFP (alfa-fetoproteinu) jako hlavního nádorového markeru, dále celkový stav pacienta (performance status) a funkční stav jater. Zatímco ve stadiu I přežívá pět let až 55 % nemocných, ve stadiu III to je už jen 16 %. Prognostický Okudův systém zohledňuje kromě velikosti nádoru i stupeň cirhózy. Existuje i řada dalších prognostických schémat (barcelonské, francouzské), z nichž se v poslední době nejvíce používá italský skórovací sytém – The Cancer of the Liver Italian Program score (CLIP) kombinující informace o nádoru (makroskopická morfologie nádoru, hladina AFP a přítomnost portální trombózy) se závažností cirhózy. Odhad prognózy nemocného hraje zásadní roli při volbě léčebného přístupu [2].
Léčebné možnosti u HCC
Vycházet v léčebných indikacích ze stagingu nádoru je obtížné, protože TNM systém vychází v podstatě až z operačních nálezů. Pro rozhodnutí o možné transplantaci jater se používají nejčastěji milánská/Mazzaferro kritéria. Pro transplantaci je vhodný neresekabilní nádor buď solitární ≤ 5 cm, nebo vícečetný s maximálně třemi ložisky do velikosti ≤ 3 cm bez vaskulární invaze. Kontraindikací je metastatický nádor nebo postižení lymfatických uzlin tumorem. Při transplantační indikaci je třeba zvažovat celkový stav nemocného a funkční rezervu jater [3].
Další potenciálně kurativní lokální metodou je parciální hepatektomie, která je vhodná pro nemocné v celkově dobrém stavu s dostatečnou funkční jaterní rezervou s lokalizovaným postižením jednoho jaterního laloku [4]. Dlouhodobé výsledky této léčby jsou dobré, pět let přežívá 90 % resekovaných pacientů. Pokud se dodržují indikační kritéria, mají nemocní excelentní pětileté přežití kolem 80 %. Přežití je jen o málo horší než u nemocných podstoupivších operaci z benigních příčin [5].
V poslední době je hodně využívanou lokální léčebnou metododu i radiofrekvenční ablace (RFA), při které se tepelně zničí nádorové buňky v okolí zavedené elektrody. RFA je vhodná metoda pro pacienty, kteří nesplňují kritéria resekability [6]. Vhodnými kandidáty jsou nemocní s nádorovou lézí s průměrem < 4 cm a cirhózou ve stadiu Child-Pugh A nebo B. Z hlediska přínosu pro pacienta je resekce zpravidla před RFA upřednostňovaná, pokud je možná. Perkutánní alkoholizace nebo aplikace kyseliny octové má podobný dopad jako RFA.
Další možností lokální léčby je transarteriální chemoembolizace (TACE) [7]. Představuje aplikaci chemoterapeutika s lipiodolem do jaterní žíly. Zamezení přítoku krve k nádoru a efekt chemoterapie se v účinku sčítají. Využívá se pro velké neresekabilní nádory nebo recidivující HCC. Absolutní kontraindikací je trombóza portální žíly, jaterní encefalopatie nebo obstrukce žlučových cest. Pokud je ložisko neřešitelné RFA pro nebezpečí poškození okolních struktur teplem, je někdy možné využít perkutánní kryoablaci.
Radioterapie jako lokální metoda není zatím příliš využívána přesto, že HCC je radiosenzitivní nádor. Důvodem je vysoká citlivost jater k radioterapii, takže únosná dávka je zpravidla jen 20 Gy. S využitím moderních stereotaktických metod by bylo možné zvýšit lokální dávku v nádoru až na 100 Gy. Stereotaktická radioterapie minimálně poškozuje okolní tkáně, ale je opět vhodná spíše pro léze menších rozměrů [8]. Experimentální lokální metodou, která vyžaduje podrobnější studium, je radioembolizace jaterní žíly, která nejčastěji využívá radioaktivního jódu s lipiodolem nebo ytria se skleněnými mikrokuličkami.
Systémová terapie v podobě chemoterapie se většinou nevyužívá rutinně z řady důvodů [9]. Jednak je HCC považován za chemorefrakterní nádor, pravděpodobně pro vysokou expresi genů pro p-glykoprotein, glutation-S transferázu, heat shock proteiny a mutaci p53, které všechny úzce korelují s chemorezistencí. Vzhledem k časté poruše funkce jater obvykle tolerují nemocní s HCC chemoterapii velmi špatně [10]. Proto je zpravidla určena jen pro pacienty s lokálně neřešitelným HCC, s dobrou funkcí jater a nejlépe v rámci klinických studií [11]. Podání chemoterapie může také způsobit reaktivaci virové hepatitidy, je tedy důležité pokračovat v protivirové léčbě. Nejstudovanějším cytostatikem v souvislosti s léčbou HCC byl doxorubicin, který prokázal odpověď v klinických studiích v dávce 75 mg/m2 u 20 % pacientů. Ve studiích se 106 a 455 nemocnými se ale prokázal velmi malý význam léčby doxorubicinem pro celkové přežití nemocných proti nejlepší podpůrné léčbě (medián přežití 10,6 vs 7,5 týdnů). Podobně malý přínos prokázal i epirubicin nebo mitoxantron [12]. Na základě výsledků klinické studie, ve které byl v případě 38 nemocných s HCC zjištěn mírný potenciační efekt tamoxifenu při léčbě doxorubicinem, dosáhlo odpovědi 12 nemocných (32 %). Ale doba bez progrese byla jen sedm měsíců. Slibné se zdálo i využití fluoropyrimidimů, protože fluorouracil je intenzivně metabolizován v játrech. Ve studiích byla zaznamenána v kombinaci s leukovorinem 28% odpověď, ale léčba byla často komplikovaná žloutenkou a selháním jater. Monoterapie kapecitabinem vykazovala odpověď u 25 % nemocných, ale slibné výsledky v podobě parciální a dokonce kompletní remise se v dalších studiích nepotvrdily, a to ani při kombinaci s oxaliplatinou [13]. Ani samotná léčba gemcitabinem, irinotekanem nebo thalidomidfenem neznamenala pro nemocné s HCC dlouhodobější zlepšení. Také kombinovaná terapie s platinou nebo gemcitabinem nepřinesla zásadní zlepšení výsledků a naopak znamenala zvýšení nežádoucích účinků při toxicitě léčby.
Imunoterapie interferonem alfa byla zkoumána ve třech klinických studiích. V čínské práci byla porovnávána s doxorubicinem s lepší odpovědí i tolerancí léčby v rameni s interferonem. I v další studii s inoperabilním HCC u 75 nemocných byla léčba IFN alfa (50 mU/m2 i.m. 3× týdně) srovnávána s nejlepší podpůrnou léčbou. Medián celkového přežití byl významně lepší ve skupině s interferonem (14,5 vs 7,5 týdnů). Odpověď na léčbu se objevila v 31 %. Tyto příznivé výsledky ale nepotvrdila třetí studie s 58 nemocnými. Odpověď byla zaznamenána jen u 6,6 % a v celkovém přežití nebyl žádný rozdíl. Podání IFN alfa bylo spojeno s vysokým procentem nežádoucích účinků (77 %), které vedly k přerušení léčby. Kombinovaná léčba cisplatinou, IFN alfa a doxorubicinem (PIAF) dosáhla u pokročilého HCC objektivní odpovědi v 26 % a byla doprovázena řadou nežádoucích účinků [14]. Tento režim byl srovnáván s doxorubicinem v monoterapii a kombinovaná chemoimunoterapie nebyla signifikantně lepší. Pravděpodobný důvod neúspěchu kombinace byl i špatný výběr nemocných. Ve studii s PIAF režimem nejlépe reagovali pacienti s málo pokročilým nálezem a kompenzovanou cirhózou. Kombinace 5-fluorouracilu s interferonem byla v rámci studií různě úspěšná, závisela na léčebném schématu a dosahovala až 33 %.
Cílená terapie sorafenibem – multityrosinkinázovým inhibitorem, který prokázal v roce 2007 v rámci výsledků studie SHARP statisticky významné prodloužení celkového přežití nemocných s pokročilým HCC, se stala novým standardem systémové léčby pokročilého HCC [15,16].
Přestože je molekulární patogeneze HCC relativně špatně známá, již delší dobu existovaly informace o možném významu EGFR (receptor pro epidermální růstový faktor typu 1) pro vznik a vývoj HCC. Proto se v klinických studiích zkoumal efekt inhibitorů EGFR na HCC (erlotinib, cetuximab). HCC je výrazně vaskularizovaný nádor, který vykazuje vysokou expresi VEGF (vaskulárního endotelového růstového faktoru). Cesta Raf/MAP kinázy-ERK kinázy (MEK) hraje v tumorigenezi HCC také významnou roli. Raf (faktor aktivace receptoru) kináza je základní součastí metabolizmu MAP kinázy, což je signální mechanizmus ovlivňující mnoho buněčných funkcí, jako je například růst, transformace a apoptóza. ERK je konečný enzym MAP kinázové metabolické cesty, který je přímo aktivován Raf kinázou k fosporylaci ERK [17].
Overexpresse aktivované MEK1 v buněčné linii HCC zvyšuje růst nádorových buněk a jejich přežití. Také jaderný protein viru hepatitidy C (HCV), která představuje významné riziko pro HCC, vyvolává vysokou hladinu Raf-1 activity v hepatocytech, a tím zvyšuje riziko nádorové transformace. Z toho vyplývá potenciální efekt léků inhibujících Raf kinázu.
Sorafenib je perorální multikinázový inhibitor, který právě inhibuje Raf kinázu a také intracelulární část VEGF [18].
Vývoj sorafenibu původně směřoval pouze k inhibici Raf serin/threonin kinázy (c-Raf). Teprve při dalším výzkumu byla prokázána jeho široká multikinázová inhibiční aktivita nejen k b-Raf („wild-type“ a V599E mutace), ale i k ERK fosforylaci v různých liniích nádorů. Bylo zjištěno, že sorafenib inhibuje aktivaci (fosforylaci) kináz v celé MAPK signální dráze. Navíc také prokazatelně inhibuje tyrozinkinázy receptorů pro endoteliální růstový faktor (VEGFR) 2 a 3, destičkový růstový faktor (PDGFR), fibroblastový růstový faktor (FGFR-1), c-Kit, Flt-3 i p38 [19].
Sorafenib tedy ovlivňuje nejen proces nádorové angiogeneze, ale i vlastní nádorovou proliferaci, a zaujímá tak z pohledu „duálního“ mechanizmu účinku unikátní postavení mezi ostatními používanými zástupci biologické léčby (obr. 1) [20].
Obr. 1. Účinek sorafenibu v nádorové buňce. Fig. 1. The mechanism of action of sorafenib in a cancer cell. 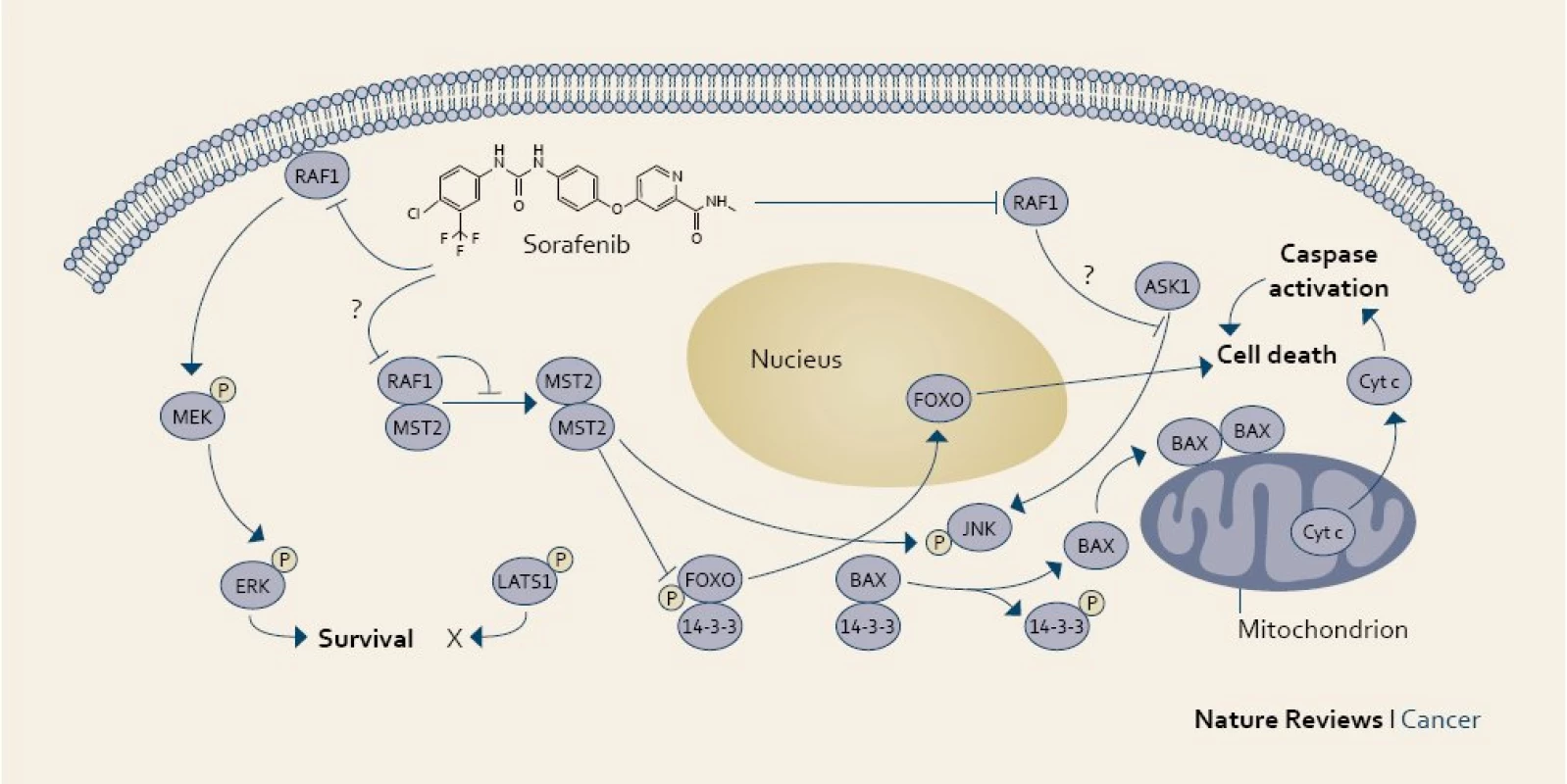
Svůj účinek prokázal již ve studiích fáze I, kde jednotliví pacienti s HCC dosáhli parciální remise. Následné studie fáze II a III nepotvrdili tak vysokou protinádorovou aktivitu, nicméně výsledky studie fáze III SHARP prokázaly signifikantní prodloužení celkového přežití proti podpůrné léčbě. Ve fázi II klinického hodnocení byl sorafenib (400 mg 2× denně) podáván pacientům (n = 137) s pokročilým inoperabilním HCC a cirhózou Child-Pugh A bez předchozí systémové terapie. Výsledky léčby sorafenibem předpovídaly v této pilotní studii slibnou účinnost: PR 2,2 %, MR (minor response) 5,8 %, SD 33,6 %, délka trvání odpovědi 12–14,5 měsíce, TTP (doba do progrese) 4,2 měsíce, OS 9,2 měsíce [21].
Do dvojitě zaslepené evropské studie fáze III kontrolované placebem vstoupilo již 602 pacientů s pokročilým HCC bez předchozí systémové terapie. Pacienti byli randomizováni k léčbě sorafenibem 400 mg 2× denně, nebo dostávali placebo. Ve skupině pacientů léčené sorafenibem bylo zjištěno o 44 % vyšší OS proti placebu (10,7 vs 7,9 měsíce, p = 0,0006), TTSP (doba do symptomatické progrese) nesignifikantní rozdíl, TTP o 73 % delší po léčbě sorafenibem (24 vs 12 týdnů, p = 0,000007), DCR 43 % sorafenib vs 32 % placebo. Nežádoucí účinky závažnosti stupně 3 až 4 u pacientů, kterým byl podán sorafenib, resp. placebo: průjem (11 % vs 2 %), palmoplantární (hand-foot) syndrom (8 % vs 1 %), únava (10 % vs 15 %). Sorafenib prokázal vysokou účinnost v monoterapii ve srovnání s placebem a je prvním a zatím i jediným léčivem, které signifikantně zlepšilo celkové přežívání pacientů s HCC [22].
Tyto výsledky byly dostatečným důvodem k tomu, aby se sorafenib stal standardní systémovou léčbou pokročilého HCC [22].
Účinek sorafenibu u asijské populace s pokročilým HCC a cirhózou Child--Pugh A zkoumala studie se sorafenibem v dávce 800 mg denně oproti placebu. Pacienti se sorafenibem měli delší medián celkového přežití (6,5 vs 4,2 měsíce) i dobu do progrese (2,8 vs 1,4 měsíce). Toxicita stupně 3 a 4 představovala především hand-foot syndrom (11 %), průjem (6 %) a únavu (3 %) [23]. Horší výsledky celkového přežití nemocných v asijské studii, která měla stejná zařazovací kritéria jako studie SHARP, lze snad částečně vysvětlit horším celkovým stavem zařazovaných nemocných [24]. Otázkou zůstává, zda není odpověď na sorafenib nějakým způsobem modifikovaná přítomností viru hepatitidy B. V asijské studii totiž bylo výrazně vyšší zastoupení HBV pozitivních pacientů (73 % vs 18 %). Některá předchozí data ale ukazují, že naopak pacienti s virem hepatitidy C mají na léčbu sorafenibem daleko lepší odpověď [25].
Ne zcela jasný zůstává možný vliv sorafenibu na jaterní cirhózu. Největší počet nemocných v obou studiích tvořili pacienti s cirhózou ve stadiu Child-Pugh A (95 %), ale další studie zařazovaly pacienty s pokročilejším onemocněním (Child-Pugh B, C). Negativním prognostickým faktorem může být i progredující dekompenzovaná cirhóza, která léčebné výsledky u HCC stírá. Přestože FDA v USA nijak neomezuje indikace sorafenibu dle tíže cirhózy, nejsou literární data u pokročilejších forem (Child-Pugh B a C) dostatečně přesvědčivá. V jedné práci s 38 pacienty s HCC byly porovnány výsledky ve skupině s cirhózou Child-Pugh A a B. Přestože nežádoucí účinky, ukončení léčby i redukce dávky byly v obou skupinách stejné, zásadně se lišil medián doby do progrese (13 vs 21 týdnů) i celkové přežití (14 vs 41 týdnů). U pacientů s pokročilejší cirhózou bylo daleko častější také jaterní selhání s rozvojem ascitu, hyperbilirubinemie a encefalopatie. K stejnému závěru dospěly i další podobné studie [26].
Přítomnost cirhózy představuje i otázku, zda je třeba modifikovat obvyklou dávku sorafenibu při zahájení léčby a na základě jakých parametrů. Subanalýza studie SHARP se zabývala pacienty s elevací transamináz [27]. U pacientů, kteří měli hodnoty transamináz zvýšeny ≥ 1,8x proti horní hranici normy, se neprojevil žádný rozdíl v toxicitě léku a klinický přínos byl stejný jako u nemocných bez elevace jaterních testů, takže se zdá, že v případě mírného zvýšení transamináz není redukce dávky nutná. Naopak na základě výsledků studie fáze I je nepochybné, že elevace bilirubinu 1,5–3× vyžaduje redukci dávky o 400 mg denně. Při vyšší hodnotě bilirubinu by neměl být sorafenib vůbec podáván [28]. To částečně souvisí i s otázkou preskripce sorafenibu pacientům v pokročilejším stadiu onemocnění. Česká onkologická společnost proto doporučuje sorafenib jako terapii první volby v léčbě inoperabilního nebo metastazujícího hepatocelulárního karcinomu s omezením na stadium cirhózy Child-Pugh A a B. Kontraindikací je hypersenzitivita na kteroukoli část přípravku. Lék by neměl být podáván s antacidy a induktory metabolických enzymů. Užívá se v dávce 2 × 200 mg 2× denně vždy ve stejnou dobu nalačno nebo s jídlem s nízkým obsahem tuků do doby, dokud můžeme pozorovat efekt léčby, nebo pokud není nutno lék pro toxicitu vysadit. Z nežádoucích účinků je třeba počítat s kožní toxicitou (hand-foot syndrom), hypertenzí a ischemickou chorobou srdeční a zhoršením funkce jater. Vysazení léku před operací indikuje zhoršené hojení ran.
Kombinovaná biochemoterapie
Ve studii fáze II byli pacienti léčeni doxorubinem v dávce 60 mg/m2 jednou za 21 dní. Polovina z nich užívala ještě sorafenib v dávce 400 mg 2× denně 6 měsíců, druhá polovina placebo. Kombinovaná léčba vedla v předběžném hodnocení ke snížení počtu odpovědí, ale prodloužení doby do progrese (8,6 vs 4,8 měsíců) i celkového přežití (13,7 vs 6,5 měsíců). Profil toxicity nebyl výrazně horší v kombinovaném rameni, i když u pěti nemocných došlo ke snížení LVEF (ejekční frakce levé komory srdeční). Výsledky však vyžadují delší dobu sledování [32].
Další možnosti biologické léčby
Díky zacílení na VEGF u HCC je také účinný bevacizumab. Prokázaly to dvě studie. V první studii bylo 46 nemocných s nemetastazujícím HCC léčeno bevacizumabem v dávce 5 mg/kg nebo 10 mg/kg každý druhý týden. Odpověď byla zaznamenána u 13 % s jedním případem kompletní remise, medián doby bez progrese byl 6,9 měsíce. Hlavními typy toxicity grade 4 byla hypertenze (15 %), trombóza (6 %) a krvácení (11 %). Podobné výsledky měla i druhá studie se 30 nemocnými se stejnou dávkou léku. Ke stabilizaci došlo u 13 z nich se stejným profilem toxicity. Hlavním problémem bylo krvácení z jícnových varixů. V rámci studie byla vyzkoušena také kombinace bevacizimabu s GEMOXEM (gemcitabin, oxaliplatina). Odpověď se dostavila u 20 % nemocných, 48 % dosáhlo šestiměsíčního mediánu doby do progrese a celkové přežití bylo 9,6 měsíců, což je lepší výsledek proti monoterapii bevacizumabem nebo léčbě GEMOXem samotným. Nicméně toxicita a náročnost léčby ji vymezuje pouze pro klinické studie. Další studie zkoumají nové kombinace chemoterapie a bevacizumabu [32].
Také sunitinib jako perorální tyrosinkinázový inhibitor ovlivňující VEGFR, PDGFR, KIT, RET a FLT3 byl předmětem studie fáze II se 37 pacienty. Lék byl podáván v dávce 50 mg denně vždy šest týdnů. Léčba dosáhla jedné kompletní remise a u 39 % pacientů stabilizace nemoci za cenu významných nežádoucích účinků jako trombocytopenie (43 %), neutropenie (24 %), příznaků CNS (24 %), hubnutí (22 %) a krvácení (14 %). Čtyři pacienti zemřeli na fatální komplikace (jaterní selhání, krvácení aj.) Při snížení dávky sunitinibu na 37,5 mg denně ubylo sice závažných komplikací, ale také byl menší účinek léčby (PFS 3,9 měsíců a OS 9,8 měsíců) [29].
Malá molekula anti EGFR tyrosinkinázového inhibitoru erlotinib byla testována ve studii fáze II s 38 nemocnými s inoperabilním HCC, z nichž polovina byla už předléčena chemoterapií. Overexpresi HER1-EGFR mělo 88 % z nich. 32 % nemocných progredovalo později než po šesti měsících, medián celkového přežití byl 13 měsíců [31]. V druhé studii bylo léčeno 40 pacientů 150 mg erlotinibu denně. 17 dosáhlo stabilizace nemoci po 16 týdnů a medián celkového přežití byl 11 měsíců. V současné době probíhají další studie s kombinací erlotinibu s chemoterapií. Velmi dobré výsledky měla i kombinace erlotinibu s bevacizumabem ve studii fáze II se 40 pacienty s inoperabilním HCC. Byl podáván bevacizumab 10 mg/kg 1× za 14 dní v kombinaci s denní dávkou erlotinibu 150 mg. Čtvrtina léčených pacientů dosáhla parciální remise a 37 % mělo onemocnění stabilní. Medián období bez progrese byl 9 měsíců a celkové přežití 15,6 měsíců. Tyto slibné výsledky potřebují konfirmaci dalšími klinickými daty [33].
Kombinace cetuximabu (anti EGFR monoklonální protilátka) s GEMOXEM (gemcitabin, oxaliplatina) se jevila v rámci studie se 44 pacienty také slibně. 65 % nemocných dosáhlo kontroly nemoci s minimem nežádoucích účinků, z nichž nejzávažnější byla trombocytopenie.
Přítomnost estrogenních receptorů na buňkách HCC představovala určitou naději, že jejich blokáda antiestrogenní léčbou tamoxifennem bude mít terapeutický efekt, což se, bohužel, ve studiích neprokázalo. Stejně tak měl megestrol acetát spíše jen roborující efekt v rámci podpůrné léčby než objektivní dopad na ústup nádoru. Na nádorových buňkách byly identifikovány i somatostatinové receptory, což byl opět logický důvod k úvaze o možné účinnosti jejich inhibitorů. Závěry klinických studií jsou však kontroverzní. V jedné z nich se sice neobjevila významná objektivní odpověď, ale došlo k prodloužení přežití. Žádná z dalších studií toto zjištění nepotvrdila, takže octreotid i lantreotid k rutinnímu užití doporučovány nejsou [34].
Současná léčebná doporučení
Hepatocelulární karcinom je agresivní nádor, který se velmi často objevuje v souvislosti s chronickým onemocněním jater a cirhózou. Rezervu jaterního parenchymu dobře popisuje klasifikace dle Child-Pugh (tab. 1).
Tab. 1. Child-Pugh skóre jaterní cirhózy. Tab. 1. Child-Pugh liver cirrhosis score. 
Zhodnocení: třída A: 5–6 bodů / třída B: 7–9 bodů / třída C: 10–15 bodů Pokud je možné indikovat některou z forem lokální terapie, je zpravidla upřednostňována před léčbou systémovou. Pacienti, kteří nejsou vhodní pro lokoregionální léčbu pro pokročilé onemocnění, mohou profitovat ze systémové léčby. Vzhledem k naději na prodloužení života je současným standardem systémové léčby u málo pokročilé cirhózy sorafenib (úroveň dokladů 1B) v dávce 400 mg 2× denně. Výhodnou volbou léčby je i zařazení takového nemocného do probíhajících klinických studií, kde je sorafenib obvyklým komparátorem. Pokud onemocnění při léčbě sorafenibem progreduje a pacient je v dobrém celkovém stavu s dostatečnou funkční rezervou jater, je metodou volby systémová chemoterapie (tab. 2).
Tab. 2. Indikace systémové léčby hepatocelulárního karcinomu. Tab. 2. Suggestions for systemic treatment of hepatocellular carcinoma. 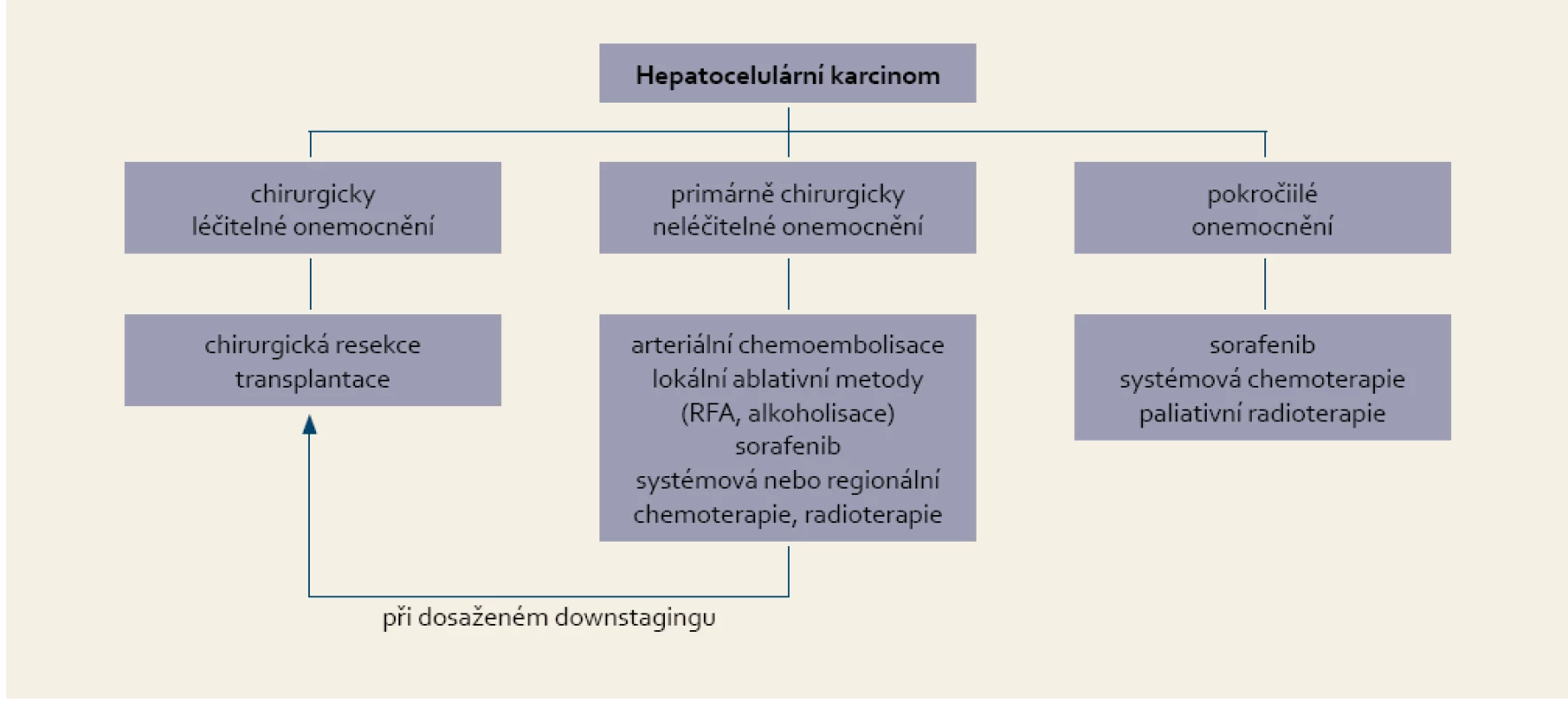
Žádný ze zkoušených režimů nepotvrdil svou superioritu, takže volba léčby závisí na individuálním zhodnocení přínosů a potenciálních nežádoucích účinků léčby. Pokud nemocný nemůže vstoupit do klinické studie, je možnou volbou kombinace gemcitabinu s cisplatinou (úroveň dokladů 2C). Alternativou je podávání doxorubicinu s cisplatinou, gemcitabinu s oxaliplatinou nebo pegylovaného lipozomálního doxorubicinu. Pro starší pacienty nebo ,,křehké“ nemocné je vhodná aplikace doxorubicinu v týdenních intervalech nebo capecitabinu per os. 5-fluoruracil s leukovorinem je metodou volby pro pacienty s ikterem [35].
Přínos a bezpečnost kombinace preparátů biologické léčby nebo biologické léčby s chemoterapií není ještě dostatečně ověřena, a proto se mimo klinické studie nedoporučuje. Tamoxifen není ani v monoterapii ani v kombinaci s doxorubicicnem či oktreotidem dostatečně účinný. Podání oktreotidu nebo lanreotidu mimo klinické studie také není vhodné.
Při volbě sorafenibu jako standardní léčby je třeba dobře zvážit celkový stav nemocného, pokročilost cirhózy a potenciální nežádoucí účinky této léčby v individuálním případě konkrétního pacienta. Podmínkou k zahájení léčby sorafenibem je i histologická verifikace nádoru.
doc. MUDr. Petra Tesařová, CSc.
Onkologická klinika 1. LF UK a VFN Praha
Tesarova.Petra@seznam.cz
Zdroje
1. Mínguez B, Tovar V, Chiang D et al. Pathogenesis of hepatocellular carcinoma and molecular therapies. Curr Opin Gastroenterol 2009; 25(3): 186–194.
2. Villanueva A, Toffanin S, Llovet JM. Linking molecular classification of hepatocellular carcinoma and personalized medicine: preliminary steps. Curr Opin Oncol 2008; 20(4): 444–453.
3. Luna LE, Kwo PY, Roberts LR et al. Liver transplantation after radioembolization in a patient with unresectable HCC. Nat Rev Gastroenterol Hepatol 2009; 6(11): 679–683.
4. Nguyen KT, Gamblin TC, Geller DA. World review of laparoscopic liver resection-2,804 patients. Ann Surg 2009; 250(5): 831–841.
5. Padma S, Martinie JB, Iannitti DA. Liver tumor ablation: percutaneous and open approaches. J Surg Oncol 2009;100(8): 619–634.
6. Palussičre J, Descat E, Fonck M et al. [Radiofrequency ablation in the treatment of liver and lung tumors]. Bull Cancer 2009; 96(11): 1099–1109.
7. Forner A, Trinchet JC.Transarterial therapies in HCC: does embolization increase survival? J Hepatol 2009; 51(6): 981–983.
8. Mohnike K, Wieners G, Pech M et al. Image-guided interstitial high-dose-rate brachytherapy in hepatocellular carcinoma. Dig Dis 2009; 27(2): 170–174.
9. Shim JH, Park JW, Nam BH et al. Efficacy of combination chemotherapy with capecitabine plus cisplatin in patients with unresectable hepatocellular carcinoma. Cancer Chemother Pharmacol 2009; 63(3): 459–467.
10. Lee JO, Lee KW, Oh DY et al. Combination chemotherapy with capecitabine and cisplatin for patients with metastatic hepatocellular carcinoma. Ann Oncol 2009; 20(8): 1402–1407.
11. Parikh PM, Fuloria J, Babu G et al. A phase II study of gemcitabine and cisplatin in patients with advanced hepatocellular carcinoma. Trop Gastroenterol 2005; 26(3): 115–118.
12. Chia WK, Ong S, Toh HC et al. Phase II Trial of Gemcitabine in Combination with Cisplatin in Inoperable or Advanced Hepatocellular Carcinoma. Ann Acad Med Singapore 2008; 37(7): 554–558.
13. Ivy SP, Wick JY, Kaufman BM. An overview of small-molecule inhibitors of VEGFR signaling. Nat Rev Clin Oncol 2009; 6(10): 569–579. Epub 2009 Sep 8.
14. Llovet JM, Sala M, Castells L et al. Randomized controlled trial of interferon treatment for advanced hepatocellular carcinoma. Hepatology 2000; 31(1): 54–58.
15. Kerr SH, Kerr DJ. Novel treatments for hepatocellular cancer. Cancer Lett 2009; 286(1): 114–120.
16. Keating GM, Santoro A. Sorafenib: a review of its use in advanced hepatocellular carcinoma. Drugs 2009; 69(2): 223–240.
17. Thomas M. Molecular targeted therapy for hepatocellular carcinoma. J Gastroenterol 2009; 44 (Suppl 19): 136–141.
18. Kudo M. Hepatocellular carcinoma 2009 and beyond: from the surveillance to molecular targeted therapy. Oncology 2008; 75 (Suppl 1): 1–12.
19. Kane RC, Farrell AT, Madabushi R et al. Sorafenib for the treatment of unresectable hepatocellular carcinoma. Oncologist 2009; 14(1): 95–100.
20. Greten TF, Korangy F, Manns MP et al. Molecular therapy for the treatment of hepatocellular carcinoma. Br J Cancer 2009; 100(1): 19–23.
21. Abou-Alfa GK, Schwartz L, Ricci S et al. Phase II study of sorafenib in patients with advanced hepatocellular carcinoma. J Clin Oncol 2006; 24(26): 4293–4300.
22. Llovet JM, Ricci S, Mazzaferro V et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008; 359(4): 378–390.
23. Cheng AL, Kang YK, Chen Z et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol 2009; 10(1): 25–34.
24. Raoul J, Santoro A, Beaugrand M et al. Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma according to ECOG performance status: a subanalysis from the SHARP trial (abstract). J Clin Oncol 2008; 26 : 234.
25. Huitzel-Melendez FD, Saltz LB, Song J et al. Retrospective analysis of outcome in hepatocellular carcinoma (HCC) patients with hepatitis C (C+) versus B (B+) treated with sorafenib (abstract). Data preseted at the 2007 ASCO Gastrointestinal Cancers Symposium, January 19–21st, 2007, Orlando, FL.
26. Bolondi L, Caspary W, Bennouna J et al. Clinical benefit of sorafenib in hepatitis C patients with hepatocellular carcinoma (HCC): subgroup analysis of the SHARP trial (abstract). Data presented at the 2008 ASCO Gastrointestinal Cancers Symposium, Orlando, FL, January 25–27, 2008. (abstract 129).
27. D‘Amico G, Garcia-Tsao G, Pagliaro L. Natural history and prognostic indicators of survival in cirrhosis: A systematic review of 118 studies. J Hepatol 2006; 44(1): 217–231.
28. Abou-Alfa GK, Amadori D, Santoro A et al. Is sorafenib safe and effective in patients with hepatocellular carcinoma and Child-Pugh B cirrhosis? (abstract). J Clin Oncol 2008.
29. Zhu AX, Duda DG, Sahani DV et al. Development of sunitinib in hepatocellular carcinoma: rationale, early clinical experience, and correlative studies. Cancer J 2009; 15(4): 263–268.
30. Mendizabal M, Reddy KR. Current management of hepatocellular carcinoma. Med Clin North Am 2009; 93(4): 885–900.
31.Wörns MA, Weinmann A, Schuchmann M et al. Systemic therapies in hepatocellular carcinoma. Dig Dis 2009; 27(2): 175–188.
32. Finn RS, Zhu AX. Targeting angiogenesis in hepatocellular carcinoma: focus on VEGF and bevacizumab. Expert Rev Anticancer Ther 2009; 9(4): 503–509.
33. Oseini AM, Roberts LR. PDGF Ralpha: a new therapeutic target in the treatment of hepatocellular carcinoma? Expert Opin Ther Targets 2009; 13(4): 443–454.
34. Llovet JM, Bruix J. Molecular targeted therapies in hepatocellular carcinoma. Hepatology 2008; 48(4): 1312–1327.
35. Verslype C, Van Cutsem E, Dicato M et al. The management of hepatocellular carcinoma. Current expert opinion and recommendations derived from the 10th World Congress on Gastrointestinal Cancer, Barcelona, 2008. Ann Oncol 2009; 20 Suppl 7: vii1-vii6.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2010 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Srovnávací analýza výsledků laparoskopické a tradiční cholecystektomie u pacientů s akutní cholecystitidou
- Místo sorafenibu v léčbě hepatocelulárního karcinomu
- Gastrointestinální stromální tumor (GIST) jako příčina obskurního krvácení do zažívacího traktu
-
Účinnost udržovací terapie u ulcerózní kolitidy je ovlivněna farmakokinetikou mesalazinu a adherencí k medikamentózní léčbě
Komentář ke studii PODIUM - Prof. MUDr. Jiří Ehrmann, CSc. sedmdesátníkem
- 7. letní škola gastroenterologie ASNEMGE/EAGE
-
Jiří Ehrmann, Petr Hůlek. Hepatologie.
Praha: Grada 2010.
616 stran - Kalendář gastroenterologických akcí 2011
- Starostlivosť o pacientov s akútnou pankreatitídou v Slovenskej republike – prieskum
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Prof. MUDr. Jiří Ehrmann, CSc. sedmdesátníkem
- Starostlivosť o pacientov s akútnou pankreatitídou v Slovenskej republike – prieskum
- Místo sorafenibu v léčbě hepatocelulárního karcinomu
- Srovnávací analýza výsledků laparoskopické a tradiční cholecystektomie u pacientů s akutní cholecystitidou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



