-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučené postupy Evropské společnosti pro gastrointestinální endoskopii (ESGE): profylaxe pankreatitidy po provedené ERCP
Autoři: J.-M. Dumonceau 1; A. Andriulli 2; J. Deviere 3; A. Mariani 4; J. Rigaux 3; T. H. Baron 5; P. A. Testoni 4
Působiště autorů: Service of Gastroenterology and Hepatology, Geneva University Hospitals, Ženeva, Švýcarsko 1; Division of Gastroenterology, Casa Sollievo Sofferemza Hospital, IRCCS, San Giovanni Rotondo, Itálie 2; Departments of Gastroenterology and Hepato-Pancreatology, Erasme University Hospital, Brusel, Belgie 3; Division of Gastroenterology and Gastrointestinal Endoscopy, Vita-Salute San Raffaele University, IRCCS San Raffaele Hospital, Milán, Itálie 4; Department of Medicine, Division of Gastroenterology and Hepatology, Mayo Medical Center, Rochester, Minnesota, USA 5
Vyšlo v časopise: Gastroent Hepatol 2013; 67(2): 134-150
Kategorie: Digestivní endoskopie: doporučené postupy
Překlad: J. Špičák
Klinika hepatogastroenterologie, IKEM, Praha
julius.spicak@ikem.cz
Pankreatitida představuje nejčastější komplikaci endoskopické retrográdní cholangiopankreatografie (ERCP). Rizikové faktory rozvoje pankreatitidy po ERCP (post-ERCP pancreatitis, PEP) se vztahují jak ke stavu pacienta, tak k povaze výkonu. Identifikace pacientů s vysokým rizikem rozvoje PEP má význam pro zaměření profylaktických opatření. Prevence PEP zahrnuje podávání nesteroidních antirevmatik (NSAID), používání specifických kanylačních technik a zavádění dočasných pankreatických stentů. Cílem těchto doporučených postupů, jejichž vypracování zadala Evropská společnost pro gastrointestinální endoskopii (European Society of Gastrointestinal Endoscopy, ESGE), je poskytnout praktická, odstupňovaná doporučení pro prevenci PEP.
1. Úvod
Endoskopická retrográdní cholangiopankreatografie (ERCP) se stala téměř výhradně terapeutickým výkonem. Ze všech v současnosti prováděných rutinních gastrointestinálních endoskopických výkonů je zatížena nejvyšším výskytem komplikací. Mezi komplikace ERCP patří pankreatitida, krvácení, cholangitida, cholecystitida a perforace. Nejčastější z těchto komplikací je PEP. Většinou se jedná o postižení lehké či středně závažné, ale v 10 % případů je těžké a potenciálně fatální. Rizikové faktory PEP v souvislosti s pacientem a výkonem jsou dobře známy. V poslední době byly přesně popsány účinné způsoby prevence PEP; patří mezi ně zdokonalení technik kanylace i farmakologické a chirurgické intervence.
Cílem těchto doporučených postupů je nabídnout poskytovatelům péče rámec, v němž lze realizovat postupy ve snaze omezit na minimum incidenci a závažnost PEP. Doporučení nejsou striktní a nemohou nahradit úsudek lékaře v klinické praxi.
2. Metody
ESGE zadala vypracování těchto doporučených postupů, které byly následně schváleny výborem společnosti. Způsob vypracování doporučených postupů je shrnut v následujících řádcích. V roce 2009 provedl první autor předběžnou literární rešerši. Původní články byly vyhledány v databázích PubMed//MEDLINE, Cochrane Library, Embase a na internetu zadáním termínů „ERCP“ a „pancreatitis“. Články byly nejprve vybrány podle názvu. Jejich hodnota byla následně potvrzena kontrolou odpovídajícího abstraktu. Publikace psané jinak než v angličtině a ty, jejichž obsah byl vyhodnocen jako nevýznamný, byly vyřazeny. Tato počáteční rešerše se zaměřila na celé publikované prospektivní studie, zvláště randomizované kontrolované studie (Randomized Controlled Trials, RCT), i když zařazeny byly i retrospektivní analýzy a studie malých skupin pacientů (case series), pokud pojednávaly o tématech, jimiž se prospektivní studie nezabývaly. Další články byly vyhledány ručně v citacích (literárních odkazech) na konci nalezených článků. Přehled výsledků rešerše byl předložen výboru ESGE.
Autoři, jimž bylo vypracování těchto doporučených postupů zadáno, se sešli třikrát a následně vypracovali doporučené postupy, do nichž zahrnuli doporučení členů výboru společnosti. V listopadu roku 2009 byl konečný návrh dokumentu rozeslán všem členům ESGE. Po zapracování poznámek zaslaných jednotlivými členy ESGE byl rukopis zaslán redakční radě časopisu Endoscopy k posouzení a recenzi zahraničních odborníků. Konečné znění doporučených postupů bylo odsouhlaseno všemi autory.
Kategorie důkazů
Síla důkazů použitá v těchto doporučených postupech vycházela z kritérií doporučených organizací Scottish Intercollegiate Guidelines Network [1]. Stručný přehled způsobu hodnocení úrovně důkazů je uveden v následujících odstavcích:
1++ Vysoce kvalitní metaanalýzy, systematické přehledy RCT nebo RCT s velmi nízkým rizikem zkreslení.
1+ Správně provedené metaanalýzy, systematické přehledy RCT nebo RCT s nízkým rizikem zkreslení.
1– Metaanalýzy, systematické přehledy nebo RCT s vysokým rizikem zkreslení.
2++ Vysoce kvalitní systematické přehledy studií případů a kontrol nebo kohortových studií; vysoce kvalitní studie případů a kontrol nebo kohortové studie s velmi nízkým rizikem zkreslení, neobjektivnosti nebo náhody a s vysokou pravděpodobností kauzality.
2+ Dobře provedené studie případů a kontrol nebo kohortové studie s nízkým rizikem zkreslení, neobjektivnosti nebo náhody a s přiměřenou pravděpodobností kauzality.
2 – Studie případů a kontrol nebo kohortové studie s vysokým rizikem zkreslení, neobjektivnosti nebo náhody a se statisticky významným rizikem, že se nejedná o kauzální vztah.
3 Neanalytické studie, např. kazuistiky, malé skupiny pacientů a kontrol.
4 Názor odborníka.
Stupně doporučení
Doporučení vycházela z úrovně důkazů přeložených na podporu těchto doporučení a byla příslušným způsobem odstupňována [1]. Toto odstupňování je shrnuto dále:
A Alespoň jedna metaanalýza, systematický přehled nebo RCT hodnocená 1++ a přímo použitelná na cílovou populaci nebo systematický přehled několika RCT nebo řada důkazů pocházejících převážně ze studií s hodnocením 1+ přímo použitelných pro cílovou populaci a vykazujících celkovou homogenitu výsledků.
B Řada důkazů včetně studií hodnocených 2++ přímo použitelných pro cílovou populaci a vykazujících celkovou homogenitu výsledků nebo důkazy extrapolované ze studií hodnocených 1++ nebo 1+.
C Řada důkazů včetně studiích hodnocených 2+ přímo použitelných pro cílovou populaci a vykazujících celkovou homogenitu výsledků nebo důkazy extrapolované ze studií hodnocených 2++.
D Úroveň důkazů 3 nebo 4 nebo důkazy extrapolované ze studií hodnocených 2+.
Žádná doporučení nebyla vypracována pro intervence analyzované v jediné studii.
3. Přehled konstatování a doporučení
- Pankreatitida představuje nejčastější komplikaci po ERCP s incidencí 3,5 % u neselektovaných pacientů, přibližně v 90 % případů je lehká až středně závažná. Nezávislé rizikové faktory rozvoje PEP v souvislosti s pacienty a s výkony jsou uvedeny v tab. 1. Rizikové faktory synergicky zvyšují riziko PEP (úroveň důkazů 1+).
Tab. 1. Nezávislé rizikové faktory rozvoje pankreatitidy po ER CP (PEP).* Tab. 1. Randomized controlled trials of interventions for pain in uncomplicated chronic pancreatitis (excluding celiac plexus block and surgery-only trials). 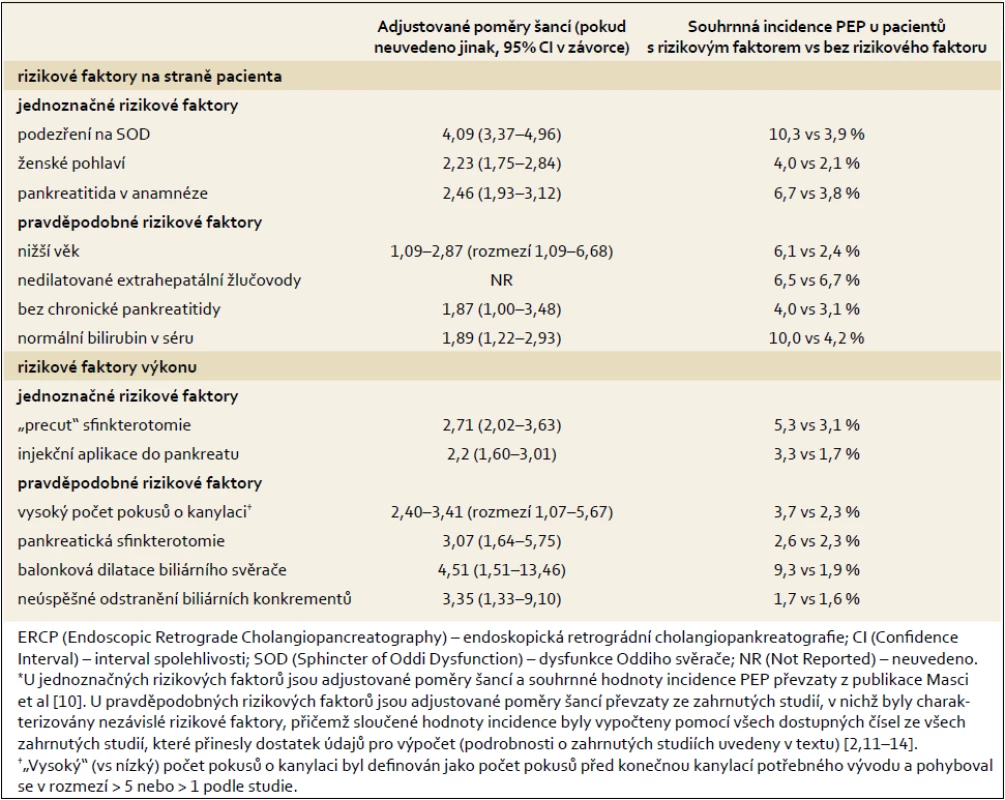
- Nejsou k dispozici důkazy, že by počty ERCP prováděných v daném zařízení měly vliv na incidenci PEP, údaje o potenciální spojitosti mezi incidencí PEP a počty pacientů ošetřených konkrétním endoskopistou nejsou jednoznačné. Malé počty pacientů ošetřených konkrétním endoskopistou a na konkrétních pracovištích jsou spojeny s vyšším procentem neúspěšné ERCP (úroveň důkazů 2+).
- Hodnoty amyláz v séru nižší než 1,5násobek horní hranice normálu (Upper Limit of Normal, ULN) naměřené 2–4 hod po ERCP téměř vylučují přítomnost PEP, hodnoty vyšší než 3 nebo pětinásobek ULN 4–6 hod po ERCP vykazují zvyšující se pozitivní predikční hodnotu přítomnosti PEP (úroveň důkazů 2+). Doporučuje se stanovovat sérové koncentrace amylázy u pacientů před propuštěním v den provedení ERCP, pacienty s hodnotami amylázy pod 1,5násobkem ULN lze propustit bez obav ohledně rizika PEP (stupeň doporučení B).
- Nesteroidní antirevmatika (NSAR) snižují incidenci PEP, bylo prokázáno, že účinná profylaxe PEP vyžaduje rektální podávání diclofenacu nebo indomethacinu v dávce 100 mg (úroveň důkazů 1++). Doporučuje se rutinně podávat bezprostředně před ERCP nebo po něm rektálně diclofenac nebo indomethacin v dávce 100 mg (stupeň doporučení A).
- Nitroglycerin snižuje incidenci PEP, při transdermální aplikaci však není účinný (úroveň důkazů 1++). Mohou se vyskytnout nežádoucí účinky jako přechodná hypotenze a bolesti hlavy. Rutinní podávání nitroglycerinu v profylaxi PEP nedoporučujeme (stupeň doporučení A).
- Ceftazidim v jedné studii snižoval incidenci PEP (úroveň důkazů 1–). Dříve než se bude doporučovat užívání ceftazidimu v profylaxi PEP, je třeba získat další údaje (stupeň doporučení C).
- Somatostatin: Na základě ad hoc metaanalýzy výsledků deseti vysoce kvalitních RCT se neprokázala prevence PEP (úroveň důkazů 1++). Paušální profylaktické podávání somatostatinu pacientům s průměrným rizikem rozvoje ERCP se nedoporučuje (stupeň doporučení A). Podávání somatostatinu by mohlo být účinnější při použití specifických dávkovacích režimů, interpretaci výsledků analýz podskupin je však nutno brát s rezervou, protože v RCT se často nadhodnocují rozdíly mezi jednotlivými způsoby léčby.
- Podávání octreotidu po analýze osmi kvalitních studií celkovou incidenci PEP neovlivnilo (úroveň důkazů 1++). Profylaxe octreotidem se nedoporučuje (stupeň doporučení A). V příštích studiích účinnosti profylaktického podávání octreotidu je třeba hodnotit účinnost dávek 0,5 mg a vyšších.
- Profylaxe gabexatem nebo ulinastatinem incidenci PEP nesnižuje (úroveň důkazů 1++). Ani jedna z těchto se v profylaxi PEP nedoporučuje (stupeň doporučení A).
- Nejsou k dispozici žádné důkazy o tom, že by glukokortikoidy jako látky snižující sevření Oddiho svěrače (kromě nitroglycerinu), antioxidanty, heparin, interleukin-10, nesteroidní antirevmatika (s výjimkou diclofenacu a indomethacinu), pentoxyfilin, semapimod a acetylhydroláza rekombinantní destičky aktivující faktor snižovaly incidenci PEP (úroveň důkazů v rozmezí 1 – až 1++). Žádná z těchto látek se k profylaxi PEP nedoporučuje (stupeň doporučení A).
- Nejsou žádné důkazy o tom, že by incidenci PEP ovlivňovala poloha pacienta během ERCP (úroveň důkazů 2++). Proto se žádné doporučení ohledně polohy pacienta neuvádí.
- Bylo prokázáno, že traumatizace Vaterské papily v důsledku opakovaných pokusů o kanylaci žlučových cest (biliary cannulation) představuje rizikový faktor rozvoje PEP (úroveň důkazů 2++). Počet pokusů o kanylaci je nutno omezit na minimum (stupeň doporučení B).
- Injekční aplikace kontrastní látky do pankreatických vývodů představuje nezávislý prediktor rozvoje PEP (úroveň důkazů 1+). Ať již k injekční aplikaci do pankreatického vývodu dojde náhodou nebo je ho zapotřebí, je nutno počet injekčních aplikací a objem kontrastních látek injikovaných do pankreatického vývodu omezit na minimum (stupeň doporučení B).
- Ve srovnání s tradičními vysoce osmolárními kontrastními látkami jsou kontrastní látky s nízkou osmolalitou dražší a přitom nesnižují výskyt PEP (úroveň důkazů 1–). Rutinní aplikace těchto látek pro ERCP se nedoporučuje (stupeň doporučení B).
- Použití oxidu uhličitého (CO2) místo vzduchu pro insuflaci lumen během ERCP incidenci PEP neovlivňuje, ale snižuje incidenci a závažnost bolestí břicha po výkonu (úroveň důkazů 1+). Oxid uhličitý se pro insulfaci doporučuje a mohl by být zvláště užitečný při ambulantní ERCP, kdy by tlumil bolest břicha po výkonu a umožnil odlišení výsledného stavu od PEP (stupeň doporučení B).
- Při hluboké biliární kanylaci snižuje technika s primárním zavedením vodicího drátu (wire guided) riziko PEP a zvyšuje úspěšnost primární kanylace oproti standardní metodě s primární aplikací kontrastní látky (úroveň důkazů 1++). Pro hlubokou biliární kanylaci se doporučuje technika „wire-guided“ (stupeň doporučení A).
- Incidence pankreatitidy po papilosfinkterotomii není ovlivněna použitým typem elektrochirurgického proudu (ať již čistým řezacím nebo smíšeným) (úroveň důkazů 1+). Pro biliární sfinkterotomii se doporučuje smíšený proud (blended current), zvláště u pacientů s vysokým rizikem krvácení (stupeň doporučení A).
- Údaje o užitečnosti a bezpečnosti zavádění pankreatického vodicího drátu pro usnadnění biliární kanylace v obtížných případech nejsou jednoznačné. Profylaktické zavedení pankreatického stentu snižuje při použití této techniky incidenci PEP (úroveň důkazů 2+). Zavedení vodicího drátu do pankreatiku může usnadnit biliární kanylaci hlavně v případě opakované nezamýšlené kanylace pankreatického vývodu; pokud se použije tato metoda, je vhodné zavést dočasně pankreatický stent jako profylaxi PEP (stupeň doporučení B).
- Byly popsány různé techniky „precut“ biliární sfinkterotomie; technika fistolotomie může být vzhledem k vniku PEP bezpečnější než standardní „precut“ jehlovým nožem, ale teprve další RCT mohou dát definitivní odpověď. Nejsou k dispozici žádné důkazy, že by úspěšnost a výskyt komplikací „precut“ byly ovlivněny mírou zkušeností endoskopisty s touto technikou, ale publikované údaje jsou pouze od jednoho endoskopisty (úroveň důkazů 2–). Snaha o prolongovanou kanylaci standardní technikou může zvýšit riziko rozvoje PEP více než samotná „precut“ sfinkterotomie (úroveň důkazů 2+). „Precut“ sfinkterotomii musí provádět endoskopista se znalostí standardních technik kanylace (stupeň doporučení D). Rozhodnutí o provedení „precut“ biliární sfinkterotomie, jejího načasování a samotné techniky vychází z anatomických poměrů, preference endoskopisty a indikace k výkonu (stupeň doporučení C).
- Ve srovnání s endoskopickou sfinkterotomií je endoskopická papilární balonková dilatace (Endoscopic Papillary Balloon Silation, EPBD) s použitím balonků o malém průměru (≤ 10 mm) spojena se statisticky významně vyšší incidencí PEP a statisticky významně nižší incidencí krvácení (úroveň důkazů 1++). EPBD se nedoporučuje jako alternativa sfinkterotomie při rutinním ERCP, ale může být vhodná u pacientů s koagulopatií a změněnou anatomií (např. Billroth II) (stupeň doporučení A). Pokud se balonková dilatace provádí u mladých pacientů, je nutno zvážit preventivní zavedení pankreatického stentu (úroveň důkazů 4; stupeň doporučení D).
- Potenciální výhody dilatace s velkým balonkem po endoskopické sfinkterotomii při odstraňování objemných biliárních konkrementů stále nebyly přesně definovány (úroveň důkazů 3). Nezdá se, že by endoskopická sfinkterotomie po dilataci pomocí velkých balonků zvyšovala riziko PEP a u některých pacientů může být alternativou mechanické litotripsie, pro rutinní provádění však není k dispozici dostatek údajů (stupeň doporučení D).
- Bylo zjištěno, že použití standardního perfuzního katétru bez možnosti aspirace (aspiračního portu) při manometrii Oddiho svěrače zvyšuje riziko rozvoje PEP oproti modifikovaným katétrům s perfuzí vodou (úroveň důkazů 2++). Manometrie pankreatického Oddiho svěrače je nutno provádět s použitím trojcestného modifikovaného perfuzního katétru se současným odsáváním nebo s „microtransducer“ katétrem (bez perfuze vodou) (stupeň doporučení B).
- U nemocných s vysokým rizikem PEP se doporučuje profylaktické zavedení pankreatického stentu. V současné době se doporučují krátké 5-Fr plastové pankreatické stenty. Umístění stentu v pankreatickém vývodu je nutno zkontrolovat 5–10 dnů po jeho zavedení a stenty zůstávající v pankreatiku je nutno urychleně endoskopicky odstranit (úroveň důkazů 1+; stupeň doporučení A).
4. Definice
Konsenzuální definice komplikací ERCP, kterou navrhli Cotton et al, umožnila standardizované hlášení incidence a závažnosti PEP [2]. PEP byla původně definována jako „klinická pankreatitida s hodnotou amylázy 24 hod od výkonu minimálně třikrát vyšší než je normální hodnota, která vyžaduje hospitalizaci nebo její neplánované prodloužení. Existují odlišnosti v interpretaci příznaků. V některých studiích byla pankreatitida definována jako „nově vzniklá nebo zhoršená bolest břicha“ [2], „typická bolest a příznaky“ [3] nebo „bolest a citlivost oblasti břicha“ [4]. Definice, kterou použili Freeman et al (nová nebo zhoršená bolest břicha), bere v úvahu nemocné absolvující ERCP za přítomnosti akutní pankreatitidy nebo vzplanutí chronické pankreatitidy [2]. Současný systém odstupňování závažnosti PEP vychází primárně z délky hospitalizace: mírná PEP je definována jako potřeba příjmu do nemocnice nebo prodloužení plánové hospitalizace až o tři dny; PEP střední intenzity je definována nutností hospitalizace na dobu 4–10 dnů a těžká PEP nutností hospitalizace po dobu delší než 10 dnů nebo rozvojem hemoragické pankreatitidy, flegmóny (dnes označované termínem pankreatická nekróza), vznikem pseudocysty nebo nutností intervence nebo chirurgického výkonu [5]. V budoucích prospektivních studiích doporučujeme užívat specifičtější „grading“ systémy závažnosti pankreatitidy (např. Atlantskou klasifikaci) [6].
Zvýšené hodnoty amylázy v séru 24 hod po ERCP v nepřítomnosti chronické pankreatitidy lze zjistit často (53 % v prospektivní studii). V další RCT se bolest břicha v nepřítomnosti PEP vyskytla v 62 % případů při insuflaci vzduchem namísto oxidu uhličitého [7,8]. Proto je v RCT hodnotících účinnost intervencí k prevenci rozvoje PEP nutno stanovovat standardní prahové hodnoty amyláz v séru (trojnásobek horní hranice normálních hodnot (three times the upper limit of normal ULN) 24 hod po ERCP) a klinické vyšetření pacienta musí hodnotit lékař, který není informován, do které skupiny byl pacient zařazen.
5. Incidence, rizikové faktory a závažnost PEP
- Pankreatitida představuje nejčastější komplikaci po ERCP s incidencí 3,5 % u neselektovaných pacientů, přibližně v 90 % případů je mírně až středně závažná. Nezávislé rizikové faktory rozvoje PEP v souvislosti s pacienty a s výkony jsou uvedeny v tab. 1. Rizikové faktory synergicky zvyšují riziko PEP (úroveň důkazů 1+).
Na základě systematického přehledu 21 prospektivních studií, do nichž bylo zařazeno více než 16 000 pacientů [9], se zjistilo, že PEP je nejčastější komplikací po ERCP s incidencí 3,47 % (95% interval spolehlivosti (Confidence Interval, CI) 3,19–3,75 %). Jak již bylo uvedeno výše, může být PEP z hlediska závažnosti lehká, středně závažná a těžká. V přehledu studií s neselektovanými pacienty byla PEP lehká v 45 % případů, středně závažná ve 44 % a těžká v 11 % případů, 3 % pacientů zemřelo (95% CI 1,65–4,51 %). Stratifikace pacientů do kategorií s nízkým a vysokým rizikem PEP je nutná pro rozhodování o odeslání pacienta na specializované pracoviště.
Na základě velké metaanalýzy [10] jsou za nezávislé rizikové faktory vzniku PEP považovány tři charakteristiky v souvislosti s pacientem a dvě charakteristiky v souvislosti s výkonem (tab. 1). Nejsilnější vztah vykazuje potvrzená dysfunkce Oddiho svěrače (nebo podezření na dysfunkci) (Sphincter of Oddi Dysfunction, SOD) s incidencí PEP blížící se hodnotě 10 %. Protože bylo v uvedené metaanalýze hodnoceno pouze pět potenciálních rizikových faktorů PEP, analyzovali jsme prospektivní multicentrické studie zkoumající potenciální rizikové faktory PEP pomocí multivariační analýzy. Kritéria splňovalo pět studií zahrnujících celkem 13 745 pacientů [2,11–14]. Charakteristiky v souvislosti s pacienty a s výkony nezávisle spojené s rozvojem PEP nejméně v jedné z uvedených studií jsou uvedeny jako pravděpodobné rizikové faktory v tab. 1 (pankreatická injekce odpovídala ≥ 1 injekci a vysoký počet pokusů o kanylaci odpovídal více než pěti nebo více než jednomu pokusu před kanylací požadovaných vývodů). Výčet rizikových faktorů v tab. 1 není vyčerpávající, protože nebyly analyzovány všechny potenciální rizikové faktory. Například na základě několika malých prospektivních studií je za jednoznačný rizikový faktor rozvoje PEP obecně považována ampulektomie [15,16].
Protože multivariantní analýza prokázala, že rizikové faktory PEP jsou na sobě nezávislé, mohly by mít kumulativní účinek. Freeman et al vypočítali relativní riziko (Odds Ratio, OR) pro různé kombinace rizikových faktorů pomocí údajů prospektivně získaných přibližně z 2 000 ERCP: nejvyšší riziko PEP (42 %) bylo zjištěno u žen s normálními hodnotami bilirubinu v séru, podezřením na SOD a s obtížnou biliární kanylací [11]. Skutečná incidence a závažnost PEP při rizikových onemocněních se odhaduje pomocí údajů z kontrolních ramen RCT hodnotících účinnost profylaktického zavádění pankreatického stentu (kritérii k zařazení byly SOD, průměr společného žlučovodu < 10 mm, „precut“, obtížná kanylace, manometrie Oddiho svěrače, ampulektomie i standardní endoskopická sfinkterotomie) [15,17–19]. Metaanalýza kontrolních ramen čtyř těchto studií zjistila incidenci PEP ve výši 24,1 %; v 84,4 % případech se jednalo o mírné/středně závažné postižení, 15,6 % případů bylo těžkých [20].
- Nejsou k dispozici důkazy, že by počty ERCP prováděných v daném zařízení měly vliv na incidenci PEP; údaje o potenciální spojitosti mezi incidencí PEP a počty pacientů ošetřených konkrétním endoskopistou nejsou jednoznačné. Malé počty pacientů ošetřených konkrétním endoskopistou a na konkrétních pracovištích jsou spojeny s vyšším procentem neúspěšné ERCP (úroveň důkazů 2+).
Mezi faktory, které mohou ovlivnit výsledek ERCP a které specificky souvisí s množstvím tohoto výkonu prováděných v daném zařízení, patří variabilita vybavení a anestezie, spolupráce radiologů i erudice zdravotních sester. Na mnoha pracovištích není počet prováděných ERCP tak velký, jak se obecně předpokládá: v třech velkých (regionálních nebo celostátních) studiích se medián počtu ERCP provedených za rok pohyboval v rozmezí od 49 do 235 [21–23]. V jiné velké studii byl medián počtu ERCP za rok na jednoho endoskopistu 111 a 40 % endoskopistů provádělo méně než 50 sfinkterotomií ročně [24].
Je pravděpodobné, že na pracovištích s malými a velkými počty výkonů je poměr prováděných výkonů (diagnostické a různé terapeutické výkony) rozdílný, což může ovlivnit uváděnou incidenci PEP: např. prevalence podezření na SOD byla 11,7 % ve studiích zařazených do metaanalýzy, kterou provedli Masci et al [10], naopak podle reprezentativního anglického auditu dosáhla tato hodnota pouhých 1,5 % a jedna studie zahrnující údaje z osmi amerických regionálních nemocnic uvedla hodnotu 2,2 % [14,25]. Zdá se tedy, že pracoviště zamýšlející prezentovat údaje o rizikových faktorech vykazují vyšší procenta pacientů s podezřením na SOD, což ukazuje na zkreslení ve smyslu odesílání vysoce rizikových pacientů do uvedených zdravotnických zařízení.
Multivariantní analýzy dvou prospektivních auditů provedených v Anglii a v Itálii (66, resp. 9 zařízení) nezjistily statisticky významné spojitost mezi počtem provedených ERCP v nemocnici za rok a incidencí PEP [12,14]. Podle italské studie se komplikace obecně a cholangitida vyskytovaly častěji v zařízeních s nízkými počty výkonů než v zařízeních s vysokými počty výkonů [12]. Rozsáhlá americká studie (> 2 500 nemocnic) analyzovala vztah mezi počty provedených výkonů v nemocnici a výsledky ERCP [22]. Výskyt komplikací nebylo pro nedostatky v použité databázi možno vyhodnotit. Velký počet provedených ERCP byl spojen s nižším počtem neúspěšných výkonů, nikoli však s mortalitou či PEP.
Počet ERCP provedených endoskopistou lze zvažovat s hlediska celkového počtu za celou kariéru nebo v ročním intervalu, což se považuje za případnější. Ve dvou prospektivních multicentrických studiích, které publikovali Freeman et al [2,11], nebyl při použití multivariantní analýzy zjištěn mezi incidencí PEP a počtem výkonů žádný vztah. PEP byla statisticky významně častější u endoskopistů s vysokými počty výkonů, ale tento vztah pozbyl statistické významnosti po adjustaci se zahrnutím dalších rizikových faktorů v multivariantní analýze [11]. Úspěšnost kanylace žlučovodů byla vyšší u endoskopistů provádějících průměrně více než dvě ERCP týdně [11]. V další prospektivní studii [26] byl nejvýznamnějším rizikovým faktorem PEP po endoskopické papilosfinkterotomii malý počet (méně než 40) těchto výkonů ročně. Jednalo se však o monocentrickou studii nehodnotící další známé rizikové faktory PEP.
Predikce PEP
- Hodnoty amyláz v séru nižší než 1,5násobek horní hranice normálu (Upper Limit of Normal, ULN) naměřené 2–4 hod po ERCP téměř vylučují přítomnost PEP; hodnoty vyšší než troj - nebo pětinásobek ULN 4–6 hod po ERCP vykazují zvyšující se pozitivní predikční hodnotu přítomnosti PEP (úroveň důkazů 2+). Doporučuje se stanovovat sérové koncentrace amylázy u pacientů před propuštěním v den po provedení ERCP; pacienty s hodnotami amylázy pod 1,5násobkem ULN lze propustit bez obav ohledně rizika PEP (stupeň doporučení B).
Ve studii, do níž bylo zařazeno 231 pacientů, byla hodnota amylázy v séru po 2 hod od výkonu přesnější při klinickém hodnocení pro odlišení PEP od bolesti břicha obecně: hodnoty amylázy v séru nižší než 276 IU/l nebo vyšší než šestinásobek ULN po 2 hod od ERCP vyloučily, resp. předpověděly rozvoj PEP téměř ve 100 % případů [27]. V jiné prospektivní studii s 1 185 provedenými ERCP nebyly sérové hodnoty amylázy 6 hod po ERCP nižší než trojnásobek ULN nikdy spojeny s PEP a hodnoty vyšší než pětinásobek ULN byly spojeny s PEP v 90 % případů [28]. Podobnou predikční hodnotu zvýšených koncentrací sérové amylázy pro PEP na více než pětinásobek ULN po 6 hod od ERCP nedávno popsali Kapetanos et al [29]. Závěry australské studie zdůraznily význam normální nebo pouze mírně zvýšené hodnoty amylázy v séru 4 hod po ERCP pro vyloučení PEP: hodnoty amylázy pod 1,5násobek ULN měly 100% negativní predikční hodnotu a bylo možno je použít jako spolehlivé kritérium pro propuštění pacientů; sérové hodnoty amylázy vyšší než trojnásobek ULN dosáhly 36,8 % pozitivní predikční hodnoty a byly určeny jako kritérium doporučení k hospitalizaci [30]. Pokud je hodnota amylázy mezi 1,5násobkem a trojnásobkem ULN, pak by se další postup měl zvažovat s ohledem na klinický stav a přítomnost dalších faktorů PEP. Ještě nověji zjistili Ito et al, že pokud byly hodnoty sérové amylázy 3 hod po ERCP, došlo k rozvoji PEP pouze u 1 % pacientů oproti 39 % s hodnotami amylázy nad pětinásobek ULN [31].
6. Farmaka pro profylaxi PEP
Většina dostupných údajů ohledně účinnosti farmak v profylaxi PEP byla získána u pacientů s průměrným rizikem PEP. Za těchto okolností mohla nedostatečně prokázanou účinnost příslušné látky způsobit statistická příčina (relativně malý počet rizikových nemocných): lze odhadnout, že v hypotetické RCT, do níž by byli zařazeni nízkorizikoví pacienti podstupující ERCP s nízkým rizikem, by bylo nutno zařadit celkem 2 300 pacientů (při randomizačním poměru 1 : 1), aby se dosáhlo dostatečné statistické síly ke zjištění poklesu rizika ze 4 % na 2 %. Kdyby naopak byli do RCT byli zařazeni pacienti s vysokým rizikem, bylo by podle odhadu nutno zařadit celkem 400 pacientů (při randomizačním poměru 1 : 1), aby se dosáhlo dostatečné statistické síly pro zjištění poklesu rizika z 20 % na 10 %. Takto koncipované studie dosud nebyly provedeny.
Látky s prokázanou účinností
Nesteroidní antirevmatika (NSAR)
- Nesteroidní antirevmatika (NSAID) snižují incidenci PEP; bylo prokázáno, že účinná profylaxe PEP vyžaduje rektální podávání diclofenacu nebo indomethacinu v dávce 100 mg (úroveň důkazů 1++). Doporučuje se rutinně podávat bezprostředně před nebo po ERCP rektálně diclofenac nebo indomethacin v dávce100 mg (stupeň doporučení A).
Byly publikovány tři různé metaanalýzy s údaji získanými ze čtyř prospektivních, randomizovaných, placebem kontrolovaných studií srovnávajících rektálně podávaný diclofenac nebo indomethacin v dávce 100 mg s placebem [32–34]. Mezi studiemi nebyla zjištěna statistická heterogenita. Dvě RCT hodnotily účinek rektálního podání 100 mg diclofenacu bezprostředně po výkonu, druhé dvě hodnotily rektální podávání indomethacinu v dávce 100 mg těsně před výkonem. Obě studie přinesly podobné výsledky; do obou studií byli zařazeni pacienti, u nichž se předpokládalo vysoké riziko PEP. Celkově došlo k rozvoji PEP u 20/456 (4,4 %) pacientů v léčebných skupinách vs 57/456 (12,5 %) pacientů v placebových skupinách se souhrnným relativním rizikem (RR) 0,36 (95% CI 0,22–0,60); počet pacientů, které by bylo nutno léčit (Number Needed to Rreat, NNT) k zabránění jedné epizody PEP, byl 15. Podávání NSAID bylo spojeno s podobným poklesem incidence PEP bez ohledu na výši rizika [34]. V souvislosti s aplikací NSAID nebyly zjištěny žádné nežádoucí příhody.
Potenciálně účinné léky
Glyceryltrinitrát (nitroglycerin)
- Nitroglycerin snižuje incidenci PEP; při transdermální aplikaci však není účinný (úroveň důkazů 1++). Mohou se vyskytnout nežádoucí účinky jako přechodná hypotenze a bolesti hlavy. Rutinní podávání nitroglycerinu v profylaxi PRP se nedoporučuje (stupeň doporučení A).
Vliv nitroglycerinu na incidenci PEP byl hodnocen ve dvou metaanalýzách údajů z pěti RCT, do nichž bylo zahrnuto 1 662 pacientů [35,36]. Studie byly homogenní a obě metaanalýzy prokázaly celkové statisticky významné snížení výskytu PEP s hodnotou RR 0,61 (95% CI 0,44–0,86) a NNT 26. Většině pacientů byl nitroglycerin aplikován transdermálně. Po omezení analýzy na tuto skupinu nemocných se již statisticky významné snížení incidence PEP neprokázalo (RR 0,66; 95% CI 0,43–1,01). Použití nitroglycerinu bylo spojeno s významným rizikem hypotenze a bolestí hlavy.
Ceftazidim
- Ceftazidim snížil incidenci PEP v jediné studii (úroveň důkazů 1–). Dříve než bude možno ceftazidim doporučit pro profylaxi PEP, bude nutno získat další údaje (stupeň doporučení C).
V jediné studii, v níž byl použit ceftazidim v profylaxi PEP, vedla aplikace tohoto antibiotika (2 g intravenózně po dobu 30 min před ERCP) ke statisticky významnému snížení incidence PEP oproti kontrolním jedincům (15/160 (9,4 %) vs 4/155 (2,6 %); p = 0,009) [37]. Tato studie byla z metodologického hlediska nekvalitní (kontrolní skupina nedostávala žádná antibiotika místo aby dostávala placebo).
Somatostatin
- Podle jedné post hoc metaanalýzy výsledků deseti vysoce kvalitních RCT byl somatostatin v prevenci PEP neúčinný (úroveň důkazů 1++). Paušální profylaktické podávání somatostatinu pacientům bez zvýšeného rizika PEP se nedoporučuje (stupeň doporučení A). Somatostatin by snad mohl být účinnější při použití specifických dávkovacích režimů; výsledky analýz podskupin je však nutno interpretovat s rezervou, protože často přehnaně zdůrazňují rozdíly mezi léčebnými skupinami v RCT.
V ad hoc metaanalýze deseti vysoce kvalitních (Jadadovo skóre > 3) studiích [4,38–46] byla incidence PEP 5,1 % (79/1542) ve skupině se somatostatinem vs 7,6 % (115/1507) v placebové skupině. Žádná ze studií nezahrnovala dostatečně velký počet účastníků a údaje mezi studiemi se značně lišily (I2 67,97; p < 0,001). Celkově nevedlo používání somatostatinu ke snížení incidence PEP (OR 0,57; 95% CI 0,32–1,03). Zajímavým zjištěním bylo, že pokud byl výskyt PEP u kontrolních osob při zařazení do studie vyšší než 10 %, byl somatostatin účinný, zatímco při přibližně 5% incidenci již jeho přínos nebyl průkazný. Po vyloučení studií s incidencí PEP nad 10 % v placebové skupině [38–40] klesla incidence PEP v placebové skupině na 6,7 % (88/1322), přičemž ve skupině se somatostatinem činila tato hodnota 4,9 % (57/1 364).
Aplikace somatostatinu ve formě jednorázového injekčního podání bolusu byla hodnocena ve dvou malých studiích; údaje byly statisticky homogenní a v souhrnu prokázaly preventivní efekt; hodnoty incidence PEP dosáhly u kontrolních osob 9,9 % (20/202) vs 2,0 % u léčených pacientů (4/198) (OR 0,19; 95% CI 0,06–0,63) [40, 42]. Hodnota NNT byla 13. Infuze somatostatinu po dobu delší než 12 hodin v rámci profylaxe PEP byla zkoumána ve čtyřech RCT: souhrnná analýza prokázala statisticky významný pokles incidence PEP ze 7,4 % u kontrolních osob (48/648) na 3,2 % (20/632) ve skupině s aktivní léčbou; OR dosáhl statisticky významné hodnoty 0,42 (95% CI 0,22–0,83), ačkoli údaje byly heterogenní (I2 55,98; p < 0,01). Hodnota NNT byla 24. V případě kratší infuze (méně než 6 hodin) nebyla profylaxe somatostatinem účinná.
Octreotid
- Aplikace octreotidu po sloučení údajů z osmi vysoce kvalitních studií hodnotu celkové incidence PEP neovlivnila (úroveň důkazů 1++). Profylaxe octreotidem se nedoporučuje (stupeň doporučení A). V budoucích studiích účinnosti profylaktického použití octreotidu bude třeba hodnotit dávky ≥ 0,5 mg.
Byla provedena ad hoc metaanalýza sloučením údajů z osmi vysoce kvalitních RCT (Jadadovo skóre ≥ 3). Incidence PEP byla 8,3 % (78/945) v placebové skupině vs 6,0 % (56/933) ve skupině s účinnou látkou [47–54]. Údaje z původních studií byly heterogenní (I2 52,39; p = 0,04) a odpovídající hodnota OR (0,73; 95% CI 0,41–1,30) nebyla statisticky významná. Analýza podskupin s aplikací octreotidu buď před ERCP, nebo před a po ERCP prokázala, že ani jeden z těchto režimů není účinný. Zdá se, že účinek octreotidu souvisí s dávkou, protože octreotid nebyl účinný v dávce < 0,5 mg, ale ve vyšších dávkách příznivé účinky vykazoval: u pacientů s aplikací octreotidu v dávce vyšší než 0,5 mg byla incidence PEP 3,7 % (26/706); v kontrolní skupině byla incidence PEP 7,5 % (53/710). Údaje ze studií byly homogenní a odpovídající hodnota OR byla statisticky významná (0,48; 95%CI 0,29–0,79) s NNT 26.
Antiproteázové léky
- Profylaxe gabexátem nebo ulinastatinem incidenci PEP nesnižuje (úroveň důkazů 1++). Pro profylaxi PEP se nedoporučuje ani jeden z těchto léků (stupeň doporučení A).
Přínos gabexátu v prevenci PEP byl hodnocen v šesti vysoce kvalitních RCT [38,39,41,55–57]. Incidence PEP dosáhla 6,3 % (83/1318) u kontrolních osob vs 4,5 % (68/1509) u aktivně léčených pacientů. Údaje z jednotlivých studií byly vysoce heterogenní (I2 64,09; p = 0,016) a souhrnný účinek nedosáhl statistické významnosti (OR 0,65; 95% CI 0,36–1,185). Dávkovací režim gabexát neměl na sledované parametry žádný vliv, protože ani krátkodobá (méně než 6 hod) ani delší infuze (přes 12 hod) neměly pozitivní efekt.
Ulinastatin jako účinná látka pro prevenci PEP byl hodnocen ve čtyřech RCT. Ve dvou studiích byl srovnáván s placebem a ve dvou dalších s gabexátem. Výsledky uvedených studií byly rozporuplné [58–61]. Ve studii s 406 nemocnými [59] byla při aplikaci ulinastatinu incidence PEP statisticky významně nižší (150 000 U aplikovaných před ERCP) než v placebové skupině (2,9 % vs 7,4 %; p = 0,041). Tento přínos však nepotvrdila jiná RCT s 227 pacienty náhodně zařazenými do skupin s aplikací buď ulinastatinu (100 000 U), nebo placeba bezprostředně po ERCP (incidence PEP 6,7 %, resp. 5,6 %; p > 0,05) [61]. Ve dvou japonských klinických studiích byl gabexát srovnáván s ulinastatinem podaným před a po ERCP; výskyt PEP se statisticky významně nelišil (4,3 % vs 7,5 % v jedné studii a 2,9 % vs 2,9 % ve druhé) [58,60].
Průkazně neúčinné látky (tab. 2)
Tab. 2. Přehled studií s látkami, které se prokázaly jako neúčinné v profylaxi PEP. Tab. 2. Long-term outcome after endoscopic treatment of chronic pancreatitis. 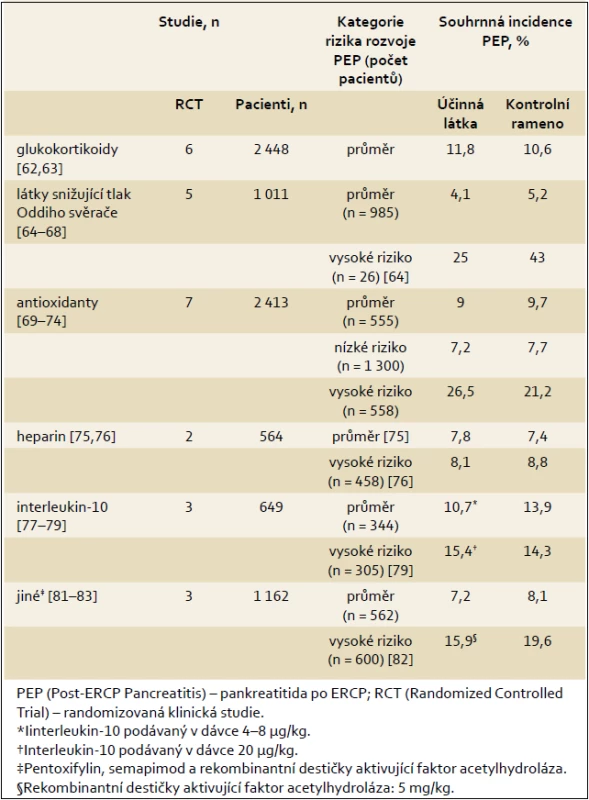
- K dispozici nejsou žádné důkazy, že by glukokortikoidy, látky snižující tonus Oddiho svěrače (kromě nitroglycerinu), antioxidanty, heparin, interleukin-10 nebo jiná antirevmatika (s výjimkou diclofenacu a indomethacinu), pentoxifylin, semapimod a acetylhydroláza-rekombinantní destičky aktivující faktor snižovaly incidenci PEP (úroveň důkazů z 1 – na 1++). Žádná z těchto látek se pro profylaxi PEP nedoporučuje (stupeň doporučení A).
Glukokortikoidy
Účinnost glukokortikoidů v profylaxi PEP hodnotily dvě metaanalýzy s údaji ze šesti RCT [62,63]. Incidence PEP se významně nelišila a dosáhla 11,8 % (144/1 221) ve skupině s podávanými kortikosterdoidy vs 10,6 % (130/1 227) v kontrolní skupině.
Látky snižující tlak Oddiho svěrače (kromě nitroglycerinu)
Jako látky hypoteticky působící profylaxi PEP na základě snižování tlaku Oddiho svěrače byly zkoušeny botulinum toxin [64], epinefrin [65], lidokain [66] a nifedipin [67,68]. Příslušné RCT účinnost těchto látek neprokázaly [64–68].
Antioxidanty
Hodnoceny byly tři antioxidanty: alopurinol, N-acetylcystein a přírodní betakaroten. Tři metaanalýzy výsledků čtyř RCT, do nichž bylo zařazeno 1 730 pacientů, neprokázaly vliv alopurinolu (RR 0,86; 95% CI 0,42–1,77) [69–71]. Přínos N-acetylcysteinu v prevenci rozvoje PEP hodnotily dvě RCT: sloučená hodnota incidence PEP byla ve skupině užívající aktivní látku a v placebové skupině podobná (10,6 %, resp. 10,2 %) [72,73]. Účinek přírodního betakarotenu v prevenci PEP byl hodnocen v jediné studii s celkovým počtem 321 zařazených pacientů a jeho účinnost v prevenci nebyla prokázána [74].
Heparin
Účinnost subkutánně aplikovaného heparinu v profylaxi PEP hodnotily dvě RCT, do nichž bylo zařazeno 564 pacientů [75,76]. Obě studie neměly vzhledem k malému počtu účastníků dostatečnou statistickou průkaznost. Údaje z každé studie samostatně i po jejich sloučení přínos podání této látky nepotvrdily. Za pozornost stojí, že podle všeho heparin – v těchto studiích – pokud byl aplikován ve vybranou/určitou dobu a dávkách, nezvyšoval oproti placebu riziko krvácení po papilosfinkterotomii.
Interleukin-10
Účinnost rekombinantního lidského interleukinu-10 jako látky pro profylaxi PEP byla hodnocena ve třech RCT s celkem 649 zařazenými pacienty [77–79]. V první ze studií [77] interleukin-10 podaný i.v. ve dvou různých dávkách (4 nebo 20 µg/kg – vždy jednou) 30 min před léčebnou ERCP statisticky významně snížil incidenci a závažnost PEP (v placebové skupině z 24,4 % na 10,4 % a 6,8 % u pacientů s nízkou, resp. vysokou dávkou). V této studii byla incidence PEP v placebové skupině vyšší, než by bylo možno očekávat u pacientů s průměrným rizikem. Dvě následující studie přínos interleukinu-10 nepotvrdily [78,80].
Jiná farmaka
U tří různých antirevmatik (pentoxifylin, semapimod a acetylhydroláza-rekombinantní destičky) aktivující faktor hodnocených v RTC se schopnost snížení výskytu PEP neprokázala [81–83].
7. Technika ERCP
Obecné poznámky
- K dispozici nejsou žádné důkazy, že by incidenci PEP ovlivňovala pacientova poloha během ERCP (úroveň důkazů 2++). Proto se pacientovy polohy netýká žádné doporučení.
Ve dvou RCT s celkem 154 pacienty se srovnávala poloha pacientů vleže na zádech a na břiše během ERCP [84,85]. Celková incidence PEP byla 2,6 %, bez statisticky významných rozdílů mezi skupinami.
- Traumatizace papily v důsledku opakovaných pokusů o biliární kanylaci byla zjištěna jako rizikový faktor rozvoje PEP (úroveň důkazů 2++). Počet pokusů o kanylaci je nutno omezit na minimum (stupeň doporučení B).
Riziko rozvoje PEP se po opakovaných pokusech o kanylaci žlučovodů zvyšuje [2,14,86].
- Injekční aplikace kontrastní látky do pankreatického vývodu představuje nezávislý prediktor vzniku PEP (úroveň důkazů 1+). Ať již je aplikace kontrastní látky do pankreatického vývodu nezamýšlená, či úmyslná, je třeba omezit počet aplikací a objem kontrastní látky na minimum (stupeň doporučení B).
Ve velké metaanalýze se zjistilo, že aplikace kontrastní látky do pankreatických vývodů je nezávislým prediktorem PEP (RR 2,2; 95% CI 1,60–3,01; p < 0,001) [10]. V retrospektivní studii zahrnující více než 14 000 ERCP byl s rozvojem PEP nezávisle spojen rozsah aplikace do pankreatického vývodu (aplikace pouze do hlavy vs hlavy a těla vs do ocasu pankreatu) [87], v další prospektivní studii se však o nezávislý rizikový faktor nejednalo [86].
- Ve srovnání s tradičními kontrastními látkami s vysokou osmolalitou jsou kontrastní látky s nízkou osmolalitou sice nákladnější, ale incidenci PEP nesnižují (úroveň důkazů 1–). Rutinní používání těchto látek při ERCP se nedoporučuje (stupeň doporučení B).
Metaanalýza 13 RCT, do nichž bylo zařazeno 3 381 pacientů, nenašla statisticky významné rozdíly ve výskytu PEP mezi použitím kontrastních látek s vysokou a nízkou osmolalitou [88]. Uvedená metaanalýza měla jisté nedostatky včetně nejednotných definic PEP ve studiích a chybějící stratifikaci rizika.
- Použití oxidu uhelnatého (CO2) jako náhražky vzduchu pro insuflaci lumen během ERCP incidenci PEP neovlivňuje, ale snižuje incidenci a intenzitu bolesti břicha po výkonu (úroveň důkazů 1+). Oxid uhelnatý se pro insuflaci doporučuje a mohl by být obzvláště užitečný při ambulantně prováděné ERCP, kdy by snižoval bolest břicha po výkonu způsobenou insuflací a zabránil její záměně s PEP (stupeň doporučení B).
Odstraňování plynů ze střev po endoskopickém vyšetření probíhá při použití oxidu uhelnatého přibližně 160×, resp. 12× rychleji, než je tomu u dusíku a kyslíku, dvou hlavních složek vzduchu, což je důsledkem vyšší rozpustnosti oxidu uhelnatého. Byly publikovány tři RCT s celkem 282 pacienty, v nichž se srovnávala insuflace vzduchem a oxidem uhelnatým při distenzi lumen během ERCP [8,89,90]. Incidence a intenzita bolesti po výkonu byly při použití oxidu uhelnatého statisticky významně nižší po dobu až 2 hod po ERCP. Toto zjištění může napomoci při klinické interpretaci bolestí břicha po výkonu jako PEP.
- Při hluboké biliární kanylaci snižuje technika s primárním použitím vodicího drátu „wire guided“ riziko PEP a zvyšuje úspěšnost primární kanylace oproti standardní technice s primární aplikací kontrastní látky (úroveň důkazů 1++). Pro hlubokou kanylaci se technika s kanylací pomocí drátu doporučuje (stupeň doporučení A).
Při biliární kanylaci technikou s primárním zavedením vodicího drátu se tento zavádí katétrem (nejčastěji se 0,035´´ hydrofilní vodicí drát zavádí do sfinkterotomu). Kanylace se provádí buď zavedením drátu přímo do papily, nebo vhodněji zavedením sfinkterotomu a následně zasunutím vodicího drátu. Ve čtyřech metaanalýzách byly hodnoceny výsledky RCT srovnávajících bezpečnost a účinnost „wire-guided“ vs „standardní kanylace žlučovodu“; výsledky byly nakonec podobné [91–94]. Dvě z těchto metaanalýz byly publikovány in extenso; zahrnovaly 1 762 pacientů z pěti RCT [91] a 2 128 pacientů ze sedmi RCT [94]. Vzhledem ke zkříženému uspořádání dvou RCT, což neumožňovalo připisovat případy PEP jediné technice, byly analýzy omezeny na RCT bez zkříženého uspořádání (tzn. tři, resp. pět studií) [91,94]. V obou metaanalýzách byly OR prevence PEP ve skupině s kanylací technikou „wire-guided“ nižší než ve skupině s kanylací standardní technikou (0,23 (95% CI 0,13–0,41), resp. 0,38 [95% CI 0,19–0,76]) [91,94]. Obě metaanalýzy prokázaly, že další předností „wire-guided“ kanylační techniky je významně vyšší procento primárních kanylací.
- Incidence pankreatitidy po papilosfinkterotomii není ovlivněna typem použitého elektrochirurgického proudu (čistého řezacího nebo smíšeného) (úroveň důkazů 1+). Pro biliární papilosfinkterotomii, zvláště u pacientů s vysokým rizikem krvácení, se doporučuje použití smíšeného proudu (stupeň doporučení A).
Protože čistý řezací proud má menší tendenci k edému tkáně kolem řezu [95], soudilo se, že by snad mohl snížit incidenci PEP. Metaanalýza čtyř RCT se 804 zařazenými pacienty nezjistila žádné významné rozdíly v incidenci PEP mezi čistým řezacím a smíšeným proudem [90]. Incidence krvácení však byla statisticky významně vyšší při použití „pure-cut“ proudem.
Vliv obtížné biliární kanylace
Definice obtížné biliární kanylace je různá. Zahrnuje nemožnost provedení hluboké kanylace potřebného vývodu po 10–15 pokusech nebo po 10 min i 5 pokusů nezamýšlené kanylace vývodu, jehož zobrazení nepožadovala indikace. V takových případech následují další pokusy o kanylaci pomocí standardního příslušenství, alternace ve smyslu pokusu o primární zavedení vodicího drátu sfinkterotomem, provedení „precut“ sfinkterotomie a odesílání pacientů na specializované pracoviště.
Technika umístění vodicího drátu v pankreatu (Pancreatic Guide Wire-assisted Technique)
- Údaje o významu a bezpečnosti zavedení vodicího drátu do pankreatického vývodu k usnadnění následné zamýšlené biliární kanylace v případech obtížné kanylace jsou rozporuplné. Preventivní zavedení pankreatického stentu snižuje výskyt PEP (úroveň důkazů 2+). Technika s pomocí zavedení vodicího drátu do pankreatiku může usnadnit biliární kanylaci v případě nežádoucí opakované kanylace pankreatického vývodu; pokud se použije, je nutno zavést profylakticky pankreatický stent (stupeň doporučení B).
Vodicí drát zavádí do hlavního pankreatického vývodu k usnadnění biliární kanylace narovnáním anatomických struktur papily, aby se předešlo nežádoucí opakované kanylaci pankreatického vývodu. Podmínkou je, aby zavedení do pankreatického vývodu bylo snadné [96]. Ve dvou RCT se tato technika srovnávala s používáním standardní techniky kanylace s různými výsledky [96,97]. V první z těchto RCT se v žádné ze dvou skupin nevyskytl ani jeden případ PEP. V novější RCT byla incidence PEP při použití této techniky vyšší (17 %) než při použití standardní kanylace (8 %), rozdíl však nebyl statisticky významný.
Ito et al náhodně zařadili do dvou skupin 69 pacientů, v jedné byl po umístění vodicího drátu pro biliární kanylaci zaveden 5-Fr pankreatický stent, ve druhé nebyl stent použit: incidence PEP byla ve skupině se stentem nižší než ve skupině bez stentu (2,9 %, resp. 23 %; RR 0,13; 95% CI 0,02–0,97) [98]. Protože preventivní zavedení pankreatického stentu bývá po předchozím zavedení vodicího drátu snadné, jeho použití se důrazně doporučuje [99]. V šesti studiích, vždy zahrnujících přes 20 pacientů s obtížnou biliární kanylací (celkem 408 pacientů), umožnila technika s pankreatickým drátem úspěšnou biliární kanylaci v 73 % případů [96,97,100–103]. Někteří autoři se domnívají, že v případě neúspěšné biliární kanylace by zavedení pankreatického stentu měl následovat precut [102].
Biliární papilosfinkterotomie tzv. precutem
- Byly popsány různé techniky biliárního precutu; technika fistulotomie může být spojena s nižší incidencí PEP než standardní precut jehlovým nožem, rozhodnutí o tom, která technika je ve vztahu k papilární anatomii úspěšnější a bezpečnější, si však vyžádá provedení dalších studií. Nejsou žádné důkazy o tom, že by úspěšnost a komplikace biliárního precutu byly ovlivněny zkušeností endoskopisty s touto technikou, ale publikované údaje uvádějí zkušenosti pouze jednoho endoskopisty (úroveň důkazů 2–). Delší pokusy o kanylaci standardními technikami může vést ke zvýšení rizika nad hodnoty spojené se samotnou precut sfinkterotomií (úroveň důkazů 2+). Precut sfinkterotomii musí provádět endoskopisté se zkušenostmi se standardními technikami kanylace (stupeň doporučení D). Rozhodnutí o provedení precut biliární papilosfinkterotomie, její načasování a výběr techniky vychází z anatomických poměrů, preferencích endoskopisty a indikace k výkonu (stupeň doporučení C).
Ve srovnání se standardní biliární kanylací zvyšuje precut úspěšnost selektivní biliární kanylace, ale i incidenci PEP [2,10,13,104,105]. Zatím však není jasné, zda zvýšení rizika precut techniky souvisí se samotnou technikou precut nebo s dlouhodobou snahou o kanylaci, která ji předchází. Incidence komplikací po precut popsali tři endoskopisté s různým množstvím zkušeností: ve všech studiích byla incidence PEP stabilní přes narůstající zkušenost endoskopistů [106–108]. V jedné z těchto studií byla celková incidence komplikací vyšší na začátku sbírání zkušeností, ale u většiny komplikací se jednalo o mírné krvácení nevyžadující ani krevní transfuze ani opakovanou endoskopii [106]. Výsledná úspěšnost biliární kanylace byla rovněž podobná bez ohledu na šíři zkušeností [106–108].
Ve čtyřech RCT se ověřovala hypotéza, že vysoká incidence PEP uváděná při použití precut souvisí s dlouhou dobou pokusů o kanylaci předcházejících samotnému výkonu precut spíše než se samotnou technikou [104,109–111]. Pacienti byli náhodně zařazeni do skupiny s časným nebo s jinak provedeným výkonem precut nebo do skupiny s provedením precut výkonu po delších pokusech o kanylaci standardními technikami jako prvním způsobem biliární kanylace (jedna RCT) nebo pouze do skupiny s provedením precut pouze po neúspěšných pokusech pomocí standardních technik trvajících 5–12 min (tři RCT). Kromě definice časného provedení precut existovaly rozdíly mezi studiemi i v technice precut a randomizačním poměru (od 1 : 1 po 1 : 3). Všechny výkony prováděli endoskopisté se zkušenostmi s precut technikami. Celková incidence PEP byla u pacientů náhodně zařazených do skupiny s časným precut výkonem nižší než při setrvání u standardních technik (2,8 % (8/290) vs 6,4 % (23/360); p = 0,04).
Specifické techniky léčby
Balonková dilatace biliárního svěrače (EPBD, balonková sfinkteroplastika)
- Ve srovnání s endoskopickou sfinkterotomií je EPBD s použitím balonků o malém průměru (≤ 10 mm) spojena se statisticky vyšší incidencí PEP a významně nižším výskytem krvácení (úroveň důkazů 1++). EPBD se nedoporučuje jako alternativa sfinkterotomie při rutinní ERCP, ale může být užitečná u pacientů s koagulopatií a změněnými anatomickými poměry (např. Billroth II) (stupeň doporučení A). Pokud se balonková dilatace provádí u mladých pacientů, je třeba důkladně zvážit možnost profylaktického zavedení pankreatického stentu (úroveň důkazů 4, stupeň doporučení D).
Možnou výhodou EPBD ve srovnání s endoskopickou sfinkterotomií je nižší výskyt klinicky významného krvácení u pacientů s koagulopatií při zachování funkce Oddiho svěrače u mladších pacientů [112] a odstranění konkrementů ze žlučovodů u pacientů se změněnými anatomickými poměry (Billroth II), kdy je sfinkterotomie technicky náročná. Ve dvou metaanalýzách vedlo provedení EPBD k nižší úspěšnosti než endoskopická sfinkterotomie při iniciálním odstraňování biliárních konkrementů při významně vyšší incidenci PEP a významně nižší incidenci krvácení [113,114]. Objevily se obavy z rizika závažných život ohrožujících PEP u mladých pacientů EPBD, a to na základě výsledků americké multicentrické RCT s významně vyššími hodnotami závažné morbidity (p = 0,004) včetně těžké PEP (p = 0,01) po EPDB ve srovnání s papilosfinkterotomií [115]. Uvedená studie však byla provedena před zavedením pankreatických stentů v profylaxi PEP. U pacientů – zvláště mladších – indikovaných k EPBD je třeba důkladně zvážit možnost profylaktického zavedení pankreatického stentu.
- Potenciální přednosti provedení dilatace s velkým balonkem navíc k endoskopické sfinkterotomii k odstranění obtížných biliární konkrementů zatím nebyly přesně definovány (úroveň důkazů 3). Nezdá se, že by endoskopická sfinkterotomie spolu s dilatací velkým balonkem zvyšovala riziko rozvoje PEP a s její pomocí se lze vyhnout mechanické litotripsii u vybraných pacientů. Zatím však není k dispozici dostatek údajů, aby bylo možno doporučit rutinní používání sfinkterotomie s následnou dilatací proti sfinktrerotomii s mechanickou litotripsií (stupeň doporučení D).
Byly publikovány výsledky několika malých skupin pacientů (case series), kdy byla použita modifikovaná technika pro extrakci velkých nebo obtížně odstranitelných konkrementů společného žlučovodu, která spočívá v provedení endoskopické sfinkterotomie s následnou dilatací balonkem o velkém průměru (12–20 mm) [116–120]. Většina těchto malých skupin pacientů zahrnuje jedince, u nichž byla extrakce biliárních konkrementů pomocí standardních technik s košíčkem/balonkem neúspěšná. Po sfinkterotomii a dilataci velkým balonkem byla úspěšnost extrakce konkrementu bez nutnosti mechanické litotripsie vysoká. Nezdá se, že by incidence PEP byla zvýšená ve srovnání se samotnou endoskopickou sfinkterotomií, možná proto, že tlak balonku působí ve směru biliární sfinkterotomie od otvoru pankreatického vývodu. Zatím však pouze jediná RCT zjistila při srovnání samotné endoskopické sfinkterotomie a endoskopické sfinkterotomie v kombinaci s dilatací velkým balonkem rozdíly v úspěšnosti odstranění konkrementů, potřeby mechanické litotripsie a výskytu komplikací [121]. Dilatace velkým balonkem v kombinaci s endoskopickou sfinkterotomií může být užitečná u pacientů se zmenšujícím se průměrem žlučovodu distálně nebo se změněnými anatomickými poměry (např. Billroth II), které omezují rozsah biliární sfinkterotomie.
Manometrie Oddiho svěrače
- U pacientů podstupujících manometrii pankreatického Oddiho svěrače se prokázalo, že použití standardního perfuzního katétru bez otvoru pro odsávání zvyšuje riziko PEP více než použití modifikovaných katétrů pro perfuzi vodou (úroveň důkazů 2++). Manometrii pankreatického Oddiho svěrače je nutno provádět s modifikovaným trojcestným perfuzním katétrem a se simultánní aspirací nebo s katétrem s mikropřevaděčem (bez perfuze vodou); (stupeň doporučení B).
Ve snaze o snížení rizika PEP z hydrostatického poškození v souvislostí s perfuzí byly vyvinuty modifikované perfuzní katétry. Sem patří modifkované trojcestné katétry, které umožňují odsávání perfundované tekutiny z pankreatu, kdy se provádí reverzní perfuze tekutiny tak, aby tekutina vtékala do duodena a nikoli do pankreatického vývodu, a dále katétr s mikropřevaděčem využívajícím technologii tuhého skupenství [122–125]. Mezi oběma instrumenty je vynikající korelace výsledků měření [122,126]. Byly provedeny tři RCT srovnávající incidenci PEP po použití standardního perfuzního katétru a jiných katétrů; dvě z těchto studií zjistily významně nižší incidenci PEP při použití jiného katétru oproti standardnímu perfuznímu katétru (3,0 % vs 23,5 %; p = 0,01 a 3,1 % vs 13,8 %; p < 0,05); ve třetí RCT k výskytu PEP nedošlo [125,127,128].
8. Úloha umístění pankreatického stentu v profylaxi PEP
- Profylaktické umístění pankreatického stentu se doporučuje v prevenci PEP u pacientů s vysokým rizikem rozvoje PEP. V současnosti se doporučuje použití krátkých plastových 5-Fr pankreatických stentů. Odchod stentu z pankreatického vývodu je nutno zkontrolovat během 5–10 dnů od umístění a neuvolněné stenty je nutno neprodleně endoskopicky odstranit (úroveň důkazů 1+; stupeň doporučení A).
Dvě metaanalýzy zkoumající význam umístění pankreatických stentů v profylaxi PEP u pacientů s vysokým rizikem rozvoje PEP prokázaly, že umístění stentu incidenci PEP významně snižuje [20,129]. Nejnovější metaanalýza byla nejspolehlivější, protože – kromě analýzy šesti prospektivních kontrolovaných studií – přinesla samostatnou analýzu čtyř dostupných RCT a použila principů „intention-to-treat” (předpokladu, že u pacientů, u nichž byly pokusy o profylaktické umístění pankreatických stentů neúspěšné, skutečně k rozvoji PEP došlo, pokud nebyl v původní studii uveden klinický výsledek) [20,129]. Při použití tohoto přístupu činila hodnota OR pro PEP 0,44 ve skupině se stenty vs skupina beze stentů (95 % CI 0,24–0,81; p = 0,009), při absolutním snížení rizika o 12,0 % (95 % CI 3,0–21,0). Následně byla publikována velká multicentrická RCT (201 pacientů), která prokázala sníženou incidenci PEP po profylaktickém umístění pankreatického stentu, a to bez ohledu na přítomnost, nebo nepřítomnost rizikových faktorů PEP (incidence PEP ve skupinách se stentem a bez stentu byla 3,2 %, resp. 13,6 %; p = 0,019) [130]. Z těchto studií rovněž jednoznačně vyplývá, že riziko těžké pankreatitidy po úspěšném profylaktickém umístění pankreatického stentu téměř úplně vymizí.
Používají se různé typy plastových stentů. I když se v prvních studiích používaly nazopankreatické katétry, ve většině novějších studií byly použity pankreatické stenty velikosti 3–5-Fr. Ve dvou nedávno provedených RCT srovnávajících stenty velikostí 5-Fr a 3-Fr se prokázalo, že 5-Fr stenty jsou téměř rovnocenné 3-Fr stentům ve většině sledovaných parametrů, ale 5-Fr stenty byly úspěšně zavedeny statisticky významně častěji [131,132]. Často se používají rovné polyetylénové stenty o průměru 5-Fr a délce 2 nebo 3 cm bez vnitřních lemů a s jedním nebo dvěma vnějšími lemy (směrem k duodenu). Při použití tohoto typu stentu došlo ke spontánní migraci do střevního lumen dva týdny po ERCP u více než 95 % ze 200 pacientů [130,131]. Bez spontánní migrace z pankreatického vývodu během 5–10 dnů po ERCP (potvrzeného běžným rentgenovým vyšetřením břicha) se vzhledem ke zvýšenému riziku PEP a možnosti poškození pankreatického vývodu stentem doporučuje urychlené endoskopické odstranění stentu (RR 5,2 u pacientů bez spontánní migrace stentu vs se spontánním odchodem) [131,133].
Preventivní umístění pankreatického stentu je z hlediska poměru nákladů a účinku vhodné u pacientů s vysokým rizikem PEP, ne však u jedinců s průměrným rizikem [134]. Při pokusech o profylaktické umístění pankreatického stentu je třeba opatrnosti, protože incidence PEP po neúspěšných pokusech může dosáhnout hodnoty až 65 % [135]. Profylaktické umístění pankreatických stentů u vysoce rizikových pacientů je proto z hlediska poměru nákladů a účinku vhodné pouze v případě úspěšnosti vyšší než 75 %.
Průzkumy lékařské praxe prokázaly, že američtí a kanadští endoskopisté se zkušenostmi s výkony v pankreatikobiliární oblasti běžně pankreaticky stenty profylakticky zavádějí, zatímco u většiny evropských endoskopistů tomu tak není [136,137]. V současnosti nejnovější průzkumy prokázaly že: (i) endoskopisté, kteří neprováděli profylaktické zavádění pankreatických stentů, uváděli jako důvod nedostatek zkušeností s touto technikou a (ii) hodnocení incidence PEP a ročního počtu více než 500 ERCP provedených za rok bylo nezávisle spojeno s profylaktickým umístěním pankreatických stentů [137].
9. Výběr opatření v profylaxi PEP
- V případě ERCP s nízkým rizikem se doporučuje periprocedurální aplikace nesteroidních antirevmatik. V případě ERCP s vysokým rizikem je nutno důkladně zvážit možnost profylaktického umístění pankreatického stentu (úroveň důkazů 1+; stupeň doporučení A).
V kontextu ERCP je nutno mít na paměti, že s vysokým rizikem rozvoje PEP jsou spojeny následující výkony a stavy: endoskopická ampulektomie (papilektomie), prokázaná SOD nebo podezření na ni, pankreatická sfinkterotomie, precut biliární sfinkterotomie, biliární kanylace „guide wire-assisted“ technikou, endoskopická balonková sfinkteroplastika a přítomnost více než dvou rizikových faktorů uvedených v tab. 1. Výkony a onemocnění, které nejsou uvedeny výše, jsou považovány za situace a stavy představující nízké riziko rozvoje PEP.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 7. 1. 2010
Přijato: 15. 3. 2010
J.-M. Dumonceau, MD, PhD.
Division of Gastroenterology and Hepatology
Geneva University Hospitals
rue Micheli-du-Crest 24
1205 Geneva, Switzerland
jmdumonceau@hotmail.com
Zdroje
1. Harbour R, Miller J. A new system for grading recommendations in evidence based guidelines. BMJ 2001; 323(7308): 334–336.
2. Freeman ML, Nelson DB, Sherman S et al. Complications of endoscopic biliary sphincterotomy. N Engl J Med 1996; 335(13): 909–918.
3. Choi CW, Kang DH, Kim GH et al. Nafamostat mesylate in the prevention of post-ERCP pancreatitis and risk factors for post-ERCP pancreatitis. Gastrointest Endosc 2009; 69(4): e11–e18.
4. Lee KT, Lee DH, Yoo BM. The prophylactic effect of somatostatin on post-therapeutic endoscopic retrograde cholangiopancreatography pancreatitis. Pancreas 2008; 37(4): 445–448.
5. Cotton PB, Lehman G, Vennes J et al. Endoscopic sphincterotomy complications and their management: an attempt at consensus. Gastrointest Endosc 1991; 37(3): 383–393.
6. Bradley EL. A clinically based classification system for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta, GA, September 11 through 13, 1992. Arch Surg 1993; 128(5): 586–590.
7. Testoni PA, Caporuscio S, Bagnolo F, Lella F. Twenty-four-hour serum amylase predicting pancreatic reaction after endoscopic sphincterotomy. Endoscopy 1999; 31(2): 131–136.
8. Bretthauer M, Seip B, Aasen S et al. Carbon dioxide insufflation for more comfortable endoscopic retrograde cholangiopancreatography: a randomized, controlled, double-blind trial. Endoscopy 2007; 39(1): 58–64.
9. Andriulli A, Loperfido S, Napolitano G et al. Incidence rates of post-ERCP complications: a systematic survey of prospective studies. Am J Gastroenterol 2007; 102(8): 1781–1788.
10. Masci E, Mariani A, Curioni S et al. Risk factors for pancreatitis following endoscopic retrograde cholangiopancreatography: a metaanalysis. Endoscopy 2003; 35(10): 830–834.
11. Freeman ML, DiSario JA, Nelson DB et al. Risk factors for post-ERCP pancreatitis: a prospective, multicenter study. Gastrointest Endosc 2001; 54(4): 425–434.
12. Loperfido S, Angelini G, Benedetti G et al. Major early complications from diagnostic and therapeutic ERCP: a prospective multicenter study. Gastrointest Endosc 1998; 48(1): 1–10.
13. Masci E, Toti G, Mariani A et al. Complications of diagnostic and therapeutic ERCP: a prospective multicenter study. Am J Gastroenterol 2001; 96(2): 417–423.
14. Williams EJ, Taylor S, Fairclough P et al. Risk factors for complication following ERCP; results of a large-scale, prospective multicenter study. Endoscopy 2007; 39(9): 793–801.
15. Harewood GC, Pochron NL, Gostout CJ. Prospective, randomized, controlled trial of prophylactic pancreatic stent placement for endoscopic snare excision of the duodenal ampulla. Gastrointest Endosc 2005; 62(3): 367–370.
16. Norton ID, Gostout CJ, Baron TH et al. Safety and outcome of endoscopic snare excision of the major duodenal papilla. Gastrointest Endosc 2002; 56(2): 239–243.
17. Fazel A, Quadri A, Catalano MF, Meyerson SM, Geenen JE. Does a pancreatic duct stent prevent post-ERCP pancreatitis? A prospective randomized study. Gastrointest Endosc 2003; 57(3): 291–294.
18. Smithline A, Silverman W, Rogers D et al. Effect of prophylactic main pancreatic duct stenting on the incidence of biliary endoscopic sphincterotomy-induced pancreatitis in high-risk patients. Gastrointest Endosc 1993; 39(5): 652–657.
19. Tarnasky PR, Palesch YY, Cunningham JT et al. Pancreatic stenting prevents pancreatitis after biliary sphincterotomy in patients with sphincter of Oddi dysfunction. Gastroenterology 1998; 115(6): 1518–1524.
20. Andriulli A, Forlano R, Napolitano G et al. Pancreatic duct stents in the prophylaxis of pancreatic damage after endoscopic retrograde cholangiopancreatography: a systematic analysis of benefits and associated risks. Digestion 2007; 75(2–3): 156–163.
21. Williams EJ, Taylor S, Fairclough P et al. Are we meeting the standards set for endoscopy? Results of a large-scale prospective survey of endoscopic retrograde cholangio-pancreatograph practice. Gut 2007; 56(6): 821–829.
22. Varadarajulu S, Kilgore ML, Wilcox CM et al. Relationship among hospital ERCP volume, length of stay, and technical outcomes. Gastrointest Endosc 2006; 64(3): 338–347.
23. Allison MC, Ramanaden DN, Fouweather MG et al. Provision of ERCP services and training in the United Kingdom. Endoscopy 2000; 32(9): 693–699.
24. Hilsden RJ, Romagnuolo J, May GR. Patterns of use of endoscopic retrograde cholangiopancreatography in a Canadian province. Can J Gastroenterol 2004; 18(10): 619–624.
25. Colton J, Curran C. Quality indicators, including complications, of ERCP in a community setting: a prospective study. Gastrointest Endosc 2009; 70(3): 457–467.
26. Rabenstein T, Roggenbuck S, Framke B et al. Complications of endoscopic sphincterotomy: can heparin prevent acute pancreatitis after ERCP? Gastrointest Endosc 2002; 55(4): 476–483.
27. Gottlieb K, Sherman S, Pezzi J, Esber E, Lehman GA. Early recognition of post-ERCP pancreatitis by clinical assessment and serum pancreatic enzymes. Am J Gastroenterol 1996; 91(8): 1553–1557.
28. Testoni PA, Bagnolo F. Pain at 24 hours associated with amylase levels greater than 5 times the upper normal limit as the most reliable indicator of post-ERCP pancreatitis. Gastrointest Endosc 2001; 53(1): 33–39.
29. Kapetanos D, Kokozidis G, Kinigopoulou P et al. The value of serum amylase and elastase measurements in the prediction of post-ERCP acute pancreatitis. Hepatogastroenterology 2007; 54(4): 556–560.
30. Thomas PR, Sengupta S. Prediction of pancreatitis following endoscopic retrograde cholangiopancreatography by the 4-h post procedure amylase level. J Gastroenterol Hepatol 2001; 16(8): 923–926.
31. Ito K, Fujita N, Noda Y et al. Relationship between post-ERCP pancreatitis and the change of serum amylase level after the procedure. World J Gastroenterol 2007; 13(28): 3855–3860.
32. Dai H-F, Wang X-W, Zhao K. Role of nonsteroidal anti-inflammatory drugs in the prevention of post-ERCP pancreatitis: a meta-analysis. Hepatobiliary Pancreat Dis Int 2009; 8(1): 11–16.
33. Elmunzer B, Waljee A, Elta G et al. A meta-analysis of rectal NSAIDs in the prevention of post-ERCP pancreatitis. Gut 2008; 57(9): 1262.
34. Zheng M-H, Xia H, Chen Y-P. Rectal administration of NSAIDs in the prevention of post-ERCP pancreatitis: a complementary meta-analysis. Gut 2008; 57(11): 1632.
35. Bang UC, Nojgaard C, Andersen PK, Matzen P. Meta-analysis: Nitroglycerin for prevention of post-ERCP pancreatitis. Aliment Pharmacol Ther 2009; 29(10): 1078–1085.
36. Shao LM, Chen QY, Chen MY, Cai JT. Nitroglycerin in the prevention of post-ERCP pancreatitis: a meta-analysis. Dig Dis Sci 2010; 55(1): 1–7.
37. Raty S, Sand J, Pulkkinen M, Matikainen M, Nordback I. Post-ERCP pancreatitis: reduction by routine antibiotics. J Gastrointest Surg 2001; 5(4): 339–345.
38. Andriulli A, Clemente R, Solmi L et al. Gabexate or somatostatin administration before ERCP in patients at high risk for post-ERCP pancreatitis: a multicenter, placebo-controlled, randomized clinical trial. Gastrointest Endosc 2002; 56(4): 488–495.
39. Andriulli A, Solmi L, Loperfido S et al. Prophylaxis of ERCP-related pancreatitis: a randomized, controlled trial of somatostatin and gabexate mesylate. Clin Gastroenterol Hepatol 2004; 2(8): 713–718.
40. Arvanitidis D, Anagnostopoulos GK, Giannopoulos D et al. Can somatostatin prevent post-ERCP pancreatitis? Results of a randomized controlled trial. J Gastroenterol Hepatol 2004; 19(3): 278–282.
41. Benvenutti S, Zancanella L, Piazzi L et al. Prevention of post-ERCP pancreatitis with somatostatin versus gabexate mesylate: A randomized placebo controlled multicenter study. Dig Liv Dis 2006; 38: S15.
42. Bordas JM, Toledo-Pimentel V, Llach J et al. Effects of bolus somatostatin in preventing pancreatitis after endoscopic pancreatography: results of a randomized study. Gastrointest Endosc 1998; 47(3): 230–234.
43. Persson B, Slezak P, Efendic S et al. Can somatostatin prevent injection pancreatitis after ERCP? Hepatogastroenterology 1992; 39(3): 259–261.
44. Poon RT, Yeung C, Liu CL et al. Intravenous bolus somatostatin after diagnostic cholangiopancreatography reduces the incidence of pancreatitis associated with therapeutic endoscopic retrograde cholangiopancreatography procedures: a randomised controlled trial. Gut 2003; 52(12): 1768–1773.
45. Poon RT, Yeung C, Lo CM et al. Prophylactic effect of somatostatin on post-ERCP pancreatitis: a randomized controlled trial. Gastrointest Endosc 1999; 49(5): 593–598.
46. Saari A, Kivilaakso E, Schroder T. The influence of somatostatin on pancreatic irritation after pancreatography. An experimental and clinical study. Surg Res Comm 1988; 2 : 271–278.
47. Arcidiacono R, Gambitta P, Rossi A et al. The use of a long-acting somatostatin analogue (octreotide) for prophylaxis of acute pancreatitis after endoscopic sphincterotomy. Endoscopy 1994; 26(9): 715–718.
48. Duvnjak M, Supanc V, Simicevic VN et al. Use of octreotide-acetate in preventing pancreatitis-like changes following therapeutic endoscopic retrograde cholangiopancreatography. Acta Med Croatica 1999; 53(3): 115–118.
49. Hardt PD, Kress O, Fadgyas T et al. Octreotide in the prevention of pancreatic damage induced by endoscopic sphincterotomy. Eur J Med Res 2000; 5(4): 165–170.
50. Li ZS, Pan X, Zhang WJ et al. Effect of octreotide administration in the prophylaxis of post-ERCP pancreatitis and hyperamylasemia: A multicenter, placebo-controlled, randomized clinical trial. Am J Gastroenterol 2007; 102(1): 46–51.
51. Manolakopoulos S, Avgerinos A, Vlachogiannakos J et al. Octreotide versus hydrocortisone versus placebo in the prevention of post-ERCP pancreatitis: a multicenter randomized controlled trial. Gastrointest Endosc 2002; 55(4): 470–475.
52. Sternlieb JM, Aronchick CA, Retig JN et al. A multicenter, randomized, controlled trial to evaluate the effect of prophylactic octreotide on ERCP-induced pancreatitis. Am J Gastroenterol 1992; 87(11): 1561–1566.
53. Testoni PA, Bagnolo F, Andriulli A et al. Octreotide 24-h prophylaxis in patients at high risk for post-ERCP pancreatitis: results of a multicenter, randomized, controlled trial. Aliment Pharmacol Ther 2001; 15(7): 965–972.
54. Thomopoulos KC, Pagoni NA, Vagenas KA et al. Twenty-four hour prophylaxis with increased dosage of octreotide reduces the incidence of post-ERCP pancreatitis. Gastrointest Endosc 2006; 64(5): 726–731.
55. Cavallini G, Tittobello A, Frulloni L et al. Gabexate for the prevention of pancreatic damage related to endoscopic retrograde cholangiopancreatography. Gabexate in digestive endoscopy – Italian Group. N Engl J Med 1996; 335(13): 919–923.
56. Manes G, Ardizzone S, Lombardi G et al. Efficacy of postprocedure administration of gabexate mesylate in the prevention of post-ERCP pancreatitis: a randomized, controlled, multicenter study. Gastrointest Endosc 2007; 65(7): 982–987.
57. Xiong GS, Wu SM, Zhang XW et al. Clinical trial of gabexate in the prophylaxis of post-endoscopic retrograde cholangiopancreatography pancreatitis. Braz J Med Biol Res 2006; 39(1): 85–90.
58. Fujishiro H, Adachi K, Imaoka T et al. Ulinastatin shows preventive effect on post-endoscopic retrograde cholangiopancreatography pancreatitis in a multicenter prospective randomized study. J Gastroenterol Hepatol 2006; 21 : 1065–1069.
59. Tsujino T, Komatsu Y, Isayama H et al. Ulinastatin for pancreatitis after endoscopic retrograde cholangiopancreatography: a randomized, controlled trial. Clin Gastroenterol Hepatol 2005; 3(4): 376–383.
60. Ueki T, Otani K, Kawamoto K et al. Comparison between ulinastatin and gabexate mesylate for the prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis: a prospective, randomized trial. J Gastroenterol 2007; 42: 161–167.
61. Yoo JW, Ryu JK, Lee SH et al. Preventive effects of ulinastatin on post-endoscopic retrograde cholangiopancreatography pancreatitis in highrisk patients: a prospective, randomized, placebo-controlled trial. Pancreas 2008; 37(4): 366–370.
62. Bai Y, Gao J, Shi X et al. Prophylactic corticosteroids do not prevent post-ERCP pancreatitis: a meta-analysis of randomized controlled trials. Pancreatology 2008; 8(4–5): 504–509.
63. Zheng M, Bai J, Yuan B et al. Meta-analysis of prophylactic corticosteroid use in post-ERCP pancreatitis. BMC Gastroenterol 2008; 8 : 6.
64. Gorelick A, Barnett J, Chey W et al. Botulinum toxin injection after biliary sphincterotomy. Endoscopy 2004; 36(2): 170–173.
65. Matsushita M, Takakuwa H, Shimeno N et al. Epinephrine sprayed on the papilla for prevention of post-ERCP pancreatitis. J Gastroenterol 2009; 44(1): 71–75.
66. Schwartz JJ, Lew RJ, Ahmad NA et al. The effect of lidocaine sprayed on the major duodenal papilla on the frequency of post-ERCP pancreatitis. Gastrointest Endosc 2004; 59(2): 179–184.
67. Prat F, Amaris J, Ducot B et al. Nifedipine for prevention of post-ERCP pancreatitis: a prospective, double-blind randomized study. Gastrointest Endosc 2002; 56(2): 202–208.
68. Sand J, Nordback I. Prospective randomized trial of the effect of nifedipine on pancreatic irritation after endoscopic retrograde cholangiopancreatography. Digestion 1993; 54(2): 105–111.
69. Bai Y, Gao J, Zhang W et al. Meta-analysis: allopurinol in the prevention of postendoscopic retrograde cholangiopancreatography pancreatitis. Aliment Pharmacol Ther 2008; 28(5): 557–564.
70. Zheng M, Chen Y, Bai J et al. Meta-analysis of prophylactic allopurinol use in post-endoscopic retrograde cholangiopancreatography pancreatitis. Pancreas 2008; 37(3): 247–253.
71. Andriulli A, Annese V. Risk of post-endoscopic retrograde cholangiopancreatography pancreatitis and ways to prevent it: old myths, a current need? The case of allopurinol. Clin Gastroenterol Hepatol 2008; 6(4): 374–376.
72. Katsinelos P, Kountouras J, Paroutoglou G et al. Intravenous N-acetylcysteine does not prevent post-ERCP pancreatitis. Gastrointest Endosc 2005; 62(1): 105–111.
73. Milewski J, Rydzewska G, Degowska M et al. Nacetylcysteine does not prevent post-endoscopic retrograde cholangiopancreatography hyperamylasemia and acute pancreatitis. World J Gastroenterol 2006; 12(23): 3751–3755.
74. Lavy A, Karban A, Suissa A et al. Natural beta-carotene for the prevention of post-ERCP pancreatitis. Pancreas 2004; 29(2): e45–e50.
75. Barkay O, Niv E, Santo E et al. Low-dose heparin for the prevention of post-ERCP pancreatitis: a randomized placebo-controlled trial. Surg Endosc 2008; 22(9): 1971–1976.
76. Rabenstein T, Fischer B, Wiessner V et al. Low-molecular-weight heparin does not prevent acute post-ERCP pancreatitis. Gastrointest Endosc 2004; 59(6): 606–613.
77. Deviere J, Le Moine O, Van Laethem JL et al. Interleukin 10 reduces the incidence of pancreatitis after therapeutic endoscopic retrograde cholangiopancreatography. Gastroenterology 2001; 120(2): 498–505.
78. Dumot JA, Conwell DL, Zuccaro G Jr. et al. A randomized, double blind study of interleukin 10 for the prevention of ERCP-induced pancreatitis. Am J Gastroenterol 2001; 96(7): 2098–2102.
79. Sherman S, Cheng CL, Costamagna G et al. Efficacy of recombinant human interleukin-10 in prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis in subjects with increased risk. Pancreas 2009; 38(3): 267–274.
80. Sherman S, Cheng C-L, Costamagna G et al. Efficacy of recombinant human interleukin-10 in prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis in subjects with increased risk. Pancreas 2009; 38(3): 267–274.
81. Kapetanos D, Kokozidis G, Christodoulou D et al. A randomized controlled trial of pentoxifylline for the prevention of post-ERCP pancreatitis. Gastrointest Endosc 2007; 66(3): 513–518.
82. Sherman S, Alazmi WM, Lehman GA et al. Evaluation of recombinant platelet-activating factor acetylhydrolase for reducing the incidence and severity of post-ERCP acute pancreatitis. Gastrointest Endosc 2009; 69 (3 Pt 1): 462–472.
83. van Westerloo DJ, Rauws EA, Hommes D et al. Pre-ERCP infusion of semapimod, a mitogen-activated protein kinases inhibitor, lowers post-ERCP hyperamylasemia but not pancreatitis incidence. Gastrointest Endosc 2008; 68(2): 246–254.
84. Terruzzi V, Radaelli F, Meucci G et al. Is the supine position as safe and effective as the prone position for endoscopic retrograde cholangiopancreatography? A prospective randomized study. Endoscopy 2005; 37(12): 1211–1214.
85. Tringali A, Mutignani M, Milano A et al. No difference between supine and prone position for ERCP in conscious sedated patients: a prospective randomized study. Endoscopy 2008; 40(2): 93–97.
86. Vandervoort J, Soetikno RM, Tham TCK et al. Risk factors for complications after performance of ERCP. Gastrointest Endosc 2002; 56(5): 652–656.
87. Cheon YK, Cho KB, Watkins JL et al. Frequency and severity of post-ERCP pancreatitis correlated with extent of pancreatic ductal opacification. Gastrointest Endosc 2007; 65(3): 385–393.
88. George S, Kulkarni AA, Stevens G et al. Role of osmolality of contrast media in the development of post-ERCP pancreatitis: a meta-analysis. Dig Dis Sci 2004; 49(3): 503–508.
89. Keswani R, Hovis R, Edmunowicz S et al. Carbon dioxide (CO2) insufflation during ERCP for the reduction of post-procedure pain: preliminary results of a randomized, double-blind controlled trial. Gastrointest Endosc 2008; 67: AB107.
90. Maple JT, Keswani RN, Hovis RM et al. Carbon dioxide insufflation during ERCP for reduction of postprocedure pain: a randomized, doubleblind, controlled trial. Gastrointest Endosc 2009; 70(2): 278–283.
91. Cennamo V, Fuccio L, Zagari RM et al. Can a wire-guided cannulation technique increase bile duct cannulation rate and prevent post-ERCP pancreatitis?: A meta-analysis of randomized controlled trials. Am J Gastroenterol 2009; 104(9): 2343–2350.
92. Choudhary A, Puli S, Ibdah J et al. Guidewire use for prevention of post ERCP pancreatitis: a meta-analysis of randomized controlled trials. Gastrointest Endosc 2009; 69: AB305.
93. Madhoun M, Te C, Stoner J et al. Does wire-guided cannulation prevent post-ERCP pancreatitis? A meta-analysis. Gastrointest Endosc 2009; 69: AB132.
94. Cheung J, Tsoi KK, Quan W-L et al. Guidewire versus conventional contrast cannulation of the common bile duct for the prevention of post-ERCP pancreatitis: a systematic review and meta-analysis. Gastrointest Endosc 2009; 70(6): 1211–1219.
95. Verma D, Kapadia A, Adler DG. Pure versus mixed electrosurgical current for endoscopic biliary sphincterotomy: a meta-analysis of adverse outcomes. Gastrointest Endosc 2007; 66(2): 283–290.
96. Herreros de Tejada A, Calleja JL, Díaz G et al. Double-guidewire technique for difficult bile duct cannulation: a multicenter randomized, controlled trial. Gastrointest Endosc 2009; 70(4): 700–709.
97. Maeda S, Hayashi H, Hosokawa O et al. Prospective randomized pilot trial of selective biliary cannulation using pancreatic guide-wire placement. Endoscopy 2003; 35(9): 721–724.
98. Ito K, Fujita N, Noda Y et al. Can pancreatic duct stenting prevent post-ERCP pancreatitis in patients who undergo pancreatic guidewire placement for achieving selective biliary cannulation? A prospective randomized controlled trial. Endoscopy 2008; 40 (Suppl 1): A17.
99. Nguyen-Tang T, Dumonceau JM. Double-guidewire technique for difficult bile duct cannulation: why not insert a prophylactic pancreatic stent? Gastrointest Endosc 2010; 72(2): 466.
100. Iqbal S, Sharma P, Shah S. Role of double guide wire cannulation during ERCP. Gastrointest Endosc 2008; 67: AB158.
101. Ito K, Fujita N, Noda Y et al. Pancreatic guidewire placement for achieving selective biliary cannulation during endoscopic retrograde cholangio-pancreatography. World J Gastroenterol 2008; 14(36): 5595–5600.
102. Patel S, Torres V, Gross G. The early use of the double-wire technique to facilitate difficult biliary cannulation and its impact on post-ERCP pancreatitis. Gastrointest Endosc 2009; 69: AB159.
103. Gyökeres T, Duhl J, Varsányi M et al. Double guide wire placement for endoscopic pancreaticobiliary procedures. Endoscopy 2003; 35(1): 95–96.
104. Cennamo V, Fuccio L, Repici A et al. Timing of precut procedure does not influence success rate and complications of ERCP procedure: a prospective randomized comparative study. Gastrointest Endosc 2009; 69 (3 Pt 1): 473–479.
105. Wang P, Li Z-S, Liu F et al. Risk factors for ERCP-related complications: a prospective multicenter study. Am J Gastroenterol 2009; 104(1): 31–40.
106. Akaraviputh T, Lohsiriwat V, Swangsri J et al. The learning curve for safety and success of precut sphincterotomy for therapeutic ERCP: a single endoscopist’s experience. Endoscopy 2008; 40(6): 513–516.
107. Fukatsu H, Kawamoto H, Harada R et al. Quantitative assessment of technical proficiency in performing needle--knife precut papillotomy. Surg Endosc 2009; 23(9): 2066–2072.
108. Harewood GC, Baron TH. An assessment of the learning curve for precut biliary sphincterotomy. Am J Gastroenterol 2002; 97(7): 1708–1712.
109. Manes G, Di Giorgio P, Repici A et al. An analysis of the factors associated with the development of complications in patients undergoing precut sphincterotomy: a prospective, controlled, randomized, multicenter study. Am J Gastroenterol 2009; 104(10): 2412–2417.
110. deWeerth A, Seitz U, Zhong Y et al. Primary precutting versus conventional over-the-wire sphincterotomy for bile duct access: a prospective randomized study. Endoscopy 2006; 38(12): 1235–1240.
111. Tang S-J, Haber GB, Kortan P et al. Precut papillotomy versus persistence in difficult biliary cannulation: a prospective randomized trial. Endoscopy 2005; 37(1): 58–65.
112. Yasuda I, Tomita E, Enya M et al. Can endoscopic papillary balloon dilation really preserve sphincter of Oddi function? Gut 2001; 49(5): 686–691.
113. Baron TH, Harewood GC. Endoscopic balloon dilation of the biliary sphincter compared to endoscopic biliary sphincterotomy for removal of common bile duct stones during ERCP: a metaanalysis of randomized, controlled trials. Am J Gastroenterol 2004; 99(8): 1455–1460.
114. Weinberg BM, Shindy W, Lo S. Endoscopic balloon sphincter dilation (sphincteroplasty) versus sphincterotomy for common bile duct stones. Cochrane Database Syst Rev 2006; CD004890.
115. DiSario JA, Freeman ML, Bjorkman DJ et al. Endoscopic balloon dilation compared with sphincterotomy for extraction of bile duct stones. Gastroenterology 2004; 127(5): 1291–1299.
116. Attasaranya S, Cheon Y, Vittal H et al. Large-diameter biliary orifice balloon dilation to aid in endoscopic bile duct stone removal: a multicenter series. Gastrointest Endosc 2008; 67(7): 1046–1052.
117. Ersoz G, Tekesin O, Ozutemiz AO et al. Biliary sphincterotomy plus dilation with a large balloon for bile duct stones that are difficult to extract. Gastrointest Endosc 2003; 57(2): 156–159.
118. Maydeo A, Bhandari S. Balloon sphincteroplasty for removing difficult bile duct stones. Endoscopy 2007; 39(11): 958–961.
119. Minami A, Hirose S, Nomoto T et al. Small sphincterotomy combined with papillary dilation with large balloon permits retrieval of large stones without mechanical lithotripsy. World J Gastroenterol 2007; 13(15): 2179–2182.
120. Misra SP, Dwivedi M. Large-diameter balloon dilation after endoscopic sphincterotomy for removal of difficult bile duct stones. Endoscopy 2008; 40(3): 209–213.
121. Heo JH, Kang DH, Jung HJ et al. Endoscopic sphincterotomy plus large-balloon dilation versus endoscopic sphincterotomy for removal of bile-duct stones. Gastrointest Endosc 2007; 66(4): 720–726.
122. Kawamoto M, Geenen J, Omari T et al. Sleeve sphincter of Oddi (SO) manometry: a new method for characterizing the motility of the sphincter of Oddi. J Hepatobiliary Pancreat Surg 2008; 15(4): 391–396.
123. Frenz MB, Wehrmann T. Solid state biliary manometry catheter: impact on diagnosis and post-study pancreatitis. Curr Gastroenterol Rep 2007; 9(2): 171–174.
124. Craig AG, Omari T, Lingenfelser T et al. Development of a sleeve sensor for measurement of sphincter of Oddi motility. Endoscopy 2001; 33(8): 651–657.
125. Sherman S, Troiano FP, Hawes RH, Lehman GA. Sphincter of Oddi manometry: decreased risk of clinical pancreatitis with use of a modified aspirating catheter. Gastrointest Endosc 1990; 36(5): 462–466.
126. Draganov P, Kowalczyk L, Forsmark C. Prospective trial comparing solid-state catheter and water-perfusion triple-lumen catheter for sphincter of Oddi manometry done at the time of ERCP. Gastrointest Endosc 2009; 70(1): 92–95.
127. Wehrmann T, Stergiou N, Schmitt T, Dietrich CF, Seifert H. Reduced risk for pancreatitis after endoscopic microtransducer manometry of the sphincter of Oddi: a randomized comparison with the perfusion manometry technique. Endoscopy 2003; 35(6): 472–477.
128. Sherman S, Hawes RH, Troiano FP, Lehman GA. Pancreatitis following bile duct sphincter of Oddi manometry: utility of the aspirating catheter. Gastrointest Endosc 1992; 38(3): 347–350.
129. Singh P, Das A, Isenberg G et al. Does prophylactic pancreatic stent placement reduce the risk of post-ERCP acute pancreatitis? A meta-analysis of controlled trials. Gastrointest Endosc 2004; 60(4): 544–550.
130. Sofuni A, Maguchi H, Itoi T et al. Prophylaxis of post-endoscopic retrograde cholangiopancreatography pancreatitis by an endoscopic pancreatic spontaneous dislodgement stent. Clin Gastroenterol Hepatol 2007; 5(11): 1339–1346.
131. Chahal P, Tarnasky P, Petersen B et al. Short 5Fr vs long 3Fr pancreatic stents in patients at high risk for post - endoscopic cholangiopancreatography pancreatitis. Clin Gastroenterol Hepatol 2009; 7(8): 834–839.
132. Fehmi SMA, Schoenfeld PS, Scheiman JM et al. 5 Fr prophylactic pancreatic stents are easier to place and require fewer guide wires than 3 Fr stents. Gastrointest Endosc 2008; 67: AB328–AB329.
133. Smith MT, Sherman S, Ikenberry SO et al. Alterations in pancreatic ductal morphology following polyethylene pancreatic stent therapy. Gastrointest Endosc 1996; 44(3): 268–275.
134. Das A, Singh P, Sivak MV et al. Pancreatic-stent placement for prevention of post-ERCP pancreatitis: a cost-effectiveness analysis. Gastrointest Endosc 2007; 65(7): 960–968.
135. Freeman ML, Overby C, Qi D. Pancreatic stent insertion: consequences of failure and results of a modified technique to maximize success. Gastrointest Endosc 2004; 59(1): 8–14.
136. Brackbill S, Young S, Schoenfeld P, Elta G. A survey of physician practices on prophylactic pancreatic stents. Gastrointest Endosc 2006; 64(1): 45–52.
137. Dumonceau JM, Rigaux J, Kahaleh M et al. Prophylaxis of post-ERCP pancreatitis: a practice survey. Gastrointest Endosc 2010; 71(6): 934–939.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2013 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Mozkový natriuretický peptid je markerem horší prognózy při dekompenzaci jaterní cirhózy
- Multifokální hepatocelulární karcinom imitující jaterní cirhózu
- Chirurgická léčba metastáz hepatocelulárního karcinomu do nadledvin
- Kolonoskopie ve vodní imerzi s „capem“ – prospektivní, randomizovaná studie
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Metastatické postižení tenkého střeva jako první projev generalizace kožního melanomu
- Endoskopická léčba Zenkerova divertiklu
- Doporučené postupy Evropské společnosti pro gastrointestinální endoskopii (ESGE): profylaxe pankreatitidy po provedené ERCP
- Invazivní léčba chronické pankreatitidy je indikována pro bolesti, podezření na malignitu, biliární obstrukci, leak a cystoid
- Zdravotní stav a karcinom pankreatu
- Prevence pankreatitidy po ERCP
- 3rd Prague Endoscopy Workshop (and 14th Endoscopy Workshop in IKEM)
- Životní jubileum prof. MUDr. Marie Brodanové, DrSc.
-
Správná odpověď na kvíz
Intramurální hematom ve stěně rekta při antikoagulační terapii - Autodidaktický test: hepatologie
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Co nového v hepatologii?
-
Kvíz – případ z klinické praxe
Nečekaná příčina akutní renální insuficience vycházející z rekta - Doporučení České gastroenterologické společnosti pro podávání antiagregační terapie kyselinou acetylsalicylovou
- Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV) – aktualizace
- Danišův jícnový stent v terapii varikózního krvácení
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Danišův jícnový stent v terapii varikózního krvácení
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Prevence pankreatitidy po ERCP
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



