-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zdravotní stav a karcinom pankreatu
Health status and pancreatic cancer
Introduction:
The Czech Republic ranks among the countries with high incidence and mortality of pancreatic cancer.Method:
The hospital based case-control study included a total of 529 people (309 pancreatic cancer cases and 220 controls). People in the study came from Olomouc, Ostrava, and Ceske Budejovice (Czech Republic). The relationship between health status (diabetes mellitus, chronic pancreatitis, cholelithiasis), use of medication (aspirin and other anti-inflammatory drugs), the family history (cancer in first-degree relatives), and cancer of the pancreas was studied.Results:
A positive statistically significant association was found in diabetes mellitus (OR 1.84, 95% CI 1.12–3.03) and pancreatitis (OR 4.10, 95% CI 1.43–11.81). A statistically significant inverse association was found in the use of aspirin (OR 0.33, 95% CI 0.17–0.62) and anti-inflammatory drugs (OR 0.28, 95% CI 0.12–0.65). No association between family history of cancer in first-degree relatives and pancreatic cancer was found.Conclusion:
Because no specific prevention of pancreatic cancer in the form of an effective screening program exists, it is necessary to pay attention to the factors associated with the disease, such as pancreatitis, diabetes mellitus, and metabolic syndrome, for early detection of pancreatic cancer.Key words:
pancreatic cancer – health status – analysis
Autori: H. Kollárová 1
; K. Azeem 1; H. Tomášková 2; V. Procházka 3
; Arnošt Martínek 4
; O. Shonová 5; J. Ševčíková 1
; D. Horáková 1
; V. Janout 1
Pôsobisko autorov: Ústav preventivního lékařství, LF UP v Olomouci 1; Ústav epidemiologie a ochrany veřejného zdraví, LF OU v Ostravě 2; II. interní klinika – gastro-enterologická a hepatologická, FN Olomouc 3; Interní klinika FN Olomouc 4; Gastroenterologické oddělení, Nemocnice České Budějovice, a. s. 5
Vyšlo v časopise: Gastroent Hepatol 2013; 67(2): 154-161
Kategória: Gastrointestinální onkologie: původní práce
Súhrn
Úvod:
ČR patří mezi země s vysokým výskytem i úmrtností karcinomu pankreatu.Metoda:
Do nemocniční studie případů a kontrol bylo zařazeno celkem 529 osob, z toho 309 s karcinomem pankreatu a 220 osob v kontrolním souboru. Osoby zařazené do studie pocházely z Olomouce, Ostravy a Českých Budějovic. Studie se zabývala vztahy mezi zdravotním stavem (diabetes mellitus, chronická pankreatitida, cholelithiáza), užíváním léků (aspirin a jiné protizánětlivé léky) a dále výskytem nádorových onemocnění u prvostupňových příbuzných a výskytem karcinomu pankreatu.Výsledky:
Pozitivní statisticky významná asociace byla nalezena u diabetes mellitus (OR 1,84, 95% IS 1,12–3,03) a pankreatitidy (OR 4,10, 95% IS 1,43–11,81). Statisticky významná inverzní asociace byla zjištěna u užívání aspirinu (OR 0,33, 95% IS 0,17–0,62) a protizánětlivých léků (OR 0,28, 95% IS 0,12–0,65). U familiárního výskytu nádorových onemocnění se žádná asociace nenalezla.Závěr:
Vzhledem k tomu, že specifická prevence v podobě efektivního screeningového programu neexistuje, je třeba věnovat pozornost také faktorům, které s tímto onemocněním souvisí a umožní včasnější záchyt karcinomu pankreatu, jako je například pankreatitida, diabetes mellitus a metabolický syndrom.Klíčová slova:
karcinom pankreatu – zdravotní stav – analýza
Karcinom pankreatu je onemocnění s mimořádně špatnou prognózou, kde přežívání je nižší než 5 % a většina nemocných umírá během šesti měsíců od stanovení diagnózy. Hlavním problémem u karcinomu pankreatu je chybění screeningového programu, který by umožnil včasný záchyt onemocnění u asyptomatických osob a také neúplná znalost etiologie, protože nádorová onemocnění jsou ovlivněna mnoha faktory [1–4]. Mezi státy s vysokým výskytem i úmrtností patří také Česká republika. Při srovnání incidence v České republice s ostatními zeměmi světa v přepočtu na světový standard je Česká republika na druhém místě na světě za Arménií a v mortalitě na místě třetím za Maďarskem a Izraelem [5,6]. K rizikovým faktorům dávaným do souvislosti s karcinomem pankreatu patří jednak faktory neovlivnitelné jako věk, pohlaví, hereditární faktory, urbanizace a faktory ovlivnitelné jako kouření, výživové faktory, obezita, konzumace alkoholu, faktory pracovního prostředí (azbest, pesticidy aj.) a zdravotní stav, zejména chronická pankreatitida, cholelithiáza a diabetes mellitus [7]. Přičemž k faktorům s velmi silnou asociací kromě kouření, obezity a některých faktorů pracovního prostředí patří zejména chronická pankreatitida, kdy relativní riziko může být až kolem 14 a diabetes mellitus s relativním rizikem mezi 2 a 3 [3,8]. Jednotlivé faktory se mohou vzájemně shlukovat, ovlivňovat a potencovat.
Hlavní analýza předkládané práce se zaměřuje na sledování faktorů souvisejících se zdravotním stavem (diabetes mellitus, žlučové kameny, pankreatitida) a vyšším rizikem vzniku karcinomu pankreatu, dále je posuzován vliv protizánětlivých léků ve vztahu ke karcinomu pankreatu a asociace mezi výskytem karcinomu pankreatu u prvostupňových příbuzných a studovaným souborem. Kouření, BMI, konzumace alkoholu a vzdělání jsou do analýzy zařazeny jako možné ovlivňující faktory sledovaných charakteristik zdravotního stavu.
Soubor a metoda
Studie probíhala jako studie případů a kontrol v letech 2006–2009 v rámci projektu IGA (NR 9029-4/2006) ve třech centrech, a to v Olomouci, Ostravě a Českých Budějovicích. Do studie bylo zařazeno celkem 529 osob, z toho 309 s karcinomem pankreatu a 220 osob v kontrolním souboru. Zastoupení počtu osob s karcinomem pankreatu a kontrolního souboru z jednotlivých center ukazuje tab. 1.
Tab. 1. Zastoupení případů a kontrol v jednotlivých centrech. Tab. 1. Cases and controls in individual centres. 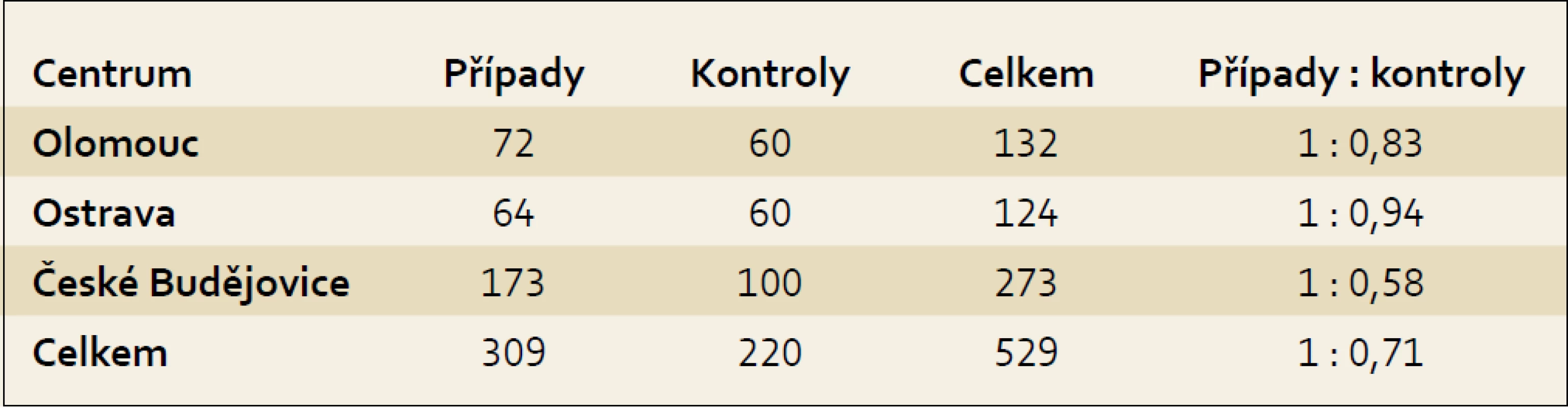
Z celkového počtu osob bylo 303 mužů a 226 žen. Případy byly vybírány v nemocnicích v jednotlivých centrech (FN Olomouc, FN Ostrava a Nemocnice České Budějovice, a. s.) z osob, u kterých byl nově diagnostikován karcinom pankreatu a které žily v příslušném regionu. Kontrolní skupina byla získána ve spolupráci s vybranými praktickými lékaři pro dospělé a jedná se o populační kontrolní skupinu. Kontrolní skupina pocházela ze stejných regionů jako skupina případů, aby se předešlo zkreslujícím vlivům. Zohledněn byl věk, pohlaví a zdravotní stav. Vzhledem ke složitosti získávání populačních kontrol byl jejich počet nižší než osob s karcinomem pankreatu. Tento rozdíl byl významný zejména v Jihočeském kraji, kde se podařilo zajistit osoby do kontrolní skupiny ve srovnání s počtem případů v poměru 1 : 0,58 (tab. 1). Informace byly získávány od zúčastněných osob přímo, formou rozhovoru s vyškoleným tazatelem, a byly zaznamenávány do standardizovaného dotazníku. Dotazník obsahoval otázky vztahující se k životnímu stylu (antropometrické hodnoty pro výpočet BMI, konzumace alkoholu, kouření aj.), k výši vzdělání a otázky související se zdravotním stavem (diabetes mellitus, chronická pankreatitida, cholelithiáza), užíváním léků (aspirin a jiné protizánětlivé léky) a dále výskytem nádorových onemocnění u prvostupňových příbuzných. Hodnoty pro výpočet BMI se zjišťovaly pro věk 20 a 40 let a dále dva roky před vznikem onemocnění, ev. dva roky před pohovorem u kontrolní skupiny a aktuální hodnoty v době pohovoru. Zdravotní stav, diabetes mellitus, chronická pankreatitida a cholelithiáza se zjišťovali dva roky před vznikem onemocnění, aby se vyloučila případná souvislost se sledovaným onemocněním. U užívání protizánětlivých léků bylo za expozici považováno pravidelné podávání léku alespoň jednou týdně po dobu jednoho roku.
Studie byla schválena etickou komisí LF UP v Olomouci a FN v Olomouci. Informovaný souhlas byl získán od všech zúčastněných osob před jejich zařazením do studie.
Na některé otázky se respondenti rozhodli neodpovídat, proto se frekvence odpovědí u jednotlivých charakteristik mohou lišit.
Pro hodnocení výskytu sledovaných faktorů mezi případy a kontrolami byl použit výpočet hrubého OR s 95% intervalem spolehlivosti (IS) a logistická regrese. Pro hodnocení statistické významnosti byla zvolena hladina významnosti 5 %. Statistické zpracování bylo provedeno programem Stata v. 10.
Výsledky
Při analýze byl zjištěn statisticky významný rozdíl u věku v závislosti na pohlaví a průměrný věk při vzniku onemocnění u žen byl statisticky významně vyšší – zatímco u mužů byl průměrný věk 65,4 let, u žen byl 68,9 let. V souboru nebyl zjištěn statisticky významný rozdíl ve výskytu mezi muži a ženami.
Aktuální hodnoty pro BMI ukazovaly statisticky významný rozdíl mezi muži, kdy muži s karcinomem pankreatu měli nižší hodnoty BMI než muži z kontrolní skupiny (p < 0,001), a také u žen byly aktuální hodnoty BMI u případů nižší než u kontrol (p < 0,048), což pravděpodobně již souviselo se sledovaným nádorovým onemocněním. Jednotlivé hodnoty BMI ve sledovaných obdobích ukazuje tab. 2.
Tab. 2. Hodnoty BMI u případů a kontrol dle pohlaví. Tab. 2. BMI values in cases and controls according to gender in the pancreatic cancer study. 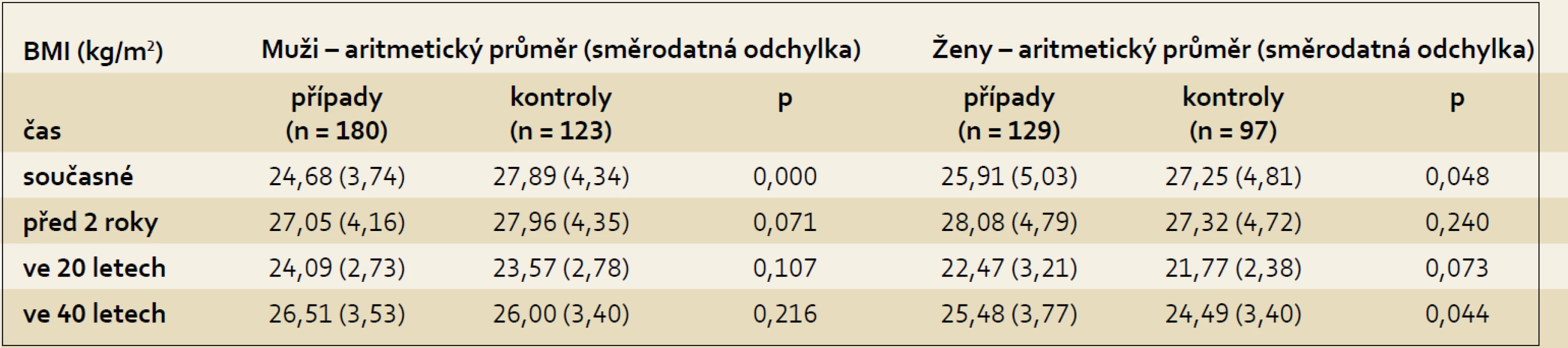
Vztah mezi nadváhou a obezitou byl analyzován pomocí hrubého i adjustovaného OR (OR = 0,84 a 0,79, resp. po adjustaci 0,83 a 0,67), nebyla ale nalezena žádná statisticky významná asociace (tab. 3). Kouření je považováno za kauzální rizikový faktor pro vznik karcinomu pankreatu, nicméně v předkládané studii pozitivní asociace nalezena nebyla. Při srovnání osob, které uvedly, že konzumují alkohol, s osobami, které alkohol nekonzumují, byla nalezena inverzní asociace (tab. 3).
Tab. 3. Vztah mezi zdravotním stavem a rizikem vzniku karcinomu pankreatu – hrubé OR a model logistické regrese. Tab. 3. Association between health status and pancreatic cancer risk by crude OR and in the logistic regression model. 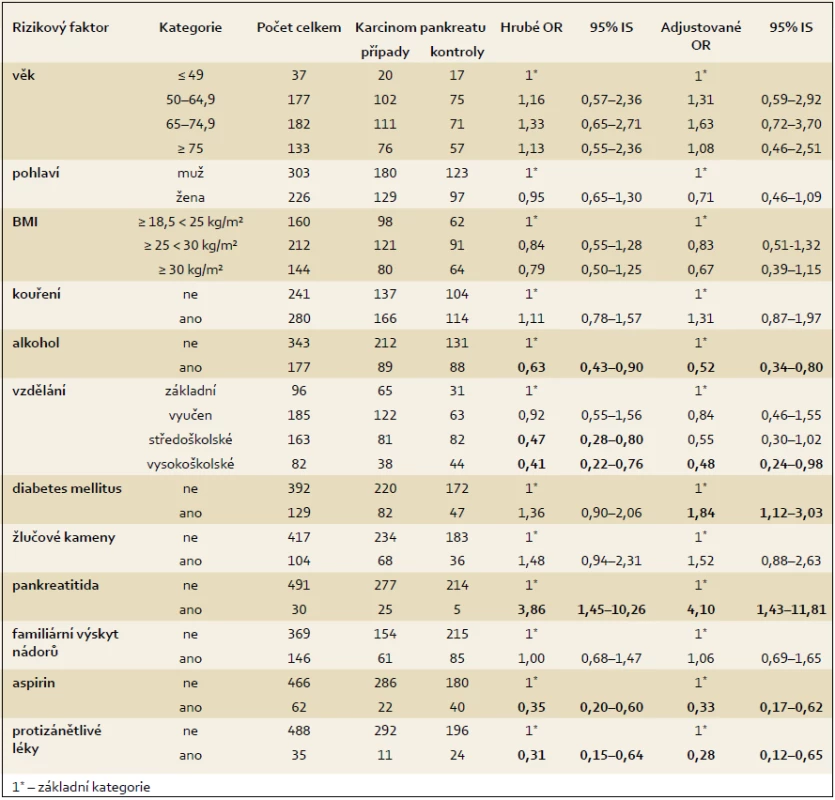
Při analýze, zda vzdělání má vztah ke vzniku karcinomu pankreatu, byla zjištěna inverzní asociace u osob s vyšším vzděláním, kdy u osob se středoškolským vzděláním bylo zjištěno hrubé OR 0,47 (95% IS 0,28–0,80) a u osob s vysokoškolským vzděláním 0,41 (95% IS 0,22–0,76). Vyšší vzdělání se ve srovnání se vzděláním základním ukázalo jako ochranný faktor při vzniku karcinomu pankreatu. Tento výsledek byl u vysokoškolského vzdělání potvrzen i po přizpůsobení dalším sledovaným faktorům, kdy nalezená hodnota OR byla 0,48 a výsledky byly statisticky významné (tab. 3).
Pozitivní statisticky významná asociace byla nalezena u diabetes mellitus po přizpůsobení, kdy hodnota OR byla 1,84, přičemž průměrná doba trvání diabetu před stanovením diagnózy karcinomu pankreatu byla 10,5 let. Věkový medián byl u pacientů s diabetem 60 let. Celkem 26 % osob s diabetem se léčilo inzulinem.
Velmi silná pozitivní asociace byla nalezena u pankreatitidy, kdy hodnota hrubého OR byla 3,86 (95% IS 1,45–10,26) a tato silná asociace se potvrdila i po přizpůsobení dalším sledovaným faktorům (OR = 4,10). Průměrná doba diagnostikování pankreatitidy před stanovením diagnózy byla u osob s karcinomem pankreatu 12,3 let a věkový medián byl 51 let.
U žlučových kamenů byla naznačena slabá asociace, ale výsledky nebyly statisticky významné, přičemž věkový medián byl 50 let. Výsledky ukazuje tab. 3.
U aspirinu byla zjištěna statisticky významná inverzní asociace. Hodnoty hrubého a adjustovaného OR při užívání aspirinu byly 0,35, resp. 0,33 a výsledky byly statisticky významné. Nejvyšší frekvence užívání aspirinu byla mezi 50. a 66. rokem věku. Jako důvod užívání aspirinu uvedlo 90 % osob, které lék užívaly alespoň jednou týdně po dobu jednoho roku, preventivní důvody a 10 % osob užívalo tento lék z terapeutických důvodů, zejména pro bolest hlavy. Na otázku, zda užívali pravidelně i jiné protizánětlivé léky, odpovědělo kladně celkem 35 respondentů, z toho 11 osob s karcinomem pankreatu a 24 osob v kontrolní skupině. Nalezená inverzní asociace byla statisticky významná a snížení rizika bylo o 69 %, resp. po adjustaci o 72 %. Důvodem užívání protizánětlivých léků byly nejčastěji bolesti zad, kloubů a hlavy. Nejčastěji užívanými preparáty byly Ibalgin a Ibuprofen.
U familiárního výskytu nádorových onemocnění se žádná asociace nenalezla. Výsledky analýz shrnuje tab. 3, do modelu s přizpůsobením byly zahrnuty pouze vybrané charakteristiky, u kterých se na základě jiných epidemiologických studií předpokládá silnější asociace.
Diskuze
Jedním z nejdůležitějších rizikových faktorů pro vznik karcinomu pankreatu je věk. Pandol et al ve své práci uvádí věkový medián 72 let. Méně než 10 % pacientů s karcinomem pankreatu je mladších 50 let a u těchto osob se vyskytuje vyšší proporce geneticky podmíněných onemocnění [8]. V ČR je nejvyšší výskyt u mužů ve věku 65–74 let a u žen ve věku 75–79 let [5]. Ve studovaném souboru byl průměrný věk u mužů 65,4 a u žen 68,9 a tento rozdíl mezi pohlavím byl statisticky významný. Ačkoli byl průměrný věk u mužů i u žen nižší než je celorepublikově zjištěný nejvyšší výskyt karcinomu pankreatu, je zřejmý rozdíl ve věku při výskytu tohoto karcinomu u mužů a u žen, kdy ženy při stanovení diagnózy bývají starší než muži. Výskyt karcinomu pankreatu byl v předkládané studii u mužů nepatrně vyšší než u žen a podle některých epidemiologických studií to může souviset i s kuřáckými zvyklostmi [7,8].
Obezita je považovaná za jeden z mála rizikových faktorů, které jsou dávány do souvislosti s tímto nádorovým onemocněním, i když výsledky nejsou jednoznačné a mechanizmus účinku není zcela jasný. Řada epidemiologických studií i metaanalýz potvrzují, že nalezené riziko se pohybuje od slabé až po silnou asociaci (1,1–2,8) [7–11]. K pravděpodobným mechanizmům účinku obezity patří zánětlivé a hormonální vlivy tukové tkáně, energetická dysbalance a zvýšená expozice karcinogenním látkám kvůli zvýšené spotřebě potravin a také snížená fyzická aktivita [9]. Viscerální tuková tkáň je více než jen zásobárnou tuku a energie, je také aktivním endokrinním orgánem [12]. Tuková tkáň hraje centrální roli v lipidovém a glukózovém metabolizmu a produkuje řadu hormonů a cytokinů, které mají klíčovou úlohu v zánětlivém procesu [13]. Obezita sama je spojena s řadou zdravotních důsledků, včetně kardiovaskulárních onemocnění, hypertenze, diabetes mellitus a metabolického syndromu, proto by redukce obezity mohla ovlivnit i úmrtnost na karcinom pankreatu. Genkinger et al ve své metaanalýze založené na 14 kohortových studiích, které zahrnovaly 845 640 osob (u 2 135 z nich byl diagnostikován karcinom pankreatu), nalezli pozitivní asociaci mezi zvýšeným BMI v rané dospělosti a mírně zvýšeným rizikem vzniku karcinomu pankreatu [14]. Nadváha a obezita v rané dospělosti vedla také k mírně mladšímu věku v době diagnózy karcinomu pankreatu [14]. Nicméně v předkládané studii se nepotvrdila pozitivní asociace mezi nadváhou a obezitou a vyšším rizikem vzniku karcinomu pankreatu. Nepotvrzení asociace může souviset s vysokou prevalencí nadváhy a obezity v celé populaci i ve sledovaném souboru.
Kouření patří k nejsilnějším rizikovým faktorům při vzniku karcinomu pankreatu, kdy výsledky metaanalýzy 82 studií ukazují až dvojnásobné zvýšení rizika pro kuřáky [7,8]. Po zanechání kouření dochází během několika let k výraznému poklesu rizika [8]. Vysoká prevalence kuřáctví ve společnosti (kolem 25 %) toto riziko ještě zvyšuje [8]. Prevalence kuřáctví v ČR je kolem 30 %, přičemž nebyl v posledních letech zjištěn trend, že by se kuřáci snažili svého návyku zbavit [15]. I přesto, že kontrolní skupina byla vybrána z běžné populace a prevalence kuřáctví u běžné populace bývá obecně nižší než u nemocničních kontrolních skupin, nebyla v předkládané studii nalezena pozitivní statisticky významná asociace, kdy by důvodem mohlo být vysoké zastoupení kuřáků v kontrolní skupině (52 %), které bylo vyšší, než je prevalence kouření v ČR. Střídmá konzumace alkoholu neovlivňuje vyšší riziko vzniku karcinomu pankreatu. Metaanalýzy zjišťují pozitivní asociaci až při vyšší konzumaci alkoholu, kdy při konzumaci více než 84 g čistého alkoholu bylo riziko vyšší až o 50 % [7,8,16,17]. V předkládaném souboru byla nalezena inverzní asociace a výsledek je konzistentní s publikovanými údaji. Vzdělání a bydlení jsou považovány za faktory umožňující hodnocení socioekonomického postavení. Zejména úroveň vzdělání významně ovlivňuje socioekonomické postavení jednotlivců i celých rodin a hierarchii jejich hodnot a chování [18]. Protektivní účinek vyššího vzdělání se projevil i v předkládané studii, kdy zejména osoby s vysokoškolským vzděláním měly riziko nižší o 52 %.
Hlavním cílem předložené studie bylo vyhodnocení asociace mezi zdravotním stavem a užíváním vybraných protizánětlivých léků ve vztahu ke karcinomu pankreatu. Kouření, BMI, konzumace alkoholu a vzdělání patří k základním rizikovým faktorům pro vznik tohoto nádorového onemocnění a byly do analýzy zařazeny, aby byl podchycen jejich vliv jako možných zkreslujících faktorů (konfounderů). V rámci zdravotního stavu se sledoval vztah mezi diabetes mellitus, žlučovými kameny a pankreatitidou v anamnéze a vyšším rizikem vzniku karcinomu pankreatu. Zejména diabetes mellitus a pankreatitida vykazují silnou asociaci v řadě provedených epidemiologických studií a metaanalýz, kdy nejsilnější asociace je pozorována u osob, u kterých byl diabetes diagnostikován do dvou let před vznikem karcinomu pankreatu a kdy nalezené riziko bylo až trojnásobné [7]. Dosud prováděné studie zaznamenaly pozitivní asociaci mezi diabetem a karcinomem pankreatu, ale kauzální vztah zatím nebyl jasně stanoven [19]. Diabetes je přítomen u 60–80 % pacientů s karcinomem pankreatu a mnoho pacientů diabetes mellitus nově onemocnělo [20–22]. Jee a Gapstur potvrdili pozitivní asociaci také mezi inzulinovou rezistencí a karcinomem pankreatu [23–25]. Jedna studie sledovala téměř 1,3 mil. osob po dobu 10 let a zjistila, že jedinci s vysokými hladinami glykemie na lačno (> 140 mg/dl = 7,8 mmol/l) mají také nejvyšší úmrtnost na nádorová onemocnění po přizpůsobení kouření a konzumaci alkoholu [24]. Četné studie také nalezly zvýšenou expresi inzulinových receptorů u mnoha typů nádorů, včetně karcinomu pankreatu [26].
Chari ve své práci [27] poukázal na nově vzniklá onemocnění diabetem u 52,3 % pacientů s karcinomem pankreatu, zatímco u kontrol to bylo pouze 23,6 % (p < 0,0001). V jiné studii byl u 40 % pacientů diagnostikován současně s diabetem i karcinom pankreatu a 16 % pacientů onemocnělo diabetem do dvou let před zjištěním onemocnění karcinomem pankreatu [28]. Proto se diabetes zdá být více klinickou manifestací malignity než přímým kauzálním činitelem [19]. Kauzální vztah mezi diabetem a karcinomem pankreatu je kontroverzní, i když v četných metaanalýzách bylo zjištěné riziko přibližně dvojnásobné [19]. Cílená léčba diabetu by pravděpodobně měla snížit riziko vzniku karcinomu pankreatu [29,30]. Ve studii Egawa et al byli pacienti s karcinomem pankreatu v případě, že měli diabetes mellitus v rodinné anamnéze (u prvostupňových příbuzných), v průměru o pět let mladší v době diagnózy (61 ± 9 vs 65 ±11 let) než osoby bez této diagnózy v rodinné anamnéze [31]. U nově diagnostikovaného diabetes mellitus 2. typu bylo u pacientů riziko vzniku karcinomu pankreatu v příštích třech letech téměř osminásobné ve srovnání s obecnou populací [32]. Síla asociace je také závislá na délce trvání diabetu a pohybuje se od rizika 1,5 při době nemoci 10 a více let do rizika 3,0 při krátkém trvání diabetu. Výsledky asociace mohou být zkresleny i vlivem dalších rizikových faktorů, zejména obezitou a kouřením. Vyšší riziko pro osoby s diabetem diagnostikovaným do dvou let před vznikem karcinomu pankreatu pravděpodobně souvisí již se změnami v pankreatu, a tím se studovaným nádorovým onemocněním [7,33]. Studie případů a kontrol z Itálie zkoumala riziko vzniku karcinomu pankreatu zejména u léčených diabetiků [34]. Tato práce zjistila, že přítomnost diabetes mellitus je signifikantním rizikovým faktorem pro vznik karcinomu pankreatu. Riziko vzniku karcinomu pankreatu klesalo s délkou období, které uplynulo od diagnózy, a počátku léčby diabetes mellitus. Zdálo se, že i druh léčby ovlivňuje riziko vzniku karcinomu pankreatu, kdy pacienti léčení inzulinem měli signifikantně vyšší riziko než osoby léčené orálními hypoglykemiky (RR 7,68, 95% IS 1,27–17,22). Diabetici léčení inzulinem po více než pět let měli relativní riziko vzniku karcinomu pankreatu 6, zatímco pacienti léčení orálními hypoglykemiky neměli zvýšené riziko, a to ani po pěti letech. Ve sledovaném souboru bylo riziko pro osoby s diabetem 1,36 a 1,84, přičemž výsledek po adjustaci byl statisticky významný. Pouze u 15 % osob s diabetes mellitus bylo onemocnění diagnostikováno do dvou let před vznikem nádorového onemocnění, resp. pohovorem u kontrolní skupiny, a dá se tedy jen u malé části předpokládat určitá souvislost mezi změnami, které souvisí se vznikem diabetu, a karcinomem pankreatu.
Ač skutečná prevalence chronické pankreatitidy zatím není známa, odhaduje se, že se pohybuje mezi 0,04 a 5 % normální zdravé populace [35]. Pankreatitida je jednak rizikovým faktorem pro vznik karcinomu pankreatu a také může být časným diagnostickým indikátorem. Riziko se může pohybovat od 3,6–24,3 také v závislosti na délce sledování, výživě, konzumaci alkoholu a dalších faktorech [8]. Chronická pankreatitida je úzce spojena s karcinomem pankreatu, ačkoli ještě není zcela vyjasněn vztah mezi příčinou a následkem [36]. Současná metaanalýza naznačila, že interval mezi chronickou pankreatitidou a vznikem karcinomu pankreatu je téměř 20 let a pankreatitida, která se objevila během 1–2 let před diagnózou karcinomu pankreatu, je zpravidla výsledkem obstrukce pankreatických duktů způsobených nádorem [37,38]. Vztah je podpořen pozorováním, které zjistilo, že chronická pankreatitida byla daleko běžnější (> 70 %) u osob ve vysokém riziku, než je prevalence těchto změn u osob kontrolních (< 20 %). Zejména vyšší konzumace alkoholu se může uplatnit jako ovlivňující faktor. Sledování 223 pacientů s nehereditární chronickou pankreatitidou (> 70 % z nich v důsledku konzumace alkoholu) odhalilo, že incidence karcinomu pankreatu je u těchto pacientů téměř 6 % během 14letého období [39]. Pacienti měli zároveň vyšší riziko vzniku karcinomu žaludku a jícnu, i když toto riziko bylo nižší než u karcinomu pankreatu. Celková prevalence pankreatitidy v populaci není příliš vysoká a také ve sledovaném souboru uvedlo pouze 30 osob toto onemocnění v anamnéze, z toho 25 s karcinomem pankreatu a 5 v kontrolním souboru. Zvýšená konzumace alkoholu, kouření i obezita zvyšují riziko vzniku pankreatitidy. Tento vzájemný vztah může ovlivňovat vznik i průběh karcinomu pankreatu [8]. V předkládané studii byla při konzumaci alkoholu nalezena inverzní asociace, zatímco u pankreatitidy byla nalezena velmi silná pozitivní asociace. Při analýze pomocí logistické regrese a přizpůsobení pankreatitidy i ostatním sledovaným faktorům, kdy se uvedené faktory hodnotí současně, bylo nalezeno riziko 4,42 a výsledek byl statisticky významný, přitom vliv konzumace alkoholu ani kouření se neprojevil. Ve studovaném souboru byla průměrná doba diagnostikování pankreatitidy před vznikem karcinomu pankreatu 12,3 let, a nebyla tedy indikátorem sledovaného nádorového onemocnění. S pankreatitidou souvisí i nadváha a obezita, které zároveň ovlivňují vznik diabetes mellitus. Shluk zdravotních poruch, včetně obezity, inzulinové rezistence, diabetu a dyslipidemie jsou součástí metabolického syndromu, který má stále se zvyšující prevalenci a může do značné míry ovlivnit vznik karcinomu pankreatu [8]. Některé epidemiologické studie poukazují i na vliv cholelitiázy na vznik karcinomu pankreatu, ale nalezené asociace bývají slabé [40]. V předkládané studii bylo zjištěné riziko vyšší pro osoby s cholelitiázou o 48 % a po adjustaci o 38 %, ale výsledky nebyly statisticky významné. Úloha hereditárních faktorů není ještě zcela objasněna, i když se předpokládá, že u 5–10 % jedinců s karcinomem pankreatu se tato souvislost uplatňuje. Pokud se karcinom pankreatu vyskytl u prvostupňových příbuzných, potom riziko může být až trojnásobné a tyto nádory mohou být i součástí syndromů (Li-Fraumeni syndrom, Lynchův syndrom II, Familiární adenomatózní polypóza, hereditární pankreatitida aj.) [7,8,41,42]. Při hodnocení je třeba také zvážit společné působení faktorů životního stylu či životního a pracovního prostředí, které mohou asociace zkreslit. Ve sledovaném souboru nebyla nalezena žádná asociace mezi familiárním výskytem a vyšším rizikem karcinomu pankreatu.
Schernhammer et al ve své multivariabilní analýze nedává užívání aspirinu a jiných protizánětlivých léků do souvislosti s karcinomem pankreatu a užívání těchto léků má jen okrajový význam, i když důležitá je i doba užívání a velikost dávky [43]. K obdobným závěrům došli ve své práci i Larsson et al, kde i při vyšší frekvenci užívaní (šest nebo více tablet za týden) nebo delší době užívání nenašli jednoznačnou asociaci [44]. Britská studie (nested case-control) sledovala užívání nesteroidních protizánětlivých léků. Nesteroidní protizánětlivé léky užívané po dva roky před diagnózou karcinomu pankreatu vedly ke snížení rizika (OR 0,75, 95% IS 0,62–0,97) [45]. V předkládané práci byla zjištěna inverzní statisticky významná asociace jak u užívání aspirinu, tak i u užívání protizánětlivých léků a riziko bylo sníženo o 72–65 % a tyto výsledky jsou konzistentní s publikovanými údaji.
Karcinom pankreatu je jen zřídka odhalen v počátečním stadiu [4]. Je to dáno částečně nepřítomností symptomů, případně jejich malou specifičností. Populační studie případů a kontrol z oblasti San Francisco Bay zjistila, že již tři roky před diagnózou karcinomu pankreatu existovaly u pacientů symptomy, které by mohly naznačovat přítomnost změn pankreatu. Jednalo se nejčastěji o bolesti břicha, nezvyklé nadýmání, říhání nebo pálení žáhy, změny vyprazdňování (zácpa či průjem), případně příznaky biliární obstrukce [46]. Přesto zavedení screeningového programu pro toto závažné nádorové onemocnění není v současnosti pravděpodobné. Mezi hlavní důvody tohoto stavu patří velmi nízká incidence onemocnění ve všeobecné populaci a nedostatek přesných, levných a neinvazivních diagnostických testů pro časné formy onemocnění [47,48]. Screening bývá v současnosti zvažován pouze u osob s nejméně jedním prvostupňovým příbuzným, který onemocněl karcinomem pankreatu (familiární) [37,48]. U familiárního výskytu riziko roste s počtem postižených prvostupňových příbuzných od 5 do 32, podle počtu výskytu v rodině [49]. Znalost rizikových faktorů může pomoci stratifikovat kritéria efektivněji a konkrétně přizpůsobit screening a strategii surveillance. Odhaduje se, že screening pro jedince ve vysokém riziku by neměl být v intervalech delších než 10–12 let [50]. Jako možné screeningové metody se u asymptomatických osob ve zvýšeném riziku jeví endoskopická ultrasonografie a magnetická rezonance, která je u těchto osob cenově efektivní metodou screeningu [48,51].
Závěr
Vlivy jednotlivých faktorů na výskyt karcinomu pankreatu se různí. Protože však vznik nádorových onemocnění je proces multifaktoriální, dá se předpokládat, že i u karcinomu pankreatu se jednotlivé vlivy shlukují (clustering) a modifikují. A právě znalosti těchto vlivů i jejich vzájemného působení lze využít v prevenci karcinomu pankreatu, a tím přispět k ovlivnění incidence tohoto onemocnění. V poslední době se při zkoumání rizikových faktorů karcinomu pankreatu obrací pozornost i na metabolická onemocnění (obezitu a diabetes) a také na soubor rizikových faktorů, které jsou součástí metabolického syndromu. Vzhledem k tomu, že specifická prevence v podobě efektivního screeningového programu neexistuje, je třeba věnovat pozornost také faktorům, které s tímto onemocněním souvisí a umožní včasnější záchyt karcinomu pankreatu, jako je například pankreatitida, diabetes mellitus a metabolický syndrom.
Práce byla podpořena grantem IGA MZČR č. NR 9029-4/2006.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 5. 2. 2013
Přijato: 26. 2. 2013
doc. MUDr. Helena Kollárová, Ph.D.
Ústav preventivního lékařství LF UP v Olomouci
Hněvotínská 3, 775 15 Olomouc
helena.kollarova@upol.cz
Zdroje
1. Shikata K, Ninomiya T, Kiyohara Y. Diabetes mellitus and cancer risk: Review of the epidemiological evidence. Cancer Sci 2012; 104(1): 9–14. doi: 10.1111/cas.12043.
2. Dítě P, Geryk E, Jelšíková M et al. How to define people at a high risk of pancreatic cancer. Vnitř Lék 2012; 58(7–8): 195–198.
3. Ben Q, Xu M, Ning X et al. Diabetes mellitus and risk of pancreatic cancer: A meta-analysis of cohort studies. Eur J Cancer 2011; 47(13): 1928–1937.
4. Dušek L, Mužík J, Pavlík T et al. Epidemiologie zhoubných nádorů trávicího traktu v České republice – současný stav a predikce. Gastroenterol Hepatol 2012; 66(5): 331–339.
5. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, [2005], [cit. 2012-9-18]. Dostupný z: http://www.svod.cz.
6. Bosetti C, Bertuccio P, Negri E et al. Pancreatic cancer: overview of descriptive epidemiology. Mol Carcinog 2012; 51(1): 3–13.
7. Olson SH, Kurtz RC. Epidemiology of pancreatic cancer and the role of family history. J Surg Oncol 2012; 107(1): 1–7. doi: 10.1002/jso.23149.
8. Pandol S, Gukovskaya A, Edderkaoui M et al. Epidemiology, risk factors, and the promotion of pancreatic cancer: role of the stellate cell. J Gastroenterol Hepatol 2012; 27 (Suppl 2): 127–134.
9. Bracci PM. Obesity and pancreatic cancer: overview of epidemiologic evidence and biologic mechanisms. Mol Carcinog 2012; 51(1): 53–63.
10. Urayama KY, Holcatova I, Janout V et al. Body mass index and body size in early adulthood and risk of pancreatic cancer in a central European multicenter case-control study. Int J Cancer 2011; 129(12): 2875–2884.
11. Li D, Morris JS, Liu J et al. Body mass index and risk, age of onset, and survival in patients with pancreatic cancer. JAMA 2009; 301(24): 2553–2562.
12. Hajer GR, van Haeften TW, Visseren FL. Adipose tissue dysfunction in obesity, diabetes, and vascular diseases. Eur Heart J 2008; 29(24): 2959–2971.
13. Baranova AV. Adipokine genetics: unbalanced protein secretion by human adipose tissue as a cause of the metabolic syndrome. Genetika 2008; 44(10): 1338–1355.
14. Genkinger JM, Spiegelman D, Anderson KE et al. A pooled analysis of 14 cohort studies of anthropometric factors and pancreatic cancer risk. Int J Cancer 2011; 129(7): 1708–1717.
15. Sovinová H, Sadílek P, Csémy L. Vývoj prevalence kuřáctví v dospělé populaci ČR, názory a postoje občanů ČR k problematice kouření (období 1997–2009). Státní zdravotní ústav 2010. Dostupné z: http://www.szu.cz/uploads/documents/czzp/zavislosti/koureni/Zprava2009DEF.pdf.
16. Lucenteforte E, La Vecchia C, Silverman D et al. Alcohol consumption and pancreatic cancer: a pooled analysis in the International Pancreatic Cancer Case-Control Consortium (PanC4). Ann Oncol 2012; 23(2): 374–382.
17. Tramacere I, Scotti L, Jenab M et al. Alcohol drinking and pancreatic cancer risk: a meta-analysis of the dose-risk relation. Int J Cancer 2010; 126(6): 1474–1486.
18. Stronks K, Van de Mheen H, Van den Bos J et al. The Interrelationship between Income, Health and Employment Status. Int J Epidemiol 1997; 26(3): 592–600.
19. Hsu C, Saif MW. Diabetes and pancreatic cancer. Highlights from the "2011 ASCO Annual Meeting". Chicago, IL, USA; June 3–7, 2011. JOP 2011; 12(4): 330–333.
20. DiMagno EP. Pancreatic cancer: clinical presentation, pitfalls and early clues. Ann Oncol 1999; 10 (Suppl 4): 140–142.
21. Permert J, Larsson J, Westermark GT et al. Islet amyloid polypeptide in patients with pancreatic cancer and diabetes. N Engl J Med 1994; 330(5): 313–318.
22. Schwarts SS, Zeidler A, Moossa AR et al. A prospective study of glucose tolerance, insulin, C-peptide, and glucagon responses in patients with pancreatic carcinoma. Am J Dig Dis 1978; 23(12): 1107–1114.
23. Greer JB, Whitcomb DC. Inflammation and pancreatic cancer: an evidence-based review. Curr Opin Pharmacol 2009; 9(4): 411–418.
24. Jee SH, Ohrr H, Sull JW et al. Fasting serum glucose level and cancer risk in Korean men and women. JAMA 2005; 293(2): 194–202.
25. Gapstur SM, Gann PH, Lowe W et al. Abnormal glucose metabolism and pancreatic cancer mortality. JAMA 2000; 283(19): 2552–2558.
26. Spector SA, Olson ET, Gumbs AA et al. Human insulin receptor and insulin signaling proteins in hepatic disease. J Surg Res 1999; 83(1): 32–35.
27. Chari ST, Leibson CL, Rabe KG et al. Pancreatic cancer-associated diabetes mellitus: prevalence and temporal association with diagnosis of cancer. Gastroenterology 2008; 134(1): 95–101.
28. Gullo L, Pezzilli R, Morselli-Labate AM et al. Diabetes and the risk of pancreatic cancer. N Engl J Med 1994; 331(2): 81–84.
29. Sadeghi N, Abbruzzese JL, Yeung SC et al. Metformin use is associated with better survival of diabetic patients with pancreatic cancer. Clin Cancer Res 2012; 18(10): 2905–2912. doi: 10.1158/1078-0432.CCR-11-2994.
30. Lee MS, Hsu CC, Wahlqvist ML et al. Type 2 diabetes increases and metformin reduces total, colorectal, liver and pancreatic cancer incidences in Taiwanese: a representative population prospective cohort study of 800,000 individuals. BMC Cancer 2011; 11 : 20.
31. Egawa N, Tu Y, Sanaka M et al. Family history of diabetes and pancreatic cancer. Pancreas 2005; 30(1): 15–19.
32. Chari ST, Leibson CL, Rabe KG et al. Probability of pancreatic cancer following diabetes: a population-based study. Gastroenterology 2005; 129(2): 504–511.
33. Pannala R, Leibson CL, Rabe KG et al. Temporal association of changes in fasting blood glucose and body mass index with diagnosis of pancreatic cancer. Am J Gastroenterol 2009; 104(9): 2318–2325.
34. Bonelli L, Aste H, Bovo P et al. Exocrine pancreatic cancer, cigarette smoking, and diabetes mellitus: a case-control study in northern Italy. Pancreas 2003; 27(2): 143–149.
35. Tsirambidis JV, Conwell DL, Zuccaro G. Chronic pancreatitis. Med Gen Med 2003; 5(1): 17.
36. Bhanot UK, Moller P. Mechanisms of parenchymal injury and signaling pathways in ectatic ducts of chronic pancreatitis: implications for pancreatic carcinogenesis. Lab Invest 2009; 89(5): 489–497.
37. Chakraborty S, Baine MJ, Sasson AR et al. Current status of molecular markers for early detection of sporadic pancreatic cancer. Biochim Biophys Acta 2011; 1815(1): 44–64.
38. Raimondi S, Lowenfels AB, Morselli-Labate AM et al. Pancreatic cancer in chronic pancreatitis; aetiology, incidence, and early detection. Best Pract Res Clin Gastroenterol 2010; 24(3): 349–358.
39. LaFemina J, Roberts PA, Hung YP et al. Identification of a novel kindred with familial pancreatitis and pancreatic cancer. Pancreatology 2009; 9(3): 273–279.
40. Tavani A, Rosato V, Di Palma F et al. History of cholelithiasis and cancer risk in a network of case-control studies. Ann Oncol 2012; 23(8): 2173–2178.
41. Kollárová H, Janoutová G, Foretová L et al. The risk factors of pancreatic cancer (Rizikové faktory karcinomu pankreatu). Klin Onkol 2006; 6 : 287–289.
42. Landi S. Genetic predisposition and environmental risk factors to pancreatic cancer: A review of the literature. Mutat Res 2009; 681(2–3): 299–307.
43. Schernhammer ES, Kang JH, Chan AT et al. A prospective study of aspirin use and the risk of pancreatic cancer in women. J Natl Cancer Inst 2004; 96(1): 22–28.
44. Larsson SC, Håkansson N, Giovannucci E et al. Folate intake and pancreatic cancer incidence: a prospective study of Swedish women and men. J Natl Cancer Inst 2006; 98(6): 407–413.
45. Bradley MC, Hughes CM, Cantwell MM et al. Non-steroidal antiinflammatory drugs and pancreatic cancer risk: a nested case-control study. Br J Cancer 2010; 102(9): 1415–1421.
46. Holly EA, Chaliha I, Bracci PM et al. Signs and symptoms of pancreatic cancer: a population-based case-control study in the San Francisco Bay area. Clin Gastroenterol Hepatol 2004; 2(6): 510–517.
47. Canto MI, Goggins M, Hruban RH et al. Screening for early pancreatic neoplasia in high-risk individuals: a prospective controlled study. Clin Gastroenterol Hepatol 2006; 4(6): 766–781.
48. Hucl T. Karcinom pankreatu (Pancreatic cancer). Gastroent Hepatol 2012; 66(5): 350–356.
49. Klein AP, Brune KA, Petersen GM et al. Prospective risk of pancreatic cancer in familial pancreatic cancer kindreds. Cancer Res 2004; 64(7): 2634–2638.
50. Brat DJ, Lillemoe KD, Yeo CJ et al. Progression of pancreatic intraductal neoplasias to infiltrating adenocarcinoma of the pancreas. Am J Surg Pathol 1998; 22(2): 163–169.
51. Canto MI, Hruban RH, Fishman EK et al. Frequent detection of pancreatic lesions in asymptomatic high-risk individuals. Gastroenterology 2012; 142(4): 796–804.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2013 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Mozkový natriuretický peptid je markerem horší prognózy při dekompenzaci jaterní cirhózy
- Multifokální hepatocelulární karcinom imitující jaterní cirhózu
- Chirurgická léčba metastáz hepatocelulárního karcinomu do nadledvin
- Kolonoskopie ve vodní imerzi s „capem“ – prospektivní, randomizovaná studie
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Metastatické postižení tenkého střeva jako první projev generalizace kožního melanomu
- Endoskopická léčba Zenkerova divertiklu
- Doporučené postupy Evropské společnosti pro gastrointestinální endoskopii (ESGE): profylaxe pankreatitidy po provedené ERCP
- Invazivní léčba chronické pankreatitidy je indikována pro bolesti, podezření na malignitu, biliární obstrukci, leak a cystoid
- Zdravotní stav a karcinom pankreatu
- Prevence pankreatitidy po ERCP
- 3rd Prague Endoscopy Workshop (and 14th Endoscopy Workshop in IKEM)
- Životní jubileum prof. MUDr. Marie Brodanové, DrSc.
-
Správná odpověď na kvíz
Intramurální hematom ve stěně rekta při antikoagulační terapii - Autodidaktický test: hepatologie
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Co nového v hepatologii?
-
Kvíz – případ z klinické praxe
Nečekaná příčina akutní renální insuficience vycházející z rekta - Doporučení České gastroenterologické společnosti pro podávání antiagregační terapie kyselinou acetylsalicylovou
- Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV) – aktualizace
- Danišův jícnový stent v terapii varikózního krvácení
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Danišův jícnový stent v terapii varikózního krvácení
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Prevence pankreatitidy po ERCP
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



