-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Účinnosť a bezpečnosť silymarínu u pacientov s chronickými chorobami pečene – multicentrická, prospektívna, otvorená klinická štúdia IMHOTEP
Efficiency and safety of silymarine in patients with chronic liver diseases – multicenter, prospective, open clinical trial IMHOTEP
Silymarine is the most commonly prescribed hepatoprotective medicine in real clinical practice. The evidence from the last decades has confirmed a relationship between its efficiency and dosing. The prescribing practice is actually not always fast enough to reflect the latest findings and changes in rational pharmacotherapy.
Design:
A multicenter, prospective, open clinical study IMHOTEP in patients with chronic hepatopathy of different etiology, indicated for chronic treatment with therapeutic dosing of silymarine as chosen by the doctor during a 36-week observation. Selected markers of hepatic injury (AST, ALT, GMT, ALP, total and conjugated bilirubin) as well as the objective symptoms and patients’ subjective complaints were monitored at defined time intervals.Population size and results:
A total of 1,069 patients were included, of which 594 (55.6%) were men with an average BMI of 29.4 kg/m2 and 475 (44.4%) were women with an average BMI of 29.1 kg/m2. The average age of males was significantly higher than that of women (57 ± 12 vs 50 ± 13 years) (p < 0.001). Etiologies of chronic liver disease were dominated by non-alcoholic fatty liver disease (41.3%), followed by alcohol (17.2%) and drug-induced (9.2%) etiology. Alcohol etiology was significantly more common among men (24.1 vs 8.6%; p < 0.001). Smoking was more common among men (26.7 vs 14%; p < 0.001). The average dose of silymarine in the entire population was 472 ± 131 mg/day in the initial phase of the study and 470 ± 162 mg/day at the end of the study, while in men the daily therapeutic dose (DTD) of silymarine was 20 mg higher on average. During treatment with silymarine (V0 vs V4) we recorded a statistically significant decrease in the markers of hepatic damage in ALT: 2.2 ± 1.47 µkat/L vs 0.75 ± 0.50 µkat/L (p < 0.001); AST: 1.07 ± 1.24 µkat/L vs 0.62 ± 0.37 µkat/L (p < 0.001); GMT: 2.82 ± 3.39 µkat/L vs 1.97 ± 1.52 µkat/L (p < 0.001); ALP: 1.66 ± 1.18 µkat/L vs 1.41 ± 0.68 µkat/L (p < 0.001). The total amount of bilirubin in the entire study group decreased non-significantly 15.7 ± 12.6 vs 15.3 ± 13.13 (p < 0.599), while the decline in conjugated bilirubin was statistically significant 5.7 ± 8.2 µmol/L ± 4.3 vs 3.3 µmol/L (p < 0.001). Although we did not find any statistically significant differences in the entry values or in the ALT, AST, or ALP activities changes between men and women, in men we recorded a more significant decrease of GMT, both types of bilirubin and ALP. In parallel with the decrease in laboratory markers, a statistically significant decrease in the perception of symptoms associated with chronic hepatopathy and an increase in the number of asymptomatic patients was recorded.Conclusions:
Treatment with silymarine has confirmed its hepatoprotective effects; we noticed a significant improvement in laboratory markers, as well as in the subjective and objective manifestations of chronic hepatic injury symptoms. The average dosing of silymarine over the entire course of the study was higher in comparison with the “traditional” dosing. We confirmed the relationship between the efficiency and the dosage of the medicine. Intersexual differences in efficiency were probably due to the higher values of the hepatic injury markers and higher prevalence of alcoholic etiology of chronic hepatopathy in men. In the course of the study no serious adverse effects related to the silymarine treatment were recorded.Key words:
chronic liver disease – hepatoprotective drugs – silymarine – intersexual differences – rational pharmacotherapy – adverse effects
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
20. 1. 2014Accepted:
18. 5. 2014
Autoři: J. Holomáň 1; P. Borecký 2; J. Lietava 3
Působiště autorů: Národné referenčné centrum pre liečbu chronických hepatitíd, SZU v Bratislave 1; ŠGN Podunajské Biskupice, UN Bratislava 2; II. interná klinika LFUK a UN Bratislava 3
Vyšlo v časopise: Gastroent Hepatol 2014; 68(4): 346-355
Kategorie: Hepatologie: původní práce
Souhrn
Silymarín patrí v reálnej medicínskej praxi medzi najčastejšie predpisované liečivo zo skupiny hepatík. V posledných rokoch boli publikované výsledky potvrdzujúce vzťah závislosti účinnosti na dávke liečiva. Reálna preskripčná prax nie vždy dostatočne rýchlo reaguje na novšie poznatky v oblasti racionálnej farmakoterapie.
Dizajn sledovania:
Multicentrická, prospektívna, otvorená klinická štúdia IMHOTEP v súbore pacientov s chronickými hepatopatiami rôznej etiológie, indikovaných k liečbe silymarínom v lekárom zvolenej dávke v 36-týždňovom období sledovania. V definovaných intervaloch boli sledované markery hepatálneho poškodenia (AST, ALT, GMT, ALP, celkový a konjugovaný bilirubín), objektívne symptómy i subjektívne ťažkosti pacientov.Súbor a výsledky:
1 069 pacientov, z toho 594 (55,6 %) mužov s priemerným BMI 29,4 kg/m2 a 475 (44,4 %) žien s priemerným BMI 29,1 kg/m2. Priemerný vek mužov bol významne vyšší ako u žien (57 ± 12 vs 50 ± 13 rokov) (p < 0,001). V etiológii chronickej hepatopatie dominovala tuková choroba pečene (41,3 %), nasledovaná alkoholovou (17,2 %) a poliekovou (9,2 %) etiológiou. Alkoholová etiológia bola významne častejšia u mužov (24,1 vs 8,6 %; p < 0,001). Fajčenie bolo častejšie u mužov (26,7 vs 14,0 %; p < 0,001). Priemerná dávka silymarínu v celom súbore bola 472 ± 131 mg v iniciálnej fáze sledovania a 508 ± 174 mg na konci sledovania, pričom u mužov bola denná terapeutická dávka (DTD) silymarínu v priemere o 20 mg vyššia. V priebehu liečby silymarínom (V0 vs V4) sme zaznamenali štatisticky významný pokles markerov hepatálneho poškodenia ALT: 1,47 ± 2,22 µkat/l vs 0,75 ± 0,50 µkat/l (p < 0,001); AST: 1,07 ± 1,24 µkat/l vs 0,62 ± 0,37 µkat/l (p < 0,001); GMT: 2,82 ± 3,39 µkat/l vs 1,52 ± 1,97 µkat/l (p < 0,001); ALP: 1,66 ± 1,18 µkat/l vs 1,41 ± 0,68 µkat/l (p ± 0,001). Hodnoty celkového bilirubínu v celom súbore poklesli nevýznamne 15,7 ± 12,6 vs 15,3 ± 13,13 (p < 0,599), kým rozdiel v poklese konjugovaného bilirubínu bol štatisticky významný: 5,7 ± 8,2 µmol/l vs 4,3 ± 3,3 µmol/l (p < 0,001). Hoci sme nezistili štatisticky významný rozdiel medzi hodnotami vstupných aktivít a ani medzi zmenami aktivity ALT, AST, ALP medzi mužmi a ženami počas liečby, u mužov sme zaznamenali signifikantne výraznejší pokles GMT, oboch typov bilirubínu a ALP. Analogicky s poklesom laboratórnych markerov došlo v celom súbore aj k štatisticky významnému poklesu percepcie symptómov asociovaných s chronickou hepatopatiou a k nárastu počtu asymptomatických pacientov.Záver:
Liečba silymarínom potvrdila jeho hepatoprotektívny efekt. Zaznamenali sme normalizáciu laboratórnych markerov hepatálneho poškodenia, ako aj subjektívnych i objektívnych prejavov chronickej hepatopatie. Priemerná dávka silymarínu v priebehu celého sledovania bola vyššia v porovnaní s „tradičným“ dávkovaním. Potvrdili sme vzťah účinnosti v závislosti na dávke liečiva. Intersexuálne rozdiely v účinnosti boli pravdepodobne podmienené vyššími vstupnými hodnotami markerov hepatálneho poškodenia a vyšším zastúpením alkoholovej etiológie chronickej hepatopatie u mužov. V priebehu štúdie sme nezaznamenali žiadne závažnejšie nežiaduce účinky liečby.Kľúčové slová:
chronická hepatopatia – hepatiká – silymarín – intersexuálne rozdiely – racionálna farmakoterapia – nežiaduce účinky
Liečba chronického ochorenia pečene hepatikami patrí dlhodobo medzi neuspokojivo riešené terapeutické problémy. Tie sú podmienené zložitosťou interakcie medzi hepatotoxickým prostredím, komplexnosťou hepatálneho poškodenia a nedostatočným diapazónom hepatík. V posledných rokoch boli publikované dáta o vzťahu účinnosti a dávky silymarínu [1,2]. Reálna terapeutická prax nezriedka zaostáva za výsledkami vedecky dokladovanej medicíny (EBM – evidence based medicine). Napriek dlhoročným skúsenostiam s hepatikami stále nie sú jednoznačne stanovené dávkovacie schémy a dávkovanie je závislé od aktuálneho klinického stavu pacienta a aktuálneho rozhodnutia lekára, ktoré však neraz vychádza z empirických poznatkov.
Terapeutická rozvaha lekára by však mala zohľadniť aktuálny stav pacienta a realizovať liečbu v súlade s princípmi racionálnej farmakoterapie podopretej výsledkami EBM [3–7]. Cieľom štúdie IMHOTEP bolo overiť účinnosť a bezpečnosť liečby silymarínom, ako aj reálne preskripčné správanie v ambulantnej praxi, a faktory, ktoré ho ovplyvňujú.
Metodika
Do multicentrickej, prospektívnej, otvorenej klinickej štúdie bolo zaradených 1 069 ambulantných pacientov s chronickou hepatopatiou. Štúdia sa uskutočnila v 98 internistických, gastroenterologických a hepatologických ambulanciách Slovenska.
Vstupné kritériá zahŕňali potvrdenú diagnózu chronickej hepatopatie s pretrvávajúcimi zvýšenými markermi hepatálneho poškodenia. Do štúdie mohli byť zaradení aj pacienti, ktorí doteraz užívali silymarín v dennej terapeutickej dávke (DTD) ≤ 150 mg po dobu aspoň troch posledných mesiacov. Štúdia bola vykonaná so súhlasom etickej komisie.
Subjekty štúdie boli poučené o základných cieľoch sledovania a po podpísaní informovaného súhlasu im bola odobratá anamnéza, zahŕňajúca prítomnosť rizikových faktorov (kontakt s potenciálnymi toxickými noxami: alkohol, ťažké kovy, prchavé látky, priemyselné hnojivá, herbicídy, drogy, aktívne i pasívne fajčenie, lieky, interkurentné infekčné ochorenie, kontraceptíva, iné nešpecifikované toxické látky). Pacienti si viedli „Toxikologický denník“, do ktorého si zaznamenávali expozíciu uvedeným noxám v priebehu štúdie.
V rámci špecifikácie hepatopatie bola zaznamenaná primárna diagnóza (kategorizovaná ako NAFLD/nealkoholová steatohepatitída, alkoholová steatóza, alkoholová hepatitída, cirhóza alkoholová, cirhóza postvírusová, cirhóza biliárna, venostatická pečeň pri chronickom srdcovom zlyhaní, poškodenie pečene pri hemochromatóze a iná etiológia (graf 1).
Graf 1. Štruktúra diagnóz chronickej hepatopatie. Graph 1. Chronic hepatopathy diagnoses structure. 
Primárna etiológia bola kategorizovaná ako NAFLD, polieková, alkoholová, vírusová, autoimunitná, iná a nešpecifikovaná. Štádium chronickej hepatopatie bolo charakterizované prítomnosťou fibrózy (neprítomná, mierna, stredná a ťažká) [8–10], cirhózy (kompenzovaná, dekompenzovaná) alebo nešpecifikované (graf 2). Aktivita chronickej hepatopatie bola definovaná ako nízka, stredná a vysoká (graf 3). Trvanie hepatopatie bolo definované v rokoch. Subjektívne ťažkosti asociované s chronickou hepatopatiou boli klasifikované pomocou semikvantitatívnej škály (0–5). Počas anamnézy boli hodnotené nasledujúce parametre súvisiace s gastrointestinálnymi symptómami (nechutenstvo, nauzea, meteorizmus, tlak pod pravým rebrovým oblúkom), psychickými ťažkosťami (únavnosť, podráždenosť, neschopnosť koncentrácie, bolesť hlavy) a muskulokutánne prejavy (bolesť svalov a kĺbov, svrbenie kože, suchosť kože).
Graf 2. Štádium chronickej hepatopatie podľa stupňa fibrózy. Graph 2. Chronic hepatopathy staging. 
Graf 3. Aktivita chronickej hepatopatie. Graph 3. Chronic hepatopathy activity. 
V objektívnom vyšetrení sa zrealizovali základné antropometrické merania (výška, váha, obvod pása) a bola hodnotená prítomnosť/absencia ikteru, ascitu, pavúčikových névov a palmárneho erytému. Z venóznej krvi boli v certifikovaných laboratóriách štandardným postupom [11] stanovené základné markery hepatálneho poškodenia (gamaglutamyltransferáza – GMT, aspartátaminotransferáza – AST, alanínaminotransferáza – ALT, alkalická fosfatáza – ALP, nekonjugovaný a konjugovaný bilirubín), základné hematologické markery (hemoglobín, erytrocyty, trombocyty). V rámci stanovenia rizikového profilu bolo vyšetrené lipidové spektrum (celkový a HDL cholesterol, triglyceridy) a glykémia. LDL cholesterol bol vypočítaný štandardným spôsobom metódou podľa Friedewalda. U diabetikov bola vyšetrená aj hladina glykovaného hemoglobínu. Krvný tlak bol zmeraný v sediacej polohe trikrát za sebou štandardným spôsobom.
Pacienti boli liečení silymarínom po dobu 36. týždňov s definovanými intervalmi medzi kontrolami V0 (0. týždeň), V1 (8. týždeň), V2 (20. týždeň), V3 (28. týždeň) a V4 (36. týždeň), pri ktorých boli vyšetrované základné markery hepatálneho poškodenia. Dávkovanie silymarínu určoval lekár na základe klinického stavu a priebežného laboratórneho nálezu u každého pacienta individuálne. Na konci štúdie bol zrealizovaný kompletný vyšetrovací protokol – anamnestické, objektívne i laboratórne vyšetrenie. Medikácia: silymarín (Lagosa), 1 tbl s obsahom 150 mg silymarínu.
Štatistické spracovanie
Všetky individuálne pacientske dáta podliehali pri vstupe krížovej kontrole. Pri štatistickom spracovaní boli zohľadnené rôzne referenčné pásma pre fyziologické hodnoty pre ALT, AST, GMT, ALP a celkový bilirubín. Hodnoty boli prepočítané ako normálne a patologické pre každé pohlavie [11]. Normalita rozloženia nameraných parametrických dát bola testovaná K-S testom. Normálne distribuované numerické dáta boli hodnotené párovým dvojcestným t-testom. Heterogénne distribuované numerické dáta z dvoch meraní (napr. celkový cholesterol, HDL a LDL cholesterol, glykémia a triglyceridy) boli hodnotené Wilcoxonovým znakovým testom pre spárované parametre. Semikvantitatívne kategorizované subjektívne ťažkosti boli hodnotené neparametrickým Wilcoxonovým znakovým testom pre spárované parametre.
Na analýzu vzťahu zmien markerov hepatálneho poškodenia počas jednotlivých vizít sme použili buď Friedmanovu analýzu alebo ANOVA pre opakované merania. V rámci analýzy efektu liečby bola urobená mnohopočetná regresná analýza (metóda stepwise) so závislým parametrom delta marker, napr. AST (rozdiel medzi prvým a posledným meraním) a viacerými parametrami s cieľom určiť, ktoré zo sledovaných parametrov predikujú efekt terapie. Binominálne parametre sme hodnotili xi kvadrátom, v prípade početnosti výskytu javu v niektorej položke menej ako päť s použitím Yatesovej korekcie. Za hladinu štatistickej významnosti sme zvolili hodnotu p < 0,05.
Výsledky
Do multicentrického prospektívneho otvoreného sledovania bolo zaradených 1 069 pacientov, z toho 594 (55,6 %) mužov a 475 (44,4 %) žien. Muži boli významne starší ako ženy (57 ± 12 ro-kov vs 50 ± 13 rokov; p < 0,001) a čas-tejšie fajčili (26,7 vs 14,0 %; p < 0,001). Obe pohlavia mali porovnateľný BMI a krvný tlak. Liečba silymarínom bola novoiniciovaná u 1 012 pacientov a pokračujúca u 57 pacientov, pričom v 27 prípadoch boli porušené zaraďovacie kritériá (DTD silymarínu ≤≤ 150 mg/deň) a títo pacienti neboli ďalej hodnotení. Až na hodnotu GMT (1,88 vs 2,87 ukat/l; p < 0,048), ktorá bola pri zaradení pacientov do sledovania nižšia v súbore pacientov s pokračujúcou liečbou silymarínom, sme nezistili efekt predchádzajúcej liečby nízkymi dávkami silymarínu na hodnoty markerov hepatálneho poškodenia.
V celom súbore na začiatku sledovania bola priemerná denná terapeutická dávka silymarínu 472 ± 131 mg. V priebehu štúdie sme zaznamenali mierne zvýšenie celkovej priemernej dávky na 508 ± 174 mg na konci sledovania. Terapia bola upravovaná u viac ako štvrtiny pacientov (n = 298; 27,9 %). Muži mali v priebehu celej štúdie približne o 20 mg vyššiu priemernú dávku silymarínu.
Liečba silymarínom navodila štatisticky významný pokles markerov hepatálneho poškodenia (celý súbor V0 vs V4): ALT: 1,47 ± 2,22 µkat/l vs 0,75 ±± 0,50 µkat/l (p < 0,001); AST: 1,07 ±± 1,24 µkat/l vs 0,62 ± 0,37 µkat/l (p < 0,001); GMT: 2,82 ± 3,39 µkat/l vs 1,52 ± 1,97 µkat/l (p < 0,001); ALP: 1,66 ± 1,18 µkat/l vs 1,41 ± 0,68 µkat/l (p < 0,001). Hodnoty celkového bilirubínu poklesli len nevýznamne: 15,7 ±± 12,6 vs 15,3 ± 13,13, p < 0,599; zatiaľ čo pokles konjugovaného biliru-bínu bol štatisticky významný: 5,7 ±± 8,2 µmol/l vs 4,3 ± 3,3 µmol/l (p < 0,001) (graf 4–5).
Graf 4. Dynamika zmien aktivít ALT a AST v celom súbore. Graph 4. Dynamics of activity changes in SGOT and SGPT in the whole study population. 
Graf 5. Dynamika zmien aktivít GMT a ALP v celom súbore. Graph 5. Activity changes dynamics in GGPT and ALP in the whole study population. 
Terapeutický efekt sa signifikantne zvyšoval so zvýšením dávky silymarínu. Dávkovanie 1 350 mg bolo štatisticky nehodnotiteľné pre malý počet (n = 5) subjektov (tab. 1).
Tab. 1. Efekt terapie v závislosti na dávke silymarínu. Tab. 1. Therapeutic effect (as δ in enzyme activity) in relationship to silymarine dosage. 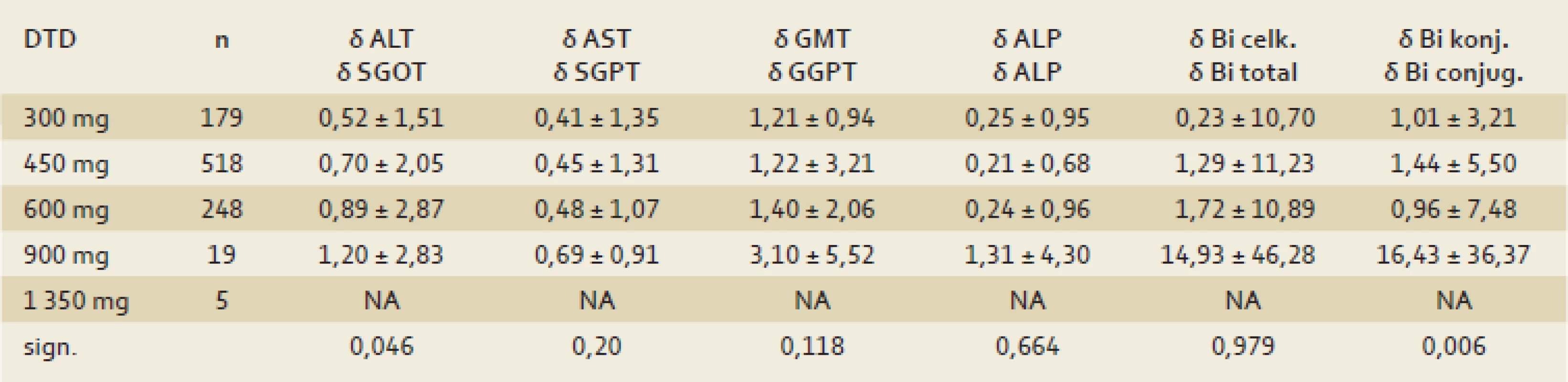
DTD: denná terapeutická dávka (daily treatment dose) Pri hodnotení subjektívnych ťažkostí pacientov sa dokázal významný nárast počtu asymptomatických pacientov (graf 6). U pacientov, ktorí naďalej udávali subjektívne ťažkosti, významne poklesla intenzita ťažkostí.
Graf 6. Porovnanie počtu asymptomatických pacientov na začiatku a na konci štúdie. Graph 6. Comparison of the number of asymptomatic patients at the beginning and at the study end. 
Pri analýze intersexuálnych rozdielov sme potvrdili štatisticky významne vyššie vstupné hodnoty GMT a oboch foriem bilirubínov u mužov. Ženy mali vyššie vstupné hodnoty alkalickej fosfatázy. Hoci sme nezistili štatisticky významný rozdiel medzi vstupnými hodnotami aktivít a ani medzi zmenami aktivity ALT, AST, ALP medzi mužmi a ženami počas liečby, u mužov sme zaznamenali signifikantne výraznejší pokles GMT a oboch typov bilirubínu a ALP (tab. 2).
Tab. 2. Dynamika zmien hodnôt markerov hepatálneho poškodenia podľa pohlavia. Tab. 2. Comparison of hepatic markers changes dynamics according to the gender. 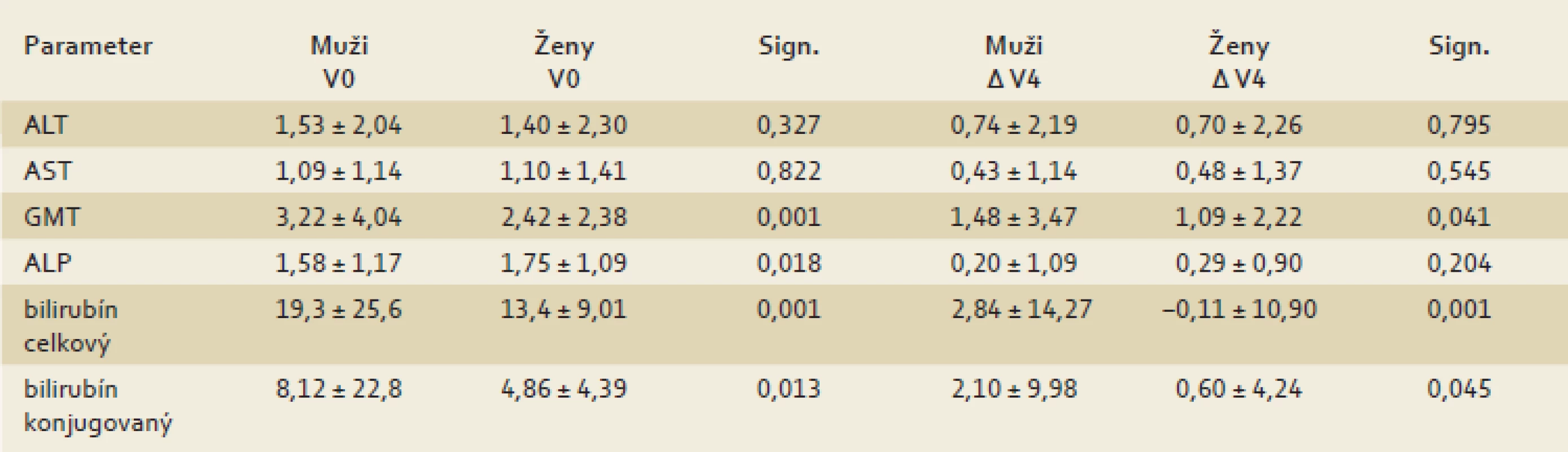
Diskusia
Hoci v Edwin-Smithovom papyruse, ktorý sa považuje za neskorší prepis Imhotepových traktátov o starobylej chirurgii, dietológii a naturálnej herbálnej medicíne z dôb faraóna Džósera (3. dynastia, cca 2600 p. n. l.), nie je explicitne zmienka o liečivej sile silymarínu, Imhotepovi sa pripisuje – okrem iných významných atribútov – titul „praotca“ starovekej medicíny. Prvá zmienka o terapeutickom použití silymarínu v kontexte európskej medicíny pochádza z čias antického Grécka od Pedania Dioskoridesa z anatolijského Azanurbusu, ktorý v rokoch 50–70 n. l. napísal prvý herbár „De Materia Medica“, používaný ako referenčný liekopis až do neskorého stredoveku [12].
Napriek takmer dvetisícročnému empirickému používaniu silymarínu a uskutočneniu viacerých klinických štúdii v 20. storočí, sa až začiatkom 21. storočia podujala moderná experimentálna a klinická farmakológia definovať základné klinicko-farmakologické vlastnosti silymarínu, resp. jeho frakcií. Najvýznamnejšie sú zistenia o farmakokinetike silymarínu.
Silymarín má relatívne nízku biologickú dostupnosť, len cca 23–47 % orálne podaného silymarínu je merateľných v plazme [13]. Účinné plazmatické hladiny vzhľadom na krátky biologický polčas (2–6 hod podľa jednotlivých frakcií flavonolignanov) je potrebné udržiavať dávkovaním trikrát denne, pričom až pri vysokom dávkovaní (≥ 280 mg jednotlivá dávka) je možné udržať ustálené hladiny všetkých frakcií, ktoré sa navyše líšia svojím imunomodulačným a antioxidačným účinkom [14]. V porovnaní pacientov so zdravou pečeňou je celkové množstvo merateľných flavonolignanov v plazme (AUC 0–24h) 2,4-krát väčšie u pacientov s chronickou hepatitídou C, 3,3-krát väčšie u pacientov s NAFLD a až 4,7-krát väčšie u pacientov s cirhózou pečene [15]. Veľké očakávania priniesli informácie o virostatickom účinku silymarínu, resp. jeho flavonoidných frakcií v podmienkach in vitro i v klinickej praxi. Vnútrožilovo podaný silibinín v dávke 10–20 mg/kg po dobu siedmich dní dokázal navodiť kompletnú blokádu replikácie vírusu (merané hladinami HCV-RNA) u pacientov so zlyhaním liečby dvojkombináciou pegylovaným interferónom (PEG IFN) s ribavirínom (RBV) [16]. Podobne u pacientov s ortotopickou transplantáciou pečene vnútrožilovo podávaný silibinín bránil reinfekcii graftu. V malej prospektívnej, placebom kontrolovanej dvojito zaslepenej štúdii v súbore 14 pacientov s chronickou hepatitídou C (CHC) bolo liečených 21 dní pred a sedem dní po transplantácii pečene. Parenterálna liečba signifikantne znížila replikáciu vírusu (HCV-RNA) [17]. Podobné výsledky potvrdzujú aj iné pozorovania [18–20]. Tento účinok nebol potvrdený v dobre vedenej „dose finding study“ (SyNCH) v súbore 154 pacientov rezistentných na dvojkombináciu IFN/RBV s orálne dávkovaným silymarínom 420 alebo 700 mg/deň vs placebo, kde ani vyššie dávky nedokázali zlepšiť primárny sledovaný parameter ALT [21]. Vo viac ako osemročnom sledovaní v súbore 1 049 voči PEG IFN/RBV rezistentnej skupiny pacientov v štúdii HALT-C (Hepatitis C antiviral long-term treatment against cirrhosis) podskupina pacientov, ktorá užívala silymarín už pri zaradení do sledovania, mala napriek vyšším vstupným hodnotám ALT, nižšiemu indexu AST/ALT, resp. prítomným pažerákovým varixom menší obsah kolagénu v pečeni a v priebehu sledovania pomalšiu progresiu fibrózy, potvrdenú celkovo tromi biopsiami u každého pacienta (pri zaradení, po 18 a 42 mesiacoch) [22]. Tieto závery podporujú dnešné chápanie silymarínu a jeho jednotlivých frakcií ako hepatika s vlastnosťami inhibítora replikácie vírusov, vírusmi indukovaného oxidačného stresu, inhibítora na NF-κB závislej transkripcie a TCR mediovanej proliferácie [23].
Druhou, a z hľadiska epidemiológie ešte frekventovanejšou diagnózou, je nealkoholová tuková choroba pečene (NAFLD). Aj keď sa dnes diskutuje názor, že steatohepatitída môže byť aj samostatnou entitou s etiológiou „nad rámec“ teórie „dvojitého úderu“ [24], v smerniciach odborných spoločností sa steatohepatitída (NASH) charakterizuje ako vyššie štádium NAFLD s vystupňovanými zápalovými, nekrotickými a prípadne fibro-proliferatívnymi zmenami [25,26]. V rutinnej ambulantnej praxi je nezriedka prítomné a neriešené „len“ zvýšenie sérových aminotransferáz. V rámci sústredenia záujmu na „metabolický syndróm“ (MS), ktorý je v centre pozornosti najmä vo vzťahu ku kardiovaskulárnym komplikáciám, došlo k prehĺbeniu poznatkov o úlohe pečene pri jeho vzniku. Pochopenie vzniku inzulínovej rezistencie posunulo pečeň z pozície „orgánovej komplikácie“ MS na pozíciu „iniciátora“ – predovšetkým pre objasnenie úlohy voľných mastných kyselín vo vzťahu k samotnej inzulínovej rezistencii [27]. Úloha silymarínu v tejto indikácii sa chápe predovšetkým ako úloha „hasiča“ oxidačného stresu, indukovaného metabolickým stresom pri inzulínovej rezistencii. V každom prípade je klinická prítomnosť „fenotypu MS“ rizikovým faktorom aj pre prítomnosť hepatopatie. Preto by klinicky stanovená diagnóza metabolického syndrómu mala viesť automaticky aj k zhodnoteniu aktuálneho funkčného i morfologického stavu pečene. Pri prevalencii MS 25–48 % v slovenskej populácii by to mala byť výzva nielen pre hepatológov [10,28,29]. Silymarín vo viacerých štúdiách normalizoval nielen markery pečeňového poškodenia (AST, ALT, ALP), oxidačného stresu, či zápalu, ale zlepšil parametre glykemickej kontroly (HbA1c, GNL, PPG) i lipidového spektra (TAG, HDL) [30–35].
Napriek dnes už známej klinickej farmakológii silymarínu sa v každodennej klinickej praxi naďalej používajú „empirické“ dávky silymarínu 60–140 mg/deň. Metaanalýzy klinických štúdií so silymarínom jasne ukázali, že pozitívny efekt na sledované cieľové parametre, vrátane mortality súvisiacej s pečeňovým ochorením, bol dosiahnutý len pri dennej terapeutickej dávke 420 mg a viac [1,2,31]. Slabinou uvedených štúdií je však skutočnosť, že hodnotili populácie s veľmi heterogénnou etiológiou hepatopatií v rôznych štádiách progresie. To sa často podieľalo aj na oslabení štatistickej významnosti zistených zmien. Vzhľadom na už spomenuté, logicky najefektívnejšia liečba bola pri včasných štádiách poškodenia pečene (Child-Pugh A). Aj rozdiely medzi výsledkami pri sledovaní in vitro či rozdiely v inhibícii replikácie vírusu v klinických štúdiách možno vysvetliť klinicko-farmakologicky. Kým dávka 700–1 400 mg silibinínu vnútrožilovo bola efektívna, pri orálnej liečbe rovnakou dávkou boli dosahované len 100 až 1 000-krát nižšie plazmatické koncentrácie jednotlivých frakcií silymarínu a len okrajový efekt liečby [14].
Vyššie stručne sumarizované novšie poznatky v oblasti klinickej farmakológie silymarínu, ako aj narastajúci význam a početnosť chronických chorôb pečene [36,37] viedli k iniciácii našej štúdie. Cieľom multicentrickej, prospektívnej, otvorenej klinickej štúdie bolo sledovanie účinnosti, bezpečnosti silymarínu, ako aj manažmentu pacientov s chronickými chorobami pečene v reálnej klinickej praxi. Do sledovania bolo zaradených 1 069 pacientov s chronickými chorobami pečene v 98 ambulanciách internistov, gastroenterológov a hepatológov. Zaujalo zloženie súboru z pohľadu etiológie a diagnóz sledovaných subjektov. Potvrdila sa až neštandardne vysoká prevalencia NAFLD (68,3 %) – a relatívne nízka účasť alkoholovej choroby pečene (ALD). Tieto zistenia vyžadujú ďalšiu analýzu a predznamenávajú očakávaný nárast NAFLD v populácii. Prekvapivým bolo i zistenie relatívne vysokého percenta poliekovej etiológie (9,2 %). Podrobnejšia analýza tohto zistenia presahuje rámec tejto publikácie a bude predmetom samostatnej analýzy. Predstavuje však významný signál pre venovanie sa tomuto fenoménu v reálnej klinickej praxi. V sumárnom pohľade išlo o chronické hepatitídy prevažne v štádiu nízkej aktivity (63 %) a miernej progresie (51,5 % – neprítomnosť fibrózy pečene – F0). Toto predstavuje pozitívny signál včasného záchytu rozvoja chronického ochorenia pečene v ambulantnej praxi, keď je najlepší predpoklad na spomalenie, resp. zastavenie ďalšieho rozvoja chronického ochorenia pečene racionálnym rozhodnutím o liečbe daného ochorenia.
Analýza liečebného profilu, resp. dávky a dávkovania sledovaného liečiva ukázala, že správanie predpisujúcich lekárov bolo relatívne v súlade s novšími poznatkami výskumu. Denná dávka silymarínu sa pohybovala medzi 300 a 1 350 mg. Priemerná dávka silymarínu bola okolo 500 mg/deň (podrobnejšie v kapitole Výsledky). Toto zistenie je pozitívne v zmysle prekonania tradičnej schémy dávkovania, keď dochádzalo nezriedka k významnému poddávkovaniu, resp. k liečbe dennými dávkami 65–150 mg silymarínu – vrátane „liečby“ rôznymi voľnopredajnými hepatikami (výživovými doplnkami). Hoci si uvedomujeme štatistické limitácie pri hodnotení disproporcionálnych súborov, nezistili sme, až na nižšiu hodnotu GMT, efekt predchádzajúcej liečby nízkymi dávkami silymarínu v dávke ≤ 150 mg/deň (tab. 3). Prejavila sa však pozitívna korelácia medzi použitou dávkou silymarínu a poklesom markerov aktivity (ALT, AST). Prekvapivé bolo zistenie, že do súboru boli zaradení prevažne novozistení/novoindikovaní pacienti. Možno to pripočítať k nezanedbateľnému edukačnému významu samotnej štúdie. Takmer tretina súboru bola pred zaradením do štúdie liečená rôznymi inými neracionálne (zvykovo) indikovanými terapeutikami, kde prevažovali multivitamíny a esenciálne fosfolipidy, hoci tieto liečivá nie sú uvedené v súčasných odporúčaniach odborných spoločností na liečbu NAFLD [25].
Tab. 3. Porovnanie vstupných hodnôt markerov pečeňového poškodenia u pacientov s novoiniciovanou liečbou a u pacientov na liečbe po dobu ≥ 3 mesiacov s dávkou silymarínu ≤ 150 mg/deň. Tab. 3. Comparison of the entry hepatic injury markers values in newly treatment initiated patients with patients on silymarin ≥ 3 months treatment on the dose ≤ 150 mg/day. 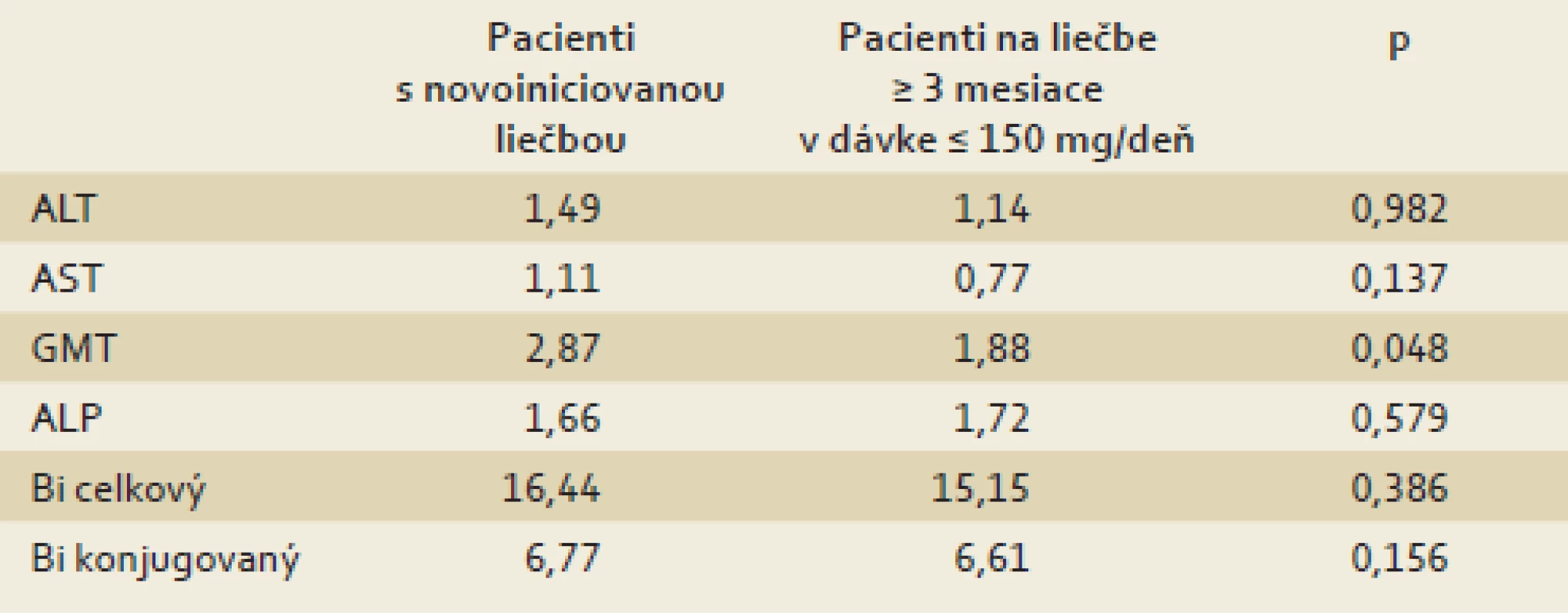
Významným a do istej miery aj prekvapivým zistením bolo sledovanie efektu liečby na správanie sa v praxi najčastejšie používaných tzv. hepatálnych testov (ALT, AST). V priebehu medikácie po ôsmich týždňoch (V1) sme zaznamenali štatisticky vysoko významný pokles týchto parametrov a v ďalšom priebehu štúdie (V2–V4) došlo postupne k ich ďalšiemu poklesu až do rozsahu referenčného rozmedzia. V klinickom vnímaní to znamená neprítomnosť humorálnych znakov aktivity chronického ochorenia pečene, čo je významný predpoklad zastavenia progresie samotného ochorenia. Uvedomujeme si nekontrolovaný dizajn štúdie (charakter a cieľ štúdie neumožňoval inú, resp. kontrolovanú formu štúdie). Napriek teoreticky možným iným kofaktorom to interpretujeme ako významný efekt liečby. Významné bolo zlepšenie subjektívnych ťažkostí pacientov – kvality života sledovaného súboru, čo korešponduje s výsledkami aj iných štúdií, napr. HALT-C [38]. To potenciálne môže mať významný dopad na správanie sa pacienta a jeho postoj k liečbe a zodpovednosti za vlastné zdravie.
V takmer 50 % prípadoch sme evidovali asociáciu konkomitantného užívania liekov s hepatotoxickým potenciálom, kým expozícia iným noxám (organické rozpúšťadlá, herbicídy, umelé hnojivá, ťažké kovy) varírovala v rozmedzí 2,8–8 %. Návykové látky pripúšťalo 1,1 % pacientov, pričom 26 % pacientov s hepatopatiou boli fajčiari. Ako už bolo spomínané, kauzálny vzťah lieku ako etiopatogenetického agens vzniku hepatopatie bol však identifikovaný len v 9,3 %. V prípade priemyselných nôx došlo k relatívnemu poklesu expozície týmto škodlivinám ku koncu sledovaného obdobia.
Hoci sa fajčenie od dôb Framinghamskej štúdie považuje za jeden z najzávažnejších kardiovaskulárnych rizikových faktorov a osveta argumentuje práve rizikom fatálnych cerebrovaskulárnych, či kardiálnych príhod alebo rizikom amputácií v dôsledku PAO, asociácia nikotinizmu a hepatocelulárneho karcinómu je dnes zoširoka akceptovaná [39–41]. Nikotinizmus sa u pacientov s CHC spája s vyššími hodnotami zápalovej aktivity, zrýchlenou fibrogenézou a závažnejším poškodením pečeňového parenchýmu [42,43]. V našom súbore boli fajčiari zastúpení v 26 %. Potvrdil sa u nich štatisticky významný vyšší výskyt ikteru, ascitu, pavúčikových névov a palmárneho erytému, čo sprevádzala aj iniciálne vyššia hodnota GMT (3,87 vs 2,6; p < 0,001) a jej pomalší pokles (V4 : 1,7 vs 1,47 ukat/l; NS), čo sa nepotvrdilo pre ALT a AST. Sledovaním nežiaducich účinkov sme potvrdili známu skutočnosť o vysokom bezpečnostnom profile sledovaného liečiva [1,2,44].
V priebehu sledovania sa nevyskytli žiadne závažnejšie nežiaduce účinky liečby. V dvoch prípadoch bola liečba prerušená (bolesť pod PRO; bolesť žalúdka) bez súvislosti so sledovaným liečivom (tab. 4).
Tab. 4. Nežiaduce účinky. Tab. 4. Side effects. 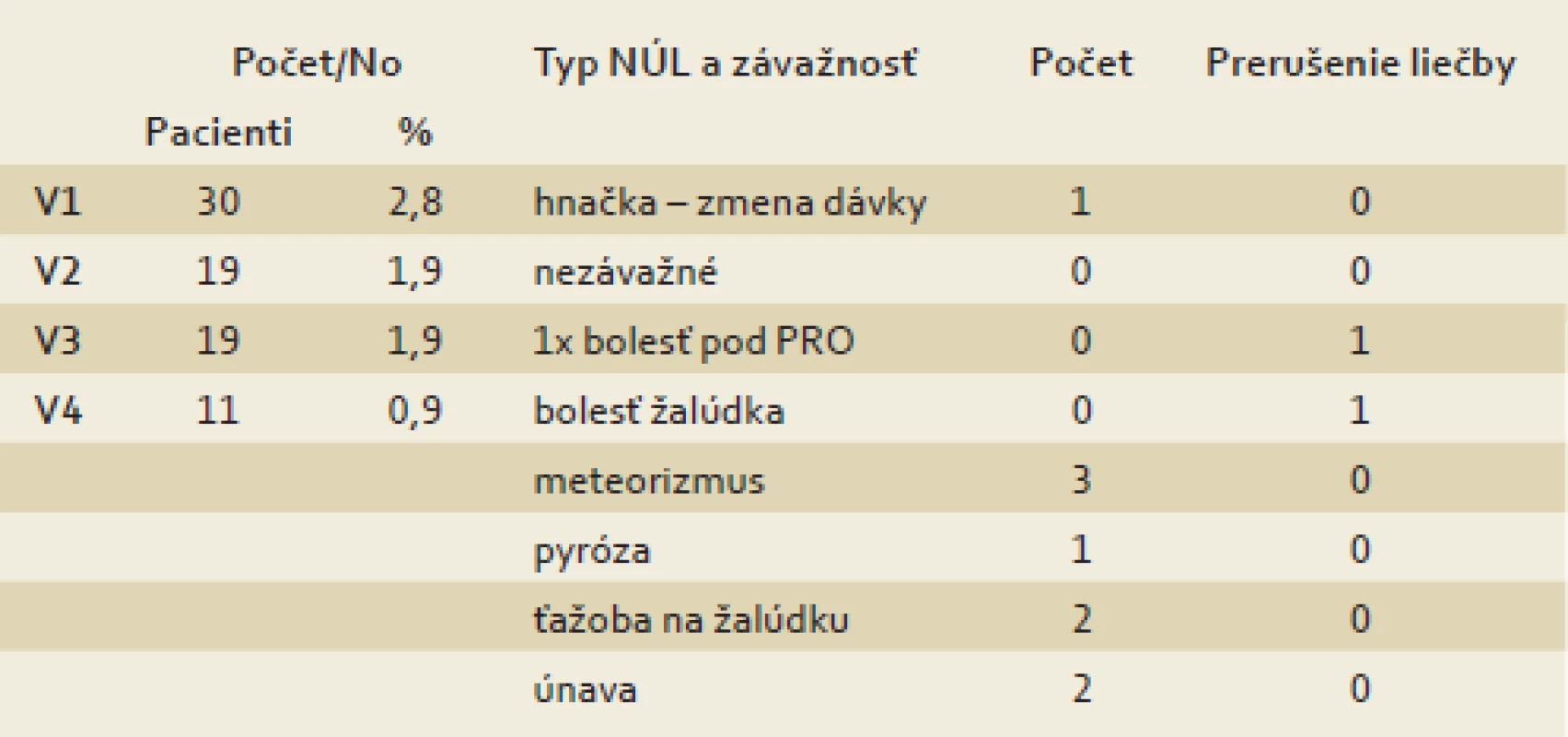
Záver
Liečba silymarínom potvrdila hepatoprotektívny efekt sledovaného liečiva, vyjadrený normalizáciou laboratórnych markerov poškodenia pečene, ako aj zlepšenie subjektívnych i objektívnych prejavov u pacientov s chronickými hepatopatiami. Priemerná dávka silymarínu (508 ± 174 mg//deň) bola vyššia v porovnaní s obvyklým „tradičným“ dávkovaním. Potvrdili sme vzťah účinnosti v závislosti na dávke sledovaného liečiva, pričom sa nepotvrdila dostatočná efektivita dennej terapeutickej dávky silymarínu ≤ 150 mg/deň. Intersexuálne rozdiely v účinnosti boli pravdepodobne podmienené vyššími vstupnými hodnotami markerov hepatálneho poškodenia a vyšším zastúpením alkoholovej etiológie chronickej hepatopatie u mužov. V priebehu štúdie sme nezaznamenali žiadne závažnejšie nežiaduce účinky liečby.
Poďakovanie riešiteľom
Adamcová-Selčanová S; Adásková Z; Al Radman W; Albertová-Martinovičová M; Bačíková Z; Baláž D; Baník M; Beňová K; Bemátová A; Blaha P; Bočáková J; Bollová D; Čarnoký M; Danningerová-Molnárová A; Dorosiaková E; Drozdáková E; Dudášová I; Fabiánová A; Fiedler A; Filová M; Garaiová J; Hájek L; Hervay E; Chachaľáková J; Imrichová M; Jurisa M; Jutka J; Kaletová K; Kališová I; Kasalová Ľ; Kirka M; Kmecíková H; Koller T; Krajňák J; Krakovská J; Králik R; Kravčák J; Kršák J; Krupša R; Kujnisch F; Kuročka J; Lacková D; Lenická Z; Lenner E; Lennerová J; Leško A; Mačugová I; Malachovská K; Malgotová I; Mančíková I; Maruškin D; Meliš P; Mičík J; Michálková Ľ; Mikoláš J; Miková N; Ninišová K; Nováková B; Oršulová A; Ozimy M; Palugyayová K; Papáčková I; Paulovič V; Pavlov R; Pellová A; Petrusová M; Podlupszki C; Potyčný K; Pokluš J; Raška B; Rosenbergerová A; Salgó P; Sallai O; Salmáš Z; Seleštianska A; Schweier M; Skladaný Ľ; Sláčková E; Sládkovičová Ľ; Slobodová Ľ; Smiešna A; Sopko M; Strýčková A; Svozilová E; Szabóová A; Štefancová D; Štefanča P; Šuch S; Šumec P; Tibenská A; Vargová T; Weis M; Zita Ľ; Zvarová J; Žáková D; Žingorová D.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 20. 1. 2014
Přijato: 18. 5. 2014
prof. MUDr. Jozef Holomáň, CSc.
Národné referenčné centrum pre liečbu chronických hepatitíd, SZU
Limbová 14, 833 03 Bratislava
jozef.holoman@szu.sk
Zdroje
1. Rambaldi A, Jacobs BP, Iaquinto G et al. Milk thistle for alcoholic and/or hepatitis B or C liver diseases – a systematic cochrane hepato-biliary group review with meta-analyses of randomized clinical trials. Am J Gastroenterol 2005; 100(11): 2583–2591.
2. Saller R, Brignoli R, Melzer J et al. An updated systematic review with meta-analysis for the clinical evidence of silymarin. Forsch Komplementmed 2008; 15(1): 9–20. doi: 10.1159/000113648.
3. Berger J, Kowdley KV. Is silymarin hepatoprotective in alcoholic liver disease? J Clin Gastroenterol 2003; 37(4): 278–279.
4. Trappoliere M, Tuccillo C, Federico A et al. The treatment of NAFLD. Eur Rev Med Pharmacol Sci 2005; 9(5): 299–304.
5. Navarro VJ. Medical management of NASH and the SyNCH NASH TRIAL. 46th Annual Meeting of EASL, Satellite symposium. Berlin, Germany 2011.
6. Holomáň J, Kristián P. Štandardný diagnostický a terapeutický postup. 52. Metodický list racionálnej farmakoterapie. Manažment liečby chronickej hepatitídy C trojkombináciou 3K-TVR: Telaprevir – pegylovaný interferón α – ribavirín. Zdravotnícke vydavateľstvo HERBA, spol. s r. o. 2012.
7. Holomáň J, Glasa J. EASL clinical practice guidelines. Letters to the Editor. J Hepatol 2009; 51 : 821–828.
8. Holomáň J, Glasa J, Galbavý Š et al. Serum markers of liver fibrogenesis and liver histology findings in patients with chronic liver diseases. Bratisl Lek Listy 2002; 103(2): 70–75.
9. Holomáň J, Glasa J, Kazár J et al. Serum markers of liver fibrosis in patients with non-alcoholic steatohepatitis (NASH). Correlation to liver morphology and effect of therapy. J Hepatol 2000; 32 : 210. doi: 10.1016/S0168-8278(00)81130-7.
10. Holomáň J, Glasa J, Galbavý Š et al. Non-alcoholic steatohepatitis: treatment with ursodeoxycholic acid. Liver & Drugs 2000; 5 (Suppl 1): 73.
11. Laboratórna príručka. Bratislava: Medirex 2013.
12. Flora K, Hahn M, Rosen H et al. Milk thistle (Silybum marianum) for the therapy of liver disease. Am J Gastroenterol 1998; 93(2): 139–143.
13. Yang KY, Hwang du H, Yousaf AM et al. Silymarin-loaded solid nanoparticles provide excellent hepatic protection: physicochemical characterization and in vivo evaluation. Int J Nanomedicine 2013; 8 : 3333–3343. doi: 10.2147/IJN.S50683.
14. Hawke RL, Schrieber SJ, Soule TA et al. Silymarin ascending multiple oral dosing phase I study in noncirrhotic patients with chronic hepatitis C. J Clin Pharmacol 2010; 50(4): 434–449. doi: 10.1177/0091270009347475.
15. Schrieber SJ, Wen Z, Vourvahis M et al. The pharmacokinetics of silymarin is altered in patients with hepatitis C virus and nonalcoholic Fatty liver disease and correlates with plasma caspase-3/7 activity. Drug Metab Dispos 2008; 36(9): 1909–1916. doi: 10.1124/dmd.107.019604.
16. Ferenci P, Scherzer TM, Kerschner H et al. Silibinin is a potent antiviral agent in patients with chronic hepatitis C not responding to pegylated interferon/ribavirin therapy. Gastroenterology 2008; 135(5): 1561–1567. doi: 10.1053/j.gastro.2008.07.072.
17. Mariño Z, Crespo G, D'Amato M et al. Intravenous silibinin monotherapy shows significant antiviral activity in HCV-infected patients in the peri-transplantation period. J Hepatol 2013; 58(3): 415–420. doi: 10.1016/j.jhep.2012.09.034.
18. Neumann UP, Biermer M, Eurich D et al. Successful prevention of hepatitis C virus (HCV) liver graft reinfection by silibinin mono-therapy. J Hepatol 2010; 52(6): 951–952. doi: 10.1016/j.jhep.2010.02.002.
19. Beinhardt S, Rasoul-Rockenschaub S, Scherzer TM et al. Silibinin monotherapy prevents graft infection after orthotopic liver transplantation in a patient with chronic hepatitis C. J Hepatol 2011; 54(3): 591–592. doi: 10.1016/j.jhep.2010.09.009.
20. Bárcena R, Moreno A, Rodríguez-Gandía MA et al. Safety and anti-HCV effect of prolonged intravenous silibinin in HCV genotype 1 subjects in the immediate liver transplant period. J Hepatol 2013; 58(3): 421–426. doi: 10.1016/j.jhep.2012.10.009.
21. Fried MW, Navarro VJ, Afdhal N et al. Effect of silymarin (milk thistle) on liver disease in patients with chronic hepatitis C unsuccessfully treated with interferon therapy: a randomized controlled trial. JAMA 2012; 308(3): 274–282. doi: 10.1001/jama.2012.8265.
22. Freedman ND, Curto TM, Morishima C et al. Silymarin use and liver disease progression in the hepatitis C antiviral long-term treatment against cirrhosis trial. Aliment Pharmacol Ther 2011; 33(1): 127–137. doi: 10.1111/j.1365-2036.2010.04503.x.
23. Polyak SJ, Morishima C, Lohmann V et al. Identification of hepatoprotective flavonolignans from silymarin. Proc Natl Acad U S A 2010; 107(13): 5995–5999. doi: 10.1073/pnas.0914009107.
24. Yilmaz Y. Review article: is non-alcoholic fatty liver disease a spectrum, or are steatosis and non-alcoholic steatohepatitis distinct conditions? Aliment Pharmacol Ther 2012; 36(9): 815–823.
25. Holomáň J, Glasa J, Kazár J et al. Liver fibrosis in patients with non-alcoholic steatohepatitis. Hepatology 2000; 32: P210.
26. Chalasani N, Younossi Z, Lavine JE et al. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology 2012; 55(6): 2005–2023. doi: 10.1002/hep.25762.
27. Van Wagner LB, Rinella ME. The role of insulin-sensitizing agents in the treatment of nonalcoholic steatohepatitis. Therap Adv Gastroenterol 2011; 4(4): 249–263. doi: 10.1177/1756283X11403809.
28. Dukát A, Lietava J, Krahulec B et al. Prevalencia abdominálnej obezity na Slovensku. Štúdia. Idea Slovakia. Vnitř Lék 2007; 53(4): 326–330.
29. Lietava J, Kosmálová V, Turek P. New metabolic syndrome in Slovakia: NEMESIS. Bratislava: Fami 2010.
30. Velussi M, Cernigoi AM, De Monte A et al. Long-term (12 months) treatment with an anti-oxidant drug (silymarin) is effective on hyperinsulinemia, exogenous insulin need and malondialdehyde levels in cirrhotic diabetic patients. J Hepatol 1997; 26(4): 871–879.
31. Huseini HF, Larijani B, Heshmat R et al. The efficacy of Silybum marianum (L.) Gaertn. (silymarin) in the treatment of type II diabetes: a randomized, double-blind, placebo-controlled, clinical trial. Phytother Res 2006; 20(12): 1036–1039.
32. Loguercio C, Federico A, Trappoliere M et al. The effect of a silybin-vitamin e-phospholipid complex on nonalcoholic fatty liver disease: a pilot study. Dig Dis Sci 2007; 52(9): 2387–2395.
33. Hajaghamohammadi AA, Ziaee A, Rafiei R. The efficacy of silymarin in decreasing transaminase activities in non-alcoholic fatty liver disease: a randomized controlled clinical trial. Hepat Mon 2008; 8(3): 191–195.
34. Hashemi SJ, Hajiani E, Sardabi EH. A placebo-controlled trial of silymarin in patients with nonalcoholic fatty liver disease. Hepat Mon 2009; 9(4): 265–270.
35. Cacciapuoti F, Scognamiglio A, Palumbo R et al. Silymarin in non alcoholic fatty liver disease. World J Hepatol 2013; 5(3): 109–113. doi: 10.4254/wjh.v5.i3.109.
36. Holomáň J. Hepatológia – medicínsky špecializačný odbor. Zdravotnícke noviny, Lekárske listy 1998; 15 : 1–15.
37. Williams R, Horton R. Liver disease in the UK: a Lancet Commission. Lancet 2013; 382(9904): 1537–1538. doi: 10.1016/S0140-6736(13)62152-2.
38. Seeff LB, Curto TM, Szabo G et al. Herbal product use by persons enrolled in the hepatitis C antiviral long-term treatment against cirrhosis (HALT-C) trial. Hepatology 2008; 47(2): 605–612.
39. Hsing AW, McLaughlin JK, Hrubec Z et al. Cigarette smoking and liver cancer among US veterans. Cancer Causes Control 1990; 1(3): 217–221.
40. Wang LY, Chen CJ, Zhang YJ et al. 4-aminobiphenyl DNA damage in liver tissue of hepatocellular carcinoma patients and controls. Am J Epidemiol 1998; 147(3): 315–323.
41. Yu MC, Yuan JM. Environmental factors and risk for hepatocellular carcinoma. Gastroenterology 2004; 127 (5 Suppl 1): S72–S78.
42. Pessione F, Ramond MJ, Njapoum C et al. Cigarette smoking and hepatic lesions in patients with chronic hepatitis C. Hepatology 2001; 34(1): 121–125.
43. Felippe MJ, Meira DA. Comparison of risk factors among blood donors, volunteers and replacement individuals, infected or not by hepatitis C virus. J Venom Anim Toxins Incl Trop Dis 2009; 15(1).
44. Súhrn charakteristických vlastností lieku – LAGOSA. Príloha č. 1 k rozhodnutiu o predĺžení registrácie, ev. č. 2133/2005. Dostupné z: http://www.adcc.sk/web/humanne-lieky/spc/lagosa-spc-12989.html.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Autoimunitní pankreatitida u pacientů po resekci pro ložiskový proces pankreatu – první výsledkyČlánek Divertikulární chorobaČlánek Projekt RISING STARSČlánek Novinka v léčbě akutních i chronických průjmů v České republice – Tammex family a Tammex family plusČlánek Správná odpověď na kvíz
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2014 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Pozvánka na ESGE Live Demonstration
- Pohled laiků, lékařů a pacientů na novou metodu léčby achalázie (POEM) – dotazníková studie
- Efekt učení perorální endoskopické myotomie (POEM) během prvního roku ověřování metody v České republice
- Efektivní techniky uzávěru transrektálního přístupu NOTES – výsledky experimentální studie
- Kvíz: Recidivující subileózní stav u mladé pacientky
- Divertikulární choroba
- Celiakia – body mass index u pacientov v čase diagnózy a efekt bezlepkovej diéty
- Stanovenie hladiny C-peptidu v priebehu glukózového tolerančného testu u pacientov s karcinómom pankreasu
- High-resolution anorektální manometrie – update v diagnostice anorektálních poruch
- Autoimunitní pankreatitida u pacientů po resekci pro ložiskový proces pankreatu – první výsledky
- Účinnosť a bezpečnosť silymarínu u pacientov s chronickými chorobami pečene – multicentrická, prospektívna, otvorená klinická štúdia IMHOTEP
- Kolorektální screening a projekt adresného zvaní – elegantní řešení přetíženosti kolonoskopických screeningových center
- Projekt RISING STARS
- Dobrodružství českého gastroenterologa v Africe
- Fakultní nemocnice v Plzni přivítala druhý ročník Motilitní akademie
- XXVIIIth Hildebrand Bardejov gastroenterology days 2014
- Ostrava Live Endoscopy, 20. červen 2014 – fenomenální úspěch
- Novinka v léčbě akutních i chronických průjmů v České republice – Tammex family a Tammex family plus
- Správná odpověď na kvíz
- Autodidaktický test: klinická a experimentální gastroenterologie
- Prevenar 13 – vakcína první volby v prevenci pneumokokových infekcí u imunokompromitovaných osob
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Účinnosť a bezpečnosť silymarínu u pacientov s chronickými chorobami pečene – multicentrická, prospektívna, otvorená klinická štúdia IMHOTEP
- High-resolution anorektální manometrie – update v diagnostice anorektálních poruch
- Divertikulární choroba
- Kvíz: Recidivující subileózní stav u mladé pacientky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



