-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Divertikulární choroba
Diverticular disease
Diverticular disease has a high prevalence percentage and an increasing incidence, even in young individuals. Its incidence is usually associated with relatively low-fibre diet. Other risk factors include smoking, opiate or corticoid consumption, obesity, alcoholism and smoking and non-steroid antiphlogistics. Patients with diverticular disease also display abnormal intestinal motility, intestinal dysbiosis and other physiological and morphological abnormalities. Most diverticuloses occur in the sigmoid colon, however, occurrence in the colon ascendens is increasing, especially in Asia. There are also several classification schemes, among which individual assessment of complications is becoming the most important. The incidence of diverticulosis used to be over 10% of all the diverticuloses, but nowadays it is lower. The diagnosis includes clinical testing, general laboratory tests of the inflammation, coloscopy, ultrasound, CT and magnetic resonance. The treatment of symptomatic uncomplicated diverticulosis is based on medicines bringing symptomatic relief, fibre, mesalazine, probiotics and non-absorbed antibiotics. Diverticular disease with a mild progression can be treated only by hydration and modification of the dietary regimen. In the case of complications and sepsis, antibiotics are administered. By way of prevention of further attacks, again probiotics, mesalazine and non-absorbed antibiotics are administered, these at one-month intervals. The ratio of operated patients is decreasing even in the case of acute states, and the efficiency of the conservative treatment of diverticulosis is above 80%. The abscess should be primarily treated by non-surgical drainage. Even peritonitis can be treated by means of laparoscopic drainage without the necessity of subsequent operation. In the past, elective resection was recommended after two attacks of diverticulitis, but today emphasis is laid on an individual approach considering age, comorbidities and the character of the disease. The percentage of laparoscopic resections is increasing. The results for the Hartmann's operation and the primary resection are almost identical.
Key words:
diverticular disease – probiotics – mesalazine – resection
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
21. 4. 2014Accepted:
26. 5. 2014
Autoři: J. Špičák; G. Suchánková; M. Kučera
Působiště autorů: Klinika hepatogastroenterologie, IKEM, Praha
Vyšlo v časopise: Gastroent Hepatol 2014; 68(4): 307-318
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
Souhrn
Divertikulární choroba je onemocnění s prevalencí v desítkách procent a s narůstající incidencí i u mladších jedinců. Její výskyt se dává do souvislosti s příjmem potravy s relativně nízkým obsahem vlákniny. Mezi další rizikové faktory patří kouření, užívání opiátů či kortikoidů, obezita, alkoholizmus a kouření a nesteroidní antiflogistika. Nemocní s divertikulární nemocí také vykazují abnormální střevní motilitu, střevní dysbiózu a další fyziologické a morfologické abnormality. Většina divertikulóz je v esovitém tračníku, avšak zejména v Asii přibývá postižení colon ascendens. Existuje několik klasifikačních schémat, z nichž nabývá na významu individuální hodnocení komplikací. Incidence divertikulitid bývala přes 10 % všech divertikulóz, dnes je nižší. Diagnostika zahrnuje kliniku, běžnou laboratoř zánětu, koloskopii, ultrazvuk, CT a magnetickou rezonanci. Základem léčby symptomatické nekomplikované divertikulózy jsou léky přinášející symptomatickou úlevu, vláknina, mesalazin, probiotika a nevstřebávající se antibiotika. Divertikulitida s mírným průběhem může být léčena pouze hydratací a úpravou dietního režimu. V případě komplikací a sepse se podávají antibiotika. Jako prevence dalších atak se podávají opět probiotika, mesalazin a nevstřebatelná antibiotika, tato v jednoměsíčních intervalech. Poměr operovaných klesá i u akutních stavů a účinnost konzervativní léčby divertikulitid se pohybuje nad 80 %. Absces by měl být primárně léčen nechirurgickou drenáží. I peritonititida může být léčena laparoskopickou drenáží bez nutné následné operace. Elektivní resekce se v minulosti doporučovala po dvou atakách divertikulitid, dnes se zdůrazňuje individuální přístup s ohledem na věk, komorbiditity a charakter postižení. Zvyšuje s podíl resekcí prováděných laparoskopicky. Výsledky jsou prakticky shodné u Hartmannovy operace i primární resekce.
Klíčová slova:
divertikulární choroba – probiotika – mesalazin – resekce
Divertikulární choroba je běžné onemocnění, jehož incidence celosvětově dále vzrůstá. Vůdčím patogenetickým principem je relativní nedostatek vlákniny, nicméně uplatňují se také střevní dysbióza, zánětlivé změny a senzomotorické poruchy. Chronické obtíže mohou napodobovat dráždivý tračník či nespecifický střevní zánět a dlouhodobě snižovat kvalitu života pacienta. Epizody divertikulitidy mohou mít v těžších případech charakter náhlé břišní příhody a v případě komplikací mohou mít vážný i smrtelný průběh vyžadující chirurgickou léčbu. Jak chronické symptomy, tak epizody akutního zánětu běžně rekurují.
Epidemiologie a patogeneze
Prevalence divertikulózy je méně než 20 % ve věku do 40 let a dále stoupá až k nadpolovičnímu výskytu u starších 80 let [1]. V posledních letech dochází ke zvyšování incidence zejména v mladší populaci, zatímco u jedinců starších 65 let zůstává výskyt stabilní [2]. V mladším věku má toto onemocnění častěji agresivnější průběh vyžadující chirurgickou intervenci. Ve věku do 50 let je toto onemocnění častější u mužů (2 : 1), naopak mezi staršími pacienty dominují ženy (1,5 : 1) [3,4]. Spekulativními příčinami pohlavní diference jsou ochranný vliv testosteronu na zeslabování ténií střevní stěny a negativní vliv proběhlého těhotenství.
Největší výskyt divertikulózy je v zemích s tzv. západním způsobem života, což se dává do souvislosti s příjmem potravy s relativně nízkým obsahem vlákniny. V roce 1971 uveřejnili Painter a Burkitt v British Medical Journal pravděpodobnou hypotézu spočívající v nedostatečném příjmu dietní vlákniny vedoucí ke zvýšenému intraluminálnímu tlaku v tračníku, a tím ke vzniku divertiklů [5]. Tuto hypotézu podpořila studie, ve které se srovnávala váha stolice a trvání pasáže (transit time) u 1 200 jedinců z Velké Británie a Ugandy [6]. Delší pasáž a menší objem stolice u obyvatel Británie byly udávány jako důkaz vlivu dietních faktorů. Hypotézu také podporuje vývoj, při kterém dochází k nárůstu incidence divertikulózy v dalších zemích přijímajících západní styl života. Některá fakta a studie ovšem dietní hypotézu pravděpodobně v důsledku odlišné metodiky nepotvrzují.
Překvapivě divertikulární chorobu nacházíme jen přibližně u 6 % pacientů se zácpou [7] a ta naopak provází jen 16 % pacientů s divertikulózou [8]. V roce 2012 Peery et al uveřejnili studii s účastí více než 2 000 respondentů, dle které preventivní role vysokého příjmu vlákniny v rozvoji divertikulózy nebyla potvrzena [9]. Zakořeněné dogma, že oříšky a semínka provokují divertikulitidu, nepotvrdila jiná studie zabývající se dietními faktory [10]. Recentní britská prospektivní studie zahrnula 690 075 žen středního věku vyšetřených validovaným dietním dotazníkem, z nichž 17 325 bylo hospitalizováno pro symptomatickou divertikulární chorobu. Průměrný denní příjem vlákniny byl 13,8 g denně (SD 5,0), z čehož 42 % pocházelo z obilovin, 22 % z ovoce, 19 % ze zeleniny a 15 % z brambor. Relativní riziko divertiklové nemoci na 5 g denního příjmu vlákniny bylo podle jejího původu 0,84 u obilovin, 0,81 u ovoce, 1,03 u zeleniny a 1,04 u brambor [11]. Rozdílné riziko u jednotlivých druhů vlákniny zůstává nevyjasněno.
Mezi další rizikové faktory manifestace divertikulární choroby včetně vzniku komplikací patří kouření a pravidelné užívání opiátů či kortikoidů [12,13]. Riziko krvácení zvyšují také nesteroidní antiflogistika [14], naproti tomu blokátory Ca kanálů a statiny mohou mít protektivní efekt [15,16]. Rizikovými faktory divertikulitidy a krvácení jsou také malá fyzická aktivita a obezita. Podle dánské studie z let 1977–1993 znamenal alkoholizmus zvýšení rizika divertikulitidy u mužů 2,0krát a u žen 2,9krát. Spekulovalo se o vlivu alkoholické imunosuprese [17].
Důležitou roli ve vzniku divertiklu hraje abnormální střevní motilita. Pacienti s divertikulózou vykazují výrazné segmentární kontrakce s nižší frekvencí, ale delším trváním charakteru spastického colon [18]. Příčina tohoto jevu není zcela jasná, dle některých dat by se mohla uplatňovat up-regulace M3 receptorů ve sliznici tlustého střeva [19,20]. Bylo také zjištěno, že u pacientů s divertikulózou je signifikantně snížena denzita Cajalových buněk, jimž je přisuzována funkce pacemakeru střevní peristaltiky [21]. Potenciálním patogenetickým mechanizmem může být i změna v koncentraci vazoaktivního intestinálního peptidu ve střevní stěně [22].
Dalším zvažovaným mechanizmem manifestace divertikulární choroby a také dráždivého tračníku je změna ve složení střevní mikroflóry. Stagnace stolice v divertiklech může způsobit dysmikrobii se změnou profilu metabolitů, které se uplatňují v patogenezi chronického zánětu. U pacientů s anamnézou akutní divertikulitidy bylo u 60 % z nich prokázáno bakteriální přerůstání [23].
Zánět probíhající ve střevní stěně při chronické divertikulární chorobě může být v podstatě identifikovatelný jen mikroskopicky. Podle Horgana et al byl u 3/4 resekátů přítomný pouze mikroskopický zánět v okolí divertiklu [24]. Struktura divertiklu vzniká v místě fyziologického zeslabení střevní stěny, konkrétně v místě prostupu vasa recta cirkulární vrstvou svaloviny, přes kterou dochází k herniaci mukózy a submukózy, a dochází tak ke vzniku pulzního, tzv. nepravého divertiklu krytého pouze serózou.
Přibližně u 95 % pacientů jsou divertikly v esovitém tračníku, přičemž u 65 % jsou omezeny pouze na něj, ve 24 % postihují i další části tlustého střeva, v 7 % jsou rozmístěny difuzně a u 4 % pacientů jsou divertikly pouze v pravostranném tračníku [25]. Rozvoj divertiklů převážně v esovitém tračníku může být vysvětlen Laplaceovým zákonem, který říká, že tlak je nepřímo úměrný poloměru daného prostoru. Vzhledem k tomu, že esovitý tračník je úsek střeva s nejmenším poloměrem, je to současně místo, kde je v průběhu střevní kontrakce nejvyšší tlak [26]. Pozoruhodné je, že v Asii výrazně dominuje postižení vzestupného tračníku (cca 70 %) [27]. Recentně publikované údaje pochází z Thajska. Analyzováno bylo 2 877 radiologických nálezů, průměrný věk byl 59,8 ± 14,7 let. Divertikulóza byla zjištěna u 820 nálezů (28,5 %), z toho pravostranná v 641 případech a levostranná v 383 případech. U 98 nálezů se jednalo o pandivertikulózu. Výskyt byl shodný u obou pohlaví a vůdčí symptomatologií byly poruchy pasáže [28].
Klinika a klasifikace
Termín divertikulóza odkazuje pouze na přítomnost výchlipků střevní stěny, tzv. divertiklů. Ty mohou být asymptomatické nebo symptomatické. V případě klinicky významné symptomatologie hovoříme o divertikulární chorobě, která se manifestuje několika klinicko-patologickými podjednotkami. Divertikulitida je charakterizována zánětem přímo postihujícím divertikl a může být akutní nebo chronická. Akutní divertikulitida je bakteriální zánětlivé onemocnění, které se může dále komplikovat a šířit. Uvádí se, že divertikulitida je způsobena obstrukcí divertiklu s následným zvýšením intradivertikulárního tlaku. Ten vede k poškození sliznice a jejím zánětlivým změnám s následnou bakteriální translokací. Komplikacemi jsou absces, perforace, peritonitida a krvácení, které se může objevit i bez projevů zánětu. Jak již bylo uvedeno, byly mikroskopické zánětlivé změny opakovaně popsány i tam, kde k manifestní divertikulitidě nedošlo, a odtud pochází hypotézy o možném preventivním podávání protizánětlivých léků a antibiotik. Incidence divertikulitidy se uváděla mezi 10 a 25 % divertikulóz, ale novější studie udávají riziko podstatně nižší [11,7]. Například Shahedi et al v retrospektivní studii skupiny veteránů s nálezem divertikulózy při koloskopii popisují během 11letého sledování riziko vzniku divertikulitidy jen kolem 1 % [29]. Další studie s více než 2 000 pacienty trvající po dobu sedmi let prokázala kumulativní riziko vzniku divertikulitidy u 4,3 %, resp. při potvrzení pomocí CT jen u 1 % pacientů. Za každou další dekádu života bylo riziko vzniku divertikulitidy sníženo o dalších 24 %. Souhrnně řečeno oproti dříve uváděnému až 25% riziku rozvoje divertikulitidy bylo v této studii po dobu 11letého sledování prokázáno riziko pod 5 %. Mladí pacienti byli ohroženi vznikem divertikulitidy více [30]. Podle údajů z USA dochází k 71 hospitalizacím na 100 000 obyvatel za rok pro akutní divertikulitidu a ke čtyřem pro perforaci. Incidence krvácení je přibližně 10 na 100 000 obyvatel za rok a činí přibližně 50 % všech enteroragií [2,31]. Divertikly jsou nejčastějším zdrojem masivní enteroragie následované hemoroidy a ischemickou kolititidou. Asi u 15 % enteroragií se zdroj nalézá v oblasti horní části trávicí trubice, takže spolu s koloskopií se zvažuje i orální vyšetření. Rizikové faktory krvácení zahrnují užívání aspirinu a nesteroidních antirevmatik, opiátů, kortikoidů, kalciových blokátorů a komorbidity běžné ve stáří. Indikována je koloskopie, která ovšem bez přípravy bývá nevýtěžná. Příprava by měla být zahájena okamžitě po zjištění krvácení a efektivitu vyšetření zásadně zlepší aplikace vody tryskou (tzv. clearpath). V případě určení divertiklů jako zdroje krvácení se okamžitě přistupuje k léčbě, při níž se využívají stejné principy jako při stavění krvácení z horní části trávicí trubice. Aplikuje se roztok adrenalinu, koagulace termickou sondou, klipy či adhezivní činidla a krvácející divertikl lze strangulovat ligací. Podle jedné studie bylo adrenalinem a klipy dosaženo zástavy krvácení u všech pěti nemocných, podle jiné bylo ligací zastaveno krvácení u 25 z 27 nemocných. Srovnávací studie ze zřejmých důvodů nelze očekávat. Je prokázáno, že časná endoskopie a následná léčba je provázena nižším rizikem recidivujícího krvácení než koloskopie opožděná. V případě inkonkluzivní koloskopie lze provést scintigrafii, její výtěžnost se ovšem pohybuje pod 80 % a naopak nesprávné určení zdroje krvácení je běžné. Zejména v Asii se dosahuje dobrých výsledků u angiografie, kterou může následovat superselektivní katetrizace větví arteria mesenterica a aplikace coilů, obtulujícího gelu či mikročástic [32–35].
Klasifikaci komplikované divertikulitidy vytvořili v roce 1978 Hinchey et al a v roce 1999 Hansen a Stock (tab. 1 a 2) [36,37].
Tab. 1. Klasifikace divertikulitidy dle Hincheyho. Tab. 1. Classification of diverticulitis according to Hinchey. 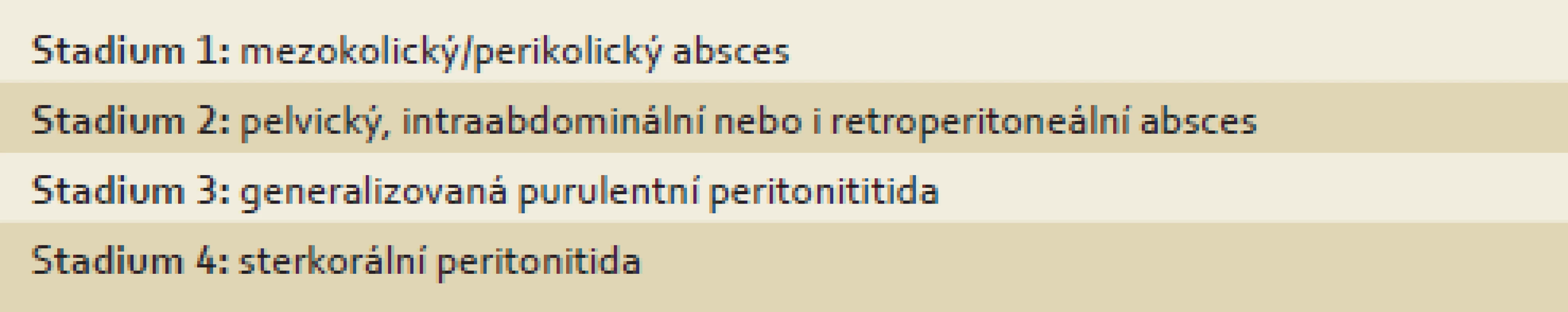
Tab. 2. Klasifikace divertikulitidy dle Hansena a Stocka. Tab. 2. Classification of diverticulitis according to Hansen and Stock. 
Köhler dělí divertikulární nemoc na symptomatickou nekomplikovanou, rekurentní symptomatickou komplikovanou, zatímco Klarenbeekova klasifikace zahrnuje nekomplikovanou, chronickou a akutní nemoc. Z komplikací vyjmenovává krvácení, absces, flegmónu, fistulu, perforaci, stenózu, obstrukci v důsledku adhezí a peritonititidu, která může být purulentní nebo fekální [38]. Stenóza při divertikulární chorobě může mít podobné histologické rysy jako nespecifický střevní zánět nebo ischemická či infekční kolitida. Popisuje se kryptitida, kryptové abscesy i granulomy [39]. V některých případech se může jednat o souběh dvou onemocnění [40]. Nejčastější manifestací divertikulární nemoci jsou vleklé gastrointestinální potíže (tenezmy, plynatost, poruchy pasáže a palpační citlivost) bez klinicky manifestního zánětu, a tedy bez odpovídajících laboratorních markerů a makroskopických zánětlivých změn. Otázkou je, nakolik je u těchto pacientů vyjádřena vlastní divertikulární choroba či nakolik se na potížích podílí dráždivý tračník. Symptomy se mohou objevit jako následek akutní divertikulitidy nebo existují jako chronický problém a divertikly jsou zjištěny obvykle při diagnostické koloskopii. U obou těchto skupin byla zjištěna viscerální hypersenzitivita [41] a současně u pacientů s dráždivým tračníkem bylo prokázáno zvýšené riziko vzniku divertikulózy [42]. Přehledně zpracovali klasifikaci divertikulární nemoci také Stallinger et al [43] (schéma 1). Specifickou skupinou mohou být nemocní s bolestí v levém podbřišku a poruchami pasáže bez klinických a laboratorních známek zánětu (smouldering diverticulitis), která může profitovat z elektivní resekce [44].
Schéma 1. Klasifikace divertikulitidy dle Stallingera et al. Scheme 1. Classification of diverticulitis according to Stallinger et al. 
Je nutné, aby popsaná terminologie a klasifikační principy byly všeobecně respektovány, protože jsou jako vždy komunikačním prostředkem a jejich neznalost může vést v jednotlivých případech k nekorektním terapeutickým postupům.
Doporučení
Klasifikace slouží jako komunikační schéma a odvíjí se od ní další diagnostický a terapeutický postup. Jednotlivá klasifikační schémata divertikulitidy se překrývají, což částečně odráží medicínský vývoj. Autoři se přiklání ke klasifikaci recentní, tj. Klarenbeekově či Stallingerově.
Diagnostika
Manifestací symptomatické divertikulární choroby jsou abdominální bolesti, nadýmání, plynatost a změny stolice, v podstatě podobně jako je tomu u dráždivého tračníku. Typickou manifestací divertikulitidy je bolest v levém podbřišku doprovázená obvyklou obecnou symptomatologií a laboratorními parametry bakteriálního zánětu. V diagnostice divertikulární nemoci se využívají obvyklé zobrazovací metody: dříve kontrastní rentgen, nyní koloskopie, ultrasonografie, počítačová tomografie (CT) a magnetická rezonance (MR). Diagnostickými kritérii při podezření na divertikulitidu jsou u sonografie a CT zobrazení divertiklů, postižení perikolického tuku a ztluštění střevní stěny na 4–5 mm. Řada studií a metaanalýzy prokázaly v podstatě shodnou senzitivitu i specificitu ultrasonografie, CT i MR většinou převyšující 90 %. Koloskopie je patrně nejčastější diagnostickou metodou. Divertikly se mohou vyskytovat spolu s jakýmkoli jiným střevním onemocněním včetně nádorů a mohou ztěžovat koloskopii jako takovou i polypektomii v důsledku spazmů či stenóz. Časná koloskopie při divertikulitidě zvyšuje riziko perforace [45–48]. V diagnostice kolovezikálních píštělí je snad kupodivu nejpřesnější test s požitím makových zrnek, které se následně hledají v moči. Test předčil CT, MR, kontrastní rentgen i koloskopii [49].
Doporučení
Jednotlivé vyšetřovací modality se uplatňují s ohledem na konkrétní klinickou situaci. Obecně nejčastější diagnostickou metodou je koloskopie. Divertikly ji mohou ztěžovat po stránce technické i z hlediska možných komplikací. Stenózy zvyšují riziko perforace. Koloskopie je kontraindikována v případě volného vzduchu v dutině břišní při perforaci a u akutního zánětu.
Terapie
Základem léčby symptomatické nekomplikované divertikulární choroby jsou léky přinášející symptomatickou úlevu, vláknina, mesalazin, probiotika a nevstřebávající se antibiotika.
Vlákninou se jako první systematicky zabývali Painter a Burkitt. Painter prokázal, že dieta s nízkým obsahem vlákniny má za následek snížení objemu stolice, hypersegmentaci a zvýšení intraluminálního tlaku [6]. Následovala řada studií, při nichž se podávaly otruby nebo rozpustná vláknina psyllium (jitrocel indický), z nichž z pěti randomizovaných tři prokázaly zlepšení ve skupině s vlákninou a dvě s relativně menším množství vlákniny nikoli [50–54]. Důkaz o prospěšnosti vlákniny také přináší dvě rozsáhlé prospektivní studie, které prokázaly nepřímou souvislost mezi obsahem vlákniny v potravě a vznikem divertikulitidy (relativní riziko 0,6 při dietě s relativně nejvyšším obsahem vlákniny vs potrava s obsahem nejnižším [55,56]. Vlákninu v léčbě divertikulární nemoci doporučuje několik standardů (tab. 3) [57].
Tab. 3. Standardy doporučující vlákninu v léčbě divertikulární nemoci. Tab. 3. Standards recommending fiber in the treatment of diverticular disease. 
U nás se zabývali divertikulární nemocí a úlohou diety Adamová a především František Antoš. Zdůrazňují potřebu dostatečného množství vlákniny, které by mělo dosáhnout 30 g denně, a tedy dvojnásobku běžného příjmu v naší oblasti. Antoš specificky doporučuje vysoký příjem otrub a dalších potravin s vysokým obsahem vlákniny, což bylo v 80. letech s všeobecně velmi omezenou nabídkou nesnadno realizovatelné. Připomeňme, že vysoký obsah vlákniny je vlastní vedle otrub zejména hrubozrnnému pečivu, neloupané rýži, sušenému ovoci, ořechům, luštěninám, cizrně, jablkům a hruškám, kořenové zelenině, tmavému chlebu a pečeným bramborám [58,59].
Léčba akutní divertikulitidy
Základem terapie akutní divertikulitidy jsou systémová antibiotika a eliminace orálního příjmu potravy (tzv. bowel rest). V případě nekomplikovaného mírného onemocnění postačí širokospektrá antibiotika podávaná perorálně. Doporučují se kombinace ciprofloxacinu s metronidazolem nebo ampicilin-sulbactam po dobu 7–10 dnů. Ambulantní terapie je ve většině případů účinná s méně než 10% rizikem rehospitalizace během následujících dvou měsíců. V případě komplikované divertikulitidy je nezbytností hospitalizace s intravenózní aplikací antibiotik pokrývající gramnegativní a anaerobní patogeny. Mezi doporučované antibiotické režimy patří opět ampicilin-sulbactam, piperacilin-tazobactam v monoterapii a cefalosporiny třetí generace v kombinaci s metronidazolem. U pacientů alergických na betalaktamová antibiotika jsou alternativou ciprofloxacin nebo levofloxacin s metronidazolem nebo karbapenemy v monoterapii. Součástí terapie je dostatečná hydratace a přiměřená dietní opatření, tj. tekutá strava či parenterální výživa.
Recentně provedená multicentrická studie zahrnující přes 600 pacientů s typickými symptomy nekomplikované divertikulitidy verifikované CT srovnávala terapii širokospektrými antibiotiky oproti samotné infuzní terapii [60], aniž byl prokázán signifikantní rozdíl mezi oběma skupinami v délce pobytu v nemocnici, komplikacích nebo recidivách divertikulity vyžadující rehospitalizaci. Ve skupině bez antibiotik se komplikace, konkrétně absces, rozvinula u pouze tři (1 %) nemocných. Autoři soudí, že antibiotika by měla být podávána jen v případě komplikované divertikulitidy a stejné doporučení vydala i např. Dánská gastroenterologická společnost ve svém oficiálním doporučení. Podávání antibiotik doporučuje pouze u nemocných se sepsí, deficitem imunity a gravidních žen. V současné době probíhá tzv. DIABOLO randomizovaná studie srovnávající intravenózní antibiotika se symptomatickou léčbou u akutní nekomplikované divertikulitidy s následným sledováním po šest měsíců [61].
Doporučení
V léčbě nekomplikované divertikulitidy postačuje parenterální zavodnění a omezení orálního příjmu. Antibiotika jsou vyhrazena pro sepsi a lokální zánětlivé komplikace. V nejasných či nevyhraněných případech jejich podání jistě není chybou.
Léčba symptomatické nekomplikované divertikulární choroby
Rifaximin
Stáza střevního obsahu může vést k bakteriálnímu přerůstání a tkáňovým zánětlivým změnám, což odůvodňuje podávání antibiotik i bez přítomnosti klinicky zjevné divertikulitidy. Rifaximin je špatně vstřebatelné širokospektré antibiotikum působící proti grampozitivním i gramnegativním, aerobním i anaerobním bakteriím. Jako ostatní antibiotika i rifaximin redukuje fekální bakteriální flóru, která se ovšem až pozoruhodně rychle během 1–2 týdnů obnovuje v původním složení. Důsledkem redukce bakteriální flóry je snížení degradace vlákniny a produkce metanu. Nicméně přes tento jen dočasný doložitelný účinek se antibiotika podávají nejen u akutních infekcí, ale i u chronických zánětů, kde je hypotéza jejich účinku více diskutabilní. Podává se i u jiných, z bakteriologického hlediska empirických indikací jako u dráždivého tračníku a průjmu cestovatelů. V případě rifaximinu existuje značná metodická variabilita – léky se podávají v různých dávkách a kombinacích a liší se kritéria hodnocení. Papi na počátku 90. let prokázal u 217 nemocných redukci skóre symptomů z 63,9 % na 47,6 % [62]. K podobným závěrům dospěly při cyklickém podávání i některé další randomizované studie (tab. 4) [63–68] a účinnost potvrdila metaanalýza čtyř prospektivních randomizovaných studií zahrnujících 1 600 nemocných [69]. Vzhledem k opakovanému a dlouhodobému podávání je přirozeně na zvážení riziko komplikací, zejména selekce zkříženě rezistentních kmenů Mycobacterium tuberculosis k rifampicinu, ale tato rezistence zůstává pod 3 %, je klinicky nevýznamná a nezvyšuje se i přes narůstající preskribci rifaximinu. Podobně nedochází k selekci rezistentních kmenů Clostridium difficile, resp. žádný případ se neobjevil ve studii u dráždivého tračníku a jen jeden (0,3 %) ve studii s Crohnovou nemocí [70].
Tab. 4. Studie doporučující cyklické podávání rifaximinu v léčbě divertikulární nemoci. Tab. 4. Studies recommending cyclic administration of rifaximin in the treatment of diverticular disease. 
Recentní observační multicentrická studie pochází z Rakouska. Léčeno bylo 1 003 nemocných s nekomplikovanou symptomatickou divertikulární chorobou a rifaximin se podával v 7–10denních kúrách měsíčně po dobu tří měsíců. Celkově došlo k významnému zmírnění symptomů (plynatost, abdominální bolesti a průjem). Zaznamenáno bylo 24 potenciálně vedlejších účinků vesměs nezávažných u 20 nemocných, z toho 6 v příčinné souvislosti s podáním rifaximinu [71].
5-ASA v terapii chronických forem divertikulární choroby
Vzhledem k zánětlivé složce onemocnění se nabízí využití mesalazinu jak v prevenci divertikulitidy, tak k léčbě symptomatické divertikulózy, kde zánětlivou složku nelze vyloučit. Byla publikována celá řada metodicky rozdílných studií s různými výsledky. Studie se liší v dávkování, kombinaci s jinými léky i v hodnocení cílů. Trepsi et al [71] v otevřené randomizované studii hodnotili osmitýdenní užívání mesalazinu oproti placebu po proběhlé atace akutní divertikulitidy (15 vs 46 % symptomatických relapsů). Tursi et al [72] porovnávali kontinuální (denní) podávání 5-ASA v dávce 1,6 g oproti cyklickému podávání 10 dnů v měsíci po dobu dvou let. Ve větvi s kontinuálním podávání bylo 78 % asymptomatických oproti 56 % při cyklické aplikaci. V jiné studii bylo v prevenci rekurence účinné užívání 5-ASA v kombinaci s rifaximinem nebo s probiotiky [73]. Ve dvojitě zaslepené placebem kontrolované studii DIVA se sledovalo tříměsíční podávání mesalazinu v dávce 2,4 g/den po epizodě akutní divertikulitidy. V mesalazinové skupině bylo pozorováno signifikantní snížení celkových gastrointestinálních potíží ve 12. (56,3 vs 17,2 %) i 52. týdnu (59,3 vs 27,3 %) [74]. Přehled šesti randomizovaných kontrolovaných studií s 818 pacienty prokázal, že mesalazin byl ve srovnání s placebem signifikantně účinnější v ústupu symptomů a v prevenci rekurentní divertikulitidy [75]. Naproti tomu Raskin et al ve studii PREVENT II během dvouletého období snížení atak divertikulitidy při léčbě mesalaminem neprokázali, nezaměřili se ovšem na chronické abdominální obtíže [76]. V prospektivní a randomizované studii srovnával Di Mario cyklicky podávaný rifaximin s mesalazinem v symptomatické úlevě u nemocných se symptomatickou nekomplikovanou divertikulární chorobou. Při hodnocení globálního skóre byla účinnost obou režimů shodná [77].
Probiotika
Probiotika jsou živé mikroorganizmy ovlivňující hostitelskou mikroflóru s pozitivním účinkem na zdravotní stav organizmu. Většina přípravků pocházejících z mléčných kultur obsahuje Bifidobacterium spp., Lactobacillus spp., některé kmeny E. coli a kvasinku Saccharomyces boulardi. Mechanizmus účinku probiotik je víceúrovňový. Jedním z nich je suprese růstu a adheze bakterií na střevní sliznici se snížením bakteriální translokace [78,79]. Současně modulují imunitní systém – indukují tvorbu ochranně působících cytokinů, jako je IL-10 a TGFß, a potlačují proinflamatorně působící cytokiny – tumor nekrotizující faktor (TNF) [80,81]. Saccharomyces boulardi snižuje migraci Th1 lymfocytů v zánětlivě změněné tkáni u myšího modelu s IBD [82]. Ve vývoji jsou ale i další kmeny bakterií produkující imunomodulátory (např. IL-10 a defensiny). Bolest a její vnímání ovlivňují některé kmeny lactobacilů indukcí exprese mikroopioidních a kanabioidních receptorů ve střevní sliznici [83]. Některé studie prokázaly účinnost probiotik v terapii divertikulární choroby a jejích komplikací [84,85]. Lamiki et al publikovali studii s probiotiky obsahujícími kmeny Lactobacillus acidophilus a Bifidobacterium spp. u pacientů se SUDD. Během šestiměsíčního sledování bylo 70 % pacientů bez potíží a 77 % z nich hodnotilo terapii jako velmi účinnou [86]. Současně vyšetřovali stolici pomocí PCR a prokázali změnu její kolonizace. Tursi et al zkoumali kombinaci balsalazinu s VSL#3 oproti probiotiku samotnému. Během 12měsíčního sledování neprokázali statisticky významný rozdíl v dosažení remisí, ale v kombinované skupině prokázali snížení subjektivních potíží [73]. V další randomizované studii zkoumali podávání mesalazinu a probiotika v kombinaci a separovaně. Bylo randomizováno 210 nemocných do čtyř skupin: M (mesalazin 1,6 g/d + Lactobacillus casei placebo), L (aktivní Lactobacillus casei subsp. DG 24 bill./day plus mesalazin placebo), LM (oba léky v aktivní formě), P (oba léky jako placebo). Léčba probíhala v desetidenních periodách měsíčně po jeden rok. Rekurence obtíží se posuzovala podle skóre bolesti. K rekurenci došlo v 0 % ve skupině LM, v 13,7 % ve skupině M, v 14,5 % ve skupině L a v 46,0 % ve skupině P (LM vs M; p = 0,015; LM vs L; p = 0,011; LM p vs P; p = 0,000; M vs P; p = 0,000; L vs P; p = 0,000). Akutní divertikulitida vznikla u šesti nemocných ve skupině P a u jednoho ve skupině L (p = 0,003). Kvalitní studie jednoznačně prokázala přínos obou léků, který byl větší při kombinovaném podávání [87]. Za zmínku stojí domácí studie Friče a Zavorala hodnotící účinnost nepatogenní E. coli v udržení remise u 15 nemocných se symptomatickou nekomplikovanou divertikulózou. Krátkodobé podání střevního desinficiens a absorbens následovalo podávání nepatogenní E. coli po dobu pěti týdnů. Přidání probiotika prodloužilo remisi z 2,43 na 14,1 měsíců a významně se snížila symptomatologie [88]. Zdá se, že k dosažení účinku nemusí být nutné podávat organizmy v kompletní vitální podobě. Vylučované proteiny a DNA jednoho probiotika, konkrétně VSL#3, blokují aktivaci cytokinů a apoptózu epiteliálních buněk [89]. Účinek závisí na specifické DNA pocházející z různých bakteriálních kmenů, které jsou součástí probiotika. Nemetylovaná DNA z VSL#3 zrovna tak jako další náhodně vybrané některé kmeny E. coli potlačují experimentální kolitidu na několika zvířecích modelech [90]. Tyto léčebné účinky jsou zprostředkovány pomocí toll-like receptorů 9 a indukcí interferonu typu 1 alfa/beta [91]. I z dalších probiotik, včetně Lactobacillus GG, mohou proteiny s definovanou molekulovou hmotností inhibovat prozánětlivou signalizaci a cytokiny navozenou apoptózu epiteliálních buněk tlustého střeva pomocí epidermálního růstového faktoru (EGFR) [92]. Veškerá konzervativní léčba podávaná k léčbě symptomů a prevenci zánětlivých komplikací byla pečlivě zhodnocena obsáhlou nedávno publikovanou metaanalýzou. Celkem bylo hodnoceno 31 prospektivních studií, často s problematickou kvalitou. Jen u osmi byl použit validizovaný dotazník a jen 14 přesně definovalo jednotlivé parametry. Pouze jedna studie splňovala náročná metodologická kritéria (dlouhodobá dvouslepá randomizovaná studie). Ta prokázala významné zlepšení symptomů při podávání rifaximinu s vlákninou proti vláknině samotné. Celkem 12 studií zkoumalo rifaximin a osm mesalazin nebo balsalazid v různých dávkách a kombinacích v symptomatické léčbě u nekomplikované divertikulózy. Devět studií s rifaximinem a dvě studie s mesalazinem prokázaly redukci symptomů. Celkem v 11 studiích byla cílem prevence divertikulitidy. Šest z nich zkoumalo rifaximin v různých kombinacích proti vláknině nebo mesalazinu, z nich u všech s pozitivním výsledkem, který nicméně u čtyř nedosáhl statistické významnosti. Kumulativní data z těchto studií prokázala při léčbě rifaximinem s vlákninou poměr jednoročního výskytu divertikulitidy 1,1 % vs 2,9 % při léčbě samotnou vlákninou s nutností léčby 57 nemocných k prevenci jedné ataky. Autoři uzavírají, že výsledky jsou ve svém úhrnu přesvědčivější v léčbě symptomů, kdežto úloha léčby v prevenci divertikulitidy musí být dále definována [93].
Doporučení
Většina přehledů i doporučených postupů pokládá vlákninu za základ léčby a nutné celoživotní opatření. Ve stejném duchu vyznívají zkušenosti domácích autorů. Rifaximin, mesalazin i probiotika prokázala účinnost ve studiích, i když často jen na hranici statistické významnosti. Lepších výsledků se dosahuje při podávání léků v kombinacích. Rifaximin by se měl podávat cyklicky. Medikamentózní léčba by měla být uvážlivá s ohledem na individuální klinický stav.
Chirurgie
Úspěšnost konzervativní terapie u akutní nekomplikované divertikulitidy se pohybuje mezi 70 a 100 %. Po zaléčení první epizody akutní divertikulitidy prodělá cca 1/3 pacientů další epizodu a z nich další 1/3 prodělá epizodu třetí. Historicky přibližně u 20 % pacientů s akutní divertikulitidou byla v průběhu onemocnění nutná chirurgická intervence [94]; v současnosti potřeba intervencí vzhledem k úspěšnosti konzervativní léčby klesá. Většina pacientů podstupujících intervenci je indikována pro akutní či chronické komplikace jako např. píštěl, nedrenovatelný absces, peritonitida nebo obstrukce, kde je indikace operačního řešení zřejmá. Druhou skupinou jsou pak pacienti s těžkými epizodami rekurentní divertikulitidy, kde je operace preventivním elektivním výkonem. Zde je otázkou, kdy a jak načasovat event. operační výkon. Do konce minulého století byl univerzálně akceptován pokyn k operaci po dvou atakách divertikulitidy. Dnes se zdůrazňuje individuální přístup vzhledem k celkově nízkému riziku recidivy divertikulitidy, variabilnímu průběhu i výskytu komorbidit. Specifická situace je u pacientů mladších 40 let, u kterých může být doporučována resekce postiženého úseku již po jedné epizodě akutní divertikulitidy. Důvodem je skutečnost, že průběh divertikulitidy zde bývá agresivnější a současně je zde vyšší riziko rekurence. Tito mladší pacienti i častěji podstupují urgentní operační výkon, na kterém se kromě vlastních komplikací divertikulitidy často podílí špatně stanovená diagnóza. Dle některých dat to je až kolem 40–50 % [95–97]. Specifickou skupinou jsou pacienti se snížením imunity, např. při dlouhodobé kortikoterapii či jiné imunosupresi, u diabetu nebo u renálního selhání a při postižení systémovým onemocnění pojiva, např. systémovým lupus erythematodes, u nichž je vyšší riziko perforující divertikulitidy [98]. Imunosuprimovaní pacienti často vykazují nevýrazné symptomy i přes těžce probíhající onemocnění. Pravostranná divertikulitida (cékální) tvoří přibližně 1,5 % všech divertikulitid [99]. Většinou se jedná o mladší nemocné a bývá zaměněna za akutní apendicitidu, takže správná diagnóza bývá před operací stanovena jen výjimečně [100]. Abscesy byly primárně indikovány k chirurgické léčbě; nyní se často volí drenáž pod CT. Ambrosetti et al drenovali 73 nemocných. Z nich muselo být 18 % operováno během iniciální hospitalizace a dalších 34 % během dalšího sledování [101]. Ve studii Siewerta et al muselo být operováno osm z 22 nemocných s malým abscesem (do 2 cm) a pět (62,5%) s abscesem větším [102]. Ve studii Durmishiho et al byla drenáž úspěšná u 23 z 34 nemocných a 12 z nich bylo operováno s odstupem. Z 11 s neúspěšnou drenáží byla provedena resekce u 10 s 80% nutností stomatu a 33% mortalitou [103]. Studie Kumara et al zahrnula 114 nemocných, z nichž polovina byla léčena jen anbitibiotiky. Drenovaná skupina měla abscesy významně větší a častěji se manifestovala zvýšenou teplotou [104]. V případě perforace byla po desetiletí univerzálně akceptovaná Hartmannova operace, tj. resekce s dočasnou kolostomií. Kronborg srovnával Hartmannovu operaci s primární kolostomií bez resekce a v této skupině byla mortalita nižší (0/21 vs 6/25) [105]. Zeitoun et al došli k částečně opačnému závěru – u primární kolostomie byly častější reoperace, rozdíl v mortalitě nebyl statisticky významný [106]. V jiné studii byla mortalita v resekované skupině s primární suturou nižší než u Hartmannovy operace (98 nemocných, 10 vs 19 %) [107]. Roli v odlišných výsledcích hraje jako vždy selekce nemocných, protože u těžších nemocných se autoři přikláněli k Hartmannově metodě. V přehledu studií srovnávajících primární resekci s Hartmannovou operací byla mortalita prakticky shodná (14,1 vs 14,4 %) [108]. Jako v jiných indikacích i u peritonitidy se uplatnil laparoskopický přístup. V několika studiích byly popsány dobré výsledky u laparoskopické inspekce a drenáže u stadia III dle Hincheyho. Karoui et al nenalezli rozdíl při srovnání tohoto přístupu s Hartmannovou operací [109]. Myers et al popsali výsledky laparoskopické drenáže u 92 nemocných s perforovanou divertikulitidou léčených laparoskopicky a konzervativně. Jen u jednoho byla provedena resekce s kolostomií [110]. Zdá se, že po úspěšné laparoskopické drenáži peritonitidy nemusí nevyhnutelně následovat elektivní resekce. V současnosti je v běhu nizozemská multicentrická prospektivní studie. V plánu je zařadit dostatečný počet nemocných, aby výsledky byly validní. U purulentní peritonitidy se nemocní budou zařazovat do skupin peritoneální laváž/drenáž, Hartmannova operace a resekce s primární suturou v poměru 2 : 1 : 1, u sterkorální peritonitidy do dvou skupin s Hartmannovou operací a resekcí s primární suturou v poměru 1 : 1 [111]. Elektivní resekce je také indikována u opakované divertikulitidy v prevenci dalších atak. V úvahu je třeba vzít riziko rekurence navzdory provedené resekci (do 10 %), nezanedbatelnou mortalitu (do 2,3 %) a riziko stomie blížící se 10 %. Vodítkem je znalost průběhu onemocnění. Mortalita opakované epizody divertikulitidy je nižší než u první epizody (2,5 vs 10 %) [112]. U většiny nemocných s komplikovanou divertikulitidou se jedná o první epizodu a nepředcházejí ji varovné symptomy. Rizikovým faktorem relapsu divertikulitidy je pánevní absces léčený konzervativně (nechirurgicky) a, jak už bylo uvedeno, těžký průběh mívá onemocnění u mladých jedinců. Podle studie Brodericka-Villy et al bylo relativní riziko rekurence divertikulitidy při věku nad 50 let RR 0,68 [113]. V mimořádně rozsáhlé retrospektivní studii zahrnující Washingtonský registr a čítající 25 058 nemocných s divertikulitidou podstoupilo konzervativní léčbu 80,4 % a z nich u 19 % došlo k relapsu, který byl léčen urgentní operací v 18,1 %. Riziko rekurence mladších nemocných bylo 27 vs 17 % u starších a podobně významně vyšší bylo také riziko urgentní operace. Nicméně mortalita ve věku do 40 let byla nulová, zatímco nad 50 let byla 3,4 % [114]. V dřívějších studiích byl poměr nemocných s divertikulitidou léčených chirurgicky kolem 20 %, avšak v současnosti se tento podíl snižuje v důsledku účinnější antibiotické a miniinvazivní léčby. Podle kanadské retrospektivní studie (685 390 nemocných) poklesla během 15 let do roku 2005 operabilita z 18 na 14 % u nekomplikovaných případů a ze 71 na 56 % u případů komplikovaných [115]. Podle švédské studie poklesl podíl urgentních resekcí na 5 % divertikulitid s tím, že dalších 5 % operací následovalo elektivně. Mortalita byla zaznamenána jen u sterkorálních peritonitid [116]. Operace sama může být provedena laparoskopicky i klasicky. Sigma Trial, multicentrická studie, zahrnula 52 nemocných s opakovanou atakou divertikulitidy či drenovaným abscesem nebo stenózou. Méně komplikací a kratší hospitalizace byly ve skupině laparoskopické, nicméně doba laparoskopického zákroku byla delší a konverze byla nutná v 19,2 %. V kvalitě života (SF 36) byl rozdíl ve prospěch laparoskopie jen po šesti týdnech, ale po šesti měsících se skóre vyrovnalo. Náklady na léčbu byly shodné [117,118]. Podle jiné studie zahrnujících 113 nemocných byly komplikace u obou postupů shodné, nedošlo k leaku ani k úmrtí a konverze dosáhla 8,3 %. Kratší dobu hospitalizace a kratší restituci střevní pasáže vykázala analýza u laparoskopického přístupu [119] a ke stejnému závěru dospěla metaanalýza nerandomizovaných studií [120]. Větší problémy lze očekávat u divertikulitidy komplikované abscesem nebo stenózou a výsledky rozsáhlé studie (konverze 5,3 %, morbidita 11,5 % a mortalita 0,9 %) nelze na jiných pracovištích automaticky očekávat [121]. Otázkou je optimální načasování operace. Reissfel-der et al srovnávali operace provedené 5.–8. den a 4.–6. týden od ataky divertikulitidy v letech 1999–2001 a 2002–2005. Komplikace – absces v ráně (119/116 vs 5/94), leak (8/116 vs 0/94) a konverze (9/116 vs 1/94) byly významně častější při operaci časně po zánětlivé atace [122]. Riziko rekurence se zvyšuje při kolosigmoideální anastomóze ve srovnání s anastomózou kolorektální (12,5 vs 2,9 %, 236 nemocných) [123].
Doporučení
Technika i taktika chirurgické léčby reflektují změny v charakteru onemocnění i technický pokrok. Urgentní operace se zvažuje v případě komplikací, jako jsou krvácení, ileus a sterkorální peritonitida. I ve většině těchto situací lze uplatnit alternativní instrumentální přístup. Abscesy se mohou primárně drenovat pod CT kontrolou, krvácení stavět endoskopicky a peritonitida drenovat laparoskopicky. Načasování elektivní resekce vyplývá z individuální situace. Ve zvyšující se míře se uplatňuje laparoskopická technika. Hartmannova operace i primární resekce dosahují v úhrnu stejných výsledků.
Závěr
Nemůže být překvapením, že u běžného onemocnění s klinickým obrazem v naprosté většině případů totožným s dráždivým tračníkem jsou výsledky studií s konzervativní léčbou nejednoznačné. K heterogenitě výsledků přispívá také nejednotná metodika. Studie se liší v režimu léčby i v cílech. V případě nekomplikované symptomatické divertikulózy je vhodná dieta s vyšším obsahem vlákniny, která se příznivě uplatňuje v řadě jiných diagnóz. V medikamentózní léčbě se prokázal účinek probiotik, mesalazinu i nevstřebatelného antibiotika rifaximinu, a to zejména v kombinacích. V léčbě nekomplikované nemoci je však třeba tuto léčbu indikovat uvážlivě v korelaci s tíží symptomů i osobnostním profilem nemocného. Protizánětlivá léčba je indikována také v prevenci rekurence divertikulitidy. Rifaximin by se měl podávat intervalově. K léčbě nekomplikované zánětlivé ataky bez známek sepse postačí dostatečná hydratace, v případě těžkého zánětu a komplikací jsou na místě antibiotika. Absces by měl být přednostně drenován pod CT kontrolou. I peritonitida se ve většině případů zvládne drenáží bez následné resekce postiženého úseku. Případná operace by se měla zvažovat individuálně. Zvyšuje se podíl laparoskopického přístupu. Časnější chirurgický zásah by měl být zvažován u mladších a imunokompromitovaných nemocných.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 21. 4. 2014
Přijato: 26. 5. 2014
prof. MUDr. Julius Špičák, CSc.
Klinika hepatogastroenterologie, IKEM
Vídeňská 1958/9, 140 21 Praha 4
julius.spicak@ikem.cz
Zdroje
1. Shaheen NJ, Hansen RA, Morgan DR et al. The burden of gastrointestinal and liver diseases, 2006. Am J Gastroenterol 2006; 101(9): 2128–2138.
2. Etzioni DA, Mack TM, Beart RW Jr et al. Diverticulitis in the United States: 1998–2005: changing patterns of disease and treatment. Ann Surg 2009; 249(2): 210–217. doi: 10.1097/SLA.0b013e3181952888.
3. Warner E, Crighton EJ, Moineddin R et al. Fourteen-year study of hospital admissions for diverticular disease in Ontario. Can J Gastroenterol 2007; 21(2): 97–99.
4. Kang JY, Hoare J, Tinto A et al. Diverticular disease of the colon – on the rise: a study of hospital admissions in England between 1989/1990 and 1999/2000. Aliment Pharmacol Ther 2003; 17(9): 1189–1195.
5. Painter NS, Burkitt DP. Diverticular dis-ease of the colon: a deficiency disease of Western civilization. Br Med J 1971; 2(5759): 450–454.
6. Burkitt DP, Walker AR, Painter NS. Effect of dietary fibre on stools and the transit-times, and its role in the causation of dis-ease. Lancet 1972; 2(7792): 1408–1412.
7. Arora G, Mannalithara A, Mithal A et al. Concurrent conditions in patients with chronic constipation: a population-based study. PLoS One 2012; 7(10): e42910. doi: 10.1371/journal.pone.0042910.
8. Kang JY, Firwana B, Green AE et al. Uncomplicated diverticular disease is not a common cause of colonic symptoms. Aliment Pharmacol Ther 2011; 33(4): 487–494. doi: 10.1111/j.1365-2036.2010.04540.x.
9. Peery AF, Barrett PR, Park D et al. A high-fiber diet does not protect against asymptomatic diverticulosis. Gastroenterology 2012; 142(2): 266–272. doi: 10.1053/j.gastro.2011.10.035.
10. Strate LL, Liu YL, Syngal S et al. Nut, corn, and popcorn consumption and the incidence of diverticular disease. JAMA 2008; 300(8): 907–914. doi: 10.1001/jama.300.8.907.
11. Crowe FL, Balkwill A, Cairns BJ et al. Source of dietary fibre and diverticular disease incidence: a prospective study of UK women. Gut 2014. [In press]. doi: 10.1136/gutjnl-2013-304644.
12. Hjern F, Wolk A, Hakansson N. Smoking and the risk of diverticular disease in women. Br J Surg 2011; 98(7): 997–1002. doi: 10.1002/bjs.7477.
13. Humes DJ, Fleming KM, Spiller RC et al. Concurrent drug use and the risk of perforated colonic diverticular disease: a population-based case-control study. Gut 2011; 60(2): 219–224. doi: 10.1136/gut.2010.217281.
14. Strate LL, Liu YL, Huang ES et al. Use of aspirin or nonsteroidal anti-inflammatory drugs increases risk for diverticulitis and diverticular bleeding. Gastroenterology 2011; 140(5): 1427–1433. doi: 10.1053/j.gastro.2011.02.004.
15. Morris CR, Harvey IM, Stebbings WS et al. Do calcium channel blockers and antimuscarinics protect against perforated colonic diverticular disease? A case control study. Gut 2003; 52(12): 1734–1737.
16. Hjern F, Wolk A, Hakansson N. Obesity, physical inactivity, and colonic diverticular disease requiring hospitalization in women: a prospective cohort study. Am J Gastroenterol 2012; 107(2): 296–302. doi: 10.1038/ajg.2011.352.
17. Tonnesen H, Engholm G, Moller H. Association between alcoholism and diverticulitis. Br J Surg 1999; 86(8): 1067–1068.
18. Bassotti G, Sietchiping-Nzepa F, De Roberto G et al. Colonic regular contractile frequency patterns in irritable bowel syndrome: the 'spastic colon' revisited. Eur J Gastroenterol Hepatol 2004; 16(6): 613–617.
19. Golder M, Burleigh DE, Belai A et al. Smooth muscle cholinergic denervation hypersensitivity in diverticular disease. Lancet 2003; 361(9373): 1945–1951.
20. Böttner M, Barrenschee M, Hellwig I et al. The enteric serotonergic system is altered in patients with diverticular disease. Gut 2013; 62(12): 1753–1762. doi: 10.1136/gutjnl-2012-302660.
21. Bassotti G, Battaglia E, Bellone G et al. Interstitial cells of Cajal, enteric nerves, and glial cells in colonic diverticular disease. J Clin Pathol 2005; 58(9): 973–977.
22. Milner P, Crowe R, Kamm MA et al. Vasoactive intestinal polypeptide levels in sigmoid colon in idiopathic constipation and diverticular disease. Gastroenterology 1990; 99(3): 666–675.
23. Tursi A, Brandimarte G, Giorgetti GM et al. Assessment of small intestinal bacterial overgrowth in uncomplicated acute diverticulitis of the colon. World J Gastroenterol 2005; 11(18): 2773–2776.
24. Horgan AF, McConnell EJ, Wolff BG et al. Atypical diverticular disease: surgical results. Dis Colon Rectum 2001; 44(9): 1315–1318.
25. Parks TG. Natural history of diverticular disease of the colon. Clin Gastroenterol 1975; 4(1): 53–69.
26. Painter NS, Truelove SC, Ardran GM et al. Segmentation and the localization of intraluminal pressure in the human colon, with special reference to the pathogenesis of colonic diverticula. Gastroenterology 1968; 54 (4 Suppl): 778–780.
27. Sugihara K, Muto T, Morioka Y et al. Diverticular disease of the colon in Japan. A review of 615 cases. Dis Colon Rectum 1984; 27(8): 531–537.
28. Lohsiriwat V, Suthikeeree W. Pattern and distribution of colonic diverticulosis: analysis of 2877 barium enemas in Thailand. World J Gastroenterol 2013; 19(46): 8709–8713. doi: 10.3748/wjg.v19.i46.8709.
29. Shahedi KF, Fuller G, Bolus R et al. Progression from incidental diverticulosis to acute diverticulitis. Gastroenterology 2012; 142 (Suppl 1): 144.
30. Stollman N, Raskin JB. Diverticular dis-ease of the colon. Lancet 2004; 363(9409): 631–639.
31. Hart AR, Kennedy HJ, Stebbings WS et al. How frequently do large bowel diverticula perforate? An incidence and cross-sectional study. Eur J Gastroenterol Hepatol 2000; 12(6): 661–665.
32. Kvasnovsky CL, Papagrigoriadis S, Bjarnason I. Increased diverticular complications with nonsteroidal anti-inflammatory drugs and other medications: a systematic review and meta-analysis. Colorectal Dis 2014; 16(6): 189–196. doi: 10.1111/codi.12516.
33. Yap FY, Omene BO, Patel MN et al. Transcatheter embolotherapy for gastrointestinal bleeding: a single center review of safety, efficacy, and clinical outcomes. Dig Dis Sci 2013; 58(7): 1976–1984. doi: 10.1007/s10620-012-2547-z.
34. Couto-Worner I, González-Conde B, Estévez-Prieto E et al. Colonic diverticular bleeding: urgent colonoscopy without purging and endoscopic treatment with epinephrine and hemoclips. Rev Esp Enferm Dig 2013; 105(8): 495–498.
35. Ghassemi KA, Jensen DM. Lower GI bleeding: epidemiology and management. Curr Gastroenterol Rep 2013; 15(7): 333. doi: 10.1007/s11894-013-0333-5.
36. Hinchey EJ, Schaal PG, Richards GK. Treatment of perforated diverticular disease of the colon. Adv Surg 1978; 12 : 85–109.
37. Hansen O, Stock W. Prophylactische operation bei der divertikelkrankheit des kolons – stufenkoncept durch exakte stadienteilung. Langenbecks Arch Chir 1999; Suppl II: 1257–1260.
38. Klarenbeek BR, de Korte N, van der Peet DL et al. Rerview of current classifications for diverticular disease and a translation into clinical practice. Int J Colorectal Dis 2012; 27(2): 207–214. doi: 10.1007/s00384-011-1314-5.
39. Lamps LW, Knapple WL. Diverticular disease-associated segmental colitis. Clin Gastroenterol Hepatol 2007; 5(1): 27–31.
40. Mulhall AM, Mahid SS, Petras RE et al. Diverticular disease associated with inflammatory bowel disease-like colitis: a systematic review. Dis Colon Rectum 2009; 52(6): 1072–1079. doi: 10.1007/DCR.0b013e31819ef79a.
41. Clemens CH, Samsom M, Roelofs J et al. Colorectal visceral perception in diverticular disease. Gut 2004; 53(5): 717–722.
42. Jung HK,Choung RS, Locke GR 3rd et al. Diarrhea-predominant irritable bowel syndrome is associated with diverticular disease: a population-based study. Am J Gastroenterol 2010; 105(3): 652–661. doi: 10.1038/ajg.2009.621.
43. Stallinger S, Eller N, Högenauer C. Non-interventional study evaluating efficacy and tolerability of rifaximin for treatment of uncomplicated diverticular disease. Wien Klin Wochenschr 2014; 126(1–2): 9–14. doi: 10.1007/s00508-013-0447-7.
44. Horgan AF, McConnell EJ, Wolff BG et al. Atypical diverticular disease: surgical results. Dis Colon Rectum 2001; 44(9): 1315–1318.
45. Green BT, Rockey DC, Portwood G et al. Urgent colonoscopy for evaluation and management of acute lower gastrointestinal hemorrhage: a randomized controlled trial. Am J Gastroenterol 2005; 100(11): 2395–2402.
46. Laméris W, van Randen A, Bipat S et al. Graded compression ultrasonography and computed tomography in acute colonic diverticulitis: meta-analysis of test accuracy. Eur Radiol 2008; 18(11): 2498–2511. doi: 10.1007/s00330-008-1018-6.
47. Heverhagen JT, Sitter H, Zielke A et al. Prospective evaluation of the value of magnetic resonance imaging in suspected acute sigmoid diverticulitis. Dis Colon Rectum 2008; 51(12): 1810–1515. doi: 10.1007/s10350-008-9330-4.
48. Sakhnini E, Lahat A, Melzer E et al. Early colonoscopy in patients with acute diverticulitis: results of a prospective pilot study. Endoscopy 2004; 36(6): 504–507.
49. Melchior S, Cudovic D, Jones J et al. Diagnosis and surgical management of colovesical fistulas due to sigmoid diverticulitis. J Urol 2009; 182(3): 978–982. doi: 10.1016/j.juro.2009.05.022.
50. Taylor I, Duthie HL. Bran tablets and diverticular disease. Br Med J 1976; 1(6016): 988–990.
51. Brodribb AJ. Treatment of symptomatic diverticular disease with a high-fibre diet. Lancet 1977; 1(8013): 664–666.
52. Hodgson WJ. The placebo effect. Is it important in diverticular disease? Am J Gastroeterol 1977; 67(2): 157–162.
53. Ornstein MH, Littlewood ER, Baird IM et al. Are fibre supplements really necessary in diverticular disease of the colon? A controlled clinical trial. Br Med J (Clin Res Ed) 1981; 282(6273): 1353–1356.
54. Smits BJ, Whitehead AM, Prescott P. Lactulose in the treament of symptomatic diverticular disease: a comparative study with high-fibre diet. Br J Clin Pract 1990; 44(8): 314–318.
55. Aldoori WH, Giovannucci EL, Rimm EB et al. A prospective study of diet and the risk of symptomatic diverticular disease in men. Am J Clin Nutr 1994; 60(5): 757–764.
56. Ünlü C, Daniels L, Vrouenraets BC et al. A systematic review of high-fibre dietary therapy in diverticular disease. Int J Colorectal Dis 2012; 27(4): 419–427. doi: 10.1007/s00384-011-1308-3.
57. Tursi A. Diverticular disease: a therapeutic overview. World J Gastrointest Pharmacol Ther 2010; 1(1): 27–35. doi: 10.4292/wjgpt.v1.i1.27.
58. Adamová Z. Divertikulární nemoc tračníku. Rozhl Chir 2011; 90 : 463–477.
59. Antoš F. Divertikulární choroba tlustého střeva. Praha: Avicenum 1990 : 141–149.
60. Chabok A, Pahlman L, Hjern F et al. Randomized clinical trial of antibiotics in acute uncomplicated diverticulitis. Br J Surg 2012; 99(4): 532–539. doi: 10.1002/bjs.8688.
61. Unlü C, de Korte N, Daniels L et al. A multicenter randomized clinical trial investigating the cost-effectiveness of treatment strategies with or without antibiotics for uncomplicated acute diverticulitis (DIABOLO trial). BMC Surg 2010; 10 : 23. doi: 10.1186/1471-2482-10-23.
62. Papi C, Ciaco A, Koch M et al. Efficacy of rifaximin on symptoms of uncomplicated diverticular disease of the colon. A pilot multicentre open trial. Ital J Gastroenterol 1992; 24(8): 452–456.
63. Papi C, Ciaco A, Koch M et al. Efficacy of rifaximin in the treatment of symptomatic diverticular disease of the colon. A multicentre double-blind placebo-controlled trial. Aliment Pharmacol Ther 1995; 9(1): 33–39.
64. Latella G, Pimpo MT, Sottili S et al. Rifaximin improves symptoms of acquired uncomplicated diverticular disease of the colon. Int J Colorectal Dis 2003; 18(1): 55–62.
65. Pistoia MA, Lombardi L, Rossi M et al. Does rifaximin prevent complications of diverticular disease? A retrospective study. Eur Rev Med Pharmacol Sci 2004; 8(6): 283–287.
66. Colecchia A, Vestito A, Pasqui F et al. Efficacy of long term cyclic administration of the poorly absorbed antibiotic rifaximin in symptomatic, uncomplicated colonic diverticular disease. World J Gastroenterol 2007; 13(2): 264–269.
67. D´Inca R, Pomerri F, Vettorato MG et al. Interaction between rifaximin and dietary fibre in patients with diverticular disease. Aliment Pharmacol Ther 2007; 25(7): 771–779.
68. Trivedi CD, Das KM. Emerging therapies for diverticular disease of the colon. J Clin Gastroenterol 2008; 42(10): 1145–1151. doi: 10.1097/MCG.0b013e318188adc1.
69. Bianchi M, Festa V, Moretti A et al. Meta-analysis: long-term therapy with rifaximin in the management of uncomplicated diverticular disease. Aliment Pharmacol Ther 2011; 33(8): 902–910. doi: 10.1111/j.1365-2036.2011.04606.x.
70. Calanni F, Renzulli C, Fogli MV et al. Comment on: rifaximin in the treatment of irrit-able bowel syndrome. Is there a high risk for development of antimicrobial resistance? J Clin Gastroenterol 2013; 47(9): 814. doi: 10.1097/MCG.0b013e3182951b6c.
71. Trepsi E, Colla C, Panizza P et al. Therapeutic and prophylactic role of mesalazine (5-ASA) in symptomatic diverticular dis-ease of the large intestine. 4 year follow-up results. Minerva Gastroenterol Dietol 1999; 45(4): 245–252.
72. Tursi A, Brandimarte G, Daffina R. Long-term treatment with mesalazine and rifaximin versus rifaximin alone for patients with reccurent attacks of acute diverticulitis of colon. Dig Liver Dis 2002; 34(7): 510–515.
73. Tursi A, Brandimarte G, Giorgetti GM et al. Balsalazide and/or high-potency probiotic mixture (VSL#3) in maintaining remission after attack of acute, uncomplicated diverticulitis of the colon. Int J Colorectal Dis 2007; 22(9): 1103–1108.
74. Stollman N, Magowan S, Shanahan F et al. A randomized controlled study of mesalamine after acute diverticulitis: results of the DIVA trial. J Clin Gastroenterol 2013; 47(7): 621–629. doi: 10.1097/MCG.0b013e31828003f6.
75. Gatta L, Vakil N, Vaira D et al. Efficacy of 5-ASA in the treatment of colonic diverticular disease. J Clin Gastroenterol 2010; 44(2): 113–119. doi: 10.1097/MCG.0b013e3181a15864.
76. Shire. Shire announces top-line results of the PREVENT2 trial. [online]. Available from: http://www.shire.com/shireplc/en/investors/irshirenews?id=583.
77. Di Mario F, Aragona G, Leandro G et al. Efficacy of mesalazine in the treatment of symptomatic divesticular disease. Dig Dis Sci 2005; 50(3): 581–586.
78. Seth A, Yan F, Polk DB et al. Probiotics ameliorate the hydrogen peroxide-induced epithelial barrier disruption by a PKC - and MAP kinase-dependent mechanism. Am J Physiol Gastrointest Liver Physiol 2008; 294(4): G1060–G1069. doi: 10.1152/ajpgi.00202.2007.
79. Yan F, Cao H, Cover TL et al. Soluble proteins produced by probiotic bacteria regulate intestinal epithelial cell survival and growth. Gastroenterology 2007; 132(2): 562–575.
80. Borruel N, Carol M, Casellas F et al. Increased mucosal tumour necrosis factor alpha production in Crohn's disease can be downregulated ex vivo by probiotic bacteria. Gut 2002; 51(5): 659–664.
81. Lin YP, Thibodeaux CH, Peña JA et al. Probiotic Lactobacillus reuteri suppress proinflammatory cytokines via c-Jun. In-flamm Bowel Dis 2008; 14(8): 1068–1083. doi: 10.1002/ibd.20448.
82. Dalmasso G, Cottrez F, Imbert V et al. Saccharomyces boulardii inhibits inflammatory bowel disease by trapping T cells in mesenteric lymph nodes. Gastroenterology 2006; 131(6): 1812–1825.
83. Rousseaux C, Thuru X, Gelot A et al. Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nat Med 2007; 13(1): 35–37.
84. Tursi A, Brandimarte G, Giorgetti GM et al. Mesalazine and/or Lactobacillus casei in preventing recurrence of symptomatic uncomplicated diverticular disease of the colon: a prospective, randomized, open-label study. J Clin Gastroenterol 2006; 40(4): 312–316.
85. Annibale B, Maconi G, Lahner E et al. Efficacy of Lactobacillus paracasei sub. paracasei F19 on abdominal symptoms in patients with symptomatic uncomplicated diverticular disease: a pilot study. Minerva Gastroenterol Dietol 2011; 57(1): 13–22.
86. Lamiki P, Tsuchiya J, Pathak S et al. Probiotics in diverticular disease of the colon: an open label study. J Gastrointestin Liver Dis 2010; 19(1): 31–36.
87. Tursi A, Brandimarte G, Elisei W. Randomised clinical trial: mesalazine and//or probiotics in maintaining remission of symptomatic uncomplicated diverticular disease – a double-blind, randomised, placebo-controlled study. Aliment Pharmacol Ther 2013; 38(7): 741–751. doi: 10.1111/apt.12463.
88. Fric P, Zavoral M. The effect of non-pathogenic Escherichia coli in symptomatic uncomplicated diverticular disease of the colon. Eur J Gastroenterol Hepatol 2003; 15(3): 313–315.
89. Yan F, Polk DB. Probiotic bacterium prevents cytokine-induced apoptosis in intestinal epithelial cells. J Biol Chem 2002; 277(52): 50959–50965.
90. Rachmilewitz D, Katakura K, Karmeli F et al. Toll-like receptor 9 signaling mediates the anti-inflammatory effects of probiotics in murine experimental colitis. Gastroenterology 2004; 126(2): 520–528.
91. Katakura K, Lee J, Rachmilewitz D et al. Toll-like receptor 9-induced type I IFN protects mice from experimental colitis. J Clin Invest 2005; 115(3): 695–702.
92. Yan F, Cao H, Cover TL et al. Soluble proteins produced by probiotic bacteria regulate intestinal epithelial cell survival and growth. Gastroenterology 2007; 132(2): 562–575.
93. Maconi G, Barbara G, Bosetti C et al. Treatment of diverticular disease of the colon and prevention of acute diverticulitis: a systematic review. Dis Colon Rectum 2011; 54(10): 1326–1338. doi: 10.1097/DCR.0b013e318223cb2b.
94. Chappuis CW, Cohn I Jr. Acute colonic diverticulitis. Surg Clin North Am 1988; 68 : 301.
95. Biondo S, Parés D, Martí Ragué J et al. Acute colonic diverticulitis in patients under 50 years of age. Br J Surg 2002; 89(9): 1137–1141.
96. Schauer PR, Ramos R, Ghiatas AA et al. Virulent diverticular disease in young obese men. Am J Surg 1992; 164(5): 443–446.
97. Chodak GW, Rangel DM, Passaro E Jr. Colonic diverticulitis in patients under age 40: need for earlier diagnosis. Am J Surg 1981; 141(6): 699–702.
98. Fischer MG, Farkas AM. Diverticulitis of the cecum and ascending colon. Dis Colon Rectum 1984; 27(7): 454–458.
99. Markham NI, Li AK. Diverticulitis of the right colon – experience from Hong Kong. Gut 1992; 33(4): 547–549.
100. Lo CY, Chu KW. Acute diverticulitis of the right colon. Am J Surg 1996; 171(2): 244–246.
101. Ambrosetti P, Chautems R, Soravia C et al. Long-term outcome of mesocolic and pelvic diverticular abscesses of the left colon: a prospective study of 73 cases. Dis Colon Rectum 2005; 48(4): 787–791.
102. Siewert B, Tye G, Kruskal J et al. Impact of CT-guided drainage in the treatment of diverticular abscesses: size matters. Am J Roentgenol 2006; 186(3): 680–686.
103. Durmishi Y, Gervaz P, Brandt D et al. Results from percutaneous drainage of Hinchey stage II diverticulitis guided by computer tomography scan. Surg Endosc 2006; 20(7): 1129–1133.
104. Kumar RR, Kim JT, Haukoos JS et al. Factors affecting the successful management of intra-abdominal abscesses with antibiotics and the need for percutaneous drainage. Dis Colon Rectum 2006; 49(2): 183–189.
105. Kronborg O. Treatment of perforated sigmoid diverticulitis: a prospective randomized trial. Br J Surg 1993; 80(4): 505–507.
106. Zeitoun G, Laurent A, Rouffet F et al. Multicentre, randomized clinical trial of primary versus secondary sigmoid resection in generalized peritonitis complicating sigmoid diverticulitis. Br J Surg 2000; 87(10): 1366–1374.
107. Salem L, Flum DR. Primary anastomosis or Hartmann´s procedure for patients with diverticular peritonitis? A systematic review. Dis Colon Rectum 2004; 47(11): 1953–1964.
108. Constantinides VA, Tekkis PP, Athanasiou T et al. Primary resection with anastomosis vs. Hartmann's procedure in nonelective surgery for acute colonic diverticulitis: a systematic review. Dis Colon Rectum 2006; 49(7): 966–981.
109. Karoui M, Champault A, Pautrat K et al. Laparoscopic peritoneal lavage or primary anastomosis with defunctioning stoma for Hinchey 3 complicated diverticulitis: results of a comparative study. Dis Colon Rectum 2009; 52(4): 609–615. doi: 10.1007/DCR.0b013e3181a0a674.
110. Myers E, Hurley M, O´Sullivan GC et al. Laparoscopic peritoneal lavage for generalized peritonitis due to perforated divertikulitis. Br J Surg 2008; 95(1): 97–101.
111. Swank HA, Vermeulen J, Lange JF et al. The ladies trial: laparoscopic peritoneal lavage or resection for purulent peritonitis and Hartmann´s procedure or resection with primary anastomosis for purulent or faecal peritonitis in perforated divertikulitis (NTR2037). BMC Surg 2010; 10 : 29. doi: 10.1186/1471-2482-10-29.
112. Somasekar K, Foster ME, Haray PN. The natural history diverticular disease: is there a role for elective colectomy? J R Coll Surg Edinb 2002; 47(2): 481–482, 484.
113. Broderick-Villa G, Burchette RJ, Collins JC et al. Hospitalization for acute diverticulitis does not mandate routine elective colectomy. Arch Surg 2005; 140(6): 576–581, discussion: 581–583.
114. Anaya DA, Flum DR. Risk of emergency colectomy and colostomy in patients with diverticular disease. Arch Surg 2005; 140(7): 681–685.
115. Ricciardi R, Baxter NN, Read TE et al. Is the decline in the surgical treatment for diverticulitis associated with an increase in complicated diverticulitis? Dis Colon Rectum 2009; 52(9): 1558–1563. doi: 10.1007/DCR.0b013e3181a90a5b.
116. Hjern F, Josephson T, Altman D et al. Outcome of younger patients with acute diverticulitis. Br J Surg 2008; 95(6): 758–764. doi: 10.1002/bjs.6137.
117. Klarenbeek BR, Bergamaschi R, Veenhof AA et al. Laparoscopic versus open sigmoid resection for diverticular disease: follow-up assessment of the randomized control Sigma trial. Surg Endosc 2011; 25(4): 1121–1126. doi: 10.1007/s00464-010-1327-0.
118. Klarenbeek BR, Coupé VM, van der Peet DL et al. The cost effectiveness of elective laparoscopic sigmoid resection for symptomatic diverticular disease: financial outcome of the randomized control Sigma trial. Surg Endosc 2011; 25(3): 776–783. doi: 10.1007/s00464-010-1252-2.
119. Gervaz P, Inan I, Perneger T et al. A prospective, randomized, single-blind comparison of laparoscopic versus open sigmoid colectomy for diverticulitis. Ann Surg 2010; 252(1): 3–8. doi: 10.1097/SLA.0b013e3181dbb5a5.
120. Purkayastha S, Constantinides VA, Tekkis PP et al. Laparoscopic vs. open surgery for diverticular disease: a meta-analysis of nonrandomized studies. Dis Colon Rectum 2006; 49(4): 446–463.
121. Jones OM, Stevenson AR, Clark D et al. Laparoscopic resection for diverticular dis-ease: follow-up of 500 consecutive patients. Ann Surg 2008; 248(6): 1092–1097. doi: 10.1097/SLA.0b013e3181884923.
122. Reissfelder C, Buhr HJ, Ritz JP. What is the optimal time of surgical intervention after an acute attack of sigmoid diverticulitis: early or late elective laparoscopic resection? Dis Colon Rectum 2006; 49(12): 1842–1848.
123. Thaler K, Baig MK, Berho M et al. Determinants of recurrence after sigmoid resection for uncomplicated diverticulitis. Dis Colon Rectum 2003; 46(3): 385–388.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2014 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Pozvánka na ESGE Live Demonstration
- Pohled laiků, lékařů a pacientů na novou metodu léčby achalázie (POEM) – dotazníková studie
- Efekt učení perorální endoskopické myotomie (POEM) během prvního roku ověřování metody v České republice
- Efektivní techniky uzávěru transrektálního přístupu NOTES – výsledky experimentální studie
- Kvíz: Recidivující subileózní stav u mladé pacientky
- Divertikulární choroba
- Celiakia – body mass index u pacientov v čase diagnózy a efekt bezlepkovej diéty
- Stanovenie hladiny C-peptidu v priebehu glukózového tolerančného testu u pacientov s karcinómom pankreasu
- High-resolution anorektální manometrie – update v diagnostice anorektálních poruch
- Autoimunitní pankreatitida u pacientů po resekci pro ložiskový proces pankreatu – první výsledky
- Účinnosť a bezpečnosť silymarínu u pacientov s chronickými chorobami pečene – multicentrická, prospektívna, otvorená klinická štúdia IMHOTEP
- Kolorektální screening a projekt adresného zvaní – elegantní řešení přetíženosti kolonoskopických screeningových center
- Projekt RISING STARS
- Dobrodružství českého gastroenterologa v Africe
- Fakultní nemocnice v Plzni přivítala druhý ročník Motilitní akademie
- XXVIIIth Hildebrand Bardejov gastroenterology days 2014
- Ostrava Live Endoscopy, 20. červen 2014 – fenomenální úspěch
- Novinka v léčbě akutních i chronických průjmů v České republice – Tammex family a Tammex family plus
- Správná odpověď na kvíz
- Autodidaktický test: klinická a experimentální gastroenterologie
- Prevenar 13 – vakcína první volby v prevenci pneumokokových infekcí u imunokompromitovaných osob
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Účinnosť a bezpečnosť silymarínu u pacientov s chronickými chorobami pečene – multicentrická, prospektívna, otvorená klinická štúdia IMHOTEP
- High-resolution anorektální manometrie – update v diagnostice anorektálních poruch
- Divertikulární choroba
- Kvíz: Recidivující subileózní stav u mladé pacientky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



