-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vývoj léčby idiopatických střevních zánětů v posledních 20 letech
Therapy of inflammatory bowel diseases over the past two decades
The therapy of inflammatory bowel diseases (IBD) has substantially changed over the past two decades, mostly because of the introduction of biologic agents. Whereas aminosalicylates still remain the major drug for ulcerative colitis, their role in Crohn’s disease has however become negligible. Thiopurines dominate in long‑term maintenance therapy of IBD, especially in Cronh’s desease; they also play an important role in combined therapy with anti‑TNF antibodies. Systemic steroids still remain an important and highly effective drug for severely active IBD. Budesonide is a clearly weaker, topical variant with no effect in maintenance therapy. Whereas biologic therapy, namely anti‑TNF antibodies, are currently at the top of the therapeutic pyramid, vedolizumab, a promising representative of the new class of integrin antibodies has recently been registered, and is expected to be marketed soon in the Czech Republic. Surgical therapy is an inseparable part of IBD treatment. Current management of IBD is based on individualized and tailored therapy, and aimed at treatment that targets: the elimination of the risk of irreversible structural changes and repeated surgeries with disabling consequences for the patient.
Key words:
inflammatory bowel disease – ulcerative colitis – Crohn’s disease – therapy
Autori: M. Bortlík
Pôsobisko autorov: Klinické a výzkumné centrum pro střevní záněty ISCARE I. V. F. a. s. a Interní klinika 1. LF UK a ÚVN, Praha
Vyšlo v časopise: Gastroent Hepatol 2015; 69(4): 341-350
Kategória: 70 let České gastroenterologické společnosti
Súhrn
V terapii idiopatických střevních zánětů (IBD) došlo v posledních dvou desetiletích k významným změnám, které souvisejí především se zavedením biologické léčby. Aminosalicyláty jsou využívány zejména v léčbě ulcerózní kolitidy, jejich role v terapii Crohnovy choroby je minimální. Thiopurinová imunosupresiva jsou nejpoužívanějšími léky v dlouhodobé udržovací léčbě IBD, zejména pak Crohnovy choroby, významnou roli mají i v kombinované léčbě s protilátkami proti tumor nekrotizujícímu faktoru (anti‑TNF). Systémové glukokortikoidy jsou stále významným nástrojem k potlačení vysoké aktivity IBD, jejich topická varianta – budesonid – je méně efektivní a není účinný v udržovací léčbě. Biologické terapii, která je vrcholem medikamentózní terapie obou forem IBD, dominují stále anti‑TNF protilátky. V dohledné době bude v ČR k dispozici antiintegrinová protilátka vedolizumab, která vykazuje vysokou účinnost především u pacientů s ulcerózní kolitidou. Nedílnou součástí komplexní léčby IBD je terapie chirurgická. Současná strategie léčby IBD je založena na terapii šité na míru individuálního pacienta, jejím cílem je dlouhodobé potlačení zánětlivé aktivity, minimalizace rizika strukturálních změn, opakovaných chirurgických výkonů a následné invalidizace pacienta.
Klíčová slova:
idiopatické střevní záněty – ulcerózní kolitida – Crohnova choroba – terapieÚvod
Idiopatické střevní záněty (IBD), mezi něž řadíme Crohnovu chorobu (CN) a ulcerózní kolitidu (UC), patří mezi zánětlivá onemocnění trávicí trubice se širokým spektrem projevů střevních i mimostřevních. Ačkoli jde o relativně vzácné nemoci postihující přibližně 0,3 – 0,5 % naší populace [1], z řady příčin se obě choroby zařadily v uplynulých dvou dekádách mezi nejsledovanější onemocnění v oblasti celé gastroenterologie. Důvody lze spatřovat nejen ve stále neznámé etiologii, chronickém a špatně předvídatelném průběhu, ale také v narůstajícím výskytu – zejména v dětské a adolescentní populaci. Klíčovou roli v tomto období ovšem sehrál bouřlivý vývoj v oblasti terapie IBD, zejména terapie medikamentózní. Ten je do značné míry spjat s objevem a zavedením látek souhrnně označovaných jako biologická léčba a uplynulých 20 let lze z tohoto pohledu bez nadsázky označit jako éru biologické terapie IBD.
Léčba CN a UC ovšem nespočívá jen v aplikaci biologik, většina nemocných je stále léčena především látkami, které řadíme mezi léky konvenční. Aminosalicyláty, kortikoidy, imunosupresiva, ale též antibiotika, probiotika či nutriční a podpůrná terapie rovněž prošly nezanedbatelným vývojem. Sulfasalazin byl definitivně u většiny pacientů nahrazen mesalazinem, jehož lokální formy (čípky, nálevy, pěna) navíc významně přispívají k léčbě distálních forem UC. Byly zavedeny topické kortikoidy (budesonid) a imunosupresivní terapie reprezentovaná především thiopuriny (azathioprin, 6‑merkaptopurin) se stala rutinní součástí udržovací terapie IBD. Jiné imunosupresivum – cyklosporin A – prokazuje vysokou účinnost v záchranné terapii nemocných s těžkou atakou UC, byť v praxi je v této indikaci využíván jen zřídka. Antibiotika (ciprofloxacin, metronidazol) dnes patří do první linie léčby perianálních forem CN, byla prokázána efektivita probiotického kmene E. coli Nissle 1917 v udržovací léčbě UC, enterální výživa je běžně využívána nejen v léčbě dětských pacientů, ale i u dospělých (tab. 1).
Tab. 1. Přehled medikamentózní terapie IBD dostupné v ČR. Tab. 1. Summary of the pharmacological treatment of IBD available in the Czech Republic. 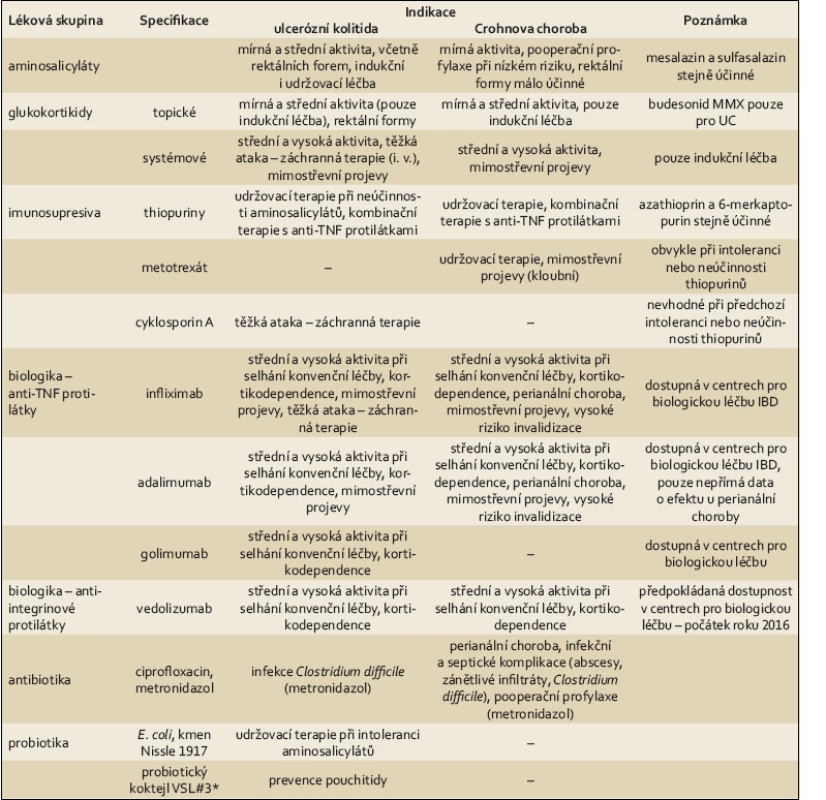
*Preparát VSL#3 je nyní na českém trhu k dispozici pod názvem Vivomixx. Obsahuje tyto bakteriální kmeny: Streptococcus thermophilus, Bifidobacterium breve, Bifidobacterium longum, Bifidobacterium infantis, Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus paracasei, Lactobacillus delbrueckii subsp. bulgaricus. Samostatnou kapitolu tvoří chirurgická léčba střevních zánětů. Od rozsáhlých, mutilujících výkonů se v souladu se všeobecným chirurgickým trendem přesunula k výkonům minimalizujícím ztrátu resorpční plochy tenkého střeva a zachovávajícím kontinuitu trávicí trubice a kontinenci pacientů. Laparoskopická ileocékální resekce je dnes běžným výkonem, stejně jako strikturoplastika krátkých střevních striktur. Proktokolektomie s konstrukcí ileálního pouche a ileo ‑ pouch ‑ anální anastomózy je považována za zlatý standard chirurgické terapie UC, kde téměř zcela nahradila dříve prováděnou subtotální kolektomii s ileorektální anastomózou. Významných změn doznala nejen předoperační příprava pacientů, ale též perioperační průběh (zavedení protokolu ERAS – enhanced recovery after surgery) a pooperační sledování, včetně profylaktické terapie po střevní resekci.
I přes zřetelný pokrok v léčbě a úrovni péče o nemocné s IBD mnoho problémů přetrvává. Efektivita aminosalicylátů v terapii CN je minimální a podle mnoha odborníků nemají v této indikaci žádný smysl. Očekávání spojená s topickými kortikoidy se z větší části nenaplnila, relativně vyšší bezpečnost je doprovázena i zřetelně nižší účinností budesonidu, zejména v léčbě CN. Používání thiopurinů naráží na vysokou četnost nežádoucích účinků (25 – 30 %), u významné části pacientů (zejména s UC) je problémem i nízká efektivita imunosupresivní monoterapie. Cyklosporin A je sice vysoce účinný v záchranné terapii těžkých forem UC, je ovšem také lékem relativně toxickým (nefrotoxicita, infekce, šokové stavy, hypertenze), navíc je použitelný jen krátkodobě, a proto je nevhodný tam, kde selhala předchozí léčba thiopuriny. Indikace antibiotik a probiotik jsou značně omezené, problém (zejména u dospělých) činí i tolerance nutriční terapie v podobě enterální výživy. A na řadu limitů, či dokonce komplikací, narazíme i při podávání biologické terapie. Praktickým problémem je její omezená dostupnost způsobená finančními limity zdravotních pojišťoven. Ačkoli je situace v ČR nesrovnatelně lepší ve srovnání s některými zeměmi východní Evropy (např. Polskem), biologiky je léčena přibližně polovina skutečně indikovaných pacientů. Zásadním omezením, např. v porovnání s revmatologií, je limitované spektrum biologik, které v současné době reprezentují výlučně protilátky proti tumor nekrozujícímu faktoru alfa (TNFa). S velkými nadějemi je proto očekáván vstup vedolizumabu (antiintegrinová protilátka) na náš trh na počátku roku 2016. Protilátky proti TNFa jsou velmi efektivní zejména na počátku léčby, s délkou terapie ovšem narůstá počet pacientů, kteří odpověď ztrácejí nebo se u nich objevují komplikace vyžadující přerušení nebo ukončení léčby. Je tedy zřejmé, že i přes bouřlivý vývoj a pokrok v terapii IBD existuje stále značný prostor k vývoji nových léků, zdokonalování léků již používaných a především k hledání optimálních léčebných strategií „šitých na míru“ individuálního pacienta.
Praktickým důsledkem dnes dominujícího principu medicíny založené na důkazech (evidence based medicine) je tvorba doporučení týkajících se diagnostiky a léčby řady onemocnění. V oblasti IBD byl hlavním impulzem pro tvorbu těchto doporučení vznik Evropské společnosti pro Crohnovu chorobu a ulcerózní kolitidu (ECCO) v roce 2001, jejíž aktivitou vznikla již více než desítka doporučení zaměřených na různé oblasti IBD. Na národní úrovni se této aktivitě věnuje Pracovní skupina pro idiopatické střevní záněty (PS IBD) založená v únoru roku 1996. S určitou nadsázkou lze ovšem konstatovat, že každá doporučení jsou již v době svého vzniku zastaralá a jejich absolutní dodržení v běžné klinické praxi není možné. Proto následující text shrnuje nejen současná doporučení ECCO a PS IBD, ale i aktuální pohledy na problematiku léčby IBD, jež mají potenciál být zařazeny do doporučení následujících.
Léčba ulcerózní kolitidy
Ulcerózní kolitida má charakter hemoragicko‑katarálního zánětu, který postihuje sliznici tlustého střeva, v těžké formě se mohou objevit slizniční vředy. U čtvrtiny pacientů je zasaženo pouze rektum, ve 45 % levá polovina tlustého střeva a přibližně třetina nemocných má postiženo střevo celé. U většiny pacientů dochází ke vzplanutí aktivity zánětu jednou či dvakrát ročně (intermitující průběh), méně častá je chronicky aktivní UC, při níž nedochází ke spontánní ani medikamentózně navozené remisi [2].
Konvenční medikamentózní léčba UC
Základem léčby mírné a středně aktivní UC je podávání aminosalicylátů [3]. Samotný mesalazin, který je vlastní účinnou látkou (v sulfasalazinu je vázán diazovazbou se sulfapyridinem), byl do terapie IBD zaveden až v polovině 80. let minulého století. Na náš trh se mesalazin dostal se zhruba desetiletým zpožděním (především z politických a ekonomických důvodů) a záhy prakticky nahradil dříve používaný a řadou nežádoucích účinků zatížený sulfasalazin. Paralelně byly do léčby UC zaváděny i lokální (rektální) formy mesalazinu v podobě čípků a nálevů, k dispozici (bohužel pouze v zahraničí) je i pěna obsahující mesalazin. Současně farmaceutický průmysl pokračoval ve vývoji nových lékových forem mesalazinu. Spolu s tradičními léky obsahujícími mesalazin s pH ‑ dependentním uvolňováním (Salofalk, Asacol) jsou od poloviny 90. let k dispozici i tablety s řízeným uvolňováním a nově i mesalazin ve formě granulátu (obojí v preparátu Pentasa). Výrobci zvyšují množství účinné látky v jedné tabletě nebo sáčku s cílem minimalizovat počet denních dávek. Jednou z hlavních změn týkajících se léčby mesalazinem je totiž zjištění, že terapeutický efekt je podmíněn celkovou denní dávkou, nikoli jejich počtem v průběhu dne. Ve studii PODIUM [4] byla u nemocných s UC efektivnější udržovací léčba mesalazinem v dávce 2 g podávaným jednou denně ve srovnání s režimem 2 × 1 g. Stejná efektivita mesalazinu v dávce 3 g denně jednorázově nebo rozděleně (3 × 1 g) byla zjištěna i v léčbě aktivní UC [5]. Pro zvýšení adherence pacientů k léčbě je proto v současnosti preferováno podávání mesalazinu v minimálním počtu denních dávek, ideálně jednorázově. Jde o léčbu nejen efektivní, ale i bezpečnou. Další novinkou poslední dekády jsou přípravky na bázi tzv. multi‑matrix (MMX) systému. Účinná látka je zde součástí komplexní hydrofilní a lipofilní matrix, která zajišťuje pozvolné a plynulé uvolňování léčiva (např. mesalazinu) v průběhu pasáže trávicí trubicí [6]. V ČR však dosud není MMX mesalazin dostupný.
V klinické praxi je problematická především léčba nemocných s vysokou aktivitou UC nebo těch, kteří nereagují dostatečně na mesalazin. V indukční fázi jsou léčbou volby systémové glukokortikoidy vhodné zejména u nemocných s vysoce aktivní UC. V terapii mírně a středně aktivní UC nereagující na mesalazin je kromě systémových kortikoidů možno nově použít také topický kortikoid budesonid MMX, který byl recentně uveden i na náš trh (Cortiment). Jeho efekt prokázaly dvě rozsáhlé studie (CORE I a II), které celkem zahrnuly více než 900 pacientů s UC [7,8]. V udržovací léčbě je při nedostatečném efektu mesalazinu vhodný azathioprin, jehož účinnost je u pacientů s UC mírně snížena ve srovnání s CN [9].
Biologická léčba UC
Dalším krokem v terapii UC je biologická léčba, která je v této indikaci používána od roku 2006. O rok dříve zveřejnil Paul Rutgeerts v časopise New England Journal of Medicine výsledky studií ACT 1 a 2, které se staly základním kamenem na cestě infliximabu k léčbě UC [10]. Až v roce 2012 následoval adalimumab a o rok později golimumab [11] (vše zástupci anti‑TNF protilátek). V roce 2014 pak díky výsledkům studie GEMINI 1 [12] vstoupilo do terapie UC první biologikum ze skupiny antiintegrinových protilátek – vedolizumab [13,14].
Podle současných doporučení je biologická terapie indikována u pacientů se středně a vysoce aktivní UC refrakterní na kortikoidy, při známkách kortikodependence a také ve fázi těžké ataky při hrozící kolektomii a nedostatečném efektu intravenózně podávaných systémových glukokortikoidů (tzv. záchranná terapie UC) [11]. Vzácnějšími důvody k podání biologické léčby jsou některé kloubní, kožní nebo oční komplikace UC. Nejdéle používaný (a proto nejlépe prozkoumaný) infliximab navozuje krátkodobou odpověď u 60 – 80 % pacientů, v další fázi ovšem významná část pacientů odpověď ztrácí – kolem 25 % v prvním roce a 10 – 15 % v každém dalším roce pokračující terapie [15]. Ztráta odpovědi je v klinické praxi nejčastějším problémem terapie infliximabem a spolu s výskytem nežádoucích účinků bývá hlavním důvodem k ukončení terapie. Efekt terapie lze u části pacientů obnovit intenzifikací léčby, event. změnou preparátu (terapeutický switch).
Oproti infliximabu je adalimumab méně razantní v rychlosti nástupu účinku, přibližně po roce léčby se celkový počet respondérů na infliximab i adalimumab vyrovnává. Podobně lze hodnotit i krátkodobou účinnost golimumabu, který je ovšem v klinické praxi nejmladší protilátkou proti TNF, a proto jsou i klinické zkušenosti s tímto lékem zatím velmi omezené.
Velká očekávání jsou vkládána do nejnovější molekuly na poli biologických preparátů, kterou je vedolizumab – protilátka proti integrinovému receptoru a4b7 [13,14]. Jeho protizánětlivý mechanizmus se liší od anti‑TNF protilátek a je založen na selektivní blokádě migrace aktivovaných leukocytů z cévního řečiště do tkáně střeva. Výsledkem je vysoký účinek v potlačení slizničního zánětu a také bezpečnost léčby, která postrádá systémový efekt. Lék byl schválen pro terapii UC i CN v roce 2014 na základě výsledků studií GEMINI. Zejména v případě UC (studie GEMINI I) byly dosažené výsledky pozoruhodné [12]. Téměř polovina pacientů se středně a vysoce aktivní UC odpověděla na indukční fázi léčby v šestém týdnu (dvě infuze) a po jednom roce dosáhlo remise 42 – 45 % léčených. Odlišný mechanizmus účinku ve srovnání s anti‑TNF protilátkami, vysoká účinnost a bezpečnost terapie činí vedolizumab velmi nadějným lékem, který je v nejbližších měsících očekáván i na českém trhu.
Cíle a strategie léčby UC
Cílem léčby UC je dosažení stabilní a hluboké remise, eliminace rizika vzniku střevní neoplazie a ochrana nemocného před nutností kolektomie [15]. Podobně jako u CN, i u nemocných s UC je pro dosažení uvedených cílů nutno měnit celkový přístup a strategii léčby. Ta spočívá v první řadě v hledání prognostických faktorů umožňujících identifikovat potenciálně rizikové pacienty a zahajovat u nich razantní a dostatečně efektivní léčbu dříve, než se projeví ireverzibilní změny ve střevě nebo onemocnění dosáhne stadia nezvratně směřujícího ke kolektomii. U nemocných s UC však spolehlivé prediktory nalézáme těžko. Některé práce ukazují na to, že by k nim mohl patřit nízký věk v době diagnózy UC (pod 20 let), výskyt mimostřevních projevů a refrakternost na konvenční terapii, tedy nedosažení remise při využití konvenčních léků [15,16]. Prvním krokem k zachování funkčního tračníku a rekta je včasné zahájení biologické terapie v indikovaných případech. Nález strukturálních, nevratných změn je sice typický především pro CN, i v případě UC ale může chronická zánětlivá aktivita vést ke zkrácení délky tlustého střeva, vyhlazení hauster, tubulizaci lumen se snížením elasticity střevní stěny nebo vzniku mnohočetných zánětlivých nebo pozánětlivých polypů. Kromě zvýšeného rizika neoplazie jsou tyto změny příčinou porušení funkce tračníku s projevy syndromu dráždivého střeva. Závažné je zejména postižení rekta, kdy snížení kapacity a elasticity rektální ampuly indukuje frekventní tenesmy přetrvávající i po zklidnění zánětlivé aktivity na sliznici.
U většiny nemocných s UC léčených infliximabem je používán obdobný režim jako v případě CN, tj. dávka 5 mg/ kg v týdnech 0, 2 a 6, a v případě pozitivní odpovědi stejná dávka v osmitýdenním intervalu v dlouhodobé udržovací terapii. V posledních letech se ovšem ukazuje zjevná nedostatečnost tohoto režimu u nemocných s vysokou aktivitou a klinicky těžkou atakou UC, u nichž je infliximab indikován jako záchranná terapie druhé linie (při neúčinnosti intravenózních glukokortikoidů). Na rozdíl od CN, kde vysoká zánětlivá aktivita zvyšuje šance na příznivý efekt biologické léčby, u těžké ataky UC standardní dávky infliximabu často selhávají. Za možné příčiny jsou považovány ztráty léčiva zánětem poškozenou sliznicí tračníku do stolice, rozsah zánětem poškozené plochy, který je mnohonásobný ve srovnání s relativně ložiskovým zánětem u CN, popřípadě je nedostatečný efekt infliximabu dáván do souvislosti se sníženou hladinou albuminu, která je nezávislým prediktorem nižších sérových hladin infliximabu [17]. V praxi se proto v současné době jednoznačně prosazuje intenzifikace léčby těžké ataky UC infliximabem od samého počátku terapie, přičemž existují různé varianty tohoto postupu. K nejčastějším patří podání dvojnásobné dávky (10 mg/ kg) na počátku léčby, zkrácení intervalu do druhé infuze na jeden týden, aplikace prvních tří dávek v intervalu dvou týdnů atd. Gibson et al v recentně publikované studii prokázali signifikantní redukci počtu časných kolektomií při podání intenzifikovaného režimu ve srovnání s režimem standardním [18].
Chirurgická léčba UC
V uplynulém dvacetiletí se postupně stala dominantním výkonem v léčbě UC proktokolektomie s konstrukcí ileálního rezervoáru (pouche) a pouch ‑ anální anastomózy [19]. Výhodou oproti dříve rutinně prováděné subtotální kolektomii s ileorektální anastomózou je odstranění celého postiženého střeva, eliminace rizika střevní neoplazie a symptomů vyvolaných perzistující aktivitou zánětu v pahýlu rekta. Naproti tomu ovšem stojí fakt, že konstrukce pouche je výkonem technicky podstatně náročnějším a značně expert dependentním. Jedná se navíc obvykle o výkon prováděný ve dvou nebo třech etapách, a celý proces chirurgické léčby je tak rozložen přibližně do období 12 měsíců. Prvním krokem je, zejména u nemocných v těžším stavu a při probíhající kortikoterapii, subtotální kolektomie s ponechaným pahýlem rekta a ileostomií. V odstupu několika měsíců následuje vlastní konstrukce pouche s jeho napojením na řitní kanál, obvykle při ponechání pojistné derivační ileostomie do doby zhojení anastomózy. K zanoření iloestomie pak dochází dva až tři měsíce po vytvoření pouche. Právě anastomóza mezi ileálním pouchem a anorektálním přechodem je totiž kritickým místem celé procedury a řada chronických obtíží v následujícím období zde může mít svůj původ. Septické komplikace v malé pánvi vzniklé v pooperačním období v důsledku insuficience anastomózy dávají vznik chronickým sinusům, píštělím a stenózám, jejichž následkem je zhoršena evakuace pouche a usnadněn vznik zánětu v pouchi – pouchitidy. Důsledkem technicky nedokonalého výkonu může být i ponechání delšího úseku rektální sliznice mezi anorektální junkcí a ileálním vakem – tzv. rektálního cuffu. V něm obvykle perzistuje zánět (cuffitida) projevující se tenesmy a krvácením. Ani bezproblémový průběh chirurgické léčby ovšem nevede u většiny pacientů k plné normalizaci vyprazdňovacího režimu. Obvyklý počet stolic se v příznivém případě pohybuje mezi pěti až sedmi, výjimkou není mírná inkontinence v podobě špinění. Je tedy zřejmé, že ani tento způsob léčby UC není optimální, byť kvalita života je ve srovnání s pacienty s chronicky aktivní UC zřetelně zvýšena [20].
Léčba Crohnovy choroby
Ve srovnání s UC je nejen diagnostika, ale i léčba CN zpravidla komplikovanější. Pokud by byl měřítkem úspěšnosti medikamentózní terapie podíl pacientů podstupujících léčbu chirurgickou, je zřejmé, že efektivita terapie CN je nízká a zavedení moderní biologické terapie tento stav mění jen velmi pozvolna. Potřeba chirurgické léčby ovšem vyplývá především z odlišného charakteru morfologických změn u CN: transmurální zánět šířící se do okolí postiženého střeva, fibróza střevní stěny a tendence k rozvoji střevní stenózy jsou hlavními příčinami toho, že chirurgická terapie dnes zdaleka nepředstavuje jen „ultimum refugium“ léčby CN, ale je její nedílnou součástí a je úzce provázána s léčbou medikamentózní [21].
Konvenční medikamentózní léčba CN
Standardní neboli konvenční terapie CN doznala v posledních 20 letech změn podstatně menších, než je tomu v případě UC. Důvodem je skutečnost, že biologika zasáhla do této oblasti více než do léčby UC a prostor pro konvenční léčbu se zúžil. Jako názorný příklad je možno uvést postavení aminosalicylátů v léčbě CN. Již první doporučení ECCO z roku 2006 (vytvářené v letech 2004 – 2005) konstatovalo, že aminosalicyláty nejsou účinné v léčbě CN, a to ani v případě lehké formy [22]. Proti tomu ovšem stojí klinická praxe, kde užívá aminosalicyláty stále značná část pacientů s CN. Jisté je, že v mnoha případech zbytečně, a přestože jde o léky bezpečné, léčba je tak zbytečně prodražována. Existují ovšem i data dokladující efektivitu mesalazinu v léčbě lehkých forem CN. Ďuricová et al popsali dokonce fenomén tzv. 5 – ASA dependence u pacientů s CN v dánském IBD registru, celkem z dlouhodobé monoterapie mesalazinem profitovala přibližně pětina sledovaných [23]. Podle aktuálních doporučení české PS IBD může být mesalazin účinný v léčbě lehké formy ileokolické CN a u nízkorizikových pacientů jako profylaxe po ileokolické resekci. Vždy je však nutno podávat dostatečně vysoké dávky léku (3 – 4 g denně) [3].
V první polovině 90. let minulého století byl do terapie CN zaveden topický glukokortikoid budesonid. Zvýšená afinita k cílovému receptoru a současně zrychlená eliminace léku měly zajistit minimalizaci nežádoucích účinků při zachování dostatečné terapeutické účinnosti. Přestože se budesonid postupně stal běžnou součástí terapeutického armamentária CN, naděje do něj vkládané se z větší části naplnit nepodařilo. Důvodem je nižší protizánětlivá účinnost a především fakt, že nebyla prokázána jeho schopnost dlouhodobě udržet medikamentózně navozenou remisi. Indikací budesonidu proto zůstává indukční terapie mírné a středně těžké formy CN, v udržovací léčbě nemá, podobně jako systémové kortikoidy, žádné místo [24].
Imunosupresiva jsou součástí terapie CN téměř půl století. Počáteční váhavý postoj k thiopurinům změnila zásadně Pearsonova a Sutherlandova metaanalýza z roku 1995, v níž autoři jasně prokázali jejich pozitivní efekt, který je obzvláště patrný při dlouhodobé terapii [25]. V uplynulých 20 letech byla tato jejich pozice nejprve posílena v souvislosti s tím, jak klesal význam mesalazinu a posléze i budesonidu pro udržovací terapii, nástup a rozšíření anti‑TNF protilátek však vzápětí snížilo význam thiopurinové monoterapie v udržovací léčbě CN. Recentní analýza v rámci Cochranovy databáze prokazuje účinnost thiopurinů v udržovací terapii i v profylaktické léčbě po předchozí střevní resekci [26]. Nicméně situace dospěla do fáze, kdy je efektivita thiopurinů v udržovací léčbě CN zpochybňována a jsou stavěny do pozice pouhých „spoluhráčů“ anti‑TNF protilátek jako součást kombinované terapie. Jedním z hlavních argumentů jsou výsledky dvou recentních studií, v nichž nebyla prokázána dostatečná efektivita azathioprinu v udržovací terapii u nemocných s nově diagnostikovanou CN [27,28]. Za hlavní výhodu je vydávána pouze nízká cena těchto léků, naopak je zdůrazňována vysoká frekvence nežádoucích účinků, včetně rizika non‑Hodgkinského lymfomu (asociovaného s infekcí virem Eppsteina a Barrové) a nemelanomových kožních nádorů. Je však třeba zdůraznit, že v rámci kombinované terapie riziko nežádoucích účinků nejen neklesá, ale může spíše narůstat (zejména riziko oportunních infekcí a hepatosplenický T lymfom), byť jsou výsledky sledování na různých souborech nejednotné. Autor tohoto textu považuje thiopurinová imunosupresiva za léty prověřenou lékovou skupinu vhodnou nejen k léčbě kombinační, ale v mnoha případech i k monoterapii nemocných s CN. Tuto pozici ještě zvýrazňuje možnost (v praxi stále častěji využívaná) kombinovat podávání thiopurinů s alopurinolem, který snižuje výskyt některých nežádoucích účinků (např. hepatotoxicity) a zvyšuje terapeutický efekt [29]. Je ovšem použitelný pouze u adherentních pacientů, které je třeba pravidelně sledovat a včas reagovat na případné signály „přestřelení“ efektu léčby.
Biologická léčba CN
Bezmála dvacetiletá historie biologické léčby CN není jen obdobím, během něhož byla zavedena nová léková skupina zahrnující v současné době tři protilátky proti TNFa (infliximab, adalimumab a certolizumab ‑ pegol) a dvě antiintegrinové protilátky (natalizumab – dostupný pouze v USA a vedolizumab). Byly a stále jsou upravovány terapeutické režimy včetně dávkování léků, hledají se optimální varianty souběžné imunosupresivní terapie, možnosti monitorace léčby pomocí farmakokinetických parametrů i nové indikace, jako např. profylaktická léčba po střevní resekci. Především je to ale doba hledání prediktorů efektivní a bezpečné aplikace biologik a změny terapeutických strategií, jejichž cílem je minimalizace strukturálních změn střeva, omezení frekvence a rozsahu chirurgických výkonů a v konečném důsledku ochrana před invalidizujícími následky chronického střevního zánětu.
Podobně jako v případě UC je biologická terapie podle stávajících doporučení indikována u pacientů se střední a vysokou aktivitou CN a při projevech kortikodependence [11]. Významnou indikací je perianální choroba, jejíž terapie vykazuje dlouhodobě neuspokojivé výsledky. Důvodem je agresivní podstata tohoto fenotypu CN, minimální dlouhodobá účinnost konvenčních medikamentů a rovněž nedostatky v chirurgické terapii, která je u naprosté většiny nemocných s komplexními píštělemi nezbytnou součástí terapie. Příznivou odpověď na podání infliximabu pozorujeme u dvou třetin nemocných s perianální formou CN, po jednom roce léčby dosáhne remise, tedy zhojení píštělí, přibližně třetina léčených. Infliximab je jedinou látkou, u níž byly provedeny studie primárně zaměřené na léčbu perianální choroby, data o efektivitě adalimumabu jsou pouze nepřímá a ukazují pozvolnější nástup efektu, který je však posléze relativně stabilní. V každém případě je i biologická terapie součástí dlouhodobé komplexní léčby, jejíž podstatnou složku tvoří chirurgická drenáž píštělových traktů [30].
Další indikací biologické terapie je situace, kdy se nemocný nachází ve vysokém riziku nepříznivého, invalidizujícího průběhu CN (v anglosaské literatuře označovaného termínem „disabling disease“). Pro tuto strategii je dnes používán termín akcelerovaná step ‑ up léčba a jde o racionální kompromis mezi standardní léčbou založenou na postupném navyšování terapie (step ‑ up) a postupem opačným, při němž je biologikum podáno na samém počátku léčby (top ‑ down). Za prediktory nepříznivého průběhu CN považujeme především časný začátek nemoci (diagnóza CN před 17. rokem života), perianální chorobu, extenzivní postižení tenkého střeva a rychlou progresi onemocnění do stadia penetrujících komplikací (intraabdominální abscesy a píštěle) [11]. Součástí akcelerované step ‑ up léčby je obvykle i souběžné podávání imunosupresivní terapie (thiopuriny, méně často metotrexát). Kombinovaná terapie je efektivnější ve srovnání s monoterapií infliximabem, předpokládaným mechanizmem je jak aditivní efekt imunosupresiva, tak příznivý vliv na farmakokinetiku infliximabu (vyšší hladiny IFX a snížená tvorba protilátek proti infliximabu) [21]. Negativem kombinované terapie může být vyšší výskyt infekčních komplikací, vyloučit nelze ani zvýšené riziko některých malignit (např. hepatosplenický T lymfom). Jedním z řešení dilematu „kombo vs. monoterapie“ může být varianta snížené dávky imunosupresiva. Yarur et al ukázali, že hraniční hodnotou 6 - thioquanin nukleotidu (6 - TGN, finální produkt thiopurinového metabolizmu), která predikuje vyšší hladiny infliximabu a nižší tvorbu protilátek proti infliximabu, je hodnota 125 pmol/ 8 × 108 ery. Tato hodnota je téměř poloviční ve srovnání s tou, která je považována za optimální pro dostatečný efekt thiopurinů v monoterapii (232 pmol/ 8 × 108 ery) [32].
Dosavadní výsledky ukazují, že kombinovaná terapie může mít větší efekt u nemocných s UC ve srovnání s CN. Otazný je benefit kombinace imunosupresiva s adalimumabem; nedávná metaanalýza ukázala, že je mírný v indukční fázi léčby, v průběhu jednoho roku ale příznivý efekt, hodnocený podílem pacientů v remisi i potřebou intenzifikovat léčbu adalimumabem, mizí [33].
Strategie léčby CN
Jednoznačným trendem současné terapie CN je optimalizace léčebné strategie [21]. Na jejím počátku stojí správná indikace s využitím prediktorů nepříznivého průběhu (akcelerovaná step ‑ up léčba). Dalším krokem je stanovení vhodných cílů terapie. Optimální cíl – vyléčení CN – sice zůstává v nedohlednu, dosažení dlouhodobé remise klinické, biologické a endoskopické (tzv. hluboká remise) je ale prokazatelně spojeno s nižší potřebou kortikoterapie, chirurgické léčby a celkově vyšší kvalitou života nemocných. Tato koncepce je označována jako „treat ‑ to ‑ target“; její největší slabinou je omezená schopnost současných terapeutických nástrojů dosáhnout takového stavu za přiměřenou cenu. A to nejen ve smyslu finančních nákladů, ale především bez neúměrného rizika nežádoucích účinků medikamentózní terapie. Součástí nových koncepcí biologické léčby je i průběžná monitorace parametrů, které souvisejí s efektem léčby a mají prokázanou prediktivní hodnotu, např. koncentrace léku a přítomnost protilátek proti biologiku. Studie TAXIT sice ukázala, že úprava dávky infliximabu a dosažení stanovené optimální hladiny léku je opatření krátkodobě efektivní, dlouhodobý benefit tohoto postupu v celé skupině léčných ale zůstává nejasný [34]. Vedlejším pozitivem této strategie může být také snížení nákladů ve skupině pacientů s primárně vysokou hladinou léku, u kterých je možno dávku redukovat.
Ke strategickým otázkám řadíme i problematiku ukončování biologické léčby. V klinické praxi je sice u většiny pacientů léčba ukončována nechtěně z důvodu nežádoucích účinků nebo jejího selhání, z důvodů ekonomických i medicínských (bezpečnost léčby) je třeba u nemocných, kteří dosáhli stabilní, dlouhodobé remise, možnost ukončení terapie alespoň zvážit. Klíčová data v tomto smyslu přinesla studie STORI [35]: riziko relapsu u nemocných po ukončení biologické terapie ve stadiu klinické remise dosahuje 50 % v následujících dvou letech, přítomnost biologické a endoskopické remise toto riziko významně snižuje a léčba relapsu znovupodáním biologika je efektivní a bezpečná. Většina dalších prací na toto téma se shoduje především v hodnocení rizika relapsu po ukončení léčby, zatím není úplná shoda v hodnocení prediktorů relapsu. Zdá se však velmi pravděpodobné, že vedle klinické a endoskopické remise je nutno zohlednit u každého pacienta i fenotyp nemoci a předchozí průběh terapie, včetně potřeby její intenzifikace. Zvýšené riziko relapsu po ukončení biologické terapie bylo popsáno u nemocných s postižením ilea a u pacientů, kteří byli léčeni biologikem již v minulosti nebo byla v předchozím průběhu nutná intenzifikace biologické léčby [36 – 38].
Profylaktická léčba po resekci střeva
V posledních letech byla značná pozornost věnována nové indikaci biologické terapie, kterou je preventivní aplikace po předchozím resekčním výkonu. Jde o indikaci potenciálně velmi důležitou – chirurgická léčba v podobě ileocékální resekce již dávno není považována za tragické selhání medikamentózní léčby, ale v mnoha případech je naopak optimálním řešením limitované choroby, které nejrychlejším možným způsobem a s minimálním rizikem uvede nemocného do stadia remise CN. I přes využití konvenční terapie ovšem přetrvává u značné části nemocných riziko závažné (chirurgické) recidivy, více než polovina pacientů musí v následujících 10 – 15 letech podstoupit nový operační zákrok.
První randomizovanou a placebem kontrolovanou studii publikoval v roce 2009 Regueiro, který popsal vysoce signifikantní benefit profylaktické aplikace infliximabu po resekčním výkonu v průběhu jednoho roku [39]. I ve většině ostatních z celkem deseti menších studií či kazuistických sérií byl pozorován příznivý efekt profylaktické léčby infliximabem nebo adalimumabem v období 12 – 36 měsíců po operaci [40]. K definitivnímu potvrzení pozitivního efektu infliximabu na snížení rizika pooperační rekurence CN měla posloužit rozsáhlá, multicentrická a kontrolovaná studie pod názvem PREVENT [41]. Pacientům ve vysokém riziku rekurence choroby po předchozí ileokolické resekci (vysoké riziko: kouření, více než jedna resekce, perforující typ CN) byl podáván infliximab nebo placebo, primárním cílem byla klinická rekurence v průběhu jednoho a půl roku od zahájení léčby vyjádřená jak zvýšenou hodnotou indexu CDAI (Crohn´s Disease Activity Index), tak pozitivitou endoskopického nálezu – Rutgeertsovo skóre i2 a více. Překvapivě nebylo při hodnocení primárního cíle dosaženo statisticky významného rozdílu mezi sledovanými skupinami (13% vs. 20% rekurence ve skupině IFX a placebo), benefit infliximabu z hlediska klinické rekurence nebyl pozorován ani po dvou letech léčby. V týdnu 76 byl naopak signifikantní rozdíl (ve prospěch infliximabu) při hodnocení endoskopické rekurence (31 % vs. 60 %). Je otázkou, zda je negativní výsledek studie skutečným obrazem efektu infliximabu v profylaktické terapii po resekci střeva nebo zda jde o důsledek nevhodně zvoleného designu a cílů studie. V každém případě se ukazuje, že potenciál anti‑TNF terapie je i v profylaktické léčbě omezený a nedokáže v plné míře eliminovat riziko rekurence CN.
Pozitivní výsledky naopak přinesla další rozsáhlá studie zaměřená na hledání optimální strategie pro prevenci pooperační rekurence CN (studie POCER, též označovaná jako „treat ‑ to ‑ target study“) [42]. Ukázala, že aktivní přístup založený na stratifikaci pacientů podle rizika rekurence (zvýšené riziko bylo hodnoceno obdobně jako ve studii PREVENT), aktivním pooperačním sledování (koloskopie v šestém měsíci po resekci) a úpravě terapeutického režimu v závislosti na koloskopickém nálezu, je efektivnější než fixní režim bez průběžné monitorace endoskopického nálezu. V prevenci rekurence CN byl v této studii používán terapeutický režim, který bychom mohli považovat za variantu akcelerované step ‑ up léčby: v prvních třech měsících po operaci dostávali všichni pacienti metronidazol, pacienti ve zvýšeném riziku pak pokračovali léčbou azathioprinem nebo 6‑merkaptopurinem, při jeho intoleranci dostávali standardní dávku adalimumabu. Nález endoskopické rekurence v šestém měsíci (Rutgeerts i2 a více) byl důvodem k navýšení terapie o krok výše (bez léčby – azathioprin, azathioprin – adalimumab, adalimumab standardní dávka – intenzifikace adalimumabu). Výsledek koloskopie v 18. měsíci (primární cíl) ukázal endoskopickou rekurenci u 49 % pacientů v aktivně sledované skupině oproti 60 % ve skupině bez průběžné koloskopie (p = 0,03). Intenzifikace léčby u pacientů s nálezem endoskopické rekurence v šestém měsíci byla efektivní ve více než třetině případů (38 % jich bylo v endoskopické remisi v 18. měsíci). Vedlejším výsledkem studie bylo navíc zjištění, že kouření je nejvýznamnějším rizikovým faktorem pooperační rekurence CN.
Je tedy zřejmé, že účinná pooperační prevence musí být založena na komplexním přístupu: stratifikaci rizika, koloskopickém monitoringu a následné úpravě léčby. Navzdory výsledkům studie POCER, která vlastně potvrdila správnost postupu, který je na řadě pracovišť již běžně prováděn, nelze považovat výsledky pooperačního sledování a terapie za optimální. Vezmeme‑li v úvahu téměř 50% endoskopickou a 27% klinickou rekurenci CN 18 měsíců po operaci zjištěnou navzdory aktivní strategii, musíme si klást otázku, jaká je příčina neuspokojivého výsledku a zejména jak lze efekt pooperační terapie zvýšit. Jednou z příčin může být fakt, že nemalá část pacientů byla léčena anti‑TNF protilátkami již před chirurgickým výkonem, a tuto skupinu lze tedy považovat za refrakterní vůči biologikům této třídy. Bude proto zajímavé sledovat případný efekt nových léků – ať již schválených (vedolizumab) nebo stojících na prahu klinické praxe (etrolizumab, ustekinumab) v této perspektivní a pro osud pacientů zásadní indikaci.
Chirurgická léčba CN
Přestože chirurgická terapie nemá u nemocných s CN kurativní efekt, je nedílnou součástí léčebné strategie tohoto onemocnění. Podrobné informace a doporučení týkající se chirurgické léčby CN byly publikovány v recentním čísle tohoto časopisu [43]. Z pohledu gastroenterologa je vhodné zmínit skutečnost, že většina epidemiologických studií v poslední době potvrzuje, že frekvence chirurgických výkonů v prvních 5 – 10 letech po stanovení diagnózy CN klesá. Tento pokles je patrný již z doby „předbiologické“ a pokračuje i po zavedení biologik do terapie CN. Klesající křivka chirurgických výkonů je doprovázena inverzní, tedy stoupající křivkou používání imunosupresivní a biologické terapie. Některé práce pak přímo prokazují vliv časné imunosupresivní léčby na snížení rizika chirurgických výkonů [44,45], tato souvislost ale není vždy zcela zjevná [46]. Rovněž bude zajímavé sledovat, zda klesající trend vydrží i v delším odstupu od počátku choroby, a imunosupresivní a biologická terapie tak potvrdí svůj chorobu modifikující potenciál.
Pro chirurgickou léčbu CN jsou v současnosti charakteristické dva aspekty. Zaprvé, projevuje se v ní všeobecný chirurgický trend směřující k miniinvazivitě a minimalizaci rozsahu střevní resekce. Laparoskopická či laparoskopicky asistovaná resekce je již běžným výkonem, je spojena s nižší pooperační morbiditou, zkracuje délku hospitalizace a snižuje rovněž výskyt pooperačních obstrukcí a kýl v jizvě [43]. Krátké stenózy na tenkém střevu jsou řešeny strikturoplastikami, jejichž dlouhodobý efekt je stejný jako výkon resekční; výhodou je pochopitelně zachování resorpční plochy střeva. Jednoznačně byla také opuštěna koncepce extenzivní resekce střeva hluboko do zdravé tkáně, resekční linie by neměla překračovat hranici makroskopického postižení střeva.
Druhým trendem je snaha o úzkou provázanost chirurgické a medikamentózní terapie v rámci komplexní péče o nemocné s CN. Příkladem může být odložení chirurgického výkonu u nemocných ve fázi vysoké aktivity (navzdory jasné indikaci operačního řešení) do doby zklidnění zánětu medikamentózní terapií, resorpce zánětlivého infiltrátu a zlepšení podmínek pro provedení limitované resekce. Podobnou situací je také operace po předchozí drenáži nitrobřišního abscesu u nemocných s penetrující formou CN. Vzájemná spolupráce je nezbytná i v předoperační nutriční přípravě a v širším pohledu do konceptu komplexní péče patří i profylaxe pooperační rekurence CN zmíněná v předchozím textu. Z hlediska chirurgické léčby se zdá, že prevence začíná již vlastní operací, konkrétně založením dostatečně široké anastomózy.
Specifickou pozici má chirurgická léčba perianálních forem CN, zejména abscesů a píštělí. Tato problematika byla rovněž zmíněna v předchozím textu a podrobně diskutována v dřívějších číslech tohoto časopisu [21,30]. Opakovaně je nutno zdůraznit, že spolupráce gastroenterologa s poučeným chirurgem je v léčbě perianální choroby bezpodmínečnou nutností, v tomto ohledu však vidíme stále rezervy na obou stranách. Na straně chirurgické je této specifické problematice věnována malá pozornost a nemocní jsou léčeni uniformně, bez ohledu na rozdíly mezi perianální lézí sporadickou a tou, která je projevem CN. Chybou gastroenterologů je malá snaha o hledání „poučeného“ chirurga a také nesprávné posouzení reálných možností medikamentózní, především biologické léčby. V některých případech je váhavost a podcenění závažnosti perianální choroby příčinou pozdního zahájení biologické léčby, jindy je její význam nekriticky přeceňován a je ignorována potřeba souběžné chirurgické léčby, zejména u komplexních perianálních píštělí.
MU Dr. Martin Bortlík, Ph.D.
Klinické a výzkumné centrum pro střevní záněty ISCARE I.V.F. a. s.
Jankovcova 1569/ 2c
170 04 Praha 7
mbortlik@seznam.cz
Zdroje
1. Burisch J, Jess T, Martinato M et al. The burden of inflammatory bowel disease in Europe. J Crohns Colitis 2013; 7(4): 322 – 337. doi: 10.1016/ j.crohns.2013.01.010.
2. Stange EF, Travis SP, Vermeire S et al. European evidence‑based consensus on the diagnosis and management of ulcerative colitis: definitions and diagnosis. J Crohns Colitis 2008; 2(1): 1 – 23. doi: 10.1016/ j.crohns.2007.11.001.
3. Prokopová L, Ďuricová D, Bortlík M et al. Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty. Gastroent Hepatol 2012; 66(5): 391 – 400.
4. Dignass AU, Bokemeyer B, Adamek Het al. Mesalamine once daily is more effective than twice daily in patients with quiescent ulcerative colitis. Clin Gastroenterol Hepatol 2009; 7(7): 762 – 769. doi: 10.1016/ j.cgh.2009.04.004.
5. Kruis W, Kiudelis G, Racz I et al. Once daily versus three times daily mesalazine granules in active ulcerative colitis: a double‑blind, double‑dummy, randomised, non‑inferiority trial. Gut 2009; 58(2): 233 – 240. doi: 10.1136/ gut.2008.154302.
6. Schreiber S, Kamm MA, Lichtenstein GR. Mesalamine with MMX technology for the treatment of ulcerative colitis. Expert Rev Gastroenterol Hepatol 2008; 2(3): 299 – 314. doi: 10.1586/ 17474124.2.3.299.
7. Sandborn WJ, Travis S, Moro L et al. Once ‑ daily budesonide MMX® extended ‑ release tablets induce remission in patients with mild to moderate ulcerative colitis: results from the CORE I study. Gastroenterology 2012; 143(5): 1218 – 1226.e1 – 2. doi: 10.1053/ j.gastro.2012.08.003.
8. Travis SP, Danese S, Kupcinskas L et al. Once ‑ daily budesonide MMX in active, mild ‑ to ‑ moderate ulcerative colitis: results from the randomised CORE II study. Gut 2014; 63(3): 433 – 441. doi: 10.1136/ gutjnl ‑ 2012 ‑ 304258.
9. Gisbert JP, Linares PM, McNicholl AG et al. Meta‑analysis: the efficacy of azathioprine and mercaptopurine in ulcerative colitis. Aliment Pharmacol Ther 2009; 30(2): 126 – 137. doi: 10.1111/ j.1365 ‑ 2036.2009.04023.x.
10. Rutgeerts P, Sandborn WJ, Feagan BG et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353(23): 2462 – 2476.
11. Bortlík M, Ďuricová D, Kohout P et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů: 2. vydání. Gastroent Hepatol 2012; 66(1): 12 – 22.
12. Feagan BG, Rutgeerts P, Sands BE et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369(8): 699 – 710. doi: 10.1056/ NEJMoa1215734.
13. Bortlík M. Vedolizumab – nová antiintegrinová protilátka s vysokou gastrointestinální selektivitou. Gastroent Hepatol 2014; 68(6): 481 – 484. doi: 10.14735/ amgh2014481.
14. Lukáš M. Vedolizumab v léčbě ulcerózní kolitidy. Gastroent Hepatol 2015; 69(1): 29 – 32. doi:10.14735/ amgh201529.
15. Lukáš M. Současnost a budoucnost v léčbě ulcerózní kolitidy. Gastroent Hepatol 2013; 67(3): 212 – 218.
16. Torres J, Billioud V, Sachar D et al. Ulcerative colitis as a progressive disease: the forgotten evidence. Inflamm Bowel Dis 2012; 18(7): 1356 – 1363. doi: 10.1002/ ibd.22839.
17. Malíčková K, Bortlík M, Ďuricová D et al. Vliv albuminemie na farmakokinetiku infliximabu u nemocných s idiopatickými střevními záněty. Gastroent Hepatol 2011; 65(2): 70 – 74.
18. Gibson DJ, Heetun ZS, Redmond CE et al. An accelerated infliximab induction regimen reduces the need for early colectomy in patients with acute severe ulcerative colitis. Clin Gastroenterol Hepatol 2015; 13(2): 330 – 335. doi: 10.1016/ j.cgh.2014.07.041.
19. Øresland T, Bemelman WA, Sampietro GM et al. European evidence based consensus on surgery for ulcerative colitis. J Crohns Colitis 2015; 9(1): 4 – 25. doi: 10.1016/ j.crohns.2014.08.012.
20. Murphy PB, Khot Z, Vogt KN et al. Quality of life after total proctocolectomy with ileostomy or IPAA: a systematic review. Dis Colon Rectum 2015; 58(9): 899 – 908. doi: 10.1097/ DCR.0000000000000418.
21. Lukáš M. Současnost a budoucnost v léčbě Crohnovy nemoci. Gastroent Hepatol 2013; 67(4): 306 – 312.
22. Travis SP, Stange EF, Lemann M et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: current management. Gut 2006; 55 (Suppl 1): i16 – i35. doi: 10.1136/ gut.2005.081950b.
23. Duricova D, Pedersen N, Elkjaer Met al. 5 - aminosalicylic acid dependency in Crohn‘s disease: a Danish Crohn Colitis Database study. J Crohns Colitis 2010; 4(5): 575 – 581. doi: 10.1016/ j.crohns.2010.06.002.
24. Dignass A, Van Assche G, Lindsay JO et al. The second European evidence‑based Consensus on the diagnosis and management of Crohn‘s disease: current management. J Crohns Colitis 2010; 4(1): 28 – 62. doi: 10.1016/ j.crohns.2009.12.002.
25. Pearson DC, May GR, Fick GH et al. Azathioprine and 6 - mercaptopurine in Crohn disease. A meta‑analysis. Ann Intern Med 1995; 123(2): 132 – 142.
26. Prefontaine E, Sutherland LR, Macdonald JK et al. Azathioprine or 6 - mercaptopurine for maintenance of remission in Crohn‘s disease. Cochrane Database Syst Rev 2009; 1: CD000067. doi: 10.1002/ 14651858.CD000067.pub2.
27. Panés J, López ‑ Sanromán A, Bermejo F et al. Early azathioprine therapy is no more effective than placebo for newly diagnosed Crohn‘s disease. Gastroenterology 2013; 145(4): 766 – 774. doi: 10.1053/ j.gastro.2013.06.009.
28. Cosnes J, Bourrier A, Laharie D et al. Early administration of azathioprine vs conventional management of Crohn‘s disease: a randomized controlled trial. Gastroenterology 2013; 145(4): 758 – 765. doi: 10.1053/ j.gastro.2013.04.048.
29. Hoentjen F, Seinen ML, Hanauer SB et al. Safety and effectiveness of long‑term allopurinol ‑ thiopurine maintenance treatment in inflammatory bowel disease. Inflamm Bowel Dis 2013; 19(2): 363 – 369. doi: 10.1002/ ibd.23021.
30. Bortlík M. Současný pohled na léčbu perianálních píštělí u nemocných s Crohnovou chorobou. Gastroent Hepatol 2013; 67(1): 25 – 29.
31. Yarur AJ, Kubiliun MJ, Czul F et al. Concentrations of 6 - thioguanine nucleotide correlate with trough levels of infliximab in patients with inflammatory bowel disease on combination therapy. Clin Gastroenterol Hepatol 2015; 13(6): 1118 – 1124. doi: 10.1016/ j.cgh.2014.12.026.
32. Osterman MT, Kundu R, Lichtenstein GR et al. Association of 6 - thioguanine nucleotide levels and inflammatory bowel disease activity: a meta‑analysis. Gastroenterology 2006; 130(4): 1047 – 1053.
33. Kopylov U, Al ‑ Taweel T, Yaghoobi M et al. Adalimumab monotherapy versus combination therapy with immunomodulators in patients with Crohn‘s disease: a systematic review and meta‑analysis. J Crohns Colitis 2014; 8(12): 1632 – 1641. doi: 10.1016/ j.crohns.2014.07.003.
34. Vande Casteele N, Ferrante M, Van Assche G et al. Trough concentrations of infliximab guide dosing for patients with inflammatory bowel disease. Gastroenterology 2015; 148(7): 1320 – 1329. doi: 10.1053/ j.gastro.2015.02.031.
35. Louis E, Mary JY, Vernier ‑ Massouille G et al. Maintenance of remission among patients with Crohn‘s disease on antimetabolite therapy after infliximab therapy is stopped. Gastroenterology 2012; 142(1): 63 – 70. doi: 10.1053/ j.gastro.2011.09.034.
36. Bortlik M, Duricova D, Machkova N et al. Discontinuation of anti‑tumor necrosis factor therapy in inflammatory bowel disease patients: a prospective observation. Scand J Gastroent 2015. Accepted Manuscript ID: 1079924.
37. Molnár T, Lakatos PL, Farkas K et al. Predictors of relapse in patients with Crohn‘s disease in remission after 1 year of biological therapy. Aliment Pharmacol Ther 2013; 37(2): 225 – 233. doi: 10.1111/ apt.12160.
38. Brooks AJ, Sebastian S, Cross SS et al.Outcome of elective withdrawal of anti‑-tumour necrosis factor ‑ a therapy in patients with Crohn‘s disease in established remission. J Crohns Colitis 2015. In press. doi: 10.1016/ j.crohns.2014.09.007.
39. Regueiro M, Schraut W, Baidoo L et al. Infliximab prevents Crohn’s disease recurrence after ileal resection. Gastroenterology 2009; 136(2): 441 – 450. doi: 10.1053/ j.gastro.2008.10.051.
40. Herfarth HH. Anti‑tumor necrosis factor therapy to prevent Crohn‘s disease recurrence after surgery. Clin Gastroenterol Hepatol 2014; 12(9): 1503 – 1506. doi: 10.1016/ j.cgh.2014.02.014.
41. Reguiero M, Feagan BG, Zou B et al. Infliximab for Prevention of Recurrence of Post‑Surgical Crohn‘s Disease Following Ileocolonic Resection: A Randomized, Placebo ‑ Controlled Study. Gastroenterology 2015; 148(4): S ‑ 141.
42. De Cruz P, Kamm MA, Hamilton AL et al. Crohn‘s disease management after intestinal resection: a randomised trial. Lancet 2015; 385(9976): 1406 – 1417. doi: 10.1016/ S0140 ‑ 6736(14)61908 ‑ 5.
43. Šerclová Z, Ryska O, Bortlík M et al. Doporučené postupy chirurgické léčby pacientů s idiopatickými střevními záněty – 2. část: Crohnova nemoc. Gastroent Hepatol 2015; 69(3): 223 – 238. doi: 10.14735/ amgh2015223.
44. Lakatos PL, Golovics PA, David G et al. Has there been a change in the natural history of Crohn‘s disease? Surgical rates and medical management in a population‑based inception cohort from Western Hungary between 1977 – 2009. Am J Gastroenterol 2012; 107(4): 579 – 588. doi: 10.1038/ ajg.2011.448.
45. Ramadas AV, Gunesh S, Thomas GA et al. Natural history of Crohn‘s disease in a population‑based cohort from Cardiff (1986 – 2003): a study of changes in medical treatment and surgical resection rates. Gut 2010; 59(9): 1200 – 1206. doi: 10.1136/ gut.2009.202101.
46. Rungoe C, Langholz E, Andersson Met al. Changes in medical treatment and surgery rates in inflammatory bowel disease: a nationwide cohort study 1979 – –2011. Gut 2014; 63(10): 1607 – 1616. doi: 10.1136/ gutjnl ‑ 2013 ‑ 305607.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2015 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Vývoj České gastroenterologické společnosti a gastroenterologie z pohledu tří generací lékařů
- Starší generace gastroenterologů a hepatologů
- Vývoj a proměny české gastroenterologie a gastroenterologické společnosti v 70leté historii
- Niektoré postrehy z histórie slovenskej gastroenterológie 1945– 2002
- Vývoj a proměny české gastroenterologie – 90. léta minulého století
- Vzťahy
- Střední generace gastroenterologů a hepatologů
- Česká gastroenterologie po roce 1989 – osobní pohled
- Spolupráce Společnosti pro gastrointestinální onkologii s Českou gastroenterologickou společností
- Význam hradecké školy pro českou gastroenterologii
- Vývoj a premeny česko‑ slovenskej gastroenterológie po roku 2000
- Střední generace gastroenterologů a hepatologů
- Historie hepatologie na území České republiky
- Nekonečná endoskopická cesta aneb endoskopická chirurgie – nový obor?
- Vývoj léčby idiopatických střevních zánětů v posledních 20 letech
- Mladší generace gastroenterologů a hepatologů
- Další vývoj české gastroenterologie z pohledu mladých gastroenterologů
- Medailonky předsedů České gastroenterologické společnosti
- Diagnostika a léčba anémie u nemocných s chorobami gastrointestinálního traktu
-
Komentář k článku v časopise Gut
Screening jaterního poškození u pacientů s diabetes mellitus 2. typu - Svízelná diagnostika primární sklerozující cholangitidy u pacienta s rekurentními epizodami akutní bakteriální cholangitidy
-
Komentář ke kazuistice
Svízelná diagnostika primární sklerozující cholangitidy s rekurentními epizodami akutní bakteriální cholangitidy - Neobvyklá příčina průjmu – cholecystokolická píštěl: kazuistika a literární přehled
- Bouveretův syndrom – endoskopické řešení vysokého ileu
- ICDS 2015, Praha
- Komentáře k vybraným zahraničním článkům
- Budenofalk Uno 9 mg enterosolventní granule
- Autodidaktický test: historie gastroenterologické společnosti a časopisu
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Neobvyklá příčina průjmu – cholecystokolická píštěl: kazuistika a literární přehled
- Budenofalk Uno 9 mg enterosolventní granule
- Diagnostika a léčba anémie u nemocných s chorobami gastrointestinálního traktu
- Střední generace gastroenterologů a hepatologů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



