-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Esomeprazol – S-izomer omeprazolu s výhodnějšími farmakologickými vlastnostmi a silnějším farmakodynamickým účinkem
Autoři: M. Lukáš
Působiště autorů: Klinické a výzkumné centrum pro střevní záněty ISCARE I. V. F. a. s., Praha
Vyšlo v časopise: Gastroent Hepatol 2018; 72(2): 179-181
Kategorie: Lékový profil
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2018179Úvod
Nejúčinnějším terapeutickým postupem v léčbě a profylaxi acidopeptických chorob je inhibice aktivity protonové pumpy. Esomeprazol je S-izomerem omeprazolu a jeho podání blokuje kyselou žaludeční sekreci prostřednictvím ireverzibilní inhibice H+/K+ ATPázy v sekrečních kanálcích parietální buňky.
Klinická farmakologie
Esomeprazol, podobně jako ostatní léčiva ze skupiny ireverzibilních inhibitorů protonové pumpy (PPI), je podáván v inaktivní formě ve formě „proléčiva“. V tomto neaktivním a iontově neutrálním stavu snadno proniká biologickými membránami. Mateřská látka má charakter slabé báze s disociační konstantou (pKa) kolem 4,0 a díky tomu je akumulována v silně kyselém prostředí sekrečního kanálku parietální buňky. Za fyziologického stavu, kdy pH v kanálku se pohybuje kolem 1, je lokální koncentrace léčiva v místě působení asi 1 000× větší než v plazmě [1].
Farmakodynamické vlastnosti
Mechanizmus antisekrečního účinku je zprostředkován ireverzibilní inhibicí tzv. protonové pumpy (H+/K+ ATPázy), která je integrální součástí membrány parietálních buněk a skládá se ze dvou podjednotek α a β (heterodimer). Funkcí protonové pumpy je směna protonu za kationt kalia, protony putují do lumen žaludku a kalium do parietální buňky. Kyselé prostředí v sekrečním kanálku parietální buňky má zásadní důležitost nejen pro dosažení vysoké koncentrace léčiva, ale také pro aktivaci molekuly esomeprazolu, konkrétně pro vytvoření sulfenamidu s aktivní sulfhydrilovou skupinou, kterou se kovalentně váže na protein extracytoplazmatické části α podjednotky v aktivním místě pumpy. Kovalentní vazbou v iontovém kanálu je protonová pumpa nevratně ochromena. Aktivní metabolit působí výhradně extracelulárně v kanálku parietální buňky, jeho průnik do cytoplazmy je minimální. K tomu, aby se aktivní forma léčiva navázala na podjednotku protonové pumpy, je třeba, aby H+/K+ ATPáza byla na povrchu kanálku v aktivním stavu. Esomeprazol blokuje bazální i stimulovanou sekreci kyseliny solné nezávisle na charakteru sekrečního stimulu. Stupeň inhibice sekrece je závislý především na množství inaktivovaných protonových pump, to znamená, že síla účinku léčiva je dána množstvím léku, které se dokáže koncentrovat do cílové oblasti sekrečního kanálku. Proto se esomeprazol, podobně jako jiné PPI, podává v jedné denní dávce ráno na lačno s inhibicí 70 % všech aktivovaných protonových pump [2].
V porovnání s omeprazolem, který je racemátem R-a S-izomerů, má esomeprazol, který je čistým S-enanciomerem, významně silnější a setrvalejší inhibiční vliv na aktivitu protonové pumpy [1].
Farmakokinetické vlastnosti
Metabolizmus esomeprazolu je zprostředkováván především izoenzymy systému cytochromu P450 (CYP), a to zejména podjednotkami CYP2C19 a CYP3A4. Esomeprazol podléhá v nižší míře metabolizmu při prvním průchodu játry a má nižší systémovou clearance, než vykazuje omeprazol. Proto esomeprazol dosahuje vyšších plazmatických koncentrací, které se promítají do vyššího potenciálu PPI v sekrečních kanálcích parietálních buněk žaludku. Další důležitou předností esomeprazolu je vysoce konzistentní farmakokinetický profil. Plazmatický poločas esomeprazolu je přibližně 60 min, přesto většinou stačí pouze jedna denní dávka (ráno), která zabezpečí účinnou inhibici sekrece kyseliny po celých 24 hod. Důvodem je vytvořená kovalentní vazba PPI s protonovou pumpou a další sekrece kyseliny je závislá na resyntéze nebo aktivaci nových protonových pump. Antisekreční účinnost se v prvních dnech po započetí léčby kumulativně zvyšuje a během 2–3 dnů se dosáhne rovnovážného stavu. Esomeprazol je aktivován po perorálním podání během 20–40 min, a proto je nástup terapeutického účinku relativně rychlý, což má význam především na počátku léčby. Maximální účinek po dosažení rovnováhy trvá 24 hod a postupné odeznívání efektu trvá 3–4 dny. PPI jsou kompletně biodegradovány v játrech izoenzymem CYP2C19 a z menší části CYP3A4 a inaktivní metabolity jsou poté vylučovány ledvinami. Podle přítomnosti funkčních alel izoenzymu CYP2C19 rozlišujeme rychlé (s oběma funkčními alelami), střední (s jednou funkční alelou) a pomalé „metabolizátory“ (bez funkční alely). U pacientů s rychlou biodegradací PPI (u tzv. rychlých metabolizátorů) se můžeme setkat s nižší účinností PPI. Nejsilnější afinitu k izoenzymu CYP2C19 má omeprazol a nejnižší esomeprazol, jehož účinek je tak genovým polymorfizmem ovlivněn nejméně [1,2].
Lékové interakce
Hlavním farmakodynamickým efektem esomeprazolu je inhibice tvorby kyseliny solné a následné zvýšení pH žaludečního obsahu. Pokles kyselosti žaludečního obsahu s ovlivněním absorpce jiných léčiv, zejména slabých hydrofilních kyselin, je společným efektem pro všechny PPI (např. ketokonazol, kyselina acetylsalicylová). Vedle absorpce některých léčiv se může snižovat absorpce železa. Kyselé pH udržuje železo v ionizovaném a lépe vstřebatelném stavu a současně udržuje železo v redukované (dvojmocné) formě, která se vstřebává lépe než forma trojmocná. Otázku snížené absorpce železa při léčbě všemi PPI bychom měli vzít v úvahu při feroterapii [3].
Potenciálně nejvýznamnější lékové interakce vyplývají z farmakokinetického vlivu PPI na jiná léčiva daného především inhibicí aktivity izoenzymu CYP2C19. Nejvýznamnější potlačení aktivity izoenzymu CYP2C19 vykazují omeprazol a lanzoprazol, naproti tomu esomeprazol a rabeprazol ovlivňují aktivitu tohoto enzymu ze všech PPI nejméně. Závažná je interakce s vysokou inhibiční aktivitou na CYP2C19 s klopidogrelem, blokátorem trombocytárních receptorů pro adenosindifosfát. Klopidogrel je podáván v inaktivní podobě ve formě proléčiva. Jeho aktivní a klinicky účinná forma vzniká působením několika enzymů, zejména však izoenzymu CYP2C19. Inhibicí CYP2C19 nabídka aktivní formy klopidogrelu klesá a protidestičkový účinek selhává, nicméně vliv esomeprazolu v porovnání ostatními PPI je v tomto ohledu minimální.
Nežádoucí účinky
Nežádoucí účinky jsou společné s ostatními PPI a vycházejí z důsledků zvýšení pH v žaludku. Kyselé prostředí žaludku je významnou protekcí proti alimentárním infekcím. Zvýšení intraluminální hodnoty pH po inhibici žaludeční sekrece může být spojeno s vyšším rizikem alimentárních nákaz, vč. průjmů cestovatelů. Druhým potenciálním rizikem je blokáda aktivity protonové pumpy v jiných tkáních, konkrétně v osteoklastech. K obnově architektury kosti je třeba nejprve její resorpce osteoklastem za účasti tzv. vakuolární H+/K+ ATPázy. Dlouhodobá, více než 5letá blokáda fyziologické funkce osteoklastů terapií PPI může vést k postupné degeneraci architektury kostní trámčiny, k mikrofrakturám a ke zvýšení rizika zlomenin v nejvíce namáhaných oblastech (kyčel, zápěstí a obratle). Nutno zdůraznit, že se jedná o degeneraci a nikoli o osteoporózu, kostní denzita neklesá.
Klinické použití
Esomeprazol se používá v léčbě všech forem refluxní choroby jícnu, peptických vředů žaludku a duodena, hyperstenické, funkční žaludeční dyspepsie, Zollinger-Ellisonova syndromu. Je součástí trojkombinační strategie (PPI a dvou antibiotik) při eradikační léčbě Helicobacter pylori. Užívají se také u pacientů s chronickou pankreatitidou ke zvýšení účinnosti pankreatické substituce, u pacientů se syndromem krátkého střeva nebo u kriticky nemocných pacientů parenterálně v prevenci vzniku stresových vředů [4,5]. Velmi účinný je také v prevenci i léčbě gastropatie z nesteroidních antirevmatik. Esomeprazol je ve všech indikacích účinnější než blokátory histaminových receptorů H2. Důvodem je jeho delší a silnější antisekreční účinnost, což vede k dosažení vyššího pH v žaludku (pH > 4,0). Účinnost v hojení vředových a zánětlivých lézí v duodenu, žaludku nebo jícnu pozitivně koreluje s délkou zvýšení pH žaludečního obsahu nad hodnotu 4,0. Tento parametr (délka zvýšení hodnoty pH) je významně vyšší. Významné je také intravenózní podávání esomeprazolu v prevenci recidiv krvácení z peptického vředu po dosažení endoskopické hemostázy (tab. 1).
Tab. 1. Indikace krátkodobé a dlouhodobé léčby esomeprazolu. Tab. 1. Indication of short- and long-term treatment of esomeprazole. 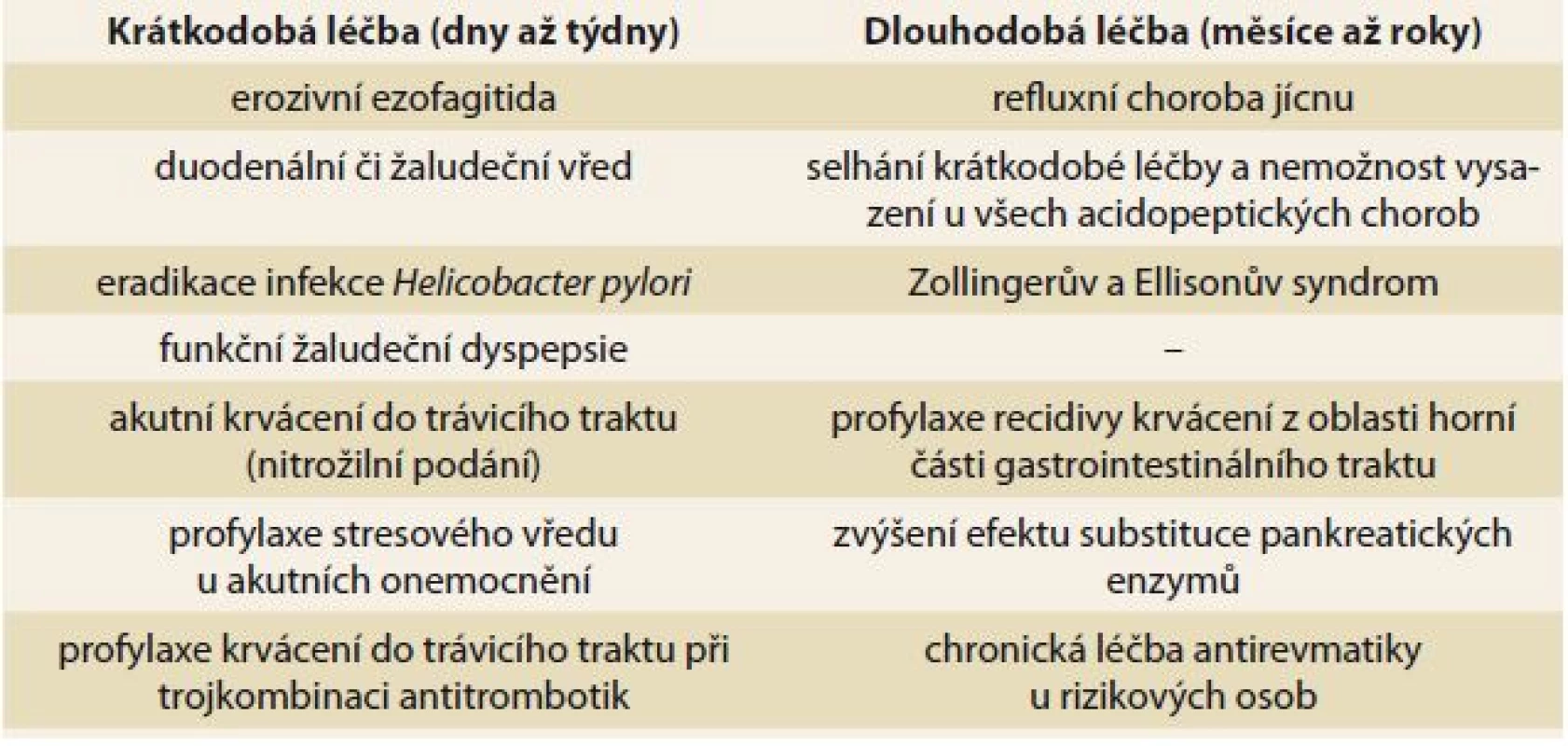
Způsob aplikace esomeprazolu
Nejvhodnější je léčba nepřerušovaná, podle potřeby trvající dny až roky. Jednorázové podání ad hoc sice sníží aciditu, ale plný efekt se objevuje až po několika dnech. K zajištění maximálního účinku je důležité podání ráno na lačno s požitím potravy za 30–60 min po aplikaci. Tak je zajištěna nejen vyšší dostupnost esomeprazolu (na lačno), ale i dostatečná exprese H+/K+ ATPázy v parietálních buňkách (po jídle). Při nedostatečném účinku je možno podat esomeprazol ve dvou denních dávkách.
Esomeprazol je dostupný k perorálnímu podávání jako potahovaná tableta obsahující 20 nebo 40 mg účinné látky nebo k intravenóznímu podání v ampuli obsahující 40 mg léčiva, které se podává velmi pomalou nitrožilní injekcí (zpravidla déle než 3 min) nebo v podobě infuze. Obvyklá denní perorální dávka je 40 mg esomeprazolu 1× denně. Pro dlouhodobou udržovací terapii refluxní choroby jícnu je doporučena dávka 20 mg 1× denně. Maximální denní dávka je 80 mg 2× denně.
Přednosti esomeprazolu
V porovnáním s ostatními PPI vykazuje esomeprazol některé výhodné farmakologické vlastnosti, které favorizují jeho využití v klinické praxi:
- výhodné a konzistentní farmakokinetické vlastnosti [1,2],
- minimální ovlivnění aktivity enzymatického komplexu CYP2C19 a minimální lékové interakce (klopidogrel) [2],
- relativní rychlý nástup farmakodynamického efektu [1],
- silnější a setrvalejší antisekreční vliv v porovnání s ostatními PPI [6].
prof. MUDr. Milan Lukáš, CSc.
Klinické a výzkumné centrum
pro střevní zánětyISCARE I. V. F., a. s.
Jankovcova 1569/2c
170 00 Praha 7
Zdroje
1. Martínek J, Lukáš M. Inhibitory protonové pumpy – up to date. Gastroent Hepatol 2011; 65 (6): 331–342.
2. Špičák J. Inhibitory protonové pumpy: vedlejší účinky a interakce. Gastroent Hepatol 2013; 67 (4): 289–297.
3. Souhrn údajů o přípravku Pylera. [online]. Dostupné z: www.sukl.cz.
4. Heribanová L. Extraezofageální a gastroezofageální reflux – vztah k astma bronchiale. Gastroent Hepatol 2016; 70 (5): 438–442. doi: 10.14735/amgh2016438.
5. Olbe L, Carlsson E, Lindberg P. A proton-pump inhibitor expedition: the case histories of omeprazole and esomeprazole. Nat Rev Drug Discov 2003; 2 (2): 132–139.
6. Miehlke S, Madisch A, Kirsch C et al. Intragastric acidity during treatment with esomeprazole 40 mg twice daily or pantoprazole 40 mg twice daily – a randomized, two-way crossover study. Aliment Pharmacol Ther 2005; 21 (8) : 963–967.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná Interné lekárstvo Nutričný terapeut Obezitológia
Článek Správná odpověď na kvízČlánek Hepatologie
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2018 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Neobvyklá příčina zvětšování břicha
- Infekce jaterní cysty při polycystóze jater jako zdroj sepse
- Terlipresin – stále nepostradatelný ve dvou indikacích
- Akutní poškození ledvin u pacientů s akutní pankreatitidou
- Léčba komplikované Crohnovy choroby vedolizumabem
- Kombinace endoskopické slizniční resekce a „full-thickness“ resekce v léčbě adenomu ascendens s příznakem „non-liftingu“
- Gastrointestinálne prejavy familiárnej stredomorskej horúčky – problém aj v strednej Európe?
- Populární sleeve gastrectomy – tubulizace žaludku v chirurgické léčbě těžké obezity a cukrovky 2. typu
- Životní jubileum prof. Zdeňka Marečka
- Pohľad na XXIII. Gastrofórum, Štrbské Pleso, 2018
- 6th Conference of Central European Hepatologic Col laboration
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: hepatologie
- Esomeprazol – S-izomer omeprazolu s výhodnějšími farmakologickými vlastnostmi a silnějším farmakodynamickým účinkem
- Hepatologie
- „Distální“ ulcerózní kolitida u seniora – jaký terapeutický postup zvolit?
- Hepatocelulárny karcinóm na strednom Slovensku – analýza kohorty 207 pacientov v nemocnici 3. stupňa
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Terlipresin – stále nepostradatelný ve dvou indikacích
- Infekce jaterní cysty při polycystóze jater jako zdroj sepse
- Neobvyklá příčina zvětšování břicha
- Akutní poškození ledvin u pacientů s akutní pankreatitidou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



