-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Personalizovaná terapie pacientů s gastroezofageální refluxní chorobou – metodika stanovení genového profilu CYP2C19
Introduction:
Conservative treatment of gastroesophageal reflux disease (GERD) is currently based on a group of drugs that effectively suppress the secretion of hydrochloric acid in the stomach, so-called proton pump inhibitors (PPI). Although these drugs do not target the cause of the disease, they are considered and accepted as the “gold standard” for the treatment of this disease. The aim of this retrospective study was to map medication of GERD patients in various phases of the disease, to analyze individual variability in the cytochrome P450 (CYP2C19) gene, and to propose an effective method for the simple determination of the gene in GERD patients.
Methods:
The study included 276 GERD patients with known pharmacological anamnesis who had undergone surgical treatment. The subjects included 94 patients with non-erosive reflux disease, 121 with reflux esophagitis, and 61 with Barrett’s esophagus (BE) or esophageal adenocarcinoma (EAC). Genotypes of two polymorphisms in the CYP2C19 gene (*17 rs12248560 and *2 rs4244285) were determined using quantitative polymerase chain reaction.
Results:
More than 90% patients were treated with PPI (omeprazole/lansoprazole/pantoprazole). Although the prescribed PPI dosing in the studied cohort was consistent with recommendations for maintenance therapy, the patients’ ability to metabolize the active substance was not considered. Carriers of genotype combinations containing the CYP2C9*17 variant, which determines the ultra-rapid metabolizer (UM) phenotype, were less likely to co-occur with the CYP2C19*2 variant, which determines the intermediate or “poor” metabolizer (IM or PM) phenotype, than individuals with the standard functioning CYP2C19 enzyme (p = 0.001). The frequencies of combinations of genotypes (haplogenotypes) and resulting UM/IM/PM phenotypes were 37.3/16.7/1.4% in GERD patients. Conclusion: Prior to initiating PPI pharmacotherapy in GERD patients, determination of CYP2C19 haplogenotypes (CYP2C19*17 and *2 variants) should be performed due to frequent occurence of these variants in population and their functional metabolic significance. We presume that this approach will increase the effectiveness of pharmacotherapy, improve patient quality of life, and very likely help prevent/reduce the risk of the development of more serious conditions, such as BE and EAC. The non-standard ability to metabolize PPI in GERD patients may be one of the indicators for surgical intervention.
Key words:
pharmacogenetics – gastroesophageal reflux – gene polymorphism – proton pump inhibitors – poor metabolizer – ultra rapid metabolizer – CYP2C19*2 – CYP2C19*17
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted: 24. 1. 2018
Accepted: 30. 3. 2018
Autoři: P. Bořilová Linhartová 1,2; L. Bartošová 3; A. Křenek 4; L. Bartoš 5; Jiří Dolina 6
; F. Marek 4; Z. Kala 4
; L. Izakovičová Hollá 1,2
Působiště autorů: Stomatologická klinika LF MU a FN u sv. Anny v Brně 1; Ústav patologické fyziologie, LF MU, Brno 2; Farmakologický ústav, LF MU, Brno 3; Chirurgická klinika LF MU a FN Brno 4; Ústav biochemie, PřF MU, Brno 6 Interní gastroenterologická klinika LF MU a FN Brno 5
Vyšlo v časopise: Gastroent Hepatol 2018; 72(4): 320-328
Kategorie: Klinická a experimentální gastroenterologie: původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2018320Souhrn
Úvod:
Konzervativní léčba refluxní choroby jícnu (GERD – gastroesophageal reflux disease) je v současnosti opřena o skupinu léků, které nejúčinněji potlačují sekreci kyseliny solné v žaludku, a to tzv. inhibitory protonové pumpy (IPP). I když se nejedná o kauzální léčbu onemocnění, jsou považovány a akceptovány jako léky volby „zlatého standardu“. Cílem retrospektivní studie bylo zmapovat medikace pacientů s GERD v různých stupních onemocnění, analyzovat jejich individuální variabilitu v genu kódujícím enzym cytochrom P450 (CYP2C19) a navrhnout metodiku pro jednoduché stanovení genového profilu pacienta s GERD pro zefektivnění terapeutických postupů.
Metody:
Do studie bylo zařazeno celkem 276 osob s GERD po chirurgickém zákroku se známou farmakologickou anamnézou – 94 pacientů s neerozivní refluxní chorobou, 121 s refluxní ezofagitidou a 61 s Barrettovým jícnem (BE – Barrett’s esophagus) nebo adenokarcinomem jícnu (EAC – esophageal adenocarcinoma). Stanovení genotypů dvou polymorfizmů genu CYP2C19 (*17 rs12248560 a *2 rs4244285) bylo založeno na principu kvantitativní polymerázové řetězové reakce.
Výsledky:
Více než 90 % pacientů užívalo IPP (omeprazol/lansoprazol/pantoprazol). Ačkoli ve sledované kohortě předepsaná dávkování IPP odpovídala doporučení pro udržovací terapii, u pacientů nebyla zohledněna míra schopnosti účinnou látku metabolizovat. Bylo zjištěno, že nositelé genotypových kombinací obsahujících variantu CYP2C9*17 determinující fenotyp ultrarychlého metabolizátoru (UM) mají nižší pravděpodobnost souběžného výskytu s variantou CYP2C19*2, která kóduje fenotyp intermediárního nebo „špatného“ metabolizátoru (IM nebo PM), než osoby se standardní funkcí enzymu CYP2C19 (p = 0,001). Frekvence kombinací genotypů (tzv. haplogenotypů) a ve výsledku fenotypů UM/IM/PM byla mezi pacienty s GERD 37,3/16,7/1,4 %.
Závěr:
U pacientů s GERD by měl být před zahájením farmakoterapie IPP definován jejich genový profil, resp. kombinace variant CYP2C19*17 a *2, a to vzhledem k jejich vysoké frekvenci v populaci a funkčnímu metabolickému významu. Předpokládáme, že by toto opatření mohlo vést ke zvýšení efektivity farmakoterapie, a tím ke zlepšení kvality života pacientů a snad i k prevenci rozvoje závažnějších stavů, jakými jsou BE a EAC. Nestandardní schopnost metabolizovat IPP by mohla být jedním z předpokladů k indikaci chirurgického zákroku u pacientů s GERD.
Klíčová slova:
farmakogenetika – gastroezofageální reflux – genový polymorfizmus – inhibitory protonové pumpy – pomalý metabolizátor – ultrarychlý metabolizátor – CYP2C19*2 – CYP2C19*17
Úvod
Gastroezofageální refluxní choroba (GERD – gastroesophageal reflux disease) je chronické onemocnění, které v západních zemích postihuje 10–20 % dospělé populace. Endoskopicky negativní/neerozivní refluxní nemoc jícnu (NERD – nonerosive reflux disease) je přítomna u významné části (až 50 %) pacientů s refluxními potížemi. Symptomy mohou být obvykle dobře kontrolovatelné terapií, dlouhotrvající průběh choroby významně zvyšuje riziko rozvoje zánětu refluxní ezofagitidy (RE), intestinálních metaplastických změn Barrettova jícnu (BE) a adenokarcinomu ezofagu (EAC – esophageal adenocarcinoma).
Léčba onemocnění je založena na dietních opatřeních, farmakoterapii a případně endoskopické léčbě a chirurgickém zákroku, který je indikován velmi často jako alternativa dlouhodobé medikamentózní terapie či při významné regurgitaci s rozvojem extraezofageálních příznaků.
Farmakoterapie u pacientů s GERD
Při farmakologické terapii jsou pacientům s GERD předepisována léčiva ze skupiny inhibitorů protonové pumpy (IPP), antacid, alginátů, prokinetik a antagonistů histaminových receptorů 2 (H2RA), příp. jejich kombinace. V současnosti nejúčinnější a nejvíce využívané v léčbě jsou IPP, které ireverzibilně blokují H+/K+ ATPázu protonové pumpy v parietálních buňkách žaludeční sliznice, což ovlivňuje sekreci vodíkových iontů, a tedy i pH.
Zatímco u pacientů s GERD bez RE jsou výsledky dlouhodobé léčby IPP a podávání IPP dle aktuální potřeby (tzv. terapie na vyžádání – on demand) srovnatelné, tak při léčbě GERD se souběžnou RE je kontinuální léčba IPP efektivnější [1]. Na druhou stranu se při dlouhodobém užívání, které je obvyklé vzhledem k chronické povaze onemocnění, mohou objevit nežádoucí účinky terapie, jako je osteoporóza v důsledku sníženého vstřebávání minerálů, snížené vstřebávání vitaminu B12 a železa, a dále pak, zejména u starších pacientů, např. chronické onemocnění ledvin nebo demence [2]. U nově vyvíjených molekul ze skupiny IPP je proto snaha zlepšit jejich farmakodynamické a farmakokinetické vlastnosti, např. časově rozvolnit efekt léčiva na změnu pH, a tím snížit výskyt nežádoucích účinků z toho pramenících; případně snížit jejich interakční potenciál daný účastí cytochromálních enzymů v metabolizmu [3].
Vzhledem k zásadnímu významu IPP ve farmakoterapii pacientů s GERD hraje velký význam identifikace faktorů, které mohou neúspěšnost této léčby předem predikovat. Mezi tyto faktory se řadí funkční poruchy trávení u pacientů s GERD [4], NERD [5] nebo nestandardní metabolizace IPP. Neopomenutelným faktorem zůstává také nedostatečná adherence pacientů k léčbě [6]. Klíčovým nástrojem pro potvrzení podezření, že pacient patří mezi nonrespondéry na IPP terapii, je u pacientů s GERD 24hodinová pH-metrie jícnu (monitoring pH-impedance) [7,8].
Metabolizace IPP a lékové interakce
Všechny IPP (omeprazol, lansoprazol, pantoprazol, esomeprazol, rabeprazol a dexlansoprazol) jsou metabolizovány v játrech enzymy cytochromu P450, jejichž aktivita je ovlivněna jak vnějšími, tak i vnitřními faktory. Na biotransformaci se primárně podílí izoenzym CYP2C19, v menší míře také CYP3A4, přičemž význam izoenzymu CYP3A4 narůstá právě u jedinců s geneticky nefunkčním CYP2C19 [9].
CYP2C19 je přitom zodpovědný nejen za metabolizaci IPP, ale i řady dalších běžně užívaných léčiv ze skupiny antiepileptik, antidepresiv, antimykotik a antiagregancií (např. klopidogrel). Interakční potenciál s klopidogrelem je nejvyšší u omeprazolu, zatímco u rabeprazolu je nejnižší ze všech IPP [10]. Vzhledem k tomu, že IPP zvyšují intragastrické pH, mohou ovlivnit množství neionizované frakce, a tedy vstřebávání některých léčiv. U slabých kyselin je rozpustnost a vstřebávání zvýšena, naopak u slabých bazí snížena. Většina dosud popsaných lékových interakcí IPP se však vysvětluje na úrovni ovlivnění jejich metabolizmu, jedná se o inhibici nebo o indukci izoenzymů CYP2C19 nebo CY3A4. Některé z IPP jsou navíc samy také inhibitory CYP2C19, např. omeprazol [11].
Genové varianty CYP2C19 a jejich klinický dopad
Změna aktivity enzymu CYP2C19 nemusí být způsobena pouze shora uvedenými lékovými interakcemi, ale i genetickou dispozicí jedince [12,13]. V odborné literatuře je pozornost věnována především asociaci mezi genotypem CYP2C19 pacienta a mírou eradikace Helicobacter pylori [14].
Do současnosti bylo v genu kódujícím enzym CYP2C19 nalezeno > 49 variantních alel, klinický dopad je však znám pouze u 9 z nich. Jen u jedné varianty (označované jako *17 rs12248560) byl zjištěn ultrarychlý metabolizmus IPP v důsledku bodové mutace v regulační části genu a následně zvýšené genové expresi a aktivitě enzymu. Alela CYP2C19*17 predikuje nositele k neefektivnímu účinku standardních dávek IPP; fenotypově se jedná o tzv. ultrarychlé metabolizátory (UM). Všechny ostatní variantní alely jsou charakterizovány sníženou aktivitou enzymu CYP2C19 nebo úplnou ztrátou jeho enzymatické funkce (*2, *2B, *3, *4, *6, *7, *8). Mezi těmito je populačně nejčetnější variantní alela CYP2C19*2 (rs4244285). Tato bodová mutace, charakteru záměny guaninu za adenin v pozici 681 v exonu 5, je zodpovědná za vznik nového aberantního místa sestřihu v aminokyselinové sekvenci genu, což vede k expresi zkráceného a nefunkčního proteinu CYP2C19 [15]. Homozygotní nositelé dvou standardních alel jsou označováni jako extenzivní metabolizátoři (EM), osoby s jednou variantní alelou jako intermediární metabolizátoři (IM), což se klinicky projeví zpomalením metabolizmu substrátů tohoto enzymu. Pokud jsou přítomny dvě variantní alely *2*2, vede to ke kompletnímu deficitu enzymatické aktivity CYP2C19 a tito nositelé jsou označováni jako pomalí metabolizátoři (PM) [12], i když příznačnější by pravděpodobně bylo označení „špatní“ metabolizátoři.
O výsledném fenotypu, resp. funkční aktivitě enzymu CYP2C19, tak rozhoduje vzájemná kombinace přítomnosti variantních alel. Jelikož je exprese CYP2C19 významně ovlivněna genovými polymorfizmy, je u léčiv jím metabolizovaných uvedeno upozornění na tuto skutečnost nebo preskripční omezení na stránkách Úřadu pro kontrolu potravin a léčiv (FDA – Food and Drug Administration) [16].
Cílem naší studie bylo:
- zmapovat užívání léčiv u pacientů s různými stupni GERD,
- analyzovat jejich individuální variabilitu v genu kódujícím CYP2C19,
- navrhnout metodiku pro jednoduché stanovení genového profilu pacienta s GERD pro zefektivnění terapeutických postupů.
Soubor pacientů a metodika
Do retrospektivní studie s designem „case-case“ (porovnávání skupin pacientů NERD vs. RE/BE + EAC i RE vs. BE + EAC) bylo zahrnuto 276 osob (z toho 94 pacientů s NERD, 121 jedinců s RE a 61 pacientů s BE nebo EAC), které v letech 2004–2011 podstoupily zákrok (laparoskopickou fundoplikaci pro GERD a BE, resekční zákrok pro EAC) na Chirurgické klinice LF MU a FN Brno. Pacienti byli k zákroku odesíláni z Interní gastroenterologické kliniky LF MU a FN Brno; GERD jim byla diagnostikována na základě klinických symptomů, jako je pálení žáhy a/nebo regurgitace kyseliny s objektivizací pomocí 24hodinové pH-metrie, ezofagogastroduodenoskopie, manometrie jícnu a histologického vyšetření. Patologický kyselý reflux byl definován dle DeMeester score nad 14,7. Kritéria pro zařazení do studie byla následující: osoby české národnosti starší 18 let, diagnóza GERD s následnou chirurgickou terapií, dostupné údaje o farmakoterapii. Vylou?eni byli pačeni byli pacienti s achalázií nebo s divertikly jícnu.
V souladu s Helsinskou deklarací pacienti před zařazením do studie podepsali informovaný souhlas schválený Etickou komisí FN Brno (NPV 2B 06060).
Genetická analýza
Pacientům bylo odebráno 9 ml periferní krve do zkumavky s protisrážlivým činidlem (EDTA). Genomová DNA byla izolována z leukocytů pomocí fenol-chloroformové extrakce s použitím izopropanolu a proteinázy K na Ústavu patologické fyziologie, LF MU Brno. Na principu kvantitativní řetězové reakce v reálném čase byly stanoveny dva jednonukleotidové polymorfizmy (SNP – single nucleotide polymorphisms) v CYP2C19 (*17 rs12248560 a *2 rs4244285) pomocí fluorescenčně značených sond 5¢ nuclease TaqMan® assay (C_469857_10 a C_25986767_70, Thermo Fisher Scientific, Waltham, Massachusetts, USA) dle protokolu od výrobce. Fluorescence byla měřena pomocí přístroje LightCycler 96 (Roche Diagnostics, Basilej, Švýcarsko) a fluorescenční změny v reálném čase byly analyzovány pomocí softwaru LightCycler 96 Application Software a LightCycler 96 Instrument.
Statistická analýza
Významnost rozdílů v alelických frekvencích mezi jednotlivými skupinami byla hodnocena Fisherovým testem. Signifikance odchylek od Hardy-Weinbergovy rovnováhy pro každý polymorfizmus a rozdíly ve frekvencích genotypů (i jejich kombinací, tzv. haplogenotypů) jsme testovali pomocí χ2-testu. Haplotypová analýza byla provedena pomocí programu SNP analyzer v. 2.0 (http: //snp.istech21.com/ snpanalyzer/2.0/). Rozdíly ve frekvencích haplotypů byly počítány permutačním testem a hodnota p < 0,05 byla považována za statisticky významnou.
Výsledky
Demografický popis studované populace vč. farmakoterapeutických údajů je uveden v tab. 1. Věkový průměr 276 pacientů s GERD zařazených do studie v době hospitalizace byl 46,4 ± 13,4 let, z toho bylo 166 mužů (ve věku 44,9 ± 13,3 let) a 110 žen (ve věku 48,6 ± 12,6 let). Průměrný body mass index (BMI) byl u pacientů s GERD 26,3 ± 3,3 kg/m2. BE nebo EAC byli častěji postiženi muži (72,1 %). Před operací byl u 89,9 % pacientů s GERD přítomen kyselý reflux, zatímco po operaci byl prokázán pouze u 15,2 % osob (p < 0,000001). U 12 pacientů došlo k progresi onemocnění do závažnějšího stadia onemocnění a naopak u 7 k objektivnímu zlepšení v průběhu sledovaného období (v rozmezí let 2004–2011). U 3 pacientů se stav z původní diagnózy NERD rozvinul do EAC, ani jeden z těchto pacientů neužíval IPP.
Tab. 1. Demografický popis studované populace a farmakoterapie GERD.
Tab. 1. Demographic description of the studied population and pharmacotherapy of GERD.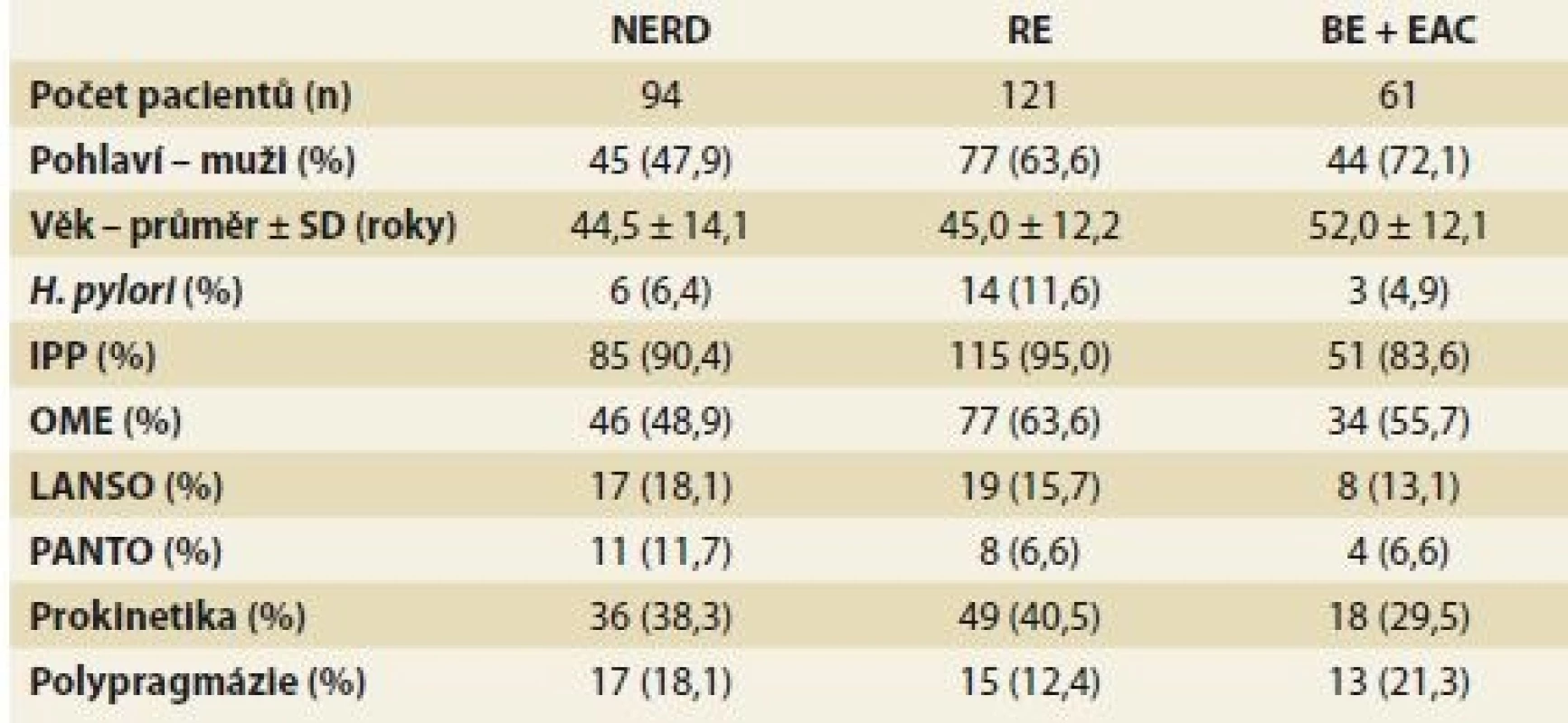
GERD – gastroezofageální refluxní choroba, NERD – neerozivní refluxní choroba jícnu, RE – refluxní ezofagitida, BE + EAC – Barrettův jícen + adenokarcinom jícnu, H. pylori – Helicobacter pylori, IPP – inhibitor protonové pumpy, OME – omeprazol, LANSO – lansoprazol, PANTO – pantoprazol, SD – směrodatná odchylka, n – počet Farmakoterapie
Z dostupných lékařských záznamů vyplynulo, že 45 pacientů s GERD (16,3 %) z našeho souboru užívá současně více než pět léčivých přípravků (tab. 2), což je definováno jako polypragmazie. Celkem 90,9 % pacientů sledované kohorty užívalo některé léčivo ze skupiny IPP, 103 pacientů (37,3 %) bralo prokinetika (itoprid, metoklopramid). Pouze jeden pacient užíval léčivo ze skupiny H2RA (ranitidin). Mezi dalšími byla nejčastěji zastoupena léčiva ovlivňující kardiovaskulární systém (antihypertenziva, antiarytmika a organické nitráty), která užívalo 23,6 % pacientů, a psychofarmaka (antidepresiva, antiepileptika a anxiolytika) užívaná 13,3 % pacientů s GERD. V námi sledované kohortě užívalo 19 pacientů (6,9 %) současně s IPP jiné léčivo (citalopram, escitalopram, sertralin, fluvastatin, fenofibrát, celekoxib a methotrexát), u něhož je popsáno potenciální riziko lékové interakce na úrovni metabolizmu.
Tab. 2. Genotypové frekvence CYP2C19 u pacientů s GERD.
Tab. 2. CYP2C19 genotype frequencies in patients with GERD.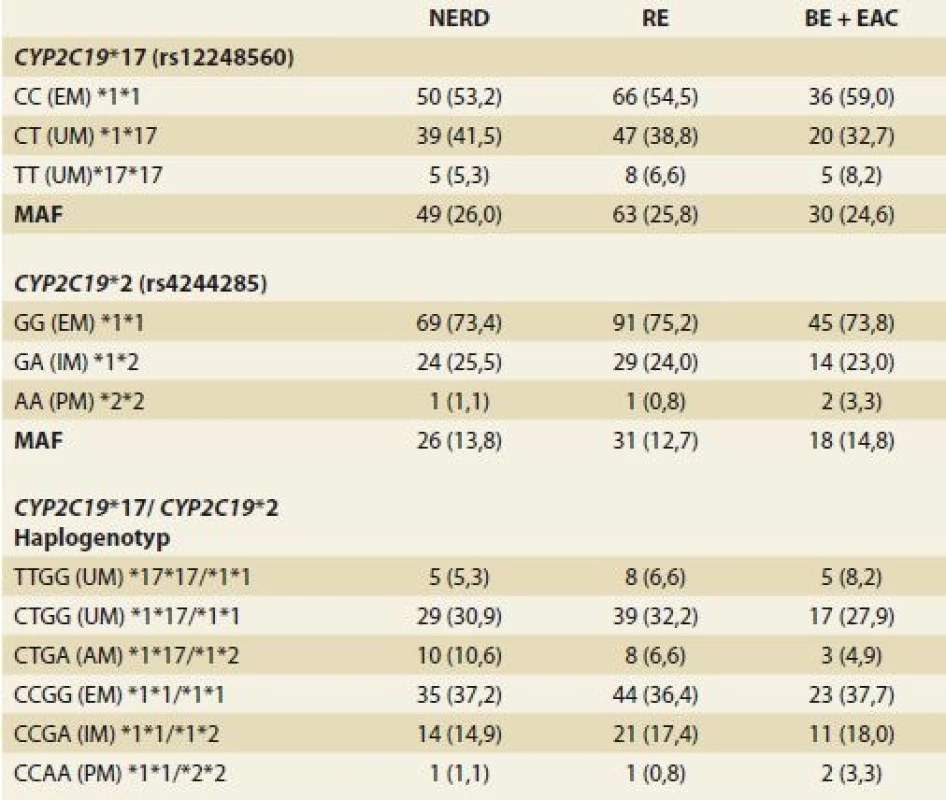
GERD – gastroezofageální refl uxní choroba, NERD – neerozivní refluxní choroba jícnu, RE – refluxní ezofagitida, BE + EAC – Barrettův jícen + adenokarcinom jícnu, CYP2C19 – cytochrom P450 2C19, PM – „špatný“ metabolizátor, IM – intermediární metabolizátor, EM – extenzivní (normální) metabolizátor, AM – ambivalentní metabolizátor, UM – ultrarychlý metabolizátor, MAF – frekvence minoritní alely Ze skupiny IPP byl nejčastěji (62,5 %) pacientům s GERD podáván omeprazol s mediánem denní dávky 20 mg (min.–max., 20–60 mg), dále pak v 17,5 % lansoprazol s mediánem denní dávky 30 mg (30–60 mg) nebo v 9,2 % pantoprazol s mediánem denní dávky 40 mg (20–40 mg). U dalších 13,1 % pacientů byl předepsán jeden z těchto IPP, v záznamech však chyběl údaj o konkrétním typu IPP a zvoleném dávkování. U 7 pacientů došlo v průběhu užívání ke změně typu IPP. Pozitivní nález H. pylori byl zaznamenán u 8,3 % pacientů a medián dávkování omeprazolu u nich byl 20 mg/den (20–60 mg), u 1 pacienta byl předepsán pantoprazol v dávkování 40 mg/den.
Genový profil CYP2C19
Nezaznamenali jsme rozdíly ve frekvencích alel ani genotypů u obou studovaných SNP mezi jednotlivými skupinami pacientů s GERD, oba hodnocené SNP byly v Hardy-Weinbergově rovnováze (p > 0,05) (tab. 2). Ve studované populaci bylo zastoupeno 44,9 % pacientů, kteří nesou alespoň jednu alelu CYP2C19*17 (rs12248560), a 25,7 % nositelů alespoň jedné alely CYP2C19*2 (rs4244285). Na základě haplogenotypové analýzy byl zjištěn signifikantní rozdíl ve frekvencích variant kódujících EM a IM + PM vs. UM a ambivalentní metabolizátor (AM) (p = 0,001) (tab. 3); v naší práci jsme fenotyp u pacientů s haplogenotypem *1*17/*1*2 originálně označili zkratkou AM. Zastoupení pacientů s GERD a současně s fenotypem AM bylo 7,6 %. Analýza vazebné nerovnováhy ukázala, že byly varianty CYP2C19*2 a CYP2C19*17 v kompletní vazebné nerovnováze (|D’| = 1,0).
Tab. 3. Haplogenotypové frekvence CYP2C19 u pacientů s GERD.
Tab. 3. CYP2C19 haplogenotype frequencies in patients with GERD.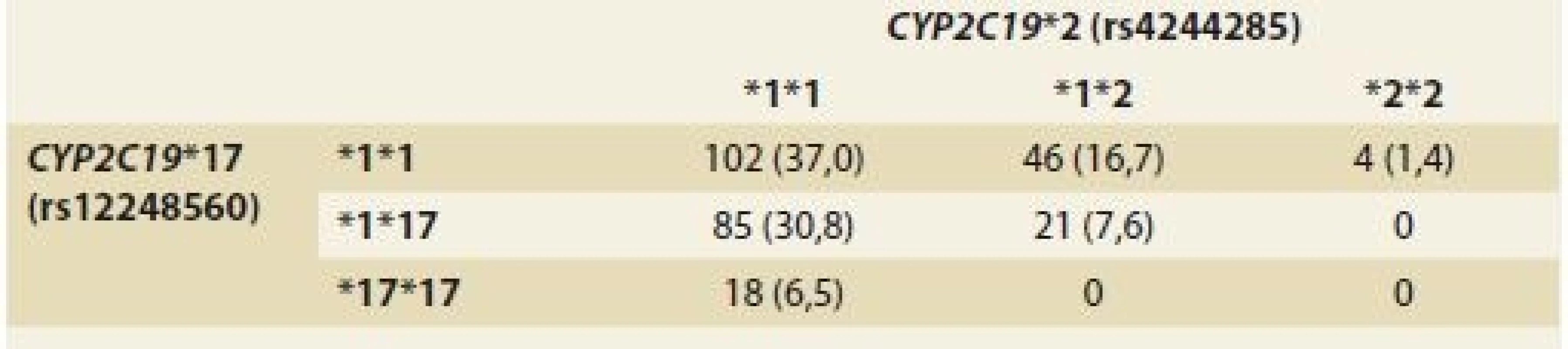
GERD – gastroezofageální refl uxní choroba, CYP2C19 – cytochrom P450 2C19 Užívání IPP ve vztahu k fenotypu CYP2C19
Více než 10 % pacientů s fenotypem UM (dle haplogenotypu), kterých bylo celkem 103, neužívalo žádný IPP. Ti, kteří v rámci farmakoterapie měli IPP předepsán, užívali ve 49,5 % omeprazol s mediánem denní dávky 20 mg (20–60 mg), případně lansoprazol/pantoprazol s mediánem 30 mg/den (30–60 mg), resp. 40 mg/den (20–40 mg). Osm pacientů s fenotypem UM a s pozitivním nálezem H. pylori mělo předepsáno dávkování omeprazolu s mediánem denní dávky 40 mg (20–40 mg) nebo 40 mg pantoprazolu za den. Všichni 4 pacienti s fenotypem PM (dle haplogenotypu) užívali IPP, a to omeprazol v denní dávce 40 mg. U 2 z těchto pacientů se rozvinul BE, 1 pacient měl RE a u 1 osoby byl zaznamenán NERD.
Diskuze
Až u 40 % pacientů s GERD přetrvávají příznaky refluxu, a to i přes terapii IPP. V recentní přehledové práci jsou shrnuty důkazy pro indikace chirurgického, resp. endoskopického přístupu k terapii GERD u pacientů nereagujících na konzervativní léčbu s podáváním IPP. Laparoskopická fundoplikace dle autorů poskytuje prokazatelnou úlevu od symptomů až na 10 let, i když její účinnost časem klesá [17]. Naše výsledky po měření pH-impedance u pacientů s GERD před operací a po ní jsou rovněž důkazem o přínosu tohoto terapeutického přístupu.
Chirurgický zákrok u pacientů s GERD je indikován především u mladších pacientů, a proto je v naší studii celkové zastoupení pacientů s polypragmazií relativně nízké. Nejvíce osob s polypragmazií jsme zaznamenali ve skupině pacientů s BE + EAC (u 21 % z nich), což může souviset s jejich vyšším průměrným věkem (tab. 1), neboť se zvyšujícím se věkem stoupá polymorbidita. V populaci seniorů se uvádí incidence polypragmazie v rozmezí 30–60 % [18]. Téměř 90 % pacientů, kteří podstoupili chirurgický zákrok z indikace GERD, současně užívalo některý z IPP 1. generace, tedy omeprazol, lansoprazol nebo pantoprazol. Medián denní dávky omeprazolu byl 20 mg, což je dle guidelines při udržovací léčbě dávka standardní. Na druhou stranu je však u pacientů, kteří mají endoskopické změny na sliznici jícnu, doporučována výrazně vyšší denní dávka, a to 60–80 mg omeprazolu nebo 60 mg lansoprazolu nebo 80 mg pantoprazolu [19]. U pacientů s BE + EAC užívajících lansoprazol bylo toto doporučení dodrženo, zatímco v případě omeprazolu a pantoprazolu byl medián preskripce denní dávky pouze 40 mg.
Ačkoli můžeme konstatovat, že předepsaná dávkování IPP následovala doporučení, u pacientů nebyla zohledněna individuální míra schopnosti účinnou látku metabolizovat. Vyšetření schopnosti metabolizace IPP není v ČR standardně prováděno, i když je známo, že nejen volba vhodného dávkování, ale také konkrétního léčiva ze skupiny IPP nabývá u pacientů s variantními alelami v genu pro CYP2C19 zásadního významu.
Mezi jednotlivými IPP existují značné rozdíly v biotransformaci vzhledem k rozdílné míře, jakou se na metabolizmu jednotlivých IPP podílejí oba izoenzymy (CYP2C19 a CYP3A4), příp. nakolik se uplatňují jiné, neenzymatické cesty metabolizace [20,21]. Jelikož je rabeprazol primárně metabolizován neenzymaticky a enzymů CYP využívá pouze omezeně [22], tak význam individuální variability v genu CYP2C19 má u pacientů užívajících rabeprazol menší význam ve srovnání např. s omeprazolem. Domníváme se proto, že rabeprazol by byl nejvhodnějším kandidátem ze všech IPP v současnosti registrovaných a distribuovaných v ČR pro léčbu GERD u pacientů s variantními alelami v genu CYP2C19, obzvláště u pacientů s fenotypy PM a UM. Rabeprazol je navíc spojován i s nejvyšší efektivitou eradikace Helicobacter pylori [14].
Nelze však říci, že rabeprazol je nejlepší IPP. Z výsledků recentní studie porovnávající účinnost a snášenlivost jednotlivých IPP v dávkách doporučovaných dle FDA vyplynulo, že např. pro hojení slizničních erozí a úlevu od pálení žáhy je nejvhodnější esomeprazol v dávce 40 mg/den. Dále autoři zjistili, že dexlansoprazol, rabeprazol a omeprazol vykazovaly nižší účinnost a snášenlivost než esomeprazol, pantoprazol nebo lansoprazol [23].
Je také známo, že při opakovaném podání omeprazolu se rozdíl ve farmakokinetice mezi pacientem s fenotypem EM a PM snižuje. Zatímco u EM dochází k inhibici CYP2C19 samotným omeprazolem (tzv. autoinhibice) a následně k částečné kumulaci léčiva, u PM k autoinhibici nedochází v důsledku nefunkčnosti enzymu CYP2C19 a částečná kumulace léčiva je dána jeho zpomaleným odbouráváním. Autoinhibice se neuplatňuje u lansoprazolu a pantoprazolu [11].
Dle doporučení FDA je u pacientů s fenotypem UM nebo při eradikaci Helicobacter pylori vhodné zvýšit denní dávku IPP na 100–200 % a pečlivě sledovat, zda je odpověď na terapii dostatečná. Pro ostatní fenotypy žádná doporučení k terapii IPP ze strany FDA nejsou [16,24]. Vzhledem ke skutečnosti, že zvolené dávkování omeprazolu i pantoprazolu bylo v našem souboru standardní, se lze domnívat, že u pacientů s GERD a fenotypem UM mohla být v důsledku jejich genetické dispozice zvolená léčba neúčinná/méně účinná. Rovněž u pacientů užívajících léčiva s interakčním potenciálem s IPP nebyl pravděpodobně výsledek terapie optimální.
IPP jsou nedílnou součástí jakéhokoli eradikačního schématu Helicobacter pylori, a to v dávkách 2× vyšších, než jsou standardní udržovací dávky. Metaanalýza studií zaměřených na účinnost eradikace v souvislosti s genetickými variantami CYP2C19 zjistila významné rozdíly u jednotlivých skupin metabolizátorů užívajících omeprazol a lansoprazol, naopak u esomeprazolu a rabeprazolu (IPP 2. generace) nebyla účinnost eradikace ovlivněna. Výsledky klinického hodnocení eradikačních režimů dokumentují vyšší rychlost a vyšší úspěšnost eradikace u pacientů s fenotypem PM ve srovnání s EM [25,26].
V naší kohortě mělo pouze 23 pacientů pozitivní nález Helicobacter pylori a většina měla předepsáno dávkování IPP poloviční, než je doporučováno [19]. Jelikož 8 z nich patří navíc mezi UM, je zřejmé, že nastavená denní doporučená dávka IPP pro ně nebyla dostatečná. Právě genotypizace CYP2C19 se tak může stát užitečným nástrojem pro rozhodování o optimálním eradikačním režimu Helicobacter pylori založeném na terapii IPP v kombinaci s antibiotickými preparáty.
U UM pacientů lze předpokládat, že mohou být nonrespondéry IPP terapie, proto by stanovení fenotypu mohlo být využito jako jeden z předpokladů k indikaci chirurgické léčby – zejména v případě, že jsou pacienti s GERD i Helicobacter pylori pozitivní. Naše výsledky, které jsou podloženy i závěry zahraničních studií zabývajících se IPP terapií u pacientů s GERD a možným efektem jejich individuální variability v genu CYP2C19, jsme shrnuli v doporučeních uvedených na schématu 1.
Schéma 1. Doporučená terapie u pacientů s GERD na základě stanoveného fenotypu CYP2C19.
Scheme 1. Recommended therapy in patients with GERD according to the CYP2C19 phenotype.
Legenda ke schématu 1
Po analýze genu CYP2C19 jsme zjistili, že v české populaci je 1,4 % pacientů, jejichž schopnost metabolizovat některé z IPP (omeprazol, esomeprazol, pantoprazol, dexlansoprazol, lansoprazol), je špatná z důvodu nízké aktivity jejich enzymu CYP2C19. Jedná se o PM, u kterých se farmakoterapie zahrnující rabeprazol jeví dle aktuálních poznatků jako nejlepší volba. Jelikož je toto IPP metabolizováno s minoritním využitím enzymu CYP2C19, je možné mít dávkování IPP více pod kontrolou, tím pádem i snížit nebezpečí nežádoucích účinků z důvodu předávkování, a rovněž lékových interakcí na úrovni cytochromu P450. Navíc u PM s GERD a pozitivním nálezem H. pylori je rabeprazol vhodný také s ohledem na jeho vysokou efektivitu při eradikaci H. pylori.
Více než 1/3 sledovaných pacientů s GERD má fenotyp EM, a tedy standardní aktivitu enzymu CYP2C19. Pro farmakoterapii těchto osob lze při negativním nálezu H. pylori předepsat jakékoli léčivo ze skupiny IPP. U EM (na rozdíl od PM) dochází k autoinhibici enzymu CYP2C19 při užívání omeprazolu, a proto je omeprazol pro EM vhodným léčivem s přihlédnutím na minimalizaci nežádoucích účinků. Pokud mají EM s GERD pozitivní nález H. pylori, pak je doporučováno zvýšit dávkování vybraných IPP (omeprazol, esomeprazol, pantoprazol, dexlansoprazol, lansoprazol) až na 200 % standardního dávkování dle SPC nebo opět zvolit rabeprazol ve standardním režimu dávkování.
Až 37,3 % pacientů s GERD, kteří fenotypově odpovídají UM, je v případě negativního nálezu H. pylori možno zaléčit všemi typy IPP, mělo by se však zvolit 100–200 % standardního dávkování dle SPC (s výjimkou rabeprazolu, kde dávkování může zůstat obvyklé). Ačkoli je u UM s pozitivním nálezem Helicobacter pylori možné předepsat rabeprazol, tak je vysoká pravděpodobnost neúspěchu farmakoterapie IPP, a proto navrhujeme indikaci chirurgického zákroku u této skupiny pacientů (při selhání terapie IPP a přetrvávajících obtížích lékaři přistupují u pacientů s GERD mimo jiné i k chirurgickému zákroku.)
U pacientů s IM, a především s AM fenotypem není aktivita enzymu CYP2C19 jednoznačně definovaná, a tudíž ani neexistují žádná klinická doporučení. Přikláníme se k tomu, že by u nich způsob terapie mohl kopírovat doporučení pro extrémní fenotypy, tedy PM, resp. UM.
Neočekávali jsme, že by mezi jednotlivými skupinami pacientů s GERD bylo významně vyšší/nižší zastoupení alel CYP2C19*17 nebo *2, neboť sledované genové polymorfizmy nezasahují do patogeneze onemocnění. V evropské populaci je frekvence výskytu minoritní alely (MAF) CYP2C19*2 (rs4244285) 14,5 % [27], v české populaci je to 13,0 % [28]. Data týkající se MAF CYP2 C19*17 v české populaci nejsou dosud k dispozici, pro evropskou populaci se uvádí hodnota 22,4 % [29]. Naše výsledky, kdy MAF pro alelu *2 byla 13,6 % a pro alelu *17 byla 25,7 %, odpovídají frekvencím v evropské populaci. Ukázalo se, že u pacientů po chirurgickém zákroku pro GERD je frekvence osob s abnormální metabolizací IPP shodná s frekvencí těchto fenotypů v celé populaci. Ačkoli by se nabízelo, že fenotyp abnormálního IPP metabolizátora bude ve skupině pacientů s GERD po laparoskopické fundoplikaci zastoupen častěji než u pacientů s GERD léčených jen konzervativně, tak naše výsledky nic takového nepotvrdily. Vysvětlení spočívá v tom, že k selhání IPP terapie dochází z vícero důvodů a že ne u všech osob, u kterých konzervativní léčba selhává, je vhodné indikovat chirurgický zákrok.
Podle práce Lewis et al [30] se variantní alela CYP2C19*17 nevyskytuje v haplotypu společně s variantní alelou CYP2C19*2, obě alelové varianty jsou v tzv. vazebné nerovnováze. Výsledky naší haplotypové/haplogenotypové analýzy tyto výsledky potvrzují. Recentní studie zaměřená na děti s GERD prokázala klinický význam varianty CYP2C19*17 a její autoři ve shodě s námi doporučují před zahájením léčby IPP genetické testování [31], neboť zvýšená aktivita CYP2C19 (nositelé variantní alely *17), a tudíž zrychlené odbourávání účinné látky, může být příčinou selhání terapie. Pro jednoznačné definování fenotypu dle našeho názoru není dostačující stanovení pouze této jedné z variantních alel. Ačkoli mají léčiva ze skupiny IPP obecně dobrou toleranci [32] a geneticky podmíněné zvýšení koncentrace u pacientů s fenotypem PM [33] se nemusí projevit toxicky, nelze zanedbat riziko nežádoucích účinků dlouhodobé terapie, které by mohlo být logicky u pacientů s tímto fenotypem vyšší. Z těchto důvodů doporučujeme stanovení polymorfizmů CYP2C19*17 i CYP2C19*2, neboť zvýšení ekonomických nákladů je již minimální v poměru k benefitu, který tím pacient získá.
Dalším zajímavým aspektem stanovení genového profilu CYP2C19 je, že při společné přítomnosti obou variantních alel s protichůdným vlivem na enzymatickou aktivitu CYP2C19 (haplogenotyp *1*17/*1*2) nemusí být fenotyp jednoznačný, označili jsme ho proto jako AM. Jelikož dosud nebyla u těchto AM jedinců definována aktivita enzymu CYP2C19, a tedy i jejich schopnost metabolizace IPP, je nutno efekt léčby IPP u těchto pacientů dále podrobněji analyzovat.
Závěr
Ačkoli jsou IPP velmi účinné a bezpečné léky s minimálním interakčním potenciálem, je nutno mít na paměti existenci genových polymorfizmů izoenzymu CYP2C19, které mohou být příčinou individuální variability farmakokinetických parametrů a vést k očividným rozdílům mezi pacienty z hlediska potlačení acidity, potenciálu pro vznik lékových interakcí a klinické účinnosti léčiva. Pochopení farmakokinetických rozdílů a přezkoumání možných alternativních cest metabolizmu může pomoci lékařům lépe individualizovat a optimalizovat léčbu IPP u nonrespondérů s GERD nebo u pacientů s vředovou chorobou po selhání eradikační terapie.
Jedná se o první studii zabývající se specifickou kombinací variant CYP2C19*17 (rs12248560) a CYP2C19*2 (rs4244285) v souvislosti s GERD a terapií IPP. Navrhujeme, aby tato jednoduchá a efektivní metodika stanovení genového profilu, která je založená na detekci dvou nejvíce frekventních funkčních variant genu kódujícího enzym CYP2C19, byla zvažována při léčbě IPP u pacientů s GERD.
Článek vznikl z prostředků poskytnutých LF MU juniorskému výzkumníkovi Petře Bořilové Linhartové a s podporou grantu GAČR GB14-37368G.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 24. 1. 2018
Přijato: 30. 3. 2018
Mgr. Petra Bořilová Linhartová, Ph.D.
Ústav patologické fyziologie LF MU
Kamenice 5 625 00 Brno
Zdroje
1. The Swedish Council on Technology Assess-ment in Health Care. Dyspepsia and gastro-oesophageal reflux. A systematic review. [online]. Available from: https: //www.ncbi.nlm.nih.gov/pubmedhealth/PMH0096647/pdf/PubMedHealth_PMH0096647.pdf.
2. Maes ML, Fixen DR, Linnebur SA. Adverse effects of proton-pump inhibitor use in older adults: a review of the evidence. Ther Adv Drug Saf 2017; 8 (9): 273–297. doi: 10.1177/204209 8617715381.
3. Mermelstein J, Mermelstein AC, Chait MM. Proton pump inhibitors for the treatment of patients with erosive esophagitis and gastroesophageal reflux disease: current evidence and safety of dexlansoprazole. Clin Exp Gastroenterol 2016; 9 : 163–172. doi: 10.2147/CEG.S91602.
4. Garros A, Mion F, Marjoux S et al. Factors associated with nonresponse to proton pump inhibitors therapy in patients referred for esophageal pH-impedance monitoring. Dis Esophagus 2016; 29 (7): 787–793. doi: 10.1111/dote.12374.
5. Bytzer P, van Zanten SV, Mattsson H et al. Partial symptom-response to proton pump inhibitors in patients with non-erosive reflux disease or reflux oesophagitis – a post hoc analysis of 5796 patients. Aliment Pharmacol Ther 2012; 36 (7): 635–643. doi: 10.1111/apt.12007.
6. Domingues G, Moraes-Filho JP. Noncompliance is an impact factor in the treatment of gastroesophageal reflux disease. Expert Rev Gastroenterol Hepatol 2014; 8 (7): 761–765. doi: 10.1586/17474124.2014.911660.
7. Kawamura O, Hosaka H, Shimoyama Y et al. Evaluation of proton pump inhibitor-resistant nonerosive reflux disease by esophageal manometry and 24-hour esophageal impedance and pH monitoring. Digestion 2015; 91 (1): 19–25. doi: 10.1159/000368766.
8. Yadlapati R, Tye M, Roman S et al. Postprandial high-resolution impedance manometry identifies mechanisms of nonresponse to proton pump inhibitors. Clin Gastroenterol Hepatol 2018; 16 (2): 211–218. doi: 10.1016/j.cgh.2017.09.011.
9. Hagymási K, Müllner K, Herszényi L et al. Update on the pharmacogenomics of proton pump inhibitors. Pharmacogenomics 2011; 12 (6): 873–888. doi: 10.2217/pgs.11.4.
10. Scott SA, Owusu Obeng A, Hulot JS. Antiplatelet drug interactions with proton pump inhibitors. Expert Opin Drug Metab Toxicol 2014; 10 (2): 175–189. doi: 10.1517/17425255.2014.856883.
11. Ogilvie BW, Yerino P, Kazmi F et al. The proton pump inhibitor, omeprazole, but not lansoprazole or pantoprazole, is a metabolism – dependent inhibitor of CYP2C19: implications for coadministration with clopidogrel. Drug Metab Dispos 2011; 39 (11): 2020–2033. doi: 10.1124/dmd.111.041293.
12. Furuta T, Shirai N, Sugimoto M et al. Pharmacogenomics of proton pump inhibitors. Pharmacogenomics 2004; 5 (2): 181–202. doi: 10.1517/phgs.5.2.181.27483.
13. Klotz U. Clinical impact of CYP2C19 polymorphism on the action of proton pump inhibitors: a review of a special problem. Int J Clin Pharmacol Ther 2006; 44 (7): 297–302.
14. Lin YA, Wang H, Gu ZJ et al. Effect of CYP2C19 gene polymorphisms on proton pump inhibitor, amoxicillin, and levofloxacin triple therapy for eradication of Helicobacter pylori. Med Sci Monit 2017; 23 : 2701–2707.
15. Rogan PK, Svojanovsky S, Leeder JS. Information theory-based analysis of CYP2C19, CYP2D6 and CYP3A5 splicing mutations. Pharmacogenetics 2003; 13 (4): 207–218. doi: 10.1097/01.fpc.0000054078.64000.de.
16. Food and Drug Administration (FDA). Table of pharmacogenomic biomarkers in drug labeling. [online]. Available from: https: //www.fda.gov/downloads/Drugs/ScienceResearch/UCM 578588.pdf.
17. Hillman L, Yadlapati R, Whitsett M et al. Review of antireflux procedures for proton pump inhibitor nonresponsive gastroesophageal reflux disease. Dis Esophagus 2017; 30 (9): 1–14. doi: 10.1093/dote/dox054.
18. Suchopár J, Prokeš M. Polypragmazie a lékové interakce. Vnitř Lék 2011; 57 (9): 755–759.
19. Červený P. Inhibitory protonové pumpy: přehled a porovnání základních údajů. Remedia 2009; 9 (6): 432–437.
20. Gregar J, Šimková I, Urbánek K. Lékové interakce inhibitorů protonové pumpy. Klin Farmakol Farm 2011; 25 (4): 188–191.
21. Sugimoto M, Furuta T. Efficacy of esomeprazole in treating acid-related diseases in Japanese populations. Clin Exp Gastroenterol 2012; 5 : 49–59. doi: 10.2147/CEG.S23926.
22. Červený P. Rabeprazol. Remedia 2013; 23 (4): 243–247.
23. Li MJ, Li Q, Sun M et al. Comparative effectiveness and acceptability of the FDA-licensed proton pump inhibitors for erosive esophagitis: A PRISMA-compliant network meta-analysis. Medicine (Baltimore) 2017; 96 (39): e8120. doi: 10.1097/MD.0000000000008120.
24. Dean L. Omeprazole therapy and CYP2C19 genotype. In: Pratt V, McLeod H, Dean L (eds). Medical Genetics Summaries.. National Center for Biotechnology Information 2012. [online]. Available from: https: //www.ncbi.nlm.nih.gov/books/NBK100895/.
25. Tang HL, Li Y, Hu YF et al. Effects of CYP2C19 loss-of-function variants on the eradication of H. pylori infection in patientstreated with proton pump inhibitor-based triple therapy regimens: a meta-analysis of randomized clinical trials. PLoS One 2013; 8 (4): e62162. doi: 10.1371/journal.pone.0062162.
26. Serrano D, Torrado S, Torrado-Santiago S et al. The influence of CYP2C19 genetic polymorphism on the pharmacokinetics/-pharmacodynamics of proton pump inhibitor-containing Helicobacter pylori treatments. Curr Drug Metab 2012; 13 (9): 1303–1312.
27. NCBI. dbSNP short genetic variations. Reference SNP (refSNP) Cluster Report: rs4244285. [online]. Available from: https: //www.ncbi.nlm.nih.gov/projects/SNP/snp_ref.cgi?rs=4244285.
28. Buzková H, Pechandová K, Danzig V et al. Lipid-lowering effect of fluvastatin in relation to cytochrome P450 2C9 variant alleles frequently distributed in the Czech population. Med Sci Monit 2012; 18 (8): CR512–CR517. doi: 10.12659/MSM.883272.
29. NCBI. dbSNP short genetic variations. Reference SNP (refSNP) Cluster Report: rs1224 8560. [online]. Available from: https: //www.ncbi.nlm.nih.gov/projects/SNP/snp_ref.cgi?rs= 12248560.
30. Lewis JP, Stephens SH, Horenstein RB et al. The CYP2C19*17 variant is not independently associated with clopidogrel response. J Thromb Haemost 2013; 11 (9): 1640–1646. doi: 10.1111/jth.12342.
31. Franciosi JP, Mougey EB, Williams A et al. Association between CYP2C19*17 alleles and pH probe testing outcomes in children with symptomatic gastroesophageal reflux. J Clin Pharmacol 2018; 58 (1): 89–96. doi: 10.1002/jcph.977.
32. Martínek J, Lukáš M. Inhibitory protonové pumpy – up to date. Gastroent Hepatol 2011; 65 (6): 331–342.
33. Furuta T, Sugimoto M, Shirai N et al. CYP2C19 pharmacogenomics associated with therapy of Helicobacter pylori infection and gastro-esophageal reflux diseases with a proton pump inhibitor. Pharmacogenomics 2007; 8 (9): 1199–1210. doi: 10.2217/14622416.8.9.1199.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2018 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Alveolární echinokokóza – vzácné onemocnění vyžadující multidisciplinární přístup
- Prevalencia a asociované faktory ovariálnych cýst u pacientiek s Crohnovou chorobou
- Porovnání účinnosti kolonické kapslové endoskopie a optické koloskopie u osob s pozitivním imunochemickým testem na okultní krvácení do stolice – multicentrická, prospektivní studie
- Experimentální enteroskopie s využitím kapsle s boční optikou
- Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů
- Mastocytární enterokolitida jako možná příčina chronického průjmového onemocnění
- Personalizovaná terapie pacientů s gastroezofageální refluxní chorobou – metodika stanovení genového profilu CYP2C19
- Efektivita a bezpečnost budesonidu MMX (Cortiment®) v dlouhodobé udržovací léčbě ulcerózní kolitidy
- Modulace signálních drah IL-12/IL-23 ustekinumabem tlumí poškozující zánět u pacientů s Crohnovou nemocí
- Klinický případ jaterního a pleuropulmonálního abscesu amébového původu u pacienta s chronickou hepatitidou B v Cotonou
- Hyponatremie v souvislosti s chorobami gastrointestinálního traktu
- 40th Czech and Slovak Endoscopic Days and 19th Endoscopic Day IKEM
- XLVI. májové hepatologické dny
-
Gastroenterologie a hepatologie nebude registrována v PubMed a co z toho plyne
Odpověď předsedovi České gastroenterologické společnosti - Zpráva o činnosti výboru ČGS ČLS JEP za období 2014–2018
- Výběr z mezinárodních časopisů
-
Správná odpověď na kvíz
Pneumatosis cystoides intestinalis (coli) - Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Metotrexát – znovu objevený lék pro Crohnovu nemoc
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hyponatremie v souvislosti s chorobami gastrointestinálního traktu
- Mastocytární enterokolitida jako možná příčina chronického průjmového onemocnění
- Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů
- Metotrexát – znovu objevený lék pro Crohnovu nemoc
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



