-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Alveolární echinokokóza – vzácné onemocnění vyžadující multidisciplinární přístup
Alveolar echinococcosis – a rare disease requiring a multidisciplinary approach
Alveolar echinoccocosis (AE) is a rare and potentially lethal zoonosis that primarily affects the liver and is caused by larvae of the tapeworm Echinococcus multilocularis, which occurs in the northern hemisphere. AE is an illness with tumor-like characteristics, such as infiltrative growth and metastatic potential. Diagnosis consists of imaging studies (ultrasonography, CT, and magnetic resonance) and serological tests. All patients are treated by long-term benzimidazoles therapy and if possible by radical surgery. In exceptional cases, a liver transplantation (LTx) can be performed. LTx is considered in patients with advanced, symptomatic and radically inoperable disease. Recurrence of AE has been linked with immunocompetence. The risk of recurrence is higher with post-transplant immunosuppressive treatment. Currently, non-surgical interventions, such as percutaneous drainage of bile ducts are preferred, which address most complications. The number of LTx due to AE is diminishing in Europe.
Key words:
Echinoccocosis – Echinococcus multilocularis – liver transplantation – benzimidazoles
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted: 19. 6. 2018
Accepted: 3. 7. 2018
Autoři: D. Erhartová 1; J. Froněk 2; F. Stejskal 3,4,5; H. Skopcová 6; D. Kautznerová 7; J. Špičák 1; P. Trunečka 1
Působiště autorů: Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 1; Klinika transplantační chirurgie, Transplantcentrum, IKEM, Praha 2; Klinika infekčních nemocí 2. LF UK a Nemocnice Na Bulovce, Praha 3; Infekční oddělení, Krajská nemocnice Liberec, a. s. 4; Ústav imunologie a mikrobiologie VFN v Praze a 1. LF UK 5; Pracoviště klinické a transplantační patologie, Transplantcentrum, IKEM, Praha 6; Pracoviště radiodiagnostiky a intervenční radiologie, Komplement, IKEM, Praha 7
Vyšlo v časopise: Gastroent Hepatol 2018; 72(4): 287-292
Kategorie: Klinická a experimentální gastroenterologie: původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amg2018287Souhrn
Alveolární echinokokóza (AE) je vzácná a potenciálně letální zoonóza způsobená larvami tasemnice Echinococcus multilocularis postihující primárně játra a vyskytující se na severní polokouli. Jedná se o onemocnění, které se pro svůj infiltrativní růst a schopnost zakládat vzdálená satelitní ložiska podobá pomalu rostoucímu zhoubnému nádoru. Diagnostika je založena na zobrazovacích metodách (UZ, CT, MR) a sérologickém vyšetření. Všichni pacienti s AE jsou dlouhodobě léčeni benzimidazoly, pokud je to možné, je indikován radikální resekční výkon a ve vybraných případech může být AE i indikací k transplantaci jater (LTx). LTx je zvažována u pacientů s pokročilým, symptomatickým a radikálně neresekabilním onemocněním. Rekurence onemocnění úzce souvisí s imunokompetencí jedince. Při potransplantační imunosupresní léčbě je proto riziko rekurence vyšší. V poslední době jsou upřednostňovány ostatní léčebné modality včetně nechirurgických intervenčních metod, které umožňují řešit většinu pozdních komplikací onemocnění. Počet LTx pro AE v Evropě spíše klesá.
Klíčová slova:
echinokokóza – Echinococcus multilocularis – transplantace jater – benzimidazoly
Úvod
Alveolární echinokokóza (AE) je vzácná zoonóza způsobená larvami tasemnice Echinococcus multilocularis postihující primárně játra. Jiný druh – Echinococcus granulosus – způsobuje cystickou echinokokózu, což je onemocnění, které se svou povahou i přístupem k léčbě od AE významně liší a není předmětem tohoto sdělení. Pro odlišný přístup k pacientům s těmito dvěma onemocněními je v klinické praxi klíčové odlišení obou diagnóz [1].
Epidemiologie
AE je parazitóza vyskytující se pouze na severní polokouli, mezi oblasti s endemickým výskytem patří západní Čína, Turecko, střední Asie, Rusko, severní oblasti Japonska, Aljaška a Kanada. Incidence se pohybuje mezi 0,03 a 1,2 na 100 000 obyvatel [2]. V Evropě v poslední době počet případů vzrůstá, s nejvyšší prevalencí v Pobaltí a ve východní Francii. V ČR bylo v období 1998–2016 diagnostikováno celkem 36 infikovaných pacientů [3].
Člověk je mezihostitelem a slepým článkem v životním cyklu echinokoka, který je svůj vývoj schopen dokončit pouze v tenkém střevě konečných hostitelů, kterými jsou masožravci (nejčastěji lišky a psi). Dle recentní studie se prevalence Echinococcus multilocularis u lišek v ČR pohybuje v rozmezí 14–62 % [4]. K nákaze konečných hostitelů dochází pozřením vnitřností infikovaných mezihostitelů (malí savci, především hlodavci), parazit se tak dostane do tenkého střeva, kde dokončí svůj životní cyklus a stane se dospělou tasemnicí. Ta produkuje vajíčka, která konečný hostitel vylučuje spolu se svým trusem. Pozřením vajíček se může nakazit mezihostitel, tedy i člověk, v jehož střevě se z vajíček uvolní larvy, které přestoupí střevní stěnu a portálním oběhem se dostávají do jater, kde začnou vytvářet larvocysty.
Klinický průběh
AE postihuje ve většině případů primárně jaterní parenchym a má charakter pomalu rostoucího tumoru – typický je invazivní růst do okolních struktur (zejména žlučových cest, cév, bránice) a dále schopnost zakládat vzdálená satelitní ložiska (nejčastěji v plicích a mozku). Neléčené onemocnění má velmi špatnou prognózu, do 10 let od manifestace symptomů umírá až 90 % pacientů [5]. Zvětšující se cysta může způsobit útlakem a prorůstáním do jaterních žil chronický Budd-Chiariho syndrom se všemi jeho důsledky. Další častou komplikací je infiltrace žlučových cest s rozvojem ikteru, sekundární biliární cirhózy či závažných rekurentních cholangitid. Ze vzdálených ložisek jsou nejobávanější mozkové metastázy, komplikace mohou pacientům působit i vzdálená ložiska v plicích či jiných orgánech. Vzácně může dojít k infiltraci podkoží, kůže i vzniku píštělí [6].
Péče o pacienty s AE je multidisciplinární. Diagnostika onemocnění je většinou v rámci vyšetřování nově zjištěného ložiskového procesu jater v rukou hepatologa a radiologa. Vždy je také konzultován chirurg, který se vyjádří k resekabilitě ložiska. Dlouhodobá dispenzarizace pacientů probíhá v infektologické ambulanci.
Diagnostika
AE je onemocnění, které probíhá dlouho latentně. Klinické symptomy se začnou projevovat až po několika letech od nákazy a jsou nespecifické. Patří mezi ně bolest v pravém epigastriu způsobená zvětšováním cyst, únava a ztráta hmotnosti. Při invazi cysty do žlučových cest s jejich následnou obstrukcí se může onemocnění primárně manifestovat ikterem.
Při vyšetřování těchto příznaků bývá na ultrazvuku břicha nalezeno objemné tumorózní ložisko velikosti až několika centimetrů různého charakteru. Dalším krokem v diferenciálně diagnostickém procesu je zobrazení jater pomocí CT nebo magnetické rezonance (MR), kde je ložisko většinou nehomogenní a po podání kontrastní látky se málo sytí (obr. 1). V řadě případů je AE náhodným nálezem při zobrazovacích vyšetřeních z jiné indikace u zcela asymptomatických pacientů.
Obr. 1. CT jater, koronární řez, venózní fáze – nesytící se ložisko v pravém laloku jater s hypodenzním centrem a drobnými hypodenzními okrsky v okolí, druhé ložisko patrné i v levém jaterním laloku. (Zdroj: MUDr. Dana Kautznerová).
Fig. 1. Liver CT scan, coronal view, venous phase – a non-enhancing mass in the right hepatic lobe with a hypodense centre and surrounding small hypodense particles; the second mass is evident in the left lobe of the liver. (Author: MUDr. Dana Kautznerová).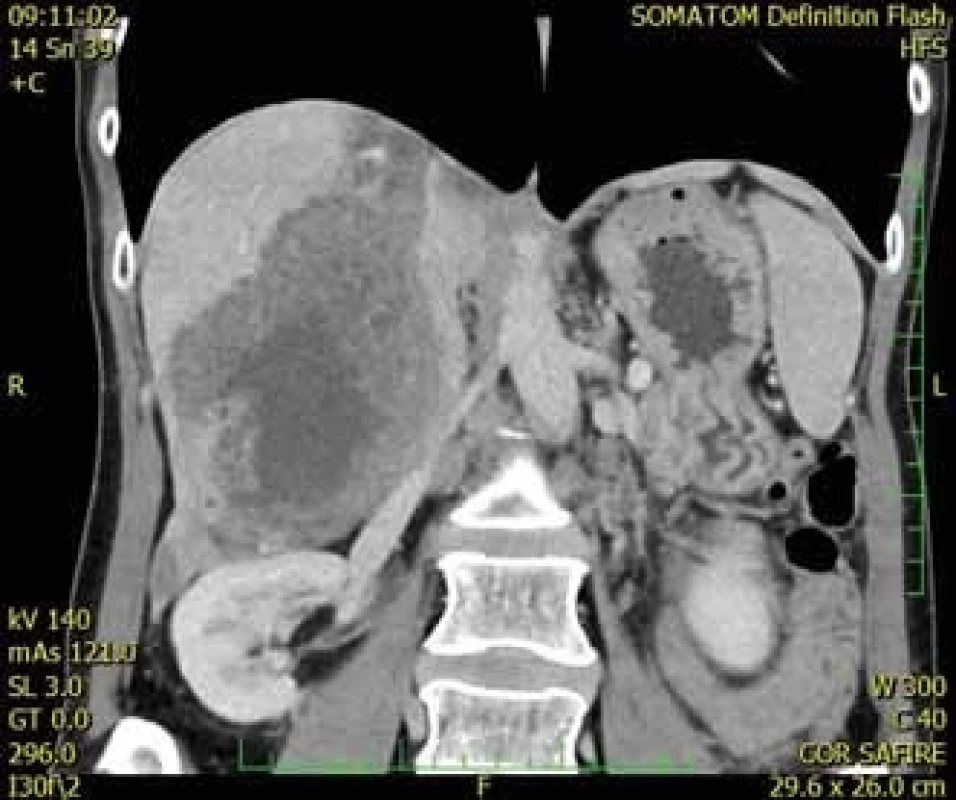
Při podezření na echinokokózu dle zobrazovacích metod se k verifikaci diagnózy provádí sérologické vyšetření, které má také nezastupitelnou roli ve sledování vývoje onemocnění a odpovědi na léčbu. U nás toto vyšetření provádí Národní referenční laboratoř pro tkáňové helmintózy VFN a 1. LF UK, Praha [7].
Pro riziko rozvoje alergické reakce a rozsevu parazita není cílená biopsie ložiska u pacientů s podezřením na AE doporučována. Pokud se ovšem v diferenciálně diagnostické rozvaze na základě zobrazovacích vyšetření na AE nemyslí a cílená biopsie se provede, jsou mikroskopicky patrné typické acelulární laminární membrány (obr. 2). Histologicky nelze zcela spolehlivě rozlišit, zda se jedná o cystickou nebo alveolární echinokokózu a v tomto případě je možné doplnit molekulárně-biologické vyšetření z nefixovaných struktur parazita. Sérologické vyšetření cystickou a alveolární echinokokózu spolehlivě neodliší, neboť mezi nimi existují zkřížené reakce.
Obr. 2. Angioinvaze nevitálních parazitárních struktur echinokoka do cévních struktur. Hvězdička ukazuje lumen cévy, šipky muskuloelastické složky cévní stěny destruované parazitem (barvení SREL, původní zvětšení 100×). (Zdroj: MUDr. Hana Skopcová).
Fig. 1. Angioinvasion of non-vital parasitic structures of echinococcus into vessels. The star shows the vessel lumen; arrows show musculoelastic tissue of the vascular wall infi ltrated by parasitic structures (SREL staining, original magnifi cation ×100). (Author: MUDr. Hana Skopcová).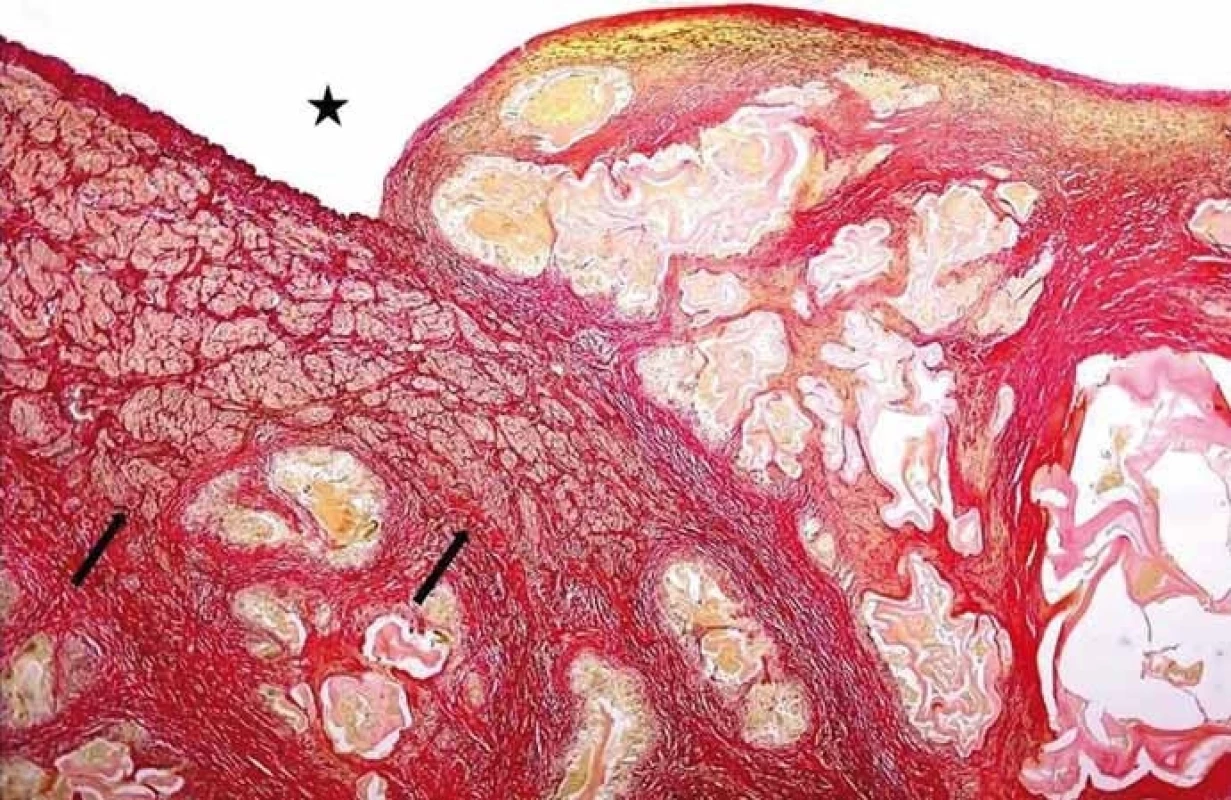
Při potvrzení diagnózy AE by v rámci stagingu onemocnění měla být doplněna buď celotělová pozitronová emisní tomografie (PET/CT) nebo CT mozku a hrudníku k vyloučení satelitních ložisek.
Klasifikace
Ke klasifikaci a stagingu se používá PNM klasifikace navržená Pracovní skupinou pro echinokokózy Světové zdravotnické organizace (World Health Organization-Informal Working Group on Echinococcosis). Hodnotí se rozsah samotné jaterní léze (P), postižení tkání v okolí jater (N) a vzdálené metastázy (M). Na základě této klasifikace jsou pacienti rozděleni do jednotlivých stadií dle pokročilosti onemocnění (tab. 1) [8].
Tab. 1. PNM klasifikace alveolární echinokokózy a staging dle WHO-IWGE. Tab. 1. PNM classifi cation of the alveolar echinococcosis and staging according to the WHO-IWGE. 
Tab. 2. Přežívání pacientů po transplantaci jater pro alveolární echinokokózu. Tab. 2. Survival of patients after liver transplantation for alveolar echinococcosis. 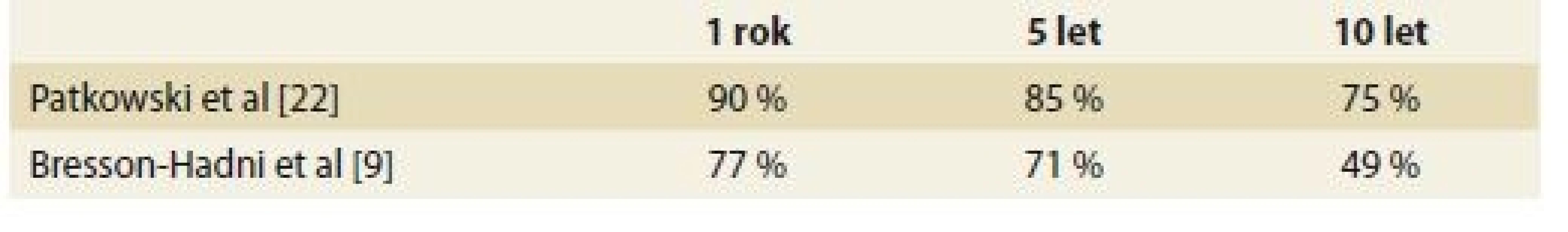
Léčba
Farmakoterapie
Dlouhodobá farmakoterapie je základem léčby všech pacientů s AE. Objev dvou benzimidazolů (BZM), albendazolu (ABZ) a mebendazolu, v 80. letech minulého století znamenal v léčbě AE významný pokrok. Jejich efekt je parazitostatický. Parazitolytické léky k léčbě AE v dnešní době nejsou k dispozici. Antihelmintiky jsou zajištěni všichni pacienti s diagnostikovanou AE bez ohledu na další léčebné modality. Preferován je ABZ, který je dlouhodobě tolerován většinou pacientů bez závažnějších nežádoucích účinků. Dočasná léčba (minimálně 2 roky) je indikována u pacientů po kurativní resekci. Pacienti, u kterých resekce není možná, užívají antihelmintika doživotně. Na podávání antihelmintik před chirurgickým výkonem nejsou jednoznačné názory, kromě pacientů indikovaných k transplantaci jater (LTx), u kterých by měla být předtransplantační léčba zahájena vždy, neboť stabilizuje onemocnění, brání jeho progresi během čekání na transplantaci a patrně i snižuje riziko rekurence po transplantaci [9].
Chirurgická léčba
U všech pacientů s AE se zvažuje radikální (R0) resekce postižené části jater. Vzhledem k pozdní diagnostice je ale možná pouze u 35 % pacientů [10]. Od paliativních (R2) resekcí se ustoupilo, neboť dle současných poznatků nejsou výsledky této léčby lepší než samotné dlouhodobé užívání antihelmintik. Navíc se jedná o chirurgicky komplikované zákroky, které jsou doprovázeny množstvím perioperačních a postoperačních komplikací snižujících kvalitu života pacientů [11].
Nechirurgické intervenční metody
V poslední době jsou u pacientů, u kterých není možná kurativní resekce, využívány k řešení komplikací nechirurgické intervenční metody. Stenózy žlučového stromu jsou řešeny perkutánní transhepatickou drenáží nebo endoskopickou retrográdní drenáží. Perkutánní transluminální angioplastika je účinná při stenózách cév. Dále se využívá perkutánní drenáž nekrotických infikovaných částí cyst a případně ligace jícnových varixů při rozvoji portální hypertenze [12].
Transplantace jater
Transplantace jater se zvažuje u pacientů s pokročilým symptomatickým onemocněním neřešitelným jinými léčebnými modalitami. V Evropě se počet transplantací pro AE snižuje. Důvodů je několik: obecný nedostatek orgánů, zlepšení výsledků přežívání pacientů léčených BMZ, rozvoj nechirurgických metod při řešení komplikací pokročilého onemocnění (zejména stenózy žlučovodů) a časnější diagnostika ve stadiích umožňujících radikální resekční výkon (screeningový program ve Francii) [13]. Klesá také počet LTx provedených pro komplikace paliativních resekcí pro pokročilou AE. V největším dosud publikovaném evropském souboru 47 pacientů po LTx pro AE bylo 80 % transplantací provedeno do roku 1991, v letech 2000–2002 pak byly provedeny pouze 2 transplantace [9]. Naopak v Číně a Turecku počet transplantací pro tuto indikaci stoupá. Jedná se zejména o transplantace od žijícího dárce [14–16]. Důvodem je pravděpodobně pozdní diagnóza.
Indikace k LTx
U AE neexistují jednoznačná indikační kritéria k LTx, přístup k pacientům musí být individuální a vycházet z konsenzu multidisciplinárního týmu (chirurg, hepatolog, infektolog, radiolog) s ohledem na přínos i rizika transplantační léčby. LTx by měla být zvažována u pacientů s biliárními komplikacemi charakteru recidivující těžké nebo abscedující cholangitidy nebo sekundární biliární cirhózy. U ostatních indikací (např. chronický Budd-Chiariho syndrom nebo objemné primárně neresekabilní ložisko) je vhodný rezervovanější přístup [17]. Tito pacienti by měli být zprvu léčeni BZM ve snaze o stabilizaci onemocnění a až při progresi nálezu na zavedené léčbě zvažováni k LTx.
Vhodná je také verifikace vitálních struktur alveolárních cyst s pomocí PET/CT, vývoje sérologických markerů nebo metody watch and wait, neboť mnoho lézí může být zastiženo již v nevitální fázi, kdy je riziko dalšího šíření nízké a tato postižení patrně mohou být dlouhodobě dobře kontrolována farmakoterapií [9].
Rizika transplantační léčby
Specifickým rizikem LTx pro AE je rekurence onemocnění nebo progrese extrahepatických ložisek (zejména mozkové metastázy) na potransplantačně zavedené imunosupresní léčbě, neboť rychlost progrese AE úzce souvisí s imunokompetencí hostitele.
Z tohoto důvodu by pacienti zvažovaní k LTx měli být předtransplantačně komplexně vyšetřeni s cílem vyloučit vzdálená satelitní ložiska (CT hrudníku a mozku). Mozkové metastázy jsou dle většiny evropských transplantačních center kontraindikací k LTx, v případě postižení jiných orgánů (plíce, slezina) se jednotlivá transplantační centra přístupem k pacientům liší [18]. Byly publikovány případy úspěšné resekce plicní metastázy před LTx s uspokojivými výsledky [19].
Pro snížení rizika rekurence onemocnění po LTx je nezbytné zajistit pacienty BZM předtransplantačně i co nejdříve po transplantaci, jakmile to stav dovolí, ideálně do 1 měsíce po transplantaci, kdy dojde k normalizaci jaterních testů. Potransplantačně by léčba BZM měla pokračovat minimálně 2 roky, pokud je pacient bez známek rekurence onemocnění (kontrolní CT hrudníku a mozku, monitorace anti-Eg IgG). V případě podezření na rekurenci onemocnění musí být pacient zajištěn BZM doživotně. Původní obavy z interakce mezi imunosupresivy a BZM se nepotvrdily [20,21].
Riziko rekurence ovlivňuje i intenzita potransplantační imunosupresivní léčby, která by měla být nejnižší možná, a měli bychom se vyvarovat použití antilymfocytárních protilátek. V již zmíněném souboru 47 pacientů transplantovaných pro AE všech 6 pacientů, kteří byli léčení antilymfocytárními protilátkami, vyvinulo rekurenci. Ze 14 pacientů léčených pulzy kortikoidů byla rekurence pozorována pouze u 4 [9].
Nelze pominout ani technickou náročnost samotné transplantace pro invazivní růst echinokokových cyst do okolních struktur. Transplantace je často komplikována nutností resekce bránice či cévních struktur s obtížnými rekonstrukcemi. Nezbytná je pečlivá preparace, při které nesmí dojít k ruptuře cysty pro riziko následného rozsevu po dutině břišní.
Follow-up pacientů po LTx
Na našem pracovišti jsou pacienti po transplantaci pro AE dispenzarizováni v potransplantační ambulanci. Management antiparazitární léčby a kontrola eventuální rekurence onemocnění je v rukou infektologa. Doporučuje se kontrolní CT mozku, hrudníku a břicha každý rok [9]. Přínosné může být i PET/CT. Ze sérologických markerů se jako nejspolehlivější k monitoraci rekurence jeví anti-Eg IgG, protilátka anti-Em2 využívaná u pacientů po radikálních resekcích se u transplantovaných neukázala být spolehlivým ukazatelem rekurence [9].
Výsledky
V souboru 47 transplantovaných pacientů pro AE v evropských transplantačních centrech do roku 2003 bylo 1-, 5-a 10leté přežití pacientů 77, 71 a 49 %. Bez rekurence přežívalo 5 let po LTx 58 % a po 10 letech 45 % pacientů [9]. Podobné přežívání je udáváno i Evropským registrem transplantací jater (tab. 2), jedná se o souhrnné přežívání pro parazitózy, nicméně se domníváme, že velké procento zaujímá AE. Výsledky jsou tak o něco lepší než po LTx pro maligní nádory, nicméně horší než celkové průměrné přežívání po LTx.
Podstatně lepší výsledky LTx pro AE byly recentně publikovány polskými autory. Z 22 pacientů transplantovaných v letech 1989–2014 pro AE zemřeli 2 v prvním roce po transplantaci, ale žádné z úmrtí nesouviselo s rekurencí AE. Roční přežití bylo 90 %, 5leté 85 % a 10leté 75 % [22]. Lepší výsledky jsou dány striktnějšími kritérii výběru pacientů k LTx a také řádnou administrací BZM pacientům před a po LTx.
Zkušenosti Transplantcentra IKEM
V IKEM byla v letech 1995–2017 LTx pro AE provedena u 2 pacientek.
U první 32leté pacientky, mírně progredovala velikost echinokokové cysty i přes roční chemoterapii ABZ. Vzhledem k intimnímu vztahu k bifurkaci portální žíly (obr. 3) byl resekční výkon považován za rizikový. Po vyloučení diseminace onemocnění byla indikována LTx, která proběhla nekomplikovaně. Po 3 letech byla u této pacientky ukončena chemoterapie ABZ. Nyní je 4 roky po transplantaci v klinicky dobrém stavu, bez známek recidivy základního onemocnění.
Obr. 3. CT jater, příčný řez, venózní fáze – zobrazuje se centrálně uložené nesytící se hypodenzní neostře ohraničené ložisko (segment IV) s drobnými hypodenzními okrsky v okolí. (Zdroj: MUDr. Dana Kautznerová).
Fig. 3. Liver CT scan, transverse view, venous phase – it shows a centrally placed non-enhancing hypodense mass surrounding small hypodense particles. (Author: MUDr. Dana Kautznerová).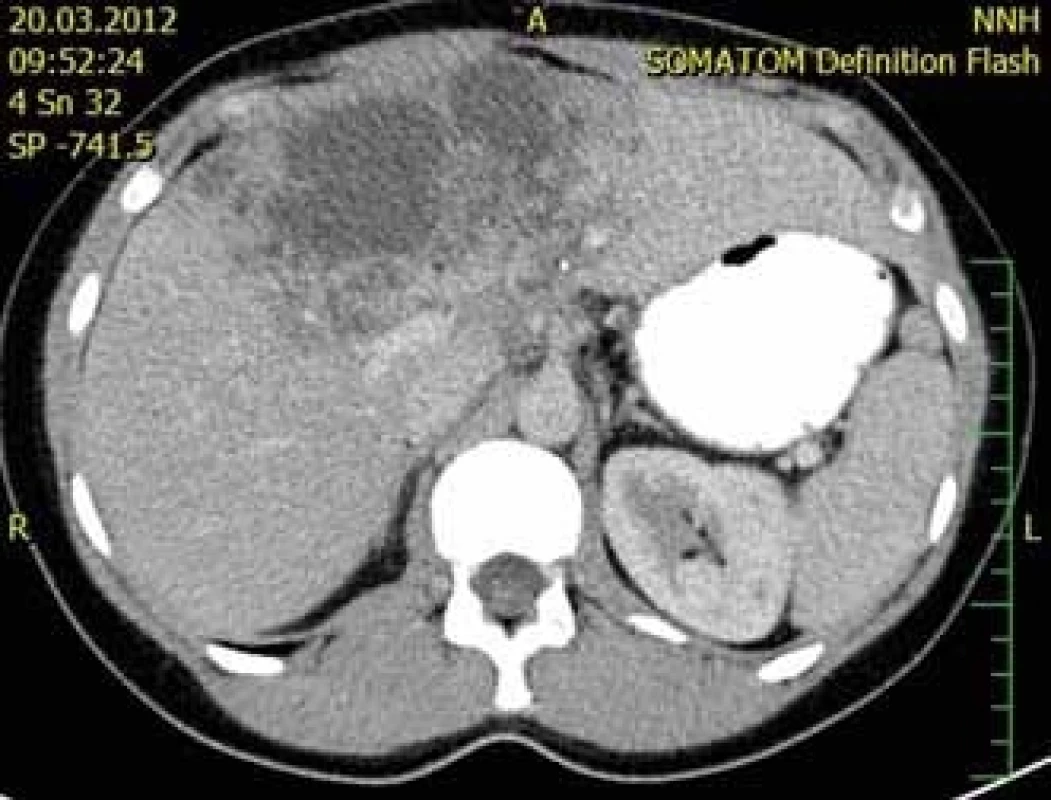
Druhá 52letá pacientka byla k LTx indikována pro rozsáhlé postižení obou laloků AE (obr. 1). Transplantační léčba byla zvažována bezprostředně po zahájení léčby ABZ. Vyšetření neprokázala generalizaci, při LTx bylo nalezeno prorůstání cysty do hlavy pankreatu a dále do retrohepatické dolní duté žíly s nutností její resekce. V explantátu byla zastižena nevitální echinokoková cysta v pravém jaterní laloku (13 × 10 × 8 mm) a druhá v levém laloku (11 × 9 × 7 cm), s propagací do stěny dolní duté žíly, větších větví portální vény, přes vazivovou kapsulu jater a dále se šířením do 5 z 9 vyšetřených lymfatických uzlin (obr. 2 a 4). Nevitální parazitární cysty byly nalezeny také v hilu jater. Potransplantační průběh byl nekomplikovaný, při dimisi 2 týdny po LTx byla pacientka zajištěna ABZ. Nyní je půl roku po LTx v ambulantní péči v uspokojivém stavu bez známek rekurence onemocnění.
Obr. 4. Perineurální šíření echinokoka. Hvězdička v nervu, šipky ukazují na struktury echinokoka (barvení hematoxylin-eozinem, původní zvětšení 100×). (Zdroj: MUDr. Hana Skopcová).
Fig. 4. Perineural spread of echinococcus. The star is in the nerve; arrows show the echinococcal structures (hematoxylin-eosin staining, original magnifi cation ×100). (Author: MUDr. Hana Skopcová).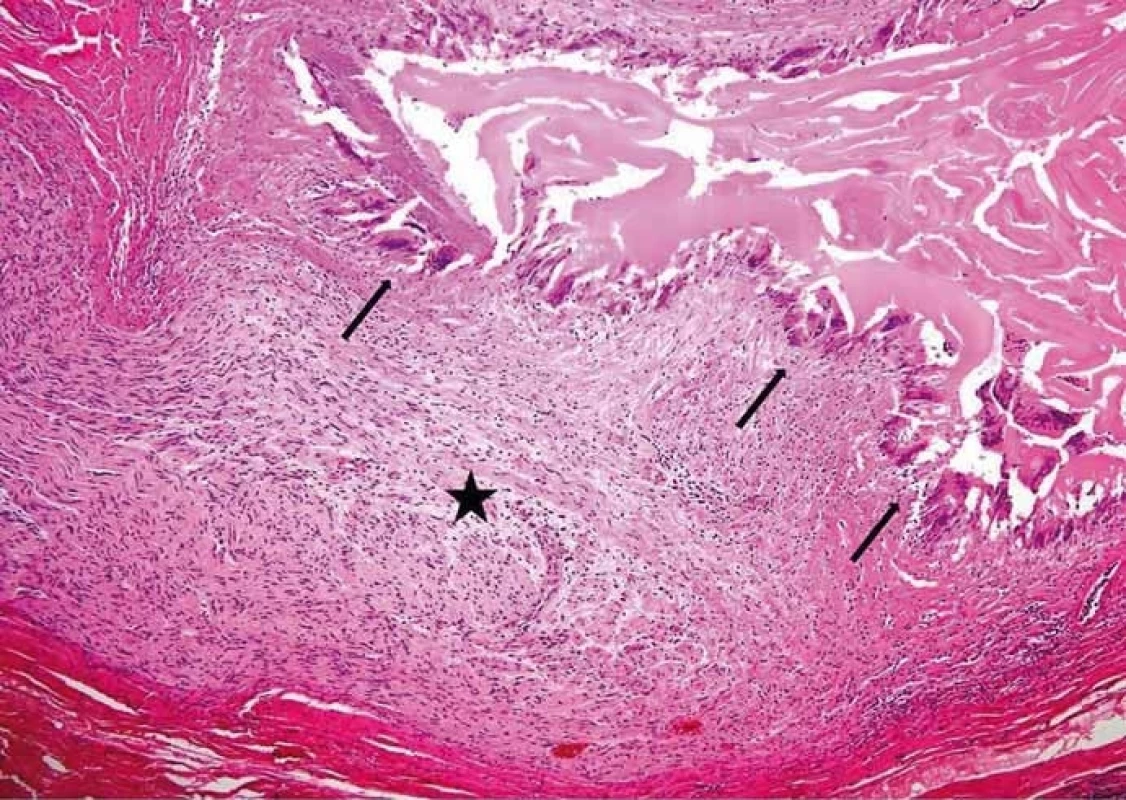
Autotransplantace
Recentně publikovaná čínská práce popisuje jako možnost léčby AE ex-vivo resekci následovanou autotransplantací jater. Pacienti jsou ušetřeni imunosupresní léčby, nicméně za cenu chirurgicky velmi obtížného zákroku [23].
Závěr
Na AE je třeba pamatovat v diferenciální diagnostice ložiskových jaterních procesů. Podezření potvrdí pozitivní sérologické vyšetření. Léčba je založena na dlouhodobém užívání antihelmintik, preferenčně ABZ, a pokud je to možné, tak i na radikálním resekčním výkonu. LTx je volbou léčby u pacientů s velmi pokročilou a radikálně neresekabilní AE. V sou?asnosti se palčasnosti se paliativní resekční výkony pro AE neprovádějí, jaterní komplikace je možné řešit nechirurgickou intervencí. Vzhledem k riziku rekurence je třeba, i přes radikální léčbu, pacienty s AE dlouhodobě dispenzarizovat.
V IKEM je AE raritní indikací k LTx, z více než 1600 transplantací byly pouze 2 indikovány pro AE, v obou případech byla LTx provedena pro nemožnost radikální resekce. Obě pacientky jsou v klinicky uspokojivém stavu a nejeví známky rekurence základního onemocnění.
AE, stejně jako všechna vzácná onemocnění, postrádá ustálený léčebný postup založený na zkušenostech s početnými soubory pacientů. O to podstatnější je optimální využití zkušeností multidisciplinárního týmu (hepatolog, chirurg, infektolog, radiolog a patolog) při tvorbě individualizovaného léčebného postupu u nemocných s tímto závažným, většinou pozdně diagnostikovaným a stále potenciálně letálním onemocněním.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Doručeno: 19. 6. 2018
Přijato: 3. 7. 2018
MUDr. Denisa Erhartová
Klinika hepatogastroenterologie Transplantcentrum, IKEM
Vídeňská 1958/ 9 140 21 Praha
Zdroje
1. Stojkovic M, Mickan C, Weber TF et al. Pitfalls in diagnosis and treatment of alveolar echinococcosis: a sentinel case series. BMJ Open Gastroenterol 2015; 2 (1): e000036. doi: 10.1136/bmjgast-2015-000036.
2. Brunetti E, Kern P, Vuitton DA et al. Expert consensus for the diagnosis and treatment of cystic and alveolar echinococcosis in humans. Acta Trop 2010; 114 (1): 1–16. doi: 10.1016/j.actatropica.2009.11.001.
3. Deplazes P, Rinaldi L, Alvarez Rojas CA et al. Global Distribution of Alveolar and Cystic Echinococcosis. Adv Parasitol 2017; 95 : 315–493. doi: 10.1016/bs.apar.2016.11.001.
4. Kolářová L, Matějů J, Hozáková L et al. Humánní alveolární echinokokokóza a přehled výskytu tasemnice Echinococcus multilocularis u zvířat v České republice. Epidemiol Mikrobiol Imunol 2017; 66 (4): 163–172.
5. Torgerson PR, Schweiger A, Deplazes P et al. Alveolar echinococcosis: from a deadly disease to a well-controlled infection. Relative survival and economic analsysis in Switzerland over last 35 years. J Hepatol 2008; 49 (1): 72–77. doi: 10.1016/j.jhep.2008.03.023.
6. Akbulut S. Parietal complication of the hydatid disease: Comprehensive literature review. Medicine 2018; 97 (21): e10671. doi: 10.1097/ MD.0000000000010671.
7. Kolářová L. Laboratorní diagnostika tkáňových helmintóz. [online]. Available from: http: //uim.lf1.cuni.cz/file/5790/raabe-3el - cm-e3.pdf.
8. Kern P, Wen H, Sato N et al. WHO classification of alveolar echinococcosis: principles and application. Parasitol Int 2006; 55 (Suppl): 283–287. doi: 10.1016/j.parint.2005.11.041.
9. Bresson-Hadni S, Koch S, Miguet JP et al. Indications and results of liver transplantation for Echinococcus alveolar infection: an overview. Langenbecks Arch Surg 2003; 388 (4): 231–238. doi: 10.1007/s00423-003-0394-2.
10. Bresson-Hadni S, Vuitton DA, Bartholomot B et al. A twenty-year history of alveolar echinococcosis: analysis of a series of 117 patients from eastern France. Eur J Gastroenterol Hepatol 2000; 12 (3): 327–336.
11. Mihmanli M, Idiz UO, Kaya C et al. Current status of diagnosis and treatment of hepatic echinococcosis. World J Hepatol 2016; 8 (28): 1169–1181. doi: 10.4254/wjh.v8.i28.1169.
12. Vuitton DA, Azizi A, Richou C et al. Current interventional strategy for the treatment of hepatic alveolar echinococcosis. Expert Rev Anti Infect Ther 2016; 14 (12): 1179–1194. doi: 10.1080/14787210.2016.1240030.
13. Bresson-Hadni S, Laplante JJ, Lenys D et al. Seroepidemiologic screening of Echinococcus multilocularis infection in Europe area endemic for alveolar echinococcosis. Am J Trop Med Hyg 1994; 51 (6): 837–846.
14. Ozdemir F, Ince V, Barut B et al. Living donor liver transplantation for Echinococcus Alveolaris: single-center experience. Liver Transpl 2015; 21 (8): 1091–1095. doi: 10.1002/lt.24 170.
15. Moray G, Shahbazov R, Sevmis S et al. Liver transplantation in management of alveolar echinococcosis: two case reports. Transplant Proc 2009; 41 (7): 2936–2938. doi: 10.1016/j.transproceed.2009.07.022.
16. Aydinli B, Ozturk G, Arslan S et al. Liver transplantation for alveolar echinococcosis in an endemic region. Liver Transpl 2015; 21 (8): 1096–1102. doi: 10.1002/lt.24195.
17. Hand J, Huprikar S. Liver transplantation for alveolar echinococcosis: Acceptable when necessary but is it preventable? Liver Transpl 2015; 21 (8): 1013–1015. doi: 10.1002/lt.24 197.
18. Bresson-Hadni S, Blagosklonov O, Knapp J et al. Should possible recurrence of disease contraindicate liver transplantation in patients with end-stage alveolar echinococcosis? A 20-year follow-up study. Liver Transpl 2011; 17 (7): 855–865. doi: 10.1002/lt.22299.
19. Pang C, Chu YK. Recurrence of liver transplantation combined with lung and diaphragm resection for alveolar echinococcosis: a case report. Transplant Proc 2015; 47 (7): 2278–2281. doi: 10.1016/j.transproceed.2015.06.013.
20. Koch S, Bresson-Hadni S, Miguet JP et al. Experience of liver transplantation for incurable alveolar echinococcosis: a 45-case European collaborative report. Transplantation 2003; 75 (6): 856–863. doi: 10.1097/01.TP.0000054230.63568.79.
21. Bresson-Hadni S, Koch S, Beurton I et al. Primary disease recurrence after liver transplantation for alveolar echinococcosis: long-term evaluation in 15 patients. Hepatology 1999; 30 (4): 857–864. doi: 10.1002/hep.510300426.
22. Patkowski W, Kotulski M, Remiszewski P et al. Alveococcosis of the liver – strategy of surgical treatment with special focus on liver transplantation. Transpl Infect Dis 2016; 18 (5): 661–666. doi: 10.1111/tid.12574.
23. Yang X, Qiu Y, Huang B et al. Novel techniques and preliminary results of ex vivo liver resection and autotransplantation for end-stage hepatic alveolar echinococcosis: A study of 31 cases. Am J Transplant 2018; 18 (7): 1668–1679. doi: 10.1111/ajt.14621
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2018 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Alveolární echinokokóza – vzácné onemocnění vyžadující multidisciplinární přístup
- Prevalencia a asociované faktory ovariálnych cýst u pacientiek s Crohnovou chorobou
- Porovnání účinnosti kolonické kapslové endoskopie a optické koloskopie u osob s pozitivním imunochemickým testem na okultní krvácení do stolice – multicentrická, prospektivní studie
- Experimentální enteroskopie s využitím kapsle s boční optikou
- Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů
- Mastocytární enterokolitida jako možná příčina chronického průjmového onemocnění
- Personalizovaná terapie pacientů s gastroezofageální refluxní chorobou – metodika stanovení genového profilu CYP2C19
- Efektivita a bezpečnost budesonidu MMX (Cortiment®) v dlouhodobé udržovací léčbě ulcerózní kolitidy
- Modulace signálních drah IL-12/IL-23 ustekinumabem tlumí poškozující zánět u pacientů s Crohnovou nemocí
- Klinický případ jaterního a pleuropulmonálního abscesu amébového původu u pacienta s chronickou hepatitidou B v Cotonou
- Hyponatremie v souvislosti s chorobami gastrointestinálního traktu
- 40th Czech and Slovak Endoscopic Days and 19th Endoscopic Day IKEM
- XLVI. májové hepatologické dny
-
Gastroenterologie a hepatologie nebude registrována v PubMed a co z toho plyne
Odpověď předsedovi České gastroenterologické společnosti - Zpráva o činnosti výboru ČGS ČLS JEP za období 2014–2018
- Výběr z mezinárodních časopisů
-
Správná odpověď na kvíz
Pneumatosis cystoides intestinalis (coli) - Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Metotrexát – znovu objevený lék pro Crohnovu nemoc
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hyponatremie v souvislosti s chorobami gastrointestinálního traktu
- Mastocytární enterokolitida jako možná příčina chronického průjmového onemocnění
- Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů
- Metotrexát – znovu objevený lék pro Crohnovu nemoc
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



