-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba spánkové apnoe malých dětí dvojúrovňovým přetlakem v dýchacích cestách
The treatment of sleep apnea in young children using bilevel positive airway pressure
Sleep apnea is prevailingly caused by an obstruction in the upper respiratory tract (URT); less often it is linked with a central respiratory control disorder. The factors contributing to the development of sleep apnea are adenoid vegetation and tonsillar hypertrophy combined with slight deviations in the structure and functioning of the URT. All diseases causing anatomic or functional changes in the URT (craniofacial malformations, achondroplasias, gastroesophageal reflux, Down syndrome, poliomyelitis, nerve-muscle diseases) also involve the risk of sleep apnea. The treatment of first choice for sleep apnea in child age is adenotonsilectomy. Treatment with constant positive airway pressure (CPAP) or bilevel positive airway pressure (BiPAP) in children is reserved for states in which adenotonsilectomy is not indicated for or ineffective in the treatment of obstructive sleep apnea (OSA), and for central apnea. We include case studies of 3 child patients aged between 1,5 to 5 years successfully treated by BiPAP. We point out the necessity for early diagnosing and treatment of sleep apnea in risk patients and the good compliance with BiPAP treatment in infant and pre-school age.
Key words:
obstructive sleep apnoea – central sleep apnea – child age – constant positive airway pressure – bilevel positive airway pressure
Autori: I. Příhodová 1; K. Šonka 1; M. Pretl 1; P. Klement 2; M. Jakoubková 1; D. Kemlink 1; P. Jiroutek 1; S. Nevšímalová 1
Pôsobisko autorov: Neurologická klinika VFN a 1. LF UK, Praha 1; Klinika dětského a dorostového lékařství VFN a 1. LF UK, Praha 2
Vyšlo v časopise: Cesk Slov Neurol N 2007; 70/103(4): 429-434
Kategória: Kazuistika
Súhrn
Spánková apnoe vzniká převážně v důsledku obstrukce horních cest dýchacích (HCD), méně často je spojená s poruchou centrálního řízení respirace. Na vzniku obstrukční spánkové apnoe (OSA) u dětí se podílí především hypertrofie adenoidní vegetace a tonzil v kombinaci s lehkými odchylkami struktury a funkce HCD. Riziko rozvoje OSA představují všechna onemocnění, která vedou k anatomickým a funkčním změnám HCD (kraniofaciální malformace, achondroplazie, gastroezofageální reflux, Downův syndrom, dětská mozková obrna, nervosvalová onemocnění). Léčbou první volby OSA v dětském věku je adenotonzilektomie. Léčba trvalým pozitivním (CPAP) nebo dvojúrovňovým (BiPAP) přetlakem v dýchacích cestách je u dětí vyhrazena pro stavy, u nichž adenotonzilektomie není indikována nebo nevede k vymizení OSA, a pro centrální apnoe. Uvádíme kazuistiky 3 dětských pacientů ve věku od 1,5 do 5 let úspěšně léčených metodou BiPAP. Zdůrazňujeme nutnost včasné diagnostiky a léčby spánkové apnoe u rizikových pacientů a dobrou komplianci léčby BiPAP v batolecím a předškolním věku.
Klíčová slova:
obstrukční spánková apnoe – centrální spánková apnoe – dětský věk – trvalý pozitivní přetlak v dýchacích cestách – dvojúrovňový přetlak v dýchacích cestáchÚvod
Spánková apnoe vzniká převážně v důsledku obstrukce horních cest dýchacích (HCD), méně často je spojena s poruchou centrálního řízení respirace. Obstrukční spánková apnoe (OSA) se vyskytuje u 2-3 % dětí s maximem mezi 3.-8. rokem života. Nejčastější příčinou je hypertrofie adenoidní vegetace a tonzil. Předpokládá se, že na vzniku OSA se rovněž podílí lehké odchylky struktury a inervace HCD, částečně podmíněné geneticky [1]. Výrazné riziko pro rozvoj OSA představují všechna onemocnění spojená s anatomickými nebo funkčními změnami v oblasti HCD, zejména kraniofaciální malformace, genetické syndromy, dětská mozková obrna, nervosvalová onemocnění, obezita, gastroezofageální reflux. OSA vede k chronické intermitentní hypoxii a fragmentaci spánku. Důsledkem jsou poruchy kognitivních funkcí, chování a nálady, neprospívání, porucha růstu a kardiovaskulární komplikace [2]. Je pravděpodobné, že při delším trvání OSA v dětském věku mohou i po léčbě přetrvávat změny kognitivních a kardiovaskulárních funkcí (dysfunkce pravé komory srdeční, zvýšení diastolického tlaku) [3,4]. Léčbou první volby OSA dětského věku je odstranění adenoidní vegetace a tonzil. U malé části pacientů (převážně s jiným základním onemocněním), u nichž adenotonzilektomie není indikována nebo je neúspěšná, se používá léčba trvalým pozitivním přetlakem v dýchacích cestách (CPAP) či v komplikovanějších případech léčba dvojúrovňovým přetlakem (BiPAP). CPAP a BiPAP se používá také k léčbě centrální apnoe, která se objevuje vzácně, především při strukturálních kmenových lézích.
Kazuistiky
1. kazuistika: 1,5letý chlapec s dětskou mozkovou obrnou, sekundární epilepsií a gastroezofageálním refluxem
1,5letý chlapec s výraznými prenatálními a perinatálními rizikovými faktory měl v rámci základního onemocnění opožděný psychomotorický vývoj, v objektivním nálezu byla levostranná centrální hemiparéza. Od 4 měsíců věku se vyskytovaly četné epileptické záchvaty fokální se sekundární generalizací, změny antiepileptické medikace nevedly k dosažení kompenzace (trojkombinace primidon, topiramat, fenytoin). V EEG byly patrny epileptiformní výboje nad pravým zadním kvadrantem s maximem temporálně. MRI mozku zobrazila postmalatickou pseudocystu komunikující s pravou postranní komorou. Ve 14 měsících se po opakovaných respiračních infektech objevilo během spánku výrazné chrápání, stridor, zástavy dechu s následným zatahováním, lapáním po dechu, kašlem a nauzeou. Během dne byl chlapec unavený, špatně polykal, přestal přibývat na hmotnosti. Před vyšetřením na našem pracovišti byla pro noční dechové potíže provedena řada vyšetření. Noční EEG videomonitorace nesvědčila pro epileptický původ noční dyspnoe. ORL vyšetření nezjistilo významnou hypertrofii adenoidní vegetace ani tonzil, chirurgický výkon nebyl indikován, nález při laryngotracheobronchoskopii byl normální. Bylo provedeno kardiologické, alergologické a imunologické vyšetření (s nálezem hypogamaglobulinemie IgA). EMG vyšetření nesvědčilo pro nervosvalové onemocnění. Jícnová pH-metrie prokázala gastroezofageální reflux (GER), který byl léčen omeprazolem a domperidonem bez efektu na noční potíže. Stejně tak byla bez efektu terapie inhalačními kortikoidy, perorálními bronchodilatancii a antihistaminiky. Po 4 měsících trvání potíží byla na našem pracovišti provedena noční polysomnografie (PSG) s nálezem těžké spánkové apnoe smíšeného typu, s převahou obstrukčních apnoí. Pravděpodobný byl podíl GER na vzniku nočních dechových potížích vzhledem k zachycené epizodě hypopnoe s probuzením, kašlem, následnou dyspnoí, s výrazným poklesem saturace hemoglobinu kyslíkem na 82 % a s bradykardií.Výskyt epileptiformních grafoelementů během spánku (SW komplexy nad pravou hemisférou s tendencí ke generalizaci, ložisko temporálně vpravo v REM spánku) nesouvisel s respiračními událostmi. Pacient měl drobné odchylky kraniofaciálního skeletu, obecně spojené s rizikem rozvoje OSA - deviaci nosního septa, vysoké úzké tvrdé patro (obr. 1). Kontrolní ORL vyšetření zvažovalo adenotomii, tonzilektomie opět nebyla doporučena. Ortodontické vyšetření bylo bez odchylek. Vzhledem ke kombinované etiologii nočních dechových potíží (obstrukční i centrální apnoe, velmi pravděpodobný podíl GER), základnímu onemocnění a zvýšenému operačnímu riziku ORL výkonu (věk pod 3 roky, těžká spánková apnoe) jsme adenotonzilektomii neindikovali. Pro špatnou toleranci CPAP byla zahájena terapie BiPAP s tlaky 5/3 (obr. 2). Tuto léčbu pacient snášel velmi dobře, pouze přechodně se objevily v obličeji otlaky, které si vyžádaly změnu masky. Noční dechové potíže vymizely, došlo ke zlepšení celkového stavu - klesla nemocnost, ustoupily potíže s polykáním, pokročil výrazněji psychomotorický vývoj. Vymizel rovněž GER. Kompenzovalo se také epileptické onemocnění, současně však proběhla změna antiepileptické terapie. Po 6 měsících léčby BiPAP byla provedena PSG s nálezem přetrvávajícího syndromu obstrukční spánkové apnoe. Doporučili jsme proto provedení adenotonzilektomie, která vzhledem k rizikovým faktorům proběhla s pooperačním monitorováním vitálních funkcí. Kontrolní PSG prokázala úpravu ventilačních parametrů ve spánku a pacient byl ponechán bez terapie.
Obr. 1. Drobné odchylky kraniofaciálního skeletu spojené s rizikem rozvoje OSA – deviace nosního septa, vysoké úzké tvrdé patro, 1. pacient. 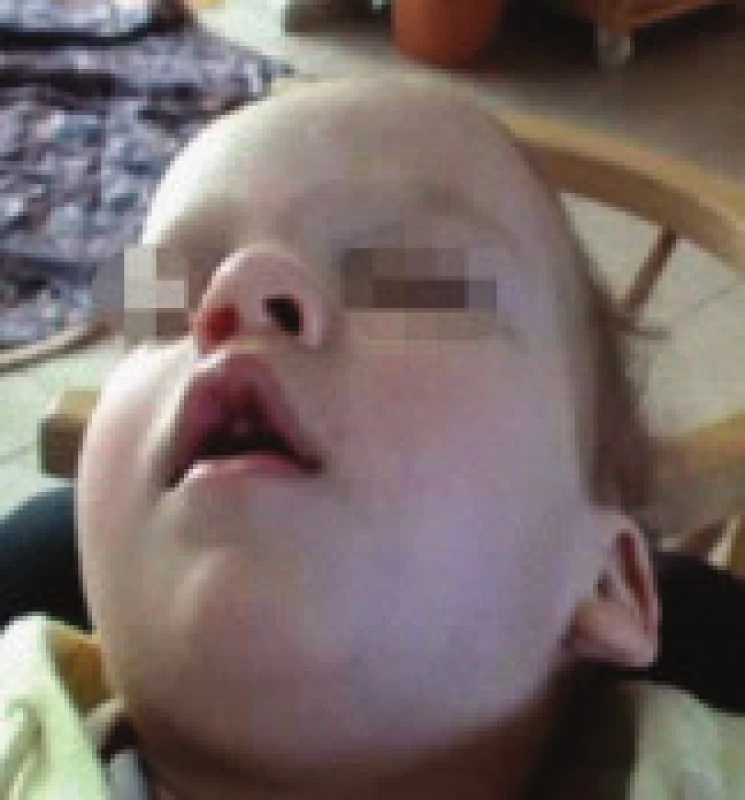
Obr. 2. Pacient č. 1 na terapii BiPAP během nočního spánku. 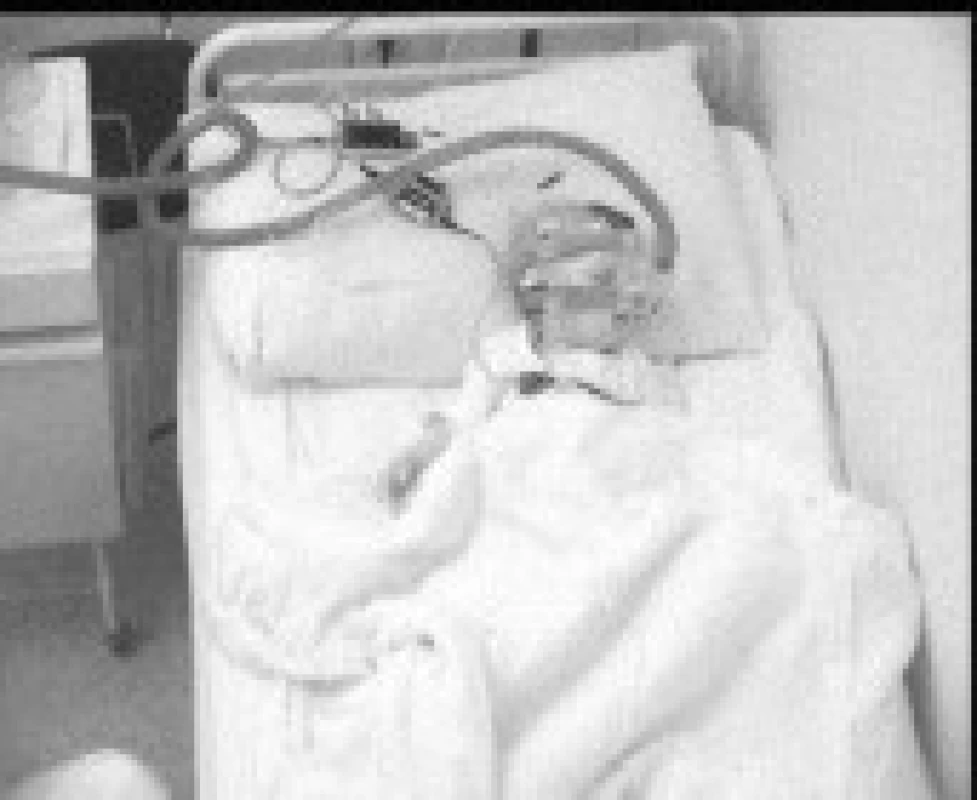
2. kazuistika: 3,5letá dívka s kraniofaciální abnormitou, psychomotorickou retardací a generalizovanou epilepsií
3,5letá dívka s kraniofaciální abnormitou, těžkou psychomotorickou retardací a generalizovanou hypotonií byla opakovaně podrobně vyšetřována neurologicky a geneticky, ale základní diagnózu se nepodařilo přesně stanovit (na základě MRI nálezu byla zvažována septooptická dysplazie, genetickým vyšetřením byla zjištěna aberace chromozomu 1). V objektivním nálezu byla psychomotorická retardace na úrovni II. trimenonu, centrální hypotonický syndrom, brachycefalie, hypoplazie střední obličejové části, asymetrie frontální oblasti (obr. 3). Neprospívání a obtížné polykání, které se během kojeneckého věku zhoršovalo, bylo v 1,5 roce řešeno perkutánní gastrostomií. Dívka měla časté respirační infekty a otitidy, proto byla v 1,5 roce provedena adenotomie. Podle anamnézy se poruchy nočního dýchání vyskytovaly již v batolecím věku, podrobnější vyšetření se však neuskutečnilo. Ve 3,5 letech byla hospitalizována pro opakované generalizované epileptické záchvaty, byla zahájena terapie primidonem. Během hospitalizace se rozvinul respirační infekt s poruchou dýchání ve spánku provázenou poklesy saturace hemoglobinu kyslíkem na 87 %, s nutností oxygenoterapie. PSG prokázala OSA těžkého stupně, s převažujícími hypopnoemi a s významnými desaturacemi (až k 60 %), obr. 4. Je pravděpodobné, že v důsledku akutního infektu došlo k akcentaci chronické ventilační poruchy ve spánku při kraniofaciální dysmorfii a hypotonickém syndromu. Na našem pracovišti byla po provedení PSG zahájena léčba BiPAP s dobrým efektem a tolerancí při tlacích 6/3. Jako další léčebný postup jsme doporučili po konzultaci s ORL tonzilektomii (i při střední velikosti tonzil) a změnu antiepileptické terapie z primidonu na valproát. Dívka zůstala v péči odesílajícího dětského lékaře a na kontrolní vyšetření po tonzilektomii se nedostavila.
Obr. 3. Kraniofaciální abnormita u 2. pacientky – brachycefalie, hypoplazie střední obličejové části, asymetrie frontální oblasti, malá dolní čelist. 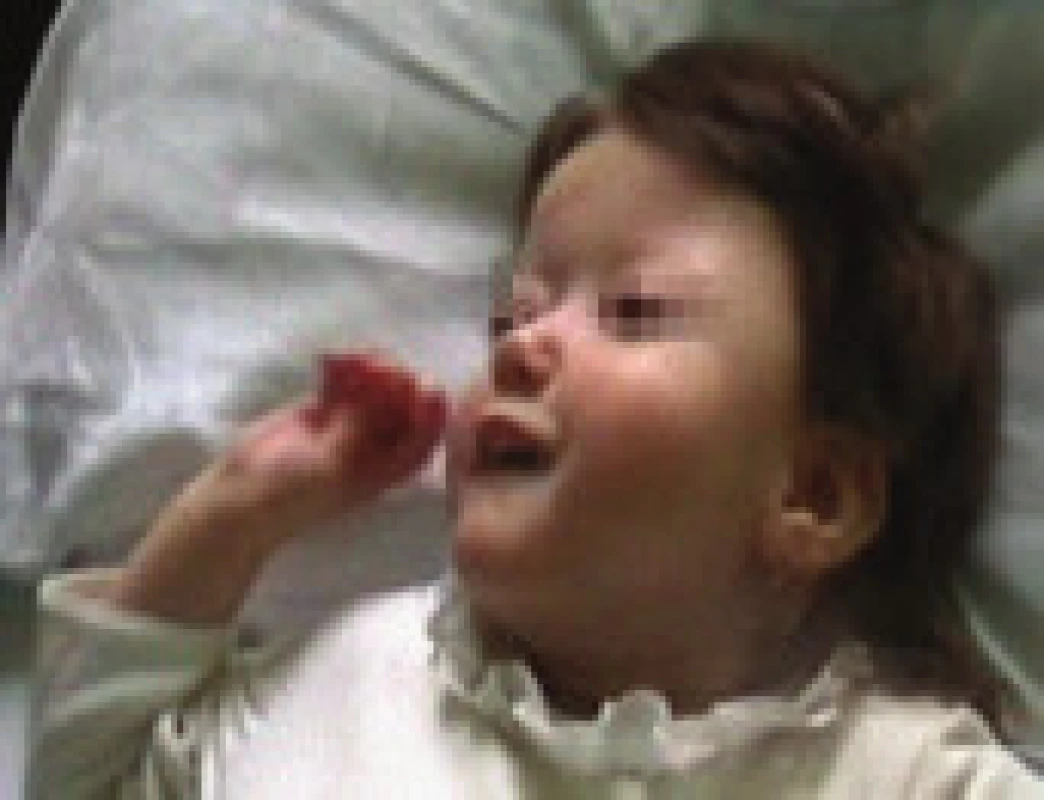
Obr. 4. Polysomnografický záznam (2minutový úsek), pacientka č. 2. Obstrukční apnoe v NREM 2 spánku spojené s poklesy saturace hemoglobinu kyslíkem (označeno šipkami). 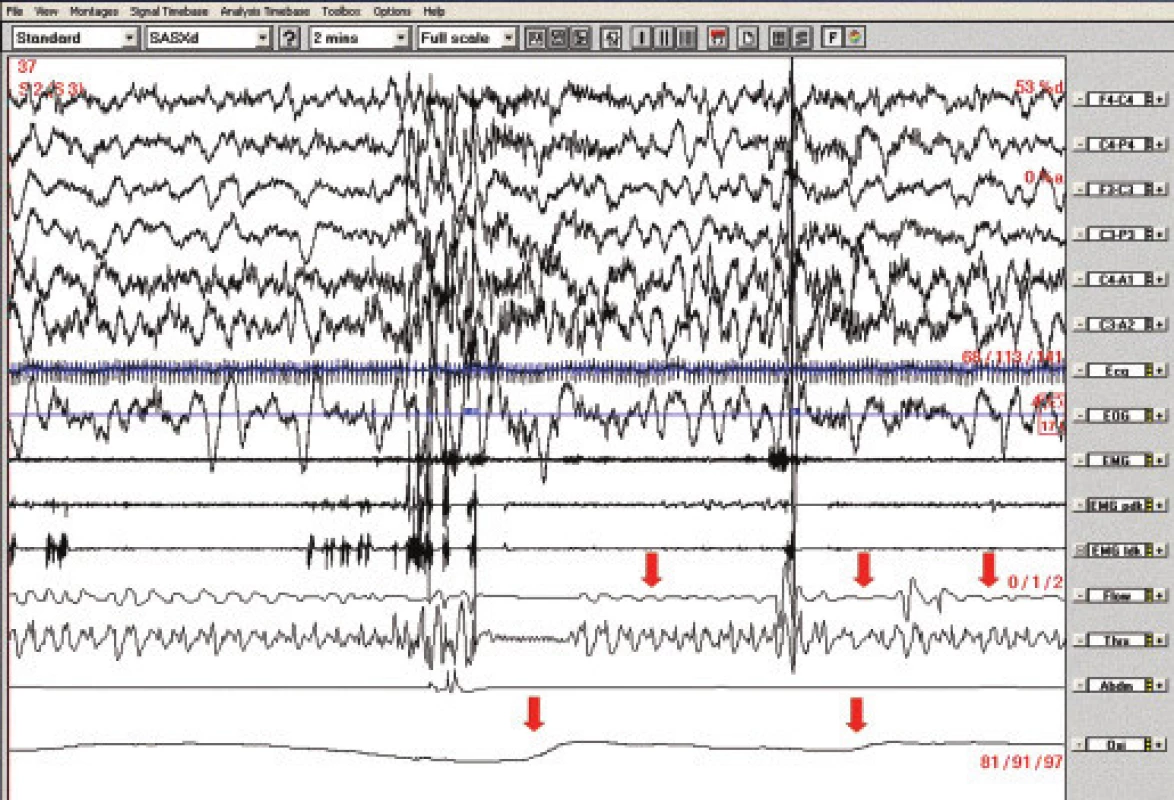
EOG – elektrookulogram, EMG – elektromyografie svalů brady, EMG pdk, ldk – elektromyografie svalů bérce, flow – proud vzduchu před nosem a ústy, Thr – dýchací pohyby hrudníku, Abd – dýchací pohyby břicha, Oxi – transkutánní oxymetrie 3. kazuistika: 5letá dívka s těžkým gastroezofageálním refluxem a generalizovanou epilepsií
5letá dívka měla negativní rodinnou, prenatální a perinatální anamnézu a normální psychomotorický vývoj. V kojeneckém věku byl zjištěn významný GER a brachyezofagus. V 9 měsících a 1,5 roce byla opakovaně provedena fundoplikace, přetrvávala paraezofageální hiátová hernie, trvale byla léčena omeprazolem. Dále byla vyšetřována pro chronickou zácpu nejasné etiologie (morbus Hirschprung nebyl neprokázán), dlouhodobě užívala laxancia. Od 3,5 let věku se objevily opakované generalizované epileptické záchvaty. Terapie valproátem nevedla ke kompenzaci, záchvaty měla až 10krát měsíčně, včetně mitigovaných nočních záchvatů. Od 5 let se bez zřejmé provokující příčiny začaly vyskytovat noční zástavy dechu s promodráním a obtížnou probuditelností, s nutností intervence matky – při protrahovaném stavu bezdeší i s nutností resuscitace. Stavy byly při používání apnoe alarmu registrovány asi 1krát za 14 dní. K vyloučení epileptické etiologie byla provedena noční EEG videomonitorace bez nálezu epileptiformních grafoelementů. Při vyšetření na dětské chirurgické klinice byly zjištěny noční poklesy saturace hemoglobinu kyslíkem na 81 %. S normálními nálezy bylo provedeno biochemické vyšetření, hladiny hormonů štítné žlázy, krevní obraz, Astrup, spirometrie, imunologické, kardiologické, ORL vyšetření, CT a MRI mozku a metabolický screening. Při PSG byly patrny centrální apnoické pauzy v REM spánku provázené významnými desaturacemi (pod 80 %), obr. 5. V době apnoe nebyly v EEG patrny žádné epileptiformní grafoelementy. 24 hodinová pH-metrie prokázala těžký GER během dne a ve 2. polovině noci. Byla zahájena terapie BiPAP, která při tlacích 7/4 vedla k eliminaci apnoí a kterou dívka tolerovala velmi dobře. Tato léčba byla používána rok. Snížila se také frekvence výskytu epileptických záchvatů, ovšem při současné úpravě antiepileptické terapie. Vzhledem k těžkému GER byla v 6 letech provedena další fundoplikace, dívka přestala přístroj používat a asi 3 měsíce byla bez potíží, pak se zástavy dechu opět objevily. Kontrolní PSG i po operaci prokazovala spánkovou apnoi centrálního typu s vazbou na REM spánek a s poklesy saturace hemoglobinu kyslíkem na 90 %, proto v terapii BiPAP pacientka pokračuje. Příčinu apnoe se nepodařilo objasnit. Pro vazbu na REM spánek byly zvažovány také apnoické pauzy při oslabení bránice, ale EMG bránice bylo normální, a ani při operaci nebyla bránice hodnocena jako hypoplastická.
Obr. 5. Polysomnografický záznam (2minutový úsek), pacientka 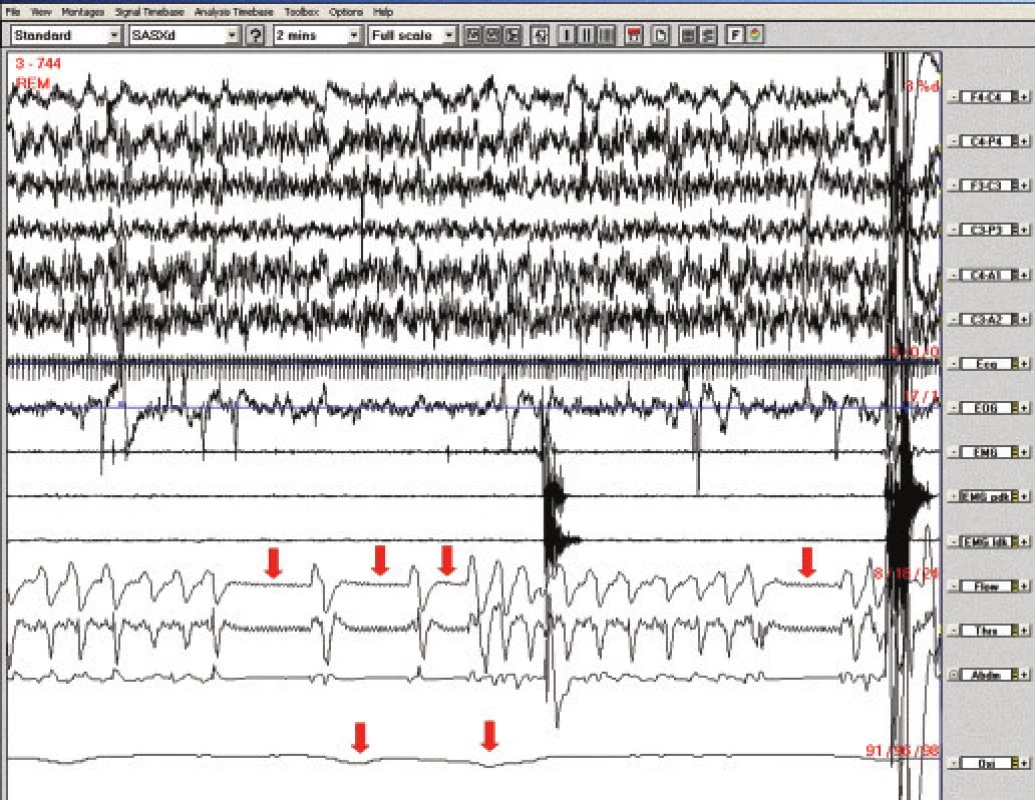
Diskuse
Uvádíme kazuistiky pacientů se základními onemocněními, která jsou spojena s rizikem rozvoje poruchy dýchání ve spánku. Častější výskyt OSA u dětské mozkové obrny je podmíněn poruchou svalového napětí a koordinace faryngeálních svalů. Na vzniku obstrukce HCD se u těchto pacientů může podílet také makroglosie, glosoptóza, adenotonzilární hypertrofie, omezená možnost měnit polohu během spánku a strukturální odchylky obličejového skeletu. Kraniofaciální malformace vedou ke vzniku OSA v důsledku anatomických a někdy také tonusových odchylek HCD. Chrápání a příznaky OSA zůstávají u těchto dětí velmi často opomíjeny a neléčeny [6]. Častým příznakem OSA u malých dětí je únava při jídle, neprospívání, zpoždění růstu a psychomotorického vývoje. U obou onemocnění může neléčená OSA přispívat k opoždění psychomotorického vývoje a ke kognitivním poruchám. Vzhledem k významným zdravotním následkům OSA doporučuje Americká pediatrická asociace u všech pacientů s rizikovým základním onemocněním vyšetření na specializovaném pracovišti s možností provedení PSG [7].
U 2 pacientů (kazuistika 1 a 3) jsme předpokládali podíl GER na vzniku apnoe. Porucha dýchání ve spánku může být jedinou manifestací GER. Až 40 % dětských pacientů s GER má respirační problémy zejména během spánku, kdy se reflux zhoršuje vlivem polohy vleže a pomalejší clearance žaludeční šťávy. Porucha dýchání ve spánku se může projevovat jako stridor, kašel, dušnost, obstrukční, vzácně i centrální apnoe [8]. Ke vzniku OSA vede reflexní laryngospazmus a edém mukózy faryngu. Vztah mezi poruchami dýchání ve spánku a GER je však vzájemný. OSA jsou provázeny zvýšením negativního intratorakálního tlaku, otevřením dolního jícnového svěrače a refluxem žaludeční šťávy. Léčba OSA v těchto případech vede k eliminaci GER [9]. Spolehlivou diagnózu sekundární OSA vlivem GER umožňuje jedině současná monitorace PSG a jícnové pH-metrie, která nebyla v době vyšetření na našem pracovišti dostupná.
U pacientky s centrální spánkovou apnoí (kazuistika 3) se příčinu nepodařilo objasnit. Nebyla prokázána strukturální kmenová léze ani souvislost s epileptickými záchvaty. Centrální apnoe se objevují také při syndromu centrální kongenitální hypoventilace, který je vrozenou poruchou centrálního řízení respirace. Výrazná porucha dýchání ve spánku začíná však již v novorozeneckém nebo časném kojeneckého věku a má maximum typicky v hlubokém spánku. Vzhledem k věku pacientky v době manifestace prvních příznaků a výrazné vazbě na REM spánek není tato diagnóza pravděpodobná. Vzácně se vyskytující idiopatická centrální apnoe má vazbu především na povrchní spánek. Apnoe s převahou v REM spánku jsou popisovány u GER [10]. Pro tuto etiologii však nesvědčí přetrvávání apnoe i po eliminaci GER.
Všichni 3 pacienti byly léčeni pro epilepsii, ve 2 případech nekompenzovanou. U pacientů s epilepsií je popisován častější výskyt poruch dýchání ve spánku [11,12,13]. K provokaci záchvatů vede fragmentace spánku a hypoxie spojená s apnoí. Některé práce prokazují, že spánková apnoe se může podílet na nedostatečné kompenzaci epilepsie a její léčba vede k snížení frekvence a intenzity záchvatů [13,14,15]. Vymizení záchvatů u 1. pacienta a snížení jejich frekvence u 3. pacientky po zahájení léčby BiPAP lze z tohoto hlediska obtížně hodnotit, protože současně proběhla úprava antiepileptické terapie. Ke vzniku OSA mohou přispívat antiepileptika, která svým sedativním efektem zvyšují práh probuzení a snižují svalový tonus HCD. Fenytoin zhoršuje adenotonzilární hypertrofii.
Základní léčbou OSA v dětském věku je adenotonzilektomie. Většina pracovišť upřednostňuje před parciálními výkony současné provedení adenotomie a oboustranné tonzilektomie. Doporučuje se rovněž odstranění tonzil, které nejsou jednoznačně hypertrofické. Také u pacientů s jiným základním onemocněním vede adenotonzilektomie k ústupu nebo zlepšení OSA. U pacientů s kraniofaciálními malformacemi, hypotonií, mladších než 3 roky, s těžkou OSA, neprospíváním či kardiálním postižením je vyšší riziko pooperačních komplikací (zejména respirační insuficience) [16].
Léčba CPAP se u dětí používá v případech, v nichž není adenotonzilektomie indikována (při malé velikosti tonzil, při výrazných rizicích operace, při jiném základním onemocnění) nebo je neúspěšná. U kraniofaciálních malformací léčba CPAP dovoluje odložení chirurgického výkonu do doby ukončení vývoje kraniofaciálního skeletu. U rizikových pacientů se CPAP používá také krátkodobě ke zmírnění tíže OSA před adenotonzilektomií či k prevenci respiračních potíží po výkonu [17,18]. Terapie CPAP vede k vymizení příznaků spojených s OSA včetně růstové retardace a kardiovaskulárních komplikací. Při současném výskytu OSA a GER dochází při této terapii k ústupu refluxu [9]. Je prokázáno, že CPAP je i u malých dětí bezpečnou, účinnou a dobře tolerovanou léčbou OSA i centrální apnoe, a to i při dlouhodobém používání [17,19, 20]. Nutná je titrace optimálního tlaku, při němž dojde k vymizení apnoí, prováděná za polysomnografické kontroly. V následné péči jsou třeba pravidelné kontroly výše tlaku a velikosti masky vzhledem k růstu obličejového skeletu. Komplikace léčby jsou obvykle nevelké (otlaky způsobená maskou, nazální kongesce, konjunktivitida, sinusitida a distenze žaludku). Úspěšnost CPAP v léčbě dětského OSA je popisována u 86-90 % pacientů. Kompliance závisí především na motivaci a spolupráci rodičů [17,21].
Alternativní, méně často používanou léčbou je BiPAP s měnlivým tlakem při inspiraci a exspiraci. Používá se při centrální apnoe, při léčbě OSA u nervosvalových onemocnění a při špatné toleranci CPAP [22]. Naše zkušenosti potvrzují dobrý terapeutický efekt a komplianci BiPAP v léčbě obstrukční i centrální apnoe u malých dětí, a to i při dlouhodobém používání.
Závěr
Zdravotní důsledky neléčené OSA na kognitivní a kardiovaskulární funkce vedou k nutnosti včasné diagnostiky a léčby poruchy dýchání ve spánku u všech dětí, zejména pak se základním onemocněním spojeným s rizikem výskytu OSA (kraniofaciální malformace, dětská mozková obrna, nervosvalová onemocnění, achondroplazie, gastroezofageální reflux a Downův syndrom). Příznaky OSA jsou u těchto onemocnění často přehlíženy, ačkoliv jejich léčba může výrazně ovlivnit kvalitu života nemocných. Při současném výskytu epilepsie a spánkové apnoe napomáhá léčba apnoe kompenzaci epileptického onemocnění. CPAP a BiPAP je bezpečným, efektivním a dobře tolerovaným způsobem terapie centrální apnoe a OSA i u malých dětí v případech, v nichž adenotonzilektomie není indikována nebo je neúspěšná, především při jiném základním onemocnění.
Přijato k recenzi: 31. 10. 2006
Přijato do tisku: 7. 2. 2007
Iva Příhodová
Neurologická klinika 1. LF UK a VFN
Kateřinská 30, 128 00 Praha 2
e-mail iprih@lf1.cuni.cz
Zdroje
1. O’Brien, LM, Gozal D. Consequences of obstructive sleep apnea syndrome. In: Sheldon SH, Ferber R, Kryger MH. Principles and practice of pediatric sleep medicine. Philadelphia: Elsevier Saunders 2005 : 211-222.
2. Brooks LJ. Obstructive sleep apnea syndrome in infants and children: clinical features and pathophysiology. In: Sheldon SH (ed). Principles and practice of pediatric sleep medicine. Philadelphia: Elsevier Saunders 2005 : 223-229.
3. Marcus CL, Greene MG, Carroll JL. Blood pressure in children with obstructive sleep apnea. Am J Respir Crit Care Med 1998; 157 : 1098-1103.
4. Tal A, Leiberman A, Margulis G, Sofer S. Ventricular dysfunction in children with obstructive sleep apnea: radionucleide assessment. Pediatr Pulmonol 1988; 4 : 139-143.
5. Kotagal S. Sleep in children with neurological disorders. In: Lee-Chiong. Sleep – a comprehensive handbook. New Jersey: Wiley-Liss 2006 : 567-573.
6. Wills LM, Shift JQ, Miller KT. Craniofacial syndromes and sleep disorders. In: Lee-Chiong. Sleep – a comprehensive handbook. New Jersey: Wiley-Liss; 2006 : 551-560.
7. American Academy of Pediatrics, Section on Pediatric Pulmonology, Subcommitttee on obstructive sleep apnea: clinical practice guideline: Diagnosis nad management of childhood obstructive sleep apnea syndrome. Pediatrics 2002; 109 : 704-712.
8. Carr MM, Brodsky L. Severe non - obstructive sleep disturbance as an initial presentation of gastroesophageal reflux disease. Int J Ped Otorhinolar 1999; 51 : 115-120.
9. Kerr P, Shoenut JP, Millar T, Buckle P, Kryger MH. Nasal CPAP reduces gastroesophageal reflux in obstructive sleep apnea syndrome. Chest 1992; 101 : 1539-1544.
10. Wasilewska J, Kaczmarski M. Sleep - related breathing disorders in small children with nocturnal acid gastroesophageal reflux. Rocz Akad Med Bialymst 2004; 49 : 98-102
11. Wyler AR, Weymuller EA. Epilepsy complicated by sleep apnea. Ann Neurol 1981; 9 : 403-404.
12. Devinski O, Ehrenberg B, Barthlen GM, Abramson HS, Luciano D. Epilepsy and sleep apnea syndrome. Neurology 1994; 44 : 2060-2064.
13. Mallow BA,Weatherwax KJ, Chervin RD. Identification and treatment of obstructive sleep apnea in adults and children with epilepsy:a prospective pilot study. Sleep Med 2003; 4 : 509-515.
14. Vaughn BV, D’Cruz OF, Brach R, Messenheimer JA. Improvement of epileptic seizure control with treatment of obstructive sleep apnea. Seizure 1996; 5 : 73-8.
15. Koh S, Ward SL, Lin M, Chen LS. Sleep apnea treatment improves seizure control in children with neurodevelopmental disorders. Ped Neurol 2000; 22 : 36-39
16. Marcus CL. Treatment of obstructive sleep apnea syndrome in children. In: Sheldon SH, Ferber R, Kryger MH (ed). Principles and practice of pediatric sleep medicine. Philadelphia: Elsevier Saunders; 2005 : 235-247.
17. Waters KA, Everest F, Bruderer JW, Sullivan CE. Obstructive sleep apnea: the use of nasal CPAP in 80 children. Am J Respir Crit Care Med 1995; 152 : 780-785.
18. Friedman O, Chidekel A, Lawless ST, Cook SP. Postoperative bilevel positive airway pressure ventilation after tonsillectomy and adenoidectomy in children - a preliminary report. Int J Pediatr Otorhinolaryngol 1999; 5 : 177-180.
19. Guilleminault C, Pelayo R, Clerck A. Home nasal continuous positive airway pressure in infants with sleep - disordered breathing. J Pediatr 1995; 127 : 905-912.
20. McNamara F, Sullivan CE. Obstructive sleep apnea in infants and its mangemenet with nasal continuous positive airway pressure. Chest 1999; 116 : 10-16.
21. McNamara F, Sullivan CE. Treatment of obstructive sleep apnea syndrome in children. Sleep 2000; 23(Suppl 4): S142-S146.
22. Witmans MB, Chen ML, Davidson Ward SL, Keens TG. Congenital syndromes affecting respiratory control during sleep. In: Lee-Chiong. Sleep – a comprehensive handbook. New Jersey: Wiley-Liss 2006 : 517-527.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2007 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Cervikální dystonie
- Repetitivní transkraniální magnetická stimulace a chronický subjektivní nonvibrační tinnitus
- Hladina D-dimerů u pacientů s akutní ischemickou cévní mozkovu příhodou
- Komentář k pilotní studii autorů D. Školoudíka et al. Změny kognitivních funkcí u pacientů s akutní cévní mozkovou příhodou testovaných pomocí Mini-Mental State Examination (MMSE) a Clock Drawing Test (CDT)
- Změny kognitivních funkcí u pacientů s akutní cévní mozkovou příhodou testovaných pomocí Mini-Mental State Examination a Clock Drawing Test
- Dekompresní kraniektomie jako léčba pro krysí model „maligního“ infarktu střední mozkové tepny
- Korelace mezi indexem IgG a oligoklonálními pásy při CSF vyšetření u pacientů s roztroušenou sklerózou
- Svalová biopsie u myotonické dystrofie v éře molekulární genetiky
- Chirurgická léčba hormonálně aktivních adenomů hypofýzy
- Analýza 1 775 pacientů léčených pro trigeminální neuralgii perkutánní radiofrekvenční rizotomií
- Ovlivnění exprese mRNA genu SMN2 inhibitory histonových deacetyláz a jejich vliv na fenotyp spinální svalové atrofie I. a II. typu
- Komentář ke článku Balcer LJ, Galetta SL, Calabresi PA et al. Natalizumab reduces visual loss in patiens with relapsing multiple sclerosis. Neurology 2007; 68: 1299–1304.
- Poliomyelitis-like syndrom na podkladě klíšťové meningoencefalitidy
- Satelitní anatomický worhshop Transtemporal approaches
- Trombóza esovitého splavu – současný pohled na diagnostiku a léčbu
- Léčba spánkové apnoe malých dětí dvojúrovňovým přetlakem v dýchacích cestách
- Polykací obtíže u difuzní idiopatické kostní hyperostózy
- Hennerici MG, Daffertshofer M, Caplan LR, Szabo K (Eds). Case Studies in Stroke. Common and Uncommon Presentations. Cambridge: Cambridge University Press 2007. 272 p. ISBN 0-521-67367-4.
- Lze bez pochybností interpretovat výsledky lumbálního infuzního testu?
- Zpráva z 8. sjezdu Evropské společnosti báze lební
-
Analýza dat v neurologii. IV.
Variabilita měření není vždy „chyba“ - Webové okénko
- XVIII. neuromuskulární sympozium
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Cervikální dystonie
- Hladina D-dimerů u pacientů s akutní ischemickou cévní mozkovu příhodou
- Trombóza esovitého splavu – současný pohled na diagnostiku a léčbu
- Repetitivní transkraniální magnetická stimulace a chronický subjektivní nonvibrační tinnitus
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



