-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ovlivnění exprese mRNA genu SMN2 inhibitory histonových deacetyláz a jejich vliv na fenotyp spinální svalové atrofie I. a II. typu
Regulation of mRNA expression of the SMN2 gene by histone deacetylase inhibitors and their influence on the phenotype of type I and II spinal muscular atrophy
Spinal muscular atrophy (SMA) type I and II (Werdnig-Hoffmann disease) is a serious autosomal recessive neuromuscular disease in children. The SMA causing gene – survival motor neuron gene (SMN) is duplicated, with telomeric copy (SMN1) and centromeric copy (SMN2). Histone deacetylase inhibitors phenylbutyrate (PBA) and valproic acid (VPA) can modify the pattern of SMN2 splicing in SMA patients towards increase of full-length SMN2 mRNA and amount of the SMN protein. The aim of our study was to correlate SMN2 gene copy numbers and changes in expression of full length mRNA with clinical outcomes in small groups of SMA type I and II patients treated with PBA (N = 6) or VPA (N = 11). The Hammersmith functional motor scale was evaluated at baseline and after 8 weeks of medication. 2 patients out of 4 in the PBA group and 5 patients out of 11 in the VPA group showed an increase of 3 or 4 points in the Hammersmith scale. 4 patients showed the increase of 4 points in the Hammersmith scale but only 2 had significantly increased levels of full-length SMN2 mRNA. The results obtained during therapy justify future interventional trials with histone deacetylase inhibitors.
Key words:
spinal muscular atrophy – SMN (survival motor neuron) gene – histone deacetylase inhibitors – phenylbutyrate – valproic acid – Hammersmith scale
Autoři: P. Vondráček 1; E. Zapletalová 2; H. Ošlejšková 1; L. Mlčáková 3; L. Fajkusová 2
Působiště autorů: Klinika dětské neurologie LF MU a FN Brno 1; Centrum molekulární biologie a genové terapie PřF MU a FN Brno 2; Neurologická klinika LF MU a FN Brno 3
Vyšlo v časopise: Cesk Slov Neurol N 2007; 70/103(4): 413-418
Kategorie: Krátké sdělení
Podpořeno granty IGA MZ ČR číslo 1A/8608-4 a MSM0021622415.
Souhrn
Spinální svalová atrofie (SMA) I. a II. typu (Werdnigova-Hoffmannova choroba) je závažné autozomálně recesivně dědičné nervosvalové onemocnění dětského věku. Kauzální gen SMN (survival motor neuron) je duplikován v telomerické (SMN1) a centromerické (SMN2) kopii. Inhibitory histonových deacetyláz fenylbutyrát (PBA) a kyselina valproová (VPA) mohou modifikovat sestřihový vzorec genu SMN2 u SMA pacientů zvýšením hladiny transkripčního produktu genu SMN2 o plné délce, a tím zvýšit i množství SMN proteinu. Cílem naší pilotní studie bylo otestovat vztah mezi počtem kopií genu SMN2, změnami exprese mRNA genu SMN2 a klinickými výsledky u malého souboru pacientů se SMA I. a II. typu na medikaci PBA (N = 6) nebo VPA (N = 11). Klinický efekt byl hodnocen pomocí Hammersmith funkční motorické škály před zahájením a po 8 týdnech medikace. 2 pacienti ze 4 ve skupině medikované PBA a 5 pacientů z 11 ve skupině s VPA vykazovalo zvýšení o 3 nebo 4 body Hammersmith škály. U 4 pacientů došlo ke zvýšení o 4 body Hammersmith škály, ale jen u 2 z nich k významnějšímu nárůstu hladiny mRNA genu SMN2 o plné délce. Dosažené výsledky prokázaly opodstatněnost budoucích rozsáhlejších intervenčních klinických studií s inhibitory histonových deacetyláz.
Klíčová slova:
spinální svalová atrofie – gen SMN (survival motor neuron) – inhibitory histonových deacetyláz – fenylbutyrát – valproát – Hammersmith škálaÚvod
Spinální svalová atrofie (SMA) I. a II. typu (časná infantilní a chronická dětská forma Werdnig-Hoffmannovy choroby) je závažné autozomálně recesivně dědičné onemocnění dětského věku s progredující degenerací motoneuronů předních rohů míšních. Klinicky je SMA charakterizována úbytkem svalové hmoty, svalovou slabostí a respirační insuficiencí vedoucí k předčasnému úmrtí. Tyto problémy jsou u typu SMA I markantní do 6 měsíců života, někdy prakticky ihned po narození, u typu SMA II se iniciálně projevují do 2. roku života. V dalším průběhu je pacient ohrožen recidivujícími pneumoniemi, rozvojem šlachových kontraktur a deformit skeletu. Frekvence onemocnění je 1 : 6000 porodů [1].
SMA je způsobena v cca 95 % případů homozygotní delecí 7. exonu genu SMN1 (survival motor neuron 1), která má za následek deficit genového produktu SMN proteinu, nezbytného pro přežití motorických neuronů předních rohů míšních. Ve stejné chromozomální oblasti (5q13) se nachází také jedna nebo více kopií genu SMN2. Gen SMN2 se ve své kódující oblasti liší od genu SMN1 pouze jednou nukleotidovou záměnou. V důsledku této záměny je ale cca 80 % pre-mRNA genu SMN2 sestřiženo za vzniku mRNA s delecí exonu 7. Translací takové mRNA vzniká zkrácený protein, který je nestabilní a podléhá rychlé degradaci.
Experimentální studie prokázaly, že některé farmakologicky aktivní látky mohou modifikovat sestřihový vzorec genu SMN2 u SMA pacientů zvýšením hladiny transkripčního produktu genu SMN2 o plné délce (tj. obsahující exon 7), a tím zvýšit i množství funkčního SMN proteinu. Jedná se o inhibitory histonových deacetyláz fenylbutyrát sodný (PBA) a kyselinu valproovou, respektive valproát sodný (VPA), které jsou nyní ve světě testovány z hlediska možné terapie SMA [2]. Gen SMN2 může být u člověka přítomen ve více kopiích. Pacienti s více než 2 kopiemi mají obvykle mírnější fenotypové projevy a jejich odpověď na medikaci PBA a VPA by také teoreticky měla být lepší [3].
Andreassi poprvé prokázal, že PBA signifikantně zvyšuje expresi genu SMN2. Na buněčných fibroblastových kulturách odvozených od 16 pacientů se SMA bylo metodou real-time PCR prokázáno zvýšení exprese mRNA genu SMN2 o plné délce o 50-160 % u typu SMA I a o 80-400 % u typů SMA II a III. Obecně byla zaznamenána výraznější odpověď na aplikaci PBA u buněčných kultur pacientů s více než 2 kopiemi genu SMN2. Metodou Western blotu byla prokázána také zvýšená hladina SMN proteinu [3]. Další studie prokázala, že perorální aplikace PBA přímo u pacientů s verifikovanou SMA vede k signifikantnímu zvýšení hladiny funkčního SMN proteinu v leukocytech testovaných pacientů. Tento důkaz vytvořil racionální předpoklad pro budoucí klinické hodnocení PBA u pacientů se SMA [4]. Bezpečnost a nezávažné vedlejší účinky PBA v terapeutických dávkách i při dlouhodobém podávání u dětských pacientů včetně kojenců, byly prokázány dlouholetým celosvětovým používáním v terapii poruch metabolizmu cyklu urey s hyperamonemií [5].
První klinické hodnocení medikace PBA provedené Mercurim u 10 dětských pacientů se SMA II. typu, prokázalo významné zlepšení motorických funkcí, které bylo patrné již po 3 týdnech medikace v dávce 500 mg/kg/den a ještě markantnější po ukončení 9týdenního intermitentního léčebného schématu. Dále bylo zaznamenáno zvýšení vitální kapacity plic (FVC). Efekt medikace byl zvláště výrazný u dětí ve věku do 5 let, které ještě nebyly postiženy deformitami pohybového aparátu a respirační insuficiencí – komplikacemi omezujícími možnosti efektivní rehabilitace. Nebyly pozorovány výraznější nežádoucí účinky medikace PBA [6]. Následná randomizovaná, dvojitě zaslepená a placebem kontrolovaná multicentrická studie se souborem 107 pacientů, kterým byl podáván PBA (500 mg/kg/den) nebo placebo v intermitentním režimu (7 dní medikace/7 dní bez medikace) po dobu 13 týdnů však neprokázala statisticky významné zvýšení hodnoty Hammersmithovy funkční motorické škály, která je uznávána jako dostatečně senzitivní a spolehlivý nástroj pro objektivizaci vývoje motorických funkcí u pacientů se SMA II. a III. typu v multicentrických intervenčních studiích, není však vhodná pro hodnocení pacientů se SMA I. typu [7,8]. Američtí autoři používají Hammersmithovu motorickou škálu také v modifikované verzi [9].
Kyselina valproová funguje rovněž jako inhibitor histonových deacetyláz a podobně jako PBA zvyšuje expresi genu SMN2 ve fibroblastových buněčných kulturách pacientů se SMA [10]. Klinický efekt VPA byl testován u dospělých i dětských pacientů [11]. Nejrozsáhlejší multicentrická studie probíhá v současnosti v USA. Jedná se o 2. fázi klinického hodnocení účinku VPA v kombinaci s karnitinem (studie CARNI-VAL) u dětí se SMA II. a III. typu ve věku 2-17 let [12].
Primárním cílem naší pilotní studie bylo otestovat vztah mezi počtem kopií genu SMN2, změnami exprese mRNA genu SMN2 a klinickými výsledky u malého souboru pacientů se SMA I. a II. typu na medikaci PBA nebo VPA. Dalším cílem bylo vytvořit praktický algoritmus sledování pacientů na klinické a molekulárně biologické úrovni, zhodnotit případné nežádoucí účinky medikace a potvrdit bezpečnost aplikace PBA a VPA u pacientů se SMA.
Materiál a metodika
V naší prospektivní otevřené pilotní klinické studii jsme po dobu 8 týdnů aplikovali PBA u skupiny 6 pacientů se SMA I. a II. typu (4 chlapci a 2 dívky) ve věku 12 měsíců až 5 let (medián 4 roky) a VPA u skupiny 11 pacientů se SMA II. typu (5 chlapců a 6 dívek) mezi 5-16 lety věku (medián 9 let). Při zařazení pacientů do PBA nebo VPA skupiny jsme se řídili věkem pacientů, kdy podle zahraničních autorů se PBA jeví vhodnější spíše pro menší děti do 2 eventuálně 5 let věku [6,12]. Vstupními kritérii byly klinický fenotyp SMA I. nebo II. typu, homozygotní delece 7. exonu genu SMN1 a normální hodnoty krevního obrazu a biochemického screeningu. Vylučujícími kritérii byly pokročilé kontraktury a deformity skeletu, elevace jaterních transamináz nebo jiné zjištěné metabolické odchylky, akutní infekty a lékové alergie v anamnéze. Klinické výsledky byly na molekulárně biologické úrovni korelovány s počtem kopií genu SMN2 a změnami exprese mRNA genu SMN2.
PBA byl podáván ve formě preparátu Ammonaps (výrobce Swedish Orphan International AB, Švédsko) jako granulát nebo tablety v celkové dávce 500 mg/kg/den, rozdělené do 4 ekvivalentních dávek, podávaných během dne ve 4hodinových intervalech (v 7, 11, 15 a 19 hodin). Pacienti se SMA I. typu byli na domácí umělé plicní ventilaci a PBA jim byl aplikován pomocí perkutánní gastrostomie (PEG) jako granulát smíchaný s tekutou nebo kašovitou stravou. VPA byl podáván ve formě preparátu Convulex CR tablety (výrobce Gerot Pharmazeutika GmbH, Rakousko) 2x denně v celkové dávce 20 mg/kg/den a sérová hladina VPA byla udržována v terapeutickém rozmezí 50-100 µg/ml. Protože se jednalo o použití PBA a VPA v neregistrované indikaci, byla splněna ohlašovací povinnost a použití preparátů nahlášeno Státnímu ústavu pro kontrolu léčiv (SÚKL). Rodiče všech dětských pacientů podepsali informovaný souhlas se zařazením do studie. Protokol studie byl schválen etickou komisí Fakultní nemocnice Brno.
Klinický efekt byl hodnocen pomocí Hammersmithovy funkční motorické škály před zahájením a po 8 týdnech medikace. Provedení testu lékařem nebo fyzioterapeutem je jednoduché a časově nenáročné, trvá cca 10-15 minut. Hodnotí se provedení 20 různých motorických úkonů ve 3bodové stupnici. Pacient získá 2 body za samostatně provedený úkon, 1 bod v případě, že pohyb provede s asistencí a 0 v případě, že požadovaný pohyb neprovede ani s pomocí vyšetřujícího. Výjimky v tomto hodnocení jsou u jednotky 1 a 2, kdy pacient obdrží 0 bodů za provedení pohybu při asistenci oběma rukama a v jednotce 18, kdy pacient obdrží 1 bod za minimální podporu v oblasti hrudníku a 0 bodů při podpoře v oblasti kyčlí nebo kolen. Celkové skóre může dosahovat hodnot od minima 0 do maxima 40 bodů. Všechny části testu musejí být prováděny bez korzetu nebo ortéz (tab.1) [8].
Tab. 1. Hammersmith SMA funkční motorická škála. Minimum 0 bodů, maximum 40 bodů [8]. ![Hammersmith SMA funkční motorická škála. Minimum 0 bodů, maximum 40 bodů [8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9b2db7cffe607fbf28c49b7544d565dc.png)
Vstupní vyšetření před nasazením medikace u každého pacienta se SMA II. typu zahrnovalo provedení Hammersmithovy funkční motorické škály (T0), základního laboratorního vyšetření (krevní obraz + biochemický screening) a molekulárně biologických testů se zaměřením na stanovení počtu kopií genu SMN2 a bazální exprese plné délky a sestřihové varianty mRNA genu SMN2 v leukocytech metodou real-time PCR. Pacienti se SMA I. typu nemohli být funkčně hodnoceni pomocí Hammersmithovy škály, která je pro kojence a batolata s takto těžkým motorickým postižením nevyhovující. Během celé doby medikace byly v 1 - až 2týdenních intervalech, podle dostupnosti pacientů, prováděny kontrolní odběry s vyšetřením krevního obrazu, biochemie, u pacientů s medikací VPA také hladiny VPA a dále byly kvantifikovány změny exprese mRNA genu SMN2 metodou real-time PCR. Po 8 týdnech medikace bylo provedeno kontrolní vyhodnocení Hammersmithovy funkční motorické škály (T1). Jako signifikantní zlepšení bylo považováno zvýšení o 3 a více bodů.
Metodika molekulárně genetických analýz
Počet kopií genu SMN2 byl určen metodou real-time PCR za použití sondy technologie MGB® specifické pro gen SMN2. Výsledky real-time PCR byly vyhodnoceny metodou 2-ΔΔCt (komparativní ct metoda pro relativní kvantifikaci), která vyjadřuje počet kopií zkoumaného genu vzhledem k počtu kopií referenčního genu a normalizuje tuto hodnotu k počtu kopií kalibračního vzorku. Jako referenční gen byl pro vyhodnocení použit gen pro albumin a jako kalibrátor vzorek se 2 kopiemi genu SMN2 [13,14].
Kvantifikace mRNA genu SMN2 o plné délce a s delecí exonu 7 před terapií a v průběhu terapie PBA nebo VPA byla provedena metodou real-time PCR po předchozí reverzní transkripci. Primery byly navrženy specificky pro spojení exonů 7 a 8 v případě mRNA o plné délce a exonů 6 a 8 v případě mRNA s delecí exonu 7. Nárust produktů PCR byl detekován fluorescenční barvičkou Sybr Green. Získaná data byla analyzována metodou 2-ΔΔCt, která v tomto případě vyjadřovala relativní expresi zkoumaného genu vzhledem k expresi referenčního genu a normalizovala tuto hodnotu k expresi u kalibračního vzorku. Jako referenční gen byl použit gen pro hypoxantin guanin fosforibozyltransferázu (HPRT) a glyceraldehyd-3-fosfátdehydrogenázu (GAPDH) jako kalibrátor vzorek před začátkem terapie.
Výsledky
Všech 6 pacientů ve skupině medikované PBA a 11 pacientů ve skupině s VPA ukončilo 8týdenní sledování klinických a laboratorních parametrů a dále pokračují v zavedené medikaci. Nebyly pozorovány závažnější nežádoucí účinky, které by byly důvodem přerušení medikace. U pacientů medikovaných PBA se jako jediný problém jevila nepříjemně hořká chuť preparátu, u pacientů kteří užívali VPA, u některých pacientů potom zvýšená chuť k jídlu spojená s nárůstem tělesné hmotnosti. U žádného ze sledovaných pacientů jsme nezaznamenali elevaci jaterních transamináz nebo jiné odchylky v biochemickém screeningu nebo krevním obraze.
Klinicky vykazovali 2 pacienti ze 4 ve skupině medikované PBA a 5 pacientů z 11 ve skupině s VPA významné zvýšení hodnoty Hammersmithovy škály, to znamená o 3 a více bodů. Celkově tedy bylo zlepšení motorických funkcí zaznamenáno u 7 pacientů (41 % všech pacientů, 47 % pacientů u kterých bylo možno hodnotit Hammersmithovu škálu). Dalších 8 pacientů nevykazovalo významnou změnu. U 2 pacientů se SMA I. typu nebylo možno případnou změnu funkčního motorického stavu kvantifikovat, nedošlo však u nich k viditelné progresi hypotonie a svalové slabosti. U žádného z pacientů nedošlo ke klinickému zhoršení (tab. 2). Malý počet pacientů v obou skupinách neumožňoval spolehlivé statistické zhodnocení.
Tab. 2. Přehled pacientů s medikací PBA a VPA. Tučně jsou vyznačeni pacienti, u kterých došlo ke zvýšení hodnoty Hammersmith funkční motorické škály o 3 a více bodů. 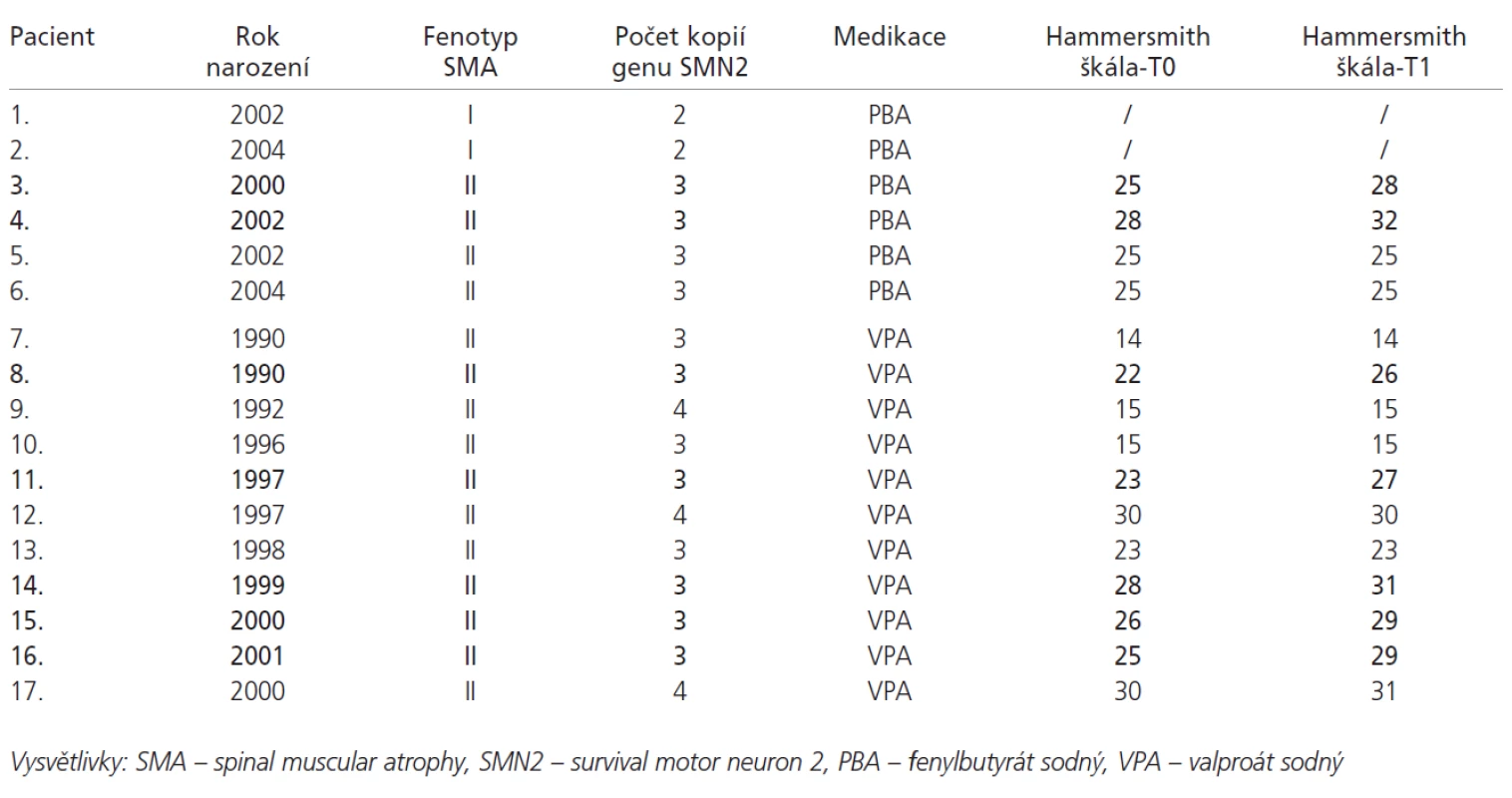
Na molekulární úrovni byly u 2 pacientů s fenotypem SMA I detekovány 2 kopie genu SMN2. V případě 15 pacientů s fenotypem SMA II. typu byly u 12 prokázány 3 kopie a u 3 pacientů 4 kopie genu SMN2 (tab. 2). K významnějšímu nárůstu hladiny mRNA genu SMN2 o plné délce (na více než 200 % původní hodnoty ve více než 1 odběru v průběhu terapie PBA nebo VPA) došlo u 2 pacientů. Oba tito pacienti vykazovali zároveň významné zvýšení hodnoty Hammersmithovy škály (pacienti 8 a 16, tab. 2, obr. 1 a 2). U ostatních pacientů nedošlo v průběhu terapie k významnějším změnám exprese genu SMN2 (obr. 3). Na obrázcích 1, 2 a 3 jsou graficky zobrazeny změny relativního množství mRNA genu SMN2 o plné délce, mRNA genu SMN2 obsahující deleci exonu 7 a v případě obrázku 1 a 2 také změny mRNA genu GAPDH.
Graf 1. Pacient 8. Změny hladiny mRNA genu SMN2 o plné délce, mRNA genu SMN2 obsahující deleci exonu 7 a mRNA genu GAPDH v průběhu terapie VPA (vyhodnoceno vzhledem k genu HPRT a normalizováno k odběru před terapií – odběr 1). 
Graf 2. Pacient 16. Změny hladiny mRNA genu SMN2 o plné délce, mRNA genu SMN2 obsahující deleci exonu 7 a mRNA genu GAPDH v průběhu terapie VPA (vyhodnoceno vzhledem k genu HPRT a normalizováno k odběru před terapií – odběr 1). 
Graf 3. Pacient 15. Změny hladiny mRNA genu SMN2 o plné délce a mRNA genu SMN2 obsahující deleci exonu 7 v průběhu terapie VPA (vyhodnoceno vzhledem k genu HPRT a normalizováno k odběru před terapií – odběr 1). 
Diskuse
Spinální svalová atrofie I. a II. typu je kauzálně neléčitelné letální onemocnění. Velká pozornost je proto celosvětově věnována možnostem zmírnění těžkého fenotypu SMA a zpomalení rapidní progrese modifikací sestřihového vzorce genu SMN2 inhibitory histonových deacetyláz. V naší pilotní klinické a molekulárně biologické studii jsme pozorovali, že medikace PBA a VPA může souviset s klinickým benefitem cca u 40 % testovaných pacientů, kteří se jevili jako respondéři na léčbu těmito preparáty. Analýzou mRNA, která byla izolovaná z leukocytů periferní krve, jsme detekovali významnější zvýšení hladiny mRNA genu SMN2 o plné délce jen u 2 léčených pacientů, kteří současně vykazovali zvýšení hodnoty Hammersmithovy škály o 4 body. Tyto výsledky jsou v souladu se zahraničními studiemi, které popisují zlepšení motorických funkcí spíše u jednotlivých pacientů, zatímco v rozsáhlejší kontrolované studii nelze tento efekt spolehlivě statisticky prokázat [6,7,11].
Praktický algoritmus sledování pacientů se SMA I. a II. typu na klinické a molekulárně biologické úrovni se nám osvědčil jako vhodný pro rozsáhlejší kontrolované studie. Problémem je, že pro objektivní hodnocení motorických funkcí u pacientů s fenotypem SMA I. typu nelze použít Hammersmithovu škálu. Je sice možno použít škálu TIMP (Test of Infant Motor Performance), která se však v praxi neosvědčila. Hodnocení případného pozitivního efektu medikace je tak u těchto pacientů pouze subjektivní. Potvrdili jsme bezpečnost a nezávažné vedlejší účinky medikace PBA i VPA. Výhodou PBA a VPA je, že tyto preparáty jsou dostupná farmaka s dobře známými farmakokinetickými i farmakodynamickými vlastnostmi, dlouhodobě používaná v jiných indikacích. Vzhledem k tomu, že klinický efekt je možno prokázat jen u části pacientů se SMA, jeví se zřejmě do budoucna perspektivnější nová generace inhibitorů histonových deacetyláz, jako benzamid M344 nebo kyselina suberoylanilid hydroxamová (SAHA), které mnohem efektivněji stimulují expresi genu SMN2. Bude však zřejmě trvat dlouhou dobu než klinická hodnocení těchto farmak umožní jejich schválení pro použití v humánní medicíně [15-18].
Rozsáhlejší multicentrické kontrolované studie budou nutné pro nalezení odpovědí na řadu otázek, které dosud zůstávají nezodpovězeny [19]. Není jasné, které faktory determinují individuální odpověď na medikaci inhibitory histonových deacetyláz, proč se někteří pacienti jeví jako respondéři, zatímco u jiných není žádný efekt medikace patrný. Může se například uplatňovat individuální metabolizmus a farmakokinetika PBA a VPA. Teoreticky by měli na medikaci inhibitory histonových deacetyláz lépe reagovat pacienti s větším počtem kopií genu SMN2, což se na našem malém souboru nepodařilo prokázat. Nikdo dosud nestanovil, jak vysoké zvýšení hladiny mRNA genu SMN2 o plné délce, a tím i funkčního SMN proteinu, je nutné, aby skutečně mohlo dojít ke zlepšení klinického stavu pacienta. Dále není jasné, pro které pacienty je vhodnější medikace VPA, event. v kombinaci s karnitinem a u kterých může být efektivnější PBA, který je ovšem finančně mnohem nákladnější. Otázkou také je, v jakém věku dítěte má tato medikace smysl, zda může být přínosem i u pacientů, u kterých již došlo k zániku velkého počtu motorických neuronů. Na zodpovězení těchto otázek budou zaměřeny plánované mezinárodní multicentrické studie, které budou v zemích Evropské unie koordinovány v rámci projektu Evropského neuromuskulárního centra TREAT-NMD [20].
Přijato k recenzi: 12. 1. 2007
Přijato do tisku: 2. 2. 2007
Korespondující autor:
MUDr. Petr Vondráček, Ph.D.
Klinika dětské neurologie LF MU a FN Brno
Černopolní 9, 625 00, Brno
pvondracek@fnbrno.cz
Zdroje
1. Kraus J, Hedvičáková P. Spinální svalové atrofie v dětském věku. Neurol pro praxi 2006; 1 : 18-19.
2. Pleasure D. New treatments for denervating diseases. J Child Neurol 2005; 3 : 258-262.
3. Andreassi C, Angelozzi C, Tiziano FD, Vitali T, De Vincenzi E, Boninsegna A et al. Phenylbutyrate increases SMN expression in vitro: relevance for treatment of spinal muscular atrophy. Eur J Hum Genet 2004; 1 : 59-65.
4. Brahe C, Vitali T, Tiziano FD, Angelozzi C, Pinto AM, Borgo F et al. Phenylbutyrate increases SMN gene expression in spinal muscular atrophy patients. Eur J Hum Genet 2005; 2 : 256-259.
5. Maestri NE, Brusilow SW, Clissold DB, Bassett SS. Long-term treatment of girls with ornithine transcarbamylase deficiency. N Engl J Med 1996; 12 : 855-859.
6. Mercuri E, Bertini E, Messina S, Pelliccioni M, D´Amico A, Colitto F et al. Pilot trial of phenylbutyrate in spinal muscular atrophy. Neuromuscul Disord 2004; 14 : 130-135.
7. Mercuri E, Bertini E, Messina S, Solari A, D'Amico A, Angelozzi C et al. Randomized, double-blind, placebo-controlled trial of phenylbutyrate in spinal muscular atrophy. Neurology 2007; 1 : 51-55.
8. Mercuri E, Messina S, Battini R, Berardinelli A, Boffi P, Bono R et al. Reliability of the Hammersmith functional motor scale for spinal muscular atrophy in a multicentric study. Neuromuscul Disord 2006; 2 : 93-98.
9. Krosschell KJ, Maczulski JA, Crawford TO, Scott C, Swoboda KJ. A modified Hammersmith functional motor scale for use in multi-center research on spinal muscular atrophy. Neuromuscul Disord 2006; 7 : 417-426.
10. Brichta L, Hofmann Y, Hahnen E, Siebzehnrubl FA, Raschke H, Blumcke I et al. Valproic acid increases the SMN2 protein level: a well-known drug as a potential therapy for spinal muscular atrophy. Hum Mol Genet 2003; 19 : 2481-2489.
11. Weihl CC, Connolly AM, Pestronk A. Valproate may improve strength and function in patients with type III/IV spinal muscle atrophy. Neurology 2006; 3 : 500-501.
12. http://www.curesma.org
13. Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res 2001; 9: e45.
14. Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method.
Methods 2001; 4 : 402-408.
15. Wirth B, Brichta L, Hahnen E. Spinal muscular atrophy: from gene to therapy. Semin Pediatr Neurol 2006; 2 : 121-131.
16. Wirth B, Brichta L, Hahnen E. Spinal muscular atrophy and therapeutic prospects.
Prog Mol Subcell Biol 2006; 44 : 109-132.
17. Riessland M, Brichta L, Hahnen E, Wirth B. The benzamide M344, a novel histone deacetylase inhibitor, significantly increases SMN2 RNA/protein levels in spinal muscular atrophy cells. Hum Genet 2006; 1 : 101-110.
18. Hahnen E, Eyupoglu IY, Brichta L, Haastert K, Trankle C, Siebzehnrubl FA et.al. In vitro and ex vivo evaluation of second-generation histone deacetylase inhibitors for the treatment of spinal muscular atrophy. J Neurochem 2006; 1 : 193-202.
19. Vondracek P, Fajkusova L, Hermanova M, Balintova Z, Seeman P, Mazanec R et al. New Perspectives in the Treatment of Inherited Neuromuscular Disorders: Innovative Ideas for Third Millenium. In: Engels JV (Eds). Focus on Birth Defects Research. New York: Nova Science Publishers 2006 : 161-183.
20. www.enmc.org
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2007 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Cervikální dystonie
- Repetitivní transkraniální magnetická stimulace a chronický subjektivní nonvibrační tinnitus
- Hladina D-dimerů u pacientů s akutní ischemickou cévní mozkovu příhodou
- Komentář k pilotní studii autorů D. Školoudíka et al. Změny kognitivních funkcí u pacientů s akutní cévní mozkovou příhodou testovaných pomocí Mini-Mental State Examination (MMSE) a Clock Drawing Test (CDT)
- Změny kognitivních funkcí u pacientů s akutní cévní mozkovou příhodou testovaných pomocí Mini-Mental State Examination a Clock Drawing Test
- Dekompresní kraniektomie jako léčba pro krysí model „maligního“ infarktu střední mozkové tepny
- Korelace mezi indexem IgG a oligoklonálními pásy při CSF vyšetření u pacientů s roztroušenou sklerózou
- Svalová biopsie u myotonické dystrofie v éře molekulární genetiky
- Chirurgická léčba hormonálně aktivních adenomů hypofýzy
- Analýza 1 775 pacientů léčených pro trigeminální neuralgii perkutánní radiofrekvenční rizotomií
- Ovlivnění exprese mRNA genu SMN2 inhibitory histonových deacetyláz a jejich vliv na fenotyp spinální svalové atrofie I. a II. typu
- Komentář ke článku Balcer LJ, Galetta SL, Calabresi PA et al. Natalizumab reduces visual loss in patiens with relapsing multiple sclerosis. Neurology 2007; 68: 1299–1304.
- Poliomyelitis-like syndrom na podkladě klíšťové meningoencefalitidy
- Satelitní anatomický worhshop Transtemporal approaches
- Trombóza esovitého splavu – současný pohled na diagnostiku a léčbu
- Léčba spánkové apnoe malých dětí dvojúrovňovým přetlakem v dýchacích cestách
- Polykací obtíže u difuzní idiopatické kostní hyperostózy
- Hennerici MG, Daffertshofer M, Caplan LR, Szabo K (Eds). Case Studies in Stroke. Common and Uncommon Presentations. Cambridge: Cambridge University Press 2007. 272 p. ISBN 0-521-67367-4.
- Lze bez pochybností interpretovat výsledky lumbálního infuzního testu?
- Zpráva z 8. sjezdu Evropské společnosti báze lební
-
Analýza dat v neurologii. IV.
Variabilita měření není vždy „chyba“ - Webové okénko
- XVIII. neuromuskulární sympozium
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Cervikální dystonie
- Hladina D-dimerů u pacientů s akutní ischemickou cévní mozkovu příhodou
- Trombóza esovitého splavu – současný pohled na diagnostiku a léčbu
- Repetitivní transkraniální magnetická stimulace a chronický subjektivní nonvibrační tinnitus
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



