-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Změny kognitivních funkcí u pacientů s akutní cévní mozkovou příhodou testovaných pomocí Mini-Mental State Examination a Clock Drawing Test
Changes in congintive functions in patients with acute cerebrovascular event who tested by Mini-Mental State Examination and the Clock Drawing Test
Introduction:
The objective of the study was to evaluate changes in testing cognitive functions by Mini-Mental State Examination (MMSE) and the Clock Drawing Test (CDT) in patients with acute cerebrovascular eventu (CVE) in the first 3 months from the occurrence of symptoms.Method:
The study enrolled patients with acute CVE admitted to the hospital within 6 hours from the onset of symptoms. The control group (CG) consisted of patients with acute coronary syndrome without symptoms of affection of the central nervous system. MMSE and CDT tests were performed in all patients on the 2nd, 30th and 90th day. The influence of the monitored factors on the results of cognitive function tests was evaluated statistically.Results:
A total of 30 patients with CVE were enrolled in the study (of which 57 % men of mean age 69.0 ± ± 11.3 years). The control group consisted of 15 patients (66.7 % of men of mean age 69.8 years ± 11.5 years). The percentage of CVE patients for whom pathological values were recorded in at least one of the performed tests was 73.3 % and 20.8 % on the 2nd and 90th day, respectively. In the control group, pathological findings were diagnosed in only 27 % and 7 % of patients on the 2nd and the 90th day, respectively (p < 0.01). A significant improvement was recorded between the results of the first and the second cognitive test (p<0.05). Significantly worse results in cognitive tests were recorded in patients at a higher age, in patients with a speech disturbance, with infection, and in patients with major neurological damage (p < 0.05). Correlation of the MMSE and CDT results was statistically significant (p < 0.01), with Pearson correlation coefficient r = 0.79.Conclusion:
Using MMSE and CDT, cognitive function impairment can be detected in 73.3 % of patients in the acute phase of CVE. In addition to brain lesions, the results of the cognitive function tests were influenced by acute stress, higher age, speech disturbance, infection and the burden of neurological affection.Key words:
cerebrovascular event – cognitive functions – risk factors – Mini-Mental State Examination – Clock Drawing Test
Autoři: D. Školoudík 1,2; T. Fadrná 1; M.sedláková 1; P. Ressner 2; M. Bar 1; O. Zapletalová 1; D.šaňák; R. Herzig 2; P. Kaňovský 2
Působiště autorů: Neurologická klinika FNsP, Ostrava 1; Neurologická klinika LF UP a FN, Olomouc 2
Vyšlo v časopise: Cesk Slov Neurol N 2007; 70/103(4): 382-387
Kategorie: Původní práce
Výsledky studie byly prezentovány formou přednášky na Third international congress on vascular dementia, Praha, 25. 10. 2003 a XXXI. Slovensko-českém neurovaskulárním sympoziu, Bratislava, Slovenská republika, 10. 10. 2 003.
Souhrn
Úvod:
Cílem studie bylo hodnocení změn při testování kognitivních funkcí pomocí Mini-Mental State Examination (MMSE) a Testu kresby hodin (Clock Drawing Test – CDT) u pacientů s akutní cévní mozkovou příhodou (CMP) v prvních 3 měsících od začátku příznaků.Metodika:
Do studie byli zařazeni pacienti s akutní CMP, přijatí do nemocnice do 6 hodin od začátku příznaků. Do kontrolní skupiny (KS) byli vybráni pacienti s akutním koronárním syndromem bez příznaků postižení centrální nervové soustavy. U všech pacientů byly provedeny testy MMSE a CDT 2., 7., 30. a 90. den. Statisticky byl zhodnocen vliv sledovaných faktorů na výsledky testů kognitivních funkcí.Výsledky:
Do studie bylo zařazeno celkem 30 pacientů s CMP (57% mužů, průměrný věk 69,0 + 11,3 let). KS tvořilo 15 pacientů (66,7 % mužů, průměrný věk 69,8 + 11,5 let). Patologická hodnota alespoň v jednom z provedených testů byla zjištěna u pacientů s CMP v 73,3 % 2. den a 20,8 % 90. den. V KS byl patologický nález diagnostikován jen u 27 %, resp. 7 % pacientů 2., resp. 90. den (p < 0,01). Mezi jednotlivými kontrolami došlo k signifikantnímu zlepšení (p < 0,05) v kognitivních testech. Signifikantně horší výsledek v kognitivních testech byl zaznamenán u pacientů ve vyšším věku, u pacientů s fatickou poruchou, infekcí a při výraznějším neurologickém postižení (p < 0,05). Korelace výsledků MMSE a CDT byla statisticky signifikantní (p < 0,01), Pearsonův korelační koeficient r = 0,79.Závěr:
Pomocí MMSE a CDT lze detekovat v akutním stadiu CMP postižení kognitivních funkcí u 73,3 % pacientů. Výsledky testů kognitivních funkcí byly ovlivněny mimo mozkové léze také akutním stresem, vyšším věkem, přítomností fatické poruchy, infekcí a tíží neurologického postižení.Klíčová slova:
cévní mozková příhoda – kognitivní funkce – rizikové faktory – Mini-Mental State Examination – Test kresby hodinÚvod
Demence jsou závažná onemocnění, která představují značný zdravotní, sociální i ekonomický problém. Proto se v posledních letech stále více studií věnuje pacientům s poruchou kognitivních funkcí, diagnostice a sledování jednotlivých typů demencí. Demence vaskulárního typu tvoří v současnosti druhou nejčetnější skupinu. Zastoupení vaskulárních demencí mezi všemi demencemi se v jednotlivých studiích liší, pohybuje se mezi 10 a 50 % [1].
V akutním stadiu cévní mozkové příhody (CMP) jsou detekovány změny kognitivních funkcí až v 92 % [2]. Jelikož v akutním stadiu CMP dochází ke kolísání kognitivních funkcí pacientů, považuje se minimální doba k testování kognitivních funkcí pro diagnostiku vaskulární demence 3 měsíce od začátku CMP. V těchto prvních měsících dochází v některých případech k výrazným změnám ve výsledcích testování kognitivních funkcí [2].
Cílem naší pilotní studie bylo sledování změn při testování kognitivních funkcí pomocí Mini-Mental State Examination (MMSE) [3] a Testu kresby hodin (Clock Drawing Test, CDT) [4-6] u pacientů s akutní CMP v prvních 3 měsících v závislosti na věku, pohlaví, typu, tíži a lokalizaci postižení mozku, infekci a vlivu akutního onemocnění.
Materiál a metodika
Soubor tvoří pacienti s CMP, kteří byli konsekutivně přijati v období od prosince 2002 do března 2003 na Iktovou jednotku Neurologické kliniky FNsP Ostrava. Vstupními kritérii bylo přijetí do nemocnice do 6 hodin od začátku příznaků a jasný neurologický deficit (NIHSS při příjmu 4-19). Vylučovacími kritérii byla kvantitativní a kvalitativní porucha vědomí (sopor, koma, delirium), senzorická nebo globální afázie. Do kontrolní skupiny (KS) byli vybráni pacienti s akutním koronárním syndromem, avšak bez příznaků postižení centrální nervové soustavy, přijati ve stejném období na Koronární jednotku Interní kliniky FNsP Ostrava. Z KS byli vyloučeni všichni pacienti s rozvojem infekce během hospitalizace.
U všech pacientů s akutní CMP bylo provedeno při přijetí neurologické vyšetření (včetně bodového ohodnocení neurologického deficitu v NIHSS škále), CT mozku a neurosonologické vyšetření. Testování kognitivních funkcí pomocí MMSE a CDT jsme provedli 2., 7., 30 a 90. den. U všech pacientů byla stanovena etiologie CMP. Soběstačnost 30. a 90. den byla hodnocena pomocí modifikované Rankinovy škály (mRS). Kontrolní neurologické vyšetření se stanovením postižení v NIHSS škále bylo provedeno 90 dní od začátku CMP.
V KS bylo provedeno testování kognitivních funkcí pomocí MMSE a CDT opět 2., 7., 30. a 90. den s určením etiologie koronární příhody. V obou skupinách byl sledován výskyt infekce se zvýšením tělesné teploty a zánětlivých markerů (C-reaktivní protein, sedimentace, leukocytóza).
Výsledky kognitivních testů jsme rozdělili do 2 skupin: normální a patologický nález. Jako patologický nález byl hodnocen výsledek MMSE 0-25 bodů, CDT -2-3 body (dle Hendriksena) [6] nebo součet obou testů -2-28 bodů.
Ke statistickému zhodnocení výsledků byly použity ANOVA test, χ2 test, Studentův t-test a Mannův-Whitneyův U-test a regresní analýza (statistický software SPSS, verze 10.1).
Výsledky
Do studie bylo zařazeno celkem 30 pacientů s CMP - 17 (57 %) mužů a 13 žen, ve věku 51-84 let, průměr 69,0 ± 11,3 let. Průměrná vstupní tíže neurologického deficitu dle NIHSS škály byla 6,3 ± 3,5 (rozmezí 4-19). Supratentoriálně bylo lokalizováno 25 lézí, infratentoriálně 5 lézí. U 28 pacientů byla etiologie CMP ischemická, u 2 hemoragická. Během prvních 90 dnů zemřelo 7 (23,3 %) pacientů.
KS tvořilo 15 pacientů s akutním koronárním syndromem - 10 mužů (66,7 %) a 5 žen, ve věku 53-83, průměrně 69,8 ± 11,5 let; 1 pacient (6,7 %) zemřel v průběhu prvních 90 dnů.
Procento pacientů s patologickým nálezem alespoň v jednom z testů kognitivních funkcí při jednotlivých kontrolách je uvedeno v tab. 1. Průměrná hodnota v kombinaci testů MMSE a CDT 2. den byla v KS signifikantně nižší (31,6 ± 3,5) než 90. den (33,8 ± 1,2), p = 0,01. Patologický nález alespoň v jednom z kognitivních testů 2. a 90. den podle etiologie a lokalizace léze zobrazuje tab. 2.
Tab. 1. Počet pacientů s patologickým nálezem v alespoň jednom z kognitivních testů při jednotlivých kontrolách. 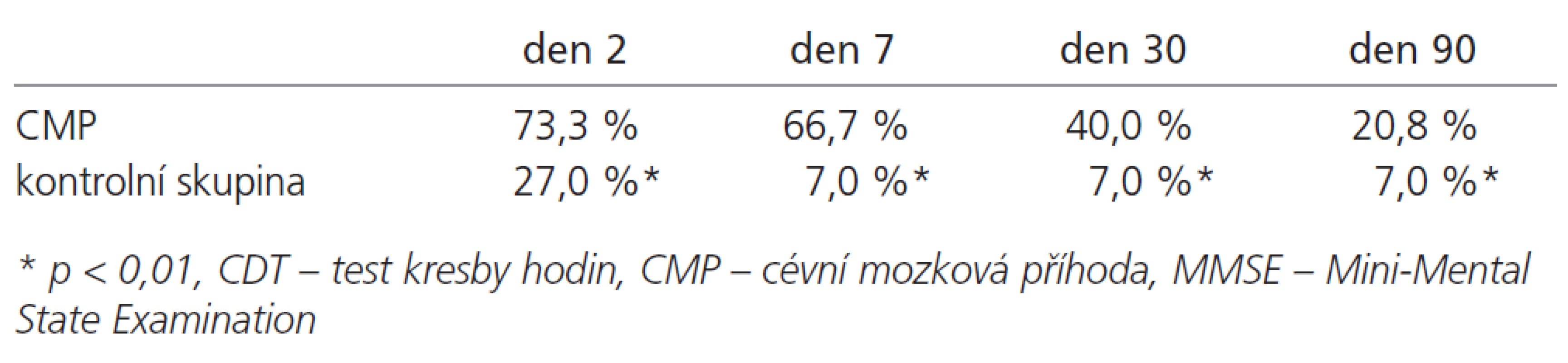
Tab. 2. Počet pacientů s patologickou hodnotou alespoň v jednom z kognitivních testů podle etiologie a lokalizace cévní léze. 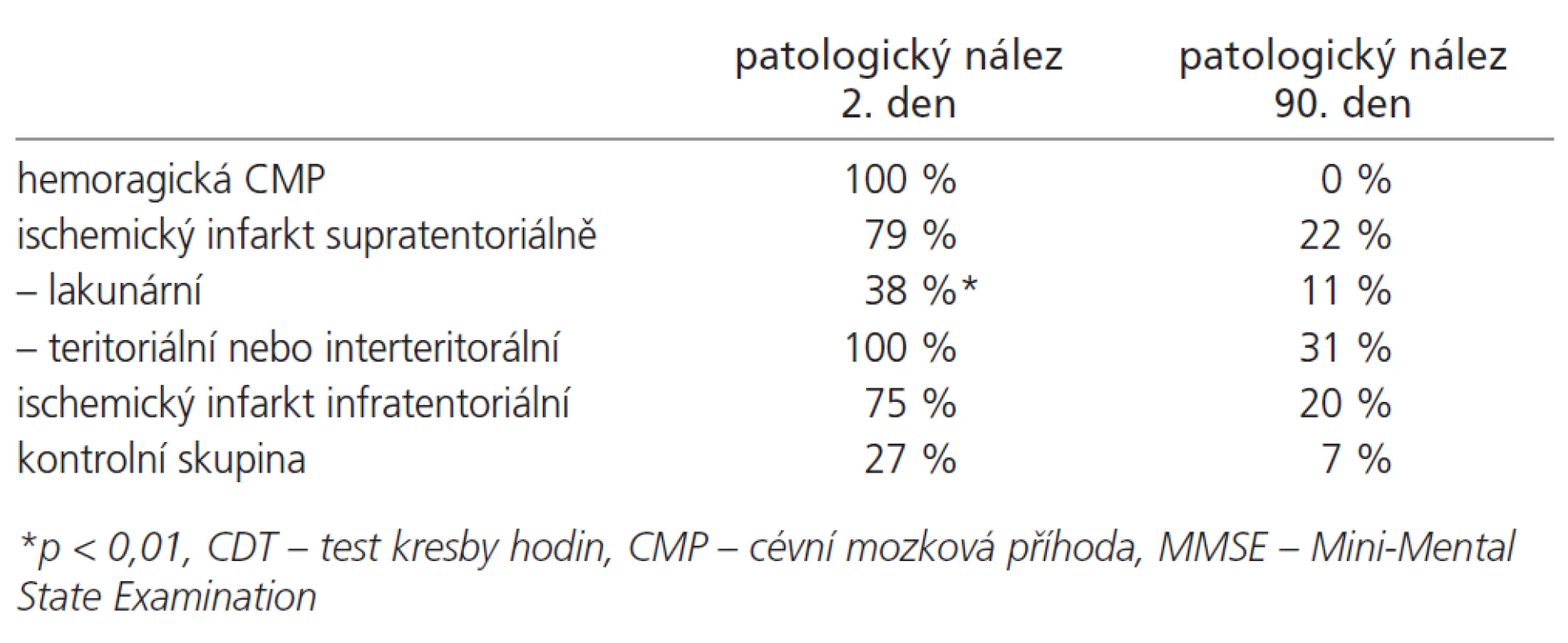
Výsledky testů kognitivních funkcí (MMSE + CDT) 2. den od rozvoje příznaků signifikantně korelovaly s neurologickým postižením (dle NIHSS) při přijetí (p < 0,05), Pearsonův korelační koeficient r = 0,56.
Z grafů 1 a 2 je patrna změna hodnot MMSE a CDT u pacientů s CMP v prvních 3 měsících od začátku příznaků. U většiny pacientů došlo k výraznější úpravě kognitivních funkcí v průběhu prvních 30 dnů. Mezi jednotlivými kontrolami došlo k signifikantnímu zlepšení v MMSE a MMSE + CDT. V testu hodin došlo k signifikantnímu zlepšení mezi dny 2, resp. 7 a dny 30, resp. 90 – viz tab. 3.
Graf 1. Průměrná hodnota MMSE a MMSE + CDT u pacientů s CMP v prvních 3 měsících od začátku příznaků. 
Graf 2. Procento patologických nálezů v MMSE, CDT a jejich kombinaci u pacientů s CMP v prvních 3 měsících od začátku příznaků. 
Tab. 3. Zlepšení ve výsledcích kognitivních testů mezi jednotlivými kontrolami u pacientů s akutní cévní mozkovou příhodou. 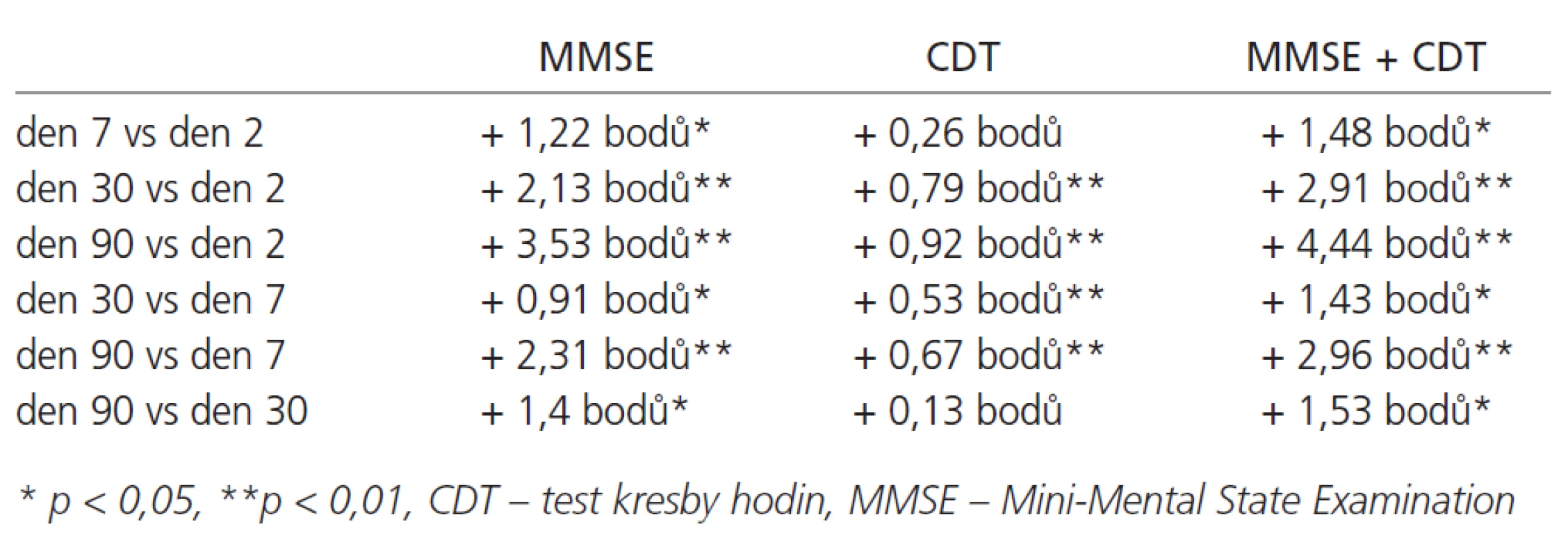
Korelace mezi soběstačností a kognitivními funkcemi (MMSE + CDT) 3 měsíce od začátku příznaků byla signifikantní (p < 0,01), Pearsonův korelační koeficient r = 0,95 – viz graf 3. Také u pacientů, kteří zemřeli v průběhu prvních 90 dní, byl signifikantně horší výsledek testů kognitivních funkcí 2. den od začátku příznaků – MMSE + CDT 21,4 ± 6,7 vs. 27,0 ± 8,9, p < 0,05.
Graf 3. Korelace výsledků testů kognitivních funkcí (MMSE a CDT) a soběstačnosti pacienta po 90 dnech hodnocené pomocí modifikované Rankinovy škály (mRS). 
Vliv jednotlivých faktorů na kognitivní funkce v prvních 90 dnech od začátku CMP je uveden v tab. 4. V grafu 4 je zaznamenána korelace mezi výsledky v testech MMSE a CDT v prvních 3 měsících od začátku CMP. Korelace je statisticky signifikantní (p < 0,01), Pearsonův korelační koeficient r = 0,79.
Tab. 4. Vliv sledovaných faktorů na testování kognitivních funkcí v prvních 90 dnech od vzniku CMP. 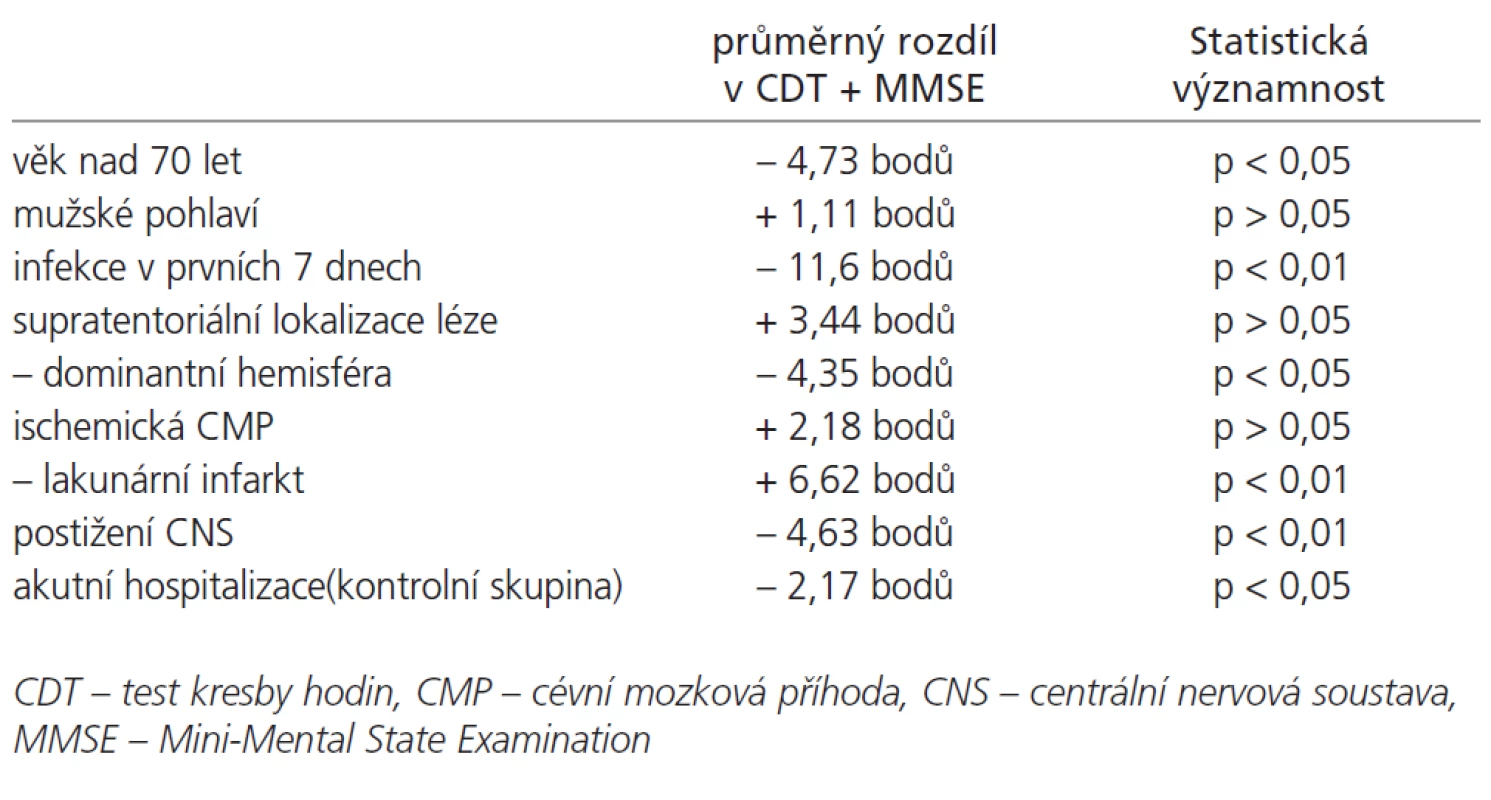
Graf 4. Korelace MMSE a CDT u pacientů v akutním stadiu CMP. 
Diskuse
V akutním stadiu CMP je až u 92 % pacientů detekovatelný kognitivní deficit. [2] V naší pilotní studii byl patologický nález alespoň v jednom z testů u 73,3 % pacientů. Toto zhoršení kognitivních funkcí je však u části pacientů reverzibilní. Dle retrospektivních i prospektivních studií postihuje vaskulární demence 9,2-30 % pacientů s CMP po 3 měsících od začátku příhody. [7-12] Také z naší studie je patrné, že u většiny pacientů s CMP dochází k úpravě kognitivní dysfunkce do 3 měsíců od začátku příznaků, a to především v prvních 30 dnech. Po 3 měsících byl patologický nález v MMSE a CDT detekovaný jen u 20,8 % pacientů.
Signifikantně lepší výsledky v kognitivních testech u pacientů s koronárním syndromem svědčí pro výrazný vliv samotného postižení mozku na kognitivní funkce v akutním stadiu onemocnění, a to bez závislosti na lokalizaci léze supratentoriálně vpravo či vlevo nebo infratentoriálně.
Signifikantně horší výsledky v kognitivních testech u pacientů s akutní koronární příhodou 2. den než 90. den při vyloučení infekce a akutního postižení centrální nervové soustavy pravděpodobně svědčí pro vliv akutního stresu z onemocnění a hospitalizace. V dostupných literárních zdrojích jsme však nenalezli větší studii, která by tuto domněnku potvrdila.
Podobně jako ve studiích u pacientů s vaskulární demencí byla i v naší studii rizikovým faktorem (RF) pro výraznější kognitivní deficit akutní infekce. U pacientů s infekcí byl zaznamenán signifikantně horší výsledek jak v MMSE, tak CDT. Výsledek odpovídá nálezům recentních studiích, v nichž byla infekce prokázána jako RF vzniku vaskulární demence [13].
Také fatické poruchy výrazně ovlivňují výsledky kognitivních testů. Z tohoto důvodu byli ve většině studií, zabývajících se vaskulární demencí, pacienti s afázií vyloučeni. Ve studiích, které sledovaly také pacienty s fatickou poruchou, byl prokázán významný vliv afázie na výsledky testů kognitivních funkcí a riziko vaskulární demence po CMP [7,10,14]. Do naší studie byli zařazeni jen pacienti s motorickou nebo amnestickou afázií. U těchto pacientů byly výsledky testů MMSE a CDT signifikantně horší než u ostatních pacientů s CMP.
Ačkoli nebyl v naší studii prokázán vliv lokalizace léze v pravé či levé mozkové hemisféře nebo infratentoriálně na výsledky kognitivních testů, byl patologický nález signifikantně častější u pacientů s teritoriálním nebo interteritoriálním ischemickým infarktem než u pacientů s lakunárním infarktem. Také pacienti s větším neurologickým deficitem měli výraznější postižení kognitivních funkcí. Oba výsledky svědčí pro vliv velikosti a lokalizace léze na kognitivní funkce u pacientů s akutní CMP.
Nejen pro vznik vaskulární demence, ale pro všechny typy demencí je věk jedním z nezávislých RF. Také v naší studii byl věk signifikantně spojen s tíží kognitivního deficitu. V dalších studiích bylo prokázáno mnoho jiných RF vzniku vaskulární demence u pacientů s CMP – arteriální hypertenze, především neléčená, diabetes mellitus, kouření, kardiovaskulární onemocnění včetně fibrilace síní, předchozí prodělaná CMP, hyperhomocysteinemie, ortostatická hypotenze, hyperfibrinogenemie, chronická infekce, elevace C-reaktivního proteinu nebo spánková apnoe [13]. Tyto faktory pravděpodobně mohou ovlivňovat kognitivní funkce i v akutním stadiu CMP. Vzhledem k malému počtu pacientů v naší pilotní studii však vliv těchto faktorů nemohl být studován.
Dalším významným faktorem, který může významně ovlivnit výsledky kognitivních testů je deprese. Z výsledků recentních studií vyplývá, že se deprese po cévní mozkové příhodě (post stroke depression) vyskytuje u 25 % až 79 % pacientů [15]. Tento faktor však v naší studii sledován nebyl, což je dalším omezením této pilotní studie.
Přestože se pomocí MMSE a CDT testují do určité míry rozdílné kognitivní funkce, u pacientů s akutní CMP byla zaznamenána signifikantní, velmi vysoká korelace mezi výsledky obou testů, a to ve všech kontrolách. Tyto výsledky ukazují na komplexní postižení kognice v prvních 3 měsících.
Vysoká korelace mezi soběstačností a kognitivním deficitem 3 měsíce od začátku příznaků CMP svědčí pro významný vzájemný vztah celkového neurologického deficitu (především hybného deficitu) s kognitivními funkcemi. Pacienti s výraznějším kognitivním deficitem měli také větší riziko úmrtí v prvních 3 měsících. Dle jiných studií je výraznější kognitivní deficit RF úmrtí také v období po 3 měsících od začátku příznaků [16,17].
Výsledky naší pilotní studie potvrzují závěry studií pacientů s vaskulární demencí - postižení kognitivních funkcí je u pacientů s akutní CMP velmi časté, částečně reverzibilní a je ovlivněno mnoha faktory [7-9,12,18-22]. Také po 3 měsících od vzniku CMP lze pozorovat změnu v kognitivních funkcích, ale u výrazně menšího počtu pacientů. Například del Ser et al referovali ve své práci 7,8 % pacientů s regresí a 14 % s progresí kognitivního deficitu mezi 3. a 24. měsícem od začátku příznaků [23].
Závěr
Pomocí MMSE a Testu kresby hodin lze detekovat v akutním stadiu CMP postižení kognitivních funkcí u 73,3% pacientů. Postižení kognitivních funkcí při vzniku CMP dobře koreluje s tíží neurologického deficitu (NIHSS). Kognitivní funkce v prvních týdnech po akutní CMP jsou ovlivněny mimo mozkové léze také vyšším věkem, infekcí, tíží neurologického postižení a pravděpodobně akutním stresem. Výsledky testů kognitivních funkcí jsou ovlivněny také přítomností fatické poruchy.
Během prvních 3 měsíců dochází k výrazné úpravě kognitivních funkcí. Pro reverzibilitu kognitivní dysfunkce v prvních týdnech po CMP není vhodné provádět screeningové vyšetření kognitivních funkcí dříve než 30 dní od začátku příznaků. Včasné rozpoznání kognitivního deficitu v akutní fázi CMP se zahájením terapie a komplexní rehabilitace může být přínosem pro rychlejší návrat pacientů po CMP do běžného života.
Přijato k recenzi: 3.4.2006
Přijato do tisku: 24.8.2006
Adresa ke korespondenci:
MUDr. David Školoudík
S.K. Neumanna 609/8
702 00 Ostrava
email: skoloudik@hotmail.com
Zdroje
1. Jirák R, Dušková J, Malá E, Neubauer K, Obenberger J. Demence. Praha: Maxdorf 1999 : 140-6.
2. Czepiel W, Lesniak M, Seniow J, Czlonkowska A. Characteristics and prevalence of cognitive impairment two weeks and a year after stroke onset. Book of abstracts of the Third International Congress on Vascular Dementia 2003 : 26 [abstract].
3. Folstein MF, Folstein SE, McHugh PR. Mini-mental state. J Psychiatr Res 1975; 12 : 189-198.
4. Dal-Pan G, Stern Y, Sano M, Mayeux R. Clock-drawing in neurological disorders. Behavioral Neurol 1989; 2 : 39–48.
5. Hendriksen Ch, Meier D, Klitzing W, Krebs M, Ermini-Funfschilling D, Stahelin HB. Early Dementia and the clock drawing test. Memory Clinic. Geriatric University Clinic, Basel: Internal Press 1993.
6. Ressner P, Ressnerová E. Test hodin, přehledná informace a zhodnocení škál dle Shulmana, Sunderlanda a Hendriksena. Neurol pro praxi 2002; 6 : 316-322.
7. Censori B, Manara O, Agostinis C, Camerlingo M, Casto L, Galavotti B et al. Dementia after first stroke. Stroke 1996; 27 : 1205-1210.
8. Lin JH, Lin RT, Tai CT, Hsieh CL, Hsiao SF, Liu CK. Prediction of poststroke dementia. Neurology 2003; 61 : 343-348.
9. Desmond DW, Moroney JT, Paik MC, Sano M, Mohr JP, Aboumatar S et al. Frequency and clinical determinants of dementia after ischemic stroke. Neurology 2000; 54 : 1124-1131.
10. Pohjasvaara T, Erkinjuntti T, Vataja R, Kaste M. Dementia Three Months After Stroke. Baseline Frequency and Effect of Different Definitions of Dementia in the Helsinki Stroke Aging Memory Study (SAM) Cohort. Stroke 1997; 28 : 785-792.
11. Hénon H, Durieu I, Guerouaou D, Lebert F, Pasquier F, Leys D. Poststroke dementia. Incidence and relationship to prestroke cognitive decline. Neurology 2001; 57 : 1216-1222.
12. Roman GC. Facts, myths, and controversies in vascular dementia. J Neurol Sci 2004; 226 : 49-52.
13. Roman GC. Vascular Dementia Prevention: A Risk Factor Analysis. Cerebrovasc Dis 2005; 20(Suppl 2): 91-100.
14. Barba R, Martínez-Espinosa S, Rodríguez-García E, Pondal M, Vivancos J, Del Ser T. Poststroke Dementia. Clinical Features and Risk Factors. Stroke 2000; 31 : 1494-1501.
15. Gupta A, Pansari K, Shetty H. Post-stroke depression. Int J Clin Pract 2002; 56 : 531-537.
16. Desmond DW, Moroney JT, Sano M, Stern Y. Mortality in patients with dementia after ischemic stroke. Neurology 2002; 59 : 537-543.
17. Tatemichi TK, Paik M, Bagiella M, Desmond DW, Pirro M, Hanzawa LK. Dementia after stroke is a predictor of long-term survival. Stroke 1994; 25 : 1915-1919.
18. Erkinjuntti T, Roman G, Gauthier S, Feldman H, Rockwood K. Emerging therapies for vascular dementia and vascular cognitive impairment. Stroke 2004; 35 : 1010-1017.
19. Skoog I. Status of risk factors for vascular dementia. Neuroepidemiology 1998; 17 : 2-9.
20. Schmidt R, Schmidt H, Fazekas F. Vascular risk factors in dementia. J Neurol 2000; 247 : 81-87.
21. Skoog I. Risk factors for vascular dementia: a review. Dementia 1994; 5 : 137-144.
22. Hassing LB, Johansson B, Nilsson SE, Berg S, Pedersen NL, Gatz M et al. Diabetes mellitus is a risk factor for vascular dementia, but not for Alzheimer’s disease: a population-based study of the oldest old. Int Psychogeriatr 2002; 14 : 239-248.
23. del Ser T, Barba R, Morin MM, Domingo J, Cemillan C, Pondal M et al. Evolution of Cognitive Impairment After Stroke and Risk Factors for Delayed Progression. Stroke 2005; 36 : 2670-2675.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2007 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Cervikální dystonie
- Repetitivní transkraniální magnetická stimulace a chronický subjektivní nonvibrační tinnitus
- Hladina D-dimerů u pacientů s akutní ischemickou cévní mozkovu příhodou
- Komentář k pilotní studii autorů D. Školoudíka et al. Změny kognitivních funkcí u pacientů s akutní cévní mozkovou příhodou testovaných pomocí Mini-Mental State Examination (MMSE) a Clock Drawing Test (CDT)
- Změny kognitivních funkcí u pacientů s akutní cévní mozkovou příhodou testovaných pomocí Mini-Mental State Examination a Clock Drawing Test
- Dekompresní kraniektomie jako léčba pro krysí model „maligního“ infarktu střední mozkové tepny
- Korelace mezi indexem IgG a oligoklonálními pásy při CSF vyšetření u pacientů s roztroušenou sklerózou
- Svalová biopsie u myotonické dystrofie v éře molekulární genetiky
- Chirurgická léčba hormonálně aktivních adenomů hypofýzy
- Analýza 1 775 pacientů léčených pro trigeminální neuralgii perkutánní radiofrekvenční rizotomií
- Ovlivnění exprese mRNA genu SMN2 inhibitory histonových deacetyláz a jejich vliv na fenotyp spinální svalové atrofie I. a II. typu
- Komentář ke článku Balcer LJ, Galetta SL, Calabresi PA et al. Natalizumab reduces visual loss in patiens with relapsing multiple sclerosis. Neurology 2007; 68: 1299–1304.
- Poliomyelitis-like syndrom na podkladě klíšťové meningoencefalitidy
- Satelitní anatomický worhshop Transtemporal approaches
- Trombóza esovitého splavu – současný pohled na diagnostiku a léčbu
- Léčba spánkové apnoe malých dětí dvojúrovňovým přetlakem v dýchacích cestách
- Polykací obtíže u difuzní idiopatické kostní hyperostózy
- Hennerici MG, Daffertshofer M, Caplan LR, Szabo K (Eds). Case Studies in Stroke. Common and Uncommon Presentations. Cambridge: Cambridge University Press 2007. 272 p. ISBN 0-521-67367-4.
- Lze bez pochybností interpretovat výsledky lumbálního infuzního testu?
- Zpráva z 8. sjezdu Evropské společnosti báze lební
-
Analýza dat v neurologii. IV.
Variabilita měření není vždy „chyba“ - Webové okénko
- XVIII. neuromuskulární sympozium
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Cervikální dystonie
- Hladina D-dimerů u pacientů s akutní ischemickou cévní mozkovu příhodou
- Trombóza esovitého splavu – současný pohled na diagnostiku a léčbu
- Repetitivní transkraniální magnetická stimulace a chronický subjektivní nonvibrační tinnitus
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



