-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Longitudinální sledování růstu po operačních reziduí afunkčních adenomů hypofýzy
Longitudinal Monitoring of the Growth of Post-Operation Non-Functioning Pituitary Adenomas
Objective:
Non-functioning pituitary adenomas (NFPAs) are regarded as benign, slowly growing tumors. However, aggressive proliferation is not exceptional, especially in younger patients. The aim of the study was to investigate the natural growth patterns of NFPAs and to identify the factors affecting volume progression. As part of the study, nuclear marker Ki-67 was tested as a potentially reliable indicator of postoperative remnant growth potential.Material:
The study is based on 105 patients operated for NFPAs between 2000 and 2007. The criteria for the inclusion in the study were met by 29 patients (22 men, 7 women).Results:
The extent of resection was approximately 75 % of the preoperative volume. Tumor consistency was not a limiting factor for the radicality of resection. Factors such as sex, presence of a cyst or invasive growth did not prove to have any significant effect on the level of radicality. Growth curves proved a statistically significant dependence of the rate of growth on the patient’s age. No correlation was found between the rate of growth and the Ki-67 proliferation index. Similarly, no relationship between the rate of growth, tumor invasiveness, sex and the presence of a cyst was observed. Invasiveness was not associated with higher Ki-67 values.Conclusion:
Based on the results, the following conclusions can be drawn: the rate of NFPAs growth depends on the patient’s age. This fact is useful for treatment strategy as well as postoperative monitoring. The Ki-67 proliferation marker, well-established in human oncology, cannot be considered as a reliable predictive marker of NFPAs growth in our recent study.Key words:
non‑functi oning pituitary adenomas – postoperative tumo ur remnant/ recurrence – proliferating marker Ki‑67
Autori: T. Česák 1; J. Náhlovský 1; T. Hosszú 1; S. Řehák 1; I. Látr 1; S. Němeček 1,2; J. Čáp 3; P. Ryška 4; P. Šuba 1,5; J. Cerman 5,1
Pôsobisko autorov: LF UK v Hradci Králové a FN Hradec Králové: 1Ne urochirurgická klinika, 2Ústav histologi e a embryologi e, 3II. interní klinika, 4Radi odi agnostická klinika, 5Ústav lékařské bi ochemi e
Vyšlo v časopise: Cesk Slov Neurol N 2009; 72/105(2): 115-124
Kategória: Původní práce
Súhrn
Cíle:
Afunkční adenomy hypofýzy (AAH) jso u považovány za benigní, pomalu rosto ucí nádory. Agresivní růst zvláště u mladších nemocných však není výjimko u. Cílem studi e bylo poznání přirozených zákonitostí růstu AAH se snaho u odhalit faktory ovlivňující jejich růstovo u potenci. So učástí studi e bylo zároveň zjistit, zda jaderný marker Ki‑67 může být spolehlivým ukazatelem růstové potence po operačních reziduí.Materi ál:
So ubor našich operovaných paci entů pro AAH od roku 2000 – 2007 čítal 105 paci entů. Stanovená kritéri a so uboru v so učasné době splnilo 29 nemocných (22 mužů, 7 žen).Výsledky:
Rozsah resekce dosáhl v průměru 75 % původního objemu adenomu. Radikalita výkonu nebyla konzistencí statisticky ovlivněna. Závislost pohlaví, přítomnosti cysty nebo invazivního růstu na radikalitu nebyla potvrzena. Růstové křivky konstruované na podkladě měřených objemů po operačních reziduí prokázaly na statisticky významné úrovni závislost rychlosti růstu na věku. Zatímco u paci entů starších 61 let byly zmapovány po uze pozvolnější růstové křivky, u skupiny nemocných mladších 61 let byly zaznamenány i agresivnější objemové progrese. Korelace rychlosti růstu a proliferačního indexu Ki‑67 nebyla statisticky potvrzena. Stejně tak nebyla prokázána závislost rychlosti růstu na invazivitě adenomu, pohlaví a přítomnosti cysty na předoperační magnetické rezonanci (MR). Invazivita adenomu nebyla spojena s vyšší hodnoto u Ki‑67.Závěr:
Na základě výsledků naší studi e lze konstatovat, že rychlost růstu AAH je ovlivněna stářím nemocného, a to tak, že s věkem klesá. Tento fakt přináší praktický příspěvek jak do léčebné strategi e, tak i do po operačního sledování. Marker proliferace Ki‑67, osvědčený v humánní onkologii, nelze v so učasném so uboru s jistoto u považovat za spolehlivý předpovědní ukazatel růstu AAH.Klíčová slova:
afunkční adenomy hypofýzy – po operační reziduum/ recidiva – marker proliferace Ki‑67Úvod
Nádorová onemocnění hypofýzy i přes svou relativní vzácnost představují medicínský, sociální a v neposlední řadě i ekonomický problém. S rozvojem diagnostických metod v medicíně je záchyt tohoto onemocnění v dnešní době častější. Rutinním vyšetřením hypofyzárních patologických procesů se stala MR centrovaná na oblast tureckého sedla.
Pituitární adenomy reprezentují 10 až 15 % všech intrakraniálních tumorů. Preva-lence tohoto onemocnění je 20 nemocných/100 000 obyvatel, incidence kolísá mezi 1,5–2 případy/100 000 obyvatel/rok. Mezi nemocnými převažují ženy s maximem ve 3.–4. deceniu. AAH tvoří asi 25–40 % těchto lézí [1–3], vznikají obvykle u pacientů přes 40 let věku s mírnou převahou u mužů [4,5].
Na vzniku adenomů se podílejí molekulární a genetické změny s významnou spoluúčastí růstových faktorů a jejich receptorů. Histologicky působí tyto nádory rozmanitě, což ilustruje cytodiferenciační schopnosti hypofýzy. Rozvoj imunohistochemických metod umožnil jejich další členění. Tzv. němé adenomy (silent adenomas), tvořící výrazně větší část, jsou histologicky nerozlišitelné od řídce granulovaných forem jednotlivých klinických funkčních typů. Vytvářejí hormony v množstvích, které nepůsobí klinickou symptomatiku, protože nejsou ve významné míře exportovány do krevního oběhu, a pokud do jisté míry ano, pak jde o strukturálně „méněcenné“, fyziologicky a klinicky neúčinné hormonální entity. Proto je imunohistochemie (IHC) může detekovat ve tkáni (preparátu). Menšinu klinicky afunkčních adenomů představují tzv. adenomy z nulových buněk (null cell adenomas), které metodami IHC nevykazují přítomnost žádného z hypofyzárních hormonů ve tkáni adenomu, a tudíž ani nejsou jejich zvýšené hladiny v cirkulující krvi [6,7]. Afunkční adenomy se klinicky většinou uplatňují až příznaky z útlaku okolních struktur. Jejich hypofunkční endokrinopatie je klinicky nenápadná [8].
Rezidua pituitárních adenomů jsou registrována při pooperačních grafických kontrolách až v 1/3 případů v závislosti na konzistenci tumoru, počáteční velikosti adenomu a na invazivitě adenomu, tedy schopnosti prorůstat do sousedních kompartmentů tureckého sedla. Přítomnost invazivního chování adenomu s velikostí procesu vzrůstá. U mikroadenomů je podle literárních pramenů pozorována ve 24%, ve větší míře ji můžeme vysledovat u makroadenomů nebo gigantických adenomů (70%) [9]. Množství recidiv je dále ovlivňováno typem operačního výkonu a v neposlední řadě zkušeností operačního týmu.
Předpoklady a cíle studie
Při formulaci cílů našeho sledování pooperačních zbytků afunkčních AAH jsme vycházeli z následujících hypotéz:
- a) afunkční adenomy hypofýzy jsou růstově heterogenní skupinou. Je velmi málo literárních informací o zákonitostech přirozeného růstu těchto adenomů. Jejich růst je považován za konstantně exponenciální bez ohledu na iniciální objem [10];
- b) není dořešen význam invazivity, věku nemocného nebo pohlaví na proliferační potenci afunkčních adenomů;
- c) reziduum adenomu může být indikací k reoperaci, k pooperačnímu ozáření nebo může být doporučeno ke sledování pomocí MR v časovém intervalu;
- d) prediktivní hodnota proliferačních markerů je u AAH v literatuře stále předmětem diskuze.
Na základě výše formulovaných předpokladů jsme stanovili konkrétní cíle naší studie:
- a) sledování růstové dynamiky pooperačních reziduí AAH pomocí MR s výpočtem jejich objemů a stanovením TVDT (Tumor Volume Doubling Time, předpokládaný čas zdvojnásobení objemu adenomu) [10];
- b) korelace rychlosti růstu reziduí s dalšími faktory – věk nemocného, konzistence tumoru, pohlaví, invazivní způsob růstu;
- c) zjištění, zda sledovaný proliferační marker (Ki‑67) je dostatečně spolehlivým ukazatelem růstové aktivity afunkčních adenomů;
- d) individualizace pooperačního sledování na základě multifaktoriálního vyhodnocení prediktivních parametrů růstu;
- e) stanovení indikačního algoritmu časného pooperačního ozáření.
Materiál a metody
Kritéria souboru
Na základě stanovených cílů sledování jsme do souboru zahrnuli pacienty, kteří aktuálně splňovali následující kritéria:
- a) histologicky verifikovaný afunkční adenom hypofýzy;
- b) detekovatelné reziduum adenomu (minimálně 100 mm3) na pooperační MR dva a více měsíců po operaci;
- c) provedení další kontrolní MR v časovém intervalu delším než tři měsíce od prvního vyšetření;
- d) absence radioterapie nebo jiné adjuvantní léčby, která by zkreslovala přirozený růst adenomu;
- e) imunohistochemická detekce sledovaného markeru z materiálu získaného při operaci pro biopsii, a to především proliferačního antigenu Ki‑67, a dále IHC endokrinní charakteristika těchto adenomů.
V letech 2000 až 2007 jsme operovali pro afunkční adenomy hypofýzy celkem 105 pacientů. Provedeno bylo celkem 124 operací. Převažujícím typem operačního výkonu byla transnazální adenomektomie ve 111 případech (89,5 %). Transkraniální přístup byl zvolen ve 13 případech (10,5 %). Celkově byl na kontrolní MR zaznamenán pooperační zbytek adenomu u 57 případů (46 %), z toho bylo 19 nemocných indikováno k radiochirurgii Leksellovým gama nožem (33 %). U osmi nemocných s pooperačním reziduem chyběla druhá MR v časovém odstupu minimálně tři měsíce od prvního vyšetření. U jednoho pacienta nebylo možné z technických důvodů zpracovat preparát k výpočtu proliferačního indexu.
Užší soubor nemocných splňujících výše stanovená kritéria čítal do konce roku 2007 celkem 29 pacientů, z toho 22 mužů a 7 žen. Tito pacienti nepodstoupili kromě chirurgické intervence žádnou další adjuvantní terapii a v pooperačním období absolvovali dvě kontrolní MR (osm pacientů, 28 %), případně tři vyšetření (21 pacientů, 72 %) umožňující sestavení růstové křivky rezidua. Průměrný věk souboru dosáhl 62,9 roku (nejmladší 41 let, nejstarší 77 let), u mužů 63,0 a u žen 62,5 let.
Makroadenomy byly na základě předoperačního grafického nálezu rozčleněny podle Hardyho klasifikace (schéma 1, graf 1) [11,12]. Stupeň II byl klasifikován na předoperační MR u celkem devíti nemocných (32 %), stupeň III u 20 nemocných (69 %). Do stadia B bylo zařazeno pět nemocných (17 %), do stadia C 14 pacientů (49 %) a do stadia D (asymetrická supraselární propagace) devět pacientů (31 %). Kritéria čisté paraselární invaze ve stadiu E splňoval pouze jeden pacient (3,5 %). Grafické nebo histologické známky invazivity procesu jsme identifikovali celkem u 22 nemocných (76 %). Převažujícím operačním výkonem byla transnazální operace ve 26 případech (90 %). Subfrontální operační přístup byl indikován u tří nemocných (10 %). O primooperaci se jednalo v 19 případech (65,5 %), devět pacientů bylo operováno podruhé (31 %), jeden nemocný potřetí (3,5 %).
Schéma 1. Chirurgická klasifikace adenomů hypofýzy dle Hardyho. 
Graf 1. Klasifikace našeho souboru dle Hardyho. Největší zastoupení představují afunkční makroadenomy stupně III (69 %) a stadia C a D (80 %). 
Histopatologická diagnóza a kvalitativní IHC charakteristika vzorků nádorové tkáně z operací byla pro jednotu v posuzování provedena vždy jedním a tímtéž zkušeným neuropatologem. Kromě klasické tinkční histochemie byla provedena s použitím IHC technik jednak detekce antigenu Ki‑67, jednak všech adenohypofyzárních hormonů či jejich podjednotek (alfa + beta) u heterodimerních glykoproteinových hormonů. Zvláštní zřetel byl kladen na separátní IHC detekci specifických beta‑podjednotek obou gonadotropinů (FSH a LH) a na jejich společnou alfa‑podjednotku (sdílenou též dimerním TSH). Právě tyto hormonální entity se velmi často vyskytují v klinicky „němých“ adenomech. Pro jejich vzájemně defektní relace se buď netvoří finálně účinné kompletní hormony, nebo dochází jen k jejich buněčné expresi v gonadotrofech, aniž jsou secernovány do krevního oběhu v klinicky významných kvantech. Hormonově specifickou charakteristiku zkoumaného souboru adenomů od 29 operovaných nemocných lze shrnout následujícím výčtem. Pouze dva z nich (7 %) měly totální absenci jakéhokoliv hormonu a cytologicky patřily k adenomům z nulových buněk, místy s onkocytární přeměnou. Ve všech ostatních 27 případech (93 %) byly přítomny některé z výše uvedených podjednotek a tyto nádory lze tedy klasifikovat jako „klinicky němé gonadotrofinové adenomy“. Z nich ve dvou případech byla přítomna beta‑FSH, čtyři měly kombinaci 2krát „beta“ (tj. pro FSH i LH) a 21 bylo pozitivních dokonce pro všechny tři podjednotky (obě „beta“ + „alfa“). Tento plurihormonální fenomén byl ještě ve dvou případech akcentován nálezem dalších hormonů, a to TSH a TSH + PRL.
MR zobrazení k výpočtu objemu rezidua adenomu
K odečtu pooperačního rezidua byla standardně používána MR v koronárních nativních T1 vážených skenech s tloušťkou řezů 3–4mm. Data exportovaná ve formátu Dicom byla dále zpracována plánovací stanicí neuronavigace firmy BrainLab s bitmapovou manuální segmentací (obr. 1). Do výpočtu objemu adenomu nebyla zahrnována cysta ani krvácení, odečítána byla i fasciální plastika o objemu cca 50 mm3. Výpočet TVDT ve dnech, tedy času předpokládaného objemového zdvojnásobení tumoru, byl prováděn podle vzorce:
TVDT= t × log 2/ log (Vt/Vo)
(TVDT: Tumor Volume Doubling Time, t: čas mezi MR ve dnech, Vo: iniciální objem tumoru v mm3, Vt: konečný objem tumoru v mm3) [10].
Obr. 1. Výpočet objemu rezidua adenomu pomocí bitmapové manuální segmentace (neuronavigace fy BrainLab) s výsledným prostorovým zobrazením procesu. 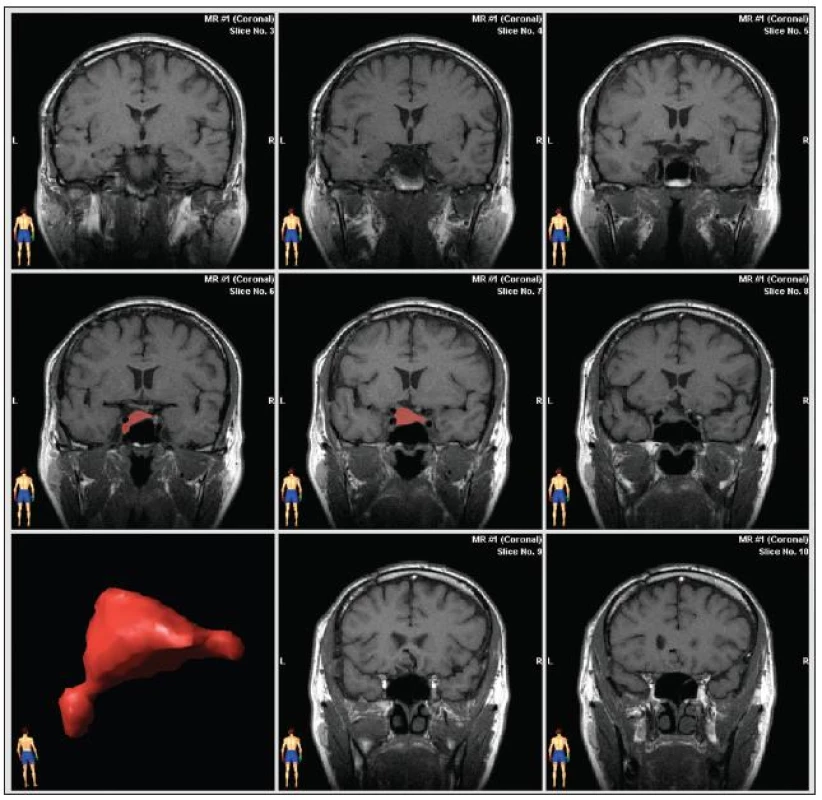
Histologie; imunohistochemie (IHC)
Formalinem fixované parafinové řezy (6 mikrometrů) byly zpracovány obvyklou technikou a použity jak pro standardní tinkční histochemii (hematoxylin‑eozin, Goldbergův trichrom, stříbření na retikulin podle Gömöriho), tak pro IHC detekci všech antigenů – hormonů i proliferačního markeru Ki‑67. Pro obnažení epitopů byla uplatněna tepelná aktivace (mikrovlnná, 700 W po dobu 15 min) v citrátovém pufru pH 6. Po IHC detekci byla buněčná jádra slabě dobarvena hematoxylinem (Weigert), zejména pro modré zobrazení negativních jader vůči imunoperoxidázové pozitivitě antigenu Ki‑67.
Index proliferace
Antigen Ki‑67 byl zvolen jako relevantní proliferační marker, který je běžně užívaný v onkochirurgické praxi u jiných typů humánních neoplázií. Jedná se o nukleární protein preferenčně exprimovaný během aktivních fází buněčného cyklu (G1, S, G2 a M fáze), v neaktivní, klidové (G0) fázi není přítomen. K jeho IHC detekci bylo použito monoklonální myší antihumánní protilátky (klon MIB-1, Code No. M7240, DAKO).
Primární protilátky pro IHC hypofyzárních hormonů
Disponovali jsme monoklonálním typem protilátky, a to proti: ACTH (C‑terminálně specifická, klon 02A3, DAKO), GH (MU 028-UC, BioGenex), následují od firmy IMMUNOTECH (uvedena katolog. čísla) proti: PRL (0371), beta‑TSH (0370), beta‑FSH (0373), beta‑LH (0374), alfa‑podjednotka (0375).
Vizualizační systém, vesměs imunoenzymový (případně imunofluorescenční), byl založen na sekundární protilátce značené biotinem a na streptavidinu konjugovaném s peroxidázou, případně s vhodným fluorochromem. Jako chromogen pro peroxidázu byl nejčastěji použit diaminobenzidin (System LSAB + HRP; Liquid DAB, Substrate – chromogen solution, DakoCytomation, kity kat. č. K0690 a K3468).
Mikroskopie
Kromě standardního diagnostického odečítání a hodnocení preparátů, včetně subjektivního počítání indexu Ki‑67 s přístupem na bázi „hot spots“ (viz níže), bylo použito automatického (softwarového) čítání pozitivních a negativních jader v následující technické sestavě: Mikroskop NIKON Eclipse 80i, Color Digital Kamera – Head DS-Fi1“ a software NIS Elements AR. Pro vhodný záběr snímaného pole kamerou (s ohledem na jeho zobrazení v počítači, rozměry a počet buněk na snímku) byl zvolen objektiv 20×. Proliferační index Ki‑67 byl stanovován jako procentuální podíl imunopozitivních jader k celkovému počtu jader (obr. 2).
Obr. 2. Ukázka preparátu s velmi vysokou četností Ki-67 imunopozitivních (hnědočerných) jader. 
Metodika zjišťování indexu Ki‑67
Byly použity v zásadě dva postupy, lišící se jak přístupem, tak technickým provedením:
- těžištěm informací z odečítaného preparátu může být v histopatologii jednak místo co možná nejvíce charakteristické, a/nebo s nadbytkem určitého typického znaku v některých lokalitách (metoda „hot spots“, HS). Tak zde bylo cíleně vybráno několik zorných polí s maximální četností pozitivních jader, a tato místa byla vyhodnocena. Je přirozené, že takto získané percentuální hodnoty indexu Ki‑67 z menšího počtu polí byly (ve srovnání s metodou 2 podstatně vyšší, a také více zatíženy možnými nepřesnostmi).
- použití softwarového čítání pozitivních a negativních jader dává možnost statisticky pracovat s vysokými hodnotami kumulativně načítaných objektů (sofwarová metoda, SM). Tato metoda umožňuje rozsáhleji „skenovat“ adenom a využít tak optimálně vysokého počtu jeho zorných polí. Tedy postup je jaksi spravedlivější, protože odhlíží od četnosti v některých polích a vybírá je systematicky za sebou. O to více je však nutné důsledně respektovat předem stanovená pravidla korektního sběru dat. Musí být jisté, že v zorném poli převládá spolehlivě rozpoznatelná struktura adenomu. Je nutno systematicky vynechávat pole, v nichž je tkáň výrazně postižena prokrvácením nebo regresivními změnami. Předem je nutno orientačně prohlédnout a podle plošné velikosti preparátu odhadnout počet využitelných zorných polí. Podle tohoto aspektu potom rozhodnout, zda bude skenováno každé vyhovující zorné pole, nebo každé druhé, třetí atd. Pro tuto část naší studie jsme si stanovili numerické vodítko, že minimální počet všech načtených buněk by měl být alespoň kolem 20 000, optimálně do 30 000 a že by neměl podstatně překročit 40 000 buněk.
Výsledky
Rozsah resekce byl v souboru stanoven na základě srovnání předoperační a pooperační MR a dosahoval v průměru 75 % (medián 81 %) u všech výkonů. U primárních operací (19 výkonů) činila v průměru 76 % (medián 81 %), u druhých operací (devět výkonů) 70 % (medián 74 %). U třetí operace byla překvapivě resekce až 98 % i díky příznivé konzistenci adenomu (jeden výkon). Celkově u opakovaných operací (10 výkonů) bylo dosaženo 72% zmenšení iniciálního objemu procesu. Objektivní graficky hodnocená radikalita operačního výkonu nekorelovala překvapivě s konzistencí procesu (p = 0,37), přítomností cysty (p = 0,31), invazivitou (p = 0,8), pohlavím (p = 0,65) a nekorespondovala ani s věkem operantů (p = 0,4).
Rychlost růstu pooperačních reziduí AAH byla kvantifikována výpočtem předpokládaného času zdvojnásobení objemu procesu (TVDT), jehož matematickým předpokladem je konstantně exponenciální růst adenomu. Tato hodnota kolísala v našem souboru v rozmezí od 496 do 30 447 dnů, průměrná hodnota dosáhla 5 146 dnů (medián 3 127 dnů). U tří nemocných měla růstová křivka mezi prvním a druhým vyšetřením MR klesající tendenci. Zpracováním těchto údajů (graf 2) jsme odhalili statisticky významnou korelaci (Pearsonův korelační koeficient) rychlosti růstu rezidua na věku nemocných (TVDTr, inverzní hodnota TVDT s p = 0,006, přirozený logaritmus TVDT s p = 0,09, směrnice přímky proložené závislostí 2–3 hodnot logaritmu objemu rezidua na době od operace mající p = 0,009). Křivky růstu byly arbitrážně rozděleny do dvou věkových kategorií. Strmější nárůsty se objevily u nemocných ve skupině pod 61 let věku. U pacientů starších 61 let byly pozorovány pouze pozvolnější růstové progrese (graf 3).
Graf 2. Korelace rychlosti růstu (převrácené hodnoty TVDT) na věku nemocných. Pearsonův korelační koeficient = – 0,498; p = 0,006. 
Graf 3. Růstové křivky u nemocných mladších 60 let (vlevo) a starších 61 let (vpravo). V mladší věkové skupině byly izolovaně pozorovány strmější růstové linie. U starších nemocných se objevily pouze pomalejší růstové křivky. 
Vztah mezi rychlostí růstu a proliferačním indexem antigenu Ki‑67 se naopak v našem souboru nepodařil na statisticky významné hladině prokázat, a to ani s použitím obou odečítacích technik z imunohistochemického preparátu (p = 0,75 HS/p = 0,52 SM, Pearsonův korelační koeficient – graf 4). Obě metody výpočtu indexu pozitivních jader byly přitom shledány jako vzájemně korelující (p = 0,00022). Medián proliferačního indexu Ki‑67 získaného metodou „hot spots“ činil 1,5 % s izolovanou maximální hodnotou 25 % a minimální 0,1 %. Softwarová metoda odečtu postihující celý preparát dosáhla v mediánu hodnoty Ki‑67 0,19 % s maximem 1,98 % a minimem 0,05 %.
Graf 4. Korelace rychlosti růstu adenomu (převrácená hodnota TVDT) na indexu Ki-67 (percentuální zastoupení imunopozitivních jader v preparátu). HS: metoda „hot spots“ (Pearsonův korelační koeficient = 0,063; p = 0,747), SM: softwarová metoda (Pearsonův korelační koeficient = 0,124; p = 0,521). 
Rychlost růstu reziduí AAH nejevila v naši studii závislost na pohlaví (p = 0,54), na přítomnosti cysty na předoperační MR (p = 0,18) a nezávisela ani na invazivitě procesu (p = 0,38). Invazivně se chovající AAH nevykazovaly vyšší pozitivitu antigenu Ki‑67 (p = 0,29 HS/p = 0,96 SM, Mann‑Whitney test).
Diskuze
Léčba operačních reziduí AAH představuje v literatuře stále diskutovaný problém s množstvím nezodpovězených otázek. Už samotná jejich diagnostika využívající nejmodernější grafické metody je zatížena množstvím nepřesností. Stejně tak existuje mnoho literárních nejistot v pohledu na spolehlivost proliferačních faktorů jako předpovědních ukazatelů rychlejšího růstu reziduí. Všeobecně jsou afunkční adenomy považovány za benigní, pomalu rostoucí léze, u nichž není agresivní růst, zvláště u mladších věkových skupin, výjimkou. Růst adenomů je všeobecně dán poměrem proliferační a regresivní složky, kterou představuje nekróza a apoptóza. Přirozená buněčná smrt se přitom podle některých autorů uplatňuje na regresivních procesech jen 1,8% podílem [13]. Na rozdíl od hormonálně aktivních adenomů je léčbou první volby u AAH mechanická cytoredukce procesu, tedy operace.
Převažujícím operačním přístupem byla v našem souboru selektivní transnazální adenomektomie. Propracovaná mikrotechnika je doposud považována pro pacienta za nejšetrnější, kosmeticky nejpříznivější a zároveň nejbezpečnější [14]. Na našem pracovišti je používána v zásadě ve dvou variantách. První přístup spočívá v submukózní separaci podél septa v pravé nosní dírce s odlomením přepážky před sfenoidálním rostrem na levou stranu. Druhý, direktní přístup proniká přes nosní sliznici až těsně před klínovou dutinou a šetří tak mukózu v oblasti septa [15]. Následná mediální sfenoidotomie s přístupem ke spodině tureckého sedla je již v obou případech shodná.
Transfenoidální operační přístup volíme i v případech výrazné supraselární porce adenomu, kdy se snažíme intrakavitární kyretáží bazální porce tumoru snížit tlak na chiazma či jiné supraselární struktury. V dalším období s pomocí likvorové pulzace dochází k postupnému kolapsu pouzdra a k jeho oddálení od zrakových nervů. To platí v situaci, kdy kapsula procesu není tuhá a zároveň není fixována fibroplastickou reakcí k supraselárním strukturám. Zásadním limitem radikality transfenoidální resekce zůstává konzistence tumoru, což částečně potvrzují i výsledky našeho souboru. V zájmu bezpečnosti operačního výkonu nesmějí nástroje vyvíjet nepřiměřené násilí na citlivé okolní struktury sedla pro riziko jejich poranění [16]. V situacích fibrózních adenomů tužší konzistence užíváme mnoho let laserovou evaporizaci procesu s defokusovaným paprskem, což přispívá k vyšší radikalitě. O to se snažíme i použitím zvýšeného intrakraniálního tlaku v závěru operace, což docilujeme nastavením PEEPu (Positive End‑Expiratory Pressure, pozitivní tlak na konci exspiria) na anesteziologickém přístroji ve snaze natlačit reziduální supraselární porci do sedla [8]. V posledních letech zvyšujeme úspěšnost operací i asistovanou endoskopickou technikou, která umožní přehlédnout a následně cíleně odstranit skryté reziduální porce tumoru. Velice slibnou technikou se perspektivně jeví kombinace endoskopického přístupu s peroperační MR umožňující grafické upřesnění aktuální situace v místě operace [17]. Transkraniální operační přístup rezervujeme pro adenomy, kde je supraselární porce tumoru výrazně asymetrická s malou pravděpodobností kolapsu rezidua do sedla (obr. 3). Dále jej indikujeme u reoperací v případech tužší konzistence adenomu.
Obr. 3. Snímek MR zobrazuje gigantický adenom hypofýzy u 54letého muže. Tumor byl radikálně odstraněn transkraniálním přístupem. Nemocný byl dále sledován pro objemovou progresi drobného rezidua (Vo = 508 mm<sup>3</sup>, Vt = 1 235 mm<sup>3</sup>, t = 815 dnů) a následně transnazálně reoperován. 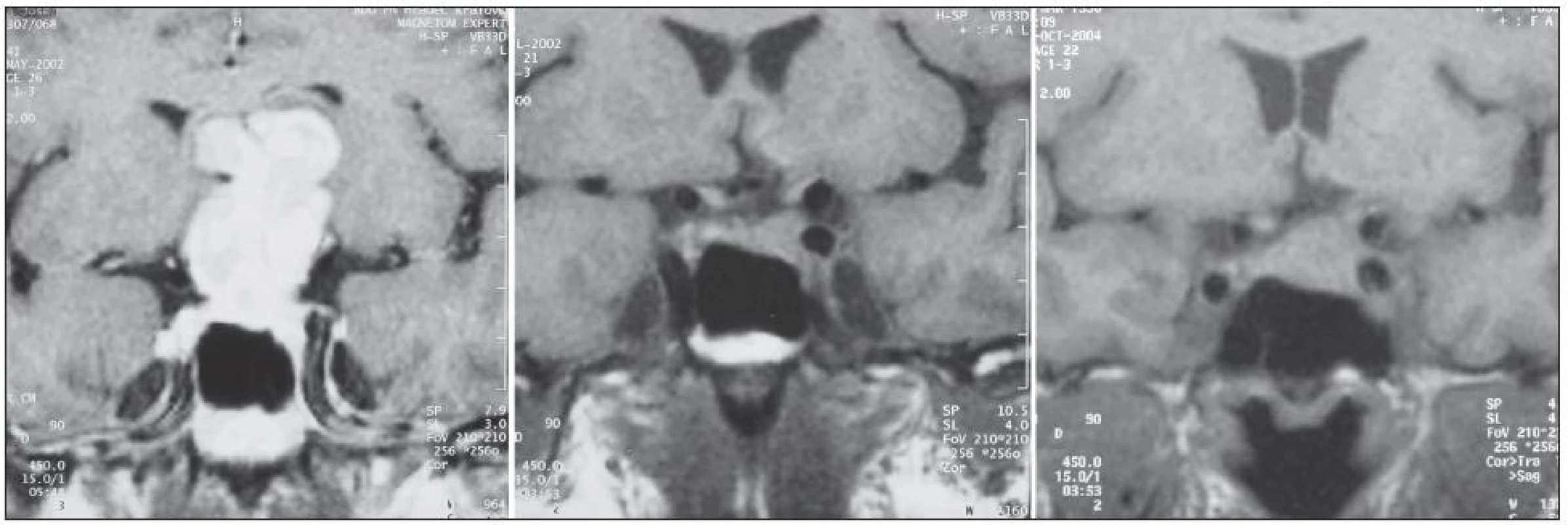
Diagnostika grafického rezidua adenomu pomocí MR činí obtíže nejenom zkušeným neuroradiologům, ale i samotným neurochirurgům. Kontura adenomu je často i po radikálním výkonu v časném pooperačním období velmi podobná jako na předoperačním snímku. Liší se ve většině případů pouze signálovou nepravidelností v centru procesu v T1 vážených obrazech. Ta koresponduje s přítomností reziduální hemoragie, edematózních a exsudativních změn v pouzdru adenomu. Dále je tato signálová nehomogenita způsobena vloženým hemostatickým materiálem nebo fasciální plastikou používanou k uzávěru spodiny sedla. Normální komprimovaná hypofyzární tkáň není v této fázi prakticky diferencovatelná [18,19]. Steiner et al ve své studii porovnávali předoperační a časné pooperační snímky MR po subfrontálních nebo transnazálních adenomektomiích a došli k závěru, že do tří měsíců po operaci je nález v oblasti sedla jen velmi obtížně hodnotitelný [20]. Další autoři se shodovali v tom, že obraz na MR se dynamicky vyvíjí díky regresivním procesům v sedle ještě do devíti měsíců po operaci [21] s jeho přibližnou stabilizací kolem čtvrtého pooperačního měsíce [22]. U souboru našich pacientů s pooperačními zbytky jsme nastavili minimální interval kontrolní MR do dvou měsíců od operačního výkonu. Standardně jsme prováděli nativní T1 vážené obrazy v koronární projekci s objemovým odečtem rezidua pomocí bitmapové manuální segmentace neuronavigačního přístroje. Na grafickém hodnocení pooperační MR a kvantifikaci rezidua adenomu se spolupodílel neuroradiolog.
Procento recidiv literárně kolísá u AAH mezi 10–32 %, přičemž chirurgická úspěšnost výkonu bývá dosažena až v 80–90 % případů [23–27]. U funkčních, hormonálně aktivních pituitárních nádorů kolísá procento úspěšné chirurgické léčby mezi 30–60 % [28–30]. Množství recidiv do značné míry závisí na radikalitě operačního výkonu, jeho počáteční velikosti a invazivitě procesu, tedy jeho schopnosti pronikat do sousedních kompartmentů tureckého sedla. Podle literárních pramenů zvyšuje paraselární propagace procesu množství recidiv [31,32].
V našem souboru nebyla invazivita rozhodujícím faktorem pro radikalitu. Převážně se totiž jednalo o infraselární propagaci tumoru s peroperační makroskopickou verifikací nebo histologickým průkazem durální infiltrace. Procento našich reziduálních nálezů na MR je díky přísnějšímu grafickému hodnocení vyšší než udávaná literární rozmezí. V užším souboru 29 nemocných, kteří splňovali kritéria studie, dosahoval rozsah resekce 76 % u prvních operací, u reoperací klesal jen minimálně na 72 %. Na tomto místě je třeba uvést i fakt, že se jednalo ve velké míře o makroadenomy stadia C a D dle Hardyho (80 %), navíc v 66 % smíšené konzistence, u nichž je dosažení kompletní resekce obtížnější. Dalším důvodem je skutečnost, že jsme se snažili poctivě identifikovat i minimální reziduální objemy s velikostí kolem 100 mm3, což je podle našeho názoru díky výše popisovaným grafickým obtížnostem velmi přísný limit. Časem je totiž zřejmé, a napovídají tomu i naše výsledky, že se tyto objemy v průběhu dalších let nezvětšují. Na základě tohoto poznatku se můžeme domnívat, že se zřejmě nejedná o reziduální hmotu adenomu, ale spíše o diagnostický artefakt přetrvávajících pooperačních změn. Obdobné vysvětlení máme i pro klesající objemový trend u tří pooperačních reziduí v čase mezi první a druhou MR, kdy kapsula adenomu ještě nedosáhla svého objemového minima. Přikláníme se tak k literárnímu názoru, že definitivního ustálení grafického nálezu na MR bývá dosaženo vlivem regresivních změn až s odstupem 3–4 měsíců od operačního výkonu [19]. Situace v operovaném sedle je v tomto časovém odstupu již přehlednější a odečet rezidua přesnější. K odlišení zdravé hypofyzární tkáně od adenomu napomáhá podání kontrastní látky gadolinia, což ale nebylo proveditelné z různých důvodů u všech pacientů, proto jsme standardně při vykreslování objemu zbytků vynechávali zadní lem tloušťky 2mm přiléhající k dorzu sedla.
S přihlédnutím k výše zmíněným faktům se nám množství pooperačních reziduí našeho souboru zdá jako přiměřené a akceptovatelné.
Hlavním cílem naší studie bylo zkoumání závislosti růstu AAH na faktorech, jako jsou věk, pohlaví, přítomnost cysty nebo invazivita adenomu. Sestavením růstových křivek adenomů jsme zjistili, že sledovaná rezidua rostou přibližně exponenciálně, a to bez ohledu na počáteční objem. Ve věkové kategorii nemocných pod 61 let jsme přitom pozorovali různé rychlosti růstu, od pomalých až po strmé, agresivně rostoucí rezidua. Naopak u nemocných starších 61 let vykazovaly všechny růstové křivky pomalejší objemové nárůsty v čase. Podařilo se nám tak potvrdit věkovou závislost na rychlosti růstu AAH s přelomovým bodem kolem 60 let věku, což je v souladu s pozorováním i jiných autorů [10]. Toto zjištění má jistě praktický dopad v tom, že u starších věkových skupin nemusí být naše snaha o operační radikalitu tak důsledná, a to s vědomím, že ponechaný zbytek adenomu již pacienta neohrozí. Výpočet TVDT, který předpokládá pozvolný exponenciální růst adenomu bez akcelerací (prokrvácení, tvorba cyst), svádí k určitým časovým předpovědím stran potencionálního ohrožení zrakových nervů. Budeme‑li důvěřovat této matematické hypotéze, potom s určitou pravděpodobností dokážeme předpovědět dobu ohrožení zrakových nervů a přizpůsobíme tomu i frekvenci kontrolních vyšetření. Tato snaha o individualizaci pooperačního sledování nemocných přináší nepochybně i efekt ekonomický v redukci nadbytečných vyšetření MR.
Invazivita pituitárních adenomů patří v literatuře ke stále nedořešeným tématům. Předmětem diskuzí mezi odborníky zůstává jak její biologická podstata, tak i její možný přínos v odhalení rychleji rostoucích adenomů. Morfologické známky agresivního chování typické pro jiné humánní neoplazie, jako jsou nukleární pleomorfizmus, cytologické atypie, vyšší buněčnost, nekróza nebo rychlá mitotická aktivita, nejsou u dobře diferencovaných pituitárních lézí vyjádřeny. Podobně problematická je i její identifikace spoléhající často jen na nepřímé známky invazivity procesu. To platí zvláště v situacích paraselární penetrace adenomu, kde je možnost histologického vyšetření limitovaná. U našeho souboru byla invazivita v souladu s literárním doporučením zjišťována na základě peroperačních nálezů, grafických známek na MR nebo histologickým vyšetřením durální infiltrace buňkami adenomu [32–34]. Penetrace tumoru do kavernózního sinu byla pouze předpokládána podle předoperační MR, kdy byl hodnocen přesah procesu přes obvod vnitřní karotidy. Řídili jsme se všeobecně uznávanou klasifikací podle Hardyho, i když se ve své původní podobě nezabývala izolovanou paraselární propagací. Ta byla zohledněna až o několik let později doplněním stadia E dalšími autory [35,36]. V detailech byla invazivita do kavernózního sinu potom dopracována Knospem et al, kteří ji rozčlenili na stupně 0 až 4 [37].
Při korelaci rychlosti růstu operačních reziduí AAH a invazivity adenomu nebyla shledána statisticky významná závislost. Jinými slovy, našich 22 invazivně se chovajích adenomů nerostlo rychleji než sedm adenomů, kde invaze do sousedních kompartmentů nebyla prokázána. K podobnému závěru došli Tanaka et al ve své studii porovnávající růstovou aktivitu 29 ohraničených reziduí a 11 invadujích [10]. Naopak k odlišného závěru se ve své studii dopracovala skupina kolem Thapara, kde dosahovala hodnota Ki‑67 u neinvazivních procesů 1,34 %, u invazivních 4,66 % a 11,9 % u pituitárních karcinomů [32]. Hranice proliferačního indexu mezi invazivními a neinvazivními adenomy tak odpovídala v této práci 3 % při senzitivitě 73 % a specificitě 97 %. Soubor přitom srovnával proliferaci u 37 neinvazivních, 33 invazivních adenomů a sedmi pituitárních karcinomů. V našem sledovaném souboru invazivita nesouvisela rovněž s věkem ani přítomností cyst na předoperačním MR. Statisticky významná korelace nebyla nalezena ani ve vztahu k proliferačnímu markeru Ki‑67, tak jak se to naopak podařilo prokázat jiným autorům [32,38–41].
Snaha předpovědět růst adenomů a odhalit rizikové faktory recidiv vedla mnoho pracovišť ke studiu proliferačních a jiných markerů, které mají své uplatnění v humánní onkochirurgii (marker onkogeneze p53, PCNA – Proliferating Cell Nuclear Antigen: proliferační jaderný antigen, bromodeoxyuridin, topoisomeráza II alfa, proteinkináza C) [31,42–51]. Jako relevantní proliferační ukazatel se v mnoha studiích uplatňoval antigen Ki‑67. Jeho četnější výskyt byl spojen s aktivnějším růstem či vyšším procentem recidiv adenomů [45,52–55], případně reflektoval nižší proliferační potenci u STH adenomů předléčených somatostatinem [56]. Honneger se svými spoluautory na souboru 23 nemocných definovali přelomovou hranici Ki‑67 na hodnotě 1,5 %. Při vyšším procentu lze očekávat podle toho literárního zdroje rychlejší růstovou progresi adenomu bez ohledu na jeho případné invazivní chování [52]. V literatuře se však objevují i protichůdné výsledky, kde vyšší proliferační aktivita antigenu nebyla spojena s častějšími recidivami nebo akcelerovaným růstem [44,47]. Literárně přetrvávající nejistota o spolehlivosti Ki‑67 pramení i z určitých metodických nejednotností mezi jednotlivými pracovišti. Svoji roli zřejmě sehrává i fakt, že odebraného materiálu při operaci bývá málo, navíc je někdy znehodnocen krevními elementy nebo mechanickou manipulací. To se odráží v poměrně značné nehomogenitě hodnoceného preparátu, což je markantnější zvláště u počítačového odečtu z více polí. Řádově nižší hodnoty proliferačního indexu našeho souboru získaného softwarovou metodou proti technice „hot spots“ to podle našeho názoru dokládají. Nabízí se zároveň i otázka, zda různé porce adenomů mají stejnou proliferační potenci. Odpovědí nám může být názor Wolfsbergera et al, kteří se zabývali regionální diferencí Ki‑67 ze 100 odběrů u 26 pacientů. Hodnota proliferačního indexu Ki‑67 byla v různých partiích adenomu statisticky obdobná [57]. Literární shody nebylo dosaženo ani v otázce rozdílu proliferačního indexu u funkčních a afunkčních adenomů. Někteří autoři podporují názor, že hormonálně aktivní adenomy, zvláště kortikotrofní, mají v průměru vyšší hodnotu Ki‑67 [32,40,58]. Ostatní se přiklánějí k závěru, že hormonální produkce nemá na míru proliferace podstatnější vliv [41,53,59]. Naše výsledky tuto literární nejednotnost ilustrují a vedou k rozpakům nad jednoznačnou preferencí antigenu Ki‑67 jako předpovědního ukazatele růstu AAH. Rychlejší růstové křivky našeho souboru nekorespondovaly s vyšší hodnotou Ki‑67, a to ani v případě jeho výrazně nadnormální hodnoty u 77letého muže, kde AAH vykazoval relativně pomalý růst. Zařazujeme se tak k pracovištím, kde se na statisticky signifikantní úrovni nepodařila závislost mezi rychlostí růstu AAH a proliferačním indexem zatím prokázat. Nicméně intuitivně přetrvává v našem rozhodování respekt k vyšším hodnotám proliferace, což se odráží i v individualizaci pooperačního sledování.
Radiochirurgii pomocí LGN považujeme za významnou doplňkovou metodu u recidivujích nebo reziduálních AAH [60]. U pacientů s pooperačními zbytky jsme gamaterapii indikovali u 19 nemocných (33 %) na základě grafické progrese rezidua, zvláště v oblasti kavernózního sinu. Dále byla doporučována v situacích tužší konzistence adenomu, kdy by transkraniální reoperace znamenala pro interně limitovaného nemocného příliš velkou zátěž. Dalším indikačním momentem v našem rozhodování byla i individuální volba nemocného. Roli paušálního pooperačního ozáření gama nožem vnímáme nadále jako kontroverzní. Při zvažování této léčebné modality dáváme přednost grafickému sledování přirozeného vývoje rezidua, zvláště jedná‑li se o staršího pacienta. Pomalejší růstová aktivita adenomů u starších nemocných, kterou jsme našimi výsledky prokázali, nám k tomu dává oprávnění.
Závěr
Afunkční adenomy hypofýzy představují díky rozmanitým biologickým vlastnostem nehomogenní skupinu onemocnění. Vlivem konzistence, většího počátečního objemu a díky invazivitě adenomů jsou pooperační zbytky zaznamenány poměrně často. Chirurgicky dosažitelná rezidua nebo recidivy adenomů indikujeme k reoperaci. Obtížně přístupné porce tumoru uložené v oblasti limitované chirurgické radikality dnes doporučujeme k radiochirurgii gamanožem. Při rozhodování jednotlivých případů postupujeme vždy individuálně, přičemž zvažujeme celý komplex informací. Na základě výsledků naši studie lze konstatovat, že rychlost růstu pooperačních reziduí AAH je ovlivněna věkem. Tento fakt přináší praktický příspěvek jak do léčebné strategie, tak i do pooperačního sledování. Kontrolní grafická vyšetření provádíme standardně po třech a 12 měsících od operace. U mladších pacientů s podezřením na rychlejší růst rezidua plánujeme druhou grafickou kontrolu s intervalem šest měsíců. Marker proliferace Ki‑67, osvědčený v humánní onkologii, nelze s jistotou považovat za spolehlivý předpovědní růstový ukazatel AAH. Vyšší hodnoty proliferačního indexu Ki‑67 přes toto zjištění nepodceňujeme a nadále je zařazujeme do mozaiky v rozhodovacím procesu u našich nemocných.
Poděkování:
Dík patří paní S. Kopecké za perfektní provedení imunohistochemických technik a Ing. J. Bukačovi, MS, Ph.D. za významnou pomoc se statistickým zpracováním dat.Tato studie byla podpořena projektem MSM 0021620820 v rámci výzkumných záměrů MŠMT ČR.
MUDr. Tomáš Česák
Neurochirurgická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové 5
e‑mail: cesak.tomas@seznam.cz
Zdroje
1. Nistor R. Pituitary tumo urs. In: Palmer JD (ed). Manu al of ne urosurgery. New York: Churchill Livingstone 1996 : 264 – 272.
2. Asa SL, Kovacs K. Clinically non‑functi oning human pituitary adenomas. Can J Ne urol Sci 1992; 19(2): 228 – 235.
3. Horvath E, Kovacs K. Ultrastructural di agnosis of human pituitary adenomas. Microsc Res Tech 1992; 20(2): 107 – 135.
4. Thapar K, Kovacs K, Horvath E, Asa SL. Classificati on and Pathology of Pituitary Tumors. In: Wilkins RH, Rengachary SS (eds). Ne urosurgery. 2nd ed. New York: McGraw - Hill 1996 : 1273 – 1289.
5. Kovacs K, Horvath E, Vidal S. Classificati on of pituitary adenomas. J Ne uro oncol 2001; 54(2): 121 – 127.
6. Němeček S, Němečková J, Cerman J. Patologi e nádorů nervového systému a hypofýzy. In: Náhlovský et al (eds). Ne urochirurgi e. Praha: Galén 2006 : 65 – 82.
7. Cerman J, Němeček S. Molekulární a genetické aspekty tumorigeneze nervového systému a hypofýzy. In: Náhlovský et al (eds). Ne urochirurgi e. Praha: Galén 2006 : 82 – 103.
8. Česák T, Náhlovský J, Látr I, Čáp J, Ryška P. Nádorová onemocnění hypofýzy. In: Náhlovský et al (eds). Ne urochirurgi e. Praha: Galén 2006 : 155 – 176.
9. Meij BP, Lopes MB, Ellegala DB, Alden TD, Laws ER jr. The long‑term significance of microscopic dural invasi on in 354 pati ents with pituitary adenomas tre ated with transspheno idal surgery. J Ne urosurg 2002; 96(2): 195 – 208.
10. Tanaka Y, Hongo K, Tada T, Sakai K, Kakizawa Y,Kobayashi S. Growth pattern and rate in residu al nonfuncti oning pituitary adenomas: correlati on among tumor volume do ubling time, pati ent age, and MIB - 1 index. J Ne urosurg 2003; 98(2): 359 – 365.
11. Hardy J. Transspheno idal hypophysectomy. J Ne urosurg 1971; 34(4): 582 – 594.
12. Hardy J, Vezina JL. Transspheno idal ne urosurgery of intracrani al ne oplasm. In: Thompson RA, Green JR (eds). Advances in ne urology. New York: Raven Press 1976 : 261 – 274.
13. Kontoge orgos G, Sambazi otis D, Pi aditis G, Karameris A. Apoptosis in human pituitary adenomas: a morphologic and in situ end‑labeling study. Mod Pathol 1997; 10(9): 921 – 926.
14. Náhlovský J, Česák T, Látr I, Čáp J, Žižka J, Krajina A.Komplikace transsfeno idálních operací u našich nemocných – příčiny a řešení. Cesk Slov Ne urol N 2004; 67/ 100(2): 112 – 119.
15. Sameš M, Vachata P, Sa ur K, Budíková M. Přímý transnazální miniinvazivní přístup pro mikrochirurgicko u resekci adenomů hypofýzy. Cesk Slov Ne urol N 2005; 68/ 101(5): 338 – 343.
16. Masopust V, Netuka D, Hána V, Marek J, Beneš V.Chirurgická léčba hormonálně aktivních adenomů hypofýzy. Cesk Slov Ne urol N 2007; 70/ 103(4): 402 – 406.
17. Schwarz TH, Sti eg PE, Anand VK. Endoscopic transspheno idal pituitary surgery with intraoperative magnetic resonance imaging. Ne urosurgery 2006; 58 (Suppl 1): ONS44 – ONS51.
18. Lanzi en CF, Larkins M, Mancall A, Loring R, Duchesne a u PM, Rosenblo om SA et al. Crani al postoperative site: MR imaging appe arence. AJNR Am J Ne uroradi ol 1988; 9(1): 27 – 34.
19. Rajaraman V, Schulder M. Postoperative MRI appe arence after transspheno idal pituitary tumor resecti on. Surg Ne urol 1999; 52(6): 592 – 599.
20. Steiner E, Knosp E, Herold CJ, Kramer J, Stiglba uer R,Staniszewski K et al. Pituitary adenomas: findings of postoperative MR imaging. Radi ology 1992; 185(2): 521 – 527.
21. Dina TS, Fe aster SH, Laws ER jr, Davis DO. MR of the pituitary gland postsurgery: Seri al MR studi es following transspheno idal resecti on. AJNR Am J Ne uroradi ol 1993; 14(3): 763 – 769.
22. Rodríguez O, Mate os B, de la Pedraja R, Villori a R, Hernando JI, Pastor A et al. Postoperative follow‑up of pituitary adenomas after transspheno idal resecti on: MRI and clinical correlati on. Ne uroradi ology 1996; 38(8): 747 – 754.
23. Bradley KM, Adams CB, Potter CP, Wheeler DW, Anslow PJ, Burke CW. An a udit of selected pati ens with non‑functi oning pituitary adenoma tre ated by transspheno idal surgery witho ut irradi ati on. Clin Endocrinol (Oxf) 1994; 41(5): 655 – 659.
24. Ciric I, Mikhael M, Stafford T, Lawson L, Garces R. Transspheno idal microsurgery of pituitary macro adenomas with long‑term follow‑up results. J Ne urosurg 1983; 59(3): 395 – 401.
25. Comto is R, Be a uregard H, Somma M, Serri O, Aris - Jilwan N, Hardy J. The clinical and endocrine o utcome of trans‑spheno idal microsurgery of nonsecreting pituitary adenomas. Cancer 1991; 68(4): 860 – 866.
26. Ebersold MJ, Qu ast LM, Laws ER jr, Scheitha uer B, Randall RV. Long‑term results in transspheno idal removal of nonfuncti oning pituitary adenomas. J Ne urosurg 1986; 64(5): 713 – 719.
27. Lillehei KO, Kirschman DL, Kleinschmidt - DeMasters BK, Ridgway EC. Re assessment of the role of radi ati on therapy in the tre atment of endocrine - inactive pituitary macro adenomas. Ne urosurgery 1998; 43(3): 432 – 439.
28. Laws ER jr, Pi epgrass DG, Randal RW, Abbo ud CF. Ne urosurgical management of acromegaly. Results in 82 pati ents tre ated between 1972 and 1977. J Ne urosurg 1979; 50(4): 454 – 461.
29. Molitch ME, Thormer MO, Wilson C. Management of prolactinomas. J Clin Endocrinol Metab 1997; 82(4): 996 – 1000.
30. Randall RV, Scheitha uer BW, Laws ER jr, Abbo ud CF, Ebersold MJ, Kao PC. Pituitary adenomas associ ated with hyperprolactinemi a: a clinical and immunohistochemical study of 97 pati ents operated on transspheno idally. Mayo Clin Proc 1985; 60(11): 753 – 762.
31. Hsu DW, Hakim F, Biller BMK, de la Monte S, Zervas NT, Klibanski A et al. Significance of proliferating cell nucle ar antigen index in predicting pituitary adenoma recurrence. J Ne urosurg 1993; 78(5): 753 – 761.
32. Thapar K, Kovacs K, Scheitha uer BW, Stefane anu L,Horvath E, Pernicone PJ et al. Proliferative activity and invasiveness among pituitary adenomas and carcinomas: An analysis using the MIB - 1 antibody. Ne urosurgery 1996; 38(1): 99 – 107.
33. Scheitha uer BW, Kovacs KT, Laws ER jr, Randall RV. Pathology of invasive pituitary tumors with speci al reference to functi onal classificati on. J Ne urosurg 1986; 65(6): 733 – 744.
34. Selman WR, Laws ER jr, Scheitha uer BW, Carpenter SM. The occurrence of dural invasi on in pituitary adenomas. J Ne urosurg 1986; 64(3): 402 – 407.
35. Wilson CB. A decade of pituitary microsurgery. J Ne urosurg 1984; 61(5): 814 – 833.
36. Mohr G, Hardy J, Comto is R, Be a uregard H. Surgical management of gi ant pituitary adenomas. Can J Ne urol Sci 1990; 17(1): 62 – 66.
37. Knosp E, Steiner E, Kitz K, Matula CH. Pituitary adenomas with invasi on of caverno us sinus space: a magnetic resonance imaging classificati on compared with surgical findings. Ne urosurgery 1993; 33(4): 610 – 618.
38. Kitz K, Knosp E, Ko os WT, Korn A. Proliferati on in pituitary adenomas: me asurement by MAb Ki‑67. Acta Ne urochir (Wi en) 1991; 53 : 60 – 64.
39. Jaffrain‑Re a ML, Di Stefano D, Minniti G, Espozito V,Bultrini A, Ferreti E et al. A critical re appraisal of MIB 1labelling index significance in a large seri es of pituitary tumo urs: secreting versus non‑secreting adenomas. Endocr Relat Cancer 2002; 9(2): 103 – 113.
40. Mastronardi L, Guiducci A, Spera C, Puzzilli F, Liberati F, Maira G. Ki‑67 labelling index and invasiveness among anteri or pituitary adenomas: analysis od 103 cases using MIB - 1 monoclonal antibody. J Clin Pathol 1999; 52(2): 107 – 111.
41. Zhao D, Tomono Y, Nose T. Expressi on of P27kip1 and Ki‑67 in pituitary adenomas: an investigati on of marker of adenoma invasiveness. Acta Ne urochir (Wi en) 1999; 141(2): 187 – 192.
42. Carboni P jr, Detta A, Hitchcock ER, Postans R. Pituitary adenoma proliferative indices and risk of recurrence. Br J Ne urosurgery 1992; 6(1): 33 – 40.
43. Ekramullah SM, Saitoh Y, Arita N, Ohnishi T, Hayakawa T. The correlati on of Ki‑67 staining indices with tumo ur do ubling times in regrowing non‑functi oning pituitary adenomas. Acta Ne urochir (Wi en) 1996; 138(12): 1449 – 1455.
44. Losa M, Franzin A, Mangili F, Terreni MR, Barzaghi R,Vegli a F et al. Proliferating index of nonfuncti oning pituitary adenomas: correlati ons with clinical characteristics and long‑term follow‑up results. Ne urosurgery 2000; 47(6): 1313 – 1319.
45. Mizo ue T, Kawamoto H, Arita K, Kurisu K, Tominaga A, Uozumi T. MIB 1 immunopositivity is associ ated with rapid regrowth of pituitary adenomas. Acta Ne urochir (Wi en) 1997; 139(5): 426 – 432.
46. Nagashima T, Murovic JA, Hoshino T, Wilson CB, DeArmond SJ. The proliferative potenti al of human pituitary tumors in situ. J Ne urosurg 1986; 64(4): 588 – 593.
47. Yonezawa K, Tamaki N, Kokunai T. Clinical fe atures and growth fracti ons of pituitary adenomas. Surg Ne urol 1997; 48(5): 494 – 500.
48. Atkin SL, Green LV, Hipkin LJ, Landolt AM, Foy PM, Jeffreys RV et al. A comparison of proliferati on indices in human pituitary adenomas using formalin‑fixed tissue and in vitro cell culture. J Ne urosurg 1997; 87(1): 85 – 88.
49. Mastronardi L, Guiducci A, Puzzilli F, Maira G. Anteri or pituitary adenomas in pati ent aged more than 65 ye ars: analysis of growth fracti on (using MIB 1 monoclonal antibody) and of clinical fe atures in comparison to yo unger pati ens. Clin Ne urol Ne urosurg 2002; 104(1): 44 – 48.
50. Schreiber S, Saeger W, Lüdecke DK. Proliferati on markers in different types of clinically non‑secreting pituitary adenomas. Pituitary 1999; 1(3 – 4): 213 – 220.
51. Vidal S, Kovacs K, Horvath E, Rotondo F, Kuroki T, Lloyd RV et al. Topo isomerase II alfa expressi on in pituitary adenomas and carcinomas: relati onship to tumor behavi or. Mod Pathol 2002; 15(11): 1205 – 1212.
52. Honegger J, Prettin C, Fe uerhake F, Petrick M, Schulte - Mönting J, Reincke M. Expressi on of Ki‑67 antigen in nonfuncti oning pituitary adenomas: correlati on with growth velocity and invasiveness. J Ne urosurg 2003; 99(4): 674 – 679.
53. Abe T, Sanno N, Osamura YR, Matsumoto K. Proliferative potenti al in pituitary adenomas: me asurement by monoclonal antibody MIB - 1. Acta Ne urochir (Wi en) 1997; 139(7): 613 – 618.
54. Kawamoto H, Uozumi T, Kawamoto K, Arita K, Yano T, Hirohata T. Analysis of the growth rate and caverno us sinus invasi on of pituitary adenomas. Acta Ne urochir (Wi en) 1995; 136(1 – 2): 37 – 43.
55. Turner HE, Wass JAH. Are markers of proliferati on valu able in the histological assessment of the pituitary tumo urs? Pituitary 1999; 1(3 – 4): 147 – 151.
56. Cap J, Cerman J, Nemecek S, Mareková M, Hana V,Frysak Z. The influence of tre atment with somatostatin analogues on morphology, proliferative and apoptotic activity in GH - secreting pituitary adenomas. J Clin Ne urosci 2003; 10(4): 444 – 448.
57. Wolfsberger S, Kitz K, Wunderer J, Czech T, Boecher - Schwarz HG, Hainfellner JA et al. Multiregi onal sampling reve als a homogeno us distributi on of Ki‑67 proliferati on rate in pituitary adenomas. Acta Ne urochir (Wi en) 2004; 146(12): 1323 – 1328.
58. Lath R, Chacko G, Chandy MJ. Determinati on of Ki‑67 labeling index in pituitary adenomas using MIB - 1 monoclonal antibody. Ne urol Indi a 2001; 49(2): 144 – 147.
59. Knosp E, Kitz K, Perneczky A. Proliferati on activity in pituitary adenomas: me asurement by monoclonal antibody Ki‑67. Ne urosurgery 1989; 25(6): 927 – 930.
60. Vladyka V, Liščák R, Šimonová G, Chytka T, Novotný J jr, Vymazal J et al. Radi ochirurgické léčení adenomů hypofýzy gama nožem: výsledky u so uboru 163 nemocných získané v intervalu 5 let. Čas Lék česk 2000; 139(24): 757 – 766.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Neurodegenerativní demence
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2009 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Krční myelopatie – diagnostický problém
- Longitudinální sledování růstu po operačních reziduí afunkčních adenomů hypofýzy
- Radi ofrekvenční terapi e facetových bolestí bederní páteře
- Indikace přední náhrady meziobratlové ploténky u zlomenin hrudní a bederní páteře s využitím magnetické rezonance – prospektivní studie
- Extra- intrakraniální arteri ální mikro anastomóza
- Myasthenia gravis – kritické zhodnocení přínosu svalové biopsie prováděné během thymektomie
- Leberova hereditární optická neuropatie s oligoklonálními pásy v likvoru považovaná za roztro ušeno u sklerózu – kazuistika
- Progresivní multifokální leukoencefalopatie jako komplikace léčby lymfomu – kazuistika
- Maligní tumor z pochvy periferního nervu – dvě kazuistiky
- Počítačem modelované náhrady kostních defektů lební klenby
- Časná karotická endarterektomi e pro reziduální kriticko u stenózu krkavice po intravenózní trombolýze
- Standard komplexní léčby spasticity po cévní mozkové příhodě
-
Webové okénko
Co nelze nemít na ploše…
-
Analýza dat v neurologii
XIV. Vyzkoušejte zvláštní typ neparametrického testování hypotéz: permutační testy – Fisherův exaktní test
- Nové poznatky o pravděpodobné so učinnosti míchy s mozkem při re alizaci pohybu
- Vybrané di agnosticko‑léčebné problémy u vysoce maligních gliomů – závěry multidisciplinárního pracovního setkání „Winter GLIO TRACK Meeting“ 2009
- Abstrakta přednášek, které odezněly na VIII. afaziologickém sympoziu s českou a slovenskou účastí v Brně 5.–6. března 2009, konaného u příležitosti Evropského dne logopedie (6. března)
- Neurodegenerativní demence
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Krční myelopatie – diagnostický problém
- Neurodegenerativní demence
- Maligní tumor z pochvy periferního nervu – dvě kazuistiky
- Radi ofrekvenční terapi e facetových bolestí bederní páteře
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



