-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dlhodobé výsledky liečby meningeómov Leksellovým gama nožom
Long-term Results of Treatment of Meningiomas with Leksell Gamma Knife
Objective:
The evaluation of the results of treatment of meningioma, a slow-growing tumour, requires long-term follow-up. This study analyzes a cohort of 226 patients harbouring 249 meningiomas, treated between 1992 and 1997 at Na Homolce Hospital, Prague. Methods: The cohort of patients for analysis consisted of 179 women (79.2%) and 47 men (20.8%) with a mean age of 61 years (18–84 years). Tumour volume ranged between 0.1 and 44.9 cm³ (median 4.37 cm³). Radiation dose to the tumour margin was between 6.5 and 24 Gy (median 12.9 Gy), usually at 50% isodose. Follow-up records of 217 of the patients, with 239 meningiomas, were available for final analysis. Results: Follow-up ranged from one to 168 months, median 96. The ten-year tumour control rate was observed in 94.7% of cases. Partial regression of the tumour was recorded in 163 (68.2%), stabilization in 70 (29.3%) and progression in 6 (2.5%). Improvement of symptoms occurred in 89 patients (41%). Temporary morbidity occurred in 30 (13.8%), permanent morbidity in 14 (6.4%) of the patients treated. Conclusion: Stereotactic radiosurgery is a safe and effective treatment of meningioma from a long term perspective. However, the decision on treatment options has to be assessed on a patient-by-patient basis.Key words:
meningioma – gamma knife – stereotactic radiosurgery – long term results
Autoři: A. Kollová 1; R. Liščák 2; J. Šemnická 3; G. Šimonová 2; V. Vladyka 2; D. Urgošík 2
Působiště autorů: Neurochirurgická klinika LF UPJŠ a FN L. Pasteura Košice 1; Oddělení stereotaktické a radiační neurochirurgie, Nemocnice Na Homolce, Praha 2; Oddělení lékařské fyziky, Nemocnice Na Homolce Praha 3
Vyšlo v časopise: Cesk Slov Neurol N 2010; 73/106(4): 415-421
Kategorie: Krátké sdělení
Souhrn
Cieľ práce:
Vyhodnotenie výsledkov stereotaktickej rádiochirurgickej liečby meningeómov ako pomaly rastúcich tumorov vyžaduje dlhodobé sledovanie. Súčasná štúdia analyzuje skupinu 226 pacientov s 249 meningeómami liečenými v rokoch 1992–1997 v Nemocnici Na Homolce v Prahe. Materiál a metodika: Sledovaný súbor pozostával zo 179 (79,2 %) žien a 47 (20,8 %) mužov s priemerným vekom 61 rokov (18–84 rokov). Objem tumoru bol v rozmedzí 0,1 do 44,9 cm³ (medián 4,37 cm³). Dávka na okraj tumoru bola volená medzi 6,5 a 24 Gy (medián 12,9 Gy), obvykle na 50% izodóze. Pre analýzu boli k dispozícii kontrolné vyšetrenia 217 pacientov s 239 meningeómami. Výsledky: Doba sledovania bola 1–168, medián 96 mesiacov. Desaťročná kontrola rastu tumoru bola zaznamenaná v 94,7 %. K parciálnej regresii tumoru došlo u 163 (68,2 %) meningeómov, stabilizácia bola zaznamenaná u 70 (29,3 %) a progresia u 6 (2,5 %) meningeómov. Klinické zlepšenie bolo pozorované u 89 pacientov (41 %). Dočasná morbidita liečby bola zaznamenaná u 30 (13,8 %) a trvalá u 14 (6,4 %) liečených pacientov. Záver: Stereotaktická rádiochirurgia je bezpečnou a efektívnou metódou liečby meningeómu z dlhodobého hľadiska. Pre každého pacienta je však nevyhnutné posudzovať možnosti liečby individuálne.Kľúčové slová:
meningeóm – gama nôž – stereotaktická rádiochirurgia – dlhodobé výsledkyÚvod
Meningeómy predstavujú okolo 25 % intrakraniálnych tumorov, vychádzajú z arachnoidálnej výstelky, až v 80 % sú benígne a vyskytujú sa prevažne u žien [1–3]. Pre hodnotenie liečby pomaly rastúcich tumorov, ku ktorým patria aj meningeómy, je dôležité dlhodobé sledovanie, minimálne 10 rokov [4]. Je všeobecne akceptované, že úplné chirurgické odstránenie s resekciou priľahlej tvrdej pleny s nízkou morbiditou a mortalitou je metódou voľby liečby meningeómov [1,3,5,6]. Bolo však dokázané, že meningeómy môžu prerastať do hlavových nervov a ciev, čo spôsobuje, že častokrát je ich úplná exstirpácia technicky náročná až nemožná [7–9]. Stereotaktická rádiochirurgia u definovanej skupiny pacientov s meningeómami do veľkosti približne 3 cm v priemere, event. do objemu 10 cm³, poskytuje možnosť zastavenia rastu tumoru v 87–100 %, s nízkou morbiditou a s nulovou mortalitou [10–22]. Dosiaľ publikované výsledky radiochirurgickej liečby disponovali stredne dobým sledovaním [14] a bolo potrebné ich overiť aj v horizonte sledovania 10 rokov a viac. K tomu je potrebná jednak dlhá tradícia pracoviska s rádiochirurgickou liečbou, jednak možnosť systematického sledovania pacientov po liečbe. Ako jedny z prvých máme možnosť takéto výsledky u benígnych meningeómov zhodnotiť a analyzujeme ich v tejto práci.
Materiál a metodika
Pre diagnózu benígneho meningeómu bolo v rokoch 1992–1997 liečených na Oddelení stereotaktickej a radiačnej neurochirurgie Nemocnice na Homolce v Prahe 226 pacientov s 249 meningeómami. Pacienti s atypickým a anaplastickým meningeómom neboli do tejto štúdie zahrnutí. Ženy tvorili 79,2 % súboru (179 pacientiek). Vek pacientov bol v rozmedzí od 18 do 84, medián 61 rokov. Na konvexite bolo lokalizovaných 133 (53,4 %), na lebečnej báze 116 (46,6 %) meningeómov. Karnofskeho skóre bolo v rozmedzí 30–100 %, medián 80 %. U pacientov, ktorí podstúpili predchádzajúci operačný výkon, boli zaznamenané poruchy hlavových nervov u 28 (12,4 %), hemiparéza u 19 (8,4 %) a cerebellárne príznaky u 8 (3,5 %). Spolu malo neurologickú symptomatiku po predchádzajúcej operácii 53 pacientov (23,4 %), nakoľko u dvoch pacientov sa vyskytla kombinácia dvoch príznakov. Celkove bol neurodeficit zaznamenaný pred liečbou gama nožom u 134 pacientov (59,3 %), epilepsia u 32 pacientov (14,2 %), 60 pacientov bolo asymptomatických (26,5 %). Bolesti hlavy boli zaznamenané u 138 pacientov. U jedného pacienta sa mohlo vyskytnúť naraz aj niekoľko symptómov (tab. 1). Mnohopočetné meningeómy boli zistené u 15 pacientov.
Tab. 1. Symptómy u pacientov liečených Leksellovým gama nožom a klinické zlepšenie po liečbe. 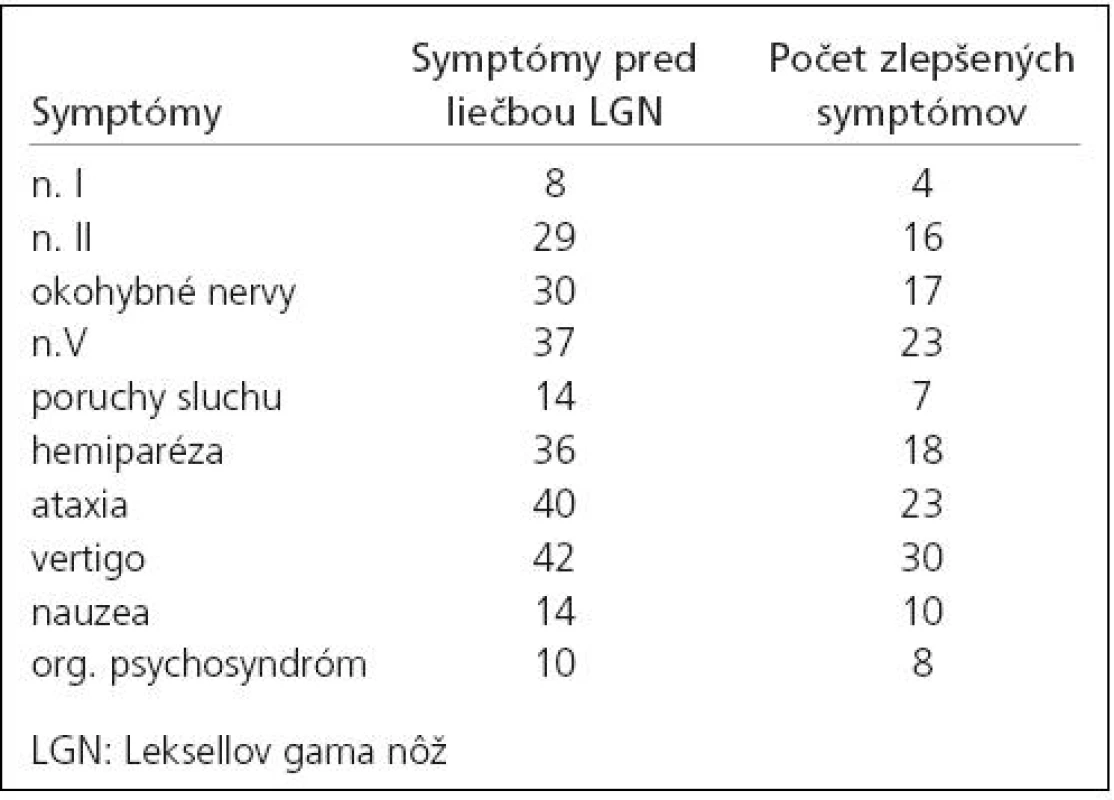
Šesťdesiat sedem pacientov (29,6 %) podstúpilo operáciu 2–132 mesiacov pred stereotaktickým výkonom. U pacientov, u ktorých nebola k dispozícii histologická verifikácia, bola diagnóza meningeómu stanovená na základe typických rádiologických charakteristík. Šesť pacientov podstúpilo pred stereotaktickým výkonom rádioterapiu. Stereotaktický rádiochirurgický výkon bol primárnou liečbou u 159 pacientov (70,3 %) sledovaného súboru. Tlak na optickú dráhu bol pozorovaný v 30 prípadoch (12 %) a tlak na mozgový kmeň u 45 (18 %) meningeómov. Perifokálny edém bol zistený u 11 (4,9 %) pacientov. U 10 (4,4 %) pacientov s meningeómom šíriacim sa do zadnej a strednej jamy lebečnej bol rádiochirurgický výkon rozdelený na dve časti, keď ako prvá bola ožiarená časť v kritickejšej oblasti a následne o pol roka bola ožiarená druhá časť tumoru.
Stereotaktický rám bol nasadený v lokálnej anestéze po premedikácii. Rádiochirurgický výkon bol realizovaný Leksellovým gama nožom (model B, Elekta Instruments AB, Švédsko). Zameranie bolo na podklade CT u 64 (25,7 %) meningeómov a na podklade MR u 185 (74,3 %). Objem tumoru bol v rozmedzí od 0,1 do 44,9 cm³, medián 4,37 cm³, priemer 5,9 cm³. Dávka na okraj tumoru bola v rozmedzí 6,5–24 Gy, medián 12,9 Gy (okrajová izodóza, t.j. referenčná izodóza okolo plánovacieho cieľového objemu, bola medzi 40–90 %, medián 50 %). Maximálna dávka sa pohybovala medzi 13–45 Gy, medián 24 Gy.
Desať premenných bolo analyzovaných v snahe nájsť vplyv rôznych faktorov rádiochirurgickej liečby. Premenné nezávislé na liečbe boli pohlavie, vek, predchádzajúca operácia, perifokálny edém pred liečbou, objem meningeómu a jeho lokalizácia (na konvexite alebo na lebečnej báze). Premenné súvisiace s liečbou boli maximálna dávka a dávka na okraj meningeómu. Päť dejov bolo analyzovaných za účelom zistenia ich vzťahu ku analyzovaným faktorom: regresia a progresia tumoru, vývoj perifokálneho edému, zhoršenie a úprava neurologického deficitu.
Univariačná analýza bola realizovaná použitím Kaplan-Meierovho štatistického testu log rank. V multivariačnej analýze bola použitá Coxova regresia (Cox proportional hazards model with backward stepwise conditional likelihood ratio). Všetky analýzy boli realizované pomocou software SPSS verzia 13.0 a 16.0 (SPSS Inc., USA). Premenné so štatisticky signifikantnými hodnotami (p < 0,05) v minimálne dvoch štatistických testoch boli považované za možné rizikové faktory pre sledované deje (tab. 2).
Tab. 2. Výsledky univariačnej a multivariačnej analýzy u pacientov s liečenými meningeómami. 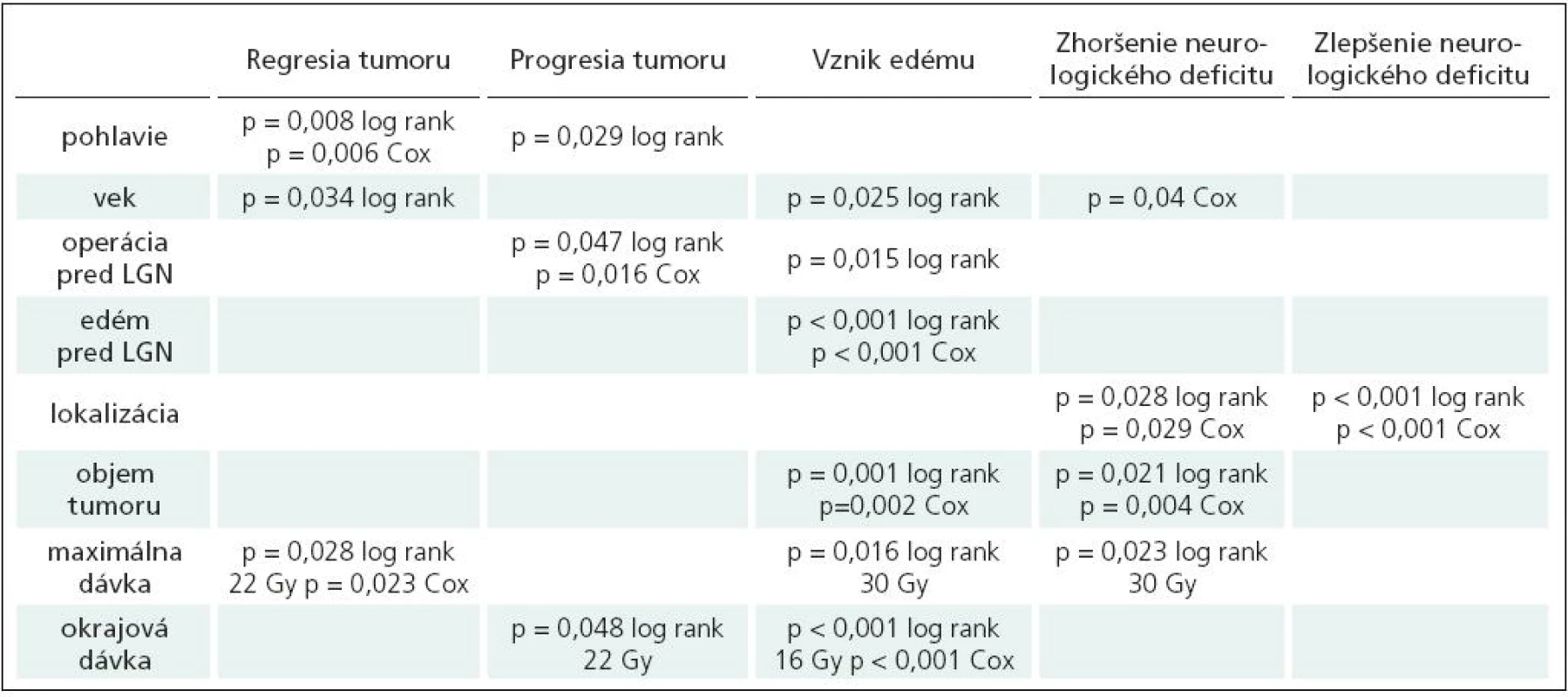
Výsledky
Zo súboru 226 pacientov boli pre analýzu dostupné údaje 217 pacientov a 239 meningeómov. Sledovanie dlhšie ako 120 mesiacov malo 81 pacientov. U 10 pacientov boli kontrolné vyšetrenia ukončené pre stabilizovaný stav a vysoký vek. Doba sledovania bola 1–168, medián 96 mesiacov. Dvadsiati piati (11,5 %) pacienti zomreli v priebehu sledovania, dvaja z nich pre progresiu perifokálneho edému u parasagitálneho meningeómu, ostatní bez súvislosti s meningeómom.
Kontrola rastu tumoru bola dosiahnutá po 10 rokoch podľa Kaplan-Meierovej krivky u 94,7 % liečených pacientov (graf 1). Objem tumoru regredoval v 163 prípadoch (68,2 %), zostal stabilizovaný u 70 (29,3 %) a progredoval u 6 (2,5 %) pacientov. Klinické zlepšenie bolo zaznamenané u 89 (41 %) pacientov. Zlepšenie bolestí hlavy udávalo 99 pacientov. Prehľad zlepšených symptómov je v tab. 1 (u jedného pacienta mohlo dôjsť k zlepšeniu viacerých symptómov).
Graf 1. Kaplan Meierova krivka kontroly rastu meningeómov po liečbe Leksellovým gama nožom. 
Postiradiačný edém sa vyskytol u 40 (18,4 %) pacientov, 1–21, medián 7 mesiacov po liečbe. U 24 (11,1 %) pacientov bol symptomatický. Kortikoidy boli podávané 19 pacientom. U pacientov, ktorých zhoršenie príznakov neobťažovalo alebo u asymptomatických pacientov s rádiologickými známkami edému, tento nebol medikamentózne liečený. U ďalších 6 (2,8 %) pacientov bolo pozorované klinické zhoršenie bez rádiologických známok edému (tab. 3). U 16 (7,4 %) pacientov sa klinické príznaky upravili, u 14 (6,4 %) pacientov pri kontrolách pretrvávali.
Intratumorálny edém sa vyvinul u dvoch pacientov, veľkosť tumoru sa zväčšila v priebehu 12 mesiacov a následne sa zmenšila v priebehu 30 mesiacov po liečbe. Štyria pacienti absolvovali následne ďalšiu liečbu gama nožom pre nárast tumoru, tri pacientky podstúpili operačné riešenie, jedna z nich napriek zmenšeniu tumoru po liečbe gama nožom.
Diskusia
Výsledok liečby meningeómov je možné zhodnotiť relevantne len v dostatočne dlhom časovom horizonte, preto sme analyzovali skupinu pacientov liečených pred 10 a viac rokmi (obr. 1). Kontrola rastu meningeómu po 10 rokoch od liečby je 94,7 %, čo je v súlade s predchádzajúcim výsledkom kontroly rastu tumoru po piatich rokoch (97,9 %), ktorá bola publikovaná r. 2007 [14].
Obr. 1. MR skeny 53-ročného muža s intra- a parasellárnym meningeómom. a) Axiálny rez v T1 vážení po aplikácii Gd pred liečbou LGN. b) Koronárny rez v T1 vážení po aplikácii Gd pred liečbou. c) Axiálny rez v T1 vážení po aplikácii Gd 10 rokov po liečbe. Známky zmenšenia tumoru so zmenšením tlaku na mozgový kmeň a ľavý spánkový lalok. d) Koronárny rez v T1 vážení po aplikácii Gd 10 rokov po liečbe. Zmenšenie tumoru s oddialením okrajov meningeómu od chiazmy. Klinicky úprava trigeminálnych symptómov. 
V našej štúdii sme sa sústredili na faktory ovplyvňujúce kontrolu rastu tumoru z dlhodobého hľadiska, ako aj na identifikáciu rizikových faktorov liečby.
Maximálna dávka a dávka na okraj nádoru
Optimálna dávka pre liečbu meningeómu je stále predmetom diskusie. Skupina analyzovaných pacientov bola liečená v období od 1992–1997; v tom čase neboli k dispozícii dlhodobé výsledky rádiochirurgickej liečby meningeómov, čo odrážajú aj údaje: dávka na okraj tumoru bola volená medzi 6,5–24 Gy (nízka okrajová dávka 6,5 Gy bola aplikovaná u pacientky s predchádzajúcou rádioterapiou – okrajová dávka predstavuje v rádioterapii užívanú formuláciu dávka na referenčnej izodóze). V našej štúdii bolo zistené, že k regresii došlo častejšie v skupine meningeómov liečených dávkou v maxime vyššou ako 22 Gy. Pretože okrajová dávka bola volená najčastejšie na 50% izodózu, s ohľadom na naše výsledky by pre dosiahnutie kontroly nádoru, resp. jeho regresiu, mala byť volená okrajová dávka minimálne 12 Gy.
Jedným z limitujúcich aspektov rádiochirurgie je kontakt alebo kompresia optickej dráhy liečenou léziou. Okrajová dávka nižšia ako 12 Gy je aplikovaná len v prípade, že liečený meningeóm komprimuje optickú dráhu (obr. 2). V týchto prípadoch by maximálna dávka na optické nervy a chiazmu nemala prekročiť 8 Gy pri jednorazovom ožiarení. Dôsledky iradiácie optického traktu sa môžu prejaviť v dlhšom časovom horizonte, a preto je na mieste dodržiavanie redukovanej dávky na okraj tumoru – 8 Gy na úsek v kontakte s optickou dráhou [23,24].
Obr. 2. MR skeny 55-ročnej ženy, rok po resekcii intra- a parasellárneho meningeómu. a) Koronárny rez v T1 vážení po aplikácii Gd pred liečbou LGN. Zjavná dislokácia a. carotis interna vľavo, kontakt s optickou chiazmou. b) Koronárny rez v T1 vážení po aplikácii Gd, stav 8 rokov po liečbe LGN. Zjavné zmenšenie meningeómu s oddialením jeho okrajov od chiazmy. 
Riziko vzniku perifokálneho edému a zhoršenie neurologického deficitu bolo signifikantne vyššie pre skupiny pacientov liečených maximálnymi dávkami vyššími ako 30 Gy. Vyššie riziko vzniku edému bolo tiež zistené v skupine pacientov liečených okrajovými dávkami vyššími ako 16 Gy.
V zhode s týmito údajmi súčasný liečebný protokol predpisuje pre meningeóm okrajovú dávku 12–15 Gy. Podobná stratégia bola publikovaná Kondziolkom [15]; okrajové dávky nad 15 Gy nepriniesli lepšiu kontrolu rastu tumoru, zároveň však zvýšili riziko komplikácií po výkone. Optimálny medián okrajovej dávky 13–14 Gy bol doporučený aj ďalšími autormi [16,25,26].
Objem nádoru
V našej predchádzajúcej štúdii (s mediánom sledovania 5 rokov) bol signifikantný nárast komplikácií po liečbe meningeómov väčších ako 10 cm³ [14]. Výsledky súčasnej analýzy ukazujú signifikantný nárast rizika výskytu edému už pre objem väčší ako 5 cm³. Tomu zrejme zodpovedá aj zistenie, že u pacientov s objemom meningeómov väčším ako 5 cm³ došlo k častejšiemu zhoršeniu neurologického deficitu.
U pacientov s menšími tumormi je menšie riziko komplikácií liečby, ako aj vyššia šanca kontroly rastu tumoru. Objem tumoru väčší ako 10 cm³ bol tiež identifikovaný ako signifikatný faktor pre skrátenie intervalu bez progresie ochorenia [11]. Pre neurochirurga zvažujúceho možnosť liečby gama nožom je praktickejšie indikačné kritérium založené na priemere tumoru, nakoľko objem v cm³ nie je vždy ľahké odhadnúť, pokiaľ nie je odmeraný, zvlášť u meningeómov s nepravidelným tvarom. Z praktického hľadiska je preto užitočné si uvedomiť, že tumor tvaru gule s priemerom 1 cm má objem 0,52 cm³, s priemerom 2 cm objem 4,19 cm³ a s priemerom 3 cm až 14,12 cm³.
Pohlavie a vek pacientov
U liečených mužov bolo väčšie riziko nárastu objemu tumoru, ale tiež väčšia šanca na zmenšenie tumoru, čo svedčí o biologicky aktívnejších nádoroch u mužov. Naša predchádzajúca štúdia, ako aj iné publikované štúdie, potvrdzujú, že muži majú vyššie riziko nárastu tumoru po rádiochirurgickej liečbe [11,14,29].
Zaujímavým zistením bola štatisticky významne vyššia šanca na zmenšenie tumoru u pacientov mladších ako 40 rokov. Nález sa dá vysvetliť faktom, že meningeómy u starších pacientov obsahujú viac kalcifikátov, a preto zmenšenie objemu tumoru po rádiochirurgickom výkone nie je také výrazné. Mladší pacienti majú vyššie percento agresívnych meningeómov, ktoré vyžadujú operačné riešenie, a títo pacienti majú aj vyššie riziko recidívy meningeómu [22].
Operácia pred liečbou Leksellovým gama nožom
Šesťdesiat sedem (29,6 %) pacientov analyzovaného súboru podstúpilo operačné riešenie meningeómu pred rádiochirurgickým výkonom. Výsledky súčasnej štúdie potvrdili, že riziko nárastu po rádiochirurgickej liečbe je vyššie u pacientov, ktorí podstúpili operáciu pred rádiochirurgickým výkonom. Toto zistenie možno vysvetliť väčšou agresivitou tumorov, ktoré vyžadovali resekciu ako prvú liečebnú modalitu. Meningeómy, ktoré boli resekované, majú tiež nižšie riziko vzniku edému po ožiarení gama nožom. Tento nález možno vysvetliť prerušením piálneho rozhrania, ktoré umožňuje prenikanie VEGF (vascular endothelial growth factor) a ostatných mediátorov edému do priľahlého mozgového tkaniva [1–3,30,31].
Perifokálny edém po liečbe Leksellovým gama nožom
Perifokálny edém sa vyskytuje u 40–60 % meningeómov a závisí od typu arteriálneho krvného zásobenia (piálne cievne zásobenie), ako aj expresie VEGF. Samotný VEGF môže mať významnejšiu úlohu pri raste meningeómu a vzniku perifokálneho edému ako jeho veľkosť a lokalizácia [1–3,30,31]. Meningeómy s perifokálnym edémom sú v prvom kroku indikované na resekčný výkon. Rádiochirurgický výkon sám o sebe môže indukovať perifokálny edém, a zhoršiť tak klinický stav. Edém pred liečbou bol v sledovanom súbore prítomný len u 11 (4,9 %) pacientov nášho súboru. Postiradiačný edém sa vyskytol u 40 pacientov (18,4 %), 1–21, medián 7 mesiacov po liečbe. Bol symptomatický u 24 (11 %) pacientov. U zvyšných 16 pacientov bol edém prítomný na MR skenoch, bez klinickej symptomatológie. Príznaky edému vymizli do 48 mesiacov. Výsledky našej štúdie ukázali, že štatisticky vyššie riziko perifokálneho edému po liečbe bolo u pacientov, u ktorých maximálna dávka bola vyššia ako 30 Gy a dávka na okraj vyššia ako 16 Gy. Perifokálny edém pred rádiochirurgickým výkonom bol ďalším rizikovým faktorom pre postiradiačné zhoršenie klinického stavu.
Štatisticky signifikantne vyššie riziko pre vznik postiradiačného edému bolo zistené u tumorov väčších ako 5 cm³, u pacientov mladších ako 40 rokov a starších viac ako 60 rokov. Vyššie riziko mali tiež pacienti, ktorí neabsolvovali predchádzajúci operačný výkon.
Intratumorálny edém je fenomén zväčšenia objemu po rádiochirurgickom výkone, ako dôsledok postiradiačných zmien vnútri tumoru. Iniciálne dochádza k zväčšeniu veľkosti tumoru, s následným zmenšením jeho veľkosti. Intratumorálny edém sme zistili u dvoch našich pacientiek. V oboch prípadoch bola táto komplikácia navodená príliš vysokou dávkou, ktorú po analýze našich skúseností už neaplikujeme. Je dôležité vedieť o existencii možnosti intratumorálneho edému, nakoľko môže byť považovaný nesprávne za progresiu ochorenia. Následne môže byť indikovaná zbytočná operácia. Intratumorálny edém nastupuje zvyčajne v skorej postiradiačnej fáze, do 24 mesiacov po výkone, zatiaľ čo nárast meningeómu ako pomaly rastúceho tumoru možno zistiť po dvoch rokoch od liečby a neskôr. V prípade objavenia sa symptómov sú podávané kortikoidy.
Nežiaduce účinky liečby Leksellovým gama nožom
Nežiaduce účinky liečby gama nožom sú vo väčšine prípadov dočasné a vyskytujú sa v 3–13 % pacientov. Trvalé následky sú popisované u 1–7 % liečených pacientov [10,11,16,17,20,21,23,25–28,32,33]. V skupine sledovaných pacientov došlo ku zhoršeniu po rádiochirurgickom výkone u 30 (13,8 %) pacientov (tab. 3) a trvalé následky zostali 14 (6,4 %) pacientom.
V analyzovanej skupine pacientov bolo riziko postiradiačných komplikácií najvyššie u pacientov mladších ako 40 rokov. Vyššie riziko komplikácií bolo tiež zistené v skupine pacientov, ktorých tumory boli väčšie ako 5 cm³ (p = 0,021 log rank, p = 0,004 Cox), a u pacientov liečených maximálnou dávkou vyššou ako 30 Gy (p = 0,023 log rank). Na zníženie rizika komplikácií Roche [18] odporúča zohľadniť nielen limit do 3 cm v priemere, ale aj lokalizáciu, vzťah ku mozgovému kmeňu, ku zásobujúcim cievam a perforátorom.
Parasagitálne meningeómy sú spojené so zvýšeným rizikom rádiochirurgickej liečby, čo potvrdila aj naša štúdia [34–37]. Dvaja pacienti našej štúdie, ktorí zomreli na progresiu edému, mali tiež parasagitálny meningeóm. V prvom prípade sa jednalo o 52-ročnú ženu s meningeómom o priemere 32 mm, ktorá z náboženských dôvodov odmietla resekciu nádoru. Bola plánovaná rádiochirurgická liečba vo dvoch dobách s odstupom pol roka. Edém nastúpil štyry mesiace po ožiarení polovice nádoru. K druhej dobe už nedošlo, pretože klinický stav sa progresívne horšil. Druhý pacient, 77-ročný muž, mal parasagitálny meningeóm šíriaci sa do oboch hemisfér, objem tumoru bol 23,5 cm³. Vzhľadom na vek a zdravotný stav priamy výkon nebol možný. Meningeóm bol ožiarený dvojfázovo v rozpätí 6 mesiacov. Edém nastúpil 3 mesiace po druhom rádiochirurgickom výkone, zdravotný stav pacienta sa progresívne zhoršoval pre edém oboch hemisfér.
Riziko poradiačných komplikácií u meningeómov lokalizovaných na lebečnej bázy je oproti ostatným lokalizáciám signifikantne nižšie (graf 2).
Graf 2. Kaplan Meierova krivka zhoršenia po liečbe Leksellovým gama nožom v závislosti od lokalizácie meningeómu. 
Klinické zlepšenie po liečbe Leksellovým gama nožom
Analýzou nášho súboru sme zistili klinické zlepšenie u 89 (41 %) pacientov. Toto môže byť spôsobené samotnou liečbou gama nožom, ako aj rehabilitáciou, keďže určité percento pacientov sa nachádzalo vo fáze progresívneho zlepšovania po priamom operačnom výkone. Toto potvrdzujú výsledky, podľa ktorých došlo ku klinickému zlepšeniu u pacientov, ktorí predtým absolvovali operačný výkon vo viac ako polovici prípadov (50,8 %), zatiaľ čo v skupine pacientov liečených rádiochirurgiou ako prvou metódou to bolo len 36,5 %. Rozdiel spočíva tiež v tom, že pacienti, ktorí absolvujú liečbu gama nožom ako prvú, boli v našej štúdii klinicky asymptomatickí (aj napriek nárastu tumoru na MR) až v 43,4 %, zatiaľ čo u operovaných pacientov boli klinicky asymptomatickí len v 5,9 %.
U meningeómov lebečnej bázy bola zistená štatisticky významne vyššia šanca na zlepšenie klinických príznakov napriek faktu, že rádiochirurgická liečba ako prvá modalita bola aplikovaná u 66 % pacientov. Neurologický deficit sa zlepšil u 63 %. Podobné výsledky ohľadom klinického zlepšenia u pacientov liečených iniciálne rádiochirurgiou uvádzajú aj iné štúdie [21,27]. Zlepšenie je v tomto prípade pripisované zmenšeniu objemu meningeómu, čo v oblasti lebečnej bázy v blízkosti hlavových nervov zmenšuje tlak na ne, ako aj zníženej koncentrácii somatostatínových receptorov prítomných na bunkách meningeómu [15–17]. V publikovaných štúdiách sa zlepšenie klinického stavu udáva medzi 21–33 % [10,12,16,18,27,31].
Indikácia rádiochirurgickej liečby
Neexistuje jeden všeobecný protokol pre liečbu meningeómov. Rozhodnutie o liečebnom postupe musí zohľadniť veľkosť a lokalizáciu meningeómu, ako aj vek a klinický stav pacienta. Častokrát je najlepší multimodálny prístup.
Kandidáti na liečbu Leksellovým gama nožom ako prvou modalitou sú pacienti s meningeómami lebečnej bázy, s veľkosťou do 3 cm v priemere, event. do 10 cm³ objemu. Ďalej sú to starší pacienti a pacienti, pre ktorých by celková anestézia a dlhý operačný výkon boli príliš rizikové. Ďalšia skupina kandidátov pre rádiochirurgický výkon sú pacienti po resekčnom výkone, pri ktorom bol ponechaný zvyšok nádoru v blízkosti dôležitých štruktúr, vzhľadom na riziko progresie rezídua [38]. Rádiochirurgický výkon je možné indikovať aj u konvexitárnych meningeómov, v prípade výskytu perifokálneho edému, resp. pri objeme väčšom ako 10 cm³, vtedy je ale treba pamätať na zvýšené riziko liečby a v tomto smere informovať pacienta a zvážiť prípadné riziká alternatívnej liečby [15,25]. Zvolená by mala byť možnosť s najnižším možným rizikom nežiaducich účinkov, pretože pooperačný deficit má dopad nielen na život pacienta, ale aj jeho okolie [38].
Záver
Z analýzy skupiny pacientov s 10-ročným odstupom od liečby a mediánom sledovania 96 mesiacov vyplýva, že stereotaktická rádiochirurgia je bezpečnou a efektívnou metódou liečby meningeómov. Kontrola rastu tumoru po desiatich rokoch je 94,7 %, s dočasnou morbiditou 13,8 % a trvalou morbiditou 6,4 %. Rozhodnutie o najoptimálnejšej liečbe meningeómu, resp. o slede jednotlivých liečebných modalít by malo byť u každého pacienta individuálne.
doc. MUDr. Roman Liščák, CSc.
Oddělení stereotaktické a radiační neurochirurgie
Nemocnice Na Homolce
Roentgenova 2
150 30 Praha 2
e-mail: roman.liscak@homolka.czPřijato k recenzi: 9. 10. 2009
Přijato do tisku: 1. 2. 2010
Zdroje
1. DeMonte F, Marmor E, Al-Mefty O. Meningiomas. In: Kaye AH, Laws ER jr (eds). Brain tumors. London: Churchill Livingstone 2000 : 719–750.
2. Sanson M, Cornu P. Biology of menigiomas. Acta Neurochir 2000; 142(5): 493–505.
3. Whittle IR, Smith C, Navoo P, Collie D. Meningiomas. Lancet 2004; 363(9420): 1535–1543.
4. Sheehan J, Yen CP, Steiner L. Gamma knife surgery-induced meningioma. Report of two cases and review of the literature. J Neurosurg 2006; 105(2): 325–329.
5. Couldwell WT, Fukushima T, Giannotta SL, Weiss MH. Petroclival meningiomas: surgical experience in 109 cases. J Neurosurg 1996; 84(1): 20–28.
6. Cudlip SA, Wilkins PR, Johnston FG, Moore AJ, Marsh HT, Bell BA. Posterior fossa meningiomas: surgical experience in 52 cases. Acta Neurochir (Wien) 1998; 140(10): 1007–1012.
7. Kotapka M, Kalia KK, Martinez AJ, Sekhar LN. Infiltration of the carotid artery by cavernous sinus meningioma. J Neurosurg 1994; 81(2): 252–255.
8. Larson JJ, van Loveren HR, Balko MG, Tew JM jr. Evidence of meningioma infiltration into cranial nerves: clinical implications for cavernous sinus meningiomas. J Neurosurg 1995; 83(4): 596–599.
9. Sindou MP, Alaywan M. Most intracranial meningiomas are not cleavable tumors: anatomic-surgical evidence and angiographic predictibility. Neurosurgery 1998; 42(3): 476–480.
10. Chang SD, Adler JR jr. Treatment of cranial base meningiomas with linear accelerator radiosurgery. Neurosurgery 1997; 41(5): 1019–1025.
11. DiBiase SJ, Kwork Y, Yovino S, Arena C, Naqvi S, Temple R et al. Factors predicting local tumor control after gamma knife stereotactic radiosurgery for benign intracranial meningiomas. Int J Radiat Oncol Biol Phys 2004; 60(5): 1515–1519.
12. Iwai Y, Yamanaka K, Yasui T, Komiyama M, Nishikawa M, Nakajima H et al. Gamma knife surgery for skull base meningiomas. The effectiveness of low-dose treatment. Surg Neurol 1999; 52(1): 40–45.
13. Kenai H, Yamashita M, Nakamura T, Asano T, Sainoh M, Nagatomi H. Tolerance dose in gamma knife surgery of lesions extending to the anterior visual pathway. J Neurosurg 2005; 102 (Supp): 230–233.
14. Kollová A, Liščák R, Novotný J jr , Vladyka V, Šimonová G, Janoušková L. Gamma Knife surgery for benign meningioma. J Neurosurg 2007; 107(2): 325–336.
15. Kondziolka D, Flickinger JC, Perez B. Gamma Knife Meningioma Study Group. Judicious Resection and/or radiosurgery for parasagittal meningiomas: outcomes from a multicenter review. Neurosurgery 1998; 43(3): 405–414.
16. Lee JY, Niranjan A, McInerney J, Kondziolka D, Flickinger JC, Lunsford LD. Stereotactic radiosurgery providing long term tumor control of cavernous sinus meningiomas. J Neurosurg 2002; 97(1): 65–72.
17. Nicolato A, Gioretti P, Foroni R, Grigolato D, Pasquin IP, Zuffante M et al. Gamma knife radiosurgery in skull base meningiomas: a possible relationship between somatostatin receptor decrease and early neurological improvement without tumor shrinkage at short term imaging follow up. Acta Neurochir (Wien) 2005; 147(4): 367–375.
18. Roche PH, Pellet W, Fuentes S, Thomassin JM, Régis J. Gamma knife radiosurgical management of petroclival meningiomas result and indications. Acta Neurochir 2003; 145(10): 883–888.
19. Shafron DH, Friedman WA, Buatti JM, Bova FJ, Mendenhall WM. Linac radiosurgery for benign meningiomas. Int J Radiat Oncol Biol Phys 1999; 43(2): 321–327.
20. Spiegelmann R, Nissim O, Menhel J, Alezra D, Pfeffer MR. Linear accelerator radiosurgery for meningiomas in and around the cavernous sinus. Neurosurgery 2002; 51(6): 1373–1380.
21. Stafford SL, Pollock BE, Foote RL, Link MJ, Gorman DA, Schomberg PJ et al. Meningioma radiosurgery: tumor control, outcomes and complications among 190 consecutive patients. Neurosurgery 2001; 49(5): 1029–1037.
22. Subach BR, Lunsford LD, Kondziolka D, Maitz AH, Flickinger JC. Management of petroclival meningiomas by stereotactic radiosurgery. Neurosurgery 1998; 42(3): 437–443.
23. Tischler RB, Leoffler JS, Lunsford LD, Duma C, Alexander E 3rd, Kooy HM et al. Tolerance of cranial nerves of the cavernous sinus to radiosurgery. Int J Radiat Oncol Biol Phys 1993; 27(2): 215–221.
24. Morita A, Coffey RJ, Foote RL, Schiff D, Gorman D. Risk of injury to cranial nerves after gamma knife radiosurgery for skull base meningiomas: experience in 88 patients. J Neurosurg 1999; 90(1): 42–49.
25. Ganz JC, Reda WA, Abdelkarim K. Adverse radiation effects after Gamma Knife Surgery in relation to dose and volume. Acta Neurochir (Wien) 2009; 151(1): 9–19.
26. Pollock BE. Stereotactic radiosurgery for intracranial meningiomas: indications and results. Neurosurg Focus 2003; 14(5): e4.
27. Aichholzer M, Bertalanffy A, Dietrich W, Roessler K, Pfisterer W, Ungersboeck K et al: Gamma knife radiosurgery of skull base meningiomas. Acta Neurochir (Wien) 2000; 142(6): 647–653.
28. Hakim R, Alexander E 3rd, Loeffler JS, Shrieve DC, Wen P, Fallon MP et al. Results of linear accelerator-based radiosurgery for intracranial meningiomas. Neurosurgery 1998; 42(3): 446–454.
29. Niiro M, Yatsushiro K, Nakamura K, Kawahara Y, Kuratsu J. Natural history of elderly patients with asymptomatic meningiomas. J Neurol Neurosurg Psychiatry 2000; 68(1): 25–28.
30. Aaslid R, Gröger U, Patlak CS, Fenstermacher JD, Huber P, Reulen HJ. Fluid flow rates in human peritumoral oedema. Acta Neurochir Suppl 1990; 51 : 152–154.
31. Yoshioka H, Hama S, Taniguchi E, Sugiyama K, Arita K, Kurisu K. Peritumoral brain edema associated with meningioma: influence of vascular endothelial growth factor expression and vascular blood supply. Cancer 1999; 85(4): 936–944.
32. Liščák R, Kollová A, Vladyka V, Šimonová G, Novotný J jr. Gamma knife radiosurgery of skull base meningiomas. Acta Neurochir Suppl 2004; 91 : 65–74.
33. Pendl G, Schröttner, Eustacchio S, Feichtinger K, Ganz J. Stereotactic radiosurgery of skull base meningiomas. Minim Invasive Neurosurg 1997; 40(3): 87–90.
34. Kim DG, Kim CH, Chung HT, Paek SH, Jeong SS, Han DH et al. Gamma knife surgery of superficially located meningioma. J Neurosurg 2005; 102 (Suppl): 255–258.
35. Patil CG, Hoang S, Borchers DJ 3rd, Sakamoto G, Soltys SG, Gibbs IC et al. Predictors of peritumoral edema after stereotactic radiosurgery of supratentorial meningiomas. Neurosurgery 2008; 63(3): 435–440.
36. Chen CH, Shen CC, Sun MH, Ho WL, Huang CF, Kwan PC. Histopathology of radiation necrosis with severe peritumoral edema after gamma knife radiosurgery for parasagittal meningioma. A report of 2 cases. Stereotact Funct Neurosurg 2007; 85(6): 292–295.
37. Girvigian MR, Chen JC, Rahimian J, Miller MJ, Tome M. Comparison of early complications for patients with convexity and parasagittal meningiomas treated with either stereotactic radiosurgery or fractionated stereotactic radiotherapy. Neurosurgery 2008; 62 (Suppl 5): A19–A27.
38. Lang DA, Neil-Dwyer G, Garfield J. Outcome after complex neurosurgery: the caregiver’s burden is forgotten. J Neurosurg 1999; 91(3): 359–363.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Webové okénkoČlánek Neurovaskulární kongres 2010
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2010 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Farmakologická léčba epilepsie
- Ložiskové léze CNS u pacientů s HIV infekcí
- Tkáňové kultury pro studium prionových chorob
- Funkční význam pólu temporálního laloku
- Problematika indikace operační léčby u intramedulárních lézí
- Posttraumatický hypopituitarizmus u dětí a dospívajících
- Mozková flebotrombóza – analýza série 33 nemocných
- Neuroendokrinní dysfunkce u dětí a dospívajících po úrazu mozku
- Dlhodobé výsledky liečby meningeómov Leksellovým gama nožom
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
- Syndrom spontánní intrakraniální hypotenze u čínské pacientky s autozomálně dominantní polycystickou nemocí ledvin – kazuistika
- Unilaterální hypoplazie bazálních ganglií u pacientky s epilepsií – kazuistika
- Neobvyklé iatrogenní poranění n. musculocutaneus – dvě kazuistiky
- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXII. Rozbor složitějších kontingenčních tabulek je účinným nástrojem pro studium vztahů kategoriálních znaků - Neurovaskulární kongres 2010
- Jsou dekomprese páteřního kanálu a opakované zpevnění páteře u transverzální léze hrudní míchy nutné?
-
III. neuromuskulární kongres
6.–7. května 2010, Brno
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Farmakologická léčba epilepsie
- Funkční význam pólu temporálního laloku
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



