-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Farmakologická léčba epilepsie
Pharmacological Approaches to the Treatment of Epilepsy
In this paper we provide an overview of the basic principles of the treatment of epilepsy. These include attention to certain key points: making a correct diagnosis; the risk of seizure recurrence; the decision to initiate drug therapy in newly-diagnosed epilepsy; drug choice in relation to seizure/syndrome type and individual patient characteristics; treatment strategy in terms of monotherapy or of combination therapy; the treatment of pharmaco-resistant epilepsy, and finally the decision to withdraw antiepileptic drug(s) from seizure-free patients.
Key words:
epilepsy – treatment of epilepsy – anti-epileptic drugs – treatment strategy – newly diagnosed epilepsy – monotherapy – rational polytherapy – pharmaco-resistant epilepsy – drug withdrawal
Autoři: J. Hovorka
Působiště autorů: Neurochirurgická klinika 1. LF UK a ÚVN Praha
Vyšlo v časopise: Cesk Slov Neurol N 2010; 73/106(4): 351-373
Kategorie: Minimonografie
Souhrn
V naší práci prezentujeme přehled základních principů v léčbě epilepsie. Ke klíčovým bodům patří správná diagnóza, posouzení rizika opakování záchvatu, rozhodnutí o zahájení léčby, volba a taktika optimální léčby podle typu epileptických záchvatů/syndromů a individuality pacienta, léčba nově diagnostikované epilepsie, léčba obtížně léčitelné a farmakorezistentní epilepsie a nakonec rozhodování o ukončení léčby.
Klíčová slova:
epilepsie – léčba epilepsie – antiepileptika – taktika léčby – nově diagnostikovaná epilepsie – monoterapie – racionální polyterapie – farmakorezistentní epilepsie – ukončování léčbyPráce je podpořena výzkumným záměrem Patofyziologie neuropsychických onemocnění a její klinické aplikace VZ 002-1620816
Úvod
Čiň věci tak jednoduše, jak je možné, nikoli jednodušeji.
– A. EinsteinLéčba epilepsie dnes bezesporu patří k nejatraktivnějším a nejoptimističtějším terapeutickým tématům v neurologii a snad v medicíně vůbec. Je tomu tak ze dvou základních důvodů. Těmi jsou současné možnosti léčby a počet pacientů, kterým můžeme úspěšně pomoci.
První důvod je kvalitativní a týká se efektivity léčby, která nabízí široké terapeutické možnosti související s příchodem nových antiepileptik. Z hlediska účinnosti se dnes daří dosáhnout kompenzace až u tří čtvrtin pacientů (schéma 1). Tím se může pochlubit málokterá oblast medicíny. Z hlediska tolerance léčby můžeme pacientům nabídnout léky, které zohledňují jejich individuální somatický i psychický stav, což je stejně důležité jako kompenzace záchvatů. Optimální volená léčba tak pacientům nabízí dobrou kvalitu života a plnohodnotné zařazení do společnosti. To je také jediný a konečný cíl antiepileptické léčby. V tomto článku se věnujeme celostnímu pohledu na možnosti dlouhodobé antiepileptické léčby. Blíže se zabýváme základními čtyřmi klíčovými body, kterými jsou: zahájení léčby (riziko recidivy záchvatu, nabídka léčby, subjektivní postoj pacienta), léčba nově diagnostikované epilepsie (důkazní podklady pro léčbu, volba konkrétního léku v monoterapii podle guidelines a podle individuality pacienta), terapie obtížně léčitelné epilepsie (kombinovaná léčba, polyterapie, farmakorezistence) a možnost ukončení léčby.
Schéma 1. Přibližná prognóza léčby epilepsie, algoritmus léčby, včasné zvážení farmakorezistence a dalších možností léčby při neúspěchu alternativní monoterapie. 
Druhý důvod je spíše kvantitativní. Aktivní epilepsie postihuje 0,5–1 % populace, a v ČR se tak dlouhodobá léčba týká až 100 000 obyvatel, což je vysoké číslo. Je to sice osmkrát méně než uváděný počet pacientů léčených pro diabetes mellitus, jedno z nejčastějších interních onemocnění, ale také téměř desetkrát tolik, než je pacientů s Parkinsonovou chorobou. Uvádí se však, že epileptický záchvat prodělá během života až 6–8 % populace [1], tedy v ČR alespoň 600 000 jedinců. K tomu lze přičíst další pacienty, kteří prodělají jiný druh záchvatu než epileptický. A zde všude je na místě adekvátní diagnostika a správné rozhodnutí o zahájení či nezahájení léčby. Můžeme totiž pomoci velkému počtu pacientů a nebo naopak.
Problematika farmakologické léčby je velice široká a nelze ji plně obsáhnout v jednom sdělení. V naší práci uvádíme přehled základních klíčových bodů dlouhodobé antiepileptické léčby. V hlavních bodech též odkazujeme na různou úroveň zdrojů, kterými jsou léčebné postupy podloženy – „evidence-based“, otevřené studie, konsenzy expertů a klinické zkušenosti.
Rozhodnutí o zahájení antiepileptické léčby
Dialog o zahájení antiepileptické léčby
Dlouhodobou antiepileptickou léčbu zahajujeme tehdy, je-li diagnóza epilepsie jistá, výjimečně v případech, kdy je vysoce pravděpodobná a rizika z opakování záchvatů jsou závažná (stáří, osamělé osoby, komorbidity aj.). Rozhodnutí o léčbě je vždy individuální, vážíme riziko opakování záchvatu a z toho plynoucích komplikací oproti rizikům chronické farmakoterapie [2–11].
Prostředkem ke správnému rozhodnutí je interaktivní dialog mezi lékařem a nemocným, mezi názorem, doporučením, nabídkou lékaře (vysvětlení uvedených rizik, nabídnutí reálných možností léčby – účinnosti, tolerability, cílů, předpokládané prognózy) a vnitřním rozhodnutím nemocného v léčbě „jeho“, nikoli „naší“ nemoci. Je to první vstřícné vykročení k dobré compliance a k vzájemné spolupráci pacienta s lékařem na počátku většinou dlouhé cesty. Je to velmi důležité, neboť výskyt špatné compliance je odhadován až na 30 % případů [10].
Zahajovat léčbu paušálně již po prvním záchvatu či naopak až po opakovaném neprovokovaném záchvatu dnes nepovažujeme zvláště u dospělých nemocných za optimální [10]. Podkladem naší nabídky je správná diagnóza, vyhodnocení rizik pro opakování záchvatu, rizik plynoucích z léčby. Dospělí nemocní se obvykle dalšího, zejména závažného záchvatu (GTCS, poruchy vědomí) velmi obávají. Jde o výrazný zásah do jejich životní integrity. U dětí se s tím tolik nesetkáváme. Rovněž u starších nemocných je riziko opakování neprovokovaného záchvatu vysoké, navíc vzrůstají rizika poranění a dalších komplikací. U dětských pacientů s některými benigními idiopatickými věkově vázanými syndromy můžeme být zdrženlivější, rizika farmakoterapie zde mohou převyšovat rizika opakování záchvatu [3,4,9,12–14].
Správná diagnóza je prevence chybně indikované léčby a pseudofarmakorezistence
Před zahájením dlouhodobé antiepileptické léčby musíme vždy důsledně diferenciálně-diagnosticky odlišit dvě skupiny pacientů se záchvatovými stavy, u kterých nejde o epilepsii a kde léčba antiepileptiky není indikována. Přesto se v tomto kroku opakovaně chybuje. Tyto dvě skupiny zahrnují:
- pacienty se záchvaty neepileptickými, somaticky či psychogenně podmíněnými;
- pacienty, kteří prodělali akutní, symptomatický, provokovaný epileptický záchvat, ale netrpí epilepsií.
Záchvaty neepileptické (NES), tzv. imitátory epilepsie
NES mohou být epileptickým záchvatům velmi podobné. Pacienti s NES léčení chybně pro epilepsii tvoří významný podíl „pseudofarmakorezistentních“ pacientů. Další komplikací je, že se NES mohou vyskytovat v koincidenci s epilepsií. Neepileptické záchvaty dělíme do dvou základních okruhů [4–9,14–18].
1. Somaticky podmíněné neepileptické záchvaty: nejčastěji jde o synkopy, zejména konvulzivní (vazovagální, kardiogenní), migrény s aurou, vertigo, řadu spánkových poruch spánku (parasomnie – probuzení se zmateností, somnambulizmus, noční děsy, noční můry, spánkové halucinace, poruchy chování v REM spánku u starších pacientů, dále abnormální pohyby ve spánku – periodické pohyby ve spánku, bruxizmus, rytmické pohyby související se spánkem zejména u dětí, myoklonické pohyby ve spánku aj.), cévní mozková onemocnění (TIA, tranzitorní globální amnezie), mimovolní pohyby (myoklonus, paroxysmální dystonie, dyskinézy kineziogenní a nekineziogenní, tiky aj.), některé projevy metabolických onemocnění (DM, endokrinopatie, iontové dysbalance), toxických vlivů, abstinenčních stavů aj. [9].
Paušální nasazení antiepileptické léčby je v těchto případech pochopitelně neúčinné. Navíc však opomenutí adekvátní somatické diagnózy a neléčení ovlivnitelné příčiny může být v některých případech osudové, např. u prognosticky významných TIA, kardiologických onemocnění aj.
2. Psychogenně podmíněné neepileptické záchvaty (PNES): u dětí jde nejčastěji o afektivní záchvaty, u dospělých paroxyzmální úzkostné poruchy (panická porucha), disociativní poruchy (disociativní amnezie, disociativní křeče aj.). Dle literárních údajů i našich vlastních zkušeností jsou tyto poruchy častou příčinou chybné diagnózy epilepsie a dosud tvoří až 20 % případů neúspěšně léčené epilepsie [15–18]. K chybné diagnóze přispívá nadhodnocení abnormních EEG a nespecifických MR nálezů. Panická porucha a disociační poruchy se často vyskytují v koincidenci s epilepsií [16]. V případě nejasností je indikováno video-EEG monitorování s využitím aktivačních metod včetně sugesce, a to již při iniciální diagnostice [12]. Paušálně, z nejistoty či pro jistotu nasazená antiepileptická léčba zde opět není indikovana a je z pochopitelných důvodů neúčinná.
Akutní symptomatické, provokované záchvaty
Tímto typem záchvatů může mozek každého z nás reagovat na mimořádné, aktuální zdravotní a životní okolnosti a nepovažujeme je za epilepsii. V případě mozkového inzultu je výskyt záchvatu vázán na akutní, resp. subakutní období, za které jsou považovány obvykle 1–2 týdny od jeho vzniku. Z hlediska terminologického jsou pojmy akutní symptomatický a provokovaný používány jako synonyma, klasifikujeme je jako situačně vázané [19].
Akutní symptomatické záchvaty mohou být vyprovokovány řadou příčin: akutní mozkovou lézí různé etiologie a různého rozsahu (mozkovým traumatem, cévní mozkovou příhodou, neuroinfekcí, mozkovou operací aj.), poruchami systémovými (poruchy metabolizmu a vnitřního prostředí, včetně hypoglykemie a iontových změn, eklampsie), dalšími faktory, např. febriliemi u dětí, prokonvulzivně působícími léky (klasická tricyklická antidepresiva a neuroleptika, teofylin, penicilin, tramadol aj., riziko narůstá s dávkou léku), toxiny (amfetaminy, kokain, halucinogeny aj.), protrahovanou insomnií, dále se mohou objevit v rámci abstinenčního syndromu (u vysazení alkoholu – až v 10–15 % případů, nejčastěji v prvních 2–3 dnech, obdobně při vysazení barbiturátů, benzodiazepinů) [9]. Z uvedené škály možných příčin vyplývá i nutnost komplexního vyšetření těchto pacientů s vyloučením významného mozkového či systémového onemocnění.
Cílem léčby je v těchto případech především korekce konkrétní vyvolávající příčiny [3–6,9,10,14,20]. Krátkodobá profylaktická léčba antiepileptiky v trvání dnů až týdnů má v epileptologiii svá omezená uplatnění, a to právě v léčbě akutních, provokovaných záchvatů. Vedle profylaxe febrilních záchvatů jde o situace, kdy by případný záchvat mohl negativně ovlivnit aktuální stav pacienta, zejména tam, kde již jeden proběhl či kde je v EEG přítomen vzorec spojený s vyšším rizikem záchvatu, např. PLEDs, PP (periodické lateralizované epileptiformní výboje, periodický vzorec) nebo epileptiformní abnormita. Je však vhodné si zapamatovat, že účinnost dlouhodobé profylaktické léčby zůstává nadále jen zbožným přáním a v klinických studiích nebyla nikdy prokázána. Vedle neúčinnosti je dlouhodobou a zbytečnou zátěží pro pacienta.
Zahájení léčby u nově diagnostikované epilepsie vychází z její definice
Epilepsie je definována trvající tendencí (dispozicí) k opakovanému výskytu neprovokovaných záchvatů na podkladě systémové poruchy nebo neurologického inzultu [21].
Pro stanovení diagnózy epilepsie byl podle původní definice požadován výskyt alespoň dvou neprovokovaných záchvatů v odstupu nejméně 24 hod [22]. Tím bylo relativně dlouho zahajování antiepileptické léčby paušálně vázáno až na výskyt druhého záchvatu. Mnohdy zřejmě zbytečně.
V současné době vždy individuálně zvažujeme možnost zahájení léčby již po prvním epileptickém záchvatu. Více to odpovídá variabilní patofyziologické podstatě epileptického onemocnění a také nově navržené definici epilepsie: Epilepsie je zde definována jako onemocnění mozku charakterizované alespoň jedním epileptickým záchvatem, trvalou predispozicí mozku generovat epileptické záchvaty a dále neurobiologickými, kognitivními a psychosociálními důsledky tohoto onemocnění [23].
O některých aspektech této definice lze jistě diskutovat, nicméně ve vztahu k zahajování antiepileptické léčby z ní vyplývá to podstatné: vyloučeny jsou záchvaty provokované, akutní a individuálně jsou vážena rizika pro opakování prvního neprovokovaného záchvatu.
Obecné riziko opakování neprovokovaného epileptického záchvatu
Po prodělání prvního neprovokovaného záchvatu se obecné riziko recidivy uvádí v širokém rozmezí 20–80 %. Do dvou let dochází dle studií k opakování záchvatu ve 20–52 %, což představuje až 80–90 % případů, v období do pěti let dochází k recidivě až v 80 % [24–26]. Po prodělání dalšího neprovokovaného záchvatu narůstá riziko třetího záchvatu na 73 % a čtvrtého na 76 % [26–28].
Tyto údaje jsou však jen obecné. Velmi důležité je konkrétní posouzení přítomnosti či nepřítomnosti dalších, níže uvedených rizikových faktorů, které umožňují cílenější odhad prognózy.
Riziko recidivy záchvatu je nejvyšší v prvních šesti až dvanácti měsících po prvním, resp. předchozím záchvatu, což také zohledňují některá posudková kritéria, např. pro možnost držení řidičského průkazu. I tyto „kvantitativní“ údaje jsou významné pro poskytnutí nabídky lékařem pacientovi při rozhodování o zahájení léčby.
Rizikové faktory opakování neprovokovaných epileptických záchvatů
Zřejmě nejčastější situací v klinické praxi je otázka zahájení léčby po prvním generalizovaném tonicko-klonickém záchvatu (GTCS).
Zahájení této včasné léčby je doporučováno podle guidelines SIGN v těchto případech [29]:
- tam, kde GTCS předcházel již jiný typ záchvatu, např. myoklonický, absence či fokální záchvat,
- je-li v EEG přítomna nepochybná epileptiformní abnormita,
- je-li podkladem záchvatu organická mozková léze, vrozená, získaná, je-li přítomen neurologický deficit,
- pokud je pro pacienta riziko opakování záchvatu nepřijatelné a současně nejde o záchvat provokovaný.
Uvedené doporučení může sloužit jako výstižná ilustrace praktického využití nejčastěji uváděných rizik pro opakovaní záchvatu: První bod uvádí, že jde sice o první neprovokovaný GTCS, ale nikoli o první epileptický záchvat, a jde tedy o epilepsii. Druhý a třetí bod uvádějí opět významné faktory podporující dg. epilepsie, a tudíž riziko recidivy záchvatu, tedy epileptiformní abnormitu na EEG, resp. symptomatický původ epilepsie. Čtvrtý bod zohledňuje individualitu pacienta, resp. jeho subjektivní postoj a vylučuje záchvat provokovaný.
Z hlediska rozhodování o zahájení či odložení léčby je velmi cenné, podaří-li se včasně, v některých případech již po prvním záchvatu, diagnostikovat epileptický syndrom se známou prognózou (tab. 1, 2) [10,12,13,29–33]. Je tomu tak zejména u dětských, věkově vázaných epileptických syndromů s typickými klinickými i EEG nálezy. Ne vždy je však syndromologická diagnostika možná již po prvním záchvatu.
Tab. 1. Nejčastěji uváděná nepříznivá rizika pro opakování záchvatů iniciálně a po ukončení léčby. 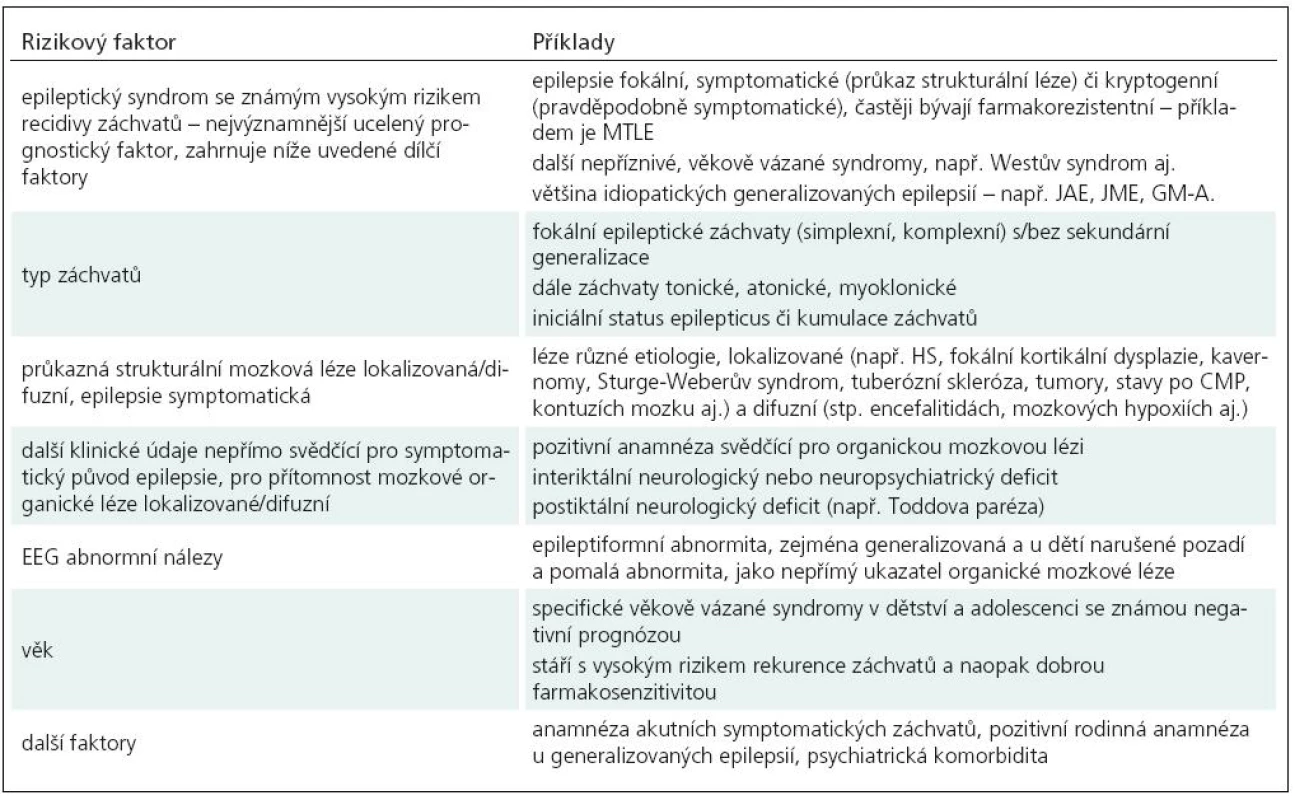
Tab. 2. Faktory svědčící proti zahájení chronické antiepileptické terapie. 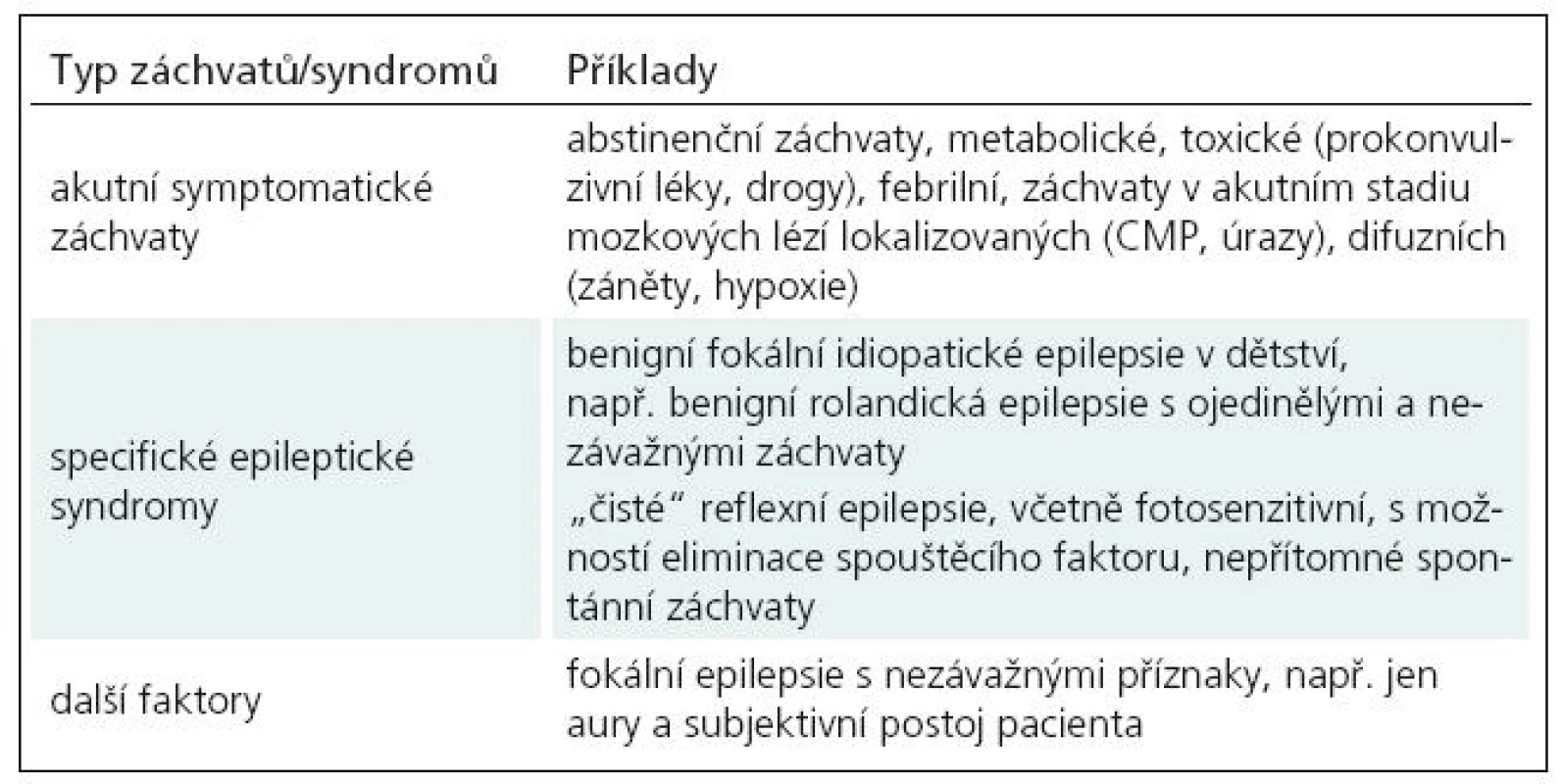
V benigních případech léčbu odkládáme, případně ani nenasazujeme. Tak je tomu u dětských benigních idiopatických fokálních epilepsií, např. benigní epilepsie s rolandickými hroty (BERS, BECT), Panayiotopoulosův syndrom, benigní epilepsie s okcipitálními hroty (BEOS) aj.
U generalizovaných idiopatických epilepsií, např. dětské absence (CAE), juvenilní absence (JAE), juvenilní myoklonické epilepsie (JME) aj. léčbu zpravidla zahajujeme včasně, obdobně jako u epileptických syndromů s nepříznivou prognózou – Westův syndrom, Lennox-Gastautův syndrom aj.
Specifickým problémem jsou reflexní epilepsie, např. fotosenzitivní. U čistě reflexních forem by mohla léčba spočívat v režimových opatřeních. Ve většině případů jsou však přítomny i spontánní záchvaty a léčbu zahajujeme.
Léčbu zahajujeme i u familiárních (autozomálně dominantních) fokálních epilepsií, např. autozomálně dominantní noční frontální epilepsie, familiární laterální temporální epilepsie aj.
Indikací k časné léčbě jsou symptomatické (sekundární) epilepsie na podkladě průkazného mozkového inzultu – např. meziotemporální epilepsie (MTLE s hipokampální sklerózou), epilepsie frontálního laloku na podkladě kortikální dysplazie, epilepsie po prodělaném mozkovém traumatu, po CMP, při mozkových nádorech, po zánětech mozku aj. Předpokladem je vyloučení záchvatů akutních. U epilepsií kryptogenních (pravděpodobně symptomatických) léčbu rovněž obvykle zahajujeme; pro sekundární původ pak svědčí přítomnost některých níže uvedených rizik.
K nejčastěji uváděným rizikům recidivy záchvatů dále patří: nepřímé údaje svědčící pro symptomatický původ záchvatů (neurologický deficit, mentální retardace, anamnéza prodělaného mozkového onemocnění), některé typy záchvatů (tonický, myoklonický, fokální), abnormní nález na EEG – lokalizovaná abnormita (fokální původ, symptomatický/kryptogenní) a zejména generalizovaná epileptiformní abnormita zvl. u dětí, svědčící pro IGE s rizikem opakování záchvatu, dále výskyt prvního záchvatu ve spánku. Diskutuje se o významu iniciální kumulace epileptických záchvatů, resp. o výskytu epileptického statu, febrilních záchvatů v anamnéze a pozitivní rodinné anamnéze u idiopatických epilepsií. Za rizikový faktor považují někteří autoři i psychiatrickou komorbiditu.
Přehled základních faktorů svědčících pro zahájení antiepileptické léčby a proti ní uvádíme v tab. 1. a 2. Obecně lze říci, že rizika svědčící pro zahájení antiepileptické léčby jsou velmi obdobná rizikům pro relaps záchvatů při jejím ukončování. Zabýváme se jimi též v části věnované ukončování antiepileptické léčby.
Diagnosticky a léčebně zavádějícími mohou být některé méně známé a nověji uváděné stavy, např. benigní (izolované) fokální záchvaty v adolescenci, jejichž podkladem je jen krátkodobě manifestní dispozice k neprovokovaným záchvatům imitující počátek fokální sekundární/kryptogenní epilepsie. Fokální i generalizované záchvaty v počtu jednoho až pěti se objevují v nakupení během krátkého období do 36 hod. Dále se již záchvaty neobjevují a léčba není nutná. Není však překvapivé, že v některých případech jsou tito pacienti dlouhodobě zbytečně léčeni jako při fokální, resp. sekundárně generalizované kryptogenní epilepsii. MR a EEG jsou u těchto pacientů normální, další rizika také chybí [9].
Při rozhodování o zahájení léčby jsou vedle uvedených rizik významné tyto faktory: závažnost symptomatologie epileptického záchvatu, subjektivní postoj pacienta a frekvence záchvatů. Příkladem mohou být záchvaty se závažnou symptomatologií, např. GTCS s bezvědomím, křečemi, následnou alterací, či záchvaty CPS s narušeným jednáním a sebeovládáním, kdy většina zejména dospělých pacientů bude zahájení léčby nakloněna. Oproti tomu bývají k zahájení léčby pacienti zdrženlivější v případě záchvatů s nezávažnou, nehendikepující symptomatologií, např. aury s jen subjektivní symptomatologií (senzitivní, senzorickou, vegetativní), či záchvaty simplexní (motorické) bez narušení vědomí, jednání a dalších závažnějších příznaků. Tomuto pohledu vychází vstříc i nově navržená klasifikace dostupná internetově na stránkách ILAE (Mezinárodní liga proti epilepsii), která v případě fokálních záchvatů odlišuje záchvaty bez poruchy nebo s poruchou vědomí/reaktivity a fokální záchvaty s vývojem do záchvatů konvulzivních (dříve sekundárně generalizovaných). Je možné, že v budoucnu tato klasifikace ovlivní i posudkové hodnocení fokálních záchvatů bez poruchy vědomí a reaktivity a uvolní kritéria např. pro držení řidičského průkazu. Tím by zřejmě poklesla i motivace k léčbě ve skupině těchto pacientů s fokálními nezávažnými záchvaty. Dalším faktorem je frekvence záchvatů, kdy pacienti se záchvaty sporadickými, vyskytujícími se třeba po řadě měsíců i několika letech, bývají k léčbě rovněž méně motivováni.
Co pacientům nabízí antiepileptická léčba?
U žádného ze současně dostupných antiepileptik nebyl dosud v klinických studiích prokázán vlastní „antiepileptický účinek“ [9,27,34], který by ovlivňoval přímo podstatu, další průběh či vznik epileptického onemocnění. Ve skutečnosti mají tyto léky pouze symptomatické účinky, „protizáchvatové“. Zda jen tyto preventivní účinky pro výskyt-frekvenci epileptických záchvatů mají nějaký další, takto zprostředkovaný nepřímý vliv na přirozený průběh epilepsie, není známo [9,27,34]. Některé starší práce podporovaly představy o progresivním průběhu a nepříznivé prognóze neléčené epilepsie. Jde o známou klinickou hypotézu „progresivní epileptogeneze“, formulovanou Gowersem, že „záchvaty plodí či přivolávají další záchvaty“. Některé novější klinické studie z rozvojových zemí však tuto hypotézu nepotvrzují a uvádějí i spontánní zlepšení. Nalézají stejný podíl remisí u pacientů léčených včasně i u těch, kde byla léčba zahájena až po delší době a kdy pacienti prodělali řadu, v některých případech až sto GTCS [27,35]. Na základě těchto údajů by tedy odložené zahájení léčby nemělo ovlivnit další prognózu onemocnění.
Jaký je tedy efekt zahájení antiepileptické léčby na další výskyt záchvatů? Údaje z řady studií se shodují na tom, že zahájení antiepileptické léčby po prvním záchvatu snižuje riziko recidivy o 50 % [34]. Kumulativní riziko v období jednoho roku bylo u včasně léčených pacientů 17, resp. 26 % a u pacientů s odloženou léčbou a po dvou letech 37, resp. 45 %. Ze shrnutí výsledků této i dalších studiích vyplývá, že včasně zahájená léčba snižuje výskyt dalších záchvatů, zejména v následujícím časném období. Na druhou stranu po zahájení léčby u pacientů včasně léčených a neléčených jsou dlouhodobé výsledky léčby a prognóza obdobné [34,35].
Volba antiepileptické léčby u nově diagnostikované epilepsie – monoterapie
Základní taktika – iniciální monoterapie
U pacientů s nově diagnostikovanou epilepsií zahajujeme antiepileptickou léčbu vždy monoterapií. V případě neúspěchu je doporučována alternativní monoterapie, obvykle alespoň dalším jedním či dvěma léky [2–4,6,9,10,28,36,37]. Nejvíce kompenzovaných pacientů s epilepsií je léčeno právě monoterapií a příznivá odezva na ni je považována za prognosticky příznivý faktor (schéma 1). Přibližně 50–70 % pacientů s nově diagnostikovanou epilepsií dosáhne nejméně roční remise.
Výstižná data o prognóze nově diagnostikované epilepsie poskytuje např. následující studie: Ze 780 pacientů s nově diagnostikovanou epilepsií dosáhlo nejméně roční remise 65 % pacientů, z toho 50 % na iniciální monoterapii, 11 % na první alternativní monoterapii a jen 4 % na druhé alternativní monoterapii či na léčbě kombinované. Prognóza pacientů, kteří iniciální monoterapii netolerovali, byla lepší nežli těch, kde byla léčba neúčinná. Zbylých 35 % pacientů remise nedosáhlo. Je velmi pravděpodobné, že v těchto případech půjde o epilepsii obtížně léčitelnou, farmakorezistentní (refrakterní) a právě u nich by měla být včas zvážena chirurgická léčba. Dlouhodobá prognóza byla lepší u seniorů a adolescentů, kteří dosáhli dlouhodobé remise v 85, resp. 65 % [38].
Již při iniciální terapii je nutno dodržovat základní pravidla, jež jsou předpokladem adekvátní a standardní léčby. Při monoterapii i polyterapii je cílem dosažení nejnižších účinných dávek léku [6,9,10,11]. Při ní je výskyt nežádoucích účinků a případných lékových interakcí nížší a rovněž compliance bývá dobrá. Od počátku bychom se měli vyhnout „nadměrné léčbě“ zbytečně vysokými dávkami či kombinacemi léků. Chyba je však také nevyužití maximálních tolerovaných dávek léku (MTD) při částečně účinné léčbě a ukvapený přechod na jiný lék či na polyterapii. Tedy nevyužití plné potence a ztráta léku, který mohl být pro pacienta např. jediný prospěšný. K přerušení léčby z důvodů intolerance může dojít i nerespektováním rychlosti titrace u konkrétního léku a typu pacienta. Z hlediska titrace můžeme antiepileptika pragmaticky rozdělit do tří skupin. Rychlá titrace během jednoho či několika málo dnů je možná u PHT, BZD, GBP, PGB, LVT, velmi pomalá titrace po dobu několika týdnů je nutná u LTG, TPM, ZNS, PHB, ostatní léky lze většinou titrovat do 2–4 týdnů. K nasazování léčby bývají citlivější děti, senioři, pacienti polymorbidní, dále pacienti s polyterapií, s psychiatrickou komorbiditou a medikací.
Z hlediska farmakokinetiky dnes preferujeme retardované formy léků a zejména u pacientů s polyterapií léky s minimálními lékovými interakcemi (LEV, GBP, PGB, LTG, ZNS, LCM) (tab. 3).
Tab. 3. Základní farmakokinetické interakce mezi antiepileptiky. 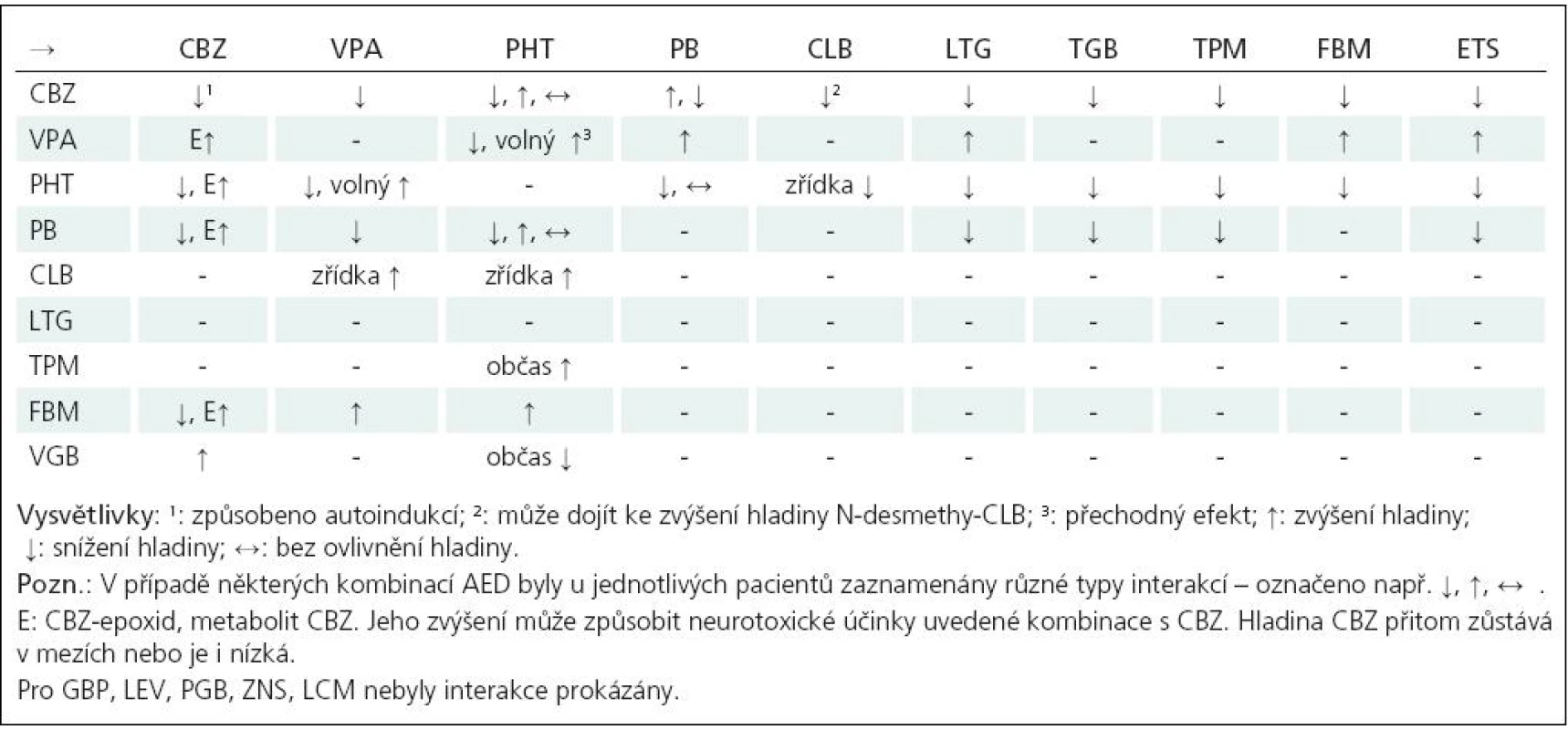
S tím souvisí i význam vyšetřování plazmatických hladin antiepileptik. V určitých situacích může být toto vyšetření velmi přínosné, na straně druhé nesmí být přeceňováno a špatně chápáno.
Rozmezí hladin nám neposkytuje informace o skutečné „terapeutické hladině“ či „terapeutickém pásmu“ u daného pacienta. Jde o „koncept statistický“, založený na monitorování hladin v populačních studiích. Vyjadřuje vzájemný vztah hladiny antiepileptika, léčebného efektu a výskytu nežádoucích účinků, který byl stanoven u pacientů s epilepsií. Rozmezí hladin antiepileptik nám tak sděluje následující skutečnosti:
- v udaném rozmezí dosáhne nejvíce pacientů „optimálního“ efektu antiepileptika,
- v případě nižších hladin bývá více pacientů léčbou nekompenzováno, u hladin vyšších je vyšší pravděpodobnost výskytu nežádoucích účinků.
Laboratorní hodnota plazmatické koncentrace antiepileptika nám udává jeho celkovou hladinu, tedy jak inaktivní – na proteiny vázanou frakci, tak aktivní – volnou frakci. Stanovení volné frakce antiepileptik by bylo ideální, není však obvykle rutinně dostupné. Hlavní klinický význam má při změnách koncentrací plazmatických bílkovin nebo při lékových interakcích, kdy dochází mezi léky ke „kompetici“ o vazebná místa na plazmatických bílkovinách.
Vyšetření plazmatických hladin využíváme nejčastěji za těchto okolností
Po zahájení, po změně léčby, po kompenzaci stavu je přínosné zjistit ustálené hladiny léků. Tím zjišťujeme jakousi individuální „terapeutickou hladinu“, při níž je pacient kompenzován. Ta může být prospěšná ve chvíli, kdy dochází k dekompenzaci záchvatů. Pokles těchto hladin může být indikátorem lékových interakcí, autoindukce vlastního metabolizmu u hepatálních induktorů (např. u CBZ), případně non-compliance.
Vyšetření hladin je přínosné pro úpravu dávek léků v průběhu fyziologických změn v souvislosti s dospíváním, stárnutím, v průběhu gravidity a obecně při změnách hmotnosti pacienta.
Obdobně je tomu i u patologických stavů ovlivňujících absorpci, distribuci nebo metabolizmus antiepileptika (obecně onemocnění gastrointestinálního traktu, renální či hepatální onemocnění) a v případě lékových interakcí u pacientů na polyterapii (antiepileptiky i ostatními léky).
V určitých situacích může docházet k nepochopení významu tohoto vyšetření, např. snížení, event. vysazení léčby při nedostatečné kompenzaci, při jen částečném zlepšení, při nepřítomnosti vedlejších účinků léčby a při vyšší hladině léku, který může být mylně označen za neúčinný. Indikováno je však při částečném zlepšení naopak další navýšení do MTD nehledě na hladiny léku, teprve poté, při nedostatečné účinnosti, je na místě výměna léku nebo kombinovaná léčba.
Dalším případem je snižování dávky antiepileptika, které má vyšší hladinu než horní hodnota statistického rozmezí, i při nepřítomnosti nežádoucích účinků a uspokojivé kompenzaci pacienta. Z klinické praxe je známo, že tento postup je rizikový z hlediska recidivy záchvatů.
Opačný případ je zbytečné navyšování léčby „podle hladin“ tam, kde je pacient plně kompenzován na minimálních terapeutických dávkách, byť jsou pod dolní hranicí statistické normy.
Některé laboratoře dávají dokonce na základě zjištěných plazmatických hladin doporučení ke změnám antiepileptické léčby. Byť dobře míněná, jsou tato doporučení klinicky zcela nerelevantní a mohou pacientovi spíše uškodit.
Jediné rozhodnutí o možné změně antiepileptické medikace je na lékaři, v jehož péči se pacient nachází. Lékař se řídí klinickým stavem pacienta. Je tedy nutné zdůraznit zcela individuální přístup k problematice využití plazmatických hladin antiepileptik.
Volba konkrétního léku – základní koncept
Výběr konkrétního léku provádíme ve dvou základních rovinách, resp. na dvou osách [40]:
- podle spektra účinnosti antiepileptika u konkrétního typu záchvatů, resp. syndromu (faktory „seizure/syndrom related“) a podle priorit léku (faktory „treatment related“), ke kterým patří jeho další vlastnosti (mechanizmy účinku, rychlost titrace, lékové interakce aj.), jde o volbu léku z hlediska přímého vztahu k epilepsii,
- podle individuality pacienta (věk, pohlaví, somatická a psychická kondice, komorbidity, další farmakoterapie aj.), tedy ze širšího pohledu na pacienta, za hranice epilepsie, epileptických záchvatů (faktory „patient-related“).
Tento koncept je umožněn současnou širokou nabídkou nových léků a zohledňuje i základní smysl antiepileptické léčby. Zde se jedná o více než pouhou kompenzaci epileptických záchvatů. Cílem léčby je optimální celkový funkční stav nemocných a optimální kvalita jejich života. Snažíme se o potlačení epileptických záchvatů, zmírnění jejich závažnosti a dopadu na život pacienta, a to za cenu pokud možno žádných, minimálních či přijatelných vedlejších účinků léčby. Jde tedy vždy o bilanci mezi mírou potlačení záchvatů a kvalitou relativně dlouhého interiktálního stavu, ve kterém by nemocný měl pokud možno normálně žít [6,10]. Cílem léčby tudíž není potlačení všech i nezávažných záchvatových projevů (např. aury, nezávažné SPS) za každou cenu, kdy by nemocný trpěl závažnými somatickými či psychickými nežádoucími účinky léčby. Výskyt nežádoucích účinků je podmíněn nejen typem a dávkami léku, ale i jeho individuální tolerancí pacientem, což tento koncept zohledňuje.
Volba léku podle typu epileptického záchvatu/syndromu, „seizure/syndrom related“
Tradičním a základním vodítkem pro výběr antiepileptika je jeho účinnost podle typu epileptického záchvatu/syndromu, a to v monoterapii i v kombinované léčbě [19,4,42].
Jde o první krok při volbě léčby a centrální téma prakticky všech guidelines. Ty jsou dostupné na dvou důkazních úrovních:
- guidelines založené na vědeckých důkazech - „evidence-based“,
- guidelines založené na konsenzu expertů.
Podrobněji jsme o guidelines pojednali v jiné dostupné práci a zde uvádíme jen jejich základní charakteristiky [43].
1. ILAE (Mezinárodní liga proti epilepsii) 2006: Doporučení pro iniciální monoterapii u nově diagnostikované či neléčené epilepsie, založené na vědeckých důkazech [44]
V Evropě jsou tyto guidelines v současné době často citovány. Jejich podkladem byla komplexní analýza studií publikovaných v letech 1940–2005 týkajících se léčby epilepsie a vyhodnocení výsledků v souladu se současným konceptem a požadavky medicíny založené na důkazech.
Původně byla koncipována komplexní otázka, která optimální iniciální monoterapie je doložena vědeckými důkazy. Ta se ukázala jako nezodpověditelná. Zahrnuje celou řadu faktorů, které se v klinické praxi sice velmi významně uplatňují, ale vědecké studie o nich nepojednávají (tab. 4). Otázka tedy byla zúžena na vědecky doložený průkaz účinnosti a efektivity iniciální léčby (setrvání na léčbě) u jednotlivých typů záchvatů/syndromů.
Tab. 4. Faktory ovlivňující výběr optimální antiepileptické léčby, ILAE 2006 [9]. ![Faktory ovlivňující výběr optimální antiepileptické léčby, ILAE 2006 [9].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/86bb2b384f61f205fddd1171b26ecdbf.jpg)
Na základě této analýzy byla vytvořena doporučení na šesti hladinách významnosti (A–F).
Doporučení na nejvyšším stup-ni A, B (účinnost potvrzená/pravděpodobná) představují léky první volby. Jsou však překvapivě stručná a týkají se jen fokálních (parciálních) záchvatů: lékem první volby jsou u dospělých CBZ, PHT, VPA, u dětí OXC, u seniorů GBP, LTG. Ostatní typy epileptických záchvatů a epileptické syndromy pak již léčíme na nižší úrovni důkazů, tedy na hladině možné/potenciální účinnosti/efektivity (tab. 5). Totéž se týká i léčby dalšími antiepileptiky, vyjma výše uvedených.
Tab. 5. Zjištěná úroveň důkazů pro iniciální monoterapii epilepsie, založená na vědeckých důkazech, ILAE 2006 [44]. ![Zjištěná úroveň důkazů pro iniciální monoterapii epilepsie, založená na vědeckých důkazech, ILAE 2006 [44].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4be43800f2ca5d1f7e7c9140ef9c354a.jpg)
Výsledky analýzy týkající se iniciální monoterapie u epilepsie nejsou z hlediska medicíny založené na důkazech příliš košaté, rozhodně nevystihují širokou klinickou realitu a nevystačíme s nimi.
Můžeme se tedy shodnout s autory, že v současné době není v případě epilepsie dostatek vědecky podložených důkazů pro vytvoření standardů optimální iniciální monoterapie v širokém slova smyslu (tab. 4). O to však v klinické praxi jde.
2. AAN a AES (Americká neurologická akademie, Americká epileptologická společnost) 2004: Účinnost a tolerabilita nových antiepileptik 2004 [45,46], doporučení založena na vědeckých důkazech.
Provedené analýzy a doporučení se v tomto případě soustředily na léčbu sedmi novými antiepileptiky (GBP, LTG, TPM, TGB, OXC, LEV, ZNS) v porovnání s antiepileptiky staršími. Přes některé odlišnosti analýzy jsou závěry a doporučení blízké doporučením ILAE [2].
Pacienti s nově diagnostikovanou epilepsií, doporučení na úrovni A, B [45]: pacienti s fokální epilepsií mohou být iniciálně léčeni klasickými, staršími antiepileptiky (CBZ, PHT, VPA, PHB) nebo novými antiepileptiky (LTG, GBP, OXC, TPM). Výběr konkrétního léku závisí na dalších individuálních charakteristikách pacienta. Účinnost léčby staršími i novými antiepileptiky je obdobná, tolerabilita nových je lepší. Pro iniciální léčbu TGB, ZNS, LEV nebyly v době vydání guidelines dostupné důkazy. Při iniciální léčbě dětských absencí je z nových antiepileptik účinný LTG.
Pacienti s refrakterní terapií, doporučení na úrovni A, B [46]: všech sedm nových antiepileptik je v add-on terapii u dospělých pacientů s refrakterní fokální epilepsií účinných. U dětí s refrakterní fokální epilepsií jsou v add-on terapii účinné GBP, LTG, OXC, TPM, pro zbylé tři léky nejsou údaje známy. Účinnost a nežádoucí účinky stoupají s dávkou léku, pomalá titrace je lépe tolerována a obecně doporučována, při neúčinnosti léčby do maximálních tolerovaných dávek. U pacientů s refrakterní fokální epilepsií jsou v monoterapii účinné LTG, OXC, TPM, pro ostatní čtyři léky nejsou údaje známy. TPM je účinný v léčbě refrakterních primárně generalizovaných tonicko-klonických záchvatů u dospělých a dětí, TPM a LTG jsou účinné při léčbě atonických záchvatů (drop-attacs) u Lennox-Gastautova syndromu.
3. Terapeutické guidelines u epilepsie, které jsou založeny na konsenzu expertů, tedy více než jen na vědeckých důkazech
Z přehledu guidelines založených na vědeckých důkazech je zřejmé, že pro klinickou praxi nepřinášejí dostatek potřebných informací [43]. Mnohé jsou však známy z vědecky méně dokonalých prací, ze studií otevřených, naturalistických, které jsou klinické praxi blízké a také přímo z klinické empirie.
Konsenzuální doporučení se netýkají pouze volby, účinnosti, tolerance a efektivity antiepileptické léčby, ale celé řady dalších významných situací v léčbě epilepsie. Např. taktiky léčby (zahajování, vedení, ukončování), léčby ve speciálních situacích (léčba dětí, žen ve fertilním věku a během gravidity, ve stáří, u somaticky a psychiatricky komorbidních pacientů, léčba epileptického statu aj.). Jde o informace velmi významné pro zavedení optimální léčby, její standardizace [44] (tab. 4). Ty jsou obvykle obsahem „národních guidelines diagnostiky a léčby epilepsie“.
V ČR je již tradičně dostupný Soubor minimálních diagnostických a terapeutických standardů u pacientů s epilepsií [2] vypracovaný a vydaný skupinou EpiStop, s poslední reedicí v roce 2007. Centrálním tématem i zde zůstává volba antiepileptické léčby podle typu záchvatu a syndromu, ve stručné a výstižné podobě jsou uvedena i další diagnostická a léčebná doporučení. Výhodou je, že standardy EpiStop jsou dostupné na webových stránkách, a proto je zde více nerozvádíme.
V Evropě jsou z řady národních guidelines z hlediska diagnostiky, taktiky a výběru léčby u epilepsie často citovány guidelines v anglickém jazyce NICE (National Institute for Clinical Excellence) z roku 2004 [47] a SIGN (Scottish Intercollegiate Guidelines Network) z roku 2003 [29]. Oproti českým doporučením jsou obsažnější, více prostoru je věnováno některým otázkám diagnostiky, diferenciální diagnostiky a taktiky léčby, které jsou doplněny přehlednými tabulkami a schématy, řada informací navíc obsahuje údaje o důkazní síle doporučení. V SIGN je např. uveden zmíněný doporučený postup po prvním GTCS, uvedena je zde i praktická tabulka týkající se ožehavé otázky – rizik vysazování antiepileptické léčby. Riziko rekurence záchvatů je doloženo studiemi a je vztaženo k následujícím faktorům: typ záchvatu, odpověď na iniciální léčbu, nález na EEG a doba remise (tab. 6). V NICE guidelines nalézáme zdařilé tabulky k volbě léčby podle typu epileptického záchvatu a syndromu (tab. 7, 8). Oproti české verzi jsou obsažnější, doporučené léky jsou děleny na 1., 2. a další volbu. To, co je pro klinickou praxi důležité, je uvedení léků nevhodných, potenciálně záchvaty agravujících (tab. 7, 8). Toto kromě jednoho údaje o LTG u syndromu Dravetové v české verzi nenalézáme. Oproti naší verzi jsou zde i další rozdíly, např. i primárně generalizované epilepsie s GTCS, je jako lék první volby CBZ, u syndromu BERS (BECT) není jako lék volby u nás s úspěchem užívaný sultiam.
Tab. 6. Odhad rizika recidivy záchvatů po dvouleté remisi, podle typu záchvatu, odezvy na iniciální terapii a EEG nálezu. 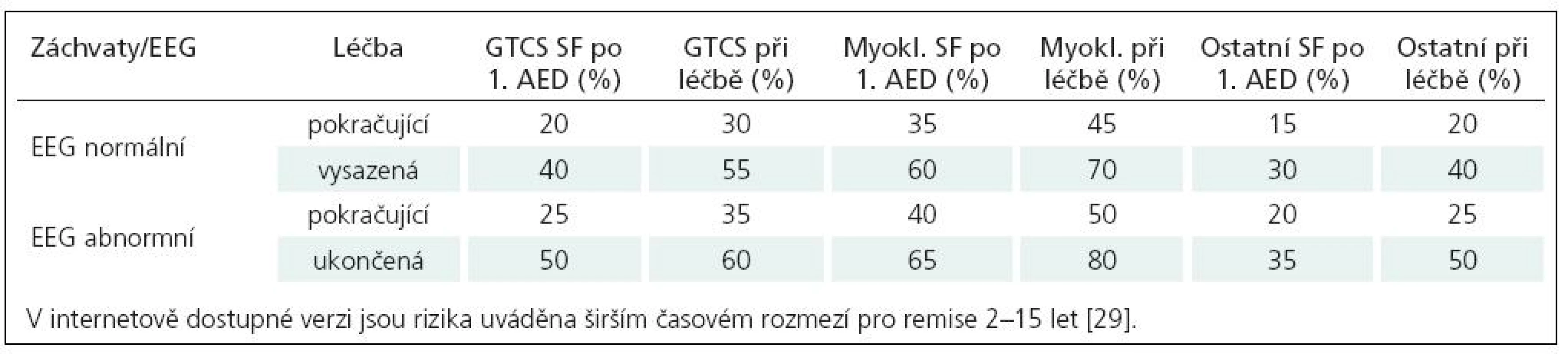
Tab. 7. Volba léku podle typu epileptického záchvatu, NICE 2004 [47]. ![Volba léku podle typu epileptického záchvatu, NICE 2004 [47].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/00b212bacb3e26a2a3d41dde5b7b9c59.jpg)
Tab. 8. Volba léku podle epileptického syndromu, NICE 2004 [47]. ![Volba léku podle epileptického syndromu, NICE 2004 [47].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1dbbff92e438a6495206ddf558f21254.jpg)
Nevýhodou všech guidelines je, že stárnou rychleji než jejich autoři.
Tak tomu je i v případě citovaných ILAE guidelines z roku 2006. Třeba zde chybí studie s LEV třídy I, která prokázala v následujících letech dle požadovaných kritérií jeho účinnost u nově diagnostikované fokální epilepsie u dospělých (záchvaty fokální, sekundárně generalizované) [48].
I v případě konsenzuálních guidelines u nás i v zahraničí chybí aktuálně registrované léčby. Informace o nich jsou však průběžně publikovány [49–52]. V současné době se to týká u nás těchto léků:
Zonisamid, ZNS je v ČR registrované antiepileptikum, které rovněž získalo úhradu. Tím vstoupil do běžné klinické praxe. Registrován je pro přídatnou léčbu fokální epilepsie. Tato indikace bude jistě zohledněna v nově připravovaných ministandardech EpiStop. Nicméně jde o širokospektré antiepileptikum, podle některých studií účinné u primárně generalizovaných záchvatů (GTCS, myoklonické, absence) a dále u progresivní myoklonické epilepsie. ZNS by neměl agravovat žádný typ záchvatů.
Lacosamid, LCM je v ČR registrován pro přídatnou léčbou fokální epilepsie se záchvaty s/bez sekundární generalizace u pacientů nad 16 let. Zcela recentně rovněž získal úhradu. Obdobně jako ZNS bude doplněn v nové verzi ministandardů EpiStop.
Rufinamid, RFM je širokospektré antiepileptikum, nadějné pro pacienty s Lennox-Gastautovým syndromem, významně ovlivňuje nejen celkovou frekvenci záchvatů, ale i atonické záchvaty (drop-ataky). V této indikaci je v EU registrován u pacientů ve věku nad čtyři roky.
Eslicarbazepin, ESL je nově v EU registrován pro přídatnou léčbu fokálních záchvatů s/bez sekundární generalizace u dospělých. V současné době je v jednání jeho úhrada.
Antiepileptika mají různé spektrum účinnosti (tab. 9).
Tab. 9. Spektrum účinnosti antiepileptik a jejich prokonvulzivní účinky. 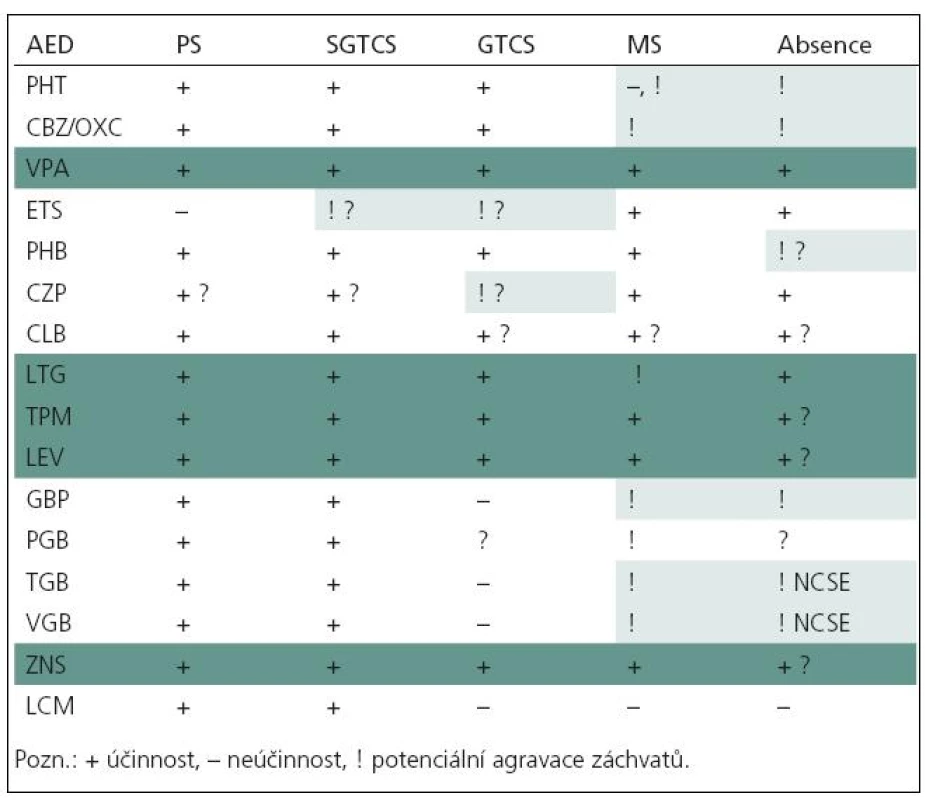
Antiepileptika můžeme rozdělit podle spektra účinnosti do dvou skupin.
1. Širokospektrá antiepileptika (VPA, LTG, TPM, LEV, ZNS) lze využít při léčbě různých typů záchvatů. Tedy i tam, kde si konkrétním typem záchvatů či syndromu nejsme jisti, případně tam, kde se u pacienta vyskytuje více typů záchvatů. Nepůsobí agravaci záchvatů. Širokospektrá antiepileptika jsou některými autory považována za optimální pro přídatnou, resp. kombinovanou léčbu. Některá širokospektrá antiepileptika potlačují fotosenzitivitu, což lze s úspěchem využít v léčbě nejčastějších forem reflexních epilepsií. Patří k nim VPA, LTG, CLZ, PHB, PRIM.
2. Antiepileptika s užším spektrem účinku (např. u fokální epilepsie – CBZ, OXC, GBP, PGB, TGB, VGB, LCM a u absencí – ETS) jsou účinná jen u některých typů záchvatů. Většinou jde o léky indikované u fokálních epilepsií, v případě ETS o léčbu absencí, u SUL léčbu BECT. Některé tyto léky však mohou zhoršovat určité typy záchvatů, zvl. u idiopatických generalizovaných epilepsií (tab. 7–9).
I přes relativně dlouhodobou znalost této problematiky se její uplatnění v klinické praxi prosazuje v širší míře až v posledních letech. Nevhodně volená léčba podle typu záchvatu/syndromu včetně jejich agravace není dosud zdaleka vzácným příkladem „pseudofarmakorezistence“ [53,54].
Základními parametry antiepileptické léčby jsou účinnost, tolerabilita, efektivita
Za nejvýznamnější parametr antiepileptické léčby je považována její efektivita, která je vyjádřena délkou setrvání na léčbě. Lze jí znázornit pomocí Kaplan-Mayerových grafů, jež uvádějí pokles počtu léčených pacientů daným lékem v průběhu léčby. Setrvání na léčbě je ovlivněno nejen účinností, ale také tolerabilitou, a zhodnocuje tak oba další parametry [9].
Účinnost, tolerabilita a efektivita léčby byly retrospektivně obecně hodnoceny v metaanalýzách provedených velkých studií u nových antiepileptik. Léky silnější, třeba TPM, VGB, byly hůře tolerovany oproti lékům slabším, např. GBP, LTG.
Jiné studie hodnotily účinnost a tolerabilitu některých léků konkrétněji, odděleně u epilepsií fokálních a generalizovaných. Z těchto studií již lze odvozovat míru účinnosti léku u daného typu záchvatů. Např. ve studii se 780 pacienty bylo ve skupině nemocných s fokální epilepsií kompenzováno 63 % na léčbě LTG, 45 % na CBZ a 42 % na VPA. Ve skupině pacientů s idiopatickými generalizovanými epilepsiemi bylo kompenzováno 68 % na léčbě VPA, 45 % na LTG a 31 % na CBZ. Pacienti s juvenilní myoklonickou epilepsií byli kompenzováni v 75 % při léčbě VPA a v 39 % na LTG. K ukončení léčby vedly nežádoucí účinky u CBZ v 16 %, u VPA v 7 %, u LTG rovněž v 7 % [55].
Uvedené parametry antiepileptické léčby byly hodnoceny také prospektivně, např. v největší prospektivní, randomizované studii SANAD, a to odděleně pro epilepsie fokální a generalizované [56,57]. Ve skupině fokálních epilepsií byly porovnávány LTG, CBZ, TPM a GBP. Nejvyšší efektivitu, tedy setrvání na léčbě, měl LTG, poté CBZ a po nich velmi podobně TPM a GBP. Bezzáchvatovosti dosahovali nejrychleji pacienti na CBZ, což je vysvětlováno pomalou titrací LTG. Nejlépe byl tolerován GBP a nejhůře CBZ a TPM. Ve skupině generalizovaných epilepsií byly porovnávány VPA, LTG a TPM. VPA byl účinnější než TPM, nejméně byl účinný LTG, nejhůře byl tolerován TPM. Parametry antiepileptické léčby byly hodnoceny i u dalších antiepileptik, včetně OXC, LEV aj., v dalších studiích. Jejich prezentace je však nad rámec tohoto sdělení.
Volba antiepileptika podle jeho priorit
Škála nových antiepileptik a jejich rozdílných priorit umožňuje širší možnosti jejich volby, za rámec spektra účinnosti podle typu záchvatu/syndromu. Jde o další vlastnosti antiepileptik („treatment-related“), kterými se liší a které mohou být v klinické praxi využity a preferovány.
Základních šest priorit na příkladu nových antiepileptik uvádíme v přehledu (tab. 10) [9,40,60].
Tab. 10. Priority nových antiepileptik při volbě přídatné léčby [9,40,60]. ![Priority nových antiepileptik při volbě přídatné léčby [9,40,60].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7729f7e2ce87d9252dbae7e6a9ae60a7.jpg)
Podle klinické potřeby můžeme individuálně volit lék silnější/slabší, tolerovaný obvykle výborně/potenciálně hůře, s možností rychlé/pomalé titrace, bez lékových interakcí/s rizikem lékových interakcí (s antiepileptiky a dalšími léky), bez nutnosti/s nutností laboratorního monitorování (hladiny léku, biochemie, krevní obraz) a také můžeme volit léky s různými mechanizmy účinku již v alternativní monoterapii či v kombinované léčbě (tab. 10).
Např. při nutnosti rychlé titrace volíme lék s adekvátním titračním schématem (PHT, GBP, PGB, LEV), byť např. na přechodnou dobu, do zavedení definitivní léčby.
Z hlediska uvedených priorit je v posledních letech věnována pozornost možnostem volby antiepileptické léčby podle různých mechanizmů účinku (tab. 10). Základní předpoklad této farmakodynamické teorie je obdobný pro monoterapii i kombinovanou léčbu. Léky s obdobnými mechanizmy působení mohou vykazovat obdobnou účinnost a navíc mívají i obdobný profil nežádoucích účinků. Zvolíme-li např. v iniciální monoterapii lék, který působí prostřednictvím ovlivnění Na+ kanálů (PHT, CBZ, OXC, LTG), je vhodné při neúspěchu léčby zvolit lék s jiným mechanizmem působení, případně s více mechanizmy účinku (VPA, TPM, GBP, PGB, LEV). Podrobněji se farmakomechanistickou teorií zabýváme u léčby kombinované.
Volba léčby podle individuality pacienta, za hranicemi epilepsie, celostní pohled na léčbu pacienta
Zohlednění individuality pacienta (faktory „patient-related“) je dalším významným vodítkem pro optimální volbu léčby nemocných s epilepsií. Antiepileptika totiž neovlivňují pouze epilepsii, ale řadu dalších mozkových i tělesných funkcí a orgánů, tedy organizmus jako celek a u naprosté většiny nemocných po řadu let, ne-li doživotně. Mají tak vliv na celkovou, tělesnou a psychickou kondici nemocných s epilepsií. Právě dobrý funkční stav nemocných a optimální kvalita jejich života jsou jediným a konečným cílem antiepileptické léčby. Zde se jedná o více než pouhou kompenzaci epileptických záchvatů.
Při volbě léčby zohledňujeme konkrétní typ, individualitu pacienta v plné šíři: věk, pohlaví, životní etapu (děti, fertilní věk, stáří), tělesný a psychický stav, ostatní farmakoterapii, lékové interakce, ale i faktory psychosociální, ekonomické aj. Tento individuální výběr antiepileptické léčby umožnilo opět rozšíření škály dostupných léků.
Níže uvádíme základní příklady některých častějších problémů. V dalších podrobnostech odkazujeme na dostupnou literaturu.
U dětí např. zohledňujeme vyšší riziko výskytu závažných hypersenzitivních reakcí na lék (rash u LTG, CBZ), hepatotoxických reakcí (VPA), kognitivního narušení (PHB, CBZ, TPM aj.), poruch chování – zejména hyperaktivní (PHM BZD, LEV aj.), hypohidrózy a metabolické acidózy (acetazolamid, SUL, TPM, ZNS), potenciálně i poruch růstu (SUL) aj.
Velmi široká a již tradiční je problematika léčby žen s epilepsií: kosmetické problémy (PHT, VPA), nadváha (VPA, VGB, GBP, PGB, CBZ), dospívání a hormonální funkce, poruchy reprodukce a metabolické poruchy u syndromu polycystických ovarií (VPA), interakce s kontraceptivy, snížení jejich spolehlivosti (induktory hepatálních emzymů CBZ, OXC, PHT, PHB, PRM, LTG, volba kontraceptiva s adekvátním obsahem hormonů) a naopak, ovlivnění hladin antiepileptik kontraceptivy, výrazně např. u LTG často užívaném právě v koncepčním věku, riziko teratogenicity (polyterapie, vyšší dávky léků zejména VPA), péče prekoncepční, plánování gravidity včetně optimalizace léčby (volba léku a přiměřených dávek, monoterapie méně rizikovými léky, např. LTG, CBZ, LEV dle aktuálních dat, přídatná suplementace kyselinou listovou), péče během gravidity (pravidelné kontroly pacientek – klinické, EEG, plazmatické hladiny léků, zohlednění nárůstu hmotnosti a dalších fyziologických změn v dávkování léků, péče porodní, poporodní, rozhodnutí o kojení, monitorování případných abstinenčních příznaků u novorozence) a nakonec problematika menopauzy a rizik osteoporózy [2,61–63]. Ovlivnění hormonálních funkcí, zejména induktory hepatálních enzymů, může být významné i u mužů.
Novějším tématem je léčba epilepsie u starších pacientů. Toto téma se však široce dotýká medicíny obecně [64–66], klíčovými body jsou:
- změna farmakodynamiky (vyšší farmakosenzitivita – účinnost i výskyt nežádoucích účinků u nižších dávek léků) i farmakokinetiky ve vyšším věku (možnost podávání léků v menším počtu dávek, např. u GBP ve dvou denních dávkách),
- častější výskyt neurotoxických nežádoucích účinků a s tím souvisejících komplikací (útlum, kognice, závrativost, neobratnost, pády, zlomeniny, ovlivnění mobility),
- lékové interakce s enzymatickými induktory u polymorbidních pacientů s polyterapií (snad nejrizikovější je interakce warfarinu s induktory: při titraci nižší INR a jeho účinnost, při vynechání induktorů, např. u noncompliance riziko krvácení, další lékové interakce s antihypertenzivy, hypolipidemiky, antidiabetiky, analgetiky, psychofarmaky aj.),
- využití léků, které nevykazují významné farmakokinetické interakce GBP, PGB, LTG, LEV, které jsou považovány pro stáří za optimální, bez významných interakcí jsou i nové léky ZNS a LCM,
- riziko kardiotoxických účinků, zvl. arytmií, AV blokád CBZ, PHT, méně ZNS, LCM (u AV blokád II. stupně),
- častější výskyt hyponatremie (CBZ, OXC), zvl. při léčbě diuretiky,
- výskyt osteopatií s až pětkrát častějšími zlomeninami femuru a páteře u pacientů léčených enzymatickými induktory (změna léčby, nutnost suplementace Ca++, vitaminem D3, antiresorpční léčba, zhodnocení neurotoxických účinků u opakovaných pádů),
- výběr a dávkování léků podle stavu orgánových funkcí a jejich dominantní eliminace (především renální eliminace – GBP, PGB, LEV, VGB, hepatální eliminace – ostatní antiepileptika),
- častější výskyt úzkostných poruch, deprese, poruch spánku aj., citlivé zohlednění volby antiepileptik dle jejich psychotropních účinků, sledování rizik i využití potenciálních výhod (např. PGB při úzkosti, nespavosti, neuropatické bolesti a syndromu neklidných nohou, tab. 11) [15–17],
- specifickou poruchou compliance je tzv. repetitivní medikace v souvislosti s kognitivním narušením, opakované požití léku může být podkladem lékové toxicity. Rovněž abúzus alkoholu není ve stáří výjimečný a je třeba po něm při neúspěšné léčbě pátrat.
Tab. 11. Nejčastěji uváděné údaje o potenciálně možném ovlivnění psychických funkcí dlouhodobě podávanou antiepileptickou léčbou [15–17]. ![Nejčastěji uváděné údaje o potenciálně možném ovlivnění psychických funkcí dlouhodobě podávanou antiepileptickou léčbou [15–17].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/77476bf6049b807762a2311d12d2d8db.jpg)
Nedoceněným tématem je problematika nadváhy, obezity, hyperlipoproteinemie ve vztahu k dlouhodobé antiepileptické léčbě. Jde o závažné rizikové faktory pro rozvoj dalších prognosticky významných zdravotních poruch, které se týkají i pacientů s epilepsií, tak jako ostatní populace. Zdaleka nejde jen o pacienty starší. Antiepileptika ovlivňují různou měrou tělesnou hmotnost [9]: přírůstek hmotnosti může být spojen především s léčbou VPA, VGB, ale i GBP, PGB, CBZ, naopak úbytek hmotnosti mohou působit TPM, ZNS, váhově neutrální jsou PHT, LTG, LEV, LCM, FBM. Zastřešujícím pojmem pro rozvoj závažných rizik spojených s obezitou je metabolický syndrom X s celým komplexem zdravotních odchylek (hypertenze, poruchy glykoregulace, ateroskleróza, prokoagulační stav, vyšší výskyt některých nádorů, psychické změny aj.) [67].
Léčba enzymatickými induktory (CBZ, PHT, PHB, PRIM, OXC) a vyššími dávkami TPM může být komplikována ve vztahu k hyperlipoproteinemii dvěma způsoby. Jednak kompeticí metabolizmu těchto léků s metabolizmem lipidů v hepatálním systému P450 a dále s metabolizmem hypolipidemik, nejčastěji statinů. V těchto případech se opět doporučují kontrolní vyšetření lipidového spektra a případná úprava dávky hypolipidemik.
Sledování potenciální rizikovosti dlouhodobé léčby ve vztahu k hyperlipidemii a MSX se vžil v psychiatrii, v epileptologii jakoby zůstával poněkud stranou.
Další oblastí je léčba mladších i starších polymorbidních pacientů. Kromě výše zmíněných nevýhod může být antiepileptická léčba spojena s „žádoucími“ vedlejšími účinky léčby. Některá antiepileptika totiž mohou léčit i několik zdravotních poruch najednou – jedním lékem. Např. u polymorbidního pacienta-diabetika s epilepsií, s algickou formou diabetické neuropatie, s porušeným spánkem a s úzkostí, můžeme pomocí „monoterapie“ PGB úspěšně léčit fokální epilepsii, bolestivou diabetickou neuropatii, úzkost a navíc účinně zlepšit spánek, případně i některé poruchy, které ho provázejí (např. syndrom neklidných nohou). PGB navíc nemá žádné významné interakce s dalšími farmaky (včetně warfarinu, antihypertenziv, hypolipidemik, antidiabetik), je však nutno sledovat váhový profil pacienta. U diabetiků se vyhýbáme léčbě PHT, která může vést k dekompenzaci diabetu narušením sekrece inzulinu a vzestupem inzulinové rezistence. Obdobně můžeme pomocí TPM úspěšně léčit pacienta s epilepsií a migrénou, nadváhou či bolestivou neuropatií. Léčba LTG u polymorbidního pacienta s vaskulární epilepsií, s metabolickým syndromem X, s depresí, inhibicí či emoční nestabilitou je obvykle velmi dobře tolerována a vedle vlastní účinnosti na záchvaty nevykazuje významné lékové interakce, LTG je váhově neutrální, může mít antidepresivní účinky spojené s aktivací pacienta či se stabilizací jeho nálady.
Tím přistupujeme k dalšímu aktuálnímu a důležitému tématu. Jsou jím psychotropní účinky antiepileptik [17,68]. Vedle zmíněných tradičních nežádoucích účinků (útlum, kognitivní problémy) mohou antiepileptika individuálně vykazovat i specifické negativní psychotropní účinky: působit depresogenně (PHB, PRM, PHT, VGB aj.), event. způsobit iritabilitu, agitovanost, agresi, manické a psychotické příznaky. V současné době se pozornost zaměřuje i na využití pozitivních – žádoucích psychotropních účinků antiepileptik: ovlivnění úzkosti (PGB, GBP, CZP, CLB), deprese (LTG) a stabilizace nálady (LTG, CBZ, VPA, GBP) aj. Jde o časté psychické poruchy, které postihují až polovinu pacientů s epilepsií. Souhrnný přehled potenciálních psychotropních účinků antiepileptik uvádíme v přehledu (tab. 11).
Oblastí, kde a jak antiepileptika ovlivňují interiktální stav nemocných, je samozřejmě více, než zde můžeme uvést, a bude jich jistě přibývat.
Další látky používané v léčbě epilepsie
Vedle vlastních antiepileptik se v léčbě epilepsie uplatňují i další léky. Pro úplnost této kapitoly uvádíme příklady: profylaktická léčba diazepamem u febrilních křečí, léčba antipyretiky v době zvýšené teploty, hormonální léčba a léčba acetazolamidem u katameniální epilepsie, léčba ACTH/steroidy u dětských epileptických encefalopatií (Westův syndrom, Lennox-Gastautův syndrom, Landau--Kleffnerův syndrom, syndrom s kontinuálními hroty v pomalém spánku) a v některých případech atypické benigní parciální epilepsie, myoklonicky-astatické epilepsie neboli Dooseho syndromu, Ohtaharova syndromu, imunosupresivní a imunomodulační léčba u Rasmussenovy encefalitidy, úspěšná může být léčba pyridoxinem u časné myoklonické epilepsie a v případech pyridoxinové dependence. Využití kyseliny listové v těhotenství zejména při léčbě staršími antiepileptiky je dobře známo, uplatňuje se i v léčbě některých novorozeneckých záchvatů. Nízké dávky betablokátoru mohou posloužit k ovlivnění tremoru rukou u pacientů léčených VPA na hranici tolerability a u těch pacientů, u nichž je jiná léčba méně účinná. O ketogenní dietě se zmíníme v souvislosti s refrakterní epilepsií.
Režimová opatření
Rozumná režimová opatření jsou dobře známou a nezbytnou součástí léčby epilepsie. Patří k nim pokud možno pravidelná a přiměřená životospráva, včetně dostatečného a nerušeného spánku, u pacientů se záchvaty bez vazby na spánek většinou tolerujeme krátký odpolední spánek. Dále pak abstinence, respektive nepožívání většího množství alkoholu. Éra prokonvulzivních účinků čokolády, kakaa a jiných neopodstatněných restrikcí již pominula.
Nemocný by se měl vyhnout individuálně známým provokačním faktorům. Ty jsou v největší míře přítomny u reflexních epilepsií či u epilepsií, kde je alespoň část záchvatů vyprovokována senzorickým podnětem. Nejčastěji jde o fotosenzitivitu, stimulaci přerušovaným světlem, televizní obrazovkou, např. u JME, GMA (GM-only), jindy obecně čtením, případně čtením či poslechem konkrétního textu, hudby, písně a jinými senzorickými vjemy, provokačním momentem mohou být i proprioceptivní stimuly, např. zavření očí ve tmě.
U aktivní, nekompenzované epilepsie platí některá posudková opatření, zákaz řízení motorových vozidel a obecně takové činnosti či práce, kde by nemocný mohl při záchvatu ublížit sobě či okolí.
Obtížně léčitelná epilepsie – kombinovaná léčba
Kdy volíme polyterapii
K „racionální polyterapii“ přistupujeme až po neúspěšné monoterapii, nikoli překotně, ale také ji zbytečně neodkládáme.
Před jejím zavedením vždy vyhodnocujeme důvody neúspěšnosti monoterapie. Jde o vyloučení „pseudofarmakorezistence“ k monoterapii [60]. K základním otázkám patří: Trpí nemocný skutečně epilepsií, nejde o neepileptické záchvaty somatické či psychogenní? Netrpí pacient současně epileptickými záchvaty, které jsou kompenzovány, a záchvaty neepileptickými, např. PNES, které perzistují? Je správná syndromologická diagnóza epilepsie, zejména fokální verzus generalizovaná? Byla volba antiepileptik v monoterapii správná ve vztahu k syndromu, jsou účinná u všech konkrétních typů záchvatů, nezhoršují některý z nich? Byly dávky léků v monoterapii dostatečné, včetně maximálních tolerovaných dávek? Byla dobrá compliance nemocného při užívání léků, je pacient k léčbě motivován, nezapomíná na pravidelnou léčbu? Byla dobrá compliance nemocného v režimové léčbě, zvl. u některých syndromů, kde jsou provokační faktory významné? Z uvedených otázek vyplývají čtyři nejčastější příčiny pseudofarmakorezistence [54,60,69,70]:
- chybná diagnóza, záchvaty jsou původu neepileptického, a tedy mimo rámec účinnosti antiepileptik,
- chybná volba antiepileptika podle typu epileptických záchvatů, resp. epileptického syndromu, neúčinnost, resp. agravace záchvatů,
- příliš nízké, neúčinné či nedostatečně účinné dávky léků – nevyužití MTD, léčbu nelze dostatečně navýšit vzhledem k výskytu nežádoucích účinků či nevhodných farmakokinetických interakcí, mezi antiepileptiky i s jinými léky (tab. 3),
- špatná compliance – nepravidelná medikace, nevhodný životní styl (nepravidelný režim, spánková deprivace, abúzus alkoholu či jiných návykových látek, další provokační vlivy).
Z hlediska průběhu epilepsie jsou polyterapií léčeny dvě základní skupiny pacientů:
1. Pacienti, kteří od počátku onemocnění nereagovali dostatečně na adekvátní monoterapii.
2. Druhou skupinu tvoří pacienti, kteří byli zpočátku kompenzováni, ale v dalším období u nich dochází k „opožděnému“ relapsu onemocnění. Tento fluktuující, remitentní průběh epilepsie je uváděn u relativně vysokého počtu pacientů, a to až v 33 %, hovoří se též o tzv. opožděné intraktibilitě či farmakorezistenci [70]. Prognóza a výsledek léčby jsou vztahovány především k vlastní podstatě konkrétního epileptického syndromu. Jeho průběh může být benigní se spontánní remisí, příznivý s iniciální a trvalou remisí, stacionární, fluktuující (remise, relapsy), progresivní, farmakorezistentní (schéma 1) [70].
Racionální polyterapie – pojem, výhody, nevýhody, volba léčby
Pojem „racionální“ polyterapie je definován spíše svým opakem: měl by zdůraznit to, že polyterapie není „iracionální“, chaotická, náhodná, indikovaná na základě špatné syndromologické diagnózy, nevhodné – neadekvátní iniciální léčby, včetně volby, dávek léků a terapeutických postupů [60]. V užším a pravém slova smyslu o „racionální“ polyterapii mířící k vlastní podstatě onemocnění dodnes mnoho nevíme. Studií na toto téma je málo, jistou oporou nám však může být tzv. farmakomechanistická teorie, jejíž platnost byla ověřena v experimentu. Polyterapie má svá rizika i výhody [60,71–75].
Rizika polyterapie
Patří k nim častější výskyt nežádoucích účinků, riziko lékových interakcí s antiepileptiky a ostatními léky, vyšší riziko teratogenicity, horší hodnotitelnost účinnosti a nežádoucích účinků jednotlivých léků, riziko horší compliance (vynechání léčby s opakovaným poklesem hladin a snížením účinnosti, nebo naopak repetitivní medikace s projevy toxicity zvl. ve stáří), nutnost častějšího laboratorního monitorování, léčba bývá obvykle nákladnější.
Výhody polyterapie
Zásadní výhodou racionální polyterapie by mělo být zvýšení – maximalizace terapeutického indexu, tedy posílení účinnosti včetně šíře terapeutického spektra (zlepšení kompenzace a pokrytí více typů záchvatů), s co možná nejnižším výskytem nežádoucích účinků léčby. Optimálním cílem je tedy synergický (supraaditivní) terapeutický efekt s infraaditivním výskytem nežádoucích účinků, současně za příznivých farmakokinetických interakcí [71,73].
Správně indikovaná a vedená racionální polyterapie by měla být nejen účinnější, ale i „efektivnější“. Přidání malé dávky druhého léku může být efektivnější (účinnější i lépe tolerované) než navyšování monoterapie do maximálních hůře tolerovaných dávek, např. u syndromů s více typy záchvatů (u syndromu JAE VPA + LTG, JME LTG + LEV ráno).
Při výběru kombinované léčby musí být pečlivě a individuálně zohledněny stejné faktory, které uvádíme u monoterapie.
Léky volíme opět v první řadě podle typu záchvatů/syndromu. Vyhýbáme se lékům, které mohou potenciálně některé záchvaty agravovat, a v této situaci využíváme antiepileptika širokospektrá. Je však chybou nevyužít u fokální epilepsie léky s užším spektrem účinku, které v těchto případech mohou být účinnější.
Při kombinované léčbě volíme léky i podle jejich dalších priorit (tab. 9). Kombinujeme léky pokud možno s odlišnými mechanizmy účinku, zohledňujeme případné farmakokinetické interakce s antiepileptiky (tab. 3) i dalšími léky a přiměřeně využíváme vyšetření plazmatických hladin léků.
Opět zohledňujeme individualitu pacienta. Soustavně sledujeme tolerabilitu léčby, výskyt případných nežádoucích účinků léčby, ty by neměly převažovat nad skutečným přínosem léčby. Vyhýbáme se „nadměrné léčbě“. V dnešní době je považována za smysluplnou dvojkombinace až trojkombinace léků. Ve spolupráci s pacientem pravidelně přehodnocujeme efektivitu kombinované léčby, zvažuje její úpravu, případně i redukci, hodnotíme též compliance.
Taktika léčby je obdobná jako u monoterapie. V případě výměny jednoho léku, snižování a vysazování začínáme lékem méně účinným. Základní situace při rozhodování o monoterapii či polyterapii uvádíme v přehledu (tab. 12).
Tab. 12. Možnosti úpravy nedostatečně účinné léčby – monoterapie, výměna léku, přídatná léčba. 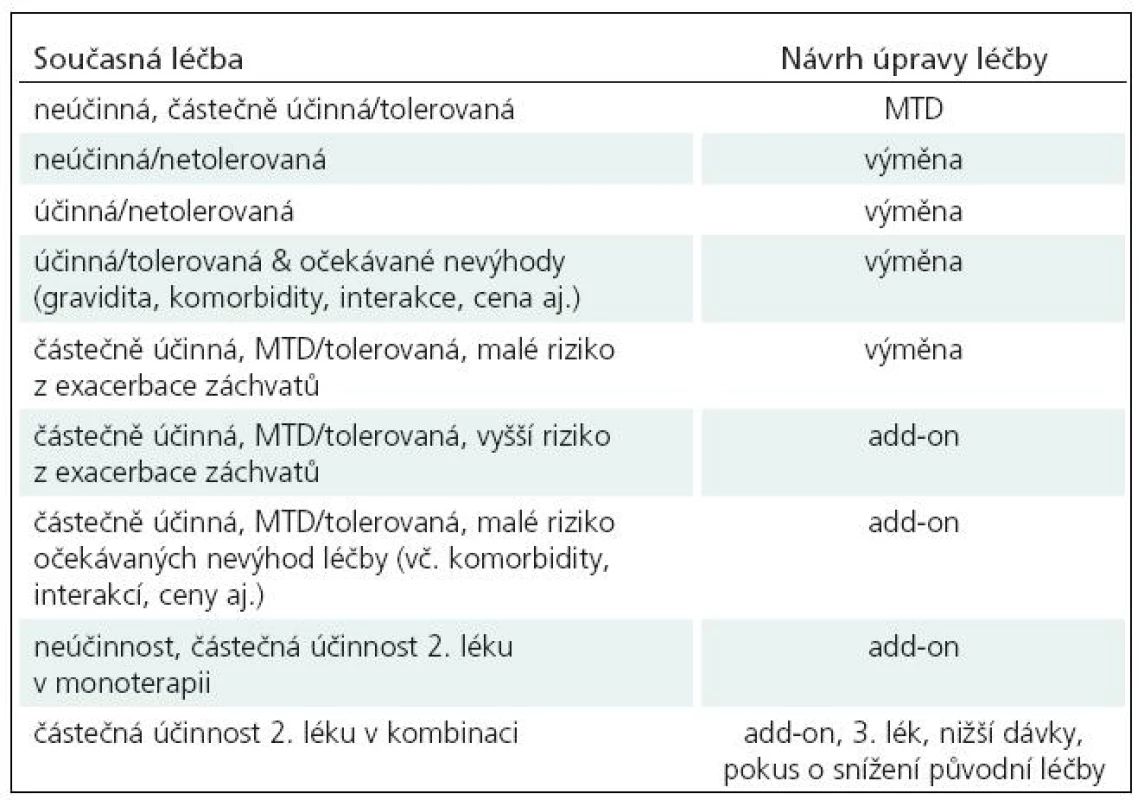
Farmakomechanistická teorie
Z hlediska uvedených priorit je v posledních letech věnována pozornost možnostem volby antiepileptické léčby podle mechanizmů účinku [8]. Předpoklad tohoto přístupu je obdobný pro monoterapii i kombinovanou léčbu. Budeme-li volit lék „pouze“ podle typu záchvatu/syndromu, můžeme v alternativní monoterapii i v kombinované léčbě užívat sice různé léky registrované k tomuto použití, nicméně s obdobnými či stejnými mechanizmy účinku. Lze očekávat, že tento postup bude méně úspěšný, než pokud v léčbě podáme léky s různými mechanizmy účinku. Tato skutečnost byla experimentálně opakovaně prokázána a podpořena některými klinickými studiemi a zkušenostmi.
V případě kombinované antiepileptické léčby vznikají mezi léky farmakodynamické interakce, které lze zjednodušeně rozdělit do základních čtyř skupin: mohou být supraaditivní (synergické), aditivní, infraaditivní (antagonistické) nebo indiferentní. Týká se to účinků terapeutických i nežádoucích. Cílem kombinace je pochopitelně maximální posílení účinnosti (supraaditivní, aditivní efekt) s minimálním nárůstem nežádoucích účinků (infraaditivní, indiferentní).
V klinických studiích, třeba u starších antiepileptik byla kombinace PHT a PB terapeuticky aditivní, z hlediska neurotoxicity infraaditivní. Obdobný byl výsledek studie VPA s CBZ nebo PB, avšak s aditivním efektem na neurotoxicitu [76]. Klinicky významný je aditivní účinek VPA s ETS [77] u absencí, s neurotoxicitou nižší, než byla pozorována při předchozí monoterapii VPA, resp. ETS. Nejcitovanější je studie potvrzující signifikantně významnější účinnost kombinace LTG a VPA, synergizmus u léků s různými mechanizmy účinku, oproti kombinacím LTG s CBZ či PHT u záchvatů parciálních i generalizovaných [78].
Využití předpokládaných mechanizmů účinku při volbě léčby má svoji logiku a může být v praxi přínosné. Odpovídají tomu i v současné době využívané kombinace antiepileptik: např. u fokální epilepsie CBZ + (VPA, LEV, GBP, PGB, TPM, ZNS, LCM aj.), LTG + (VPA, LEV, TPM, PGB, ZNS, VGB, LCM aj.), LCM + (VPA, LTG, LEV, GBP, PGB, ZNS aj.) a další kombinace. U generalizovaných idiopatických epilepsií např. VPA + (LTG, LEV, TPM, CZP aj.), LTG + (LEV, TPM, ETS, CZP aj.) a podobně.
Nadměrná léčba, redukce léčby
Nadměrná léčba („overtreatment“) je často podkladem akutních i chronických projevů lékové toxicity. Tato situace není v klinické praxi zdaleka výjimečná, bývá podceňována a týká se počtu léků i jejich dávek zvláště v polyterapii [60]. Lékaři zřejmě raději léčbu navyšují než naopak. Pokud pacient ze zavedené kombinace léků neprofituje během tří měsíců, je vhodné zvážit pomalý převod na léčbu jinou, případně léčbu jednodušší. Zvláště při polyterapii platí již zmíněná zásada o pravidelném přehodnocování skutečné efektivity konkrétní léčby včetně výskytu nežádoucích účinků.
Chronicky zavedená polyterapie nemusí být u pacientů definitivní. U části pacientů na polyterapii mohou být redukce léčby a postupná konverze na jednodušší léčbu včetně monoterapie úspěšné, bez recidivy či zhoršení záchvatů. Naopak mohou být provázeny zlepšením kompenzace záchvatů, celkového klinického stavu i kvality života [60,77,79]. To se týká i pacientů farmakorezistentních. Více než další navyšování léčby pro ně může mohou být prospěšné navození optimálního interiktálního stavu s minimalizací vedlejších účinků léčby, léčba časté psychiatrické komorbidity a podpora psychosociální. Změny v medikaci mají být „postupné“ a „pomalé“, tedy v týdnech a měsících [9]. To je zvláště významné u léků, jejichž rychlé vysazení může způsobit abstinenční záchvaty, tedy u barbiturátů a benzodiazepinů. Nejprve je snižováno méně účinné antiepileptikum. Redukce polyterapie je na místě u antiepileptik podle anamnézy neúčinných. Vysazena by měla být zejména antiepileptika kontraindikovaná ve vztahu k danému epileptickému syndromu, potenciálně působící agravaci záchvatů (tab. 4, 7, 8).
Redukce polyterapie s postupným vysazením léčby bývají možné u nemocných po úspěšné epileptochirurgické léčbě, redukci léčby je vhodné zvážit i při úspěšné stimulační léčbě.
Dietní léčba
Zejména u pediatrických pacientů může být v některých případech refrakterní epilepsie využita tzv. ketogenní dieta, napodobující proces hladovění [74,75]. Spočívá v příjmu potravy s vysokým obsahem tuků, omezeným obsahem bílkovin a minimálním podílem cukrů. Léčba však bývá špatně tolerována, provázena řadou nežádoucích účinků, zvláště v oblasti metabolické a compliance bývá problematická až v polovině případů [75]. Toleranci a compliance lze zlepšit i nastavením výhodnějšího poměru mezi tuky, cukry a bílkovinami.
Jednou z modifikací je třeba Atkinsova dieta. Podíl respondérů na léčbě ketogenní dietou je uváděn okolo 30 %. Úspěšně byla využita u některých pacientů s metabolickými vadami, v léčbě infantilních spazmů, Rettova syndromu a syndromu Landau-Kleffnerova, kdy vedle ovlivnění záchvatů je uváděno i přetrvávající zlepšení fatických funkcí a chování, účinnost je uváděna i u pacientů dospělých [74,75]. Ketogenní dieta je obvykle jedinou efektivní léčbou u pacientů s deficitem proteinu transportujícího glukózu přes hematoencefalickou bariéru. U těchto pacientů se vedle opožděného vývoje, snížené hladiny glukózy v mozkomíšním moku vyskytují epileptické záchvaty rezistentní k antiepileptické léčbě [74]. Příznivý efekt léčby většinou mizí s ukončením dietního režimu.
Farmakorezistentní epilepsie, invazivní léčba
I přes správně vedenou farmakologickou léčbu se dnes přibližně u jedné čtvrtiny až třetiny nemocných nedaří pomocí farmakoterapie dosáhnout kompenzace záchvatů. V tomto smyslu se hovoří o refrakterní, resp. farmakorezistentní epilepsii.
Patofyziologická podstata farmakorezistence je zkoumána a vysvětlována v řadě možných úrovní [80], jednotlivé komponenty se navíc mohou v daném případě vzájemně kombinovat:
- úroveň strukturální, mozkové léze s vysokým rizikem farmakorezistence (hipokampální skleróza, kortikální dysplazie a poruchy neuronální migrace, neurokutánní onemocnění, některé typy nádorových procesů, Rasmussenova encefalitida aj.),
- úroveň funkční (vliv epileptické aktivity a epileptických záchvatů včetně tvorby sekundárních epileptických ohnisek mechanizmem kindling fenoménu aj.),
- neurotransmitery a jejich receptory (narušení inhibičních a excitačních mechanizmů, např. GABA-ergních a glutamátových),
- iontové kanály (především natriové, kaliové),
- transportní proteiny ovlivňující intracelulární dostupnost léku,
- autoimunní mechanizmy ovlivňující metabolizmus neurotransmiterů,
- fyzikální vlastnosti antiepileptik, zejména jejich lipofilita, ovlivňující farmakokinetiku léku.
Definice farmakorezistence byla a je předmětem diskuzí týkajících se zvláště počtu užitých antiepileptik (2–3 léky), frekvence záchvatů a délky jejich perzistence. Definici farmakorezistence najdeme i v české monografii, která byla této problematice věnována. Tato definice uvádí, že pacient s epilepsií může být považován za farmakorezistentního, jestliže u něho do dvou let od zahájení léčby není dosaženo uspokojivé kompenzace záchvatů při použití nejméně dvou a nejlépe tří správně volených antiepileptik podávaných v maximálních tolerovaných dávkách, ať již v monoterapii nebo v kombinacích [80]. Během Evropského epileptologického sjezdu konaného minulého roku v Budapešti navrhla ILAE jednoduchou a praktickou definici dostupnou na internetu. Farmakorezistentní epilepsie je definována selháním léčby pomocí dvou adekvátně užitých a tolerovaných antiepileptik (v monoterapii či v kombinované léčbě) bez dosažení bezzáchvatovosti (www.ilae-epilepsy.org).
Význam definice by měl být především praktický. Jde vlastně o zdvižený prst, který by měl lékaře upozornit na včasné využití dalších diagnostických a léčebných postupů.
V současné době je považováno za velmi významné farmakorezistentní pacienty včas konzultovat ve specializovaném epileptologickém centru, nejpozději do dvou let. Velká část těchto pacientů s tzv. farmakorezistentní, refrakterní epilepsií může být úspěšně léčena neurochirurgicky, u jiných pacientů je naopak diagnostikována pseudofarmakorezistence.
I nyní však stále do center přicházejí pacienti až po mnoha letech neúspěšné konzervativní léčby. Seznam epileptologických center disponujících komplexními diagnostickými i léčebnými postupy je dostupný na webových stránkách České ligy proti epilepsii (www.clpe.cz). Včasnou indikaci epileptochirurgické léčby u pacientů s refrakterní temporální epilepsií podpořila i jediná recentní, randomizovaná kontrolovaná studie. Po jednom roce bylo bez záchvatů cca 60 % odoperovaných pacientů a pouze 8 % pacientů léčených konzervativně [81].
Epileptochirurgie přitom nabízí širokou škálu zákroků kurativních, které jsou preferovány před zákroky paliativními [82]. Jistým posunem v oblasti kurativních zákroků je ústup od radioterapie pomocí gama nože a renezance stereotaktické radiofrekvenční terapie (elektrokoagulace) [83–85]. V oblasti paliativních zákroků je vedle známé chronické stimulace nervus vagus (VNS) zaváděna i stimulace centrálních mozkových struktur. V podrobnějších údajích o farmakorezistentní epilepsii a invazivní léčbě epilepsie odkazujeme na souhrnnou publikaci dostupnou v naší literatuře.
Ukončování antiepileptické léčby
Snižování a ukončování dlouhodobé antiepileptické léčby je stejně významné rozhodnutí jako její zahájení. V některých ohledech je možná ještě obtížnější. V naší literatuře byla této problematice věnována relativně menší pozornost.
Antiepileptickou léčbu ukončujeme v těchto základních situacích:
- u pacientů chybně diagnostikovaných, kteří epilepsií nikdy netrpěli a netrpí,
- u pacientů, kteří epilepsií trpěli, epilepsie již není aktivní, resp. jsou v dlouhodobé remisi.
Ukončování antiepileptické léčby u pacientů „bez epilepsie“
Zní to sice banálně, ale v klinické praxi nejde zdaleka o vzácnou situaci. Řada pacientů je dlouhé roky zbytečně zatížena farmakologickou léčbou antiepileptiky.
V první řadě jde o pacienty chybně diagnostikované, kteří trpí somaticky či psychogenně podmíněnými neepileptickými záchvaty, o kterých jsme se zmínili při popisu zahajování léčby. Zřejmě nejvýznamnější problémem jsou psychogenní, disociativní neepileptické záchvaty, tzv. PNES, které tvoří ve skupině neúspěšně léčených pacientů až 20 % případů [86]. Závažnost tohoto údaje je podtržena řadou iatrogenních faktorů: chybně indikovanou dlouhodobou zátěží většinou kombinované farmakoterapie, často opakovanými pobyty na jednotkách intenzivní péče včetně umělé plicní ventilace aj. Standardním diagnostickým postupem je včasná indikace video-EEG monitorování a objasnění původu záchvatů [15–18,86]. U pacientů trpících pouze PNES antiepileptickou léčbu snižujeme a vysazujeme, vyjma situací, kde mají antiepileptika indikaci psychiatrickou, nejčastěji jako stabilizátory nálady. Část pacientů však může trpět současně záchvaty epileptickými, aktuálně či jen v anamnéze. Zde snižování, případně vysazování antiepileptické léčby posuzujeme vždy velmi individuálně ve vztahu k aktuálnímu výskytu záchvatů epileptických a neepileptických. I u řady těchto pacientů však může být antiepileptická léčba často významně zjednodušena a snížena.
Další skupinou jsou pacienti, kteří dle anamnézy prodělali pouze akutní, symptomatický, provokovaný epileptický záchvat, případně jenom mozkový inzult, na jehož základě byla chybně zahájena dlouhodobá antiepileptická léčba. Ani u těchto pacientů nejde o epilepsii a terapie by měla být ukončena.
Typicky rizikový je např. pacient po kraniocerebrálním traumatu nebo po neurochirurgické operaci, který prodělal či neprodělal akutní symptomatický záchvat a opouští prestižní pracoviště s nasazenou „profylaktickou“ léčbou, nejčastěji stále penytoinem. Často podpůrným a svůdným argumentem pro pokračování v této léčbě mohou být pooperační, klinicky nevýznamné EEG abnormity či dokonce fyziologické vzorce a artefakty (elektrodové, „breach“ rytmus aj.) [33].
Ilustrativním případem je naše starší nemocná, která před více než deseti lety prodělala úspěšně mozkovou operaci, epileptický záchvat nikdy neměla, ale byla jí nasazena plná terapeutická dávka PHT. Následně na témže neurochirurgickém pracovišti prodělala po letech operaci bederní páteře a léčba byla nadále ponechána, jak uvádí propouštěcí zpráva. A navíc bylo údajně EEG abnormní, byť bez epileptiformní abnormity. Teprve při pobytu na našem oddělení, kam pacientka přichází mimo jiné i pro difuzní bolesti páteře při pokročilé osteoporóze, léčbu ukončujeme, na EEG byl přítomen jenom breach rytmus, o epilepsii nikdy nešlo. Tato kazuistika je jistě zajímavá z hlediska chybné indikace léčby, ale také z hlediska kvantity požité farmakoterapie v plné dávce a navíc jejího potenciálního příspěvku k pokročilé osteoporóze u starší ženy v menopauze.
K této problematice patří i další, již poněkud méně časté, ale o to více zamlžené motivace k nasazení dlouhodobé, snad profylakticky míněné antiepileptické léčby? „Cílovým příznakem“, který zde má léčba ovlivnit, bývá často jen abnormní EEG nález a nikoli jasně definovaná zdravotní porucha. V naší praxi to bývají např. psychiatričtí pacienti s abnormním EEG nálezem, kteří jsou léčeni psychofarmaky a profylaktickou antiepileptickou léčbou podanou nad rámec její případné psychiatrické využitelnosti. Jindy jde o pacienty s abnormním EEG nálezem a s bolestmi hlavy, „spazmofilií“ či prodělanou konvulzivní synkopou, případně se jedná o pacienty s klinicky bezpříznakovým abnormním EEG nálezem a MR nálezem (typu arachnoidální cysty) či jen pozitivní perinatální anamnézou.
Ilustrativní je kazuistika osmiletého chlapce s lehce opožděným a protrahovaným porodem, následně s poruchami pozornosti, dyslexií, se zadrháváním v řeči od tří let, balbuties s typickou akcentací zátěží a s minimálními obtížemi o prázdninách. Následně se objevily poruchy chování, přechodné snížení zájmů, komunikace, stažení se do svého světa, jindy vztek. Závěry logopedické, psychiatrické a psychologické se shodují na dg. perinatálního postižení typu LMD s neepileptickými příznaky (poruchy pozornosti, dyslexie, balbuties, poruchy emocí a chování), doporučeny jsou soustavná psychoterapie, logopedická léčba, event. šetrná příležitostná anxiolytická léčba. Na MR však byla popsána temporálně vlevo neexpandující arachnoidální cysta a na EEG je „generalizovaná hyperfunkční abnormita“ při hyperventilaci, která spočívá v intermitentních pomalých rytmech typu FIRTA, FIRDA (fyziologické vzorce). Zahájena byly dlouhodobá „profylaktická“ léčba valproátem. Můžeme si klást otázku: „Léčba čeho a na jak dlouho?“ Rodiče přicházejí po více než roce ke konzultaci s tím, že chlapec léčbu netoleruje, je utlumený, přibývá na váze, má tremor prstů. Anamnesticky epilepsii nepotvrzujeme, jiný důvod k medikaci VPA nenalézáme, EEG je bez epileptiformní abnormity. Léčbu VPA ukončujeme, podporujeme postupy doporučené psychiatrem, psychologem, logopedem. V dalších dvou letech je chlapec nadále bez epileptických záchvatů a při komplexní péči se zlepšuje.
Ukončování antiepileptické léčby u pacientů s epilepsií
Optimálním vodítkem při rozhodování o ukončení či pokračování antiepileptické léčby je správná diagnóza epileptického syndromu se známou prognózou. Situace je obdobná jako při rozhodování o zahájení antiepileptické léčby.
Doménou využití tohoto přístupu jsou zejména věkově vázané epileptické syndromy dětského věku [2,9,12,13,14,32].
U pacientů se syndromy s nepříznivou prognózou spojenou s rozvojem epileptické encefalopatie (frekventní epileptické záchvaty, interiktální epileptiformní aktivita, progresivní postižení kognitivních a behaviorálních funkcí) nebývá otázka ukončování antiepileptické léčby aktuální. Příklady jsou známy, jde o syndromy: Westův, Dravetové, Lennox-Gastautův aj. V jiných případech je naopak antiepileptická léčba považována za neúčinnou, např. u časné myoklonické encefalopatie (EME). Diskutabilní může být i přínos antiepileptické léčby u syndromu Landau-Kleffnerova, resp. syndromu s kontinuálními hroty a vlnami v pomalém spánku (CSWS) ve druhé dekádě věku, kdy u většiny pacientů dochází ke spontánnímu zlepšení EEG a epileptických záchvatů.
Druhá skupina pacientů s příznivější prognózou není spojena s rozvojem epileptické encefalopatie a odezva na léčbu bývá rovněž příznivější [12,13]. Nicméně z hlediska dlouhodobé léčby a jejího případného ukončování je tato skupina také heterogenní.
U pacientů s dětskými benigními idiopatickými fokálními epilepsiemi, např. benigní epilepsií s rolandickými hroty (BERS, BECT), Panayotopoulosovým syndromem, benigní epilepsií s okcipitálními hroty (BEAOS), pokud léčbu vůbec zahájíme, pak jen na omezenou dobu. Většina autorů doporučuje léčbu zvolna ukončovat po 2–3leté remisi a do věku 13–15 let, kdy dochází ke spontánní remisi [9]. U dětí ve věku nad 10 let může být léčba kratší než obvykle doporučované 2–3 roky. Individuálně je však nutno vážit frekvenci a tíži záchvatů a věk pacienta. Z hlediska ukončování léčby má v této skupině epilepsií zřejmě nejlepší prognózu BERS, u ostatních syndromů je podíl dlouhodobě léčených pacientů vyšší.
U častěji se vyskytujících generalizovaných idiopatických epilepsií bývá léčba úspěšná, ale ve většině případů celoživotní, pokusy o vysazení jsou neúspěšné, navíc pro dospívající pacienty traumatizující. Výjimkou jsou dětské absence (CAE), kdy po několika málo letech (obvykle 1–3) může být léčba opět úspěšně ukončena. V případě juvenilních absencí (JAE) bývá léčba méně úspěšná než u CAE, a většinou opět dlouhodobá až celoživotní, obdobně jako u syndromu s grand-mal záchvaty vázanými na probouzení (GM-A, GM-only). V případě juvenilní myoklonické epilepsie (JME) je dnes dostupná léčba všech typů záchvatů, u většiny pacientů je úspěšná, ale opět celoživotní. V některých případech JME se daří kompenzaci udržet po cca 30. roce věku nižšími dávkami léků. U pacientů, u nichž ukončení léčby není možné a kde léčba bude dlouhodobá či celoživotní, se snažíme ve spolupráci s pacientem o vytitrování „minimální účinné léčby“, což se týká počtu i dávek antiepileptik. Jde o prevenci „nadměrné léčby“. Obdobné jsou zásady léčby u reflexních epilepsií, kde léčba rovněž bývá většinou celoživotní.
U familiárních (autozomálně dominantních) fokálních epilepsií je léčba v naprosté většině případů rovněž celoživotní. Nicméně v některých lehčích případech autozomálně dominantní noční frontální epilepsie (ADFLE) může být ojediněle léčba úspěšně ukončena [9].
V dalších podrobnostech odkazujeme na dobře dostupnou literaturu s přehledem věkově vázaných syndromů [2,4,9,12,13,14,32].
Vedle specificky definovaných dětských syndromů se známou prognózou se napříč věkovým spektrem vyskytují fokální a generalizované, symptomatické, resp. kryptogenní (sekundární) epilepsie [41,42]. V terminologii této starší klasifikace je právě „symptomatický“, sekundární původ považován za vyšší riziko relapsu záchvatů a zastřešuje řadu níže uvedený nepříznivých faktorů [87].
Výjimkou jsou pacienti s fokální epilepsií po epileptochirurgické operaci, kde byla příčina fokální epilepsie úspěšně odstraněna. Snižování a ukončení léčby bývá možné, a to obvykle po minimálně roční až dvouleté remisi. Chybou je nadbytečné prodlužování mnohdy komplikované a zatěžující předoperační polyterapie, na druhé straně však i ukvapené a rychlé snížení či vysazení léčby.
V nově navržené klasifikaci epileptických záchvatů a syndromů nejsou dosud užívané termíny (idiopatický, symptomatický, kryptogenní) již doporučovány [42]. Klasifikace syndromů je vedena přímočaře ke třem kategoriím jejich podstaty. Tedy k etiologii genetické, strukturální/metabolické a neznámé. Genetická příčina pak již neznamená, že je prognosticky „benignější“ v dřívějším pojetí termínu „idiopatická“. Je prognosticky heterogenní a patří sem syndromy s příznivým průběhem (např. CAE), ale i nepříznivým průběhem (SME). Ve skupině epilepsií podmíněných strukturální/metabolickou lézí pak lze očekávat prognózu obdobnou jako u dříve klasifikovaných epilepsií symptomatických/kryptogenních (symptomatických). U epilepsií s neznámou příčinou jsou prognostické úvahy o případném ukončování léčby nejkomplikovanější a řídíme se dalšími, uvedenými riziky [87].
Ze souhrnných analýz řady studií vyplývá, že ukončení antiepileptické léčby může být obecně zváženo u pacientů, kteří jsou v remisi nejméně dva roky a raději více. Je však třeba vážit další rizika, kterých je celá řada a jen málo pacientů se jim vyhne.
Za faktory svědčící proti vysazení léčby jsou považovány: počátek epilepsie a vysazování léčby v dospělosti, v adolescenci a ve stáří, záchvaty fokální, sekundárně generalizované, záchvaty tonické a myoklonické, symptomatická (sekundární) epilepsie, další faktory svědčící pro symptomatický původ epilepsie – neurologický deficit, mentální retardace aj. syndromy se známým vysokým rizikem relapsů (JME, GM-only aj.), abnormní EEG – zejména epileptiformní generalizovaná abnormita zvl. dětí před snižováním léčby nebo v jejím průběhu, v části studií i pomalá EEG abnormita podporující symptomatický původ epilepsie. Špatná odpověď na iniciální terapii, vyšší frekvence záchvatů, délka trvání aktivní epilepsie (delší perioda před dosažením remise) a počet užitých antiepileptik jsou považovány za markery tíže onemocnění a jeho prognózy [11,87].
Některé analýzy uvádějí kombinace rizik pro relaps záchvatů, například věk nad 16 let, užití více než jednoho antiepileptika, pokračující záchvaty po zahájení léčby, záchvaty fokální a sekundárně generalizované, myoklonické záchvaty, symptomatická epilepsie, abnormní EEG [88,89]. Praktické a na internetu dostupné jsou indexy uvádějící riziko relapsu pro období remise 1–15 let v závislosti na typu záchvatu, odezvě na léčbu a nálezu na EEG (tab. 6) [29].
Pokus o ukončení antiepileptické léčby je přesto považován za cennou nabídku, a to pro pacienty s remisí delší než dva roky, zejména v nepřítomnosti uvedených rizik [87]. Riziko relapsu je nejvyšší v prvních 6–12 měsících od vysazení léčby a postupně se snižuje. Některé studie uvádějí, že po dvou letech bylo bez záchvatů 59 % pacientů s vysazenou léčbou a 79 % pacientů léčených. Přibližně do pěti let je však výskyt záchvatů takřka obdobný u pacientů s vysazenou léčbou jako u pacientů léčených, tedy okolo 33, resp. 28 % [88,89].
Ve skupině pacientů dlouhodobě léčených pro fokální, kryptogenní epilepsii se mohou skrývat pacienti s méně známými již zmíněnými benigními (izolovanými) fokálními záchvaty v adolescenci, jejichž podkladem je jen krátkodobě manifestní dispozice k neprovokovaným záchvatům. Dlouhodobá léčba u nich není indikována, její vysazení je úspěšné a citovaná rizika relapsu nejsou rovněž přítomna. Řada těchto pacientů nemusí být správně diagnostikována a je pak zbytečně a dlouhodobě léčena, zejména vzhledem k iniciální manifestaci tohoto syndromu (typ záchvatů, kumulace). Nelze vyloučit že v budoucnu bude definováno takových klinických jednotek více, a to právě u pacientů bez uvedených rizik a bez nutnosti dlouhodobé léčby. Ostatně prim. MUDr. Jiří Dolanský ve svých kurzech nadčasově uváděl, že dlouhodobě kompenzovaným pacientům, kteří nevykazují zřejmá rizika z relapsu záchvatů, by se měla alespoň „jednou za život“ nabídnout možnost ukončení léčby.
Ve prospěch uvážlivého ukončení léčby jsou uváděny také další argumenty: ve studiích u neléčených pacientů dochází k poklesu frekvence záchvatů („antiepileptogeneza“), vlastní antiepileptická účinnost léčby nebyla v klinických studiích prokázána, přibližně u poloviny pacientů na antiepileptické léčbě se vyskytují nežádoucí účinky včetně kognitivních a behaviorálních, po ukončení léčby se celkový stav pacientů zlepšil [87,90,91].
Zejména u dospělých pacientů je však nutno vždy všestranně a individuálně vážit riziko potenciálních širokých zdravotních a psychosociálních komplikací plynoucích z případného relapsu záchvatů (riziko úrazu ve stáří, komplikace v profesním i osobním životě, ztráta řidičského průkazu, negativní dopad na psychický stav aj.) [87]. Někteří autoři také upozorňují na to, že při neúspěšném vysazování může dojít ke „ztrátě farmakosenzitivity“. Po znovuzavedení léčby nemusí být kompenzace pacienta úspěšná, a to až u 10 % pacientů [11].
Vysazování léčby tedy není zdaleka jednoduché rozhodnutí. Měl by ho vždy řídit specialista, nejlépe epileptolog po dohodě s pacientem a po zvážení všech uvedených šancí i rizik spojených s chronickou medikací a jejím vysazením. Situace zde zůstává nadále komplikovaná, jednoduché návody a záruky výsledku neexistují.
Přesný způsob vysazování léčby není znám
Obvykle se doporučuje pomalé snižování, většinou během několika měsíců [11]. Ve studii u dětských pacientů však nebyl rozdíl v relapsech mezi rychlejším vysazením léčby (6 týdnů) a pomalejším (9 měsíců) [92]. Velmi pomalé vysazování je na místě u léků, u nichž může být komplikováno výskytem abstinenčních záchvatů (benzodiazepiny, fenobarbital, primidon). V naší praxi se kloníme k vysazování pomalejšímu. Znovuobjevení se generalizované epileptiformní abnormity u generalizovaných epilepsií, zejména idiopatických, predikuje vyšší riziko recidivy záchvatů.
V případě neúspěchu a recidivy záchvatů je doporučován návrat k původním dávkám léku, na kterém byl pacient kompenzován.
Závěr
Adekvátní využití současných možností léčby epilepsie dnes pacientům nabízí více než jen účinnou kompenzaci záchvatů. Jde především o dobrou kvalitu jejich života a začlenění se do běžných životních aktivit. To je také hlavním cílem léčby. Při volbě léčby musíme citlivě a individuálně zvážit řadu faktorů týkajících se spektra účinnosti léků (faktory seizure/syndrome related), faktory týkající se jejich dalších vlastností (treatment-related) a také individualitu pacienta (faktory patient-related). Zde však hrají klíčovou roli i faktory týkající se nás lékařů (faktory doctor-related). V tomto ohledu záleží mnohé na nás a poselství C. G. Junga zůstává stále aktuální: „Osobnost pacienta vyzývá na kolbiště osobnost lékaře, nikoli technické prostředky.“ Všem těmto faktorům byl článek věnován.
Seznam citovaných zkratek
ACTH adrenokortikotropní hormon CBZ carbamazepin CLB clobazam CZP clonazepam DZP diazepam ESL eslicarbazepin ETS ethosuximid FBM felbamát GBP gabapentin LCM lacosamid LEV levetiracetam LTG lamotrigin NTZ nitrazepam OXC oxcarbazepin PHB fenobarbital PHT fenytoin PGB pregabalin PRIM primadon RFM rufinamid STER steroidy STIR stiripentol SUL sultiam TGB tiagabin TPM topiramát VGB vigabatrin VPA valproát, soli kyseliny valproové ZNS zonisamid GTCS záchvat generalizovaných tonicko-klonických křečí CAE syndrom dětských absencí JAE syndrom juvenilních absencí JME juvenilní myoklonická epilepsie GMA, GM-only syndrom grand mal vázaných na probuzení, resp. izolovaný výskyt čistých GM (GTCS), nejčastěji vázaných na období po probuzení doc. MUDr. Jiří Hovorka, CSc.
Neurologické oddělení, epileptologické a neuropsychiatrické centrum Nemocnice Na Františku 847/8
110 00 Praha 1
Neurochirurgická klinika 1. LF UK a ÚVN Praha
e-mail: hovorka@nnfp.czPřijato k recenzi: 17. 5. 2010
Přijato do tisku: 20. 7. 2010doc. MUDr. Jiří Hovorka, CSc.
Jiří Hovorka promoval v roce 1983 na 2. LF UK v Praze. Klinickou praxi zahájil na neurologickém oddělení ve Vlašimi u prof. Z. Macka. V letech 1984–1993 pracoval na Neurologické klinice 2. LF UK ve FN v Motole u prof. H. Krejčové a doc. M. Bojara a současně ve Fyziologickém ústavu 1. LF UK a AV ČR u prof. M. Langmeiera a prof. P. Mareše. Již v tomto období se jeho zájem soustředil na oblast EEG a epileptologie. Po absolvování domácích specializačních kurzů v této oblasti, zejména u prim. J. Dolanského, absolvoval stáže na prestižních zahraničních pracovištích na Mayo Clinic, Cleveland Clinic a Harvard Medical School. Doc. Hovorka atestoval v oboru neurologie, vypracoval dizertační práci týkající se progresivní epileptogeneze, absolvoval specializace v EEG a epileptologii, obhájil habilitační práci na téma diagnostiky a léčby psychických poruch u epilepsie a byl jmenován soudním znalcem. V roce 1993 nastoupil jako primář Neurologického oddělení v Nemocnici Na Františku. Zde obnovil historicky první neurologické oddělení v ČR, původně založené prof. Haškovcem. Neurologické oddělení NNF bylo postupně rozšířeno o komplexní epileptologický program, včetně léčby epileptochirurgické, stalo se jedním z vrcholových epileptologických center a také zakládajícím členem Pražské skupiny pro chirurgickou léčbu epilepsie. V dalším období bylo na stejném pracovišti založeno ojedinělé neuropsychiatrické centrum zabývající se nejprve problematickou psychických poruch u nemocných s epilepsií a postupně i u dalších neurologických a somatických onemocnění. Doc. Hovorka je členem českých i zahraničních odborných společností, je členem výboru České ligy proti epilepsii. Věnuje se klinické epileptologii a neuropsychiatrické problematice u epilepsie a v neurologii obecně, publikoval přes 200 prací doma i v zahraničí, včetně monografií, přednáší na 1. LF UK v Praze, v IPVZ Praha a na odborných sympoziích. Pracuje jako soudní znalec v oboru neurologie a v případech na pomezí neuropsychiatrie.
Vědomostní test
1. O výskytu aktivní epilepsie v populaci platí:
a) je stejně častá jako Parkinsonova choroba
b) vyskytuje se v 0,5–1 %
c) jde o vzácné onemocnění
d) vyskytuje se v 6–8 %2. Rozhodnutí o zahájení léčby epilepsie:
a) je vždy rozhodnutím lékaře
b) provádíme až po proběhlém druhém záchvatu
c) provádíme již po prvním neprovokovaném záchvatu
d) je dialogem mezi lékařem a nemocným, rozhodnutím pacienta na základě kompetentní nabídky, doporučení lékaře3. Po prodělání závažného kraniocerebrálního úrazu indikujeme dlouhodobou antiepileptickou léčbu:
a) u všech pacientů, kteří prodělali akutní symptomatický záchvat
b) u pacientů s ložiskovým strukturálním poškozením mozku nebo s přetrvávajícím neurologickým deficitem
c) u pacientů s výše uvedenými riziky (b), jen při nálezu lokalizované epileptiformní abnormity v EEG
d) pouze tam, kde pacient prodělá mimo akutní období neprovokovaný záchvat4. O riziku opakování neprovokovaného epileptického záchvatu platí:
a) je velmi nízké, okolo 2 %
b) obecně se pohybuje v širokém rozmezí 20–80 %
c) konkrétně o něm rozhoduje přítomnost dalších rizikových faktorů
d) je nejvyšší v prvních 6–12 měsících5. O antiepileptické léčbě platí:
a) po prodělání prvního neprovokovaného záchvatu snižuje riziko recidivy o 50 %
b) časné nasazení zlepšuje dlouhodobou prognózu epilepsie
c) dokáže ovlivnit vlastní podstatu epileptického onemocnění, má profylaktické účinky proti vzniku epilepsie
d) potlačuje pouze výskyt epileptických záchvatů6. O taktice iniciální léčby platí:
a) lék titrujeme vždy do terapeutického pásma plazmatických hladin
b) při jen částečné účinnosti středních dávek léku ho včas vyměníme za lék jiný i při dobré toleranci
c) indikována je monoterapie v nejnižších účinných dávkách
d) léčbu vždy navyšujeme do maximálních terapeutických dávek7. K obecným pravidlům léčby patří volba léku:
a) podle typu epileptických záchvatů/syndromu
b) důsledně podle vědecky doložených důkazů o její účinnosti
c) podle aktuálních doporučení zohledňujících vědecké a další klinické poznatky
d) podle individuality pacienta (somatická a psychická kondice, komorbidity, polyterapie aj.)8. O antiepilepticích platí:
a) nikdy nezhoršují epileptické záchvaty
b) je nutno je vždy podávat v maximálních tolerovaných dávkách a raději v kombinaci
c) kromě epilepsie nemají jiné terapeutické využití
d) mohou mít paradoxně účinky prokonvulzivní, vedle léčby epilepsie mají i další terapeutické využití9. Mezi širokospektrá antiepileptika patří:
a) CBZ, PHT
b) LTG, TPM, VPA
c) LEV, ZNS
d) GBP, PGB10. Širokospektrá antiepileptika používáme:
a) pouze tam, kde nefungují antiepileptika s užším spektrem účinku
b) u pacientů s více typy záchvatů
c) pouze tam, kde nejsou přítomny fotosenzitivní záchvaty
d) u pacientů, kteří nemají zcela jisté typy záchvatů a syndromu11. Léky volby jsou:
a) u syndromu dětských absencí ETS, VPA, LTG
b) u syndromu juvenilních absencí CBZ, PHT, OXC, LCM
c) u syndromu Dravetové LTG, CBZ
d) pro léčbu myoklonických záchvatů jsou léky volby CBZ, GBP, PGB, TGB12. Při volbě léků zohledňujeme vedle spektra účinnosti i jejich další priority:
a) tolerabilitu, rizika závažných nežádoucích účinků
b) mechanizmy účinku
c) potenciální lékové interakce
d) rychlost titrace a nutnost laboratorního monitorování13. Z hlediska farmakomechanistické teorie jsou v kombinované léčbě fokálních epilepsií výhodné kombinace:
a) CBZ + PHT
b) CBZ + LTG
c) CBZ + PGB
d) VPA + LCM14. Z hlediska farmakomechanistické teorie jsou v kombinované léčbě generalizovaných epilepsií výhodné kombinace:
a) VPA + LTG
b) PHT + LTG
c) LTG + LEV
d) VPA + TPM15. O farmakokinetických interakcích mezi antiepileptiky platí:
a) kombinace CBZ + PHT je výhodná
b) kombinace VPA + LTG je nevýhodná, dochází ke snížení hladin obou léků
c) TPM může zvýšit hladiny PHT
d) GBP, PGB, LEV, ZNS, LCM nevykazují významné interakce16. O pravé farmakorezistenci platí:
a) jde o chybnou dg. epilepsie, záchvaty jsou neepileptického původu
b) je podmíněna vlastní podstatou epileptického onemocnění, řadou možných příčin
c) její včasná diagnostika je zcela zásadní pro další možnosti invazivní léčby
d) jde o chybnou dg. typu záchvatů a syndromu a chybnou volbu léku17. Potenciálně depresogenní účinky má:
a) PHB, PRIM
b) LTG
c) VGB
d) VPA18. O antiepileptické léčbě platí:
a) cílem je optimální kvalita života nemocných, nikoli pouze potlačení záchvatů
b) optimálními léky pro pacienta léčeného warfarinem jsou induktory hepatálních enzymů, např. CBZ, PHT
c) rizika obezity a metabolického syndromu X mohou být podpořena dlouhodobou léčbou některými antiepileptiky
d) k váhově neutrálním lékům patří GBP, VPA, CBZ19. O antiepileptické léčbě platí:
a) snížení renálních funkcí je nutno přizpůsobit dávkování některých léků, např. GBP, PGB, LEV
b) snížení renálních funkcí je nutno přizpůsobit dávkování některých léků, např. CBZ, VPA, LTG
c) na rozdíl od jiných léků nemají antiepileptika žádná kardiotoxická rizika
d) pacienti léčení enzymatickými induktory mají zvýšené riziko osteopatií, zlomenin páteře a kyčelních kloubů20. O ukončování léčby platí:
a) doporučíme ho u většiny pacientů po dvouleté remisi
b) bude neúspěšné u naprosté většiny pacientů se symptomatickou epilepsií
c) bude úspěšné u naprosté většiny dospělých pacientů s idiopatickými generalizovanými epilepsiemi
d) nejlepším vodítkem je diagnostika epileptického syndromu se známou prognózou, případně vyhodnocení konkrétních rizikSprávná je jedna či více odpovědí.
Za správné vyřešení testu získá řešitel 5 kreditů ČLK. Test můžete vyplnit na: www.csnn.eu
Zdroje
1. Hauser WA, Annegers JF, Kurland LT. Incidence of epilepsy and unprovoked seizures in Rochester, Minnesota: 1935–1984. Epilepsia 1993; 34(3): 453–468.
2. EpiStop. Soubor minimálních diagnostických a terapeutických standardů u pacientů s epilepsií. Praha: Maxdorf 2007 : 1–58. (Dostupné z URL: www.epistop.cz)
3. Dolanský J. Současná epileptologie. Praha: Triton 2000.
4. Komárek V. Epilepsie a epileptické syndromy. Praha: Galén 1997 : 1–117.
5. Donáth V, Kuchar M, Sýkora P. Epilepsia. Bratislava: Slovenské pedagogické nakladatelstvo 2000 : 1–340.
6. Hovorka J. Základní principy protizáchvatové léčby. Cesk Slov Neurol N 1998 : 61/94(1): 1–16.
7. Hadač J. Epilepsie-základy diagnostických a léčebných postupů. In: Hadač J (ed). Klinické zkušenosti s přípravkem neurontin (gabapentin) v léčbě epilepsie. Praha: Maxdorf 2003 : 7–23.
8. Leppik IE. Contemporary diagnosis and management of the patient with epilepsy. 5th ed. Pennsylvania: Newton 2001.
9. Panayotopoulos CP. A clinical guide to epileptic syndromes and their treatment. 2nd ed. London: Springer-Verlag 2007.
10. Hovorka J, Herman E, Nežádal T. Epilepsie a základy antiepileptické léčby – I. Neurol pro praxi 2004; 3 : 45–49.
11. Shorvon S. Principles of treatment of epilepsy. In: Shorvon S (ed). Epilepsy. Oxford: Oxford Neurology Library 2009 : 65–90.
12. Komárek V. Léčba věkově vázaných epileptických syndromů s příznivou prognózou. Neurol pro praxi 2007; 2 : 87–90.
13. Komárek V. Léčba epileptických syndromů u dětí. Cesk Slov Neurol N 2007; 71/103(5): 473–487.
14. Ošlejšková H et al. Epileptické a neepileptické záchvaty v dětství a adolescenci. Plzeň: Adela 2009 : 1–274.
15. Hovorka J, Herman E. Neuropsychiatrické aspekty u epilepsie. Cesk Slov Neurol N 2001; 70/103 (Suppl): 1–16.
16. Hovorka J, Herman E, Bajaček M, Doubek P, Praško J. Psychiatrické aspekty epilepsie. Neurol pro praxi 2005; 2 : 89–94.
17. Hovorka J, Herman E, Nežádal T. Epilepsie a základy antiepileptické léčby – II, aspekty psychiatrické. Neurol pro praxi 2004; 4 : 13–17.
18. Praško J, Pastucha P, Raszka M, Látalová E, Herman E, Hovorka J et al. Disociativní křeče. Cesk Slov Neurol N 2009; 72/105(4): 429–436.
19. Commission on Classification and Terminology of the International League Against Epilepsy. Proposal for revised clinical and electrographic classification of epileptic seizures. Epilepsia 1981; 22(4): 489–501.
20. Kalina M. Status epilepticus. Neurol pro praxi 2002; 2 : 87–93.
21. Blume WT, Lüders HO, Mizrahi E, Tassinari C, van Emde Boas W, Engel J jr. Glossary of descriptive terminology for ital semiology: report of the ILAE task force on classification and terminology. Epilepsia 2001; 42(9): 1212–1218.
22. Commision on Epidemiology and Prognosis, International League Against Epilepsy. Guidelines for epidemiological studies on epilepsy. Epilepsia 1993; 34(4): 592–596.
23. Fischer RS, van Emde Boas W, Blume W, Elger C, Genton P, Lee P et al. Epileptic seizures and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and the International Burelu for Epilepsy (IBE). Epilepsia 2005; 46(4): 470–472.
24. Hauser WA, Rich SS, Annegers JF, Anderson VE. Seizure recurrence after a 1st unprovoked seizure: an extended follow-up. Neurology 1990; 40(8): 1163–1170.
25. Berg AT, Shinnar S. The risk of seizure recurrence following a first unprovoked seizure: a quantitative review. Neurology 1991; 41(7): 965–972.
26. Berg AT. Risk of recurrence after a first unprovoked seizure. Epilepsia 2008; 49 (Suppl 1): 13–18.
27. Hauser WA, Rich SS, Lee JR, Annegers JF, Anderson VE. Risk of recurrent seizures after two unprovoked seizures. N Engl J Med 1998; 338(7): 429–434.
28. Leach JP, Mohanraj R. Treatment of adults with newly diagnose epilepsy. In: French JA, Delanty N (eds). Therapeutic strategies in epilepsy. Oxford: Clinical Publishing 2009 : 119–133.
29. Scottish Intercollegiate Guidelines Network (SIGN). Diagnosis and Management of Epilepsy in Adults. Edinburg 2003 : 1–49. (Dostupné z URL: www.sign.ac.uk)
30. Shinnar S, Berg AT, O´Dell C, Newstein D, Moshe SL, Hauser WA. Predictors of multiple seizures in a cohort of children prospectively followed from the time of their first unprovoked seizure. Ann Neurol 2000; 48 : 140–147.
31. Haut SR, O´Dell C, Shinnar S. Risk factors for developing epilepsy after first unprovoked seizure. In: Ryvlin P, Beghi E, Camfield P et al (eds). From first unprovoked seizure to newly diagnosed epilepsy. Progress in epileptic disorders, vol. 3. Mesher: John Libbey Eurotext 2007 : 37–57.
32. Sýkora P. Liečba epileptických syndrómov v dětskom veku s nepriaznivou prognózou. Neurol pro praxi 2007; 2 : 91–93.
33. Hovorka J. Přínos EEG vyšetření pro klinickou epileptologii – možnosti „využití“ a „zneužití“. In: Hovorka J (ed). Klinická elektroencefalografe, základy klasifikace a interpretace. Praha: Maxdorf 2003: 105–165.
34. First Seizure Trial Group. Randomized clinical trial on efficacy of antiepileptic drugs in reducing the risk of relapse after a first unprovoked tonic-clonic seizure. Neurology 1993; 43 (3 Pt 1): 478–483.
35. Marson A, Jacoby A, Johnson A, Kim L, Gamble C, Chadwick D. Medical Research Council MESS Study Group. Immediate versus deferred antiepileptic drug treatment for early epilepsy and single seizures: a randomised controlled trial. Lancet 2005; 365(9476): 2007–2013.
36. Shellhaas RA, Dlugos DJ. Treatment of the child or adolescent with newly diagnose epilepsy. In: French JA, Delanty N (eds). Therapeutic strategies in epilepsy. Oxford: Clinical Publishing 2009 : 85–102.
37. Zárubová J. Zásady farmakoterapie epilepsie u dospělých. Postgrad Med 2005; 6(7): 654–662.
38. Mohanraj R, Brodie MJ. Diagnosis refractory epilepsy: response to sequential treatment scheadules. Eur J Neurol 2006; 13(3): 277–282.
40. Hovorka J.Volba optimální antiepileptické léčby na dvou osách: osa I – podle typu epileptických záchvatů/syndromu, osa II – podle typu, individuality pacienta. Postgrad Med 2009; 8 : 898–905.
41. Commission on Classification and Terminology of the International League Against Epilepsy (1989). Proposal for revised classification of epilepsies and epileptic syndromes. Epilepsia 1989; 30(4): 389–399.
42. Commission on Classification and Terminology of the International League Against Epilepsy. Revised terminology and concepts for organization of the epilepsies: Report of the Commission on Classification and Terminology. ILAE 28 July 2009 : 1–16.
43. Hovorka J. Farmakologická léčba epilepsie podle „guidelines“? Neurol pro praxi 2009; 4 : 171–176.
44. Glauser T, Ben-Menachem E, Bourgeois E, Cnaan A, Chadwick D, Guerreiro C et al. ILAE treatment guidelines: evidence-based analysis of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes. Epilepsia 2006; 47(7): 1094–1120.
45. French JA, Kanner AM, Bautista J, Abou-Khalil B, Browne T, Harden CL et al. Efficacy and tolerability of the new antiepileptic drugs I: treatment of new onset epilepsy. Report of the Therapeutics and Technology Assessment Subcommittee and Quality Standards Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Neurology 2004; 62(8): 1252–1260. (Dostupné z URL: www.aan.com/professionals/index/cfm)
46. French JA, Kanner AM, Bautista J, Abou-Khalil B, Browne T, Harden CL et al. Efficacy and tolerability of the new antiepileptic drugs II: Treatment of refractory epilepsy. Report of the Therapeutics and Technology Assessment Subcommittee and Quality Standards Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Neurology 2004; 62(8): 1261–1273. (Dostupné z URL: www.aan.com/professionals/index/cfm)
47. National Institute for Clinical Excellence (NICE). The Epilepsies: The diagnosis and management of the epilepsies in adults and children in primary and secondary care. London: Clinical guideline 2004 : 1–73. (Dostupné z URL: www.nice.org.uk)
48. Brodie MJ, Perucca E, Ryvlin P, Ben-Menachem E, Meencke HJ. Comparison of levetiracetam and controlled-release carbamazepin in newly diagnosed epilepsy. Neurology 2007; 68(6): 402–408.
49. Rektor I, Kuba R. Nová antiepileptika u dospělých – nové informace. Neurol pro praxi 2007; 2 : 70–74.
50. Zárubová J. Novinky ve farmakoterapii epilepsie. Farmakoterapie 2008; 1 : 13–18.
51. Brázdil M. Moderní racionální terapie epilepsie.Neurol pro praxi 2009; 10(2): 94–100.
52. Hovorka J. Novinky v léčbě epilepsie. Remedia 2009; 4 : 23–27.
53. Ošlejšková H. Zhoršování epileptických záchvatů a epilepsií antiepileptiky – je to možné? Cesk Slov Neurol N 2007; 70/103(2): 137–142.
54. Bajaček M, Hovorka J, Nežádal T, Němcová I, Herman E. Is pseudo-intractibility in population of patient with epilepsy still alive in 21 century? Audit of 100 seizure free patients, referred with diagnosis of pharmacoresistant epilepsy. Neuroendocrinol Lett. In press 2010.
55. Mohanraj R, Brodie MJ. Pharmacological outcomes in newly diagnose epilepsy. Epilepsy Behav 2005; 6(3): 382–387.
56. Marson AG, Al-Kharusi AM, Alwaidh M, Appleton R, Baker GA, Chadwick DW et al. SANAD study group. The SANAD study of effectiveness of carbamazepine, gabapentin, lamotrigine, oxcarbamapezine, or topiramate for generalised epilepsy: an unblinded randomised controlled trial. Lancet 2007; 369(9566): 1000–1015.
57. Marson AG, Al-Kharusi AM, Alwaidh M, Appleton R, Baker GA, Chadwick DW et al. SANAD study group. The SANAD study of effectiveness of vaproate, lamotrigine, or topiramate for treatment of partial epilepsy: an unblinded randomised controlled trial. Lancet 2007; 369(9566): 1016–1026.
58. Deckers CL, Czuczwar SJ, Hekster YA, Keyser A, Kubova H, Meinardi H et al. Selection of antiepileptic drug polytherapy based on mechanism of action: the evidence reviewed. Epilepsia 2000; 41(11): 1364–1374.
59. Kwan P, Brodie MJ. Combination therapy in epilepsy: when and what to use. Drugs 2006; 66(14): 1817–1829.
60. Hovorka J, Nežádal T. Kombinovaná léčba antiepileptiky u epilepsie: taktika, volba léků, interakce. Neurol pro praxi 2007; 2 : 80–85.
61. Zárubová J. Epilepsie a mateřství. Neurol pro praxi 2004; 6 : 331–336.
62. Zárubová J et al. Žena a epilepsie. Praha: Maxdorf 2004 : 1–109.
63. Tomson T, Battino D. Teratogenic effects of antiepileptic medications. Neurol Clin 2009; 27(4): 993–1002.
64. Topinková E et al. Geriatrie pro praxi. Praha: Galén 2005 : 1–270.
65. Nežádal T, Hovorka J, Bajaček M, Janicadisová M. Léčba epilepsie ve vyšším věku – farmakokinetické interakce. Čes Ger Rev 2007; 5(3): 156–163.
66. Hovorka J, Nežádal T, Bajaček M. Epilepsie a epileptické záchvaty ve stáří. Postgrad Med 2008; 10(7): 763–771.
67. Svačina Š, Owen K, Bretšnajderová A. Syndrom inzulinové rezistence. Praha: Triton 2003 : 1–182.
68. Hovorka J, Herman E, Bajaček M, Doubek P, Praško J. Psychiatrické aspekty epilepsie. Neurol pro praxi 2005; 2 : 89–94.
69. Komárek V, Hovorka J. Pseudofarmakorezistence a zásady racionální polyterapie. In: Brázdil M, Hadač J, Marusič P et al (eds). Farmakorezistentní epilepsie. Praha: Triton 2004 : 171–175.
70. Sillanpää M, Schmidt D. Natural history of treated childhood-onset epilepsy: prospective, long-term population-based study. Brain 2006; 129 (Pt 3): 617–624.
71. Schmidt D, Löscher W. Drug resistance in epilepsy: putative neurobiological and clinical mechanism. Epilepsia 2005; 46(6): 858–877.
72. French J, Faught E. Rational polytherapy. Epilepsia 2009; 50 (Suppl 8): 63–68.
73. Kwan P, Brodie MJ. Combination therapy in epilepsy: when and what to use. Drugs 2006; 66(14): 1817–1829.
74. Bourgeois BF. Treatment of the child or adolescent with treatment-resistant epilepsy. In: French JA, Delanty N (eds). Therapeutic strategies in epilepsy. Oxford: Clinical Publishing 2009 : 103–116.
75. Kwan P, Leung H. Treatment of adults with treatment-resistant epilepsy. In: French JA, Delanty N (eds). Therapeutic strategies in epilepsy. Oxford: Clinical Publishing 2009 : 135–151.
76. Bourgeois BF. Anticonvulsant potency and neurotoxicity of valproate alone and in combination with carbamazepine or phenobarbital. Clin Neuropharmacol 1988; 11(4): 348–359.
77. Bourgeois BF. Combination of valproate and ethosuximide: antiepileptic and neurotoxic interaction. J Pharmacol Exp Ther 1988; 247(3): 1128–1132.
78. Brodie MJ, Yuen AW. Lamotrigine substitution study: evidence for synergism with sodium vaplroate? 105 Study group. Epilepsy Res 1997; 26(3): 423–432.
79. Schmidt D. Strategies to present overtreatment with antiepileptic drugs in patients with epilepsy. Epilepsy Res 2002; 52(1): 61–69.
80. Brázdil M, Hadač J. Definice pseudofarmakorezistence, příčiny intraktibility. In: Brázdil M, Hadač J, Marusič P et al (eds). Farmakorezistentní epilepsie. Praha: Triton 2004 : 13–21.
81. Wiebe S, Blume WT, Girvin JP, Eliazsiw M. A randomized trial of surgerical versus medical therapy of temporal lobe epilepsy. N Engl Med 2001; 345: 311–318.
82. Brázdil M, Hadač J, Komárek V, Kuba R, Marusič P. Epileptochirurgické zákroky.
In: Brázdil M, Hadač J, Marusič P (eds). Farmakorezistentní epilepsie. Praha: Triton 2004 : 182–203.
83. Régis J, Rey M, Bartolomei F, Vladyka V, Liscak R, Schröttner O et al. Gamma knife surgery in mesial temporal epilepsy: a prospective multicenter study. Epilepsia 2004; 45(5): 504–515.
84. Urgošík D. Funkční neurochirurgie. In: Liščák R. Radiochirurgie gama nožem. Praha: Grada Publishing 2009 : 215–217.
85. Malíková H, Vojtěch Z, Liščák R, Procházka T, Vymazal J, Vladyka V et al. Stereotactic radiofrequency amygdalohippocampectomy for treatment of mesial temporal lobe epilepsy: correlation of MRI with clinical seizure outcome. Epilepsy Res 2009; 83(2–3): 235–242.
86. Hovorka J, Nežádal T, Herman E, Němcová I, Bajaček M. Psychogenic non-epileptic seizures, prospective clinical experience: diagnosis, clinical features, risk factors, psychiatric comorbidity, treatment outcome. Epileptic Disord 2007; 9 (Suppl 1): 52–59.
87. Specchio LM, Beghi E. Should antiepileptic drugs be withdrawn in seizure-free patients? CNS Drugs 2004; 18(4): 201–212.
88. Medical Research Council Antiepileptic Drug Withdrawal Study Group. Prognostic index for recurrence of seizure after remission of epilepsy. BMJ 1993; 306(6889): 1374–1378.
89. Medical Research Council Antiepileptic Drug Withdrawal Study Group. Randomised study of antiepileptic drug withdrawal in patients in remission. Lancet 1991; 337(8751): 1175–1180.
90. Temkin NR. Antiepileptogenesis and seizure prevention trial with antiepileptic drugs: meta - analysis of controled trials. Epilepsia 2001; 42 : 515–524.
91. Watts AE. The natural history of untreated epilepsy in rural community in Africa. Epilepsia 1992; 33(3): 464–468.
92. Tennison M, Greenwood R, Lewis D, Thorn M. Discontinuing antiepileptic drugs in children with epilepsy: a comparison of a six-week and nine-month taper period. N Engl J Med 1994; 330(20): 1407–1410.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Webové okénkoČlánek Neurovaskulární kongres 2010
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2010 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Farmakologická léčba epilepsie
- Ložiskové léze CNS u pacientů s HIV infekcí
- Tkáňové kultury pro studium prionových chorob
- Funkční význam pólu temporálního laloku
- Problematika indikace operační léčby u intramedulárních lézí
- Posttraumatický hypopituitarizmus u dětí a dospívajících
- Mozková flebotrombóza – analýza série 33 nemocných
- Neuroendokrinní dysfunkce u dětí a dospívajících po úrazu mozku
- Dlhodobé výsledky liečby meningeómov Leksellovým gama nožom
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
- Syndrom spontánní intrakraniální hypotenze u čínské pacientky s autozomálně dominantní polycystickou nemocí ledvin – kazuistika
- Unilaterální hypoplazie bazálních ganglií u pacientky s epilepsií – kazuistika
- Neobvyklé iatrogenní poranění n. musculocutaneus – dvě kazuistiky
- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXII. Rozbor složitějších kontingenčních tabulek je účinným nástrojem pro studium vztahů kategoriálních znaků - Neurovaskulární kongres 2010
- Jsou dekomprese páteřního kanálu a opakované zpevnění páteře u transverzální léze hrudní míchy nutné?
-
III. neuromuskulární kongres
6.–7. května 2010, Brno
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika
- Farmakologická léčba epilepsie
- Funkční význam pólu temporálního laloku
- Léčba juxtafacetární cysty bederní páteře dynamickou interspinózní stabilizací – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




