-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Rekonstrukce durálních defektů xenogenním implantátem
Dural reconstruction with usage of xenogenic biomaterial
Introduction:
Watertight dural reconstruction represents the golden standard of every intradural surgery.
Aim:
Autologous graft versus xenogenic graft comparison in dural reconstruction. Patients and methods: Our prospective study evaluated data of 86 patients who underwent a neurosurgical procedure. We divided patients into two groups. We used an autologous graft (fascia, periost) in the first group and xenogenic biomaterial in the second group to perform dural reconstruction. Xenogenic biomaterial was Dural graft Biodesign® (Cook-Medical, Bloomington, IN, USA). In both groups, we assessed the incidence of cerebrospinal fluid leakage, infectious and non-infectious complications of wound healing.
Results:
Cerebrospinal fluid leakage occurred in the group with the xenogenic dural graft in 11.6% and in the group with the autologous graft in 9.3%. Infection rate was low, 4.6% in both groups. All patients received standard wound care according to the workplace routine. We detected no alergic reaction or graft rejection in any of our patients. Complete follow up was successful in 77 cases (89.5%) of all pacients. Difference between incidence of liquor fistula showed no statistical difference in both groups (p < 0.05).
Conclusion:
Application of xenogenic graft is very easy and simple and we consider it suitable for dural reconstruction.
Klíčová slova:
tvrdá plena – likvorová píštěl – meningitida – neurochirurgie
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Chinese summary - 摘要
使用异种生物材料进行硬脑膜重建
介绍:
水密硬脑膜重建是每次硬膜内手术的黄金标准。
目标:
硬脑膜重建中自体移植与异种移植的比较。
患者和方法:我们的前瞻性研究评估了86例接受神经外科手术的患者的数据。 我们将患者分为两组。 我们在第一组使用自体移植物(筋膜,骨膜),在第二组使用异种生物材料进行硬脑膜重建。 异种生物材料是Dural graft Biodesign(Cook-Medical,Bloomington,IN,USA)。 在两组中,我们评估了脑脊液漏,伤口愈合的感染性和非感染性并发症的发生率。
结果:
异种硬膜移植组发生脑脊液漏11.6%,自体移植组9.3%。 感染率低; 两组均为4.6%。 所有患者均根据工作场所常规接受标准伤口护理。 我们在任何患者中均未发现过敏反应或移植排斥反应。 所有患者中77例(89.5%)完成随访。 两组间酒瘘发生率差异无统计学差异(p <0.05)。
结论:
异种移植物的应用非常简单,我们认为它适用于硬脑膜重建。
关键词:
硬脑膜 - 脑脊液漏 - 脑膜炎 - 神经外科
Autori: Z. Večeřa 1; O. Krejčí 1; M. Houdek 1; R. Lipina 1; M. Kanta 2
Pôsobisko autorov: Neurochirurgická klinika LF OU a FN Ostrava 1; Neurochirurgická klinika LF UK a FN Hradec Králové 2
Vyšlo v časopise: Cesk Slov Neurol N 2018; 81(6): 686-690
Kategória: Původní práce
doi: https://doi.org/10.14735/amcsnn2018686Súhrn
Úvod:
Vodotěsná rekonstrukce tvrdé pleny představuje optimum a zlatý standard intradurálních neurochirurgických operací.
Cíl:
Srovnání autologního štěpu a xenogenního biomateriálu použitého k rekonstrukci durálních defektů.
Soubor a metodika:
Prospektivní studie hodnotila 86 operovaných pacientů. Pacienty jsme rozdělili do dvou skupin. U první skupiny byla k rekonstrukci tvrdé pleny použita pacientova vlastní tkáň – fascie, periost, u druhé poloviny byl defekt přešit xenogenním biomateriálem. Obchodní název preparátu je Durální graft Biodesign® (Cook-Medical, Bloomington, IN, USA). V obou skupinách jsme sledovali incidenci likvorové píštěle, infekční a neinfekční komplikace hojení.
Výsledky:
Likvorová píštěl se ve sledované skupině vyskytla 11,6 %, v kontrolní skupině při užití vlastního štěpu byla 9,3 %. Četnost infekčních komplikací byla nízká, shodně 4,6 % v obou skupinách. U všech pacientů probíhala standardní péče o operační ránu dle zvyklostí pracoviště. Alergickou reakci ani rejekci štěpu jsme ve sledované skupině nezaznamenali. Kompletního sledování bylo dosaženo u 77 případů (89,5 %) pacientů. Rozdíl v incidenci likvorové píštěle mezi oběma postupy neprokázala statistickou významnost (p < 0,05). Závěr: Biomateriál se pro jednoduchost užití jeví jako vhodný alternativní kandidát k rekonstrukci durálních defektů.
Klíčová slova:
tvrdá plena – likvorová píštěl – meningitida – neurochirurgie
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Úvod
Rekonstrukce tvrdé pleny a jejich defektů hraje v neurochirurgii důležitou roli a je trvalou součástí všech intradurálních výkonů. Nedostatečné ošetření může vést k likvorové píštěli a možným zánětlivým komplikacím – od prosté infekce operační rány, meningitidy, epidurálního či subdurálního empyému až po vznik cerebritidy či mozkového abscesu. Případné zavádění zevní lumbální drenáže, reoperace, antibiotická léčba prodlužují dobu hospitalizace a navyšují ekonomickou zátěž [1]. Nehledě na negativní dopad z pohledu pacienta a jeho celkový dojem z operace a léčby.
Pokud v závěru operace není možná prostá sutura tvrdé pleny či rekonstruujeme-li vzniklý defekt, máme řadu možností, jak jej ošetřit. Můžeme použít tělu vlastní autologní materiál – nejčastěji periost kalvy či fascii skalpu – a všít jej do defektu. K dispozici je taktéž řada komerčních biomateriálů různého původu, tkáňových lepidel a hemostatik, kterými lze defekt překrýt, ale většinu nelze přišít k okrajům defektu a docílit tím vodotěsné sutury. V indikovaných případech je někdy nutné perioperační zavedení dočasné zevní lumbální drenáže.
Snaha o minimalizaci komplikací plynoucích z nedokonalého uzávěru tvrdé pleny nás vedla k vytvoření studie, v níž porovnáváme použití autologního štěpu a xenogenního biomateriálu odvozeného ze submukózy prasečího tenkého střeva. Jeho vhodné vlastnosti byly prokázány na zvířecích modelech [2–5] a v klinických studiích v USA [6]. Submukóza je vrstva střeva, která poskytuje pevnost a je umístěna mezi mukózou a muskulární vrstvou stěny střeva. Tato vrstva je odloučena ze střeva, buňky odstraněny a ponechána extracelulární matrix obsahující strukturální kolageny a další bioaktivní proteiny umožňující remodalaci hostitelem [2,7]. Fyzikální vlastnosti jako napínatelnost a pevnost se blíží kvalitě vlastní tvrdé pleny. Náhrada je v současnosti nabízena na trhu pod obchodním názvem Durální graft Biodesign® (Cook-Medical, Bloomington, IN, USA) (obr. 1).
Obr. 1. Duralní graft připravený k aplikaci po 2min naložení do fyziologického roztoku.
Fig. 1. The dural graft is ready to use after 2 min in rehydration fluid.
Soubor a metodika
Monocentrická prospektivní studie vedená v letech 2015–2017 u pacientů operovaných na Neurochirurgické klinice FN Ostrava. Do studie byli zařazeni pacienti po podepsání informovaného souhlasu schváleného etickou komisí nemocnice. Následovala nezávisle provedená randomizace softwarem MedCalc (MedCalc Software, Ostend, Belgie) do sledované a kontrolní skupiny s přidělením autentického identifikačního čísla.
Vstupním kritériem byla primární durální rekonstrukce u zevních dekompresí, operací tumorů či vaskulárních lézí supratentoriálně i infratentoriálně, traumat s lézí tvrdé pleny a dále durální rekonstrukce u Chiariho malformace. Vyloučeni byli pacienti s recidivou likvorové píštěle či dříve proběhlým operačním výkonem v místě durálního defektu. Celkově bylo do studie zařazeno 86 pacientů. Ve sledované skupině byla provedena plastika durálního defektu náhradou Biodesign®. Vždy byla k dispozici velikost 20 × 7 cm (obr. 1). V kontrolní skupině byl defekt ošetřen pacientu vlastním fasciovým či periostálním štěpem. Chirurgická technika přichycení durální náhrady byla v obou skupinách shodná a zahrnovala vodotěsnou suturu k okraji tvrdé pleny. Pojištění sutury tkáňovým lepidlem či hemostyptikem nebylo dovoleno. Standardní pooperační péče o operační ránu byla shodná v obou skupinách, podkožní drén byl vždy odstraněn nejpozději do 72 h od operace.
V celém souboru jsme se zaměřili na hodnocení incidence likvorové píštěle, incidenci infekčních a neinfekčních komplikací. Za neinfekční komplikace jsme považovali protrahované hojení spojené se sekrecí z operační rány nebo více než jednu punkci operační rány pro recidivující serohematom (přítomnost likvoru byla vždy vyloučena vyšetřením beta trace proteinu). V případě reoperace s odstupem (pro plastiku lbi) jsme hodnotili intraoperační nález – preparovatelnost laloku, pevnost plastiky dury, kvalitu prohojení k okolí a reakci okolní tkáně (obr. 2). Délka sledování byla 6 měsíců od operace. Kontrolní zobrazovací vyšetření (MR mozku) v závislosti na diagnóze bylo provedeno v rozmezí 3–6 měsíců od operace. Statistické zhodnocení provedl statistik programem R project (R Foundation, Vídeň, Rakousko).
Obr. 2. Peroperační obrázek v průběhu plastiky kalvy. Defekt po zevní dekompresi ošetřen durálním graftem před 3 měsíci.
Fig. 2. Peroperative image during cranioplasty surgery. Defect after external decompression was treated with a dural graft 3 months ago.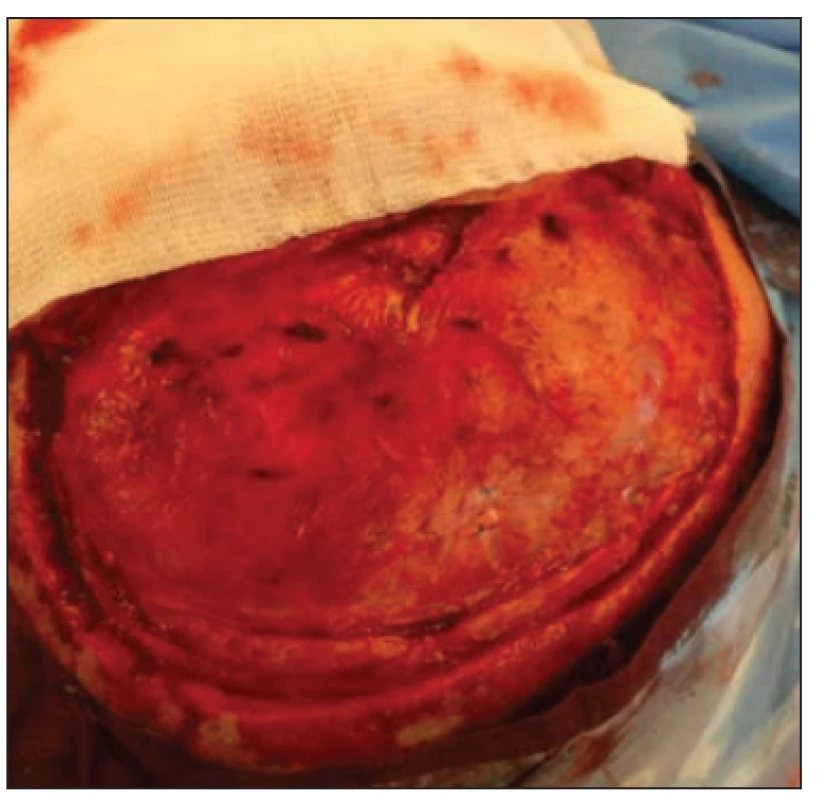
Výsledky
Do studie bylo zahrnuto celkově 86 pacientů operovaných v letech 2015–2017. Sledování po dobu 6 měsíců bylo dosaženo u 77 případů (89,5 %). V šesti případech bylo příčinou ukončení sledování úmrtí pacienta (důvodem bylo těžké kraniotrauma), dva pacienti časně zemřeli (progrese glioblastomu), jednoho pacienta se nepodařilo kontaktovat a nedorazil k plánované kontrole. Průměrný věk byl 58 ± 14,3 let a 57 % bylo mužů. Nejčastější typem operace byla supratentoriální kraniotomie (47,7 %) – operace aneuryzmat, gliomů, meningiomů. Dále oblast neurotraumatologie (36,1 %) – zevní dekomprese a evakuace hematomů. Nejméně početná skupina byla infratentoriální chirurgie – retrosigmoideální přístup, dekomprese zadní jámy pro ischemii, exstirpace metastázy, plastika Chiariho malformace. Alergickou reakci na preparát jsme nezaznamenali. Základní shrnutí přehledně zobrazuje tab. 1.
Tab. 1. Přehled jednotlivých typů operací v obou skupinách. Typ operace Autologní štěp (n 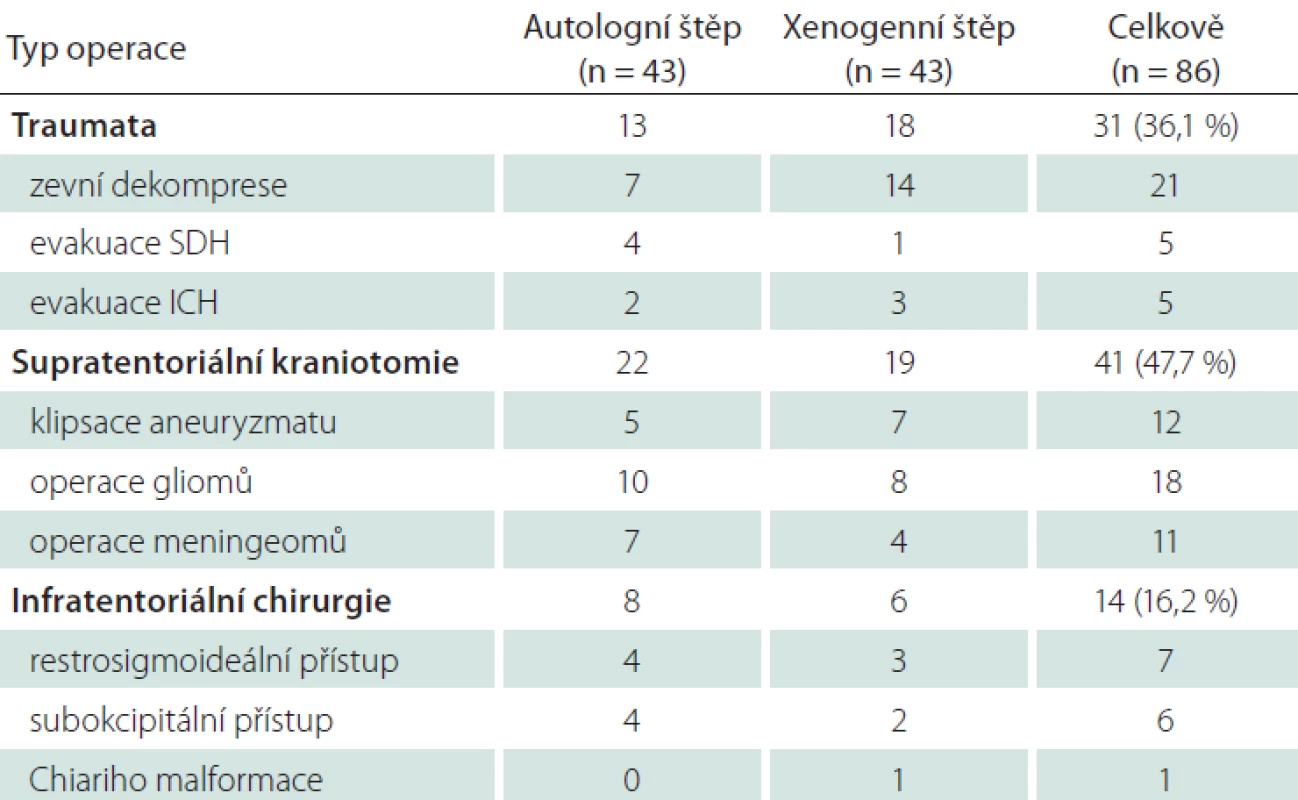
ICH – intracerebrální hematom; SDH – subdurální hematom. Likvorová píštěl se ve sledované skupině vyskytla u 11,6 % (5 pacientů), v kontrolní skupině při užití vlastního štěpu bylo 9,3 % (4 pacientů). Spontánní regrese prosaku byla u jednoho pacienta po operaci meningiomu v kontrolní skupině, u zbývajících si stav vyžádal reoperaci spojenou s prodloužením hospitalizace (průměrně o 7 dní). U jednoho pacienta proběhla reoperace 2× se zavedením zevní lumbální drenáže a přechodnou imobilizací na lůžku. Příčinou likvorey byla peroperačně zjištěna nejčastěji nedostatečná sutura 5×, přehlédnutí defektu tvrdé pleny mimo suturu 2×, rozpad sutury 1×. U pacienta s aplikací durální náhrady se rozvinula časná meningitida, v kontrolní skupině u spontánně regredované likvorey nastala hnisavá sekrece z rány přeléčená antibiotiky s efektem.
Incidence infekčních komplikací byla shodně 4,6 % v obou skupinách. Mimo dvě komplikace uvedené výše jsme řešili 2× rozvoj epidurálního empyému s odstupem několika měsíců od operace (obr. 3). U pacienta s durálním graftem se jednalo o asymptomatický nález v rámci kontroly MR. U pacienta s vlastním periostálním štěpem byla prvním projevem komplikace hnisavá sekrece z operační rány. V obou případech jsme provedli lokální operační revizi s extrakcí ploténky, přeléčení antibiotiky trvalo 6 týdnů, replastika kalvy proběhla s odstupem 3 měsíců. Kultivační nález prokázal u prvního pacienta stafylokoka – koaguláza negativní kmen, u druhého polybakteriální nález (Staphylococcus aureus, Actinomyces turicensis, peptoniphilus, Anaerococcus lactolyticus, Peptostreptococcus anaerobius). Závažnou komplikaci spojenou s narůstem morbidity jsme v našem souboru nezaznamenali.
Obr. 3. Epidurální empyém – MR u pacienta s durální náhradou. A – restrikce difuze, aparentní difuzní koeficient, B – T1 vážený obraz s aplikací kontrastní látky, C,D – CT mozku u pacienta kde byl použit autologní štěp
Fig. 3. Epidural empyema – MRI of patient with the dural graft. A – diff usion restriction, apparent diff usion coefficient, B – T1-weighted image with contrast administration, C,D – CT images of patient with autologous graft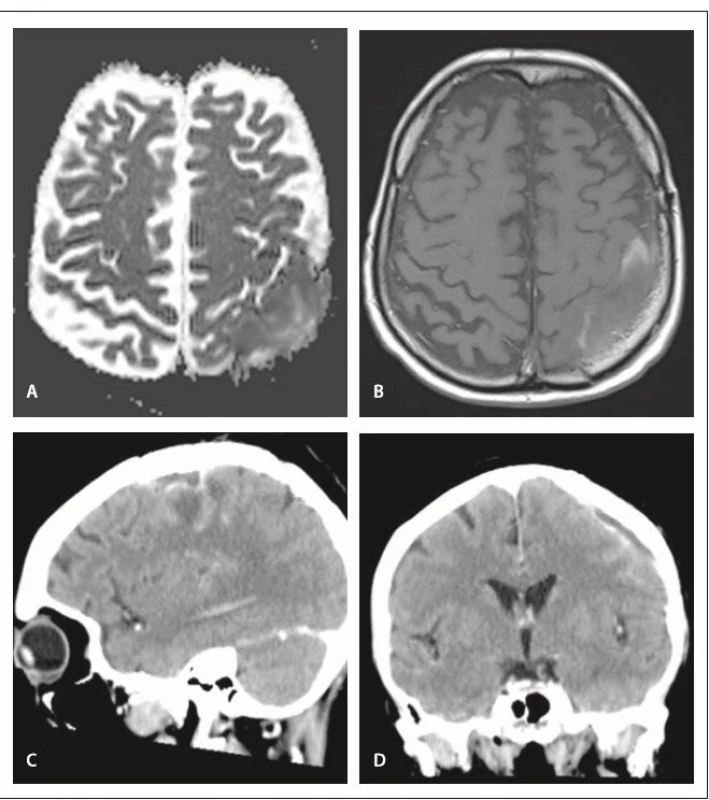
Neinfekční komplikace hojení mají v našem souboru relativně vysokou četnost 27,9 % (tab. 2). Ve většině případů se jednalo o nutnost opakované punkce operační rány (více než 2×), dále prolongovanou sekreci z operační rány (1× s nutností operační revize), 1× resuturu operační rány v lokální anestezii pro dehiscenci.
Tab. 2. Stručný přehled komplikací a jejich četnost. 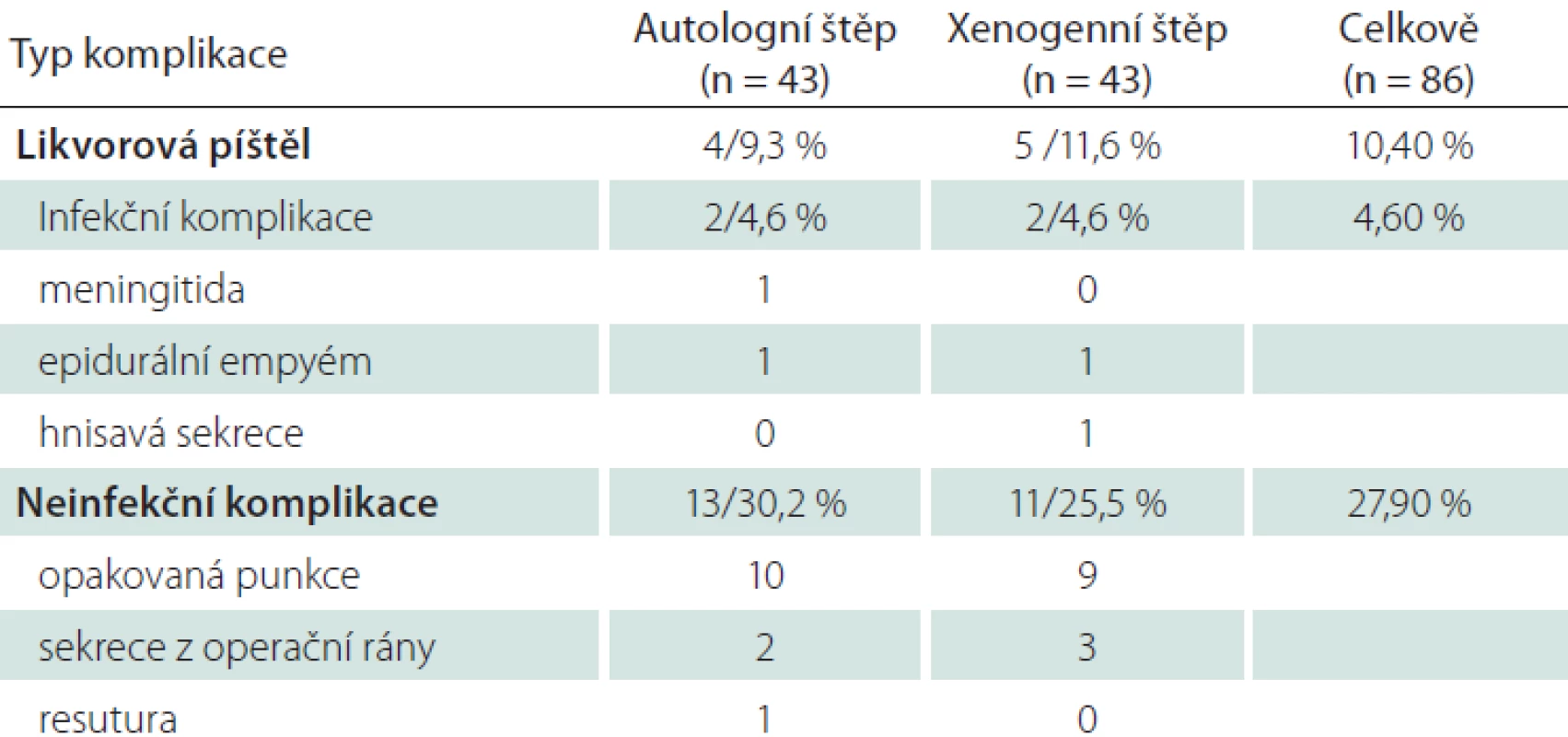
Reoperaci pro plastiku lbi a zhodnocení intraoperačního nálezu jsme provedli u 5 pacientů (obr. 2). Plastika se jevila jako pevná, neprosakovala likvorem, byla dobře preparovatelná od podkoží. Subdurální revizi jsme neprováděli. Kontrolní vyšetření MR hlavy a mozku bylo uskutečněno v 52 případech (60,4 %). Známky odhojení či enkapsulace nebyly zaznamenány.
Rozdíl v incidenci likvorové píštěle mezi oběma postupy neprokázal statistickou významnost (Fischerův exaktní test; p = 0,2985). Infekční komplikace nelze pro jejich malou incidenci statisticky validně hodnotit.
Peroperační užití preparátu je jednoduché a rychlé. Postačuje jej 2 min před aplikací naložit do fyziologického roztoku, následně můžeme všít do defektu. Preparát je pevný, podobný tvrdé pleně, stehy se neprořezávají a snadno nasazují (obr. 1).
Diskuze
Snaha o důslednou rekonstrukci durálních defektů a hledaní vhodných alternativních materiálů provází neurochirurgii v podstatě od jejích počátků. Již roku 1895 použil Abbe gumovou hmotu [8]. Xenogenní grafty charakteru animálních tkání jako perikard, peritoneum či intestinální mukóza nejsou v dnešní době používány [9,10]. Alogenní preparáty typu lyofilizované tvrdé pleny kadaverozního původu taktéž. Nechvalně proslul desetiletí užívaný preparát Lyodura prokázaným přenosem prionové infekce zejména v Japonsku a Austrálii [11–13]. Z této oblasti je v současnosti dostupný Alloderm® (BioHorizons, Birmingham, AL, USA) – graft na bázi lidské dermis zbavený buněk s ponechaným pojivem. Warren et al jej vyžívali k rekonstrukci durálních defektů u Chiariho malformace dětí s dobrým efektem [14]. Recentně skupina indonéských autorů prezentovala využití obalů amnia získaných z tkáňové banky k duroplastice kraniotraumat s dobrými výsledky. V dnešní době tento typ graftu již nepovažujeme za vhodný k užití v moderní neurochirurgii [15].
Nejvíce jsou v současnosti použivány syntetické či xenogenní deriváty kolagenů odvozené ze zvířecích tkání v podobě biomatrix zbavené antigenního potenciálu s minimálními infekčními riziky [16]. Přenos infekce nebyl dosud u těchto preparátů prokázán. Dloudobější časové vyhodnocení (více než 30 let) a zejména při použití v dětském věku pro chronická infekční rizika zatím čeká na zhodnocení. K dispozici jsou v různých velikostech a liší se způsobem aplikace (prosté položení, sutura, pojistění primární sutury). Mezi jasné výhody se počítá zkrácení operačního času a jednoduchost aplikace, největší nevýhodou preparátů je jejich cena [17]. Často diskutovaný problém incidence likvorey u těchto preparátů reflektuje řada prací. Při porovnání sutury, adaptační sutury a prosté aplikace náhrady u supratentoriální chirurgie udávají Bart et al srovnatelnou incidenci likvorové píštěle ve všech skupinách [18]. Sade et al při rekonstrukcích defektů v oblasti zadní jámy použili Duragen® (Integra, Plainsboro, NJ, USA) aplikován bez sutury s velmi nízkou incidencí píštěle 0,4 % [19]. Kshettry et al v oblasti zadní jámy stejnou technikou dosáhli incidence 8,3 % [20]. Incidence píštěle v publikovaných pracích kolísá mezi 0–13 % nezávisle na typu operace či technice aplikace [6,19–27]. Shrnutí nabízí tab. 3. Práce dokumentující užití dnes již nepouživaných či zakázaných preparátů jsme záměrně vynechali. V našem souboru dosáhla incidence likvorové píštěle 11,6 %. Výsledek považujeme v porovnání s ostatními dostupnými náhradami na trhu za rovnocenný. Taktéž finační dopad ceny durální náhrady, která se dle velikosti pohybuje v rozmezí tisíců až max. 20 000 Kč ve výsledné sumě za léčbu, považujeme za akceptovatelný. Jak z hlediska ceny, která je srovnatelná s jinými náhradami na trhu, tak z hlediska ekonomického dopadu při řešení komplikací píštěle (cena antibiotik, zevní lumbální drenáž atd.). Grothenius doporučuje suturu vždy pojistit aplikací umělé náhrady a minimalizovat riziko likvorey, a tím i celkové ekonomické následky plynoucí z řešení durální píštěle a případných komplikací [1]. Zkrácení doby pobytu na intermediární jednotce intenzivní péče aplikací Tachosilu® (Baxter Czech, Praha, ČR) jako pojistky sutury tvrdé pleny prokázali Hutter et al [28].
Tab. 3. Přehled prací týkajících se rekonstrukcí durálních defektů s incidencí komplikací a technikou ošetření. 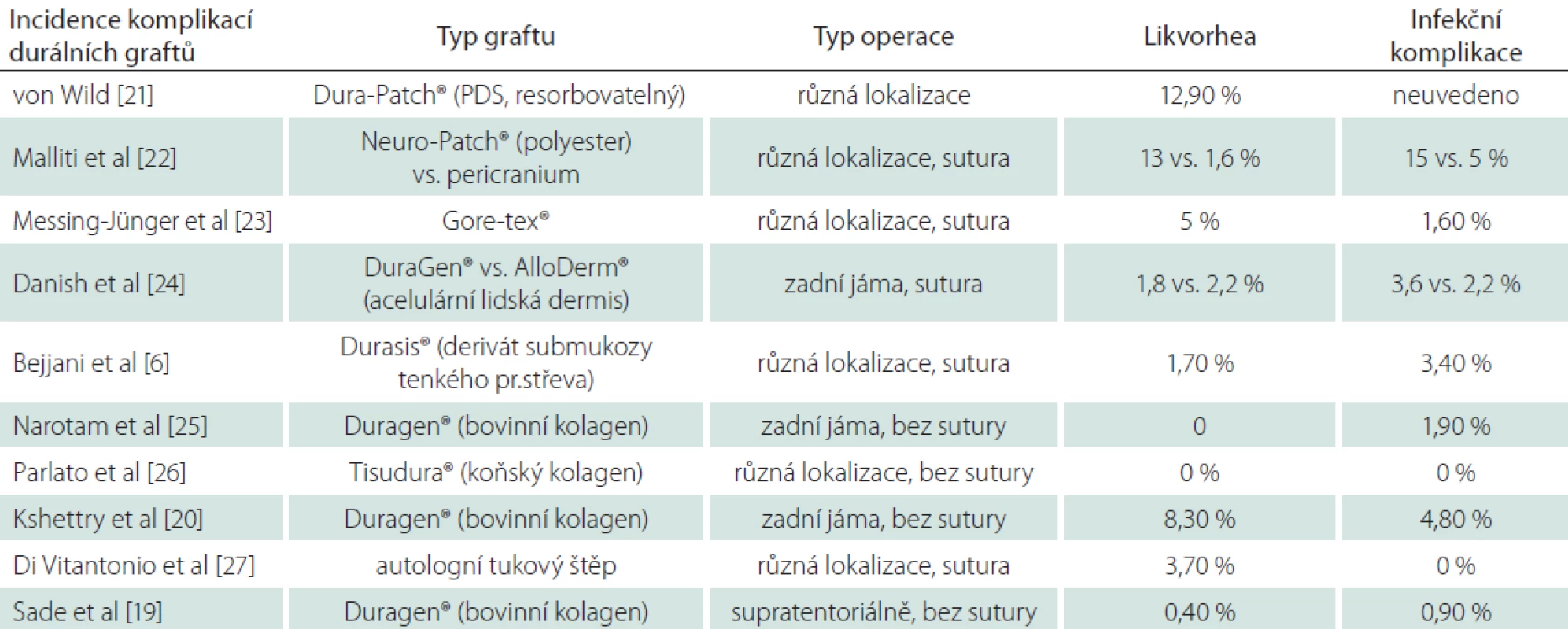
Výhody autologního štěpu jsou široce známy. Jsou to dobrá hojící tendence a žádná infekční či imunitní rizika. Nevýhodou je jistě časový faktor, může narůstat krevní ztráta či vznikat atrofie nebo chronické bolesti v místě odběru. Jistou renezanci zaživá tukový štěp jako vhodný kandidát k duroplastice. Poprvé jej užil Harvey Cushing v roce 1912 k ošetření potraumatického defektu. Rozsáhlý soubor pacientů se zaběhnutou metodikou překrytí defektu tukovým štěpem a výborným hojením v operativě meningiomů prezentovali Di Vitantonio et al [27].
Incidence zánětlivých komplikací byla v našem souboru nízká a je srovnatelná s výsledky již publikovaných prací, v nichž dosahuje četnosti 0–15 % (tab. 3). Nejčastější komplikací bývají meningitida a zánět operační rány. Největší komplikace hojení udávali Malliti et al ve skupině syntetických materialů (Neuropatch® [B. Braun Medical, Praha, ČR] 15 %), které porovnávali s perikraniálním lalokem (5 %). Za příčinu komplikací považují arteficiální charakter náhrady, a tím její větší náchylnost k bakteriální infekci [22]. Nulovou incidenci komplikací (infekce i únik likvoru) udávají Parlato et al v souboru 74 pacientů operovaných pro rozličné diagnózy vč. spinálních operací prostou aplikací náhrady Tissudura (Baxter Czech, Praha, ČR) (zdrojem koňský kolagen) s pojištěním tkáňovým lepidlem. Tyto výsledky je jistě nutno brát s určitou rezervou [26].
Závěr
Při rekonstrukci tvrdé pleny je naší snahou vždy primární sutura a případně užití tělu vlastního fasciového štěpu. V případě nutnosti durální náhrady se jeví preparát Biodesign® jako vhodný alternativní kandidát k rekonstrukci tam, kde chceme dosáhnout vodotěsné sutury.
Přijato k recenzi: 21. 6. 2018
Přijato do tisku: 7. 11. 2018
MUDr. Zdeněk Večeřa
Neurochirurgická klinika LF OU a FN Ostrava
17. listopadu 1790
708 52 Ostrava
Zdroje
1. Grotenhuis JA. Costs of postoperative cerebrospinal fluid leakage: 1-year, retrospective analysis of 412 consecutive nontrauma cases. Surg Neurol 2005; 64(6): 490–493. doi: 10.1016/ j.surneu.2005.03.041.
2. Cobb MA, Badylak SF, Janas W et al. Histology after dural grafting with small intestinal submucosa. Surg Neurol 1996; 46(4): 389–394.
3. Cobb MA, Badylak SF, Janas W et al. Porcine small intestinal submucosa as a dural substitute. Surg Neurol 1999; 51(1): 99–104.
4. Dejardin LM, Arnoczky SP, Clarke RB. Use of small intestinal submucosal implants for regeneration of large fascial defects: an experimental study in dogs. J Biomed Mater Res 1999; 46(2): 203–211.
5. Welch JA, Montgomery RD, Lenz SD et al. Evaluation of small-intestinal submucosa implants for repair of meniscal defects in dogs. Am J Vet Res 2002; 63(3): 427–431.
6. Bejjani GK, Zabramski J, Durasis Study Group. Safety and efficacy of the porcine small intestinal submucosa dural substitute: results of a prospective multicenter study and literature review. J Neurosurg 2007; 106(6): 1028–1033. doi: 10.3171/ jns.2007.106.6.1028.
7. Badylak S, Kokini K, Tullius B et al. Morphologic study of small intestinal submucosa as a body wall repair device. J Surg Res 2002; 103(2): 190–202.
8. Abbe R. Rubber tissue for meningeal adhesions. Trans Am Surg Assoc 1895; 13 : 490–491.
9. Filippi R, Schwarz M, Voth D et al. Bovine pericardium for duraplasty: clinical results in 32 patients. Neurosurg Rev 2001; 24 : 103–107.
10. Parizek J, Mericka P, Husck Z et al. Detailed evaluation of 2959 allogeneic and xenogeneic dense connective tissue grafts (fascia lata, pericardium and dura mater) used in the course of 20 years for duroplasty in neurosurgery. Acta Neurochir (Wien) 1997; 139(9): 827–838.
11. Sharkey PC, Usher FC, Robertson RC. Lyophilized human dura mater as a dural substitute. J Neurosurg 1958; 15(2): 192–198. doi: 10.3171/ jns.1958.15.2.0192.
12. Preusser M, Ströbel T, Gelpi E et al. Alzheimer-type in a 28 year old patient with iatrogenic Creutzfeldt-Jakob disease after dural grafting. J Neurol Neurosurg Psychiatry 2006; 77(3): 413–416. doi: 10.1136/ jnnp.2005.070805.
13. Brooke FJ, Boyd A, Klug GM et al. Lyodura use and the risk of iatrogenic Creutzfeldt-Jakob disease in Australia. Med J Aust 2004; 180(4): 177–181.
14. Warren WL, Medary MB, Dureza CD et al. Dural repair using acellular human dermis : experience with 200 cases : technique assessment. Neurosurgery 2000; 46(6): 1391–1396.
15. Turchan A, Rochman TF, Ibrahim A et al. Duraplasty using amniotic membrane versus temporal muscle fascia: a clinical comparative study. J Clin Neurosci 2018; 50 : 272–276. doi: 10.1016/ j.jocn.2018.01.069.
16. Azzam D, Prasanth R, Thien N et al. Dural repair in cranial surgery is associated with moderate rates of complications with both autologous and nonautologous dural substitutes. World Neurosurg 2018; 113 : 244–248. doi: 10.1016/ j.wneu.2018.01.115.
17. Vieira E, Guimarães TC, Faquini IV et al. Randomized controlled study comparing 2 surgical techniques for decompressive craniectomy: with watertight duraplasty and without watertight duraplasty. J Neurosurg 2018; 129(4): 1017–1023. doi: 10.3171/ 2017.4.JNS152954.
18. Barth M, Tuettenberg J, Thomé C et al. Watertight dural closure: is it necessary? A prospective randomized trial in patients with supratentorial craniotomies. Neurosurgery 2008; 63(4 Suppl 2): 352–358. doi: 10.1227/ 01.NEU.0000310696.52302.99.
19. Sade B, Oya S, Lee JH. Non-watertight dural reconstruction in meningioma surgery: results in 439 consecutive patients and a review of the literature. Clinical article. J Neurosurg 2011; 114(3): 714–718. doi: 10.3171/ 2010.7.JNS10460.
20. Kshettry VR, Lobo B, Lim J et al. Evaluation of non-watertight dural reconstruction with collagen matrix onlay graft in posterior fossa surgery. J Korean Neurosurg Soc 2016; 59(1): 52–57. doi: 10.3340/ jkns.2016.59.1.52.
21. von Wild KR. Examination of the safety and efficacy of an absorbable dura mater substitute (Dura Patch) in normal applications in neurosurgery. Surg Neurol 1999; 52(4): 418–424.
22. Mailliti M, Page P, Gury C et al. Comparison of deep wound infection rates using a synthethic dural substitute(neuro-patch) or pericranium graft for dural closure: a clini-cal review of 1 year. Neurosurgery 2004; 54(3): 559–603.
23. Messing-Jünger AM, Ibáñez J, Calbucci F et al. Effectiveness and handling characteristics of a three-layer polymer dura substitute: a prospective multicenter clinical study. J Neurosurg 2006; 105(6): 853–858. doi: 10.3171/ jns.2006.105.6.853.
24. Danish SF, Samdani A, Hanna A et al. Experience with acellular human dura and bovine collagen matrix for duraplasty after posterior fossa decompression for Chiari malformations. J Neurosurg 2006; 104 (1 Suppl): 16–20. doi: 10.3171/ ped.2006.104.1.16.
25. Narotam PK, Qiao F, Nathoo N. Collagen matrix duraplasty for posterior fossa surgery: evaluation of surgical technique in 52 adult patients. Clinical article. J Neurosurg 2009; 111(2): 380–386. doi: 10.3171/ 2008.10.JNS08993.
26. Parlato C, di Nuzzo G, Luongo M et al. Use of a collagen biomatrix (TissuDura) for dura repair: a long-term neuroradiological and neuropathological evaluation. Acta Neurochir 2011; 153(1): 142–147. doi: 10.1007/ s00701-010-0718-2.
27. Di Vitantonio H, De Paulis D, Del Maestro M et al. Dural repair using autologous fat: our experience and review of the literature. Surg Neurol Int 2016; 7 (Suppl 16): S463–S468. doi: 10.4103/ 2152-7806.185777.
28. Hutter G, Felten Sv, Sailer MH et al. Risk factors for postoperative CSF leakage after elective craniotomy and the efficacy of fleece-bound tissue sealing against dural suturing alone: a randomised controlled trial. J Neurosurg 2014; 121(3): 735–744. doi: 10.3171/ 2014.6.JNS131917.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Pacient s rozsiahlymi skorými zmenami (ASPECTS < 5) – rekanalizácia Komentár ku kontroverziámČlánek Efektivita jednostranné kochleární implantace u dospělých pacientů s těžkou poruchou sluchuČlánek Abstrakta přednášek, které odezněly na XI. neuromuskulárním kongresu Brno, 10.–11. května 2018Článek Analýza dat v neurologiiČlánek Recenze knih
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2018 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Diagnostika, symptomatika a nálezy u onemocnění a poruch autonomního nervového systému v neurologii
- Pacient s rozsáhlými časnými změnami (ASPECTS < 5) – rekanalizace - ANO
- Pacient s rozsáhlými časnými změnami (ASPECTS < 5) – rekanalizace - NE
-
Pacient s rozsiahlymi skorými zmenami (ASPECTS < 5) – rekanalizácia
Komentár ku kontroverziám - Těhotenství a roztroušená skleróza z pohledu neurologa
- Kvalita života osob pečujících o pacienty s progresivním neurologickým onemocněním
- Nově vzniklý refrakterní status epilepticus a syndromy z blízkého spektra (NORSE/ FIRES)
- Efektivita jednostranné kochleární implantace u dospělých pacientů s těžkou poruchou sluchu
- Klinické výsledky krčnej diskektómie a fúzie ukotvenou klietkou – prospektívna štúdia so sledovaním 24 mesiacov
- Srovnání miniinvazivní perkutánní a klasické otevřené stabilizační operace u zlomenin Th-L páteře – retrospektivní analýza
- Rekonstrukce durálních defektů xenogenním implantátem
- Fingolimod zmírňuje harmalinem navozenou poruchu paměti spojenou s pasivním vyhýbáním a motorické poruchy u potkaního modelu esenciálního tremoru
- Fingolimod zmírňuje harmalinem navozenou poruchu paměti spojenou s pasivním vyhýbáním a motorické poruchy u potkaního modelu esenciálního tremoru - komentář k článku
- Vyhodnocení systolických a diastolických srdečních funkcí a variability srdeční frekvence u pacientů s juvenilní myoklonickou epilepsií
- Rekonstrukce přední jámy lební volným svalovým lalokem po iatrogenním poškození
- Bulharská rodina s epileptickými záchvaty jako prvním projevem familiárních cerebrálních kavernózních malformací
- Meningokoková meningitida s Chiariho malformací (typ I)
- Solitární cerebelární metastáza uterinního cervikálního karcinomu
- Abstrakta přednášek, které odezněly na XI. neuromuskulárním kongresu Brno, 10.–11. května 2018
- Analýza dat v neurologii
- Komentář k článku autorů Voháňka et al Anestezie a nervosvalová onemocnění Cesk Slov Neurol N 2018; 81/114(4): 501–514.
- Recenze knih
- Prof. MUDr. Ivan Rektor, CSc., FCMA, FANA, FEAN slaví významné životní jubileum
- Prof. MU Dr. Martin Bareš, Ph.D., padesátiletý
- Výroční kongres České neurochirurgické společnosti
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diagnostika, symptomatika a nálezy u onemocnění a poruch autonomního nervového systému v neurologii
- Nově vzniklý refrakterní status epilepticus a syndromy z blízkého spektra (NORSE/ FIRES)
- Klinické výsledky krčnej diskektómie a fúzie ukotvenou klietkou – prospektívna štúdia so sledovaním 24 mesiacov
- Těhotenství a roztroušená skleróza z pohledu neurologa
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



