-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Retrospektivní autoevaluace výsledků operací intrinsických mozkových nádorů – konsekutivní kohorta 270 operací v rámci jednoho neurochirurgického centra NOS ČOS (Neuroonkologické sekce České onkologické společnosti) z let 2015–2017
Retrospective autoevaluation of the results of intrinsic brain tumor surgeries – consecutive cohort of 270 surgeries within one neurosurgical center of the NOS ČOS (Neurooncological section of the Czech Oncology Society) from 2015–2017
Aim: Retrospective evaluation of a consecutive cohort of adult intrinsic brain tumor patients operated in Ústí nad Labem (Czech Republic) from 2015 to 2017 focusing on the assessment of postoperative morbidity.
Patients and Methods: Basic evaluated variables included neurological morbidity, subgaleal cerebrospinal fluid collection or duration of hospitalization. In the subgroup of patients with high-grade gliomas, the parameters of the organization of subsequent oncological care, such as the waiting time until the start of radiotherapy were evaluated, together with overall survival estimations.
Results: A total of 270 surgeries were performed (average age 60 years, 59% men). Newly diagnosed glioblastomas (GBM) represented 37.4% of the surgeries, while metastases were 32.6% of the total. Severe neurological morbidity was observed in 18 patients (6.7%). Subgaleal cerebrospinal fluid collection was diagnosed in 13% of patients. The average length of hospitalization was 6.6 days. About 30% of patients underwent complete oncological treatment. The median waiting time for radiotherapy was 46 days after surgery (no effect on overall survival). The median overall survival of patients with GBM was 8.8 months (95% CI 2.2–13.4). Significantly longer overall survival was observed in patients who were able to undergo treatment according to the Stupp regimen (22.6 vs. 4.3 months, P < 0.001), those after resection vs. biopsy (12.4 vs. 4 months, P < 0.001) and younger patients ≤ 60 years (19.4 vs. 5.1 months, P < 0.001).
Conclusion: We observed overall low postoperative morbidity in our cohort of neurooncology patients. Self-evaluation of results is an integral part of complex neurosurgical care.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
内在性脑肿瘤手术结果的回顾性自动评估 – 2015年至2017年,在NOSČOS(捷克肿瘤学会神经病学分会)的一个神经外科中心内连续进行270例手术
目的:回顾性评估2015年至2017年在Ústí nad Labem(捷克共和国)进行的成年内在脑肿瘤患者的队列研究,重点是评估术后发病率。
患者和方法:评估的基本变量包括神经疾病发病率、枕下脑脊液收集或住院时间。在高级别胶质瘤患者的亚组中,评估了后续肿瘤护理的组织参数,如放疗开始前的等待时间,以及总体生存评估。
结果:总共进行了270例手术(平均年龄60岁,男性占59%)。新诊断的胶质母细胞瘤(GBM)占手术的37.4%,而转移灶占总数的32.6%。 18例患者(6.7%)出现严重的神经系统疾病。13%的患者被诊断为心下脑脊液收集。平均住院时间为6.6天。大约30%的病人接受了完全的肿瘤治疗。放疗的平均等待时间为术后46天(对总生存率无影响)。GBM患者的中位总生存期为8.8个月(95% CI 2.2-13.4)。能够按照Stupp方案进行治疗的患者的总生存期明显延长(22.6个月vs. 4.3个月,P < 0.001);手术切除与活检(12.4 vs. 4个月,P < 0.001)及≤60岁的年轻患者(19.4 vs. 5.1个月,P < 0.001)。
结论:我们在神经肿瘤患者队列中观察到总体的术后发病率较低。结果的自我评估是复杂的神经外科护理不可或缺的一部分。
关键词:神经肿瘤–脑肿瘤–放射治疗Keywords:
radiotherapy – neurooncology – brain tumor
Autoři: R. Bartoš 1,2; D. Ospalík 3; A. Malucelli 1; P. Vachata 1; M. Sameš 1; T. Kazda 4,5; D. Šmejkalová-Musilová 6; F. Třebický 7
Působiště autorů: Neurochirurgická klinika UJEP, a Masarykova nemocnice, KZ a. s., Ústí, nad Labem 1; Anatomický ústav, 1. LF UK, Praha 2; Neurologické oddělení, Masarykova, nemocnice, KZ a. s., Ústí nad Labem 3; Klinika radiační onkologie Masarykova, onkologického ústavu, Brno 4; Klinika radiační onkologie LF MU, Brno 5; Onkologické oddělení, Komplexní, onkologické centrum, Masarykova, nemocnice, KZ a. s., Ústí nad Labem 6; Ústav radiační onkologie, Nemocnice, na Bulovce, Praha 7
Vyšlo v časopise: Cesk Slov Neurol N 2019; 82(4): 401-409
Kategorie: Původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn2019401Souhrn
Cíl: Retrospektivní hodnocení neselektované kohorty dospělých pacientů s intrinsickými mozkovými nádory operovaných v Ústí nad Labem v letech 2015–2017 se zaměřením na hodnocení pooperační morbidity.
Soubor a metodika: Mezi základní hodnocené proměnné patřily neurologická morbidita, vytvoření likvorového depa nebo délka hospitalizace. V podskupině pacientů s vysokostupňovými gliomy byly dále také hodnoceny parametry organizace další onkologické terapie, jako je čekací doba do zahájení radioterapie, a dále parametry celkového přežití.
Výsledky: Celkem bylo provedeno 270 operací (průměrný věk 60 let, 59 % mužů). Operace nově diagnostikovaných glioblastomů (GBM) představovaly 37,4 %, metastáz 32,6 %. Těžká neurologická morbidita byla u 18 pacientů (6,7 %). Likvorové depo bylo diagnostikováno u 13 % pacientů. Průměrná délka hospitalizace byla 6,6 dne. Plnou onkologickou léčbu absolvovalo 30 % pacientů. Medián do zahájení radioterapie byl 46 dnů po operaci (bez vlivu na přežití). Medián celkového přežití pacientů s GBM byl 8,8 měsíců (95% CI 2,2–13,4). Signifikantně delší celkové přežití měli pacienti schopní podstoupit léčení Stuppovým režimem (22,6 vs. 4,3 měsíce, p < 0,001), po resekci vs. biopsii (12,4 vs. 4 měsíce, p < 0,001) a pacienti ≤ 60 let (19,4 vs. 5,1 měsíce, p < 0,001).
Závěr: V našem souboru neuroonkologických pacientů jsme pozorovali celkově nízkou pooperační morbiditu. Autoevaluace vlastních výsledků je nedílnou součástí komplexní neurochirurgické péče.
Klíčová slova:
radioterapie – neuroonkologie – mozkový nádor
Úvod
Operační výkon je důležitou součástí komplexní multidisciplinární léčby primárních i sekundárních mozkových nádorů. Přestože jsou tyto nádory, v porovnání s ostatními onkologickými diagnózami, považovány za vzácná onemocnění, představují svou lokalizací v CNS závažný zdravotní problém s vysokou morbiditou a mortalitou. U primárních mozkových nádorů je neurochirurgický výkon důležitý nejen k získání biologického materiálu pro přesné určení histopatologického nálezu, vč. popisu molekulárně-biologických charakteristik zohledněných v aktuální integrované diagnostice dle klasifikace Světové zdravotnické organizace z roku 2016 [1]. Samotná operace je také důležitou cytoredukční léčbou s prokázaným vlivem na celkové přežití, minimálně u pacientů s nejčastějšími primárními gliomy – gliomy vyššího stupně malignity (high grade gliom; HGG) [2–4]. Cílem neurochirurgické léčby HGG je také dosažení maximální možné resekce při zachování kvality života [5], resp. bez nového iatrogenního pooperačního neurologického deficitu. V případě mozkových metastáz je operace zvažována především u pacientů s limitovaným extrakraniálním onemocněním a se symptomatickou objemnou mozkovou metastázou doprovázenou kolaterálním edémem, kde nelze očekávat výraznější efekt samotné paliativní radioterapie. V současné době na významu nabývá také molekulárně-biologické hodnocení prediktivních markerů pro indikaci následné cílené biologické léčby nebo jiné formy moderní onkologické systémové terapie, kdy je popisována výrazná genetická diverzifikace při srovnání molekulárního profilu původního primárního tumoru a metastatického
onemocnění [6].S výjimkou benigních mozkových nádorů tak představuje neurochirurgie pouze první, zato nejdůležitější část komplexní onkologické léčby. Důležitým aspektem kvalitní neurochirurgické péče je tedy také zajistit a umožnit následnou terapii onkologickou, sestávající v případě nejčastějších HGG z kombinace adjuvantní radioterapie a chemoterapie temozolomidem s cílem ovlivnění mikroskopické choroby, resp. případného makroskopického rezidua.
Základním předpokladem další optimalizace neurochirurgické léčby v rámci denní klinické praxe je autoevaluace vlastních pacientů se zaměřením nejen na radikalitu a toxicitu samotného neurochirurgického výkonu, ale také se zaměřením na zajištění zmiňované následné komplexní onkologické léčby [7–9]. Vyhodnocení vlastních léčebných výsledků je rovněž důležité pro zpětnou vazbu při hraničních indikacích [10]. Cílem této práce bylo retrospektivní hodnocení neselektované kohorty dospělých pacientů operovaných pro intrinsické nádory na Neurochirugické klinice v Ústí nad Labem (NKUnL) v letech 2015–2017 se zaměřením na výše uvedené parametry kvality poskytované zdravotní péče. Mezi hlavní otázky, definované také v rámci doporučených autoevaluačních procesů Neuroonkologické sekce České onkologické společnosti, patří:
- Jaké jsou pooperační komplikace celkové, neurologické a lokální?
- Jaká část našich pacientů jde po operaci přímo domů a kolik dní tito pacienti stráví v nemocnici? Jaká část pacientů potřebuje další hospitalizaci na jiném pracovišti?
- Kolik a kteří pacienti s vysokostupňovým gliomem jsou následně onkologicky léčeni a absolvují předepsanou terapii? Za jak dlouho jim je léčba zajištěna?
- Kolik pacientů je následně graficky a klinicky dispenzarizováno neurochirurgem 3 měsíce po operaci?
Zařazení metastáz a následné vyhodnocení rizika operačního výkonu je důležité ke komplexní představě o portfoliu operačních výkonů v rámci autoevaluace operační léčby konsekutivní série pacientů. Základní metodika operování u gliomu a metastázy je podobná (identická rizika kraniotomie, riziko krvácení do dutiny, riziko komplikace likvorovým depem). Bližší charakteristika pacientů s mozkovými metastázami vč. vyhodnocení léčebných výsledků nebo srovnání s radioterapií již není předmětem tohoto sdělení.
Pacienti a metody
Soubor pacientů
Hodnocena byla konsekutivní kohorta všech onkologických pacientů operovaných na NKUnL v období od 1. 1. 2015 do 31. 12. 2017. Vylučujícím kritériem byly intrinsické nádory u dětí a mladistvých do 18 let. Do analýzy nebyli zařazeni pacienti, u kterých bylo nakonec na základě definitivního histopatologického vyšetření přes nejednoznačný předoperační nález na MR diagnostikováno nenádorové onemocnění.
Hodnocené parametry kvality neurochirurgické péče
Neurologická pooperační iatrogenní morbidita (fatická porucha, hemiparéza, hemiplegie, vegetativní stav, dysfagie, změny zorného pole) byla dělena na lehkou (umožňující pacientovi soběstačnou péči o sebe a neomezující jej příliš v běžných aktivitách) a těžkou, kdy došlo k těžké mutilaci neurologických funkcí a pacient byl po operaci nesoběstačný. Z pooperačních komplikací byly krom standardních ranných komplikací zvlášť hodnoceny také vytvoření likvorového podkožního depa a management jeho řešení. Tyto komplikace mají vliv na dobu hospitalizace pacienta po náročné operaci. Byly sledovány délka hospitalizace a další směrování pacienta (dimise domů vs. překlad na jiné pracoviště; arbitrárně považujeme za optimální dobu propuštění pacienta do 10. dne po operaci včetně, jedná se o běžný termín extrakce stehů nebo svorek z operační jizvy).
Pacienti s gliomy vyššího stupně malignity
U pacientů s HGG byly dále hodnoceny parametry organizace a zajištění další onkologické terapie, jako dokončení plné onkologické terapie (tzv. Stuppův protokol sestávající z normofrakcionované radioterapie v dávce 30 × 2,0 Gy s konkomitantní chemoterapií temozolomidem v denní dávce 75 mg/ m2 v den D1–49, následované 28denními cykly samotné adjuvantní chemoterapie temozolomidem v dávce 150–200 mg/ m2 ve dnech D1–5 [11,12]) bylo definováno absolvování alespoň čtyř cyklů adjuvantní chemoterapie po kompletní chemoradioterapii. V této podskupině pacientů s glioblastomem (GBM) a anaplastickým astrocytomem byly hodnoceny také parametry celkového přežití, počet pacientů, kteří zahájí adjuvantní zevní radioterapii, počet pacientů, kteří ji v plánované dávce dokončí, počet pacientů, kteří zahájí následnou adjuvantní chemoterapii a kteří dokončí alespoň čtyři cykly.
Statistické zpracování
Základní deskriptivní statistiky (počty a procenta pro kategoriální data a medián a rozsah pro spojitá data) byly použity pro základní popis souboru pacientů. Celkové přežití (počítané od data operace do doby úmrtí, resp. do data poslední kontroly u cenzorovaných pacientů) u pacientů s GBM bylo hodnoceno dle Kaplan-Meierova odhadu přežití (log rank test – srovnání celkového přežití dle základních prognostických faktorů, jako jsou věk v době diagnózy, typ operačního výkonu, absolvovaná léčba a doba do jejího zahájení).
Výsledky
Základní charakteristika pacientů
Ve sledovaném období 3 let bylo provedeno celkem 270 operací intrinsických mozkových nádorů. Průměrný věk pacientů byl 60 let (rozmezí 24–82 let), 160 mužů (59 %). Největší zastoupení mělo 101 operací nově diagnostikovaného GBM (37,4 %), dále 88 operací mozkových metastáz (32,6 %) a 38 operací recidiv GBM (14,1 %). Ostatní operované diagnózy jsou shrnuty v obr. 1. Celkový počet operací pro vysokostupňový gliom (vč. anaplastických astrocytomů a reoperací) byl 155 (57,4 %). Resekčních operací bylo 243 (90 %), v ostatních případech se jednalo o bioptické výkony (jehlové, nebo otevřené).
Obr. 1. Přehled operovaných nádorů dle histopatologické diagnózy. AA – anaplastický astrocytom; GBM – multiformní glioblastom; LGG – nízkostupňový gliom; meta – metastáza; myelom – myelom kosti s prorůstáním intraparenchymově; recAA – recidiva anaplastického astrocytomu; recGBM – recidiva multiformního glioblastomu
Fig. 1. Survey of the operated tumors according to the histopatological diagnosis. AA – anaplastic astrocytoma; GBM – glioblastoma multiforme; LGG – low grade glioma; meta – metastasis; myelom – myeloma of the skull growing intraparenchymally; recAA – recurrence of anaplastic astrocytoma; recGBM – recurrence of glioblastoma multiforme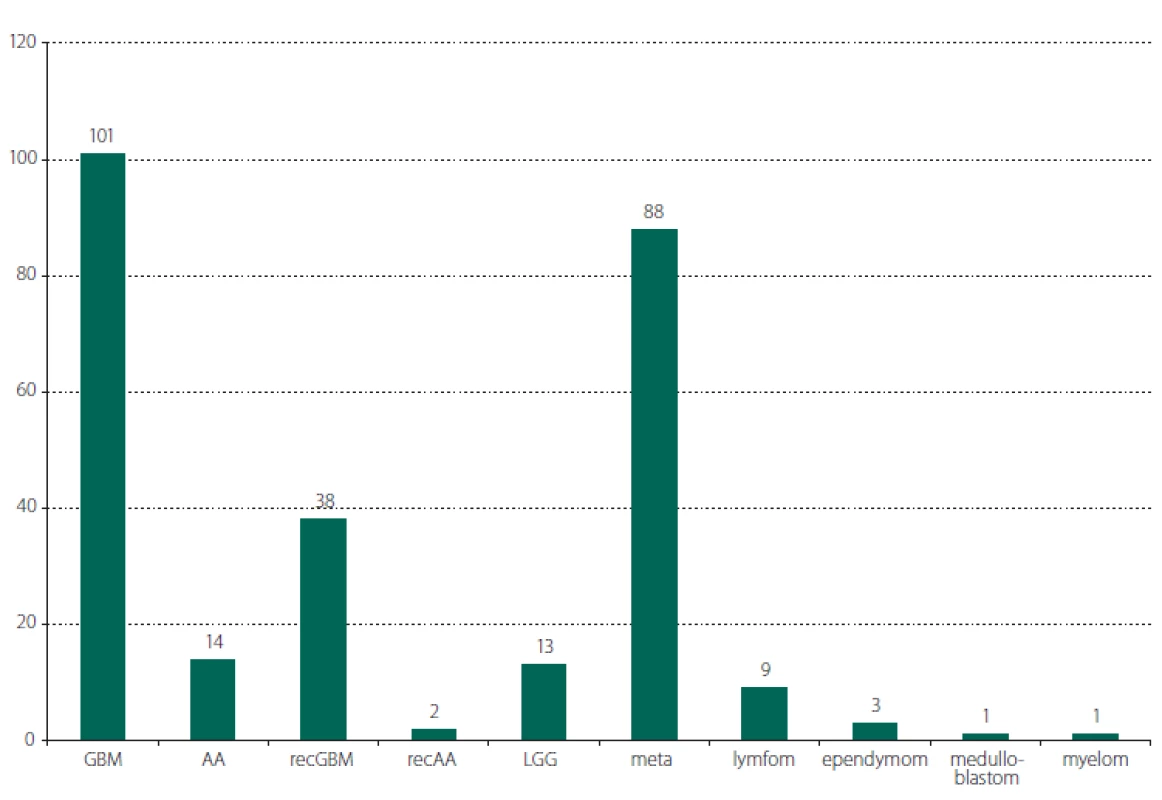
Nežádoucí účinky neurochirurgických výkonů
Přehled neurologické morbidity za jednotlivé roky je shrnut v obr. 2. Celkem 230 operací (85,2 %) proběhlo nekomplikovaně a neurologický stav pacienta byl po operaci stejný nebo zlepšen. Některé typy neurologických poruch, předevších fatická porucha (celkem 14 pacientů) a hemiparéza (celkem 10 pacientů), se vyskytovaly po některých operacích v kombinaci. Těžká neurologická morbidita byla pozorována u 18 pacientů (6,7 %). Do této skupiny patří všech 7 pacientů ve vegetativním stavu (7/ 270; 2,6 %; 7/ 18; 39 %), tento stav nastal z důvodu operaci komplikujícího hydrocefalu, edému či krvácení a tento deficit je nadřazen jinému, event. současnému neurotopickému deficitu. Dále se jedná o 3 po operaci hemiplegické pacienty, 4 pacienty s těžkou hemiparézou a 3 s těžkou pooperační fatickou poruchou. Poslední je pacientka s GBM a pooperační hemianopsií podmíněnou ischemií arteria cerebri posterior, nikoli resekcí nádoru v kalkarinní oblasti. Po operacích nízkostupňových gliomů (LGG) jsme nezaznamenali trvalý neurologický deficit, byť u jedné pacientky přetrvával těžký syndrom suplementární motorické oblasti (fatická porucha, hemiparéza) po dobu jednoho měsíce po operaci a u další pacientky po resekci LGG v oblasti limbického systému byla popsána výrazná krátkodobá změna psychického ladění.
Obr. 2. Přehled neurologického obrazu a neurologických komplikací po výkonech v jednotlivých letech a souhrnu. fatika – fatická porucha; stejný-zlepšen – stejný nebo zlepšený stav; vegetativní – vegetativní stav; vstupně špatný – vstupně špatný neurologický stav; zorné pole – zhoršení zorného pole
Fig. 2. Overview of the neurological state and neurological complications after the surgeries during individual years and in the total set of patients. fatika – speech dysfunction; stejný-zlepšen – the same or improved state; vegetativní – vegetative state; vstupně špatný – initially bad neurological state; zorné pole – worsening of the visual field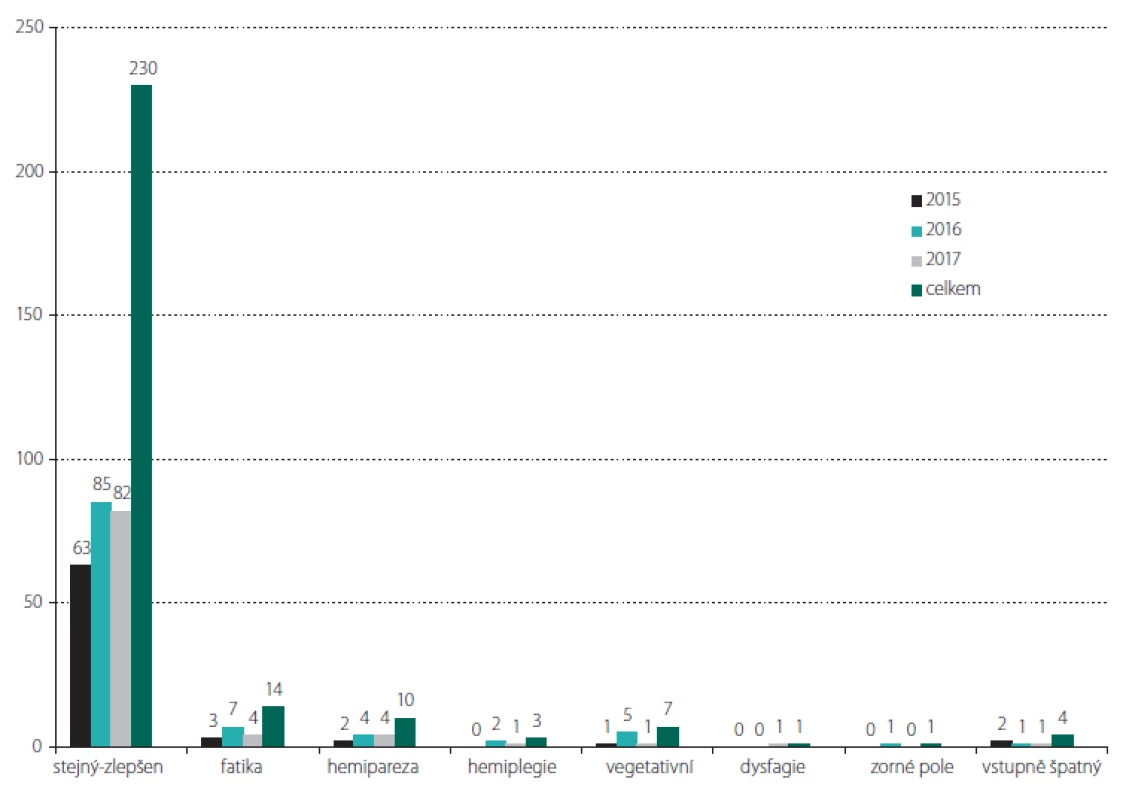
Likvorové depo bylo diagnostikováno a léčeno celkem po 35 operacích (13 %), v 7 případech (20 %) s nutností revize, v 8 případech (23 %) bylo řešeno přechodným zavedením lumbální drenáže, v 10 případech (29 %) kompresí a punkcemi a po stejném počtu operací pouhou kompresí. Infekční komplikace jsme řešili po 19 operacích (7 %), v 11 případech s nutností revize operačního pole (58 %) pro osteomyelitidu kostní ploténky nebo absces.
Tři pacienti (1 %) během hospitalizace v naší nemocnici časně po operaci zemřeli, 140 pacientů (52 %) odešlo po operaci přímo domů či do péče rodinného příslušníka (91 % pacientů bylo propuštěno mezi 2.–10. dnem, průměrně za 6,6 dne (obr. 3). Ostatní pak byli přeloženi k následné hospitalizaci na jiné oddělení. Maximální doba hospitalizace na našem pracovišti byla 26 dní po operaci, a to u pacienta po resekci recidivy GBM s nutností řešení pooperační epilepsie a likvorového depa.
Obr. 3. Doba pobytu na neurochirurgickém oddělení (hospitalizační dny po operaci) u pacientů propuštěných přímo domů (n = 140).
Fig. 3. Length of stay at the neurosurgical ward (in-patient days after the surgery) in patients discharged directly home (N = 140).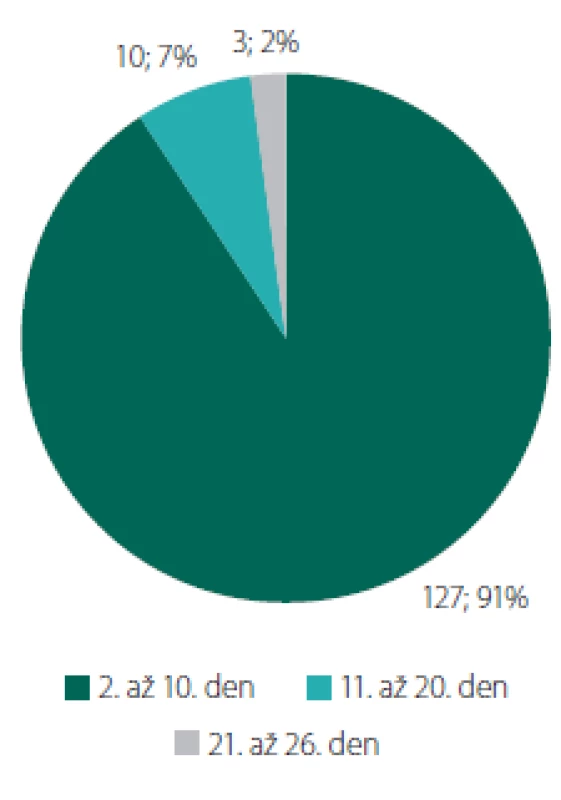
Následná léčba u pacientů s gliomy vyššího stupně malignity
Primooperaci vysokostupňového gliomu podstoupilo celkem 115 pacientů (43 %), z toho 101 pacientů s GBM (88 %). Celkem 68 % pacientů s HGG zahájilo adjuvantní zevní radioterapii, 88 % z nich ji dokončilo v plánované dávce. Celkem 40 % pacientů po operaci HGG pak zahájilo následnou adjuvantní chemoterapii a 76 % z nich absolvovalo alespoň čtyři cykly. Celkem tedy plnou onkologickou terapii podstoupilo 30 % pacientů s nově diagnostikovaným HGG. V podskupině 18 pacientů, kteří byli indikováni pouze k biopsii, která verifikovala diagnózu HGG (19 biopsií; 1× opakovaně pro nevýtěžnost), dokončilo adjuvantní zevní radioterapii 5 pacientů (28 %) a žádný z nich nedokončil čtyři cykly následné chemoterapie. Obr. 4 znázorňuje tato data v rozdělení na jednotlivé roky stanovení diagnózy. Medián doby do zahájení radioterapie byl 46 dní po operaci (IQR 36–54 dní; rozmezí 23–84 dní – u pacientky, která prodělala závažnou operační komplikaci s hemiplegií). U pacientů po resekci se jednalo o medián 47 dní (IQR 37–53 dní) a u pacientů po biopsii o medián 37 dní (IQR 33–57 dní). V podskupně pacientů léčených Stuppovým režimem byl medián doby do zahájení radioterapie 45 dní (IQR 37–51 dní).
Obr. 4. Procentuální rozložení pacientů s primodiagnózou vysokostupňového gliomu, kteří v jednotlivých letech 2015, 2016 a 2017 započali, resp. dokončili adjuvantní radioterapii a též započali, resp. dokončili čtyři cykly adjuvantní chemoterapie. 2015 (36 pacientů) – 25/19/14/9 pacientů; 2016 (36 pacientů) – 26/24/16/12 pacientů; 2017 (43 pacientů) – 28/26/16/14 pacientů Fig. 4. Proportion of patients with a primary diagnosis of high grade glioma who in particular years 2015, 2016 and 2017 started, and finished recpectively adjuvant radiotherapy and also started, and completed respectively four cycles of adjuvant chemotherapy. 2015 (36 patients) – 25/19/14/9 patients; 2016 (36 patients) – 26/24/16/12 patients; 2017 (43 patients) – 28/26/16/14 patients 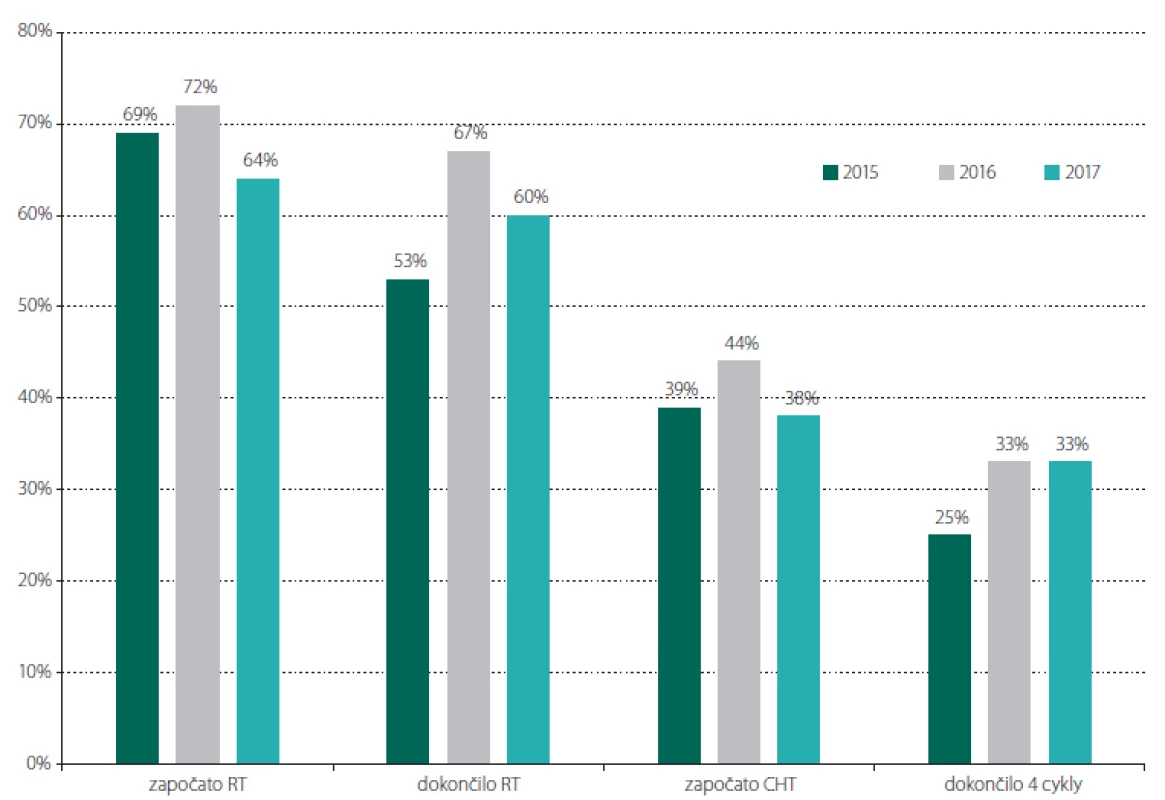
Při mediánu sledování 22 měsíců byl medián celkového přežití (median overall
survival; mOS) souboru pacientů s GBM 8,8 měsíce (95% CI 2,2–13,4 měsíce). Odhad jednoletého celkového přežití u pacientů s GBM byl 44 %, dvouletého celkového přežití 16 %. Pacienti schopní léčby Stuppovým režimem měli signifikantně delší celkové přežití než pacienti, kteří tuto léčbu neabsolvovali (mOS 22,6 vs. 4,3 měsíce, p < 0,001). Signifikantní rozdíl byl také při srovnání celkového přežití dle rozsahu operace (mOS 12,4 měsíce po resekci vs. 4 měsíce po biopsii, p < 0,001). Mladší pacienti (≤ 60 let) měli signifikantně delší celkové přežití (mOS 19,4 vs. 5,1 měsíce, p < 0,001). Čas do zahájení radioterapie neměl v našem souboru vliv na celkové přežití. V podskupině pacientů léčených dle Stuppova režimu (medián doby do zahájení radioterapie 45 dnů) bylo celkové přežití srovnatelné u pacientů s delší dobou do zahájení (> 45 dnů; mOS 22,6 měsíců, 95% CI 16,9–28,3) a u pacientů s kratší dobou
(≤ 45 dnů; mOS 23,4 měsíců, 95% CI 11,1–35,7; p = 0,37). Kaplan-Meierovy křivky odhadu přežití těchto analýz pacientů s GBM jsou prezentovány v obr. 5.Obr. 5. Kaplan-Meierovy odhady celkového přežití při rozdělení pacientů s glioblastomem: (A) dle absolvované onkologické léčby, s podskupinou pacientů léčených dle Stuppova režimu; (B) dle doby do zahájení radioterapie po operaci; (C) dle rozsahu operace a (D) dle věku v době diagnózy.
Fig. 5. Kaplan-Meier estimates of the overall survival after distribution of the patients with glioblastoma according to: (A) the completed oncological treatment with a subgroup of patients treated according to the Stupp protocol; (B) the period of initiation of radiotherapy after surgery; (C) extent of the resection; (D) age at diagnosis.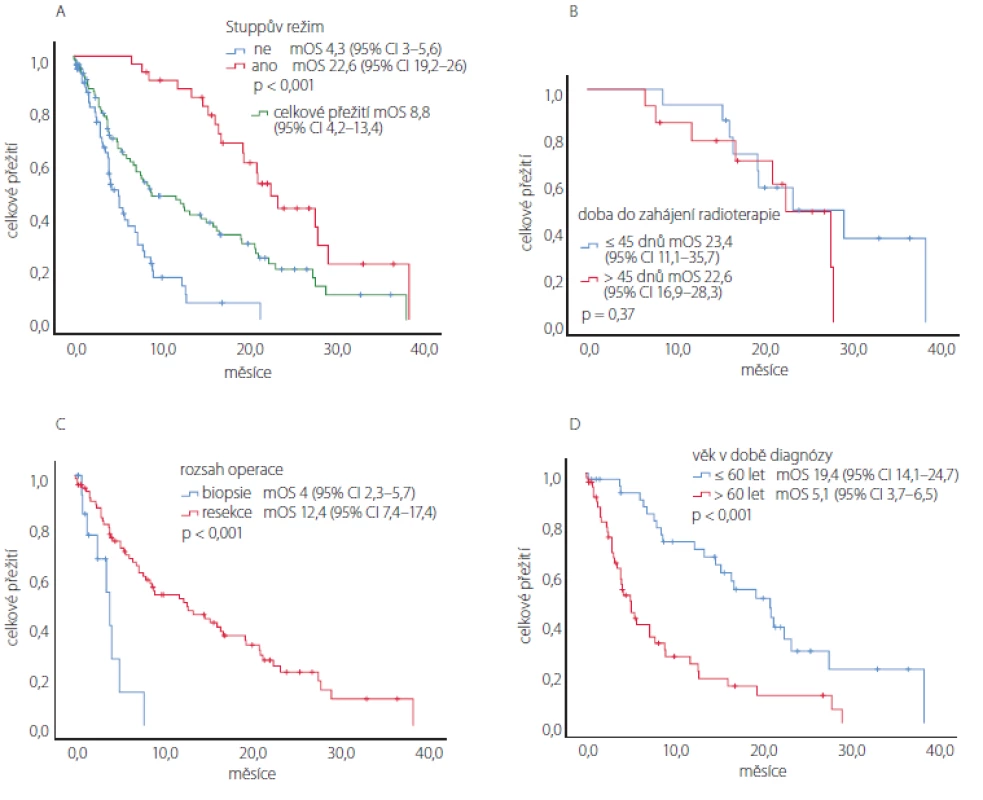
Po všech operacích pro HGG (155 pacientů vč. operacích recidiv) byl pacient klinicky a graficky sledován na neurochirurgické ambulanci v 63 % případů, v ostatních případech se již pacient po operaci ke kontrole nikdy nedostavil.
Diskuze
V této retrospektivní analýze konsekutivní série 270 operací intrinsických mozkových nádorů operovaných na jednom pracovišti jsme pozorovali těžkou pooperační morbiditu pouze u 6,7 % pacientů a mortalitu 1 %, což jsou údaje srovnatelné s analýzami jiných velkých souborů pacientů [13–15]. Ani v jediném případě se nejednalo o pacienta operovaného pro LGG. Zvláště v této skupině pacientů s relativně dobrou prognózou je nutné klást důraz na bezpečnost prováděného operačního výkonu s cílem minimalizace rizika neurologického deficitu po operaci. Prezentovaná analýza hodnocení vlastních výsledků se zaměřením na nežádoucí účinky neurochirurgického výkonu poskytuje cennou zpětnou vazbu a umožňuje identifikaci event. systematických nedostatků v komplexní neurochirurgické léčbě nejen u onkologických pacientů. Za důležitou součást tohoto komplexního přístupu považujeme také nutnost organizačního zajištění následné onkologické terapie u nově diagnostikovaných pacientů s GBM, kteří tvoří zdaleka nejpočetnější skupinu operovaných pacientů (51,5 % ze všech operací v našem souboru). Rovněž v případě operací mozkových metastáz je nutná brzká reference na radioterapeutické pracoviště vzhledem k nově etablované cílené stereotaktické radioterapii na oblast poresekčního lůžka, která je v současné době po metastazektomii preferována v porovnání s celomozkovým ozářením [16,17].
Průměrnou dobu 46 dní do zahájení po-
operační radioterapie nově diagnostikovaných GBM nelze v této prezentované autoevaluaci považovat za optimální a identifikace této doby představuje konkrétní příklad významu rigorózních systematických autoevaluačních procesů na každém pracovišti. K zajištění a udržení benefitu dobře provedeného operačního výkonu je tak nutné na našem pracovišti optimalizovat referování pacientů k následné léčbě onkologické. Možností může být také využití současných video-telekonferenčních technologií, resp. rozvíjející se oblasti telemedicíny již úspěšně testované v pediatrické neuroonkologii [18,19]. Nicméně otázka optimální doby do zahájení pooperační radioterapie GBM je dále kontroverzní, neboť v odborné literatuře nalézáme protichůdná doporučení. Ani v našem souboru pacientů léčených dle Stuppova režimu nebyl rozdíl v celkovém přežití při dichotomickém rozdělení pacientů dle mediánové hodnoty doby do zahájení radioterapie (45 dní) – mOS 22,6 vs. 23,4 měsíců. Např. Do et al na retrospektivní studii 182 pacientů s GBM ukázali, že riziko úmrtí se zvyšovalo během každého dne čekání na onkologickou léčbu o 2 % [20]. Novozélanďané Irwin et al shodně u 172 pacientů popisují 8,9% riziko úmrtí zvyšující se každým týdnem zpoždění radioterapie [21]. Nicméně je nutné vzít v potaz bias daná postponováním radioterapie u pacientů s pooperačními komplikacemi či u těch ve špatném stavu, což mohlo způsobit horší léčebné výsledky v této podskupině pacientů s pooperačními komplikacemi vedoucími k oddálení startu adjuvantní onkologické léčby. Na druhou stranu jiné práce, např. Blumethalova analýza 2 855 pacientů s GBM [22], neprokázaly horší dobu přežití, pokud byla radioterapie zahájena za 6 týdnů po histologické verifikaci nádoru. Naopak nejkratší interval (< 2 týdny) oproti nejdelšímu (> 4 týdny) vykazoval zhoršení výsledků, což může být vysvětleno např. tím, že přetrvávající hypoxie v edému může zmenšovat radiosenzitivitu nádorových buněk, nebo tím, že dochází k suboptimálnímu zacílení ozařovaného objemu tkáně při nedostatečně kolabované postresekční dutině (případně při následných posunech mozkové tkáně při resorbci, event. pooperačního pneumocefalu) [22]. Horší léčebné výsledky při brzkém zahájení radioterapie mohly být také dány selekčním bias pacientů po pouhé biopsii (tedy v prognosticky špatné skupině), kdy je obecná snaha ozářit tyto pacienty co nejdříve, tzv. přednostně. V naší podskupině 18 pacientů po biopsii GBM byl medián doby do zahájení radioterapie 37 dní, což je méně než medián 47 dní u pacientů po resekčním výkonu (malý počet pacientů s biopsií znemožňuje validní statistické vyjádření signifikance tohoto rozdílu). Soubor zahrnující standardní terapii temozolomidem publikovali Sun et al [23] v retrospektivní studii celkové skupiny 218 pacientů s GBM, u které prodleva až více než 42 dní byla negativním faktorem pro celkové přežití pacienta. Celkem 42 dní je obvykle také maximální možná doba zahájení adjuvantní terapie v prospektivních klinických hodnoceních nových léčiv u GBM. Zmiňovaná bias redukovali ve své retrospektivní multicentrické studii Louvel et al [24], kde byli všichni analyzovaní pacienti (léčení v letech 2005–2011) po radikální nebo parciální resekci a podstoupili plnou onkologickou léčbu dle Stuppova protokolu [12]. Medián celkového přežití byl 19,7 měsíce při mediánu přežití bez progrese 10,3 měsíce. Medián doby do zahájení konkomitantní chemoradioterapie 1,5 měsíce (75% kvartil dokonce 2,2 měsíce) nebyl významný v univariantní ani multivariantní analýze faktorů ovlivňujících parametry přežití. Tento výsledek byl potvrzen i v obou skupinách pacientů léčených/ neléčených lokálními carmustinovými tabletami, tak i v obou skupinách rozdílné radikality výkonu.Nicméně v případě vysokostupňových gliomů se jednoznačně jedná o biologicky výrazně agresivní onemocnění a adjuvantní léčba by neměla být zbytečně oddalována. V pooperační péči tak nelze opomíjet ani lokální problém ve formě likvorového podkožního depa, které může rekonvalescenci prodloužit i zkomplikovat, pokud si vynutí revizi či dojde k sekundárnímu infikování depa či vznikne meningitida cestou lumbální drenáže. I při nekomplikovaném průběhu je vznik depa pro pacienta nepříjemný nebo může prodloužit dobu hospitalizace. Dle analýzy národní americké databáze však nemusí být délka hospitalizace nutně parametrem poukazujícím na kvalitu daného pracoviště. Dasenbrock et al [13] provedli analýzu 11 510 pacientů, u nichž byla střední doba hospitalizace 4 dny (rozsah středního kvartálu 3–8 dní) a z nichž 27,7 % (3 185 pacientů) bylo hospitalizováno déle než 8 dní. Ovšem nezávislými faktory, které predikovaly prodlouženou dobu hospitaliazce, byly věk > 70 let, příslušnost k afroamerickému a hispánskému etniku, hodnota skóre American Society of Anesthesiologists > a = 3, částečná nebo úplná funkční závislost, inzulin-dependentní diabetes mellitus, hematologické komorbidity (např. předoperační antikoagulační léčba) a předoperační hypoalbuminemie. Tyto tzv. péčí neovlivnitelné faktory představovaly 22% variabilitu doby hospitalizace, zatímco pooperační komplikace (např. plicní embolizace, pneumonie a infekce močového traktu) se na této podílely pouze 7 %. Tento závěr nekoreluje s předchozími analýzami kardiochirurgických a jiných oborů, kde výrazné prodloužení doby hospitalizace přicházelo na vrub pooperačním komplikacím [25–27]. Ve své práci Dasenbrock et al [13] dokonce navrhují předoperační 10stupňové skórování pravděpodobnosti prodloužené hospitalizace po operativě mozkových nádorů, a to zejména vzhledem k tlaku na minimalizaci doby pobytu v nemocnici ze strany poskytovatelů a plátců zdravotní péče v USA. Retrospektivní skórování našich pacientů dle této škály bude předmětem plánované sekundární analýzy, vč. univariační a multivariační analýzy faktorů ovlivňujících délku hospitalizace, resp. četnost pooperačních komplikací s možností modifikace 10stupňového skorování se zohledněním lokálních podmínek v ČR.
Mortalita souboru v naší nemocnici činila 1 %, což je prakticky identické s dalším hodnocením stejného autora [28], které posuzuje znovupřijetí pacienta k rehospitalizaci v rámci pooperačních komplikací v souboru 9 656 pacientů po operaci mozkového nádoru. Slabinou naší práce danou absencí centrálního registru je nemožnost hodnocení event. 30denní mortality po překladu pacienta, která dle práce citovaného autora může být relativně vysoká – dosahovala 69,7 % (n = 223) oproti mortalitě během iniciální hospitalizace: 30,3 % (n = 97), tzn. 1 % stejně jako v našem souboru. Každopádně opakovaný příjem pacienta na primární pracoviště, stejně jako v případě doby hospitalizace, byl dán spíše vstupními charakteristikami pacientů a není v této publikaci doporučen jako hodnotící kritérium posuzování kvality péče.
Práce Bergerovy skupiny [14] opírající se o velký soubor 62 514 pacientů operovaných s maligním gliomem během 10 let v USA (2000–2009) si klade za cíl hodnotit výsledky operací ve vztahu k „zatížení“ (case-load) dané nemocnice či neurochirurga. Mortalita ve stejné nemocnici, kde proběhla operace, dosahuje v průměru 2,6 %, po biopsii 1,9 %, po resekci 5 %. Přímo domů je po operaci směrováno 74,5 % pacientů, celková míra komplikací je 19,8 %, neurologických 14,9 %. V porovnání s naším souborem je také naprosto odlišné proporcionální zastoupení typů jednotlivých výkonů; jehlová biopsie 56,2 %, otevřená biopsie, event. parciální resekce 23,6 %, resekce 12,5 %, lobektomie 7,7 %. Práce nehodnotí ani nekomentuje z našeho pohledu velice vysokou frekvenci jehlových biopsií, dle našich dat je šance pacienta na dokončení radioterapie po biopsii HGG výrazně nižší než po resekčním výkonu (v našem souboru 60 vs. 28 %). Ve srovnání s těmito daty stojí za vyzdvihnutí dosavadní úroveň péče o neuroonkologické pacienty v ČR. Rovněž celkové přežití v naší kohortě pacientů léčených Stuppovým režimem je srovnatelné s literárními údaji. Nejaktuálnější data pro srovnání jsou léčebné výsledky kontrolního ramene studie EF-14, publikované v prosinci 2017 (studie fáze III hodnotící efekt léčby nově diagnostikovaných GBM pomocí systému Optune [Novocure, St. Helier, Jersey , Velká Británie]) [29]. Medián celkového přežití pacientů z kontrolního ramene (Stuppův režim bez Optune) byl 19,7 měsíců od stanovení diagnózy [29], což je rozmezí 95% CI odhadu mediánu celkového přežití našich pacientů léčených Stuppovým režimem (95% CI 19,2–26,0 měsíce). Medián celkového přežití v našem souboru (22,6 měsíce) je dokonce nad 95% CI ze zmiňované aktuální studie EF-14 (95% CI kontrolního ramene 17,7–22,1 měsíce [29]), do které byli dokonce randomizováni pouze pacienti bez brzké progrese po ukončení chemoradioterapie, kteří jsou ale zahrnuti do našeho neselektovaného souboru pacientů.
Závěr
Autoevaluace vlastních výsledků je nedílnou součástí komplexní neurochirurgické péče. V našem souboru jsme pozorovali celkově nízkou pooperační morbiditu srovnatelnou s literálními údaji. Léčebné výsledky HGG jsou srovnatelné s aktuálními reporty celkového přežití GBM. Potvrdili jsme známé pozitivní prognostické faktory přežití pacientů s GBM, jako jsou léčba Stuppovým režimem (medián celkového přežití 22,6 měsíce), rozsah operace nebo věk v době diagnózy. Doba do zahájení radioterapie po operaci GBM neměla v našem souboru vliv na celkové přežítí. Poukazujeme na dobrou úroveň domácí neuroonkologie, která však nesmí klesat z důvodů osobního, společenského a ekonomického profitu jednotlivých poskytovatelů zdravotní péče. Tato dosavadní úroveň je dle našeho názoru z velké části dána entuziazmem a snahou poskytnout maximum péče danému pacientovi lékařem neuroonkologického týmu. Aby nedocházelo k tříštění této péče, odkládání a nesystematičnosti onkologické léčby, je dle našeho názoru nutná těsná lokální provázanost všech složek daného centra v rámci daného regionu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Robert Bartoš, Ph.D.
Neurochirurgická klinika UJEP a Masarykova nemocnice, KZ a.s.
Sociální péče 3316/12A
400 11 Ústí nad Labem
e-mail: robert.bartos@kzcr.eu
Přijato k recenzi: 6. 3. 2019
Přijato do tisku: 3. 6. 2019
Zdroje
1. Louis DN, Perry A, Reifenberger G et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 2016; 131(6): 803–820. doi: 10.1007/ s00401-016-1545-1.
2. Chaichana KL, Jusue-Torres I, Navarro-Ramirez R et al. Establishing percent resection and residual volume thresholds affecting survival and recurrence for patients with newly diagnosed intracranial glioblastoma. Neuro Oncol 2014; 16(1): 113–122. doi: 10.1093/ neuonc/ not137.
3. Grabowski MM, Recinos PF, Nowacki AS et al. Residual tumor volume versus extent of resection: predictors of survival after surgery for glioblastoma. J Neurosurg 2014; 121(5): 1115–1123. doi: 10.3171/ 2014.7.JNS132449.
4. Lacroix M, Abi-Said D, Fourney DR et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. J Neurosurg 2001; 95(2): 190–198.
5. McGirt MJ, Mukherjee D, Chaichana KL et al. Association of surgically acquired motor and language deficits on overall survival after resection of glioblastoma multiforme. Neurosurgery 2009; 65(3): 463–470. doi: 10.1227/ 01.NEU.0000349763.42238.E9.
6. Berghoff AS, Brastianos PK. Toward precision medicine in brain metastases. Semin Neurol 2018; 38(1): 95–103. doi: 10.1055/ s-0038-1627469.
7. Bartoš R, Třebický F, Malucelli A et. al. Volumetrické vyhodnocení efektu následné onkologické léčby (radioterapie a chemoterapie) při inoperabilní progresi či významném reziduu nízkostupňového gliomu. Cesk Slov Neurol N 2014; 77/ 110(2): 216–222.
8. Brock S, Saleh C, Zekaj E et al. How to compare clinical results of different neurosurgical centers? Is a classification of complications in neurosurgery necessary for this purpose? Surg Neurol Int 2016; 7 (Suppl 20): S565–S569. doi: 10.4103/ 2152-7806.188471.
9. Broggi M, Zattra C, Ferroli P. How to compare outcomes and complications in neurosurgery: We must make the mission possible! Surg Neurol Int 2018; 9 : 65. doi: 10.4103/ sni.sni_424_17.
10. Bartoš R, Němcová V, Radovnický T et al. Gliomy limbického a paralimbického systému, technika a výsledky resekcí. Cesk Slov Neurol N 2016; 79/ 112(2): 131–147. doi: 10.14735/ amcsnn2016131.
11. Stupp R, Hegi ME, Mason WP et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 2009; 10(5): 459–466. doi: 10.1016/ S1470-2045(09)70025-7.
12. Stupp R, Mason WP, van den Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352(10): 987–996. doi: 10.1056/ NEJMoa043330.
13. Dasenbrock HH, Liu KX, Devine CA et al. Length of hospital stay after craniotomy for tumor: a National Surgical Quality Improvement Program analysis Dasenbrock. Neurosurg Focus 2015; 39(6): E12. doi: 10.3171/ 2015.10.FOCUS15386.
14. Trinh VT, Davies JM, Berger MS. Surgery for primary supratentorial brain tumors in the United States, 2000–2009: effect of provider and hospital caseload on complication rates. J Neurosurg 2015; 122(2): 280–296. doi: 10.3171/ 2014.9.JNS131648.
15. Senders JT, Muskens IS, Cote DJ et al. Thirty-day outcomes after craniotomy for primary malignant brain tumors: a National Surgical Quality Improvement Program analysis. Neurosurgery 2018; 83(6): 1249–1259. doi: 10.1093/ neuros/ nyy001.
16. Mahajan A, Ahmed S, McAleer MF et al. Post-operative stereotactic radiosurgery versus observation for completely resected brain metastases: a single-centre, randomised, controlled, phase 3 trial. Lancet Oncol 2017; 18(8): 1040–1048. doi: 10.1016/ S1470-2045(17)30414-X.
17. Brown PD, Ballman KV, Cerhan JH et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/ CEC•3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncol 2017; 18(8): 1049–1060. doi: 10.1016/ S1470-2045(17)30441-2.
18. Amayiri N, Swaidan M, Abuirmeileh N et al. Video-teleconferencing in pediatric neuro-oncology: ten years of experience. J Glob Oncol 2018; 4 : 1–7. doi: 10.1200/ JGO.2016.008276.
19. Qaddoumi I, Mansour A, Musharbash A et al. Impact of telemedicine on pediatric neuro-oncology in a developing country: the Jordanian-Canadian experience. Pediatr Blood Cancer 2007; 48(1): 39–43. doi: 10.1002/ pbc.21085.
20. Do V, Gebski V, Barton MB. The effect of waiting for radiotherapy for grade III/ IV gliomas. Radiother Oncol 2000; 57(2): 131–136.
21. Irwin C, Hunn M, Purdie G et al. Delay in radiotherapy shortens survival in patients with high grade glioma. J Neurooncol 2007; 85(3): 339–343. doi: 10.1007/ s11060-007-9426-z.
22. Blumenthal DT, Won M, Mehta MP et al. Short delay in initiation of radiotherapy may not affect outcome of patients with glioblastoma: a secondary analysis from the radiation therapy oncology group database. J Clin Oncol 2009; 27(5): 733–739. doi: 10.1200/ JCO.2008.18.9035.
23. Sun MZ, Oh T, Ivan ME et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. J Neurosurg 2015; 122(5): 1144–1150. doi: 10.3171/ 2014.9.JNS14193.
24. Louvel G, Metellus P, Noel G et al. Delaying standard combined chemoradiotherapy after surgical resection does not impact survival in newly diagnosed glioblastoma patients. Radiother Oncol 2016; 118(1): 9–15. doi: 10.1016/ j.radonc.2016.01.001.
25. Hannan EL, Racz MJ, Walford G et al. Predictors of readmission for complications of coronary artery bypass graft surgery. JAMA 2003; 290(6): 773–780. doi: 10.1001/ jama.290.6.773.
26. Hannan EL, Zhong Y, Lahey SJ et al. 30-day readmissions after coronary artery bypass graft surgery in New York state. JACC Cardiovasc Interv 2011; 4(5): 569–576. doi: 10.1016/ j.jcin.2011.01.010.
27. Hendren S, Morris AM, Zhang W et al. Early discharge and hospital readmission after colectomy for cancer. Dis Colon Rectum 2011; 54(11): 1362–1367. doi: 10.1097/ DCR.0b013e31822b72d3.
28. Dasenbrock HH, Yan SC, Smith TR et al. Readmission after craniotomy for tumor: a national surgical quality improvement program analysis. Neurosurgery 2017; 80(4): 551–562. doi: 10.1093/ neuros/
nyw062.29. Stupp R, Taillibert S, Kanner A et al. Treating fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: a randomized clinical trial. JAMA 2017; 318(23): 2306–2316. doi: 10.1001/ jama.2017.
18718.Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2019 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Editorial
- Intrakraniálna stenóza – najlepšiu konzervatívnu liečbu je vhodné kombinovať so stentom - ÁNO
- Intrakraniální stenóza – nejlepší konzervativní léčbu je vhodné kombinovat se stentem - NE
- Intrakraniálna stenóza – najlepšiu konzervatívnu liečbu je vhodné kombinovať so stentom
- Multisystémová atrofie
- Spektrum MR nálezů progresivní multifokální leukoencefalopatie u kohorty pacientů s roztroušenou sklerózou v ČR
- Stanovení míry shody mezi záchranáři a neurology při identifi kaci těžké hemiparézy u pacientů s akutní cévní mozkovou příhodou
- Vyšetření čichu před operací nosní polypózy a po ní
- Retrospektivní autoevaluace výsledků operací intrinsických mozkových nádorů – konsekutivní kohorta 270 operací v rámci jednoho neurochirurgického centra NOS ČOS (Neuroonkologické sekce České onkologické společnosti) z let 2015–2017
- Spina bifida v České republice – incidence a prenatální diagnostika
- Čichová dysfunkce u české skupiny pacientů s idiopatickou poruchou chování v REM spánku
- Dvě původní české zkoušky k vyšetření paměti za tři minuty – Amnesia Light and Brief Assessment (ALBA)
- Liečba ťažkej spasticity intratekálnym podávaním baklofénu – 15-ročné skúsenosti
- Profil behaviorálních projevů u idiopatické poruchy chování v REM spánku
- Vliv subkutánně podávaného interferonu β-1a na aktivitu onemocnění u pacientů s klinicky izolovaným syndromem – observační studie ATRACT
- Je nutné při operační léčbě chronického subdurálního hematomu trepanací a drenáží provádět i výplach hematomu?
- Hypersomnia pri akútnej bitalamickej ischémii
- Postižení sluchu po spinální anestezii
- Objemná pneumokéla frontálního sinu s rozsáhlým intrakraniálním šířením imitujícím dysfunkci lumboperitoneální drenáže u predisponovaného pacienta s Marfanovým syndromem
- Dehiscence horního polokruhovitého kanálku
- Analýza dat v neurologii LXXVI. Korelační analýza vícerozměrných souborů kvantitativních a kvalitativních dat – představení vybraných ukazatelů
- Komentář k článku autorů Zítek et al Anterior choroidal artery aneurysm Cesk Slov Neurol N 2019; 82/ 115(3): 350–351
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Multisystémová atrofie
- Dehiscence horního polokruhovitého kanálku
- Spina bifida v České republice – incidence a prenatální diagnostika
- Postižení sluchu po spinální anestezii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



