-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv subkutánně podávaného interferonu β-1a na aktivitu onemocnění u pacientů s klinicky izolovaným syndromem – observační studie ATRACT
Effect of subcutaneously administered interferon β-1a on disease activity in patients with clinically isolated syndrome – ATRACT observational study
Background: Several clinical studies have shown that early treatment of clinically isolated syndrome (CIS), can improve the course and prognosis of the disease.
Patients and methods: ATRACT was an observational, non-interventional, prospective, non-comparative, non-randomized, single-arm, open-label, multicentre phase IV study, which primary aim was to investigate a relationship between clinical features of CIS and therapeutic response to 44 μg of subcutaneous interferon (IFN) β-1a administered three times a week. A total number of 250 subjects aged 18 - 65 years, diagnosed with CIS and treated with IFN β-1a, were enrolled in the study. Patients were followed up for 24 months from baseline and during visits scheduled 6, 12, 18 and 24 months after the baseline visit. Data on the disability level (evaluated by Expanded Disability Status Scale [EDSS]), and number and time of relapses were collected.
Results: The proportion of clinically stable subjects was 75.11% within the first year after the treatment initiation, and 59.11% at the end of the follow-up period. Throughout the 2 years, majority of subjects (85.45%) did not experience 3-month confirmed EDSS progression, and the proportion of relapse-free subjects was 62.67%. There was no significant difference in clinical activity between subgroups with mono - and polysymptomatic CIS.
Conclusion: IFN β-1a treatment led to a stabilization of clinical activity in most subjects with CIS within 2 years. The clinical stabilization had not been affected by the clinical nature of CIS and the initial MRI finding.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
皮下注射干扰素β-1a对临床孤立综合征患者疾病活动的影响 – ATRACT观察性研究
背景:多项临床研究表明,临床隔离综合征(CIS)的早期治疗可以改善疾病的病程和预后。
患者和方法:ATRACT是一项观察性,非干预性,前瞻性,非比较性,非随机性,单组,开放标签,多中心IV期研究,其主要目的是研究CIS与临床特征之间的关系。每周3次对44μg皮下干扰素(IFN)β-1a的治疗反应。该研究共纳入250名年龄在18-65岁之间的,被诊断为CIS并接受IFNβ-1a治疗的受试者。从基线开始对患者进行24个月的随访,并在基线随访后的6、12、18和24个月进行随访。收集有关残疾水平的数据(通过扩展的残疾状态量表[EDSS]进行评估)以及复发的次数和时间。
结果:临床稳定受试者的比例在治疗开始后的第一年为75.11%,在随访期结束时为59.11%。在整个2年中,大多数受试者(85.45%)没有经历3个月的EDSS确诊进展,无复发受试者的比例为62.67%。具有单症状和多症状CIS的亚组之间的临床活动无显著差异。
结论:IFNβ-1a治疗可导致大多数CIS患者在2年内临床活动稳定。 CIS的临床性质和最初的MRI发现并未影响临床稳定性。
关键词:多发性硬化症–临床孤立综合征–干扰素β-1a–治疗反应–疾病活动
Keywords:
Multiple sclerosis – clinically isolated syndrome – interferon β-1a – treatment response – disease activity
Autoři: E. Meluzínová 1; A. Tvaroh 2,3; M. Bludovská 4,5; J. Piťha 2; M. Vališ 6; J. Mareš 7; Y. Benešová 8; A. Martinková 9; M. Dufek 10; P. Hradílek 11; R. Ampapa 12; M. Grunermelová 13; T. Božovský 14; J. Adámková 15; D. Zimová 16
Působiště autorů: Neurologická klinika 2. LF UK a FN Motol, Praha 1; Neurologické oddělení, Nemocnice Teplice, o. z., Krajská zdravotní, a. s. 2; Merck spol. s r. o., Praha 3; Ústav farmakologie a toxikologie, LF UK v Plzni 4; Ústav hygieny a preventivní medicíny, LF UK v Plzni 5; Neurologická klinika LF UK a FN Hradec Králové 6; Neurologická klinika LF UP a FN Olomouc 7; Neurologická klinika LF MU a FN Brno 8; Neurologická klinika FZS UP a Pardubické krajské nemocnice, a. s. 9; I. neurologická klinika LF MU a FN u sv. Anny v Brně 10; Neurologická klinika LF OU a FN, Ostrava 11; Neurologické oddělení, Nemocnice Jihlava, a. s. 12; Neurologická klinika 3. LF UK a Thomayerovy nemocnice, Praha 13; Neurologická klinika LF UK a FN, Plzeň 14; Neurologické oddělení, Nemocnice České Budějovice, a. s. 15; Neurologická klinika 3. LF UK a FN Královské Vinohrady, Praha 16
Vyšlo v časopise: Cesk Slov Neurol N 2019; 82(4): 442-447
Kategorie: Původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn2019442Souhrn
Východiska: Řada klinických studií prokázala, že včasná léčba klinicky izolovaného syndromu (clinically isolated syndrome; CIS) může mít příznivý vliv na průběh a prognózu onemocnění.
Soubor a metody: ATRACT byla observační neintervenční prospektivní nekomparativní nerandomizovaná jednoramenná otevřená multicentrická studie fáze IV, jejímž primárním cílem bylo zhodnotit vztah mezi charakteristikou CIS a odpovědí na léčbu interferonem (IFN) β-1a podávaným v dávce 44 µg subkutánně 3× týdně. Do studie bylo zařazeno 250 osob ve věku 18 – 65 let s diagnostikovaným CIS, které byly léčeny IFN β-1a. Doba sledování činila 24 měsíců. Stav pacientů byl hodnocen při vstupu do studie a při kontrolách v 6., 12., 18. a 24. měsíci od vstupu do studie pomocí Expanded Disability Status Scale (EDSS). Aktivita onemocnění byla hodnocena počtem relapsů za rok (relapse rate).
Výsledky: Podíl klinicky stabilních osob dosahoval v průběhu prvního roku 75,11 % a po 2 letech 59,11 %. U 85,45 % osob nedošlo v průběhu 2 let k 3 měsíce trvající progresi skóre EDSS, podíl osob bez relapsu činil 62,67 %. Při hodnocení klinické aktivity onemocnění nebyl zjištěn významný rozdíl mezi podskupinami s mono - a polysymptomatickým CIS.
Závěr: Podávání IFN β-1a vedlo v průběhu 2 let u většiny osob s CIS ke stabilizaci onemocnění, která nebyla ovlivněna povahou CIS ani nálezem při vstupním vyšetření MR.
Klíčová slova:
roztroušená skleróza – klinicky izolovaný syndrom – interferon β-1a – odpověď na léčbu – aktivita onemocnění
Úvod
Roztroušená skleróza je považována za chronické autoimunitní onemocnění CNS, které vede k multifokální zánětlivé demyelinizaci a axonálnímu poškození neuronů. Předpokládá se, že etiologie zahrnuje několik faktorů, jakými jsou genetické pozadí, expozice environmentálním spouštěčům (např. virovým infekcím) a rozvoj imunitní odpovědi namířené proti nervovému systému. První příznak onemocnění je označován jako klinicky izolovaný syndrom (clinically isolated syndrome; CIS) nebo jako první klinická demyelinizační příhoda (first clinical demyelinating event; FCDE) [1].
Klinické projevy CIS a časné RS mají vliv na dlouhodobý průběh onemocnění a na jeho prognózu. V případě přirozeného průběhu onemocnění je dobrá prognóza spojena s optickou neuritidou (ON), izolovanými senzitivními symptomy, delším intervalem do prvního relapsu a normálním nebo malým nálezem na MR při vzniku onemocnění. Horší prognóza je naopak spojena s multifokálními projevy při nástupu onemocnění, vysokým počtem lézí na MR a zejména jejich infratentoriální lokalizací, krátkým intervalem do prvního relapsu, vysokou četností relapsů v prvních letech onemocnění a přítomností motorických, mozečkových a kmenových symptomů) [2 – 4].
V první linii léčby CIS a časné RS se používají interferon (IFN) β-1a, IFN β-1b, glatiramer acetát a teriflunomid [2,5 – 8]. Účinnost a bezpečnost IFN β-1a podávaného subkutánně (s. c.) v dávkování 44 µg 3× a 1× týdně ve srovnání s placebem byla prokázána u nemocných s CIS v randomizovaném klinickém hodnocení fáze III REFLEX. Primárním cílem této studie byl čas do rozvoje RS definované dle McDonaldových kritérií z roku 2005. Zařazováni byli pacienti s CIS multifokálním (46 %) i monofokálním (54 %). Podíl pacientů s konverzí do klinicky definitivní RS, tedy s relapsem onemocnění, v průběhu 2 let činil 20,6 % v rameni léčeném IFN β-1a
s. c. v dávce 44 µg 3× týdně, což představovalo snížení rizika přibližně na polovinu ve srovnání s placebem (poměr rizik [hazard ratio; HR] 0,48; p = 0,0004) [5].Popis studie
ATRACT byla observační neintervenční prospektivní nekomparativní nerandomizovaná jednoramenná otevřená multicentrická studie fáze IV, jejímž cílem bylo zhodnotit vztah mezi klinickou charakteristikou CIS, nálezem na MR a odpovědí na léčbu IFN β-1a. Doba sledování činila 24 měsíců. Studie probíhala v období mezi lety 2012 a 2017 a byli do ní zařazeni nemocní ve věku 18 – 65 let s diagnostikovaným CIS, kteří byli léčeni IFN β-1a (Rebif® [Merck KGaA, Darmstadt, Německo]) v dávce 44 µg s. c. 3× týdně) a splnili podmínky pro jeho podávání dle platných kritérií v ČR. Pacienti byli zařazeni do studie po podpisu informovaného souhlasu. Studie byla schválena etickými komisemi příslušných institucí a nahlášena Státnímu ústavu pro kontrolu léčiv – identifikační číslo 1212130002.
Ze studie byli vyloučeni nemocní s přecitlivělostí na přirozený či rekombinantní IFN β nebo jinou složku přípravku, těhotné a kojící ženy, osoby s depresí a/ nebo sebevražednými myšlenkami a s jakoukoli další kontraindikací pro podání přípravku dle souhrnu údajů o léčivém přípravku (summary of product characteristics; SPC) [6], a také pacienti, kteří se již účastnili jiné studie s IFN β-1a podávaným s. c.
Cíle a metodika studie
Průběh sledování a definice
Do studie byli zařazováni pacienti s prodělaným CIS, který se může prezentovat jako monofokální nebo multifokální. Při monofokálním CIS jde o jednotlivou demyelinizační příhodu charakterizovanou klinicky jasným neurologickým nálezem pouze v jednom z následujících funkčních systémů: pyramidovém, mozečkovém, kmenovém, senzitivním či zrakovém. Při multifokálním CIS jde o jednu demyelinizační příhodu s neurologickým nálezem v alespoň dvou z výše uvedených funkčních systémů. V obou případech CIS mohou být zároveň přítomny příznaky postižení močového měchýře či střeva (sfinkterové poruchy) a/ nebo mentálních funkcí (vč. deprese, únavy nebo poruchy kognice).
Stav pacientů zařazených do studie byl hodnocen a potřebná data byla získávána při vstupu do studie, kdy byla zahájena léčba IFN β-1a, a při kontrolách v 6., 12., 18. a 24. měsíci od vstupu do studie, s povolenou odchylkou termínu kontroly ± 4 týdny.
Postižení bylo hodnoceno pomocí škály Expanded Disability Status Scale (EDSS) – rozšířená stupnice stavu postižení, tzv. Kurtzkeho škála.
Aktivita onemocnění byla hodnocena podle četnosti relapsů během jednoho roku („relapse rate“). Relaps byl definován jako zvýšení skóre o 2 stupně v jednom či více funkčních systémech nebo zvýšení o 1 stupeň ve dvou či více funkčních systémech mimo poruch sfinkterů nebo kognice, při absenci horečky. Doba trvání tohoto zhoršení musí být ≥ 24 h a musí mu zároveň předcházet období minimálně 30 dní trvající klinické stability nebo zlepšení.
Trvalá progrese postižení je definována jako zvýšení skóre EDSS minimálně o 1 bod proti vstupní hodnotě potvrzené o 3 měsíce později při dodatečné kontrole, která byla v případě zjištění progrese doplněna. Osobou bez klinicky aktivního onemocnění (clinically disease activity-free; cDAF) je pacient bez přítomnosti jak relapsu, tak i trvalé progrese postižení od začátku léčby do poslední kontroly. Tento kompozitní cílový ukazatel vypovídá o klinické stabilizaci onemocnění („clinically disease-free patient“) a používá se při analýzách výsledků randomizovaných klinických hodnocení [10].
Primární cíl
Primárním cílem studie bylo zjistit vztah mezi klinickou charakteristikou CIS (tj. s mono - či multifokální symptomatologií) a léčebnou odpovědí na podávání IFN β-1a. Jako primární byl hodnocen složený cíl cDAF, kdy byl sledován čas do prvního relapsu nebo do 3 měsíce trvající progrese EDSS nejméně o 1 bod (cokoli nastane dříve). Čas do prvního relapsu a čas do progrese EDSS byly hodnoceny také samostatně.
Sekundární cíle
Sekundárními cíli bylo zjistit prognostickou hodnotu doby od nástupu CIS do zahájení léčby pro následnou terapeutickou odpověď, vyhodnotit vztah mezi terapeutickou odpovědí a dominantním symptomem CIS (jedním z následujících: pyramidovým, mozečkovým, kmenovým, senzitivním, zrakovým), vyhodnotit vztah mezi terapeutickou odpovědí a výchozím nálezem při MR vyšetření (tj. přítomností infratentoriální nebo míšní T2 či Gd+ léze) a prozkoumat vztah mezi terapeutickou odpovědí a adherencí
k léčbě.Statistická analýza
Všechny statistické testy byly exploratorní. Hladina významnosti byla stanovena na 0,05 (alfa = 5 %). Rozdíly mezi podskupinami dle vstupních charakteristik byly analyzovány parametrickým ANOVA testem
(t-test) pro proměnné s očekávanou normální distribucí a neparametrickými ANOVA testy (Kruskalův-Wallisův test, Wilcoxonův dvouvýběrový test, mediánový test) pro proměnné s nenormálním rozložením dat. Pro kategorické ordinální proměnné byl použit chí-kvadrát test.Doba do události (do relapsu a potvrzené progrese EDSS) byla hodnocena pomocí Kaplanovy-Meierovy analýzy přežití. Rozdíly mezi typem CIS byly testované pomocí log-rank testu. HR a 95 % interval spolehlivosti (confidence interval; CI) byly vypočteny pomocí Coxova regresního modelu rizik (polysymptomatický CIS byl definován jako riziko) a testovány log-rank testem. Byl použit statistický software SAS (SAS Institute Inc., Cary, NC, USA).
Výsledky
Sledovaní pacienti a vstupní charakteristika podskupin
Sběr dat byl zahájen u 250 osob ve 13 centrech v ČR. Dispozice pacientů v celé studijní populaci a jednotlivých podskupinách v průběhu studie je detailně uvedena v tab. 1 – 3.
Tab. 1. Počet a podíl pacientů s cDAF v celkové populaci v jednotlivých kontrolách. 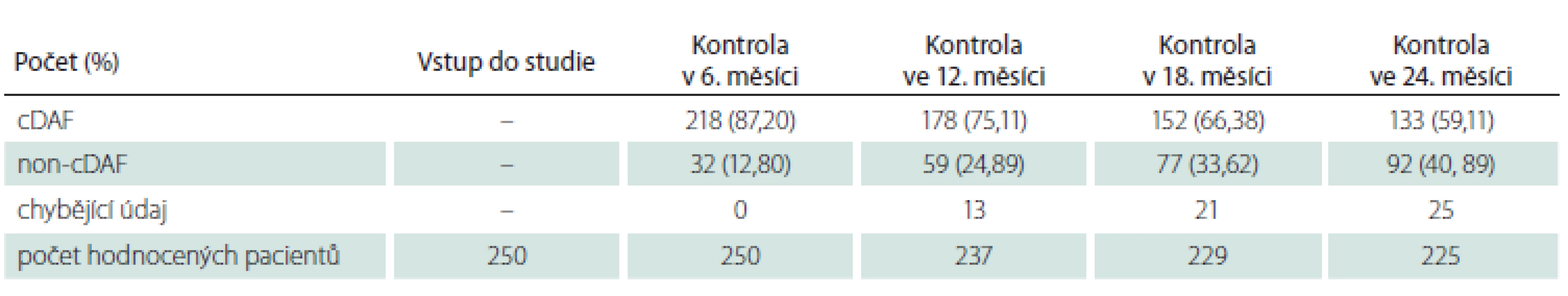
cDAF – bez klinické aktivity onemocnění Tab. 2. Počet a podíl pacientů s cDAF v podskupině pacientů s monosymptomatickým klinicky izolovaným syndromem v jednotlivých kontrolách. 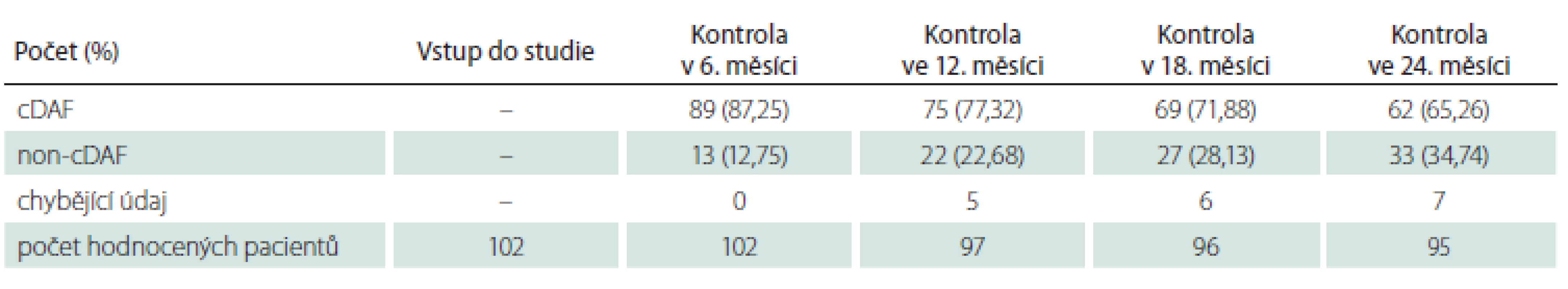
cDAF – bez klinické aktivity onemocnění Tab. 3. Počet a podíl pacientů s cDAF v podskupině pacientů s polysymptomatickým klinicky izolovaným syndromem v jednotlivých kontrolách. 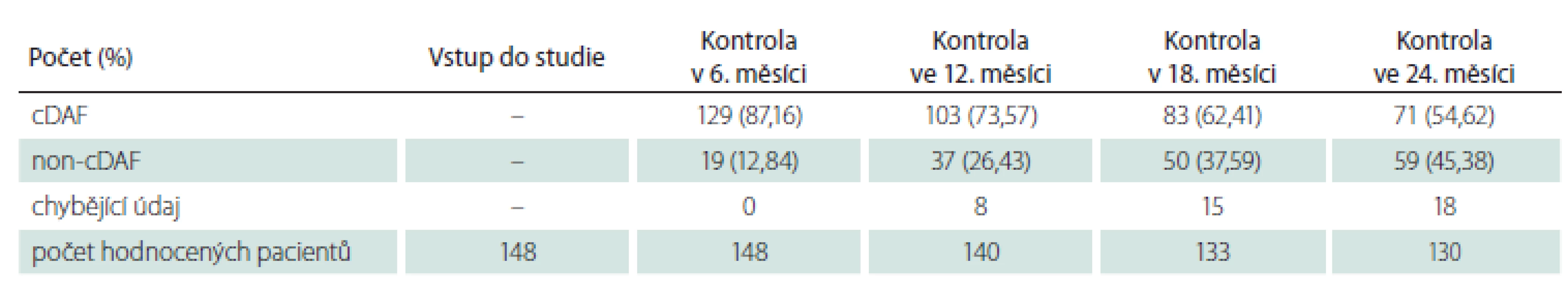
cDAF – bez klinické aktivity onemocnění Pro vstupní charakteristiku a analýzu primárního cíle studie byla sledovaná populace dle klinické prezentace CIS rozdělena na dvě podskupiny: podskupinu s polysymptomatickým CIS (n = 148; 59,2 %) a podskupinu s monosymptomatickým CIS (n = 102; 40,8 %). Průměrný věk v době vstupu do studie činil 32,36 roku (SD 9,67 roku; medián 31 let), 61 % (n = 153) tvořily ženy a 39 % (n = 97) muži. Průměrný věk v podskupině s polysymptomatickým CIS byl 32,36 ± 9,34 roků, s monosymptomatickým 32,37 ± 10,18 roků bez statisticky významného rozdílu (p = 0,8343). Podíl žen u polysymptomatických CIS byl 57,4 % a u monosymptomatických 66,6 %, také bez statisticky signifikantního rozdílu (p = 0,1409). U žen se CIS manifestoval monosymptomaticky ve 44,4 % a u mužů ve 35,0 % případů, také bez statisticky významného rozdílu (p = 0,1488).
Převažujícím symptomem CIS v celé populaci pacientů byl pyramidový, a to u 39,6 % osob (n = 99), četnost ostatních byla následující: senzitivní 22,0 % (n = 55), zrakový 21,6 % (n = 54), kmenový 10,0 % (n = 25) a mozečkový 6,8 % (n = 17). Byl zjištěn významný rozdíl mezi procentem výskytu dominantního symptomu CIS mezi mono - a polysymptomatickou podskupinou (p < 0,0001): v monosymptomatické skupině byl větší podíl jedinců s dominantním postižením zrakového nervu a nižší podíl jedinců s dominantním pyramidovým příznakem.
V monosymptomatické podskupině bylo průměrné vstupní skóre EDSS významně nižší než v polysymptomatické podskupině (1,84 vs. 2,41; p < 0,0001). Mezi podskupinami byl zjištěn významný rozdíl (p < 0,0001) v zastoupení nejvyšší míry postižení funkčních systémů, kdy v monosymptomatické bylo proti polysymptomatické podskupině vyšší procento nejvyššího postižení u zrakového nervu (33,33 vs. 4,73 %) a nižší u pyramidového systému (33,33 % vs. 61,49 %).
Celkově bylo ve studii přítomno 82,8 % osob s infratentoriální nebo míšní T2 či Gd+ lézí zjištěnou v úvodním MR vyšetření, přičemž významně nižší podíl pacientů s takovouto lézí byl v monosymptomatické podskupině (p = 0,0110).
Výsledky z hlediska primárního cíle
Celkový podíl osob s cDAF dosahoval při kontrole v 6. měsíci 87,20 % (n = 218), ve 12. měsíci 75,11 % (n = 178), v 18. měsíci 66,38 % (n = 152) a ve 24. měsíci 59,11 % (n = 133) (obr. 1, tab. 1). Počet a podíl pacientů s cDAF v obou podskupinách v jednotlivých studijních kontrolách je uveden v obr. 2 a tab. 2 a 3. Mezi podskupinami dle typu CIS nebyl zjištěn významný rozdíl (p = 0,2182; log-rank test).
Tab. 4. Kaplan-Meierova křivka přežití pro podíl osob bez klinické aktivity onemocnění v celkové populaci pacientů.
Fig. 1. Kaplan-Meier survival curve of clinically disease activity-free subjects in the total study population.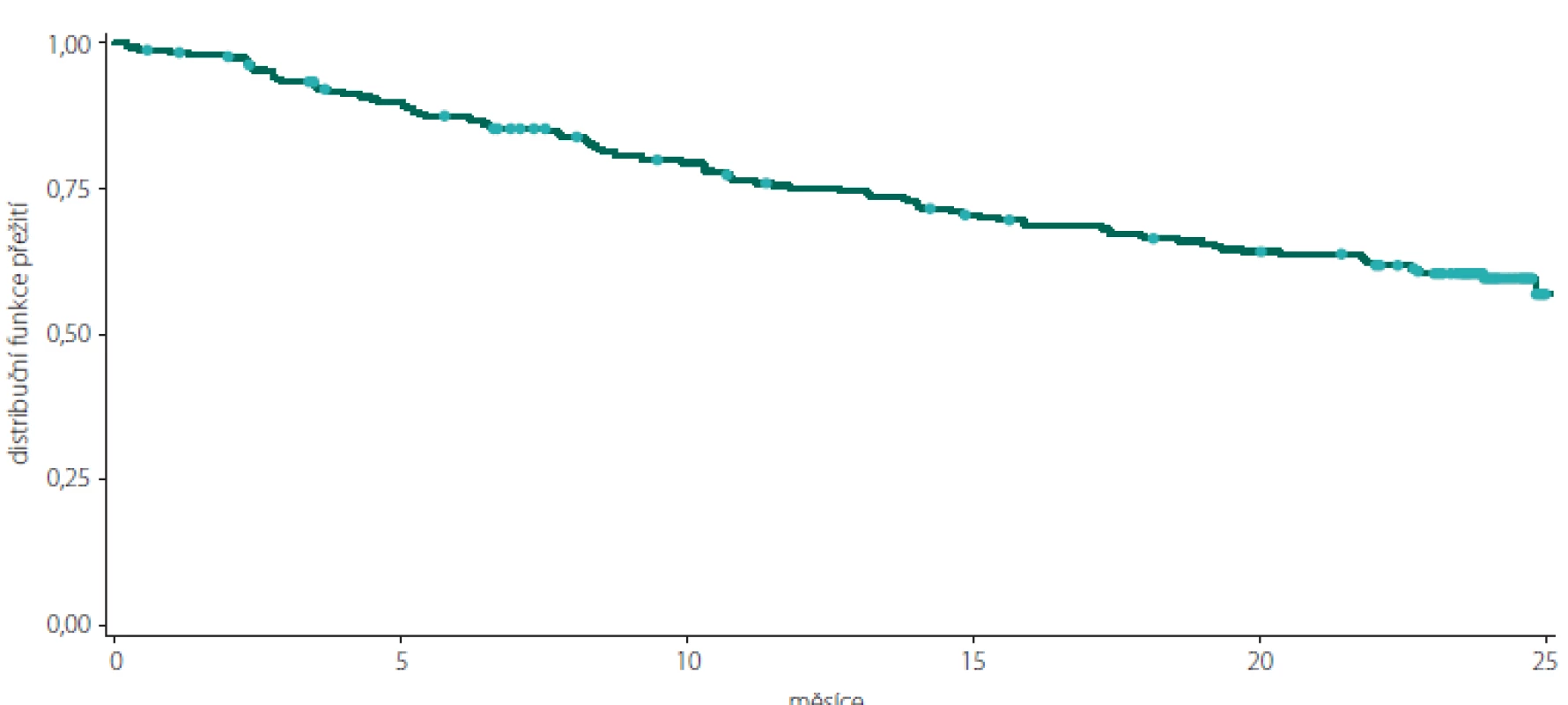
Tab. 5. Kaplan-Meierova křivka přežití pro podíl osob bez klinické aktivity onemocnění v podskupinách pacientů s monosymptomatickým (zelená) a polysymptomatickým (šedá) klinicky izolovaným syndromem.
Fig. 2. Kaplan-Meier survival curve of clinically disease activity-free subjects in the subgroups of patients with monosymptomatic (green) and polysymptomatic (grey) clinically isolated syndrome.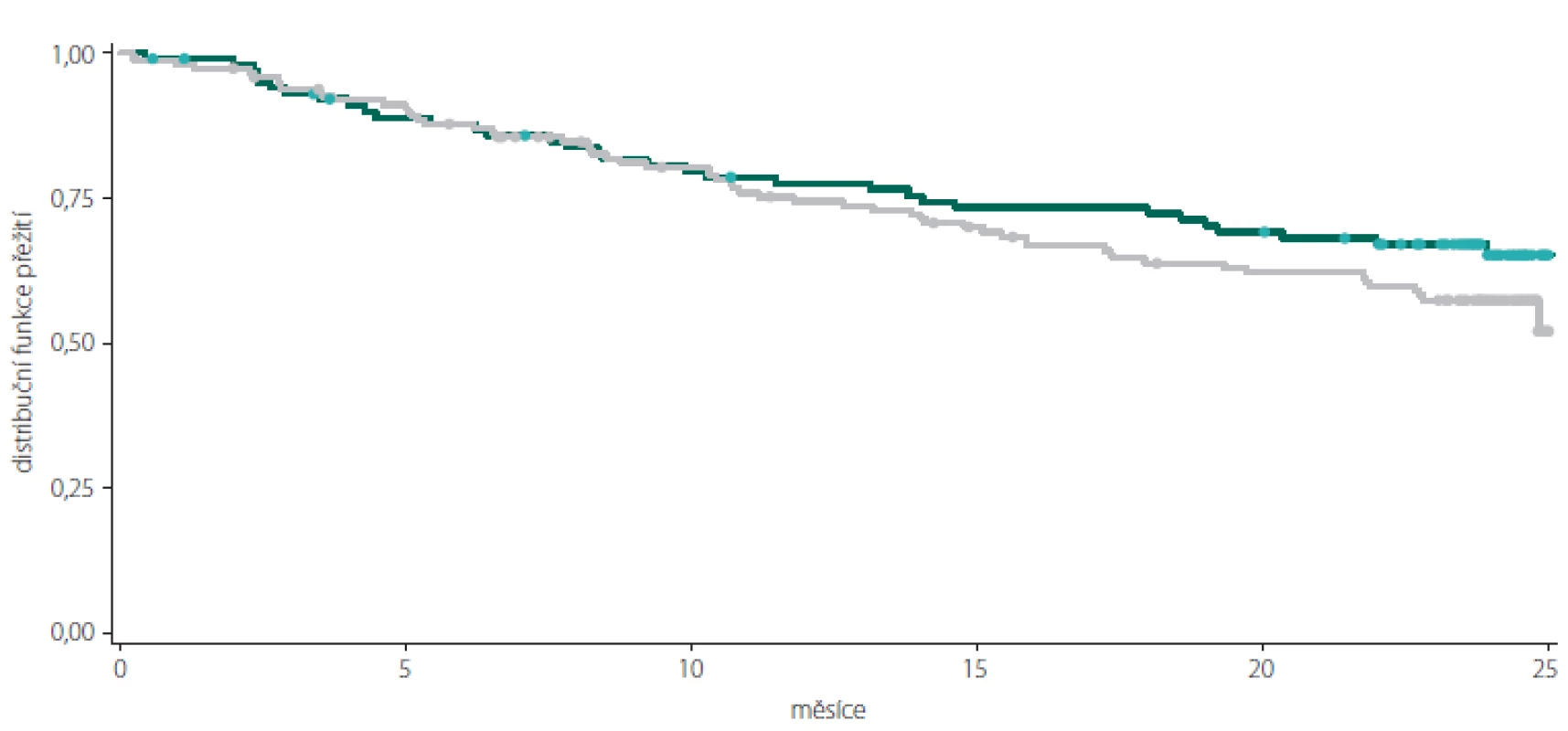
Celkový podíl osob bez relapsu dosahoval při kontrole v 6. měsíci 87,60 % (n = 219), ve 12. měsíci 76,37 % (n = 181), v 18. měsíci 67,69 % (n = 155) a ve 24. měsíci 62,67 % (n = 141). Mezi podskupinami nebyl zjištěn významný rozdíl (p = 0,1377; log-rank test).
Celkový podíl osob bez progrese EDSS dosahoval při kontrole v 6. měsíci 98,40 % (n = 246), ve 12. měsíci 94,07 % (n = 222), v 18. měsíci 91,03 % (n = 203) a ve 24. měsíci 85,45 % (n = 182). Ani zde nebyl mezi podskupinami zjištěn významný rozdíl (p = 0,6667; log-rank test).
Výsledky z hlediska sekundárních cílů
Průměrná doba od počátku příznaků CIS do zahájení podávaní IFN β-1a činila 18,13 týdne (SD 11,54). K analýze vztahu mezi touto dobou a rizikem klinické aktivity onemocnění byla studovaná populace rozdělena na čtyři podskupiny podle délky doby od počátku příznaků CIS do zahájení léčby IFN β-1a, a to: < 9 týdnů (n = 54), 9 – 14 týdnů (n = 64), 14 – 25 týdnů (n = 69) a > 25 týdnů (n = 63). Mezi těmito podskupinami nebyl zjištěn statisticky významný rozdíl (p = 0,6626; Mantelův-Coxův log rank test).
Stejně tak se významně nelišil podíl osob s cDAF v žádné z pěti podskupin pacientů rozdělených dle dominantního symptomu CIS v žádném z časových bodů studie:
6. měsíc (p = 0,6169; chí-kvadrát test), 12. měsíc (p = 0,2165), 18. měsíc (p = 0,1310) a 24. měsíc (p = 0,0996). Těchto pět podskupin se nelišilo ani v čase do klinické aktivity onemocnění (p = 0,1362; Mantelův-Coxův log rank test).Při porovnání dvou podskupin dle přítomnosti infratentoriální nebo míšní T2 či Gd+ léze zjištěné při vstupním vyšetření MR také nebyl zjištěn významný rozdíl v podílu osob s cDAF v žádném z časových bodů studie: 6. měsíc (p = 0,2091; chí-kvadrát test), 12. měsíc (p = 0,2355), 18. měsíc (p = 0,0571) a 24. měsíc (p = 0,1309). Tyto podskupiny se nelišily ani v čase do vzniku klinické aktivity onemocnění (p = 0,1279; Mantelův-Coxův log rank test).
Podíl pacientů s cDAF v závislosti na vynechaných injekcích IFN β-1a se v podskupinách nelišil. Adherence k léčbě byla vysoká, 90,8 % osob vynechalo méně než pět injekcí. Pro analýzu vlivu adherence na klinickou aktivitu onemocnění byli pacienti rozděleni na čtyři podskupiny podle počtu vynechaných injekcí v posledních 4 týdnech před každou studijní návštěvou následovně: 0 – 1 (n = 221; 88,4 %), 2 – 3 (n = 4; 1,60 %), 4 – 5 (n = 2; 0,80 %) a více než 5 vynechaných injekcí (n = 23; 9,20 %). S ohledem na nízký počet pacientů v podskupinách s 2 – 3 a 4 – 5 vynechanými injekcemi byl rozdíl v podílu osob s cDAF testován pouze mezi první a čtvrtou podskupinou a nebyl významný v žádném z časových bodů studie (chí-kvadrát test). Rozdíl v čase do klinické aktivity byl testován ve všech čtyřech podskupinách a nebyl významný (p = 0,6254; Mantelův-Coxův log rank test).
Bezpečnost
Nežádoucí reakce na podání léku byly hlášeny u 4,0 % pacientů. Žádná z hlášených nežádoucích reakcí nebyla neočekávaná a všechny byly v souladu s údaji v SPC [6]. V průběhu studie nebylo hlášeno žádné úmrtí.
Diskuze
Cílem studie bylo hledání rozdílu v odpovědi na léčbu IFN β-1a v závislosti na individuálním průběhu a manifestaci časného onemocnění. V případě zjištěných odlišností by mohl výsledek přispět k identifikaci pacientů, kteří by měli největší prospěch z IFN β-1a podávaného ve vysokých dávkách a s vysokou frekvencí.
Výsledky ukázaly potenciál IFN β-1a navodit klinickou stabilizaci onemocnění během sledovaného období. Podíl klinicky stabilních osob se v průběhu prvního roku od zahájení léčby pohyboval okolo tří čtvrtin (75,11 %) a na konci 2letého sledování stále dosahoval 59,11 %. V průběhu 2 let u většiny (85,45 %) osob nedošlo k trvalé progresi onemocnění; zvýšení jeho klinické aktivity bylo nejčastěji způsobeno relapsem. Podíl léčených osob bez relapsu činil po 2 letech 62,67 %.
Prognostickými faktory dalšího průběhu onemocnění u pacientů s CIS se zabývá nedávná práce respektovaných autorů [8]. Ti v úvodu shrnují, že u většiny neléčených pacientů nakonec dochází k rozvoji klinicky definitivní RS (clinically definite multiple sclerosis; CDMS) a akumulaci neurologického postižení. Vyšší riziko konverze do CDMS je při vzniku onemocnění v mladším věku; k větší akumulaci disability dochází u mužů. Vyšší riziko jak přechodu do CDMS, tak nárůstu postižení je u neléčených pacientů s CIS manifestujícím se jinak než jako ON, a také při přítomnosti oligoklonálních pásů v likvoru. Za nejspolehlivější prediktor konverze do CDMS a akumulace disability je považován vysoký počet T2 lézí a splnění Barkhofových kritérií na vstupním MR mozku. Na vlastním, dlouhodobě sledovaném, velkém souboru pacientů tito autoři multivariační analýzou zjistili, že pohlaví nebylo rizikovým faktorem pro další relaps, dále klasifikovali věk a klinickou symptomatiku CIS (ON vs. jiná lokalizace) jako prognostické faktory s malým vlivem, střední vliv měla přítomnost oligoklonálních pásů v likvoru a největší vliv byl pozorován u počtu lézí na vstupní MR. V kontrastu s naším souborem bylo pouze 38,3 % pacientů v citovaném souboru léčeno DMD. Při přítomnosti nepříznivých prognostických faktorů pro průběh neléčeného onemocnění u pacientů s polysymptomatickým CIS ve smyslu signifikantně menšího podílu pacientů s dominantním postižením zrakového nervu a vyššího podílu s dominantním pyramidovým příznakem, většího výskytu pyramidové symptomatologie, významně vyššího vstupního EDSS a vyššího podílu pacientů s infratentoriální a míšní lokalizací lézí na MR bychom v této podskupině očekávali vyšší aktivitu v dalším průběhu onemocnění. Tento předpoklad se však při léčbě s. c. IFN β-1a nepotvrdil – mezi podskupinou pacientů s monosymptomatickým CIS a podskupinou s polysymptomatickým CIS nebyl při žádné z kontrol zjištěn rozdíl v podílu osob s cDAF, bez relapsu a bez progrese EDSS ani rozdíl v době do dosažení stavu non-cDAF, relapsu či progrese EDSS, což svědčí o příznivém vlivu sledovaného přípravku na průběh onemocnění bez ohledu na přítomnost těchto rizikových prognostických faktorů.
Výsledky naší studie jsou tak v souladu s výsledky registrační studie fáze III REFLEX [5] a podporují klinickou účinnost IFN β-1b v dávce 44 µg 3× týdně u pacientů v časném stadiu RS bez ohledu na to, zda jde o mono - či polysymptomatický CIS. U injekčních léků 1. linie schválených pro léčbu RS ve stadiu CIS byly publikovány výsledky klinických hodnocení na populacích s mono - i polysymptomatickým CIS pouze u IFN β-1a a b [5,9,10]. U glatiramer acetátu byla účinnost prokázána v klinickém hodnocení fáze III pouze u pacientů s monosymptomatickým CIS, a to jen v dávkování 20 mg s. c. 1× denně [11]. Při srovnání účinnosti s. c. IFN β-1a v dávce 44 µg s dimetyl fumarátem a finglimodem v eskalační léčbě RS analýzou dat z registru ReMuS neprokázali Pavelek et al signifikantní rozdíl mezi těmito léky [12]. Dále poukazují na striktní úhradová kritéria výrazně omezující možnost využití eskalačních přípravků v 1. linii léčby. Výše uvedené skutečnosti, tedy účinnost s. c. IFN β-1a v dávce 44 µg srovnatelná v klinické praxi s eskalačními přípravky, a také srovnatelná u pacientů s mono - i polysymptomatickým CIS, jak potvrdila naše studie, a dále možnost úhrady již v 1. linii tak mohou být vodítkem při volbě vhodného léku právě u pacientů s polysymptomatickým či multifokálním CIS.
Analýza sekundárních cílů neukázala významný vliv průměrné doby od začátku příznaků CIS do zahájení léčby IFN β-1a. V prodloužení studie REFLEX bylo prokázáno, že odložení zahájení léčby s. c. IFN β-1a o 2 roky vedlo ke zvýšení rizika konverze do CDMS a také do RS dle McDonaldových kritérií z roku 2005 (nová aktivita zjištěná na základě vyšetření MR) [13]. U žádného z pacientů zařazených do naší studie k oddálení léčby o tak dlouhou dobu nedošlo. U 75 % z nich byla léčba zahájena do 25 týdnů od vzniku klinických příznaků a námi pozorované rozdíly v délce tohoto období neměly vliv na budoucí odpověď na léčbu s. c. IFN β-1a.
Adherence k léčbě byla velmi vysoká po celou dobu sledování. Nebyl pozorován rozdíl v podílu pacientů bez klinické aktivity onemocnění ve skupinách s vysokou a nižší adherencí. Toto pozorování je však třeba interpretovat opatrně, s ohledem na námi pozorovaný malý počet pacientů s nižší adherencí k léčbě.
Jsme si vědomi limitace naší studie spočívající především v předem definovaných cílových ukazatelích, které nezahrnovaly všechny známé prognostické faktory, a v zařazení pacientů léčených pouze jedním přípravkem. K detailnímu objasnění významu prognostických faktorů dalšího průběhu onemocnění, a především k porovnání efektu léků používaných ve stadiu CIS by jistě byla vhodná analýza dat z národního registru ReMuS.
Závěr
Subkutánní podávání IFN β-1a v dávce 44 µg 3× týdně vedlo ve sledovaném období 2 let u většiny pacientů s CIS ke klinické stabilizaci onemocnění. Tato stabilizace nebyla ovlivněna klinickou povahou CIS (mono - či polysymptomatický) ani jeho dominantním příznakem (tj. nejvíce postižený funkční systém). Stabilizaci neovlivnil ani nález zvýšené aktivity v infratentoriální oblasti nebo v míše při vstupním vyšetření MR. Výsledky studie ATRACT potvrzují, že s. c. IFN β-1a v dávce 44 µg 3× týdně představuje vhodnou alternativu pro zahájení léčby, a to i u nemocných s vyšší aktivitou na počátku onemocnění.
Studie byla podpořena společností Merck spol. s r.o.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Aleš Tvaroh, Ph.D.
Neurologické oddělení
Nemocnice Teplice, o. z.
Krajská zdravotní, a. s.
Duchcovská 53
415 29 Teplice
e-mail: ales.tvaroh@merckgroup.com
Přijato k recenzi: 27. 12. 2018
Přijato do tisku: 4. 7. 2019
Zdroje
1. Miller D, Barkhof F, Montalban X et al. Clinically isolated syndromes suggestive of multiple sclerosis, part I: natural history, pathogenesis, diagnosis, and prognosis. Lancet Neurol 2005; 4(5): 281–288. doi: 10.1016/S1474-4422(05)70071-5.
2. Confavreux C, Vukusic S, Adeleine P. Early clinical predictors and progression of irreversible disability in multiple sclerosis: an amnesic process. Brain 2003; 126 (Pt 4): 770–782. doi: 10.1093/brain/awg081.
3. Eriksson M, Andersen O, Runmarker B. Long-term follow-up of subjects with clinically isolated syndromes, relapsing remitting and secondary progressive multiple sclerosis. Mult Scler 2003; 9(3): 260–274. doi: 10.1191/1352458503ms914oa.
4. Minneboo A, Barkhof F, Polman CH et al. Infratentorial lesions predict long term disability in subjects with initial findings suggestive of multiple sclerosis. Arch Neurol 2004; 61(2): 217–221. doi: 10.1001/archneur.61.2.217.
5. Comi G, De Stefano N, Freedman MS et al. Comparison of two dosing frequencies of subcutaneous interferon beta-1a in subjects with a first clinical demyelinating event suggestive of multiple sclerosis (REFLEX): a phase 3 randomised controlled trial. Lancet Neurol 2012; 11(1): 33–41. doi: 10.1016/S1474-4422(11)70
262-9.6. Evropská agentura pro léčivé přípravky (EMA). Rebif, Souhrn údajů o přípravku. [online]. Dostupné z URL: https://www.ema.europa.eu/documents/product-information/rebif-epar-product-information_
cs.pdf.7. Havrdová E, Galetta S, Stefoski D et al. Freedom from disease activity in multiple sclerosis. Neurology 2010; 74 (Suppl 3): S3–S7. doi: 10.1212/WNL.0b013e3181dbb51c.
8. Tintore M, Rovira A, Río J et al. Defining high, medium and low impact prognostic factors for developing multiple sclerosis. Brain 2015 : 138 (Pt 7); 1863–1874. doi: 10.1093/brain/awv105.
9. Jacobs LD, Beck RW, Simon JH et al. Intramuscular interferon beta-1a therapy initiated during a first demyelinating event in multiple sclerosis. CHAMPS Study Group. N Engl J Med 2000; 343(13): 898–904. doi: 10.1056/NEJM200009283431301.
10. Kappos L, Freedman MS, Polman CH et al. Long-term effect of early treatment with interferon beta-1b after a first clinical event suggestive of multiple sclerosis: 5-year active treatment extension of the phase 3 BENEFIT trial. Lancet Neurol 2009; 8(11): 987–997. doi: 10.1016/S1474-4422(09)70237-6.
11. Comi G, Martinelli V, Rodegher M et al. Effect of glatiramer acetate on conversion to clinically definite multiple sclerosis in patients with clinically isolated syndrome (PreCISe study): a randomised, double-blind, placebo-controlled trial. Lancet 2009; 374(9700): 1503–1511. doi: 10.1016/S0140-6736(09)61259-9.
12. Pavelek Z, Sobíšek L, Horáková D et al. Srovnání účinnosti subkutánně podávaného interferonu β-1a 44 μg, dimetyl fumarátu a fingolimodu v reálné klinické praxi – multicentrická observační studie. Cesk Slov Neurol N 2018; 81/114(4): 457–465. doi: 10.14735/amcsnn 2018457.
13. Comi G, De Stefano N, Freedman MS et al. Subcutaneous interferon β-1a in the treatment of clinically isolated syndromes: 3-year and 5-year results of the phase III dosing frequency-blind multicentre REFLEXION study. J Neurol Neurosurg Psychiatry 2017; 88(4): 285–294. doi: 10.1136/jnnp-2016-314843.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2019 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Editorial
- Intrakraniálna stenóza – najlepšiu konzervatívnu liečbu je vhodné kombinovať so stentom - ÁNO
- Intrakraniální stenóza – nejlepší konzervativní léčbu je vhodné kombinovat se stentem - NE
- Intrakraniálna stenóza – najlepšiu konzervatívnu liečbu je vhodné kombinovať so stentom
- Multisystémová atrofie
- Spektrum MR nálezů progresivní multifokální leukoencefalopatie u kohorty pacientů s roztroušenou sklerózou v ČR
- Stanovení míry shody mezi záchranáři a neurology při identifi kaci těžké hemiparézy u pacientů s akutní cévní mozkovou příhodou
- Vyšetření čichu před operací nosní polypózy a po ní
- Retrospektivní autoevaluace výsledků operací intrinsických mozkových nádorů – konsekutivní kohorta 270 operací v rámci jednoho neurochirurgického centra NOS ČOS (Neuroonkologické sekce České onkologické společnosti) z let 2015–2017
- Spina bifida v České republice – incidence a prenatální diagnostika
- Čichová dysfunkce u české skupiny pacientů s idiopatickou poruchou chování v REM spánku
- Dvě původní české zkoušky k vyšetření paměti za tři minuty – Amnesia Light and Brief Assessment (ALBA)
- Liečba ťažkej spasticity intratekálnym podávaním baklofénu – 15-ročné skúsenosti
- Profil behaviorálních projevů u idiopatické poruchy chování v REM spánku
- Vliv subkutánně podávaného interferonu β-1a na aktivitu onemocnění u pacientů s klinicky izolovaným syndromem – observační studie ATRACT
- Je nutné při operační léčbě chronického subdurálního hematomu trepanací a drenáží provádět i výplach hematomu?
- Hypersomnia pri akútnej bitalamickej ischémii
- Postižení sluchu po spinální anestezii
- Objemná pneumokéla frontálního sinu s rozsáhlým intrakraniálním šířením imitujícím dysfunkci lumboperitoneální drenáže u predisponovaného pacienta s Marfanovým syndromem
- Dehiscence horního polokruhovitého kanálku
- Analýza dat v neurologii LXXVI. Korelační analýza vícerozměrných souborů kvantitativních a kvalitativních dat – představení vybraných ukazatelů
- Komentář k článku autorů Zítek et al Anterior choroidal artery aneurysm Cesk Slov Neurol N 2019; 82/ 115(3): 350–351
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Multisystémová atrofie
- Dehiscence horního polokruhovitého kanálku
- Spina bifida v České republice – incidence a prenatální diagnostika
- Postižení sluchu po spinální anestezii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



