-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
Changes of paraspinal muscle morphology in patients with chronic non-specific low back pain
Low back pain (LBP) is a frequent and major health problem. Paraspinal muscles play an important role in trunk movements, helping to maintain posture and spinal stability. Changes of paraspinal muscle morphology and function are described in patients with chronic LBP. Macroscopic changes can be evaluated by CT and especially by MRI, while microscopic changes are assessed by muscle biopsy. There is evidence available in literature stating that atrophy of paraspinal muscles and increased fat deposits in the paraspinal muscles are significantly associated with non-specific LBP, especially with chronic LBP. From a differential diagnostic point of view, changes in paraspinal muscles associated with LBP must be distinguished from paraspinal muscle involvement in patients with axial myopathies, but these are rare. The aim of this paper is to highlight the structural and functional changes of paraspinal muscles in patients with chronic non-specific LBP. A diagnostic algorithm for chronic LBP associated with degeneration of paraspinal muscles to exclude the presence of axial myopathy is presented.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Keywords:
Spine – low back pain – paraspinal muscles – fat infiltration – axial myopathies
Autori: E. Vagaská 1; T. Andrašina 2
; S. Voháňka 1; B. Adamová 1
Pôsobisko autorov: Neurologická klinika LF MU a FN Brno 1; Radiologická klinika LF MU a FN Brno 2
Vyšlo v časopise: Cesk Slov Neurol N 2019; 82(5): 505-512
Kategória: Přehledný referát
doi: https://doi.org/10.14735/amcsnn2019505Súhrn
Bolesti dolní části zad (low back pain; LBP) jsou mimořádně častým a závažným zdravotním problémem. Paraspinální svaly hrají důležitou funkci při pohybech trupu, přispívají k udržení postury a stability páteře. U pacientů s chronickými LBP dochází ke strukturálním i funkčním změnám paraspinálních svalů. Makroskopické změny lze vyšetřit na CT a zejména na MR, mikroskopické změny pomocí svalové biopsie. V dostupné literatuře existují důkazy, že atrofie paraspinálních svalů a zvýšení podílu tukové tkáně uvnitř paraspinálních svalů jsou významně asociovány s nespecifickými LBP, a to zejména s chronickými bolestmi. Z diferenciálně diagnostického hlediska je nutné změny v paraspinálních svalech asociované s LBP odlišit od postižení paraspinálních svalů u pacientů s axiálními myopatiemi, které jsou však vzácné. Cílem tohoto sdělení je upozornit na strukturální i funkční změny paraspinálních svalů u pacientů s chronickými nespecifickými LBP. Je uveden diagnostický postup při chronických LBP spojených s degenerací paraspinálních svalů k vyloučení přítomnosti axiální myopatie.
Klíčová slova:
bolesti dolní části zad – paraspinální svaly – páteř – tuková infi ltrace – axiální myopatie
Úvod
Bolesti dolní části zad (low back pain; LBP), tedy vertebrogenní syndromy v bederní oblasti, jsou mimořádně častým a ze socioekonomického hlediska závažným zdravotním problémem. Celoživotní prevalence se udává kolem 84 %, přičemž po první epizodě se relapsy vyskytují u 44 – 78 % lidí [1]. Výskyt chronických LBP (délka trvání bolesti více než 12 týdnů) se udává až u 23 % dospělé populace, přičemž funkčně je omezeno díky těmto bolestem asi 11 % populace [1].
Nejčastější skupinou jsou tzv. prosté nespecifické bolesti, které tvoří 80 – 85 % všech LBP. Nespecifické LBP lze považovat za symptom, u kterého většinou neznáme příčinu, a nejsme schopni spolehlivě identifikovat patologii, která je způsobuje [2]. Mezi nespecifické bolesti zad tedy nepatří kompresivní spondylogenní syndromy a bolesti způsobené onemocněním páteře specifické nedegenerativní povahy (např. zánětem, nádorem, traumatem, osteoporózou). Klinická manifestace prostých bolestí zad bývá pod obrazem segmentovaného syndromu nebo pseudoradikulárního syndromu. Z dostupných studií a metaanalýz vyplývá, že s nespecifickými LBP jsou asociovány různé léze, které lze identifikovat pomocí MR bederní páteře, např. degenerace disku, protruze disku, Modicovy změny (zvláště typu I), artróza facetových kloubů, spinální stenóza [3 – 9]. Nicméně metaanalýza studií prokázala, že na individuální úrovni žádná z těchto lézí identifikovaných na MR nemůže být považována za příčinu nespecifických LBP, protože tyto nálezy na MR jsou velmi časté i u asymptomatických jedinců [3]. Dalším faktorem, který znesnadňuje identifikaci příčiny těchto bolestí, je špatná korelace mezi radiologickými nálezy a klinickou manifestací vč. bolesti [10 – 12].
V poslední dekádě je stále větší pozornost věnována i paraspinálním svalům, ve kterých jsou u pacientů s LBP rovněž popisovány změny. Předpokládá se, že postižení paraspinálních svalů se etiologicky podílí na LBP a zkoumá se vztah mezi změnami paraspinálních svalů, LBP a spinální patologií [13]. Povědomí o změnách v paraspinálních svalech, které jsou asociovány s LBP, je důležité i z diferenciálně diagnostického hlediska, kdy nález těchto změn bychom mohli mylně považovat za projev myopatie v širším slova smyslu.
Cílem tohoto sdělení je upozornit na strukturální a funkční změny paraspinálních svalů u pacientů s chronickými nespecifickými LBP.
Anatomie a funkce paraspinálních svalů bederní páteře
Paraspinální (paravertebrální) svaly páteře vytvářejí hlubokou svalovou vrstvu zádových svalů. Tyto svaly probíhají převážně longitudinálně oboustranně dorzálně podél páteře a jsou inervovány z dorzálních větví míšních nervů. V oblasti bederní páteře jsou paraspinální svaly tvořeny [14]:
- m. erector spinae – souborný název pro m. iliocostalis, m. longissimus a m. spinalis (svaly jsou uvedeny ve směru od laterálního k mediálnímu, přičemž m. spinalis se vyskytuje v bederním úseku jen ve výši L1 – L2). Funkce těchto svalů spočívá ve vzpřímení páteře a v úklonu páteře na stranu působícího svalu;
- m. transversospinalis – souborný název pro svaly, které začínají na processus mamillares bederních obratlů a upínají se směrem vzhůru na spinální výběžky obratlů. V bederní oblasti je systém složen z následujících svalových celků:
- mm. multifidi – svaly přeskakují 2 – 4 obratle, funkce spočívá v záklonu, úklonu a mírné rotaci páteře,
- mm. rotatores – hluboká vrstva transverzospinálního systému s krátkými snopci, příčným průběhem a silnou rotační schopností, svaly přeskakují jen 1 obratel;
3. mm. interspinales – jedná se o svaly rozepjaté mezi sousedními obratlovými trny, zaklánějí páteř;
4. mm. intertransversarii – svaly spojující sousední příčné výběžky, funkce spočívá v úklonu páteře.
Svaly jsou heterogenní populací vláken, která se liší řadou mikroskopických, histochemických a fyziologických vlastností. Rozlišujeme 3 základní typy svalových vláken, a to [15]:
- Pomalá červená vlákna (typ 1, slow oxidative), jsou vhodnější pro stavbu svalů zajišťujících spíše statické, polohové funkce a pomalý pohyb. Málo se unaví. Nazývají se také „tonická vlákna“.
- Rychlá červená vlákna (typ 2A, fast oxidative glycolytic), hodí se pro výstavbu svalů zajišťujících rychlý pohyb prováděný velkou silou. Jsou poměrně odolná proti únavě. Používá se pro ně také název „fázická vlákna“.
- Rychlá bílá vlákna (typ 2X [dříve označení 2B], fast glycolytic), u těchto vláken dochází k rychlému stahu, který je prováděn maximální silou, ale vlákna jsou málo odolná proti únavě.
Paraspinální svaly jsou primárně pomalé posturální svaly. U zdravých jedinců paraspinální svaly obsahují více vláken typu 1 ve srovnání s ostatními muskuloskeletálními svaly, což bylo potvrzeno svalovou biopsií z m. erector spinae zdravých jedinců, u kterých se zastoupení vláken typu 1 pohybovalo v průměru mezi 63 – 65 % [16].
Úloha paraspinálních svalů při rozvoji chronických nespecifických LBP
Paraspinální svaly jsou odpovědné za iniciaci a kontrolu všech pohybů páteře, významně přispívají k udržení postury a dále se podílejí na „velkých“ pohybech páteře (předklon, úklon, záklon, rotace). Lumbální paraspinální svaly, a to m. erector spinae a zejména lumbální mm. multifidi, hrají důležitou roli ve stabilizaci bederní páteře [17]. Díky kontrole pohybů páteře mají paraspinální svaly úlohu i při stabilizaci a ochraně osteoligamentózních struktur páteře před poškozením, které by mohlo vzniknout na podkladě pohybů mimo optimální funkční rozsah [16]. Při dysfunkci paraspinálních svalů může dojít k poškození disků a osteoligamentózních struktur páteře, což je zdrojem bolestí. Bolest vede k pohybové inaktivitě, která je spojena s atrofií paraspinálních svalů, a tím se prohlubuje dysfunkce těchto svalů.
V literatuře je opakovaně popsána asociace dysfunkce lumbálních paraspinálních svalů (jejich oslabení a zvýšená únavnost) s chronickými nespecifickými LBP [16 – 18]. Nicméně stále není jasné, co v tomto vztahu (nespecifické bolesti páteře – svalová dysfunkce paraspinálních svalů) je příčina a co následek. Mechanizmy rozvoje LBP pravděpodobně tvoří „circulus vitiosus“, do kterého je zahrnuta svalová dysfunkce, bolest a inaktivita [16] (obr. 1). Rozvoj těchto bolestí je tedy multifaktoriální záležitost, na které se kromě výše zmíněných faktorů uplatňují i další nezávislé faktory, a to psychosociální faktory, jež ovlivňují zejména přechod bolesti do chronicity [19]. Dysfunkce paraspinálních svalů je spojena s makroskopickými i mikroskopickými strukturálními změnami paraspinálních svalů.
Obr. 1. Schéma mechanizmů rozvoje chronických nespecifických bolestí dolní části zad. Fig. 1. Diagram of mechanisms of development of chronic non-specific low back pain. 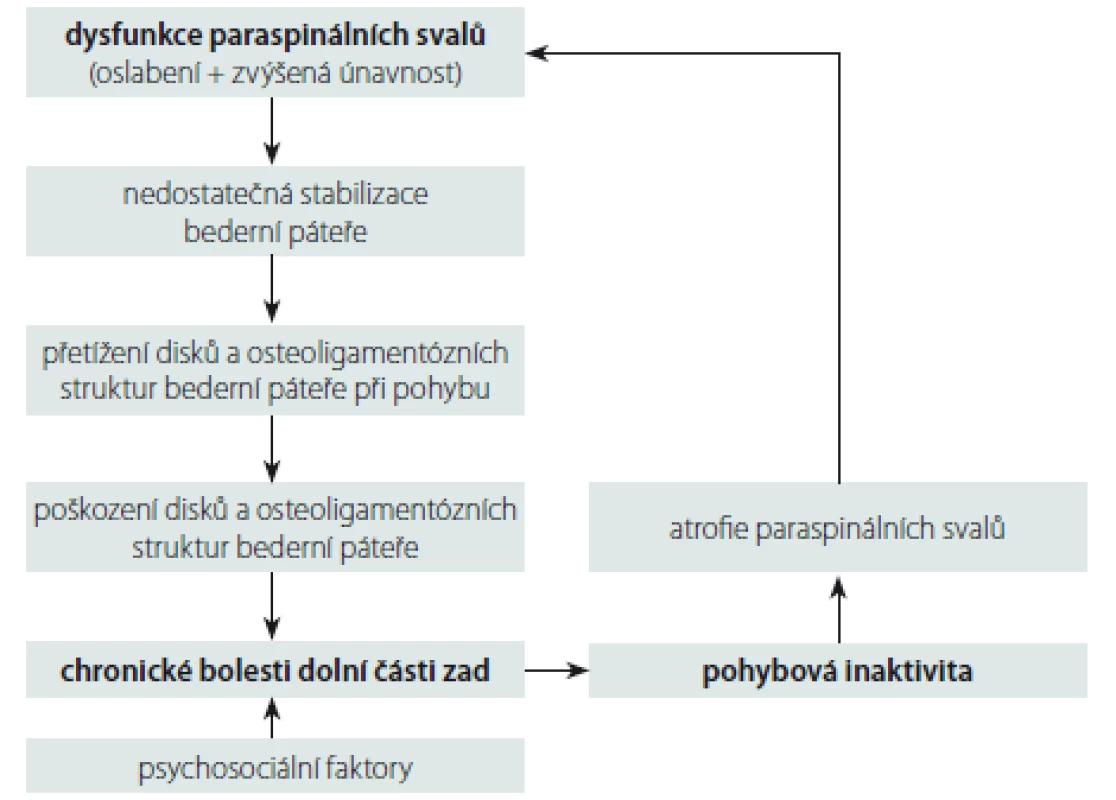
Morfologické vyšetření paraspinálních svalů a hodnocené parametry
Při posuzování změn v paraspinálních svalech se obvykle hodnotí nálezy v mm. multifidi a m. erector spinae (obr. 2). Mezi základní zobrazovací modality používané pro hodnocení morfologie paraspinálních svalů patří MR, CT a UZ vyšetření [13]. Jednoznačně nejdetailnější informace o vlastnostech paraspinálních svalů poskytuje zobrazení pomocí MR, které je výhodné především pro vynikající kontrast měkkých tkání [20]. Velmi užitečné se jeví zejména techniky Dixon sekvencí na MR vzhledem k možnosti stanovit podíl tuku a vody. Pokročilejší zobrazovací techniky, jako je MR spektroskopie nebo multi-echo sekvence MR, lze rovněž využít pro kvantifikaci obsahu tuku a detekci metabolických změn ve svalové tkáni [13,21].
Obr. 2. Axiální T2 vážený obraz MR bederní páteře na úrovni L4. Obrázek ukazuje normální anatomii paraspinálních svalů. Musculus erector spinae je tvořen m. longissimus (LI) a m. iliocostalis (IC). Multifidus (MF) je mediálně od m.erector spinae.
Fig. 2. Axial T2-weighted MRI image of the lumbar spine at the level of L4. Figure shows normal anatomy of paraspinal muscles. The erector spinae muscle consists of the longissimus (LI) and iliocostalis (IC) muscles. The multifi dus (MF) is medial to the erector spinae muscles.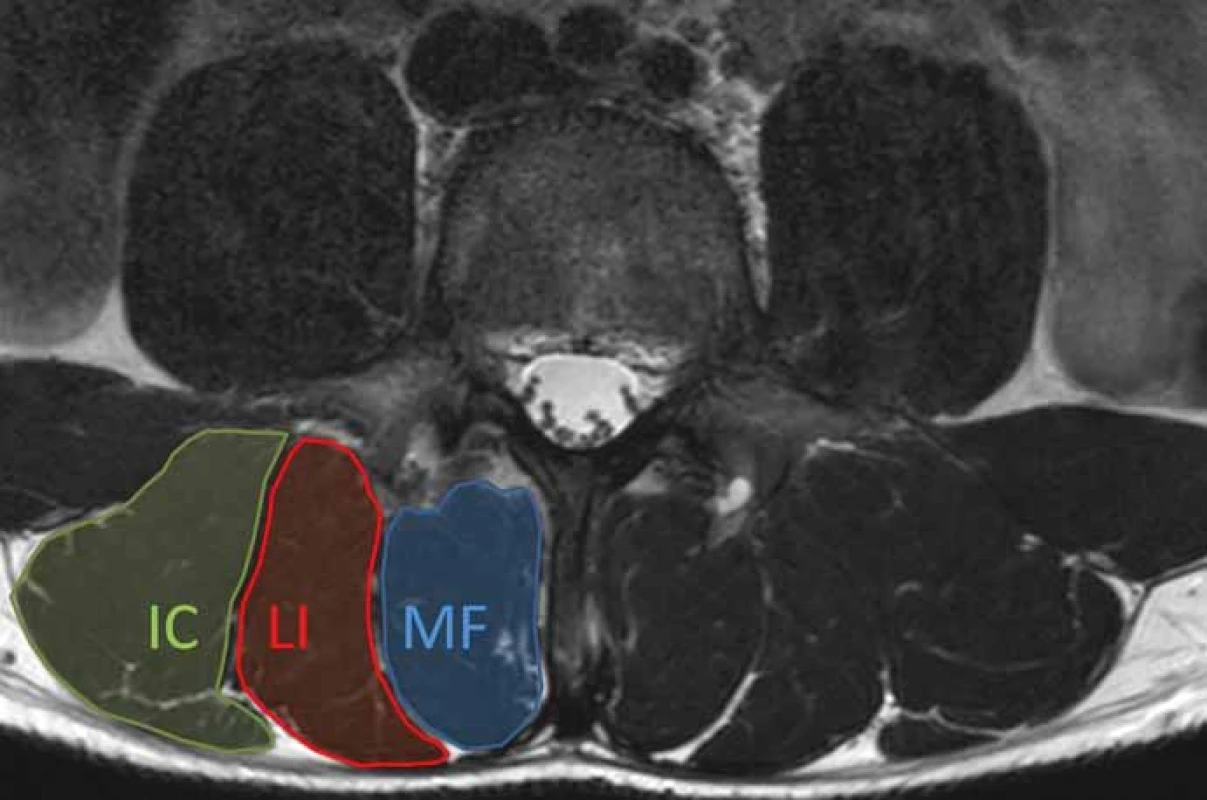
K nejčastěji popisovaným makroskopickým změnám patří pokles příčné plochy paraspinálních svalů a tuková infiltrace [13,17,22]. Pro vlastní hodnocení těchto změn můžeme použít semikvantitativní nebo kvantitativní metody.
Pro semikvantitativní hodnocení tukové infiltrace svalů na CT nebo MR lze využít semikvantitativní 5stupňovou Goutallierovu klasifikaci [23] nebo zjednodušenou 3stupňovou klasifikaci [24,25] (tab. 1). Obě tyto klasifikace se vyznačují nízkou interindividuální i intraindividuální variabilitou a jeví se vhodné pro rutinní použití v klinické praxi [13,26].
Obr. 3. Semikvantitativní hodnocení tukové infi ltrace svalů – Goutallierova klasifikace [23] a její zjednodušená 3stupňová verze [24,25]. ![Semikvantitativní hodnocení tukové infi ltrace svalů – Goutallierova klasifikace [23] a její zjednodušená 3stupňová verze [24,25].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/8538bcba497ef7232452931da91787cc.png)
Pomocí kvantitativních parametrů můžeme hodnotit tři základní morfologické vlastnosti paraspinálních svalů: velikost průřezové plochy (cross sectional area; CSA), svalovou denzitu a podíl tukové tkáně neboli tukovou infiltraci (fatty infiltration; FI). Při procesu svalové degenerace dochází ke snížení hodnoty CSA, snížení svalové denzity a zvýšení FI [13,26].
Hodnota CSA může být měřena pomocí UZ, CT i MR. Posuzuje se celková CSA (total CSA) a funkční CSA (functional CSA), která odráží obsah pouze vlastní svalové tkáně a nezahrnuje tukovou tkáň [26].
Denzita svalu se obvykle hodnotí pomocí CT, udává se v Hounsfieldových jednotkách (Hounsfield unit). Nárůst podílu tuku ve svalové tkáni se projevuje snížením denzity v obraze CT [13,27].
Tukovou infiltraci lze kvantitativně vyjádřit např. poměrem funkční CSA a celkové CSA (functional CSA to total CSA ratio), nižší hodnota odráží pokročilejší tukovou degeneraci [26].
V dostupné literatuře nacházíme při hodnocení morfologie paraspinálních svalů značné rozdíly v použitých metodikách, což může být příčinou rozporuplných výsledků. Rovněž posuzování parametrů paraspinálních svalů pouze pomocí axiálního řezu v jediné etáži není reprezentativní pro celou bederní páteř, a proto by tyto svaly měly být hodnoceny standardně ve všech lumbálních etážích [28].
Strukturální změny paraspinálních svalů
Faktory ovlivňující strukturální změny paraspinálních svalů
Struktura paraspinálních svalů je ovlivněna řadou fyziologických proměnných, ke kterým patří zejména věk, pohlaví, index tělesné hmotnosti (body mass index; BMI). Přirozený proces stárnutí vede k degeneraci paraspinálních svalů, při které je svalová tkáň nahrazována nekontraktilní pojivovou a tukovou tkání. Tento proces normálního stárnutí kosterního svalstva se označuje jako sarkopenie [13,21,29].
Několik studií se pokusilo objasnit asociaci mezi degenerací paraspinálních svalů a věkem pacientů. Většinou se shodují v zjištění, že se stoupajícím věkem se hodnota CSA lumbálních paraspinálních svalů snižuje [21,29] a podíl tukové tkáně zvyšuje [21,27,29 – 32].
Několik dalších studií se zabývalo asociací mezi pohlavím a změnami paraspinálních svalů. Hodnoty CSA a svalové denzity jsou dle většiny studií signifikantně vyšší u mužů v porovnání se ženami [21,33] a podíl tukové tkáně je vyšší u ženského pohlaví [21,30,31].
Hodnocen byl i možný vliv hmotnosti pacientů, resp. BMI na vlastnosti paraspinálních svalů. Kalichman et al ve své studii s využitím CT zobrazení dokládají nízkou, ale statisticky významnou negativní korelaci mezi denzitou paraspinálních svalů a BMI [33]. Naproti tomu jiní autoři neprokázali asociaci mezi hmotností pacientů a tukovou infiltrací m. multifidus hodnocenou pomocí MR [25].
Bylo popsáno, že míra tukové infiltrace paraspinálních svalů je u zdravých jedinců ovlivněna také typem svalu a spinální etáží. Lee et al udávají, že tuková infiltrace je výraznější v m. erector spinae ve srovnání s m. multifidus. Začíná v nejnižších lumbálních etážích a šíří se do vyšších etáží [27]. Rovněž další studie potvrdila, že obsah tuku v lumbálních paraspinálních svalech je větší v dolních lumbálních etážích, ale na rozdíl od studie Leeho et al prokázala výraznější postižení m. multifidus ve srovnání s m. erector spinae [30]. K dalším faktorům, které mohou ovlivnit strukturu paraspinálních svalů, patří fyzická aktivita a trénovanost jedince nebo přítomnost komorbidit, např. diabetes mellitus.
Publikované normativní hodnoty CSA a FI se v dostupné literatuře značně liší. Tato diskrepance je nejspíše důsledkem odlišných metodik měření [21,28]. Je zdůrazňována potřeba dalších kvalitních studií pro stanovení referenčních hodnot morfologických parametrů paraspinálních svalů pro různé věkové skupiny, pohlaví a pro každou spinální etáž. Jedině tak bude možné objektivně identifikovat patologickou změnu ve vlastnostech paraspinálních svalů a vyvinout strategie pro prevenci a léčbu degenerativních onemocnění páteře [13].
Strukturální změny paraspinálních svalů u pacientů s nespecifickými LBP
V literatuře existuje stále více důkazů, které poukazují na asociaci mezi degenerativními změnami paraspinálních svalů a nespecifickými LBP [13] (obr. 3A–C). Řada studií referuje u pacientů s chronickou nespecifickou LBP významně nižší hodnoty CSA paraspinálních svalů, zejména m. multifidus [24,34 – 37], a vyšší hodnoty tukové infiltrace [25,36,38]. Také je popisováno, že rozsah degenerativních změn paraspinálních svalů se zvyšuje s délkou trvání symptomů [20]. Jsou však i studie, které nenašly signifikantní asociaci mezi poklesem hodnoty CSA paraspinálních svalů a LBP [38,39] či tukovou infiltrací a LBP [33,35]. Zjištění, že u pacientů s nespecifickou LBP dochází k degenerativním změnám paraspinálních svalů, vedlo několik autorů k hypotéze, že tyto změny mohou být také markerem lokalizované spinální patologie [31]. I když v dostupné literatuře existují důkazy, že degenerativní změny bederní páteře a paraspinálních svalů navzájem souvisí, interpretace výsledků studií s často konfliktními závěry je nadále velmi obtížná [13,31,33,40-42].
Obr. 4. Příklady pacientů s chronickými bolestmi dolní části zad s rozdílnou tukovou degenerací paraspinálních svalů. Axiální T2 vážený obraz MR na úrovni L5. (A) Pacient (22 let) s normálním nálezem v paraspinálních svalech (stupeň 0 dle Gouttalierovy klasifikace). (B) Pacientka (38 let) se střední tukovou degenerací paraspinálních svalů (stupeň 2 dle Gouttalierovy klasifikace). (C) Pacientka (63 let) s těžkou tukovou degenerací paraspinálncíh svalů (stupeň 4 dle Gouttalierovy klasifikace). Fig. 3. Examples of patients with chronic low back pain with different fatty degeneration of paraspinal muscles. Axial T2-weighted MRI images at the level of L5.
(A) Patient (man, 22 years) with normal morphological constitution of paraspinal muscles (grade 0 according to the Goutallier Classification). (B) Patient (woman, 38 years) with moderate fat infiltration and muscle atrophy of paraspinal muscles (grade 2 according to the Goutallier Classification). (C) Patient (woman, 63 years) with severe fat infiltration and muscle atrophy of spinal muscles (grade 4 according to the Goutallier Classification).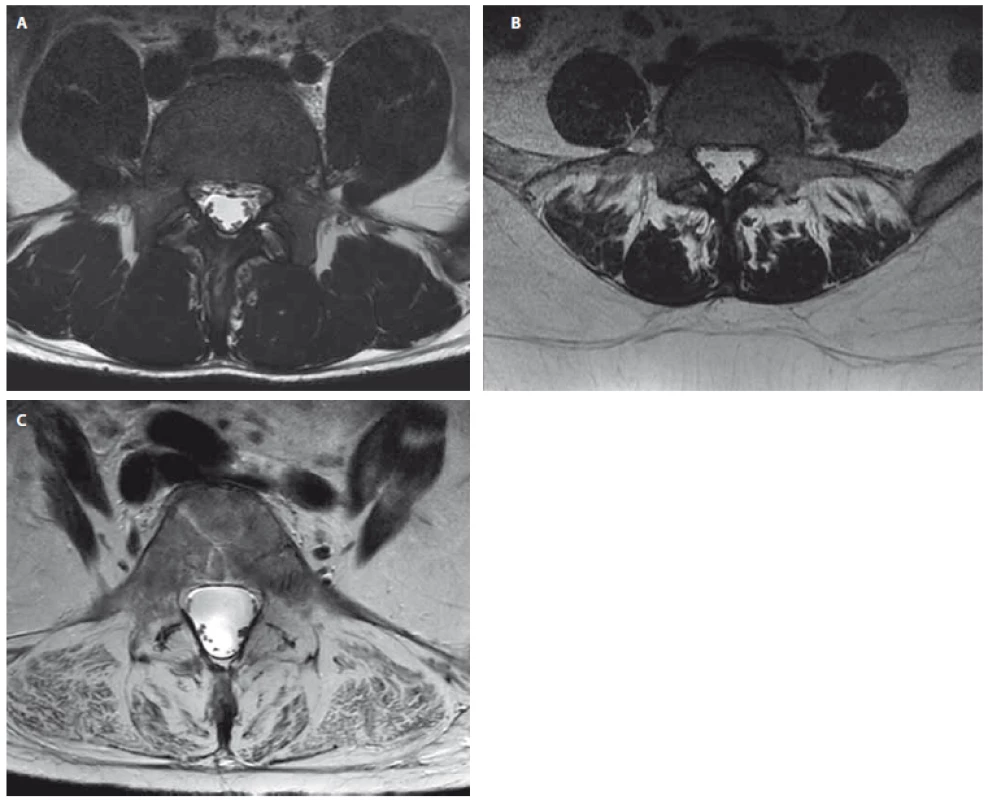
Další metodou, kterou lze využít pro hodnocení procesu degenerace paraspinálních svalů, je svalová biopsie, která ozřejmí mikrostrukturální změny. Studie referují u pacientů s chronickou LBP atrofii vláken typu 2, transformaci typu vláken, a to zvýšené zastoupení vláken typu 2X na úkor vláken typu 1 (což vede ke snížené odolnosti těchto svalů proti únavě), a zvýšený počet nespecifických abnormalit v mikrostruktuře svalové tkáně [13,16,43]. Čím je delší trvání LBP, tím je nižší zastoupení vláken typu 1 a vyšší zastoupení vláken typu 2X v paraspinálních svalech [44].
Efekt cvičení na reverzibilitu degenerativních změn paraspinálních svalů
V souvislosti s asociací mezi degenerativními změnami paraspinálních svalů a LBP vyvstává otázka, zda mohou být tyto změny v paraspinálních svalech do určité míry reverzibilní [13]. Je k dispozici několik studií, ve kterých autoři konstatují možnost zvrácení svalové atrofie a zlepšení svalové síly zádových svalů pomocí efektivního cvičení [45,46]. Hides et al ve své studii prokázali, že specifické posilování m. multifidus společně s podáváním medikamentů u pacientů s akutní LBP je spojeno s menším počtem recidiv bolesti v porovnání se skupinou pacientů, která dostávala pouze medikamentózní léčbu [47]. Z výsledků studií lze tedy usuzovat, že intenzivní cvičební program může zlepšit svalovou sílu, zvýšit hodnoty CSA a svalovou denzitu paraspinálních svalů u pacientů s LBP, a dokonce působit jako důležitý faktor v prevenci recidiv LBP [13,47].
Diferenciální diagnostika strukturálních změn paraspinálních svalů
Změny v paraspinálních svalech asociované s LBP je nutné odlišit od postižení paraspinálních svalů u pacientů s myopatií. Myopatie s postižením paraspinálních svalů se označují jako axiální myopatie. Slabost axiální svalů často vede k abnormální postuře, nicméně část pacientů i přes výraznou axiální myopatii nemá abnormální posturu, což komplikuje diagnostiku. Slabost torakolumbálních svalů může být spojena s tzv. camptocormií (neboli bent spine syndrome, název camptocormie pochází z řeckého názvu – camptos [ohnutí] a cormos [trup]), která se vyznačuje nemožností vzpřímeného postoje při stání a při chůzi, pacient je shrbený, v předklonu. Tato abnormální postura však není fixovaná (na rozdíl od kyfózy) a ustupuje vleže na zádech [48,49]. Slabost krčních paraspinálních svalů (extenzorů) vede k tzv. dropped head syndrome (padání hlavy dopředu) s neschopností udržet hlavu ve vzpřímené pozici. Někdy axiální myopatie mohou být spojeny se syndromem rigidní páteře a kontrakturami. U pacientů s axiální myopatií se často vyskytují také bolesti zad, které jsou popisovány až u 66 % těchto pacientů [50], přičemž invalidizující bolest udává 19,2 % pacientů [48]. Bolest je důsledkem svalové slabosti paraspinálních svalů a abnormální postury, nebyla však prokázána korelace mezi stupněm tukové infiltrace, slabostí paraspinálních svalů a intenzitou bolesti zad [51].
Myopatie s postižením axiálních svalů můžeme rozdělit na 2 skupiny dle přítomnosti postižení i jiných svalových skupin (mimo axiální svaly), a to 1. myopatie s dominantním postižením axiálních svalů a 2. myopatie s výrazným postižením paraspinálních svalů jako součást širšího myopatického postižení (kromě myopatického postižení axiálních svalů je přítomno i postižení jiných svalových skupin obdobné tíže) [52]. Dále jsou podrobněji charakterizovány obě výše definované skupiny axiálních myopatií postihující torakolumbální axiální svaly a jsou k nim přiřazeny jednotlivé myopatie [52].
Myopatie s dominantním postižením axiálních svalů se většinou vyznačují abnormální posturou a jsou do této skupiny řazeny zejména tato onemocnění: SEPN 1 myopatie (myopatie s deficiencí selenoproteinu 1), myopatie při postižení laminu A/ C (AD forma Emeryho Dreifussovy svalové dystrofie), Pompeho nemoc (glykogenóza typu II, bývá přítomna výrazná slabost paraspinálních svalů již na počátku onemocnění), nově popsaná RYR1 myopatie se začátkem v dospělosti (late-onset axial myopathy associated with RYR1 variants), radiací indukovaná myopatie (ozáření může indukovat predominantně axiální myopatii s průměrnou latencí 15 let od ozáření do počátku rozvoje myopatie [53]). Ve všech případech se jedná o velmi vzácné jednotky.
RYR1 myopatie se začátkem v dospělosti je nově popsaná myopatie, která je nyní považována za příčinu camptocormie, jež dříve byla hodnocena jako idiopatická [54]. Mutace je přítomna v genu pro ryanodinový receptor 1, onemocnění se manifestuje v 3. až 7. dekádě života predominantně axiální myopatií s různým stupněm bederní hyperlordózy, scapula alata (z postižení fixátorů lopatky) a/ nebo camptocormií. Bývají přítomny i myalgie, sérová kreatinkináza může být i normální nebo středně zvýšená, častou stížností jsou LBP. MR prokazuje postižení dolních paraspinálních svalů a svalů na zadní straně stehna [54].
Do skupiny myopatií s výrazným postižením paraspinálních svalů jako součást širšího svalového postižení patří zejména Duchennova svalová dystrofie (typická je hyperlordóza, skolióza), facioskapulohumerální dystrofie (FSHD1, u pacientů bývá přítomna camptocormie, postižení paraspinálních svalů může být i prvním příznakem onemocnění), Bethlemova myopatie (porucha podjednotek kolagenu VI, bývá přítomna skolióza, kontraktury a pletencová slabost), pletencové svalové dystrofie (např. dysferlinopatie a kalpainopatie), matrin-3 myopatie, SLONM (sporadická pozdní forma nemalinové [tyčinkové] myopatie). Rovněž u zánětlivých myopatií (myozitida s inkluzními tělísky, jiné zánětlivé myopatie) bývá postižení axiálních svalů manifestující se camptocormií a dropped head.
Posturální abnormity, slabost paraspinálních svalů, jejich tuková infiltrace a atrofie mohou být tedy na jedné straně projevem prostých nespecifických bolestí zad, na druhé straně mohou být způsobeny axiální myopatií. V tab. 2 jsou uvedeny axiální myopatie s možným postižením torakolumbálních paraspinálních svalů se začátkem po 25. roce věku, tedy myopatie, které nejčastěji přichází do úvahy v diferenciální diagnostice tukové degenerace paraspinálních svalů u pacientů s LBP. Z praktického hlediska je potřebné definovat, kdy při LBP a nálezu tukové degenerace paraspinálních svalů pomýšlet na přítomnost axiální myopatie a provádět další vyšetření. Námi navržený diagnostický postup při chronických LBP spojených s tukovou degenerací paraspinálních svalů k vyloučení přítomnosti axiální myopatie je uveden na obr. 4.
Tab. 1. Axiální myopatie s možným postižením lumbálních paraspinálních svalů se začátkem po 25. roce věku (modifikováno dle Wittinga et al [52]). ![Axiální myopatie s možným postižením lumbálních paraspinálních svalů se začátkem po 25. roce věku (modifikováno dle
Wittinga et al [52]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/4af40e191727c698d54d3cd58b0e75cc.png)
AD – autozomálně dominantní; AR – autozomálně recesivní; DK – dolní končetiny; HK – horní končetiny; MGUS –monoklonální gamapatie nejasného významu; LGMD – pletencová svalová dystrofie; RYR1 – ryanodinový receptor 1 Obr. 5. Diagnostický postup při chronických bolestech dolní části zad spojených s tukovou degenerací paraspinálních svalů k vyloučení přítomnosti axiální myopatie.
Fig. 4. Diagnostic algorithm for chronic low back pain associated with degeneration of paraspinal muscles to exclude the presence of axial myopathy.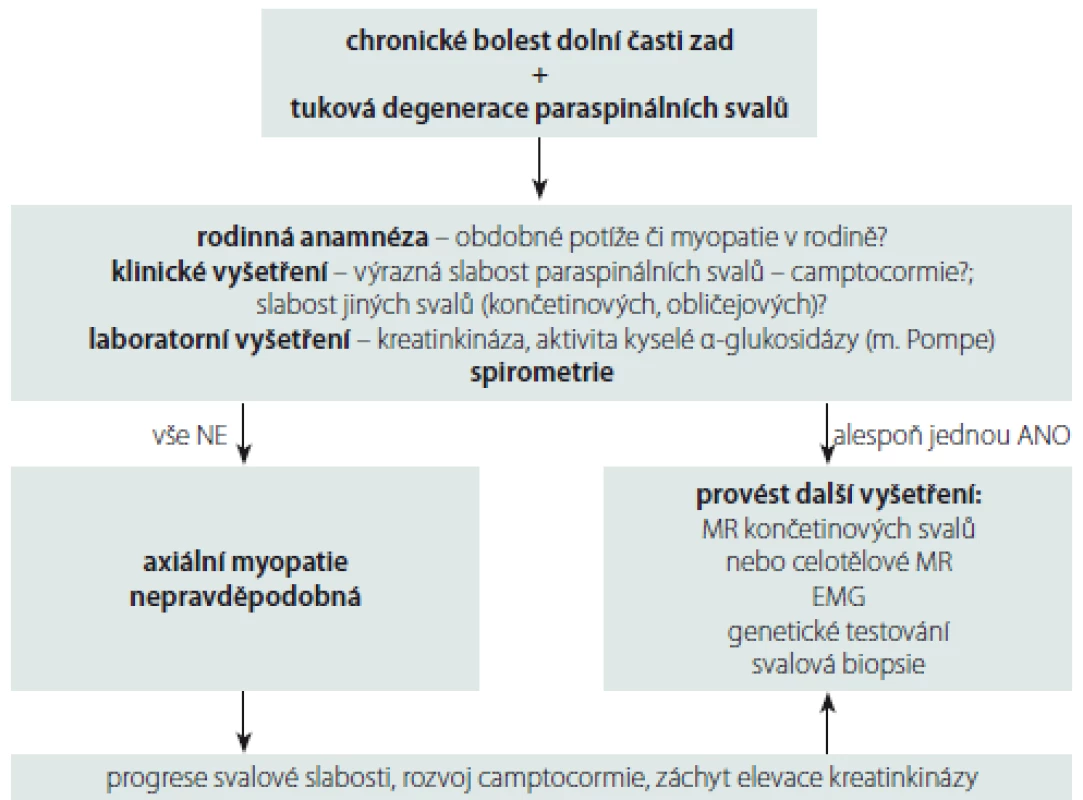
Při podezření na axiální myopatii je důležitá anamnéza vč. rodinné anamnézy a znalost motorického vývoje. Uložení paraspinálních svalů (hluboko podél páteře) a jejich překrytí tukovou vrstvou znesnadňuje klinické vyšetření těchto svalů, takže jejich postižení nemusí být klinicky zřejmé. Rozpoznání přítomnosti axiální myopatie je však relativně snadné, pokud je abnormální postura (bent spine syndrome) nebo těžká atrofie těchto svalů doprovázena postižením svalů v jiné lokalizaci (končetinové svaly, obličejové svaly). Testujeme svalovou sílu jednotlivých svalových skupin, hodnotíme posturu a mobilitu krční a bederní páteře. Z laboratorních vyšetření je vhodné provést vyšetření kreatinkinázy a event. i myoglobinu v séru, dále zjištění aktivity kyselé α‑glukosidázy v suché krevní kapce. Spirometrie pomůže verifikovat slabost respiračních svalů (typicky se vyskytuje např. u adultní formy Pompeho nemoci či SEPN 1 myopatie). Velmi cenné je cílené hodnocení paraspinálních svalů na vyšetření MR bederní páteře, které zobrazí tukovou infiltraci, svalovou atrofii a vizualizuje edém, dále je MR schopna zhodnotit charakteristický vzorec postižení axiálních svalů (odhalit selektivní postižení mediální či laterální skupiny paraspinálních svalů). Např. u pacientů s FSHD bylo popsáno ušetření nejmediálnější vrstvy paraspinálních svalů [52]. MR také pomůže odhalit typickou kombinaci (pattern – vzorec) postižení končetinových a axiální svalů, ze které lze usuzovat, o jakou myopatii se jedná. Svalová biopsie axiálních svalů není v současné době příliš doporučována vzhledem k tomu, že chybí normativní data pro jednotlivé paraspinální svaly [52]. Při podezření na postižení paraspinálních svalů v rámci myopatie může být přínosná EMG, limitací jsou však omezená normativní data pro parametry motorických jednotek paraspinálních svalů a většinou špatná relaxace těchto svalů během vyšetření. Nepostradatelné je také genetické vyšetření.
Závěr
Chronické nespecifické LBP jsou asociovány se strukturálními i funkčními změnami paraspinálních svalů. Morfologické změny, které jsou spojeny se svalovou degenerací, zahrnují tukovou infiltraci a svalovou atrofii. Makroskopické změny lze vyšetřit na CT a zejména na MR, mikroskopické změny pomocí svalové biopsie. Z diferenciálně diagnostického hlediska je nutné změny v paraspinálních svalech asociované s LBP odlišit od postižení paraspinálních svalů u pacientů s axiálními myopatiemi, které jsou však vzácné. V dalším výzkumu je nutné pokračovat v objasnění vztahu LBP – degenerativní změny páteře – degenerace paraspinálních svalů, což je významné pro prevenci i léčbu nespecifických LBP.
Práce byla dále podpořena projektem institucionální podpory FN Brno MZ ČR – RVO (FNBr – 65269705) a projektem specifického výzkumu MUNI/ A/ 1419/ 2018 z programu podpory studentských projektů na Masarykově univerzitě.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Blanka Adamová, Ph.D.
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: adamova.blanka@fnbrno.cz
Přijato k recenzi: 30. 4. 2019
Přijato do tisku: 6. 9. 2019
Zdroje
1. Airaksinen O, Brox JI, Cedraschi C et al. Chapter 4. European guidelines for the management of chronic non--specific low back pain. Eur Spine J 2006; 15 (Suppl 2): S192 – S300.
2. Balagué F, Mannion AF, Pellisé F et al. Non-specific low back pain. Lancet 2012; 379(9814): 482 – 491. doi: 10.1016/ S0140-6736(11)60610-7.
3. Endean A, Palmer KT, Coggon D. Potential of magnetic resonance imaging findings to refine case definition for mechanical low back pain in epidemiological studies: a systematic review. Spine (Phila Pa 1976) 2011; 36(2): 160 – 169. doi: 10.1097/ BRS.0b013e3181cd9adb.
4. Kalichman L, Cole R, Kim DH et al. Spinal stenosis prevalence and association with symptoms: the Framingham Study. Spine J 2009; 9(7): 545 – 550. doi: 10.1016/ j.spinee.2009.03.005.
5. Kalichman L, Kim DH, Li L et al. Computed tomography-evaluated features of spinal degeneration: prevalence, intercorrelation, and association with self-reported low back pain. Spine J 2010; 10(3): 200 – 208. doi: 10.1016/ j.spinee.2009.10.018.
6. Cheung KM, Karppinen J, Chan D et al. Prevalence and pattern of lumbar magnetic resonance imaging changes in a population study of one thousand forty-three individuals. Spine (Phila Pa 1976) 2009; 34(9): 934 – 940. doi: 10.1097/ BRS.0b013e3181a01b3f.
7. Suri P, Hunter DJ, Rainville J et al. Presence and extent of severe facet joint osteoarthritis are associated with back pain in older adults. Osteoarthritis Cartilage 2013; 21(9): 1199 – 1206. doi: 10.1016/ j.joca.2013.05.013.
8. Määttä JH, Wadge S, MacGregor A et al. ISSLS prize winner: vertebral endplate (modic) change is an independent risk factor for episodes of severe and disabling low back pain. Spine (Phila Pa 1976) 2015; 40(15): 1187 – 1193. doi: 10.1097/ BRS.0000000000000937.
9. Mok FP, Samartzis D, Karppinen J et al. Modic changes of the lumbar spine: prevalence, risk factors, and association with disc degeneration and low back pain in a large-scale population-based cohort. Spine J 2016; 16(1): 32 – 41. doi: 10.1016/ j.spinee.2015.09.060.
10. Andrasinova T, Adamova B, Buskova J et al. Is therea correlation between degree of radiologic lumbar spinal stenosis and its clinical manifestation? Clin Spine Surg 2018; 31(8): E403 – E408. doi: 10.1097/ BSD.0000000000000681.
11. Vagaska E, Litavcova A, Srotova I et al. Do lumbar magnetic resonance imaging changes predict neuropathic pain in patients with chronic non-specific low back pain? Medicine (Baltimore) 2019; 98(17): e15377. doi: 10.1097/ MD.0000000000015377.
12. Berg L, Hellum C, Gjertsen Ø et al. Do more MRI findings imply worse disability or more intense low back pain? A cross-sectional study of candidates for lumbar disc prosthesis. Skeletal Radiol 2013; 42(11): 1593 – 1602. doi: 10.1007/ s00256-013-1700-x.
13. Kalichman L, Carmeli E, Been E. The Association between imaging parameters of the paraspinal muscles, spinal degeneration, and low back pain. Biomed Res Int 2017; 2017 : 2562957. doi: 10.1155/ 2017/ 2562957.
14. Feneis H. Anatomický obrazový slovník. 4. vyd. Praha: Avicenum 1981.
15. Bednařík J, Lukáš Z. Základy anatomie a funkce kosterního svalstva. In: Bednařík J (ed). Nemoci kosterního svalstva. Praha: Triton 2001 : 23 – 38.
16. Mannion AF. Fibre type characteristics and function of the human paraspinal muscles: normal values and changes in association with low back pain. J Electromyogr Kinesiol 1999; 9(6): 363 – 377.
17. Agten A, Verbrugghe J, Stevens S et al. Feasibility, accuracy and safety of a percutaneous fine-needle biopsy technique to obtain qualitative muscle samples of the lumbar multifidus and erector spinae muscle in persons with low back pain. J Anat 2018; 233(4): 542 – 551. doi: 10.1111/ joa.12867.
18. Freeman MD, Woodham MA, Woodham AW. The role of the lumbar multifidus in chronic low back pain: a review. PM R 2010; 2(2): 142 – 146. doi: 10.1016/ j.pmrj.2009.11.006.
19. Nicholas MK, Linton SJ, Watson PJ et al. Early identification and management of psychological risk factors („yellow flags“) in patients with low back pain: a reappraisal. Phys Ther 2011; 91(5): 737 – 753. doi: 10.2522/ ptj.20100224.
20. Wan Q, Lin C, Li X et al. MRI assessment of paraspinal muscles in patients with acute and chronic unilateral low back pain. Br J Radiol 2015; 88(1053): 20140546. doi: 10.1259/ bjr.20140546.
21. Sasaki T, Yoshimura N, Hashizume H et al. MRI-defined paraspinal muscle morphology in Japanese population: The Wakayama Spine Study. PLoS One 2017; 12(11): e0187765. doi: 10.1371/ journal.pone.0187765.
22. Goubert D, Oosterwijck JV, Meeus M et al. Structural Changes of lumbar muscles in non-specific low back pain: a systematic review. Pain Physician 2016; 19(7): E985 – E1000.
23. Goutallier D, Postel JM, Bernageau J et al. Fatty muscle degeneration in cuff ruptures. Pre - and postoperative evaluation by CT scan. Clin Orthop Relat Res 1994; (304): 78 – 83.
24. Kader DF, Wardlaw D, Smith FW. Correlation between the MRI changes in the lumbar multifidus muscles and leg pain. Clin Radiol 2000; 55(2): 145 – 149. doi: 10.1053/ crad.1999.0340.
25. Kjaer P, Bendix T, Sorensen JS et al. Are MRI-defined fat infiltrations in the multifidus muscles associated with low back pain? BMC Med 2007; 5 : 2. doi: 10.1186/ 1741-7015-5-2.
26. Upadhyay B, Toms AP. CT and MRI evaluation of paraspinal muscle degeneration. Poster ECR 2015/ C-2114. doi: 10.1594/ ecr2015/ C-2114.
27. Lee SH, Park SW, Kim YB et al. The fatty degeneration of lumbar paraspinal muscles on computed tomography scan according to age and disc level. Spine J 2017; 17(1): 81 – 87. doi: 10.1016/ j.spinee.2016.08.001.
28. Urrutia J, Besa P, Lobos D et al. Is a single-level measurement of paraspinal muscle fat infiltration and cross--sectional area representative of the entire lumbar spine? Skeletal Radiol 2018; 47(7): 939 – 945. doi: 10.1007/ s00256-018-2902-z.
29. Takayama K, Kita T, Nakamura H et al. New Predictive index for lumbar paraspinal muscle degeneration associated with aging. Spine (Phila Pa 1976) 2016; 41(2): E84 – E90. doi: 10.1097/ BRS.0000000000001154.
30. Crawford RJ, Filli L, Elliott JM et al. Age - and level-dependence of fatty infiltration in lumbar paravertebral muscles of healthy volunteers. AJNR Am J Neuroradiol 2016; 37(4): 742 – 748. doi: 10.3174/ ajnr.A4596.
31. Urrutia J, Besa P, Lobos D et al. Lumbar paraspinal muscle fat infiltration is independently associated with sex, age, and inter-vertebral disc degeneration in symptomatic patients. Skeletal Radiol 2018; 47(7): 955 – 961. doi: 10.1007/ s00256-018-2880-1.
32. Shahidi B, Parra CL, Berry DB et al. Contribution of lumbar spine pathology and age to paraspinal muscle size and fatty infiltration. Spine (Phila Pa 1976) 2017; 42(8): 616 – 623. doi: 10.1097/ BRS.0000000000001848.
33. Kalichman L, Hodges P, Li L et al. Changes in paraspinal muscles and their association with low back pain and spinal degeneration: CT study. Eur Spine J 2010; 19(7): 1136 – 1144. doi: 10.1007/ s00586-009-1257-5.
34. Barker KL, Shamley DR, Jackson D. Changes in the cross-sectional area of multifidus and psoas in patients with unilateral back pain: the relationship to pain and disability. Spine (Phila Pa 1976) 2004; 29(22): E515 – E519. doi: 10.1097/ 01.brs.0000144405.11661.eb.
35. Danneels LA, Vanderstraeten GG, Cambier DC et al. CT imaging of trunk muscles in chronic low back pain patients and healthy control subjects. Eur Spine J 2000; 9(4): 266 – 272. doi: 10.1007/ s005860000190.
36. Parkkola R, Rytökoski U, Kormano M. Magnetic resonance imaging of the discs and trunk muscles in patients with chronic low back pain and healthy control subjects. Spine (Phila Pa 19756) 1993; 18(7): 830 – 836. doi: 10.1097/ 00007632-199306000-00004.
37. Fortin M, Macedo LG. Multifidus and paraspinal muscle group cross-sectional areas of patients with low back pain and control patients: a systematic review with a focus on blinding. Phys Ther 2013; 93(7): 873 – 888. doi: 10.2522/ ptj.20120457.
38. Teichtahl AJ, Urquhart DM, Wang Y et al. Fat infiltration of paraspinal muscles is associated with low back pain, disability, and structural abnormalities in community-based adults. Spine J 2015; 15(7): 1593 – 1601. doi: 10.1016/ j.spinee.2015.03.039.
39. D‘hooge R, Cagnie B, Crombez G et al. Increased intramuscular fatty infiltration without differences in lumbar muscle cross-sectional area during remission of unilateral recurrent low back pain. Man Ther 2012; 17(6): 584 – 588. doi: 10.1016/ j.math.2012.06.007.
40. Özcan-Ekşi EE, Ekşi MŞ, Akçal MA. Severe lumbar intervertebral disc degeneration is associated with modic changes and fatty infiltration in the paraspinal muscles at all lumbar levels, except for L1 – L2: a cross-sectional analysis of 50 symptomatic women and 50 age-matched symptomatic men. World Neurosurg 2019; 122: e1069-e1077. doi: 10.1016/ j.wneu.2018.10.229.
41. Chen YY, Pao JL, Liaw CK et al. Image changes of paraspinal muscles and clinical correlations in patients with unilateral lumbar spinal stenosis. Eur Spine J 2014; 23(5): 999 – 1006. doi: 10.1007/ s00586-013-3148-z.
42. Jiang J, Wang H, Wang L et al. Multifidus degeneration, a new risk factor for lumbar spinal stenosis: a case--control study. World Neurosurg 2017; 99 : 226 – 231. doi: 10.1016/ j.wneu.2016.11.142.
43. Demoulin C, Crielaard JM, Vanderthommen M. Spinal muscle evaluation in healthy individuals and low-back-pain patients: a literature review. Joint Bone Spine 2007; 74(1): 9 – 13. doi: 10.1016/ j.jbspin.2006.02.013.
44. Mannion AF, Käser L, Weber E et al. Influence of age and duration of symptoms on fibre type distribution and size of the back muscles in chronic low back pain patients. Eur Spine J 2000; 9(4): 273 – 281. doi: 10.1007/ s005860000189.
45. Storheim K, Holm I, Gunderson R et al. The effect of comprehensive group training on cross-sectional area, density, and strength of paraspinal muscles in patients sick-listed for subacute low back pain. J Spinal Disord Tech 2003; 16(3): 271 – 279.
46. Keller A, Brox JI, Gunderson R et al. Trunk muscle strength, cross-sectional area, and density in patients with chronic low back pain randomized to lumbar fusion or cognitive intervention and exercises. Spine (phila Pa 1976) 2004; 29(1): 3 – 8. doi: 10.1097/ 01.BRS.0000103946.26548.EB.
47. Hides JA, Jull GA, Richardson CA. Long-term effects of specific stabilizing exercises for first-episode low back pain. Spine (Phila Pa 1976) 2001; 26(11): E243 – E248. doi: 10.1097/ 00007632-200106010-00004.
48. Ghosh PS, Milone M. Camptocormia as presenting manifestation of a spectrum of myopathic disorders. Muscle Nerve 2015; 52(6): 1008 – 1012. doi: 10.1002/ mus.24689.
49. Gáti I, Danielsson O, Gunnarsson C et al. Bent spine syndrome: a phenotype of dysferlinopathy or a symptomatic DYSF gene mutation carrier. Eur Neurol 2012; 67(5): 300 – 302. doi: 10.1159/ 000336265
50. Laroche M, Cintas P. Bent spine syndrome (camptocormia): a retrospective study of 63 patients. Joint Bone Spine 2010; 77(6): 593-596. doi: 10.1016/ j.jbspin.2010.05.012.
51. Dahlqvist JR, Vissing CR, Thomsen C et al. Severe paraspinal muscle involvement in facioscapulohumeral muscular dystrophy. Neurology 2014; 83(13): 1178 – 1183. doi: 10.1212/ WNL.0000000000000828.
52. Witting N, Andersen LK, Vissing J. Axial myopathy: an overlooked feature of muscle diseases. Brain 2016; 139 (Pt 1): 13 – 22. doi: 10.1093/ brain/ awv332.
53. Ghosh PS, Milone M. Clinical and laboratory findings of 21 patients with radiation-induced myopathy. J Neurol Neurosurg Psychiatry 2015; 86(2): 152 – 158. doi: 10.1136/ jnnp-2013-307447.
54. Løseth S, Voermans NC, Torbergsen T et al. A novel late-onset axial myopathy associated with mutations in the skeletal muscle ryanodine receptor (RYR1) gene. J Neurol 2013; 260(6): 1504 – 1510. doi: 10.1007/ s00415-012-6817-7.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2019 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Kompresivní neuropatie jako nemoc z povolání
- Refrakterní myastenia gravis – klinická charakteristika a možnosti biologické léčby
- Úloha pohybovej aktivity v liečbe pacientov s Parkinsonovou chorobou
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Léčba nespavosti při neuropatické bolesti
- Význam kolaterální cirkulace u akutní okluze arteria basilaris
- Jiný pohled na inhibitor agregace krevních destiček klopidogrel – vhodné antiedematikum v předklinickém modelu poranění mozku?
- Možnosti stanovení likvorového tripletu tau proteinů a β-amyloidu 42 metodami ELISA a orientační normativní vodítka
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
- CRP stanovený vysoce senzitivní metodou u pacientů s ichemickou cévní mozkovou příhodou – od rizikových faktorů po vývoj
- Pegylovaný interferon beta 1-a v klinické praxi
- Kongenitální fibróza zevních okohybných svalů u české rodiny a její molekulárně genetická příčina
- Rozsáhlý cervikální hematom po minimálním traumatu
- Perinatální paréza brachiálního plexu na podkladě avulze, řešená konzervativně
- Plicní arteriovenózní malformace jako vzácná příčina ischemické cévní mozkové příhody
- Akutní amnestický syndrom při bilaterální lézi hipokampů jako raritní projev CMP
- Perforace jícnu způsobená dislokovanou krční dlahou pět let po operaci krční páteře – vzácná komplikace
- Závažné vaskulopatie u neurofibromatózy typu 1
- Simultánní vícečetné intracerebrální hemoragie
- Analýza dat v neurologii LXXVII. Korelační analýza vícerozměrných souborů kvantitativních dat – příklady
- Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba nespavosti při neuropatické bolesti
- Kompresivní neuropatie jako nemoc z povolání
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



