-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam kolaterální cirkulace u akutní okluze arteria basilaris
The importance of collateral circulation in acute basilar artery occlusion
Aim: We evaluated the prognostic value of a radiological Basilar Artery on Computed Tomography Angiography (BATMAN) score in patients with acute arterial basilaris occlusion (BAO).
Methods: We retrospectively analyzed clinical and imaging data of consecutive endovascular therapy-treated patients with BAO in our stroke unit between 2006 – 2018. The diagnosis of BAO was made on CTA. BATMAN score is a 10-point CTA-based grading system. Good outcome was defined as a modified Rankin Scale score of 0 – 3 within 3 months.
Results: We included 67 patients (37 men) with BAO treated with endovascular therapy (mechanical thrombectomy): mean age 63 years (range 31 – 82 years), median National Institutes of Health Stroke Scale (NIHSS) 16; and interquartile range 2 – 36. Succesful recanalization modified as Thrombolysis in Cerebral Infarction (TICI) 2b-3 was achieved in 91% (61/ 67) of patients. Multivariate logistic regression analysis identified BATMAN score ≤ 7 (OR 27.59; 95% CI 5.78 – 131.81; P = 0.001) and initial NIHSS ≥ 10 (OR 9.62; 95% CI 1.47 – 63.10; P = 0.0183) as independent predictors of poor outcome.
Conclusion: The BATMAN score demonstrated its ability to predict severe disability and death after BAO despite endovascular reperfusion therapies.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 19. 7. 2019
Přijato do tisku: 21. 8. 2019
侧支循环在急性基底动脉阻塞中的重要性
目的:我们评估了放射基底动脉对急性基底动脉阻塞(BAO)患者的ct血管成像(BATMAN)评分的预后价值。
方法:我们回顾性分析了2006 - 2018年期间在我们卒中单元连续进行血管内治疗的BAO患者的临床和影像学资料。BAO的诊断是在CTA上做出的。BATMAN 分数是一个基于cta的10分制评分系统。好结果定义为3个月内修改Rankin评分0 - 3分。
结果:我们纳入67例(37名男性)鲍接受血管内治疗(机械血栓切除术)的患者:平均年龄63岁(范围31 - 82岁),中位国家卫生研究院卒中量表(NIHSS) 16;四分位数范围为2 - 36。脑梗死(TICI) 2b-3再通改良溶栓成功91%(61/ 67)。多元逻辑回归分析确定BATMAN得分≤7(OR 27.59; 95%CI 5.78 – 131.81; P = 0.001)和初始NIHSS≥10(OR 9.62; 95%CI 1.47 – 63.10; P = 0.0183)作为不良结果的独立预测因子。
结论:尽管进行了血管内再灌注治疗,BATMAN评分也证明了其能够预测BAO后严重残疾和死亡的能力。
关键词:基底动脉闭塞–侧支循环–血管内治疗 – BATMAN评分
Keywords:
basilar artery occlusion – collateral circulation – endovascular therapy – BATMAN score
Autori: M. Tinková 1; P. Malý 1; H. Parobkova 2; O. Bradáč 1
Pôsobisko autorov: Ústav klinických neurooborů, Komplexní cerebrovaskulární centrum, – neurologické a neurochirurgické, oddělení, ÚVN a VFN, Praha ; Radiodiagnostické oddělení, ÚVN a VFN, Praha 2
Vyšlo v časopise: Cesk Slov Neurol N 2019; 82(5): 518-525
Kategória: Původní práce
doi: https://doi.org/10.14735/amcsnn2019518Súhrn
Cíl: Cílem naší práce je posoudit prognostickou hodnotu radiologického Basilar Artery on Computed Tomography Angiography (BATMAN) skóre u akutního uzávěru arteria basilaris (AB).
Soubor a metodika: Retrospektivně byl analyzován soubor pacientů s akutním uzávěrem AB léčených na iktové jednotce ÚVN v Praze v letech 2006 – 2018. Uzávěr AB byl vždy verifikovan podle CTA. BATMAN skóre je 10stupňové hodnocení zahrnující lokalizaci uzávěru AB a přítomnost kolaterál. Výsledný klinický stav byl posuzován s odstupem 90 dnů podle modifikované Rankinovy škály (mRS) a hodnocen jako dobrý při mRS 0 – 3.
Výsledky: Soubor zahrnoval 67 pacientů (37 mužů) průměrného věku 63 (31 – 82) let. Průměrné National Institutes of Health Stroke Scale (NIHSS) bylo 16; v rozmezí 2 – 36. Úspěšné rekanalizace Thrombolysis in Cerebral Infarction (TICI) 2b-3 bylo dosaženo u 91 % (61/ 67) pacientů. Multivarietní regresní analýza prokázala BATMAN skóre ≤ 7 (OR 27,59; 95% CI 5,78 – 131,81; p = 0,001) a vstupní NIHSS ≥ 10 (OR 9,62; 95% CI 1,47 – 63,10; p = 0,0183) jako nezávislé prediktory špatného výsledného klinického stavu.
Závěr: Hodnocení BATMAN skóre umožňuje predikovat špatný výsledný klinický stav u pacientů s akutním uzávěrem AB léčených mechanickou trombektomií.
Klíčová slova:
okluze arteria basilaris – kolaterální cirkulace – endovaskulární terapie – BATMAN skóre
Úvod
Akutní okluze arteria basilaris (AB) je devastující onemocnění [1 – 6], při konvenční antitrombotické léčbě dosahovala úmrtnost 90 – 100 % [7 – 18]. Intravenózní trombolýza (IVT) vedla k signifikantně lepším výsledkům, mortalita klesla na 40 – 60 % [15,16,19]. V současnosti je doporučovanou formou léčby IVT v kombinaci s endovaskulární terapií – mechanickou trombektomií [5,20 – 23].
Příčinou akutního uzávěru AB může být lokální trombóza nebo artery-to-artery tromboembolizmus aterosklerotické etiologie, dále embolizace při fibrilaci síní nebo z dominantní arteria vertebralis [6,24,25]. U mladších nemocných je etiologicky nutno pomýšlet na disekci arteria vertebralis, která může přecházet na AB [24,26,27]. U disekce je typickým průvodným příznakem silná bolest krční páteře. Příznaky bývají fluktující, měnlivé, pomalu progredující i po více dnů. V anamnéze těchto nemocných je často úraz krku nebo chiropraktická manipulace.
Klinický obraz akutního uzávěru AB je neobyčejně pestrý a mnohotvárný s plurifokalitou a bilateralitou příznaků v důsledku uzávěru paramediálních větví bazilární tepny zásobujících struktury mozkového kmene oboustranně podél střední čáry [28]. Podle klinického průběhu a začátku onemocnění lze uzávěr AB rozdělit na tři typy [6,25]:
- Náhlý začátek s těžkou motorickou a bulbární symptomatologií, kvadruplegií, oftalmoplegií a poruchou vědomí. Stavy vedoucí ke kómatu během prvních hodin mají 85 – 100% mortalitu [24,28]. Příčina je většinou kardioembolická a je postižen spíše střední a distální úsek AB [6].
- Postupně progredující nebo kolísavý průběh se symptomy ze zadní cirkulace: dysartrie, vertigo, nauzea, zvracení, parestezie končetin, okohybné poruchy a motorické výpadky ve smyslu přechodné hemiparézy s vývojem do kvadruparézy, která je téměř vždy asymetrická. Etiologie je častěji aterotrombotická [6,29].
- Tranzitorní prodromy (diplopie, dysartrie, vertigo, parestezie) několik dní až týdnů před následným monofazickým průběhem uzávěru AB. Etiologie rovněž spíše aterotrombotická [29].
U akutních uzávěrů ve vertebrobazilárním povodí je terapeutické okno výrazně delší (není přesně časově vymezeno) než v přední cirkulaci [6,30 – 32], může být 24 – 72 h od začátku příznaků, pokud jde o postupnou progresi nálezu a pokud koma netrvá déle než 2 h [24]. IVT lze podat i po 4,5 h od vzniku iktu, podle odborného konsenzu může být zvažována až do 24 h [33,34]. Endovaskulární léčba zahrnuje intraarteriální trombolýzu, mechanickou trombektomii a stenting. Mechanická intervence má nejvyšší šanci na úspěšnou rekanalizaci, dobrého klinického výsledku bývá dosaženo podle různých studií v 35 – 45 % případů [33].
Zásadní roli pro dosažení dobrého výsledného klinického stavu má kolaterální cirkulace, zejména obě zadní komunikanty, které při akutním uzávěru AB přivádějí krev z karotického řečiště. Tzv. tektální plexus tvoří anastomózy na úrovni tentoria mezi zadní komunikantou a horními mozečkovými tepnami [35,36]. Jedno - nebo oboustranná absence arteria communicans posterior (PCOMA) je považována za nejsilnější prediktor špatného výsledného klinického stavu (OR 6,8; 95% CI 2 – 21; p = 0,001) [1].
Na význam kolaterální cirkulace při akutním iktu upozornila řada studií zabývající se problematikou akutního uzávěru v předním karotickém povodí [6,7,15,35 – 40]. Dobrá kolaterální cirkulace významně prodlužuje terapeutické okno a činí viabilní oblast penumbry, na jejíž záchranu se zaměřují všechny rekanalizační výkony. V současnosti je zachovalá kolaterální cirkulace považována za zásadní prognostický faktor pro výsledný dobrý klinický stav [7,15,37,38,41 – 46]. Tito pacienti mají rovněž menší riziko hemoragických komplikací [47 – 49]. Rozsah kolaterální cirkulace může být významným faktorem při rozhodování o způsobu léčby, špatný kolaterální oběh definuje pacienty, kteří pravděpodobně nebudou profitovat z revaskularizační terapie [41,44] a u kterých dochází k ireverzibilním ischemickým změnám časněji [50].
Při vzniku ischemie ve vertebrobazilárním povodí jsou pro život nemocného důležité kromě výše zmíněných zadních komunikant i kolaterály mezi horními a dolními mozečkovými tepnami a penetrující pontinní větve AB [35]. Někdy se mohou plnit zadní mozkové a horní mozečkové tepny přes terminální části některé z větví arteria cerebri media [6,25]. Pomalu narůstající trombózy působí stimulačně na otevírání kolaterál, naopak embolie i do intaktních tepen má obvykle horší průběh, protože kompenzační oběhy se nestačí otevřít [38]. Na význam kolaterální cirkulace při akutním uzávěru AB upozornil již Tobias Brandt z Heidelbergu v roce 1996. Kolateralizační skóre bylo hodnoceno ve čtyřech kategoriích: 0 – žádné; 1 – minimální (chabé plnění anterográdně i retrográdně); 2 – anterográdní nebo retrográdní plnění obou arteriae cerebellares superiores; 3 – kompletní anterográdní a retrográdní kolateralizace [37].
V současnosti existuje několik skórovacích systémů na hodnocení kolaterální cirkulace v zadním povodí:
- Posterior circulation collateral score [51]. Jedná se o 10bodové skóre, které z CTA hodnotí přítomnost posterior inferior cerebellar artery, anterior inferior cerebellar arteries (AICAs), superior cerebellar arteries (SCAs) a PCOMAs. Byla nalezena signifikantní asociace mezi dobrým stavem kolaterální cirkulace (zejm. přítomností PCOMAs) a výsledným dobrým klinickým stavem.
- Posterior circulation CTA score [13], které definuje kolaterální cirkulaci takto: 0 – nepřítomnost PCOMA; 1 – pouze jednostranná PCOMA; 2 – oboustranná přítomnost PCOMAs. Pacienti s oboustranně přítomnými zadními komunikantami měli méně závažný iktus ve srovnání s těmi, kteří měli pouze jednu nebo žádnou PCOMA (median National Institutes of Health Stroke Scale [NIHSS] 18 vs. 27 bodů; p = 0,261). Funkční nezávislost dle modifikované Rankinovy škály (mRS) 0 – 3 byla u pacientů s dobrým kolaterálem 72 vs. 0 % (p = 0,001).
- Basilar Artery on Computed Tomography Angiography (BATMAN) score.
Studie autorů Alemseged et al [1] zahrnovala soubor 83 pacientů léčených v letech 2005 – 2016 v Melbourne, který byl validován se souborem 41 pacientů léčených v Newcastlu a v Římě. Hodnocena byla přítomnost arteria vertebralis, proximálního, středního a distálního úseku AB, obou arterií cerebri posteriores a obou zadních komunikant. Přítomnost obou PCOMA je hodnocena čtyřmi body, přítomnost obou nebo jedné arterie vertebralis pouze jedním bodem (obr. 1). Skóre takto odráží důležitost jednotlivých tepen v kolaterálním zásobení. Maximální dosažená hodnota, tj. zachovalý průtok celým zadním řečištěm, je 10 bodů. Pacienti s nízkou hodnotou BATMAN mají menší pravděpodobnost dosažení dobrého výsledného klinického stavu, a to i v případě úspěšné rekanalizace. Pacienti s vysokými hodnotami mohou dopadnout dobře, a to i v případě, že jsou rekanalizováni v delším časovém intervalu od vzniku symptomů, tj. po 6 a více hodinách. Obráceně, nepříznivé BATMAN skóre ≤ 7 identifikuje pacienty, kteří pravděpodobně nebudou profitovat z reperfuzní terapie.
Obr. 1. Basilar Artery on Computed Tomography Angiography (BATMAN) skóre, které zahrnuje důležitost daného segmentu. Podle Alemseged et al [1]. AICA – arteria cerebelli inferior anterior; AB – arteria basilaris (3 b); PCA – arteria cerebri posterior (2 b); PCom – arteria communicans posterior (4 b); SCA – arteria cerebelli superior; VA – arteria vertebralis (1 b)
Fig. 1. Basilar Artery on Computed Tomography Angiography (BATMAN) score that includes the importance of the segment. According to Alemseged et al. [1]. AICA – anterior inferior cerebellar artery; AB – basilar artery (3 p); PCA – posterior cerebral artery (2 p); PCom – posterior communicating artery (4 p); SCA – superior cerebellar artery; VA – vertebral artery (1 p)![Basilar Artery on Computed Tomography
Angiography (BATMAN) skóre,
které zahrnuje důležitost daného segmentu.
Podle Alemseged et al [1].
AICA – arteria cerebelli inferior anterior; AB –
arteria basilaris (3 b); PCA – arteria cerebri
posterior (2 b); PCom – arteria communicans
posterior (4 b); SCA – arteria cerebelli superior;
VA – arteria vertebralis (1 b)<br>
Fig. 1. Basilar Artery on Computed Tomography
Angiography (BATMAN) score that
includes the importance of the segment.
According to Alemseged et al. [1].
AICA – anterior inferior cerebellar artery;
AB – basilar artery (3 p); PCA – posterior cerebral
artery (2 p); PCom – posterior communicating
artery (4 p); SCA – superior cerebellar
artery; VA – vertebral artery (1 p)](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/581825352575dbe45a67a5d82f238c91.png)
Tato skórovací schémata mají význam jako prediktory funkčního výsledku a jsou nápomocná při selekci pacientů vhodných pro endovaskulární terapii [25].
Cílem naší studie je ověření prognostické validity BATMAN skóre u pacientů s akutním uzávěrem AB.
Soubor a metodika
V období od ledna 2006 do prosince 2018 bylo na neurologickém oddělení ÚVN v Praze endovaskulárně řešeno 72 pacientů s akutním uzávěrem AB (s příznaky trvajícími do 24 h). Do hodnoceného souboru nebylo zařazeno pět pacientů: u čtyř došlo k závažným periprocedurálním komplikacím s masivním subarachnoidálním a intracerebrálním krvácením a následnou mozkovou smrtí. U jednoho pacienta s příznivými vstupními faktory (Glasgow Coma Scale [GCS] 15, úspěšná rekanalizace) bylo komplikací výkonu hyperperfuzní krvácení v důsledku současného stentingu okludované AB a stenotické arteria carotis interna. Hodnocený soubor zahrnoval celkem 67 nemocných (37 mužů) průměrného věku 63 roku (31 – 80 let). Průměrné NIHSS bylo 16; v rozmezí 2 – 36. U pacientů léčených do roku 2009 bylo použito Merci retriever (Concentric Medical, Mountain View, CA, USA) stentů, v následujících letech stentů Solitare (Covidien, Mansfield, MA, USA).
Tabulka 1 ukazuje demografické faktory: věk, pohlaví, rizikové faktory CMP (hypertenze, diabetes mellitus, fibrilace síní, ischemická choroba srdeční, kouření, hyperlipidemie, anamnéza tranzitorní ischemické ataky nebo CMP), subtyp ischemické CMP podle The Trial of org 10172 in Acute Stroke Treatment classification (TOAST), vstupní NIHSS, GCS, glykemii a krevní tlak. Jako komatózní při příjmu byli označeni pacienti se vstupním GCS 3 – 7.
Tab. 1. Charakteristika souboru – demografi cké a rizikové faktory, vstupní hodnoty (NIHSS, glykémie, GCS) a TOAST klasifikace. 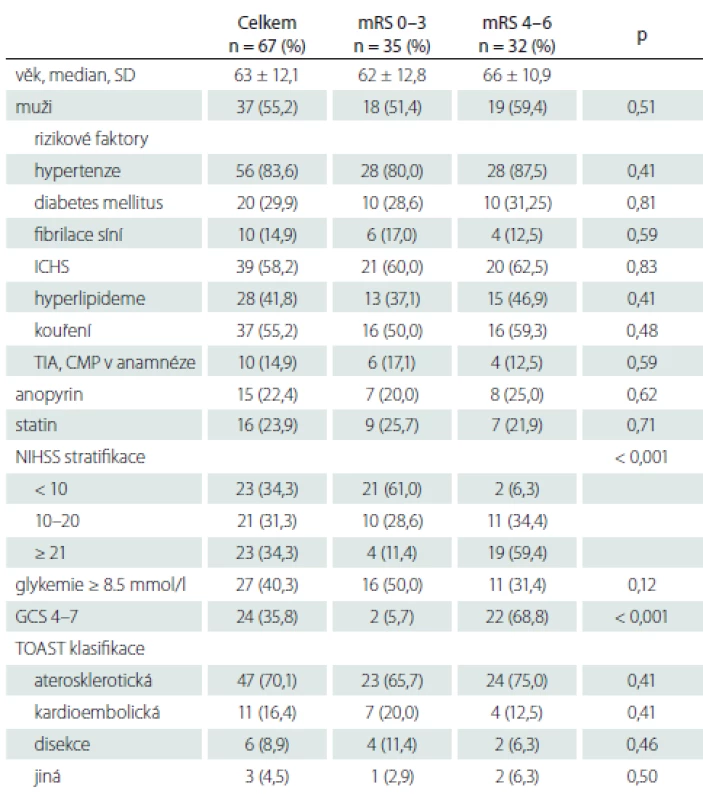
AS – aterosklerotická; GCS – Glasgow Coma Scale; ICHS – ischemická choroba srdeční; mRS – modifikovaná Rankinova škála; n – počet; NIHSS – National Institutes of Health Stroke Scale; TIA – tranzitorní ischemická ataka, TOAST – Trial of Org 10172 in Acute Stroke Treatment; SD – směrodatná odchylka Tabulka 2 ukazuje způsob léčby – IVT, mechanická trombektomie, stenting, provedení výkonu v celkové nebo lokální anestezii, čas od vzniku obtíží do výsledné rekanalizace, komplikace typu parenchymového hematomu typ 1 a 2, BATMAN skóre. Výsledná rekanalizace hodnocena pomocí Thrombolysis in Cerebral Infarction (TICI) klasifikace, TICI 2b-3 hodnoceno jako úspěšná rekanalizace [52]. Parenchymový hematom hodnocen podle Europeran Cooperative Acute Stroke Study (ECASS) II. [53] následovně: parenchymové krvácení (PH)-1 jako hematom ≤ 30 % infarktového ložiska s mírným expanzivním chováním; PH-2 definován jako hematom > 30 % oblasti infarktu s mass efektem na kontrolním CT provedeném do 24 h po výkonu. Výsledný klinický stav byl posuzován s odstupem 90 dnů a hodnocen jako dobrý při mRS 0 – 3.
Tab. 2. Způsob léčby, výsledná rekanalizace TICI 2b-3, čas od vzniku obtíží do rekanalizace, typ narkózy, BATMAN skóre u pacientů s dobrým a špatným klinickým výsledkem. 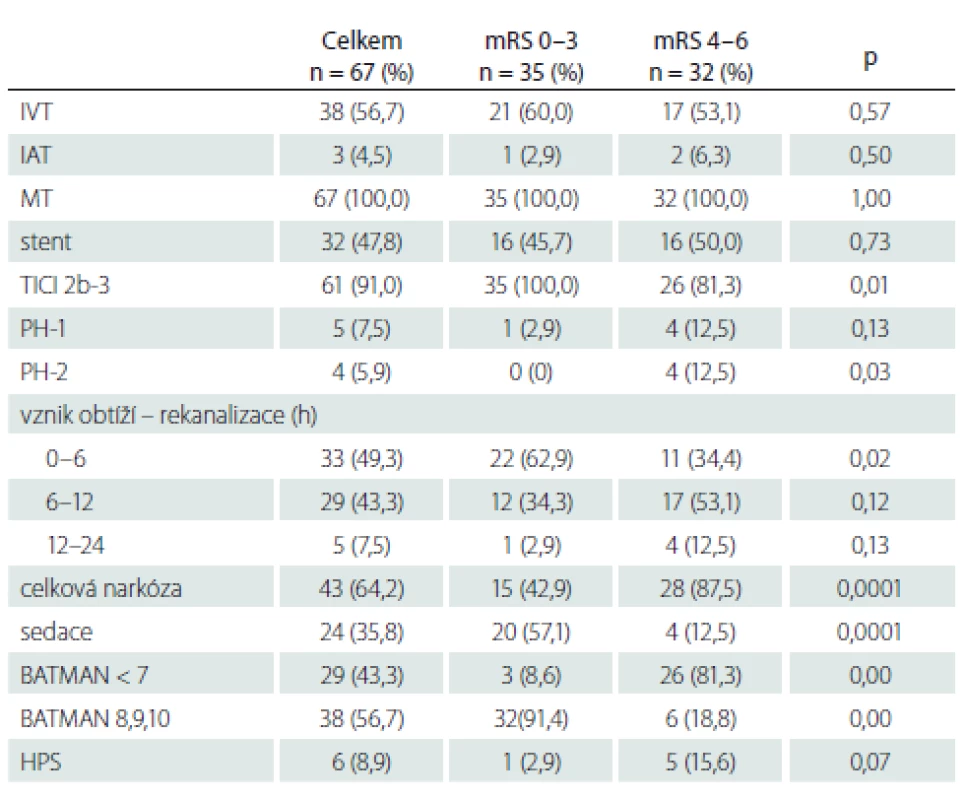
BATMAN – Basilar Artery on Computed Tomography Angiography; HPS – hyperperfuzní syndrom; IAT – intraarteriální trombolýza; IVT – intravenózní trombolýza; mRS – modifikovaná Rankinova škála; MT – mechanická trombektomie; n – počet; PH – parenchymový hematom; TICI – Thrombolysis in Cerebral Infarction Zobrazovací analýza
Kolaterální cirkulace byla hodnocena pomocí BATMAN skóre na CTA. Vertebrobazilární povodí je rozděleno do 6 segmentů:
- 1 bod pro arterii vertebralis;
- 1 bod pro každý segment AB: proximální od vertebrobazilární junkce po začátek AICA, střední od začátku AICA do SCA a distální, od začátku SCA do vrcholu AB;
- 1 bod pro každou pro každý P1 segment PCOMA (obr. 2).
Obr. 2. Pacient s Basilar Artery on Computed Tomography Angiography skóre = 9. (A) přítomna distální okluze arteria basilaris; (B) jsou přítomny obě arteria communicans posterior. Ve snímku označené „2“ (2 body). Pacient s Basilar Artery on Computed Tomography Angiography skóre = 0. (C) rozsáhlá okluze arteria basilaris; (D) nepřítomnost obou arteria communicans posterior [1].
Fig. 2. Patient with Basilar Artery on Computed Tomography Angiography score = 9. (A) distal occlusion of basilar artery; (B) both posterior communicating arteries are present. Marked “2” in the image (2 points). Patient with Basilar Artery on Computed Tomography Angiography score = 0. (C) extensive occlusion of basilar artery; (D) absence of both posterior communicating arteries [1].![Pacient s Basilar Artery on Computed Tomography Angiography skóre = 9. (A) přítomna
distální okluze arteria basilaris; (B) jsou přítomny obě arteria communicans posterior.
Ve snímku označené „2“ (2 body). Pacient s Basilar Artery on Computed Tomography
Angiography skóre = 0. (C) rozsáhlá okluze arteria basilaris; (D) nepřítomnost obou arteria
communicans posterior [1].<br>
Fig. 2. Patient with Basilar Artery on Computed Tomography Angiography score = 9. (A)
distal occlusion of basilar artery; (B) both posterior communicating arteries are present.
Marked “2” in the image (2 points). Patient with Basilar Artery on Computed Tomography
Angiography score = 0. (C) extensive occlusion of basilar artery; (D) absence of both posterior
communicating arteries [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/a80d738318541cc3e4dfa06dd5963e1a.png)
Skóre BATMAN 8 – 10 bylo hodnoceno jako dobrá kolaterální cirkulace, BATMAN ≤ 7 jako špatná kolaterální cirkulace.
Statistická analýza
Skupinová srovnání byla provedena pomocí chí-kvadrát či Fisherova testu v případě kategoriálních proměnných. Spojité proměnné byly srovnávány pomocí oboustranného dvouvýběrového t-testu. Ve všech případech byla za statistické signifikance považována p-hodnota 0,05. Multivarietní analýza byla provedena pomocí modelů logistické regrese, k identifikaci nezávislých proměnných byla použita metoda nejlepší podmnožiny. Do modelu byly přijaty všechny proměnné z univarietní analýzy s p-hodnotou < 0,15, v modelu byly ponechány pouze proměnné s p-hodnotou < 0,05. Ke statistickému zpracování byl použit program STATISTICA 13 (StatSoft, Praha, ČR).
Výsledky
Celkem bylo hodnoceno 67 pacientů léčených mechanickou trombektomií pro akutní uzávěr AB v letech 2006 – 2018. Průměrný věk byl 63 (rozmezí 31 – 82) let, median NIHSS 16 (rozmezí 2 – 36). IVT předcházela endovaskulárnímu výkonu u 38 (56,7 %) pacientů.
Výsledné rekanalizace TICI 2b-3 dosaženo u 61 (91 %) pacientů, kompletní rekanalizace TICI 3 u 49 (73,1 %). K PH typu 1 došlo u pěti (7,5 %), typu 2 u čtyř (5,9 %) pacientů. Procento periprocedurálních komplikací v našem souboru (7,1 %) odpovídá literárním údajům [8]. Pozdní komplikace charakteru perforator stroke v souvislosti se zavedením stentu se objevila u jednoho pacienta (1,5 %), tj. frekvence menší než literárně udávaná (5,1 %) [54].
Dobrého klinického stavu mRS 0 – 3 bylo dosaženo u 35 (52,2 %) pacientů. Medián BATMAN skóre této skupiny je 8,1 (6 – 9). Špatný výsledný stav mRS 4 – 6 byl u 32 (47,8 %) pacientů, průměrné BATMAN skóre 6,0 (4 – 9), viz obr. 3. Mezi oběma skupinami nebyl prokázán statisticky významný rozdíl v zastoupení jednotlivých rizikových faktorů (hypertenze, diabetes mellitus, fibrilace síní, ICHS, hyperlipidemie, kouření). Zemřelo 16 (23,9 %) pacientů.
Obr. 3. Distribuce modifi kované mRS po 90 dnech u BATMAN skóre 0–7 a 8–10. BATMAN – Basilar Artery on Computed Tomography Angiography; mRS – modifikovaná Rankinova stupnice; N – počet
Fig. 4. Distribution of mRS at 3 months according to BATMAN score 0–7 and 8–10. BATMAN – Basilar Artery on Computed Tomography Angiography score; mRS – modified Rankin scale; N – number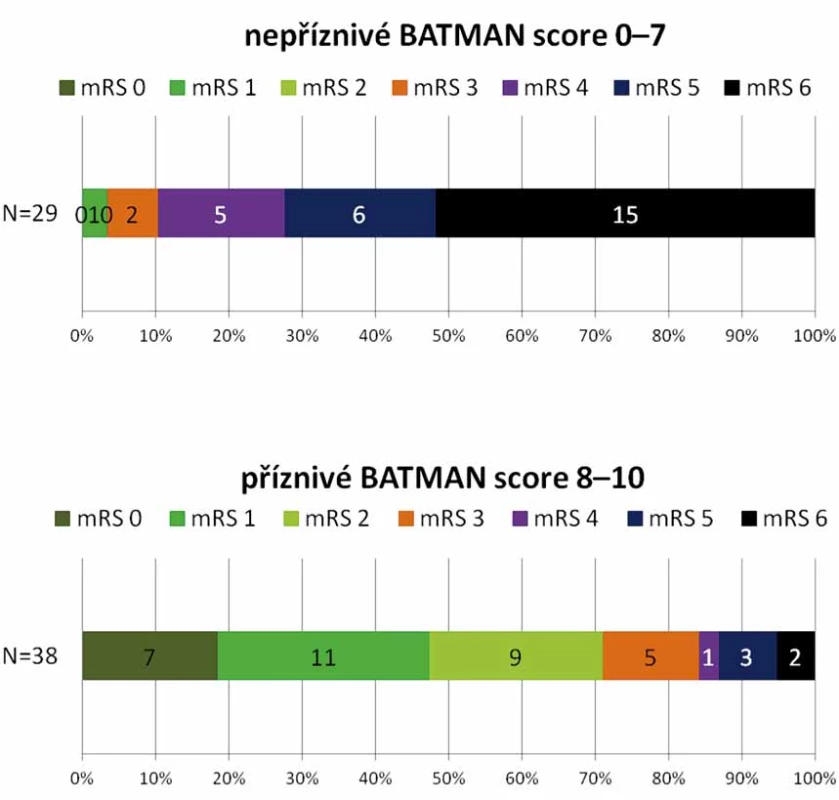
V univarietní analýze se prokázaly jako prediktory výsledného špatného stavu: vyšší hodnota NIHSS, GCS 4 – 7, nedosažení rekanalizace (TICI 0-2a) a provedení výkonu v celkové anestezii. Multivarietní regresní analýza ukázala BATMAN skóre ≤ 7 (OR 27,59; 95% CI 5,78 – 131,81; p = 0,001) a vstupní NIHSS ≥ 10 (OR 9,62; 95% CI 1,47 – 63,10; p = 0,0183) jako nezávislé prediktory špatného výsledného klinického stavu.
Diskuze
Akutní uzávěr AB je závažné onemocnění s vysokou úmrtností. V současnosti je doporučovanou léčbou mechanická trombektomie pomocí stent-retrieverů v kombinaci s IVT. I přes úspěšnou trombektomii hodnocenou TICI 2b-3 zůstává mortalita vysoká. V souboru autorů Gory et al [55] byla u pacientů s úspěšnou rekanalizací nižší mortalita (32,9 vs. 74,4 %; p < 0,001).
Významným faktorem ovlivňujícím výsledný klinický stav je zachovalá kolaterální cirkulace. BATMAN skóre posuzuje nejen přítomnost zadních komunikant, které mají zásadní význam k udržení perfuze ischemické penumbry při akutním uzávěru AB, ale rovněž hodnotí rozsah uzávěru – tzv. thrombus burden.
Kromě výše uvedené studie autorů Alemseged et al stojí za zmínku článek „Response to late-window endovascular revascularisation is associated with collateral status in basilar artery occlusion“ v červnovém vydání časopisu Stroke z roku 2019 [2]. Tato multicentrická studie ze čtyř států (Itálie, Německo, Holandsko, Austrálie) zahrnovala 172 pacientů léčených mechanickou trombektomií pro akutní uzávěr AB v letech 2009 – 2017. Pacienti s dobrým kolaterálem a méně extenzivní okluzí AB profitovali z výkonu i za časovou hranicí 6 h; obráceně, u pacientů se špatným kolaterálem a rozsáhlou okluzí byl dobrý výsledek významně závislý na časné revaskularizaci. Autoři uzavírají, že posouzení kolaterálního oběhu má význam jako selekční kritérium pro indikaci rekanalizační terapie v pozdějším časovém oknu.
Dosažení rekanalizace je obecně považováno za nejdůležitější prognostický faktor [3,6,30]. Embolické okluze rekanalizují lépe, vyskytují se spíše v distální porci AB [56]. Přítomnost hyperdense basilar artery sign na nativním CT je popsána jako prediktor úspěšné rekanalizace [7]. Důležitá je doba do dosažení rekanalizace. Čas od začátku ischemie mozkové tkáně do obnovy perfuze je zásadním faktorem ovlivnujícím klinický výsledek a mortalitu, důraz je proto kladen na časnou rekanalizaci, a to zejména u pacientů se špatnou kolaterální cirkulací [3,6,10,57]. Časový faktor je nejnaléhavější v případě náhlého vzniku těžké klinické symptomatologie na rozdíl od postupně progredujícího nebo kolísavého průběhu [6,18].
Naše práce potvrdila prognostickou hodnotu BATMAN skóre; tj. pacienti s nízkou hodnotou ≤ 7 mají menší pravděpodobnost dosažení dobrého výsledného klinického stavu, a to i v případě úspěšné rekanalizace. U těchto pacientů je třeba klást větší důraz na časnou rekanalizaci, nejlépe do 6 h od vzniku symptomů. Logicky u těchto nemocných dochází k časné ischemii, klinicky se jedná o závažný stav vyjádřený hodnotou NIHSS a poruchou vědomí dle GCS. Autoři Arnold et al [7] považují NIHSS > 20 jako prediktor špatného výsledku, Gory et al NIHSS ≥ 13 [55]. Nízké NIHSS je prediktorem dobrého výsledku [3,6,56,58 – 63].
U pacientů, kteří se iniciálně nacházejí v kómatu, je mortalita udávána 95 – 100 % [3,6,56,59 – 63]. Jako komatózní se špatnou prognózou jsou označováni pacienti s GCS ≤ 8 [7,31,56,64,65]. Vyšší GCS (9 – 15) je prognosticky spojeno s lepšími klinickými výsledky [55,66]. Podstatná je doba trvání poruchy vědomí. V prospektivní observační studii Basilar Artery International Cooperation Study (BASICS) bylo 27 pacientů léčeno pouze konzervativně, neboť byli buď v kómatu (n = 26) nebo tetraplegičtí (n = 1) [61]. V našem souboru bylo 15 pacientů s GCS 3 – 4, z toho 11 zemřelo, tři měli výsledné mRS 5 a jeden mRS 4. U 11 z 15 zemřelých se jednalo o úspěšnou rekanalizaci TICI 2b-3. Opačně: ve skupině pacientů s dobrým výsledkem mRS 0 – 3 měli pouze dva pacienti nejnižší vstupní GCS 5; z toho jeden měl výstupní mRS 3 (BATMAN 7) a druhý mRS 1 (BATMAN 8), tj. dobrou kolaterální cirkulaci. U posledního pacienta byl čas od vzniku symptomů do výsledné rekanalizace 180 min.
V souhlase s literárními údaji [32,67 – 69] dosáhli naši pacienti léčení v analgosedaci lepší funkční nezávislosti mRS 0 – 3 oproti nemocným léčených v celkové narkóze. Hlavní nevýhodou celkové narkózy je až extrémní pokles krevního tlaku škodlivě působící zejména na oblast penumbry [70 – 72] a kolísání tlaků (systolického a středního arteriálního) během výkonu. Nepříznivě působí intraprocedurální hypotenze i u pacientů řešených v analgosedaci.
Zavedení nové generace stent-retrieverů bývá obvykle spojováno s dosažením vyššího stupně rekanalizace [11]. To se v naší studii nepotvrdilo; u výkonů provedených v letech 2006 – 2012 bylo dosaženo úspěšné rekanalizace TICI 2b-3 v 90 %.
K parenchymovému krvácení PH-2 došlo u čtyř (5,9 %) pacientů. Tři nemocní byli ventilováni, zhoršení se projevilo prudkým vzestupem tlaku (ze 160/ 100 až na 240/ 140 mm Hg), u čtvrté ženy došlo k progresi neurologické symptomatologie NIHSS ≥ 4. Kromě mechanické trombektomie byl zároveň proveden i stenting stenotické AB. Stav hodnotíme jako reperfusion injury [73], ke kterému dochází i v případě úspěšné rekanalizace. Pacienti splňovali kritéria hyperperfuzního syndromu [74 – 78]. Intravenózní nebo intraarteriální léčba, která vede k rekanalizaci do již irreverzibilně poškozené mozkové tkáně, je riziková.
Indikace k rekanalizaci akutní okluze AB
Rekanalizační léčba (IVT a mechanická trombektomie) je u pacientů s akutní okluzí AB považována za život zachraňující. V současnosti nejsou k dispozici výsledky randomizovaných klinických studií se statisticky významnými výsledky, ani jasné indikace a kontraindikace k endovaskulární rekanalizaci, tak jak tomu je u akutních uzávěrů v předním karotickém povodí, tj. neexistují podrobnější obecně uznávané algoritmy diagnostického a terapeutického postupu [21,33,79,80]. Multicentrické BATMAN studie [1,2,11] prokazují, že pacienti s dobrou kolateralizací mohou profitovat z léčby i po 6 h od vzniku příznaků. Podle autorů Raphaeli et al [15] má být rekanalizační léčba indikována u všech pacientů s akutní bazilární okluzí, kteří nejsou v kómatu, nehledě na čas uplynulý od začátku příznaků. Zmiňovaní autoři považovali jako hluboké koma hodnotu GCS 3 – 4. Terapeutické okno může být 24 – 72 h od začátku příznaků, pokud jde o postupnou progresi nálezu a pokud kóma netrvá déle než 2 h [24]. Podle American Heart Association/ American Stroke Association (AHA/ ASA) guidelines je mechanická trombektomie rozumným řešením u pečlivě selektovaných pacientů do 6 h od vzniku symptomů (třída IIb, úroveň evidence C) [81]. Vzhledem ke špatné prognóze u neléčené akutní okluze AB je celosvětově běžné provádět rekanalizační terapii až do 12 – 24 h od vzniku symptomů [25]. Podle českých doporučení [22] je u akutního uzávěru AB mechanická trombektomie akceptovaná i po 6 h od začátku příznaků jako život zachraňující výkon.
Domníváme se, že posouzení kolaterální cirkulace podle BATMAN skóre může mít význam při rozhodování o endovaskulární terapii v mezních situacích, jako je např. několik hodin trvající kóma s vyhaslými kmenovými reflexy. Tato úvaha je v souladu s konceptem „marné rekanalizace“ (futile recanalization), kterému je v naší literatuře, na rozdíl od zahraniční [79,82-86], věnováno málo pozornosti. V případě akutního uzávěru AB je marná rekanalizace definována jako výsledné mRS 4 – 6 (90 dní od vzniku iktu) i přes úspěšnou rekanalizaci [79]. Předpovědní faktory marné rekanalizace jsou: kóma trvající > 3 h, tetraplegie > 6 h, oboustranná mydriáza a vyhaslé kmenové reflexy > 1 h a extenzivní známky infarktu na zobrazovacích metodách [85 – 88].
Naše práce má řadu limitací. Předně se jedná o retrospektivně hodnocenou monocentrickou studii s nevelkým počtem pacientů. Protokol léčby nebyl u všech pacientů jednotný, přestože všichni byli léčení mechanickou trombektomií. U všech pacientů nebylo provedeno CT mozku bezprostředně před výkonem.
Závěr
U akutního uzávěru AB je zachovalá kolaterální cirkulace zásadním prediktorem dobrého výsledného klinického stavu. Pacienti s nízkou hodnotou BATMAN skóre mají menší pravděpodobnost dosažení dobrého výsledného klinického stavu, a to i v případě úspěšné rekanalizace. Multivarietní regresní analýza prokázala BATMAN skóre ≤ 7 a vstupní NIHSS ≥ 10 jako nezávislé prediktory špatného výsledného klinického stavu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Marie Tinková
Ústav klinických neurooborů
Komplexní cerebrovaskulární centrum
Neurologické oddělení
ÚVN a VFN
U Vojenské nemocnice 1200
169 02 Praha
e-mail: marie.tinkova@uvn.cz
Přijato k recenzi: 19. 7. 2019
Přijato do tisku: 21. 8. 2019
Zdroje
1. Alemseged F, Shah DG, Diomedi M et al. The basilar artey on computed tomography angiography prognostic score for basilar artery occlusion. Stroke 2017; 48(3): 631 – 637. doi: 10.1161/ STROKEAHA.116.015492.
2. Alemseged F, Van der Hoeven E, Di Giulliano F et al. Response to late-window endovascular revascularisation is associated with collateral status in basilar artery occlusion. Stroke 2019; 50 : 1415 – 1422. doi: 10.1161/ STROKEAHA.118.023361.
3. Cho TH, Nighoghossian N, Tahon F et al. Brain stem Diffusion-weighted imaging lesion score: a potential marker of outcome in acute basilar artery occlusion. AJNR 2009; 30(1): 194 – 198. doi: 10.3174/ ajnr. A1278.
4. Goldmakher GV, Camargo EC, Furie KL et al. Hyperdense basilar artery sign on unenhanced CT pedicts thrombus ando oucome in acute posterior circulation stroke. Stroke 2009; 40(1): 134 – 139. doi: 10.1161/ STROKE AHA.108.516690.
5. Kayan Y, Meyers PD, Prestigiacomo CJ et al. Current endovascular strategies for posterior circulation large vessel occlusion stroke: report on the Society of neurointerventional surgery standards and guidelines committee. J Neurointervent Surg 2019. pii: neurintsurg-2019-014873. doi: 10.1136/ neurintsurg-2019-014873.
6. Roth C, Mileke A, Siekmann R et al. First experiences with a new device for mechanical thrombectomy in acute basilar artery occlusion. Cerebrovasc Dis 2011; 32(1): 28 – 34. doi: 10.1159/ 00324948.
7. Arnold M, Nedeltchev K, Schroth G et al. Clinical and radiological predictors of recanalisation and outcome of 40 patients with acute basilar artery occlusion treated with intra-arterial thrombolysis. J Neurol Neurosurg Psych 2004; 75(6): 857 – 862. doi: 10.1136/ jnnp. 2003.020479.
8. Baek JM, Yoon W, Kim SK et al. Acute basilar artery occlusion: outcome of mechanical thrombectomy with Solitaire stent within 8 hours of stroke onset. AJNR 2014; 35(5): 989 – 993. doi: org/ 10.3174/ ajnr.A3813.
9. Bose A, Henkes H, Alfke K et al. The Penumbra system: a mechanical device for the treatment of acute stroke due to thromboembolism. AJNR 2008; 29(7): 1409 – 1413. doi: 10.3174/ ajnr.A1110.
10. Berg-Dammer E, Felber SR, Henkes H et al. Long-term outcome after local intra-arterial fibrinolysis of basilar artery thrombosis. Cerebrovasc Dis 2000; 10(3): 183 – 188. doi: 10.1159/ 000016054.
11. Dumont AS, Ford GA. Delayed revascularisation in patients with basilar artery occlusion. Stroke 2019; 50(6): 1327 – 1328. doi: 10.1161/ STROKEAHA.119.025499.
12. Eckert B, Koch CH, Thomalla G et al. Aggressive therapy with intravenous abciximab and intra-arterial rtPA and additional PTA/ stenting improves clinical outcome in acute vertebrobasilar occlusion. Stroke 2005; 36(6): 1160 – 1165. doi: 10.1161/ 01.STR.000165918.80812.
13. Goyal N, Tsivgoulis G, Nickele C et al. Posterior circulation CT angiography collaterals predict outcome of endovascular acute ischemic stroke therapy for basilar artery occlusion. J Neurointerv Surg 2016; 8(8):783 – 786. doi:10.1136/ neurintsurg-2015-011883.
14. Ostrem JL, Saver JL, Alger JR et al. Acute basilar artery occlusion – diffusion-perfusion MRI characterisation of tissue salvage in patients receiving intra-arterial stroke therapies. Stroke 2004; 35(2): e30 – e34. doi: 10.1161/ 01.STR.0000113783.45745.BE.
15. Sairanen T, Strbian D, Soinne L et al. Intravenous thrombolysis of basilar artery occlusion. Stroke 2011; 42(8): 2175 – 2179. doi: 10.1161/ STROKEAHA.110.605584.
16. Schulte-Altedorneburg G, Bruckmann H, Hamann GF et al. Ischemic and hemorrhagic complications after intra-arterial fibrinolysis in vertebrobasilar occlusion. AJNR 2007; 28(2): 378 – 381.
17. Puetz V, Sylaja PN, Hill MD et al. CT Angiography source images predicts final infarct extent in patients with basilar artery occlusion. AJNR 2009; 30(10): 1877 – 1883. doi: 10.3174/ ajnr.A1723.
18. Yu W, Konstanian V, Fischer M: Endovascular recanalisation of basilar artery occlusion 80 days after symptom onset. Stroke 2007; 38(4): 1387 – 1389. doi: 10.1161/ 01.STR.0000260186.93667.a2.
19. Tountopoulou A, Ahl B, Weissenborn K et al. Intra-arterial thrombolysis using rt-PA in patients with acute stroke due to vessel occlusin of anterior and/ or posterior cerebral circulation. Neuroradiology 2008; 50(1): 75 – 83. doi: 10.1007/ s00234-007-0306-1.
20. Dias FA, Alessio-Alvez FF, Castro-Alfonzo LHet al. Clinical outcomes of patients with acute basilar artery occlusion in Brazil: an observational study. J Stroke Cerebrovasc Dis 2017; 26(10): 2191 – 2198. doi. org/ 10. 1016/ jstrokecerebrovascdis.
21. Mordasini P, Brekenfeld C, Byrne JV et al. Technical feasibility and application of mechanical thrombectomy with the Solitaire FR revascularisation device in acute basilar artery occlusion. AJNR 2013; 34(1): 159 – 163. doi: org/ 10.3174/ ajnr.A3168.
22. Tomek A et al. Neurointenzivní péče. 3. vyd. Praha: Mladá fronta a. s. 2018.
23. Uno J, Kameda K, Otsuji R et al. Mechanical thrombectomy for acute basilar artery occlusion in early therapeutic time window. Cerebrovasc Dis 2017; 44(3 – 4): 217 – 224.doi: 10.1159/ 000479939.
24. Kalina M. Akutní neurologie – intenzivní péče v neurologii. Praha: Triton 2000.
25. Sparaco M. Basilar artery occlusion: clinical management and therapy. Clin Management Issues 2018; 12(1): 67 – 76. doi: 10.7175/ cmi.v12i1.1363.
26. Goldemund D, Brichta J, Vaníček J et al. Spontánní disekce a. basilaris jako vzácná příčina mozkového infarktu. Neurol praxi 2012; 13(5): 292 – 294.
27. Mrklovský M, Klzo L, Geier P. Disekce bazilární tepny jako příčina ischemické cévní příhody. Ces Radiol 2008; 62(1): 92 – 96.
28. Drábek P. Trombóza arteria basilaris imitující temporální konus. Cesk Slov Neurol N 1988; 51 : 148 – 150.
29. Ferbert A, Bruckmann H, Drummen E. Clinical features of proven basilar artery occlusion. Stroke 1990; 21(8): 1135 – 1142. doi: 10.1161/ 01.str.21.8.1135.
30. Bergui M, Stura G, Daniele D et al. Mechanical thrombolysis in ischemic stroke attributable to basilar artery occlusion as first-line treatment. Stroke 2006; 37(1): 145 – 150. doi: 10.1161/ 01.STR.0000195178.20019.dc.
31. Hankey GJ. The BASICS of treating symptomatic basilar artery thrombosis. Lancet Neurol 2009; 8(8): 695 – 697. doi: 10.1016/ S1474-4422(09)70152-8.
32. Školoudík D, Šaňák D et al. Rekanalizační terapie akutní ischemické cévní mozkové příhody. Praha: Maxdorf 2013.
33. Škoda O. Diagnostika a léčba ischemických CMP ve vertebrobazilárním povodí. CMP Journal 2019; 1 : 9 – 15.
34. Škoda O, Herzig R, Mikulík R et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou. Cesk Slov Neurol N 2016; 79/ 112(3): 351 – 363. doi: 10.14735/ amcsnn2016351.
35. Liebeskind D. Collateral circulation. Stroke 2003; 34(9): 2279 – 2284. doi: 10.1161/ 01.STR.0000086465.41263.06.
36. Volný O, Mikulík R. Kolaterální cirkulace mozku – potencionální cíl terapie mozkových infarktů. Cesk Slov Neurol N 2013; 76/ 109(3): 307 – 314.
37. Brandt T, von Kummer R, Muller-Kuppers M et al. Thrombolytic therapy of acute basilar artery occlusion: variables affecting recanalisation and outcome. Stroke 1996; 27(5): 875 – 881. doi: 10.1161/ 01.STR.27.5.875.
38. Nekula J, Vlachová I, Chudoba V. Dynamika uzávěru bazilární tepny v DSA a MR obraze. Ces Radiol 1995; 49(2): 93 – 96.
39. Maas MB, Lev MH, Ay H et al. Collateral vessels on CT Angiography predict outcome in acute ischemic stroke. Stroke 2009; 40(9): 3001 – 3005. doi: 10.1161/ STROKEAHA.109.552513.
40. Nambiar V, Sohn SI, Almekhlafi MA et al. CTA collateral status and response to recanalisation in patients with acute ischemic stroke. AJNR 2014; 35(5): 884 – 890. doi: 10.3174/ ajnr.A3817.
41. Souza LC, Yoo AJ, Chaudhry ZA et al. Malignant CTA collateral profile is highly specific for large admission DWI infarct core and poor outcome in acute stroke. AJNR 2012; 33(7): 1331 – 1336. doi: 10.3174/ ajnr.A2985.
42. Tan IY, Demchuk AM, Hopyan J et al. CT angiography clot burden score and collateral score: correlation with clinical and radiologic outcomes in acute middle cerebral artery infarct. AJNR 2009; 30(3): 525 – 531. doi: 10.3174/ ajnr.A1408.
43. Vagal A, Aviv R, Sucharew H et al. Collateral clock is more important than time clock for tissue fate. Stroke 2018; 49(9): 2102 – 2107. doi: 10.1161/ STROKEAHA.118.021484.
44. Bang OY, Saver JL, Kim SJ et al. Collateral flow predicts response to endovascular therapy for acute ischemic stroke. Stroke 2011; 42(3): 693 – 699. doi: 10.1161/ STROKEAHA.110.595256.
45. Lau AY, Wong EH, Wong A et al. Significance of good collateral compensation in symptomatic intracranial atherosclerosis. Cerebrovasc Dis 2012; 33(6): 517 – 524. doi: 10.1159/ 000337332.
46. Sallustio F, Motta C, Pizzuto S et al. CT angiography-based collateral flow and time to reperfusion are strong predictors of outcome in endovascular treatment of patients with stroke. J Neurointervent Surg 2017; 9(10): 940 – 943. doi: org/ 10.1136/ neurintsurg-2016-012628.
47. Brunner F, Tomandl B, Hanken K et al. Impact of collateral circulation on early outcome and risk of hemorrhagic complications after systemic thrombolysis. Int J Stroke 2014; 9(8): 992 – 998. doi: 10.1111/ j.1747-4949. 2012.00922.x.
48. Shuaib A, Butcher K, Mohammad AA et al. Collateral blood vessels in acute ischaemic stroke: a potential therapeutic target. Lancet Neurol 2011; 10(10): 909 – 921. doi: 10.1016/ S1474-4422(11)70195-8.
49. Bang OY, Saver JL, Kim SJ et al. Collateral flow averts hemorrhagic transformation after endovascular therapy for acute ischemic stroke. Stroke 2011; 42(8): 2235 – 2239. doi: 10.1161/ STROKEAHA.110.604603.
50. Angermaier A, Langner S, Kirsch M et al. CT-angiographic collateralisation predicts final infarct volume after intra-arterial thrombolysis for acute anterior circulation ischemic stroke. Cerebrovasc Dis 2011; 31(2): 177 – 184. doi: 10.1159/ 000321868.
51. van der Hoeven EJ, McVerry F, Vos JA et al. BASICS Registry Investigators. Collateral flow predicts outcome after basilar artery occlusions: the posterior circulation collateral score. Int J Stroke 2016; 11(7): 768 – 775. doi: 10.1177/ 1747493016641951.
52. Singer OC, Berkefeld J, Nolte CH et al. ENDOSTROKE study Group. Mechanical recanalisation in basilar artery occlusion: the ENDOSTROKE Study. Ann Neurol 2015; 77(3): 415 – 424. doi: 10.1002/ ana.2436.
53. Hacke W, Kaste M. Fieschi C et al. Randomized double-blind placebo-controlled trial of thrombolytic therapy with intravenous altepase in acute ischaemic stroke (ECASS II). Lancet 1998; 352(9136): 1245 – 1251.
54. Baixue J, Liebeskind DS, Ning M et al. Factors associated with perforator stroke after selective basilar artery angioplasty or stenting. J Neurointerv Surg 2017; 9(8): 738 – 742. doi: 10.1136/ neurintsurg-2016-012329.
55. Gory B, Mazighi M, Laubreuche J et al. Predictors for mortality after mechanical thrombectomy of acute basilar artery occlusion. Cerebrovasc Dis 2018; 45(1 – 2): 61 – 67. doi: 10.1159/ 000486690.
56. Renard D, Landragin N, Robinson A et al. MRI-Based Score for acute basilar artery thrombosis. Cerebrovasc Dis 2008; 25(6): 511 – 516. doi: 10.1159/ 00013668.
57. Krajina A, Krajíčková D, Lojík M et al. Endovaskulární rekanalizace při léčbě akutních uzávěrů mozkových tepen. Ces Slov Neurol N 2010; 73/ 106(6): 678 – 684.
58. Vergouwen MD, Compter A, Tanne D et al. Outcomes of basilar artery occlusion in patients aged 75 years or older on the Basilar Artery International Cooperation Study. J Neurol 2012; 259(11): 2341 – 2346. doi: 10.1007/ s00415-012-6498-2.
59. Dorňák T, Herzig R, Krajina A et al. Endovascular treatment of acute basilar artery occlusion: time to treatment is crucial. Clin Radiol 2015; 70(5): e20 – e27. doi: org/ 10.1016/ j.crad.2015.01.008.
60. Jung S, Mono ML, Fischer U et al. Three-month and longterm outcomes and their predictors in acute basilar artery occlusion treated with intra-arterial thrombolysis. Stroke 2011; 42(7): 1946 – 1951. doi: 10.1161/ STROKEAHA.110.606038.
61. Schonewille WJ, Algra A, Serena J et al. Outcome in patients with basilar artery occlusion treated conventionally. J Neurol Neurosurg Psychiatry 2005; 76(9): 1238 – 1241. doi: 10.1136/ jnnp.049924.
62. Bouslama M, Haussen DC, Aghaebrahim A et al. Predictors of good outcome after endovascular therapy for vertebrobasilar occlusion stroke. Stroke 2017; 48(12): 3252 – 3257. doi: 10.1161/ STROKEAHA.117.018270.
63. Yoon W, Kim SK, Heo TW et al. Predictors of good outcome after stent retriever thrombectomy in acute basilar artery occlusion. Stroke 2015; 46(10): 2972 – 2975. doi: 10.1161/ STROKEAHA.115.010840.
64. Voetsch B, DeWitt D, Pessin MS et al. Basilar artery occlusive disease in the New England Medical Center Posterior Circulation Registry. Arch Neurol 2004; 61(4): 496 – 504. doi: 10.1001/ archneur.61.4.496.
65. Ottomeyer C, Zeller J, Fesl G et al. Multimodal recanalisation therapy in acute basilar artery occlusion. Stroke 2012; 43(8): 2130 – 2135. doi: 10.1161/ STROKEAHA.112.651281.
66. Tsao JW, Hemphill JC, Johnston C et al. Glasgow Coma Scale Score predicts outcome following thrombolysis for posterior circulation stroke. Arch Neurol 2005; 62(7): 1126 – 1129. doi: 10.1001/ archneur.62.7.1126.
67. Powers CJ, Dornbos D, Mlynash M et al. Thrombectomy with conscious sedation compared with general anesthesia: a DEFUSE 3 analysis. AJNR 2019; 40(6): 1001 – 1005. doi: 10.3174/ ajnr.A6059.
68. Goyal N, Malhotra K, Ishfaq MF et al. Current evidence for anesthesia management during endovascular stroke therapy: updated systematic review and meta-analysis. J Neurointerv Surg 2019; 11(2): 107 – 113. doi: 10.1136/ neurintsurg-2018-013916.
69. Jagani M, Brinjikji W, Rabinstein AA et al. Hemodynamics during anestesia for intra-arterial therapy of acute ischemic stroke. Neurointervent Surg 2016; 8(9): 883 – 888. doi: 10.1136-neurintsurg-2015-011867.
70. Lowhagen Hendén P, Rentzos A, Karlsson JE et al. Hypotension during endovascular treatment of ischemic stroke is a risk factor for poor neurological outcome. Stroke 2015; 46(9): 2678 – 2680. doi: 10.1161/ STROKE AHA.115.009808.
71. Molina CA, Selim MH. General ol local anesthesia during endovascular procedures. Stroke 2010; 41(11): 2720 – 2721. doi: 10.1161/ STROKEAHA.110.595447.
72. Abou Chebl A, Lin R, Hussain MS et al. Conscious sedation versus general anesthesia during endovascular therapy for acute anterior circulation stroke. Stroke 2010; 41(6): 1175 – 1179. doi: 10.1161/ STROKEAHA.115.008761.
73. Lansberg MG, Albers GW, Wijman CA. Symptomatic intracerebral hemorrhage following thrombolytic therapy for acute ischemic stroke: a review of the risk factors. Cerebrovasc Dis 2007; 24(1): 1 – 10. doi: 10.1159/ 000103110.
74. Liu S, Jung JH, Kim SM et al. Simultaneous bilateral carotid stenting in high risk patients. AJNR 2010; 31(6): 1113 – 1117. doi: 10.3174/ ajnr.A1970.
75. Liu AY, Do HM, Albers GW et al. Hyperperfusion syndrome with hemorrhage after angioplasty for middle cerebral artery stenosis. AJNR 2001; 22(8): 1597 – 1601.
76. Coutts SB, Hill MD, Sutherland G et al. Hyperperfusion syndrome: toward a stricter definition. Neurosurgery 2003; 53(5): 1053 – 1060. doi: 10.1227/ 01.NEU.0000088738.80838.74.
77. Krajíčková D. Komplikace chirurgické a endovaskulární léčby onemocnění magistrálních mozkových tepen. Neurol praxi 2003; 3 : 133 – 136.
78. Mraček J, Choc M, Richtr P et al. Hyperperfuzní syndrom. Cesk Slov Neurol N 2005; 3 : 192 – 197.
79. Meinel TR, Kaesmacher J, Panos L et al. Mechanical thrombectomy for basilar artery occlusion: efficacy, outcomes, and futile recanalisation in comparison with the anterior circulation. J Neurointerv Surg 2019. pii: neurintsurg-2018-014516. doi: 10.1136-neuintsurg-2018-014516.
80. Turc G, Bhogal P, Fischer U et al. European Stroke Organisation (ESO) – European Society for minimally invasive neurological therapy (ESMINT) guidelines on mechanical thrombectomy in acute ischemic stroke. J Neurointerv Surg 2019; 11(6): 535 – 538. doi:10.1136/ neurintsurg-2018-014569.
81. Powers WS, Rabinstein AA, Ackerson T et al. American Heart Association Stroke Council. 2018 Guidelines for the early management of patients with acute ischemic stroke. Stroke 2018; 49(3): e46 – e110. doi: 10.1161/ STR. 00000000000000158.
82. Becktepe JS, You SJ, Berkefeld J et al. Clinical outcome after mechanical recanalisation as mono - or adjunctive therapy in acute stroke: importance of time to recanalisation. Cerebrovasc Dis 2011; 32(3): 211 – 218. doi: 10.1159/ 00328814.
83. Hussein HM, Georgiadis AL, Vazquez G et al. Occurence and predictors of futile recanalisation following endovascular treatment among patients with acute ischemic stroke: a multicenter study. AJNR 2010; 31(3): 454 – 458. doi 10.3174/ ajnr.A2006.
84. Molina CA. Futile recanalisation in mechanical embolectomy trials. A call to improve selection of patients for revascularisation. Stroke 2010; 41(5): 842 – 843. doi: 10.1161/ STROKEAHA.110.580266.
85. Nagel S, Herweh CH, Kohrmann M et al. MRI in patients with acute basilar artery occlusion-DWI lesion scoring is and independent predictor of outcome. Int J Stroke 2012; 7(4): 282 – 288. doi/ 10.1111/ ijs.2012.7.issue-4/ issuetoc.
86. Nie X, Pu Y, Zhang Z et al. Futile recanalisation after endovascular therapy in acute ischemic stroke. Biomed Res Int 2018; 2018 : 5879548. doi: 10.1155/ 2018/ 5879548.
87. Mourand I, Machi P, Nogué E et al. Diffusion--weighted imaging score of the brainstem: a predictor of outcome in acute basilar artery occlusion treated with Solitaire FR Device. AJNR 2014; 35(6): 1117 – 1123. doi: 10.3174/ ajnr.A3870.
88. Noufal M, Schmidley JW, Erdem E et al. Basilar artery occlusion treated with mechanical thrombectomy beyond eight hours with succesful recanalisation and good functional outcomes. Cerebrovasc Dis 2009; 27(6): 614 – 615. doi: 10.1159/ 000218072.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2019 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Kompresivní neuropatie jako nemoc z povolání
- Refrakterní myastenia gravis – klinická charakteristika a možnosti biologické léčby
- Úloha pohybovej aktivity v liečbe pacientov s Parkinsonovou chorobou
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Léčba nespavosti při neuropatické bolesti
- Význam kolaterální cirkulace u akutní okluze arteria basilaris
- Jiný pohled na inhibitor agregace krevních destiček klopidogrel – vhodné antiedematikum v předklinickém modelu poranění mozku?
- Možnosti stanovení likvorového tripletu tau proteinů a β-amyloidu 42 metodami ELISA a orientační normativní vodítka
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
- CRP stanovený vysoce senzitivní metodou u pacientů s ichemickou cévní mozkovou příhodou – od rizikových faktorů po vývoj
- Pegylovaný interferon beta 1-a v klinické praxi
- Kongenitální fibróza zevních okohybných svalů u české rodiny a její molekulárně genetická příčina
- Rozsáhlý cervikální hematom po minimálním traumatu
- Perinatální paréza brachiálního plexu na podkladě avulze, řešená konzervativně
- Plicní arteriovenózní malformace jako vzácná příčina ischemické cévní mozkové příhody
- Akutní amnestický syndrom při bilaterální lézi hipokampů jako raritní projev CMP
- Perforace jícnu způsobená dislokovanou krční dlahou pět let po operaci krční páteře – vzácná komplikace
- Závažné vaskulopatie u neurofibromatózy typu 1
- Simultánní vícečetné intracerebrální hemoragie
- Analýza dat v neurologii LXXVII. Korelační analýza vícerozměrných souborů kvantitativních dat – příklady
- Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba nespavosti při neuropatické bolesti
- Kompresivní neuropatie jako nemoc z povolání
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



