-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transkraniální sonografie mediotemporálního laloku u pacientů s Alzheimerovou demencí
Transcranial sonography of the medial temporal lobe in Alzheimer’s disease patients
Aim: Atrophy of the medial temporal lobe (MTL) is one of the anatomical hallmarks of Alzheimer‘s disease (AD). Transcranial sonography (TCS) is able to visualize and measure the MTL. Study aimed to test the digital image analysis of the MTL TCS image in patients with AD compared to healthy controls.
Methods: Patients with AD and healthy controls were enrolled to the study. MTL and the surrounding space were imaged in the coronal plane on TCS from both sides in all enrolled subjects. All images were encoded and evaluated using B-Mode Assist software by counting the black/white ratio of the MTL. The receiver operating characteristic curve, optimal cut-off value, sensitivity, specificity, and positive and negative predictive values were statistically evaluated.
Results: A total of 78 subjects were enrolled to the study during 6 months; 31 patients with AD (14 males, mean age 76.2 ± 5.8 years) and 47 healthy controls (21 males, mean age 75.5 ± 6.4 years). A significantly lower value of MTL black/white ratio was found in patients with AD compared with healthy controls (1.63 ± 0.75 vs. 3.43 ± 1.01; P < 0.001). The optimal cut-off value of MTL black/white ratio for differentiation between patients with AD and healthy controls was 2.5 with a sensitivity of 90.3%, specificity of 87.2%, positive predictive value of 82.3% and negative predictive value of 93.2%.
Conclusion: Digital image analysis of the TCS MTL images enables the measurement of the black/white ratio as a marker of MTL atrophy in patients with AD.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Keywords:
transcranial sonography – medial temporal lobe – Alzheimer´s disease – echogenicity
Autori: D. Školoudík 1; P. Krulová 1; H. Kisvetrová 2; R. Herzig 3; J. Blahuta 4; T. Soukup 4
Pôsobisko autorov: Neurologická klinika FN Ostrava 1; Centrum vědy a výzkumu, Fakulta, zdravotnických věd, UP v Olomouci 2; Neurologická klinika, Komplexní, cerebrovaskulární centrum, LF UK a FN Hradec Králové 3; Ústav informatiky, Filozofi cko-přírodovědecká, fakulta, Slezská Univerzita, v Opavě 4
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83(2): 189-193
Kategória: Původní práce
doi: https://doi.org/10.14735/amcsnn2020189V současné době žije celosvětově okolo 50 milionů pacientů s demencí, přičemž odhady ukazují, že do roku 2050 se tento počet téměř ztrojnásobí. Regionální odhady prevalence demence u osob nad 60 let se pohybují od 4,6 % ve střední Evropě, vč. ČR, po 8,7 % v severní Africe a na Středním východě [1–3]. Nejčastějším typem demence je Alzheimerova demence (AD). Výskyt AD roste s věkem a kvůli narůstající délce dožití a stárnutí populace v rozvinutých zemích významně stoupá počet pacientů s tímto onemocněním [4,5]. Ačkoli v současnosti neexistuje kauzální léčba AD, vyvíjí se velké množství nových sloučenin, které mají potenciál modifikovat průběh nemoci a zpomalit její progresi. Pro budoucí úspěšnou léčbu je však nezbytná časná diagnostika. Neurozobrazovací metody umožňují detekovat strukturální změny mozku nejen v období plně rozvinutých klinických příznaků AD, ale již v presymptomatickém období. Nejvýznamnější strukturou v diagnostice AD se zdá být mediotemporální lalok (MTL) a jeho část – hipokampus. Zlatým standardem v detekci atrofie MTL a hipokampu je MR, která je předmětem výzkumu již po celá desetiletí.
Súhrn
Cíl: Atrofie mediálního temporálního laloku (MTL) je jedním z anatomických znaků Alzheimerovy demence (AD). Transkraniální sonografie (transcranial sonography; TCS) je schopna vizualizovat a měřit MTL. Cílem pilotní studie bylo otestovat digitální analýzu TCS obrazu MTL u pacientů s AD a zdravých kontrol.
Metody: Do studie byli zařazeni pacienti s AD a zdravé kontroly. Vyšetření TCS se zobrazením MTL a okolních struktur v koronární rovině oboustranně bylo provedeno u všech zařazených subjektů. Všechny snímky byly zakódovány a vyhodnoceny pomocí softwaru B-Mode Assist s vypočtením MTL black/white ratio. Statisticky byly vyhodnoceny křivka receiver operating characteristic, optimální hraniční hodnota, senzitivita, specifita, pozitivní a negativní prediktivní hodnota.
Výsledky: Do studie bylo během 6 měsíců zařazeno celkem 78 subjektů; 31 pacientů s AD (14 mužů, průměrný věk 76,2 ± 5,8 let) a 47 zdravých kontrol (21 mužů, průměrný věk 75,5 ± 6,4 let). Významně nižší hodnota MTL black/white ratio byla zjištěna u pacientů s AD ve srovnání se zdravými kontrolami (1,63 ± 0,75 vs. 3,43 ± 1,01; p < 0,001). Optimální hraniční hodnota MTL black/white ratio pro diferenciaci mezi pacienty s AD a zdravými kontrolami byla 2,5 se senzitivitou 90,3 %, specifitou 87,2 %, pozitivní prediktivní hodnotou 82,3 % a negativní prediktivní hodnotou 93,2 %.
Závěr: Digitální analýza TCS obrazu MTL umožňuje měřit black/white ratio jako marker atrofie MTL u pacientů s AD.
Klíčová slova:
transkraniální sonografie – mediotemporální lalok – Alzheimerova demence – echogenita
Úvod
V současné době žije celosvětově okolo 50 milionů pacientů s demencí, přičemž odhady ukazují, že do roku 2050 se tento počet téměř ztrojnásobí. Regionální odhady prevalence demence u osob nad 60 let se pohybují od 4,6 % ve střední Evropě, vč. ČR, po 8,7 % v severní Africe a na Středním východě [1–3]. Nejčastějším typem demence je Alzheimerova demence (AD). Výskyt AD roste s věkem a kvůli narůstající délce dožití a stárnutí populace v rozvinutých zemích významně stoupá počet pacientů s tímto onemocněním [4,5]. Ačkoli v současnosti neexistuje kauzální léčba AD, vyvíjí se velké množství nových sloučenin, které mají potenciál modifikovat průběh nemoci a zpomalit její progresi. Pro budoucí úspěšnou léčbu je však nezbytná časná diagnostika.
Neurozobrazovací metody umožňují detekovat strukturální změny mozku nejen v období plně rozvinutých klinických příznaků AD, ale již v presymptomatickém období. Nejvýznamnější strukturou v diagnostice AD se zdá být mediotemporální lalok (MTL) a jeho část – hipokampus. Zlatým standardem v detekci atrofie MTL a hipokampu je MR, která je předmětem výzkumu již po celá desetiletí [6–10].
Ultrazvuková diagnostika se doposud věnovala především vaskulárním patologiím u demencí [11]. Nicméně první práce Yilmaze et al [12] ukázala, že transkraniální sonografie (transcranial sonography; TCS) je také schopna detekovat známky atrofie MTL. Senzitivita a specificita TCS v diferenciaci pacientů s AD od zdravé populace v této studii byly 83 a 76 %, což bylo srovnatelné s MR, kde senzitivita atrofie MTL hodnocené pomocí MR v diferenciaci pacientů s AD oproti zdravé populaci dosahuje 75 % (95% CI: 73–77 %) a specifita dosahuje 81 % (95% CI: 79–82 %) [13].
Největší limitací TCS diagnostiky však je vysoká závislost na zkušenostech sonografisty [14]. Z tohoto důvodu jsou vyvíjeny počítačové programy pro digitální analýzu obrazu, které by tuto limitaci eliminovaly. Ve studiích se prokázalo, že digitální analýza obrazu je minimálně stejně dobrá jako zkušený sonografista nebo dokonce lepší [15].
Cílem prezentované pilotní studie bylo určit přesnost, senzitivitu a specifitu měření atrofie MTL pomocí digitální analýzy u pacientů s AD a zdravými dobrovolníky.
Materiál a metodika
Pacienti
Do studie byly zařazeny dvě skupiny subjektů. První skupinu tvořili pacienti v počáteční fázi AD sledovaní v rámci grantového projektu AZV 16-28628A. Vstupní kritéria pro zařazení byla: 1. věk ≥ 60 let; 2. diagnostikovaná pravděpodobná AD dle platných kritérií [16] s skóre Mini-Mental State Examination (MMSE) 15–25 bodů; 3. podepsaný informovaný souhlas.
Druhou (kontrolní) skupinu tvořili pacienti s normálními kognitivními funkcemi. Vstupní kritéria pro zařazení byla: 1. věk ≥ 60 let; 2. bez diagnózy demence; 3. skóre MMSE 28–30 bodů; 4. podepsaný informovaný souhlas.
Vyřazující kritéria pro všechny subjekty byla: 1. nedostatečné temporální kostní okno; 2. nesoběstačnost; 3. závažná psychická porucha; 4. terminální fáze nemoci.
Vyšetření TCS se zobrazením MTL a okolních struktur v koronární rovině oboustranně bylo provedeno u všech zařazených subjektů. Všechny snímky byly zakódovány a vyhodnoceny pomocí vlastního vyvíjeného softwaru B-Mode Assist.
Transkraniální sonografie
Vyšetření TCS bylo provedeno na duplexním sonografickém přístroji ESAOTE MyLab Twice (Esaote, Janov, Itálie) s 2,5MHz transkraniální fázovou sondou (PA240). Vyšetření u všech subjektů probíhalo vleže v poloze na zádech s náklonem hlavy 0°. Vyšetření bylo provedeno z pravého a levého temporálního kostního okna v koronárním řezu s následujícími parametry: hloubka zobrazení 16 cm, penetrace = vysoká (high); dynamický rozsah (dynamic range) = 7 (50 dB); frekvence = 1–4 MHz; zesílení (enhancement) = 3; denzita = 2; pohled (view) = 9; trvání (persistence) = 7; dynamická komprese = 0; gain = 36 %; mapa šedi (gray map) = 0; S view = vypnuto (off); 2 fokusy v hloubce 5 a 10 cm; mechanický index = 0,9 a tkáňové indexy: TIs = 1,0; TIB = 1,0; TIC = 2,1. Vyšetření TCS bylo provedeno u všech subjektů se stejným nastavením (obr. 1 a 2).
Obr. 1. Zobrazení mediotemporálního laloku pomocí transkraniální sonografi e v B-obraze v koronárním řezu u pacienta s Alzheimerovou demencí s následným měřením indexu black/white ratio (BWR = 2,3).
Fig. 1. Imaging of the medial temporal lobe using transcranial sonography in B-Mode coronal plane in a patient with Alzheimer‘s dementia and subsequent measurement of the black/white ratio index (BWR = 2.3).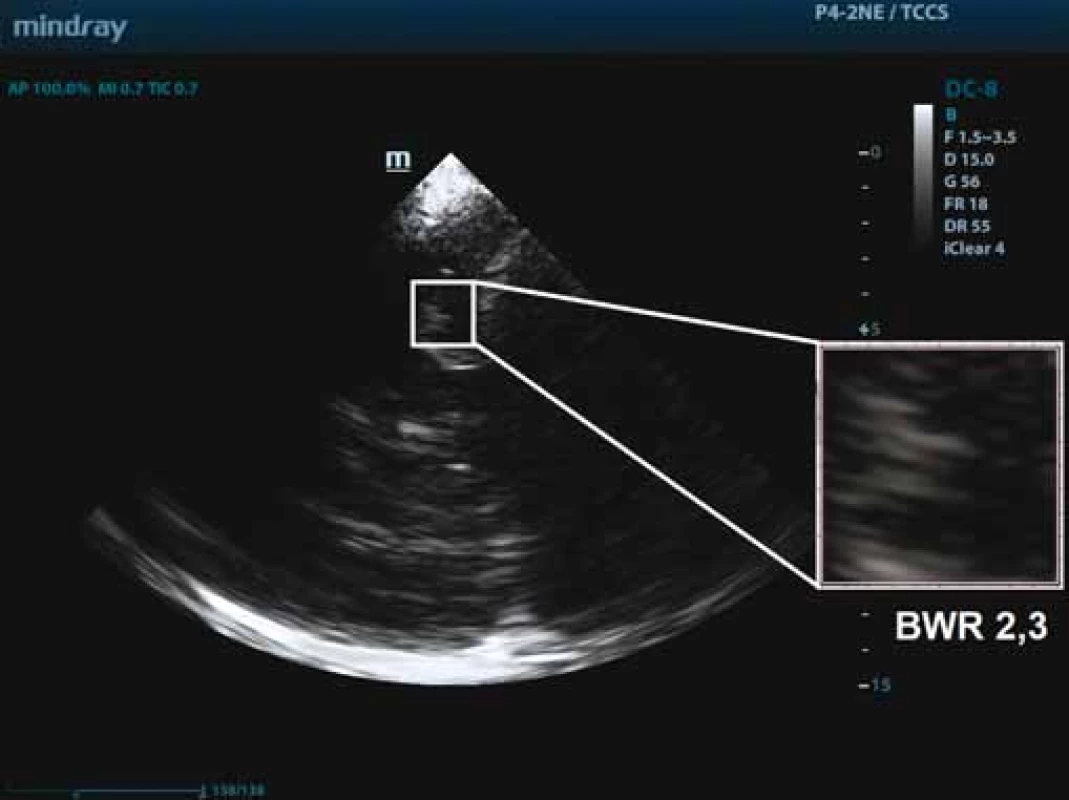
Obr. 2. Zobrazení mediotemporálního laloku pomocí transkraniální sonografi e v B-obraze v koronárním řezu u pacienta bez poruchy kognitivních funkcí s následným měření black/white ratio (BWR = 3,4).
Fig. 2. Imaging of the medial temporal lobe using transcranial sonography in B-Mode coronal plane in a subject without cognitive impairment and subsequent measurement of the black/ white ratio index (BWR = 3.4).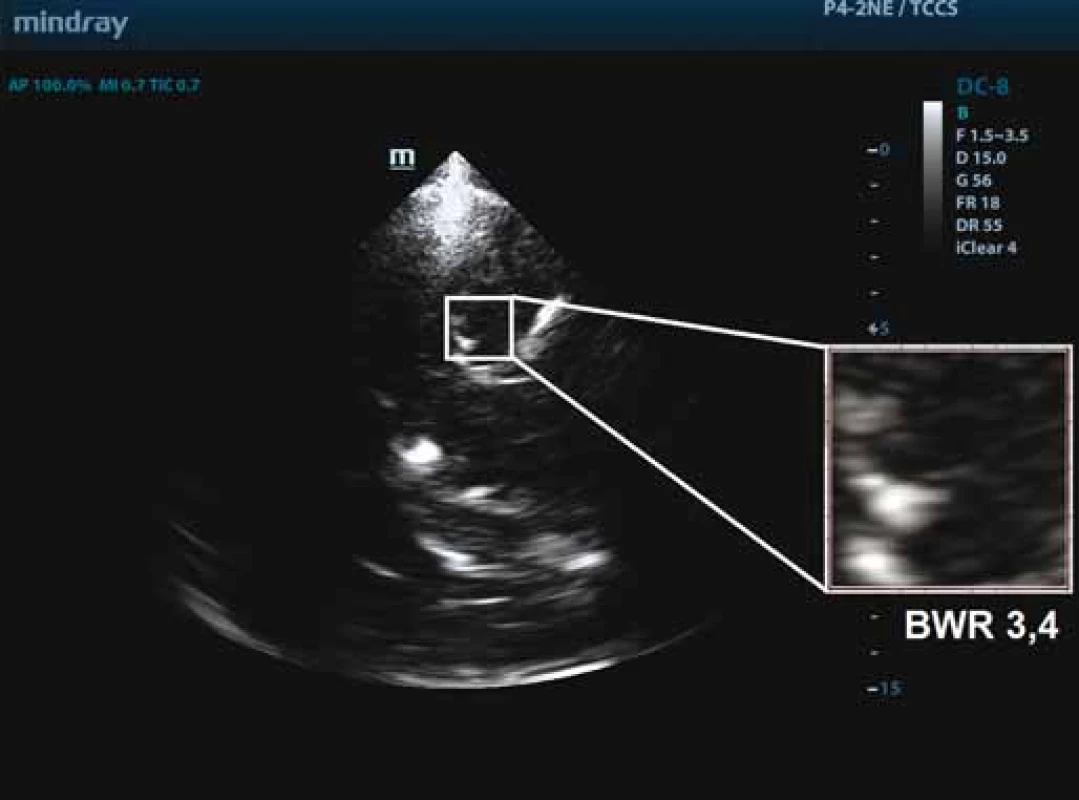
Všechny obrázky byly uloženy ve formátu Digital Imaging and Communications in Medicine (DICOM), anonymizovány a zakódovány. Pro následné vypočtení indexu MTL black/white ratio (BWR) byl použit vyvíjený počítačový program B-Mode Assist. Pro statistickou analýzu byla použita nejvyšší ze dvou naměřených hodnot z pravé a levé strany. Sonografista (D. Š.) neznal diagnózu pacientů, ale nebyl zaslepen k symptomům. Anonymizované obrazy TCS MTL byly hodnoceny nezávisle dvěma hodnotiteli (D. Š. a J. B.) a jedním hodnotitelem 2× během 2 týdnů (J. B.). Z naměřených hodnot byla vypočtena reprodukovatelnost měření indexu BWR.
Statistika
Velikost vzorku studie byla vypočtena pro očekávaný 25% rozdíl v indexu BWR mezi skupinami. Výpočty ukázaly, že bylo nutné skrínovat minimálně 42 subjektů v každé skupině, aby se dosáhlo statisticky významného rozdílu s hodnotou α = 0,05 a hodnotou β = 0,8 (30 pacientů v každé skupině) za předpokladu, že 25 % z těchto subjektů (6 pacientů) by bylo vyloučeno kvůli nedostatečnému kostnímu oknu a 25 % subjektů (6 pacientů) odmítne vyšetření.
Pro testování normality byl použit Shapiro-Wilkův test. Data s normální distribucí jsou uvedena jako průměr ± standardní odchylka, ostatní jako průměr, medián a mezikvartilní rozsah. Reprodukovatelnost mezi jedním hodnotitelem (intra-rater reliability) a mezi dvěma hodnotiteli (inter-rater reliability) byla hodnocena pomocí Spearmanova korelačního koeficientu. Srovnání mezi dvěma skupinami bylo provedeno Mann-Whitneyho U testem. Statisticky byla vyhodnocena křivka receiver operating characteristic (ROC). Byly vypočteny optimální hraniční hodnota, senzitivita, specifita, pozitivní a negativní prediktivní hodnota. Všechny testy byly provedeny na hladině významnosti α = 0,05. Data byla analyzována pomocí softwaru SPSS v.22.0 (IBM, Armonk, NY, USA).
Výsledky
Do prospektivní observační studie bylo skrínováno během 6 měsíců celkem 97 subjektů, přičemž 78 splnilo vstupní a vylučovací kritéria, z toho 31 pacientů s AD (14 mužů, průměrný věk 76,2 ± 5,8 let) a 47 subjektů do kontrolní skupiny bez poruchy kognitivních funkcí (21 mužů, průměrný věk 75,5 ± 6,4 let). Pět subjektů odmítlo vyšetření, 4 pacienti neměli dostatečné kostní okno a 10 subjektů mělo MMSE mimo požadované rozmezí. Demografická data jsou uvedena v tab. 1. Průměrné skóre MMSE u pacientů s AD bylo 21,4 ± 3,5 bodů, v kontrolní skupině subjektů bez postižení kognitivních funkcí bylo 28,7 ± 0,79 bodů.
Tab. 1. Demografická data zařazených subjektů – pacientů s Alzheimerovou demencí a subjektů v kontrolní skupině 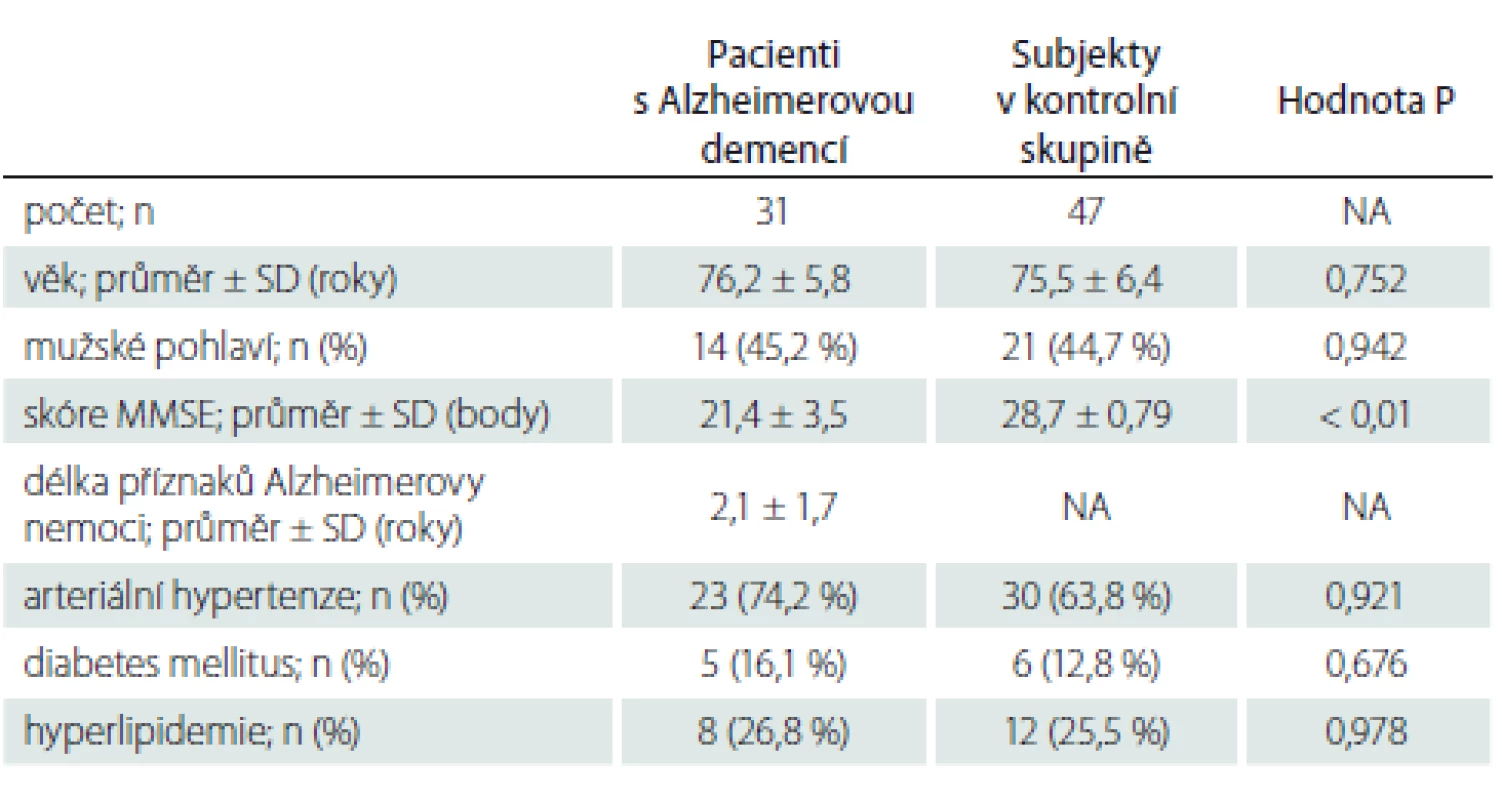
n – počet; MMSE – Mini-Mental State Examination; NA – nezjištěno; SD – směrodatná odchylka Reprodukovatelnost měření indexu BWR při 2 měřeních jedním hodnotitelem (intra-rater reliability) dosáhla r = 0,995 (95% CI: 0,993–0,997) a při měření 2 hodnotiteli (inter-rater reliability) r = 0,937 (95% CI: 0,910–0,956).
U pacientů s AD byl ve srovnání se zdravými kontrolami zjištěn signifikantně nižší poměr BWR (1,63 ± 0,75 vs. 3,43 ± 1,01; p = 0,001). Výsledná křivka ROC je na obr. 3. Plocha pod křivkou ROC (area under the curve; AUC) = 0,93. Optimální mezní hodnota BWR pro rozlišení mezi pacienty s AD a zdravými kontrolami byla 2,5 se senzitivitou 90,3 %, specifitou 87,2 %, pozitivní prediktivní hodnotou 82,3 % a negativní prediktivní hodnotou 93,2 %.
Obr. 3. ROC křivka s výpočtem AUC pro diferenciaci Alzheimerovy demence a subjektů bez poruchy kognitivních funkcí pomocí měření indexu black/white ratio digitální analýzou obrazu (AUC = 0,93). AUC – plocha pod křivkou; ROC – receiver operating characteristic
Fig. 3. ROC curve counting AUC for the diff erentiation between patients with Alzheimer ´s dementia and subjects without cognitive impairment using digital image analysis with measurement of the black/white ratio index (AUC = 0.93). AUC – area under the curve; ROC – receiver operating characteristic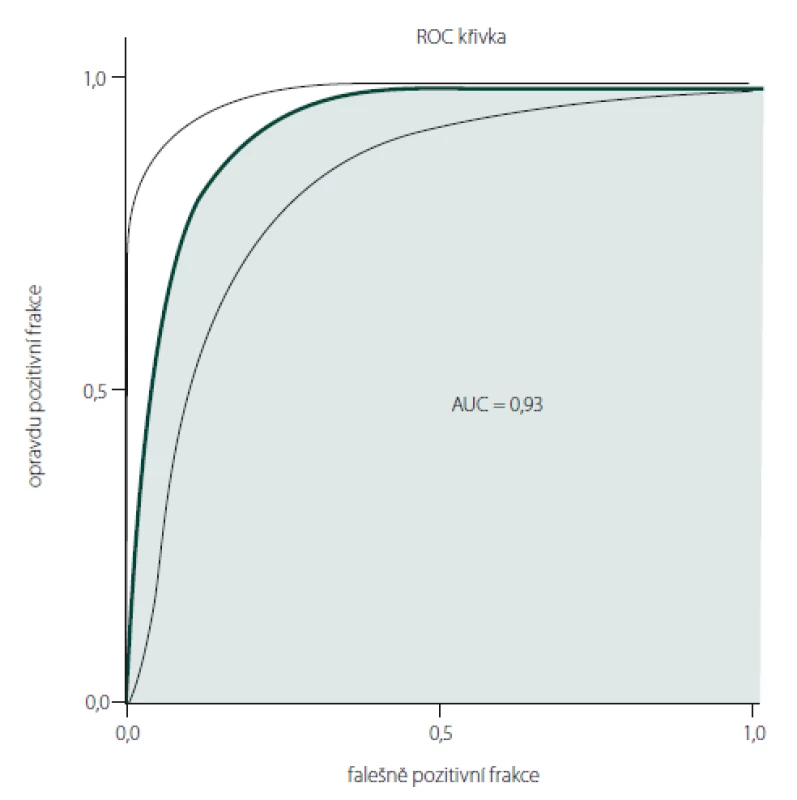
Diskuze
Výsledky prezentované pilotní studie ukazují, že vyšetření TCS s využitím hodnocení atrofie MTL pomocí digitální analýzy obrazu je schopno odlišit pacienty s AD od kontrolních subjektů bez postižení kognitivních funkcí s relativně vysokou senzitivitou a specifitou. Jako marker atrofie MTL byl použit index BWR, který porovnává poměr echogenních struktur v oblasti MTL (kortex a subarachnoidální prostory) a anechogenních struktur (bílá hmota MTL). Optimální mezní hodnota BWR pro rozlišení mezi pacienty s AD a zdravými kontrolami byla 2,5 a senzitivita při rozlišení pacientů s AD od subjektů s normálními kognitivními funkcemi dosáhla 90 %, specifita 87 %, pozitivní prediktivní hodnota 82 % a negativní prediktivní hodnota 93 %.
Doposud byly provedeny jen dvě další studie s detekcí atrofie MTL jako markeru pro odlišení AD od zdravých subjektů pomocí TCS. V první publikované studii [12] autoři testovali měření šíře jednotlivých struktur v oblasti MTL – výšky a šířky MTL, šířky ambientní cisterny a výšky choroidální štěrbiny. Nejlepší parametr k diferenciaci mezi pacienty s AD a zdravými kontrolami byl poměr výšky MTL a výšky choroidální štěrbiny se senzitivitou 83 % a specifitou 76 %. Následná studie [17] ukázala, že ještě lepších výsledků při vyšetření TCS lze dosáhnout při měření výšky choroidální štěrbiny a šířky hrotu temporálního rohu postranní komory u MTL. Při součtu obou vzdáleností hraniční hodnota 8,4 mm odlišila pacienty s AD a zdravé kontroly se senzitivitou 85 % a specifitou 83 %. Navíc korelace v měření výšky choroidální štěrbiny a šířky hrotu temporálního rohu postranní komory mezi TCS a MR byly střední až silné (r = 0,47–0,89) s AUC = 0,93. V naší studii jsme dosáhli lehce vyšší senzitivity i specifity a shodné AUC při použití digitální analýzy obrazu s využitím vyvíjeného počítačového programu B-Mode Assist oproti oběma zmíněným studiím, ve kterých bylo hodnocení prováděno vizuálně s měřením vzdáleností pomocí kaliperu.
Nicméně vyšetření TCS by do budoucna nemělo nahrazovat MR jako zlatý standard pro hodnocení atrofie MTL a hipokampu jako biomarkeru pro diagnostiku AD. Vzhledem ke své relativně nízké ceně a dobré reprodukovatelnosti by mohlo sloužit jako skríningové vyšetření a MR by byla následně indikována k potvrzení diagnózy. K určení rozsahu atrofie MTL a hipokampu jsou při vyšetření MR používány různé strategie, např. škály vizuálního hodnocení MTL [18,19], manuální nebo automatizované počítačové morfologické metody měření MTL (segmentace mozku a morfometrie založená na voxelu) [20] anebo měření hipokampální oblasti [21]. Opakovaně bylo prokázáno, že detekce MR atrofie MTL nebo hipokampu dokáže s vysokou senzitivitou a specifitou odlišit pacienty s AD nebo mírnou kognitivní poruchou od zdravých subjektů [22]. Tato atrofie koreluje s rychlostí progrese kognitivního deficitu [23] a je spojena s častějším a časnějším přechodem mírné kognitivní poruchy do AD [9,10,24–27]. Jelikož se však nejedná o specifický ukazatel AD, je v poslední době zaměřována pozornost i na jiné oblasti mozku, jejichž atrofie může souviset s AD [28]. Kombinace měření a hodnocení více regionů by do budoucna mohla dále zvýšit specifitu MR diagnostiky pro AD [29].
Techniky TCS jsou v současnosti primárně zaměřeny na diagnostiku cévních patologií, a to i na poli diagnostiky demencí. Jelikož vaskulární patologie zvyšují riziko vzniku a progrese AD a navíc ateroskleróza a AD i mírná kognitivní porucha mají prakticky totožné rizikové faktory [30,31], dochází k velkému překryvu mezi vaskulární demencí a AD [32]. Kromě detekce tepenných stenóz, okluzí a postižení drobných mozkových tepen (small vessel disease) však transkraniální duplexní sonografické vyšetření dokáže detekovat i strukturální patologie, jako rozšíření komorového systému a dále poskytuje diagnostiku hydrocefalu s možností rozlišení normotenzního a obstrukčního hydrocefalu [33], detekci hyperechogenní substantia nigra u pacientů s Parkinsonovou nemocí a demencí [34], rozšíření komorového systému v kombinaci s oboustranným nálezem hyperechogenní substantia nigra u pacientů s demencí s Lewyho tělísky [35], změnu echogenity dalších oblastí mozku u jiných neurodegenerativních onemocnění jako u Wilsonovy nemoci, Huntigtonovy chorey nebo dystonie či detekovat potenciálně léčitelné příčiny poruchy kognitivních funkcí, jako jsou nádory, subdurální hematom apod. [33].
Na závěr je třeba se ještě zmínit o některých limitacích prezentované studie. Do studie byli zařazeni jen pacienti s AD a zdravé kontroly bez kognitivního deficitu. Nebyli zařazeni pacienti se subjektivní poruchou kognitivních funkcí a mírnou kognitivní poruchou. Nebyli zařazeni ani pacienti s jiným typem demence. Z těchto důvodů je potřeba v následujících studiích otestovat význam hodnocení TCS atrofie MTL v diferenciaci různých onemocnění vedoucích k poruše kognitivních funkcí a především ověřit, zda je patologický nález poměru BWR u subjektů bez kognitivní poruchy indikátorem rychlejší nebo častější konverze do AD. V prezentované studii také nebyl provedena korelace TCS nálezů na MR mozku. Toto je v současnosti předmětem navazující studie.
Závěr
Výsledky prezentované studie ukázaly, že digitální analýza obrazu TCS s automatickým hodnocením indexu BWR jako známky atrofie MTL může být přínosná v diagnostice AD v časné fázi a dokáže odlišit pacienty s AD od subjektů bez postižení kognitivních funkcí se senzitivitou 90 % a specifitou 87 %. Nicméně v budoucnu je potřeba provést další studie k ověření využitelnosti indexu BWR v diferenciální diagnostice demencí a predikci konverze do AD.
Etické aspekty
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008) a byla schválena lokální etickou komisí FN Ostrava (475/2015, 4. 6. 2015). Všichni pacienti podepsali informovaný souhlas s účastí ve studii. Studie byla registrována před zařazením prvního pacienta na www.clinicaltrials.gov (Identifier: NCT02845830).
Grantová podpora
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 16-28628A a grantem Univerzity Palackého s reg. č. JG_2019_004. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. David Školoudík, Ph.D.,
FESO, FEAN
Neurologická klinika
FN Ostrava
17. listopadu 1790/5
708 52 Ostravaskoloudik@email.cz
e-mail:Přijato k recenzi: 24. 1. 2020
Přijato do tisku: 4. 3. 2020
Zdroje
1. Ferri CP, Prince M, Brayne C et al. Global prevalence of dementia: a Delphi consensus study. Lancet 2005; 366 (9503): 2112–2117. doi: 10.1016/S0140-6736 (05) 6 7889-0.
2. Lobo A, Launer LJ, Fratiglioni L et al. Prevalence of dementia and major subtypes in Europe: a collaborative study of population-based cohorts. Neurologic diseases in the elderly research group. Neurology 2000; 54 (11 Suppl 5): S4–S9.
3. Rizzi L, Rosset I, Roriz-Cruz M. Global epidemiology of dementia: Alzheimer‘s and vascular types. Biomed Res Int 2014; 2014 : 908915. doi: 10.1155/2014/908915.
4. Ressner P, Hort J, Rektorová I et al. Doporučené postupy pro diagnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí. Cesk Slov Neurol N 2008; 71/104 (4): 494–501.
5. Sheardová K, Hort J, Rusina R et al. Doporučené postupy pro terapii Alzheimerovy nemoci a ostatních demencí. Neurol Praxi 2009; 10 (1): 28–31.
6. Kehoe EG, McNulty JP, Mullins PG et al. Advances in MRI biomarkers for the diagnosis of Alzheimer‘s disease. Biomark Med 2014; 8 : 1151–1169. doi: 10.2217/bmm. 14.42.
7. Harper L, Barkhof F, Scheltens P et al. An algorithmic approach to structural imaging in dementia. J Neurol Neurosurg Psychiatry 2014; 85 (6): 692–698. doi: 10.1136/ jn np-2013-306285.
8. Bartoš A, Zach P, Diblíková F et al. Vizuální kategorizace mediotemporální atrofie na MR mozku u Alzheimerovy nemoci. Psychiatrie 2007; 11 (Suppl 3): 49–52.
9. Liu Y, Paajanen T, Zhang Y et al. Analysis of region al MRI volumes and thicknes ses as predictors of conversion from mild cognitive impairment to Alzheimer‘s disease. Neurobiol Aging 2010; 31 (8): 1375–1385. doi: 10.1016/ j. neurobio laging.2010.01.022.
10. Fennema-Notestine C, McEvoy LK, Hagler DJ et al. Structural neuroimag ing in the detection and prognosis of pre-clinical and early AD. Behav Neurol 2009; 21 (1): 3–12. doi: 10.3233/ BEN-2009-0230.
11. Tomek A, Urbanová B, Magerová H et al. Neurosonologické markery predikce kognitivní deteriorace. Cesk Slov Neurol N 2017; 80/113 (4): 409–417. doi: 10.14735/amcsnn2017409.
12. Yilmaz R, Pilotto A, Roeben B et al. Structural ultrasound of the medial temporal lobe in Alzheimer’s disease. Ultraschall Med 2017; 38 (3): 294–300. doi: 10.1055/s-0042-107150.
13. Frisoni GB, BocchettaM, Chetelat G et al. Imaging markers for Alzheimer disease: which vs how. Neurology 2013; 81 (5): 487–500. doi: 10.1212/WNL.0b013e31829d8 6e8.
14. Školoudík D, Walter U. Method and validity of transcranial sonography in movement disorders. In Rev Neurobiol 2010; 90 : 7–34. doi: 10.1016/S0074-7742 (10) 90002-0.
15. Mašková J, Školoudík D, Burgetová A et al. Comparison of transcranial sonography-magnetic resonance fusion imaging in Wilson‘s and early-onset Parkinson‘s diseases. Parkinsonism Relat Disord 2016; 28 : 87–93. doi: 10.1016/j.parkreldis.2016.04.031.
16. McKhann GM, Knopman DS, Chertkow H et al. The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diag-nostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7 (3): 263–269. doi: 10.1016/j.jalz.2011.03.005.
17. Yilmaz R. Detection of medial temporal lobe atrophy using transcranial sonography in Alzheimer’s disease. Ultraschall Med. In press 2020.
18. Scheltens P, Leys D, Barkhof F et al. Atrophy ofmedial temporal lobes on MRI in „probable“ Alzheimer‘s disease and normal ageing: diagnostic value and neuropsychological correlates. J Neurol Neurosurg Psychiatry 1992; 55 (10): 967–972. doi: 10.1136/jnnp.55.10.967.
19. Kaneko T, Kaneko K, Matsushita M et al. New visual rating system for medial temporal lobe atrophy: a simple diagnostic tool for routine examinations. Psychogeriatrics 2012; 12 (2): 88–92. doi: 10.1111/j.1479-8301.2011.00390.x.
20. Leung KK, Barnes J, Ridgway GR et al. Automated cross-sectional and longitudinal hippocampal volume measurement in mild cognitive impairment and Alzheimer‘s disease. Neuroimage 2010; 51 (4): 1345–1359. doi: 10.1016/j.neuroimage.2010.03.018.
21. de Flores R, La Joie R, Chetelat G. Structural imaging of hippocampal subfields in healthy aging and Alzheimer‘s disease. Neuroscience 2015; 309 : 29–50. doi: 10.1016/j.neuroscience.2015.08.033.
22. Teipel S, Drzezga A, Grothe MJ et al. Multimodal imaging in Alzheimer‘s disease: validity and usefulness for early detection. Lancet Neurol 2015; 14 (10): 1037–1053. doi: 10.1016/S1474-4422 (15) 00093-9.
23. Jack CR Jr, Petersen RC, Xu Y et al. Rates of hippocampal atrophy correlate with change in clinical status in aging and AD. Neurology 2000; 55 (4): 484–489. doi: 10.1212/wnl.55.4.484.
24. Devanand DP, Pradhaban G, Liu X et al. Hippocampal and entorhinal atrophy in mild cognitive impairment: prediction of Alzheimer disease. Neurology 2007; 68 (11): 828–836. doi: 10.1212/01.wnl.0000256697.20968.d7.
25. Ten Kate M, Barkhof F, Boccardi M et al. Task force for the roadmap of Alzheimer’s biomarkers. Clinical validity of medial temporal atrophy as a bio marker for Alzheimer’s disease in the context of a structured 5-phase development framework. Neurobiol Aging 2017; 52 : 167–182. doi: 10.1016/ j.neurobio laging.2016.05. 024.
26. Jack CR, Shiung MM, Gunter JL et al. Comparison of different MRI brain atrophy rate measures with clinical disease progression in AD. Neurology 2004; 62 (4): 591–600. doi: 10.1212/01.wnl.0000110315.26026.ef.
27. Vemuri P, Jack CR. Role of structural MRI in Alzheimer’s disease. Alzheimers Res Ther 2010; 2 (4): 23. doi: 10.1186/ alzrt47.
28. Šilhán D, Ibrahim I, Tintěra J et al. Parietální atrofie na magnetické rezonanci mozku u Alzheimerovy nemoci s pozdním začátkem. Cesk Slov Neurol N 2019; 82/115 (1): 91–95. doi: 10.14735/amcsnn201991.
29. Harper L, Fumagalli GG, Barkhof F et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post-mortem confirmed cases. Brain 2016; 139 (Pt 4): 1211–1225. doi: 10.1093/ brain/ aww005.
30. Reitz C, Brayne C, Mayeux R. Epidemiology of Alzheimer disease. Nat Rev Neurol 2011; 7 (3): 137–152. doi: 10.1038/nrneurol.2011.2.
31. Janoutová J, Ambroz P, Kovalová M et al. Epidemiologie mírné kognitivní poruchy. Cesk Slov Neurol N 2018; 81/114 (3): 284–289. doi: 10.14735/amcsnn2018284.
32. Kalaria R. Similarities between Alzheimer‘s disease and vascular dementia. J Neurol Sci 2002; 203–204 : 29–34. doi: 10.1016/s0022-510x (02) 00256-3.
33. Školoudík D. Transkraniální sonografie – možnosti zobrazení intrakraniálních struktur v B obraze. Cesk Slov Neurol N 2017; 80/113 (1): 8–23. doi: 10.14735/ amcsnn20178.
34. Walter U, Skoloudik D, Berg D. Transcranial sonography findings related to non-motor features of Parkinson‘s disease. J Neurol Sci 2010; 289 (1–2): 123–127. doi: 10.1016/j.jns.2009.08.027.
35. Favaretto S, Walter U, Baracchini C et al. Accuracy of transcranial brain parenchyma sonography in the diagnosis of dementia with Lewy bodies. Eur J Neurol 2016; 23 (8): 1322–1328. doi: 10.1111/ene.13028.
Štítky
Detská neurológia Neurochirurgia Neurológia Psychiatria
Článek Poměr fosforylovaného tau proteinu k beta amyloidu v likvoru predikuje pozitivitu amyloidové PETČlánek Chirurgická léčba benigních neurogenních tumorů mediastina – analýza 7letého souboru pacientůČlánek Dopis redakciČlánek Komentář redakceČlánek Prof. Mraček oslavil 90 letČlánek Odešla MUDr. Olga Baudyšová
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2020 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
-
Všetky články tohto čísla
- Cévní morfologie, symptomy, diagnostika a léčba ischemických příhod mozkového kmene
- Je koncept vaskulární demence trvale udržitelný?
- Je koncept vaskulární demence trvale udržitelný? NE
- Je koncept vaskulární demence trvale udržitelný? Komenář
- Mezinárodní klasifikace bolestí hlavy (ICHD-3) – oficiální český překlad
- Schwannóm extrakraniálnej časti trojklanného nervu
- Chirurgická léčba mozkových metastáz
- Cavum septi pellucidi, cavum vergae a cavum veli interpositi
- Poměr fosforylovaného tau proteinu k beta amyloidu v likvoru predikuje pozitivitu amyloidové PET
- Provocative factors and treatment response in juvenile myoclonic epilepsy – experience from a tertiary epilepsy center
- Chirurgická léčba benigních neurogenních tumorů mediastina – analýza 7letého souboru pacientů
- Transkraniální sonografie mediotemporálního laloku u pacientů s Alzheimerovou demencí
- Endarterektomie zevní karotické tepny
- Vestibulární funkce u pacientů s kochleárním implantátem
- Cystická hydatidóza mozečku – vzácná kazuistika
- A case of late brachial plexopathy after chemotherapy and radiotherapy
- Spontaneous vaginal extrusion of the distal catheter of a ventriculoperitoneal shunt
- Opakovaná trombektómia u pacienta so zriedkavou kombináciou etiologických faktorov
- Dopis redakci
- Komentář redakce
- Prof. Mraček oslavil 90 let
- Odešla MUDr. Olga Baudyšová
- K jubileu profesorky Soni Nevšímalové
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Cavum septi pellucidi, cavum vergae a cavum veli interpositi
- Cévní morfologie, symptomy, diagnostika a léčba ischemických příhod mozkového kmene
- Mezinárodní klasifikace bolestí hlavy (ICHD-3) – oficiální český překlad
- Chirurgická léčba mozkových metastáz
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



