-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Komparace multiparametrické magnetické rezonance se silou magnetického pole 3 Tesla s transrektální sonografií naváděnou biopsií prostaty
Comparrison of multiparametric magnetic resonance immaging of the prostate with Tesla magnetic field, with transrectal ultrasound-guided prostate biopsy
Aim:
Modern magnetic resonance immaging (MRI) with 3 Tesla (T) magnetic field opens new possibilities in the diagnostics of prostate cancer. The aim of this study is to compare the results of 3 T MRI of the prostate with the results of transrectal ultrasound (TRUS)-guided biopsy of the prostate and to determine the role of 3 T MRI in the diagnostics of prostate cancer.Material and methods:
In the period from 4/2011 to 4/2013 (1st period) 354 men were evaluated using 3T MRI of the prostate. One hundered ninety two of them (54.2%) underwent MRI before TRUS biopsy of the prostate (pacients with a clinical suspicion of prostate cancer), the remaining 162 participants (45.8%) underwent MRI after TRUS biopsy (patients with at least one negative biopsy and ongoing suspicion of prostate cancer, or those requiring staging before radical prostatectomy). To determine potential developments in the outcome 2 years after beginning of the study, we evaluated control group of 162 men in the period from 5/2013 to 12/2013 (2nd period). One hundered nineteen patients (73.5%) underwent MRI before TRUS biopsy, the remaining 43 (26.5%) underwent MRI after TRUS biopsy. The protocol of 3T MRI included triplane T2 weighted MRI, MR spectroscopy, diffusion-weighted imaging and dynamic contrast-enhanced MRI. Suspect results (according to either biopsy or MRI) were considered positive.Results:
The mean age was 65.4 years (41–82), mean PSA 16.03 ng/ml (1.41–523) in the 1st period and 11.5 ng/ml (2.02–75) in the 2nd period. Sensitivity of MRI was 87.6% and 81.4% in the 1st and 2nd period respectively. Specificity was 56.5% and 68.4% in 1st and 2nd period respectively. Differences between results in patients with MRI before and after biopsy were apparent mainly in specificity which was 46.7% before vs. 70.7% after (in the 1st period) and 62.9% before vs. 92.9% after (in the 2nd period). The most experienced radiologist achieved sensitivity of 83.9% and specificity of 85%, the secon most experienced radiologist achieved sensitivity 71.4% and specificity 50%.Conclusion:
In the 1st period our study showed a relatively high sensitivity (87.56%) and low specificity (56.52%) of 3T MRI of the prostate in the diagnostics of prostate cancer. In the 2nd period the sensitivity had slightly decreased to 81.4%, and contrary to that specificity had increased to 68.4%. Significant relationship between the experience of radiologist and success rate of MRI diagnosis was detected. The reason for low specificity is not necessarily the failure of MRI but it can be the inability to detect cancer using prostate biopsy. In cases where the biopsy is performed after MRI we focus on cancer loci described on MRI. In cases where the cancer has been verified by biopsy, we use MRI results to select an optimal treatment.Key words:
3 T MRI of the prostate, prostate cancer, TRUS biopsy.
Autoři: Alžběta Šobrová 1; Viktor Eret 1; Olga Dolejšová 1; Jiří Ferda 2; Jan Kastner 2; Ondřej Hes 3; Kristýna Pivovarčíková 3; Milan Hora 1
Působiště autorů: Urologická klinika LF UK a FN, Plzeň 1; Klinika zobrazovacích metod LF UK a FN, Plzeň 2; Šiklův patologicko-anatomický ústav LF UK a FN, Plzeň 3
Vyšlo v časopise: Ces Urol 2014; 18(3): 225-233
Kategorie: Původní práce
Souhrn
Cíl:
Moderní přístroje magnetické rezonance (MR) se silou magnetického pole 3 Tesla (T) dávají nové možnosti v diagnostice karcinomu prostaty. Práce srovnává výsledky multiparametrické 3T MR prostaty s výsledky transrektální biopsie prostaty za ultrasonografické kontroly (TRUS), a zjišťuje tak možnou úlohu MR v algoritmu diagnostiky karcinomu prostaty.Materiál a metoda:
Od 4/2011 do 4/2013 (dále 1. období) bylo indikováno 354 mužů k provedení 3T MR prostaty. U 192 (54,2 %) z těchto pacientů bylo MR vyšetření provedeno před biopsií prostaty, u zbylých 162 (45,8 %) po biopsii (u pozitivní biopsie kvůli zpřesnění stagingu, u negativní biopsie při přetrvávající elevaci PSA). K zjištění možné změny výsledků po 2 letech od zahájení studie byla za období 5/2013 až 12/2013 (dále 2. období) vyhodnocena kontrolní skupina pacientů (se stejnou indikací) v počtu 162 mužů – z nich byla u 119 provedena MR před biopsií, u zbylých 43 pacientů po biopsii. Vyšetřovací protokol 3T MR zahrnoval provedení T2 váženého obrazu, MR spektroskopie, difuzně váženého zobrazení a dynamického kontrastního zobrazení. Suspektní nálezy (z biopsie i MR) byly počítány jako nálezy pozitivní.Výsledky:
Průměrný věk všech pacientů byl 65,4 (41–82) let. Průměrná hodnota PSA činila v 1. období 16,03 ng/ml (1,41–523), ve 2. období 11,5 ng/ml (2,02–75). Celková senzitivita MR byla v 1. vs. 2. období 87,6 % vs. 81,4 %, specificita 56,5 % vs. 68,4 %. Rozdíly ve výsledcích u pacientů s MR před a po biopsii byly patrné především u specificity – 46,7 % vs. 70,7 % v 1. období a 62,9 % vs. 92,9 % ve 2. období. Nejzkušenější radiolog dosáhl senzitivity 83,9 % a specificity 85 %, druhý pak senzitivity 71,4 % a specificity 50 %.Závěr:
V 1. období byla zjištěna poměrně vysoká senzitivita (87,6 %) a nižší specificita (56,5 %) 3T MR při detekci karcinomu prostaty. Ve 2. období se lehce snížila senzitivita na 81,4 % a naopak zvýšila specificita na 68,4 %. Byl zaznamenán významný vztah mezi zkušeností radiologa a jeho úspěšností popisu MR. Příčinou nízké specificity však nemusí být selhání metodiky MR, ale neschopnost biopticky karcinom zachytit. Při biopsii prováděné po MR se zaměřujeme na radiologem popsaná ložiska karcinomu. U již biopticky verifikovaného karcinomu využíváme výsledky MR k rozhodování o typu léčby.Klíčová slova:
3T MR prostaty, karcinom prostaty, TRUS bio-psie.ÚVOD
V České republice byla incidence karcinomu prostaty (C61) v roce 2010 131/100 000 (www.uzis.cz) a je nejčastějším nádorem u mužů v České republice počínaje rokem 2005 (s výjimkou dg. C44 – „jiný zhoubný novotvar kůže“) a druhou nejčastější nádorovou příčinou úmrtí – v roce 2010 26,1/100 000 (www.uzis.cz). Zobrazení prostaty a detekce karcinomu prostaty je v radiodiagnostice dlouhodobě velmi problematickou záležitostí. Již v několika studiích bylo ověřeno, že přesnější vyšetření pro diagnostiku karcinomu prostaty než CT, transrektální ultrasonografie (TRUS) či fyzikální vyšetření per rectum je vyšetření magnetickou rezonancí (1–4). Magnetická rezonance (MR) je neinvazivní zobrazovací vyšetření bez radiační zátěže, které může rozlišit normální tkáň prostaty od jejího nádorového postižení, případně jeho extrakapsulární šíření, postižení semenných váčků, pánevní lymfadenopatii či dokonce kostní metastázy. V neposlední řadě může snímky z MR operatér využít k plánování operačního výkonu (velikost prostaty, šíře hrdla močového měchýře, vzdálenost hrdla od chámovodů). Postupem času dochází ke zlepšování zobrazovacích možností MR. Dříve doporučované použití endorektální cívky je poslední dobou vytěsňováno používáním povrchové cívky se zesíleným magnetickým polem z 1,5 Tesla (T) na 3T, což zvyšuje kvalitu rozlišení při současném snížení šumu (5–8). Dalším posunem v zobrazení prostaty pomocí MR bylo obohacení vyšetřovacího, resp. zobrazovacího protokolu o další funkční metodiky, čímž vzniklo tzv. multiparametrické zobrazení. Nyní se využívá jednak T2 vážených obrazů, které ukazují morfologii prostaty ve třech rovinách (u karcinomu hypointenzní zóna), T1 vážených obrazů (vhodných především k zobrazení pánevních uzlin), dále difuzně váženého zobrazení (DWI) – u karcinomu patrná restrikce difuze extracelulární tekutiny, spektroskopie – tedy detekce metabolitů (u karcinomu snížení podílu citrátu a zvýšení cholinu) a dynamického kontrastního zobrazení (DCE) – u karcinomu rychlejší sycení a časnější vymývání kontrastní látky (9–10). Pokud je MR provedena až po biopsii prostaty, doporučuje se vzhledem k posthemoragickým změnám odstup po odběru vzorků alespoň 3 týdny (11). Dle doporučení evropské společnosti pro urogenitální radiologii (ESUR, European Society for Urogenital Radiology) by měla být časová prodleva mezi biopsií a vlastním vyšetřením alespoň 4–6 týdnů (12). Cílem naší práce bylo porovnat výsledky mutliparametrické 3T MR s výsledky TRUS biopsie prostaty, a zjistit tak úlohu MR v algoritmu diagnostiky karcinomu prostaty a možnost jejího využití v naší klinické praxi. Počátek našeho výzkumu se datuje do období, kdy na Klinice zobrazovacích metod FN Plzeň začala být nově MR využívána také k diagnostice karcinomu prostaty. Radiologové tedy s touto metodikou teprve začínali, i když popisům MR obecně se věnují již delší dobu (nejzkušenější radiolog od roku 1995). Cílem bylo tedy zjistit úspěšnost zobrazení karcinomu prostaty v našich podmínkách. Na jedné straně jsou statistické výsledky ze světových studií, avšak na straně druhé je tato metodika zasazena do našeho prostředí s počátečními nulovými zkušenostmi radiologů i urologů.
MATERIÁL A METODA
Od 4/2011 do 4/2013 (dále 1. období) bylo na Urologické klinice FN Plzeň indikováno 354 mužů k provedení 3T MR prostaty (Magnetom Skyra, Siemens, Erlangen, Německo), bez použití endorektální cívky. Všechna vyšetření MR byla provedena na Klinice zobrazovacích metod FN Plzeň, snímky však hodnotilo devět radiologů. Vyšetřovací protokol 3T MR zahrnoval provedení T2 váženého obrazu, MR spektroskopie, difuzně váženého zobrazení a dynamického kontrastního zobrazení. Byla hodnocena hypointenzní ložiska v T2 obrazech, přítomnost vysokého signálu v T1 obrazech, u difuzně váženého zobrazení byly hledány nehomogenity se známkami restrikce difuze, spektroskopie byla analyzována metodou voxel-by-voxel v celém objemu prostaty a za patologické byly označeny nálezy, kde kmit cholinu s kreatinem dosahovaly více než poloviny kmitu citrátu. Při farmakodynamickém hodnocení byl používán analytický software Tissue4D (Siemens, Erlangen, Německo) – byla hodnocena mapa objemu krve v tkáni, objem extracelulární tekutiny a křivka sycení kontrastní látkou. Pokud byl pozitivní nález alespoň ve třech uváděných parametrech, pak byl radiologem popsán jako ložisko karcinomu. Popis ložisek podezřelých z karcinomu od radiologů byl bohužel pouze přibližný – umístění pouze na základě běžného anatomického dělení prostaty. Strukturovaný skórovací systém dle doporučení ESUR, tzv. PI-RADS skóre v rozmezí 1–5, které hodnotí přítomnost, resp. nepřítomnost klinicky signifikantního karcinomu je používáno jako součást definitivního popisu MR až od počátku roku 2014. U 192 (54,2 %) ze všech 354 pacientů bylo MR vyšetření provedeno před biopsií prostaty – pacienti s podezřením na karcinom prostaty při elevaci PSA či suspektním per rektum vyšetření. U zbylých 162 (45,8 %) pacientů byla MR provedena až po biopsii. Tato změna pořadí nebyla záměrná, většinou se jednalo o pacienty ambulantních urologů, kteří měli MR vyšetření doplněno buď při diagnostikovaném karcinomu prostaty před plánovanou radikální prostatektomií (RAPE), či u negativní biopsie při přetrvávající elevaci PSA před případnou re-biopsií. K zjištění možné změny výsledků po 2 letech od zahájení studie byla za období 5/2013 až 12/2013 (dále 2. období) vyhodnocena kontrolní skupina pacientů (se stejnou indikací) v počtu 162 mužů – z nich byla u 119 provedena MR před biopsií, u zbylých 43 pacientů po biopsii. Snímky z MR ve 2. skupině sice celkově hodnotilo také devět radiologů, avšak jeden radiolog hodnotil 109 z celkových 162 pacientů (67 %). Ten se věnuje popisům MR prostaty od počátku roku 2011, další dva radiologové s nejvyšším počtem popsaných MR prostaty se věnují popisům od počátku roku 2012. Biopsie prostaty byla provedena ve všech případech pod kontrolou transrektální ultrasonografie. Počet bioptických vzorků byl odebrán s ohledem na počet předchozích bio-psií – primárně většinou deset vzorků, s každou další biopsií obvykle dva vzorky navíc. Část pacientů však byla bioptována na ambulantních pracovištích, kde byl odebrán i menší počet vzorků. Vzhledem k nemožnosti přesně lokalizovat místo odběru daných vzorků (velký počet bioptujících lékařů), byla při srovnání MR a biopsie posuzována pouze přítomnost či nepřítomnost karcinomu, nebyla však zohledněna jeho lokalizace. Suspektní nálezy (z biopsie i MR) byly počítány jako nálezy pozitivní. Pokud byla provedena MR po biopsii, odstup po odběru vzorků byl minimálně 6 týdnů. Nálezy bioptické byly porovnány s nálezy na MR a následně byla stanovena senzitivita, specificita, pozitivní a negativní prediktivní hodnota MR vztažená k bioptickému nálezu.
VÝSLEDKY
Průměrný věk pacientů byl 65,9 (49–82) let. Průměrná hodnota PSA činila v 1. období 16,03 ng/ml (1,41–523), ve 2. období 11,5 ng/ml (2,02–75). Ve 2. období jsme již pacienty s extrémně vysokými hodnotami PSA k MR neindikovali, tím se snížilo i průměrné PSA. Ze všech 516 pacientů mělo 179 (34,7 %) provedenu biopsii vícekrát než jednou. Nejvyšší počet negativních biopsií u jednoho pacienta činil 7 (i přes popis karcinomu na MR). Senzitivita, specificita, pozitivní a negativní prediktivní hodnota byly vypočítány celkově i zvlášť pro dvě skupiny pacientů (s biopsií prostaty před a po MR) a také zvlášť za obě období (tab. 1). Celková senzitivita MR byla v 1. vs. 2. období 87,6 % vs. 81,4 %, specificita 56,5 % vs. 68,4 %, pozitivní prediktivní hodnota 70,7 % vs. 74,5 % a negativní prediktivní hodnota 79,1 % vs. 76,5 %. Rozdíly ve výsledcích u pacientů s MR před a po biopsii byly patrné především u specificity – 46,7 % vs. 70,7 % v 1. období a 62,9 % vs. 92,9 % ve 2. období. Ve 2. období byla vyhodnocena úspěšnost tří radiologů, kteří se podíleli na popisu nejvíce pacientů. Nejzkušenější radiolog popsal ve 2. období 109 MR prostaty (67 %) se senzitivitou 83,9 % a specificitou 85 %. Druhý nejvyšší počet MR 17 (10,5 %) popsal radiolog se senzitivitou 71,4 % a specificitou 50 % a na třetím místě byl s počtem 14 popsaných MR (8,6 %) radiolog se senzitivitou 85,7 % a specificitou 14,3 %. Celkem byl biopticky karcinom prokázán u 259 mužů, z nichž 157 následně podstoupilo radikální prostatektomii, 84 radioterapii, jeden pacient byl (dle dostupných informací) léčen v protonovém centru, u 12 pacientů byla pro pokročilost onemocnění zahájena pouze hormonální terapie a u pěti pacientů byl stanoven postup watchfull waiting. Staging cT3a mělo popsáno 16 pacientů (z nich sedm podstoupilo RAPE a devět radioterapii), staging cT3b mělo na MR popsáno 40 pacientů (z nich deset podstoupilo RAPE a třicet radioterapii).
Tab. 1. MRI senzitivita, specificita, pozitivní a negativní prediktivní hodnota u pacientů s biopsií prostaty před MR, po MR a u všech pacientů (1. období 4/2011 až 4/2013, 2. období 5/2013 až 12/2013) Table 1. MRI sensitivity, specificity, positive predictive value and negative predictive value in patients with prostate biopsy before MR, after MR and in all patients. (1st period 4/2011–4/2013, 2nd period 5/2013–12/2013 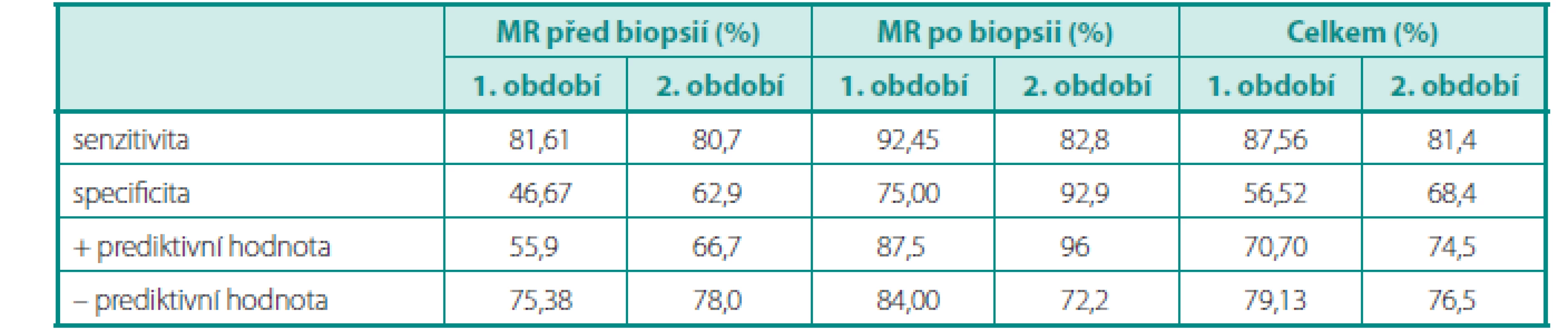
Obr. 1. 3T MRI prostaty T2 vážený obraz – nález tumoru v levé periferní zóně (hypointenzní oblast) Fig. 1. T2 weighted 3T MRI – tumor focus in the left peripheral zone (hypo-intense region) 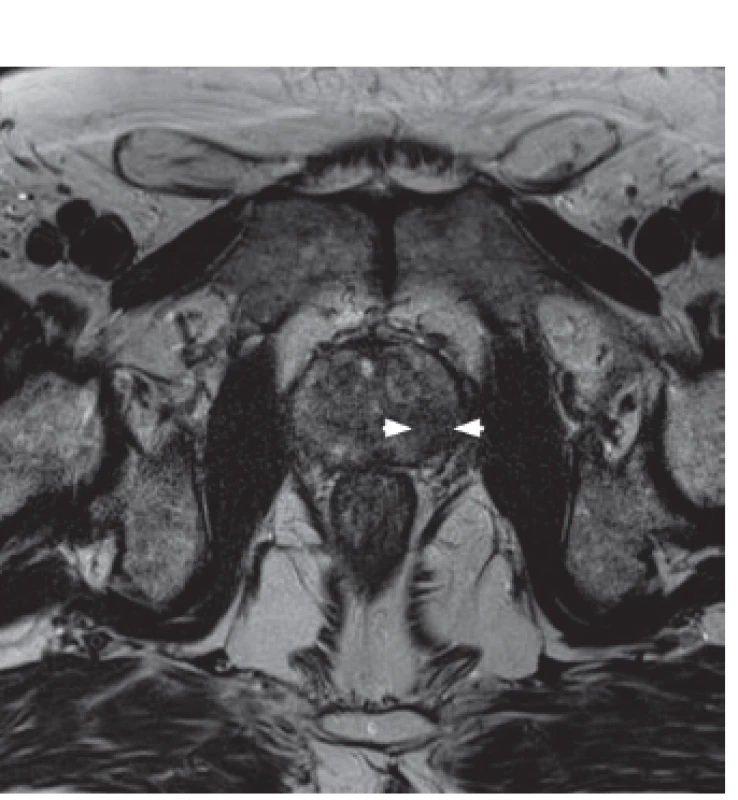
Obr. 2. Farmakodynamická analýza – ložisko hypervaskularizace v levém periferním laloku jako známka karcinomu Fig. 2. DCE (dynamic contrast enhanced) MRI – tumor focus in the left peripheral zone (region of hypervascularization) 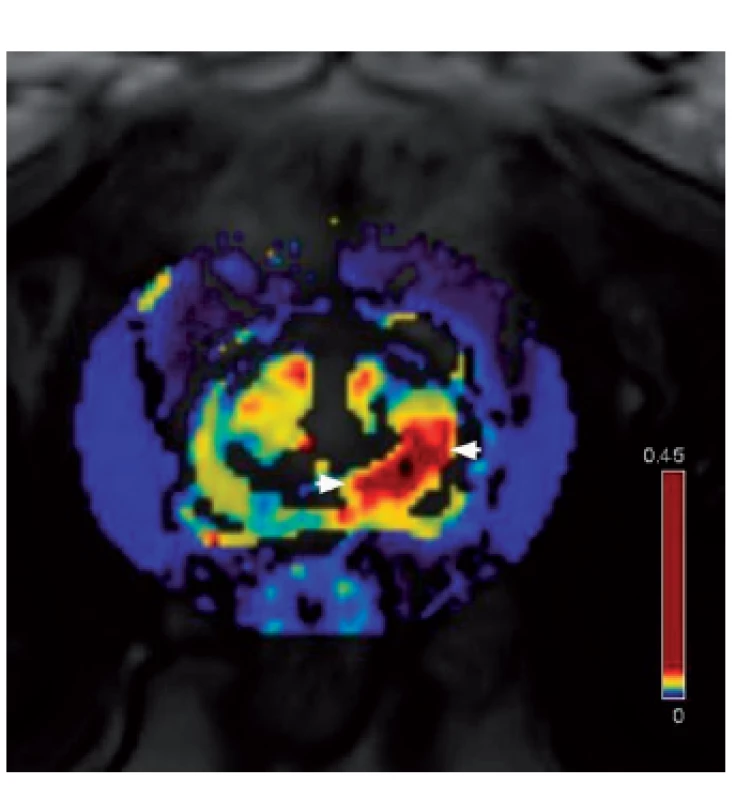
DISKUSE
Možnosti detekce karcinomu prostaty pomocí MR jsou v urologických kruzích poměrně diskutovaným tématem. V ostatních světových studiích se senzitivita 3T MR prostaty při využití multiparametrických technik pohybuje mezi 73–94 %, specificita mezi 43–91 % (13 až 16). V podobné studii byl rozdíl senzitivity MR před a po biopsii srovnatelný s našimi výpočty 84% (před biopsií) vs. 92% (po biopsii) (16). Přímé srovnání číselných hodnot je však problematické, jelikož tyto citované práce používaly při stanovení přesnosti MR jinou (z hlediska metodologie výzkumu vhodnější) referenční metodu – odvozovali přesnost MR + TRUS biopsie vůči zlatému standardu pooperačních histologických řezů. Pouze radiologové z FN Plzeň v roce 2013 postupovali stejnou metodou jako my, a prospektivně tak zhodnotili 164 mužů, kteří všichni podstoupili MR před biopsií. Senzitivita vyšla 97,6%, specificita 85% (17). Obecně se studie většinou shodují na tom, že detekovatelná jsou ložiska nad 5 mm v průměru (13–16, 18). Metodikou jak skutečně zjistit přesnost zobrazení MR by bylo porovnání nálezů na snímcích s celoplošnými řezy prostatou (whole-mount sections), získaných při následné radikální prostatektomii (19). Tímto výzkumem se naše pracoviště dále zabývá a bude předmětem dalších publikací. Příčinou diskrepance výsledků v naší studii u pacientů s MR před a po biopsii může být několik činitelů. Valná část pacientů, kteří měli prováděnou MR až po biopsii, měla již v té době biopticky ověřený karcinom prostaty, což může radiologům usnadňovat rozhodování při popisu MR. Nelze tedy lepší výsledky u těchto pacientů využít k obecnému doporučení provádění MR až po biopsii. Vhodnější by byla zaslepená studie, kdy by radiolog neznal výsledky předchozí biopsie. Otázkou je také důležitost zkušenosti radiologa při popisování snímků z MR. Také z toho důvodu byli při naší práci rozděleni pacienti do dvou období. Předpokládali jsme výraznější zlepšení ve 2. období – tedy po 2 letech zkušeností radiologů s touto metodikou. Došlo sice ke zlepšení celkové specificity, avšak senzitivita MR se naopak snížila. Nevýhodou při vyhodnocování našeho souboru pacientů bylo velké množství popisujících radiologů. Prokázal se však výrazný vztah mezi zkušenostmi radiologa s MR prostaty a jeho úspěšností v popisu. Zejména specificita významně stoupala společně s množstvím popsaných MR. Proto nyní usilujeme o to, aby snímky z MR popisovali pouze dva radiologové, kteří by se na MR diagnostiku karcinomu prostaty specializovali, nově navíc s využitím 16 (resp. 27) sektorového standardizovaného schématu. Když byl totiž u pacienta na MR popsán karcinom pouze slovně dle anatomického dělení prostaty, urolog mohl cílit suspektní ložisko při následné TRUS biopsii jen velmi přibližně. Příčinou relativně nízké specificity MR při srovnávání s výsledky biopsie tedy nemusí být selhání MR, ale neschopnost biopticky karcinom zachytit. Obtížnou lokalizací k biopsii prostaty jsou hlavně tumory ve ventrální části či v bázi prostaty. Dle dostupných dat je u nemocných s patologickou hladinou PSA 66–71 % biopsií negativních a až 23 % karcinomů prostaty není zastiženo v první biopsii (20). Hledají se tedy nové metody, které by mohly bioptickou záchytnost karcinomu zlepšit. Jednou z nich je fúze MR a USG – tedy detekce ložisek karcinomu prostaty na MR s následným vytvořením 3D modelu prostaty na USG v reálném čase a fúzí snímků MR s vytvořeným 3D modelem. Zobrazená ložiska karcinomu jsou cíleně bioptována pod transrektální USG kontrolou. Dle publikovaných prací je tak dosaženo lepší bioptické záchytnosti karcinomu prostaty (21, 22). U karcinomu prostaty s GS 7 a vyšší byl biopticky detekován karcinom pouze díky této metodě u 38 % pacientů (23). Jinou metodikou je biopsie prostaty přímo pod kontrolou MR, kdy je vytvořen 3D model prostaty a podezřelá ložiska jsou cíleně bioptována transperineálně či nyní spíše transrektálně. Ve studii zabývající se touto metodikou byla (u pacientů po 2–7 předchozích negativních TRUS biopsiích) záchytnost karcinomu při následné re-biopsii pod MR kontrolou dokonce 40 % (resp. 59 % u pacientů pouze s diagnostikovaným tumorem na MR) (24, 25). Tyto metody jsou tedy budoucností (ve světě již současností) detekce karcinomu prostaty s MR jako hlavním nástrojem. V české urologii si však zatím bohužel MR prostaty nenašla své pevné místo. Je prováděna pouze na některých pracovištích a její rutinní používání v diagnostice karcinomu prostaty je mnohými urology opomíjeno z důvodu ne-ustáleného doporučení a hlavně ekonomické stránky. Často kladenou otázkou je také načasování provedení MR. Na našem pracovišti je snaha provádět MR vždy před první TRUS biopsií (pokud pacient nemá extrémně vysokou hladinu PSA, kde je již předpoklad metastáz). Výhodu vidím především v možnosti cílit na suspektní ložiska při následné biopsii, jelikož při TRUS biopsii odebíráme vzorky prakticky „naslepo“, což může být důvodem nízké záchytnosti a vysokého počtu re-biopsií. Pacienti sledovaní pro elevaci PSA u ambulantních urologů vzhledem k ceně MR v naprosté většině před první biopsií MR provedenu nemají a bývají na naši kliniku posíláni k dovyšetření při přetrvávající elevaci PSA a negativní biopsii či biopsiích. Vzhledem k finančním limitům ambulantních specialistů se toto schéma v nejbližší době jistě nezmění.
Obr. 3. Dynamické kontrastní zobrazení – rychlejší sycení a časnější vymývání kontrastní látky v tumorozní tkáni (přerušovaná čára) než ve zdravé tkáni prostaty (plná čára) Fig. 3. Time-signal intensity curves from dynamic contrast-enhanced MR imaging show faster and stronger enhancement and faster washout in prostate cancer (broken line) than in normal tissue (solid line) 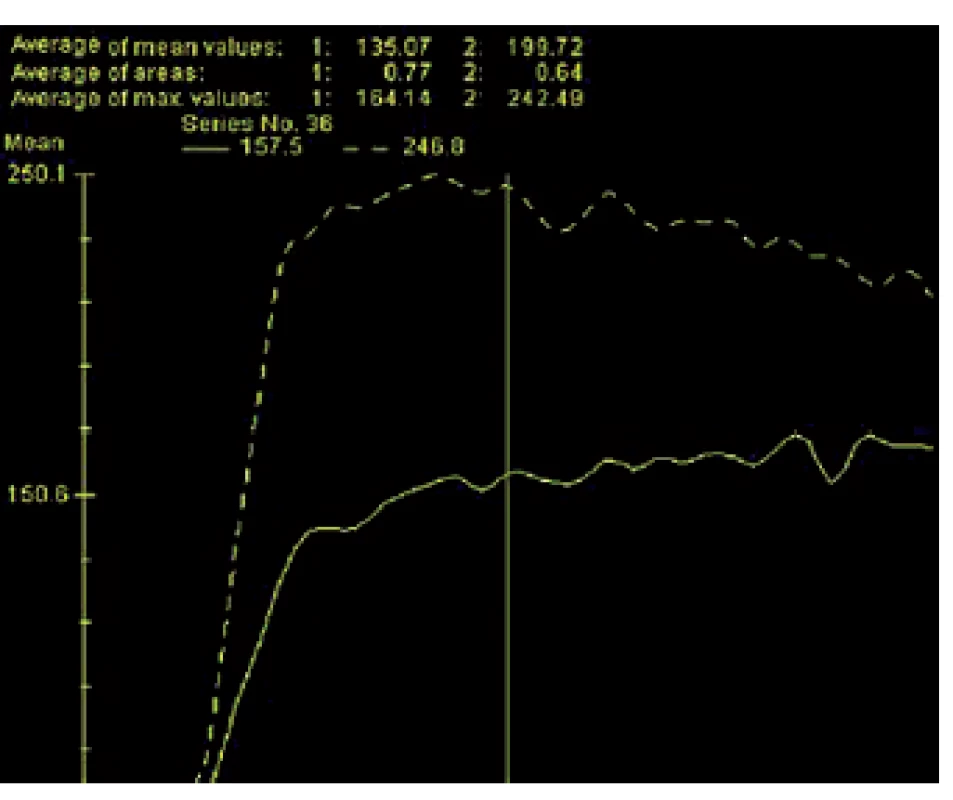
Obr. 4. MR spektroskopie – elevace hladiny cholinu s poklesem hladiny citrátu jako známka podezření na karcinom prostaty v periferní zóně vlevo Fig. 4. MR spectroscopy – elevation of choline level with a decrease in citrate level is the spectral signature of suspection of prostate cancer in the left peripheral zone of the prostate 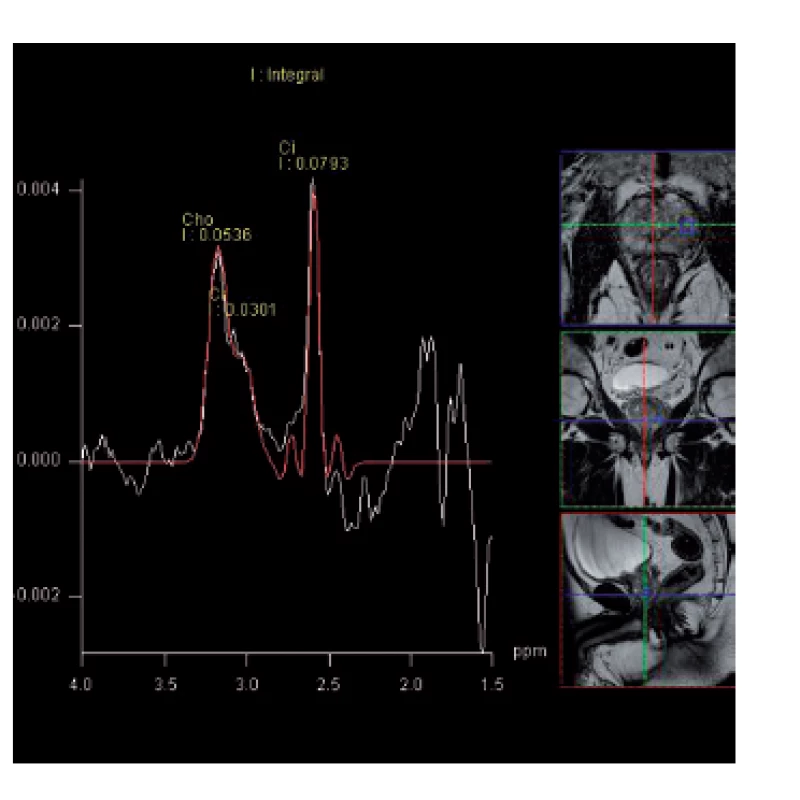
ZÁVĚR
Při detekci karcinomu prostaty pomocí 3T MR jsme zjistili v 1. období poměrně vysokou senzitivitu (87,56 %), avšak nižší specificitu (56,52 %). Ve 2. období se lehce snížila senzitivita na 81,4 % a naopak zvýšila specificita na 68,4 %. Byl zaznamenán významný rozdíl v úspěšnosti jednotlivých radiologů. Nejzkušenější radiolog popisoval se senzitivitou 83,9 % a specificitou 85 %, druhý pak se senzitivitou 71,4 % a specificitou 50 %. Je zde tedy patrná zásadní úloha radiologa a jeho zkušeností. Využití MR v detekci karcinomu prostaty se jeví vhodné před biopsií k následnému cílení popsaných suspektních ložisek či u pacientů s opakovanými elevacemi PSA, u kterých nebylo biopticky nádorové onemocnění zjištěno. Vyšetření MR však můžeme využít také u pacientů s již biopticky verifikovaným karcinomem – zpřesněním stagingu můžeme lépe rozhodovat o typu léčby. Příčinou nízké specificity nemusí být selhání metodiky MR, ale neschopnost biopticky karcinom zachytit. Budoucností tedy může být využití MR při biopsii prostaty – v reálném čase či fúzí s USG.
Došlo: 7. 5. 2014.
Přijato: 9. 9. 2014.
Kontaktní adresa
MUDr. Alžběta Šobrová
Urologická klinika FN
E. Beneše 13, 305 99 Plzeň
e-mail: sobrovam@fnplzen.cz
Podpořeno MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Střet zájmů: žádný.
Zdroje
1. Presti JC Jr, Hricak H, Narayan PA, Shinohara K, White S, Carroll PR. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR Am J Roentgenol 1996; 166 : 103–108.
2. Jackson AS, Parker CC, Norman AR, Padhani AR, Huddart RA, Horwich A, et al. Tumour staging using magnetic resonance imaging in clinically localised prostate cancer: relationship to biochemical outcome after neo-adjuvant androgen deprivation and radical radiotherapy. Clin Oncol (R Coll Radiol) 2005; 17 : 167–171.
3. Hricak H, Dooms GC, Jeffrey RB, Avallone A, Jacobs D, Benton WK, et al. Prostatic carcinoma: staging by clinical assessment, CT, and MR imaging. Radiology 1987; 162 : 331–336.
4. Fuchsová R, Topolčan O, Vrzalová J, Hora M, Dolejšová O, Klečka J, Kasík P. Přínos stanovení [-2]proPSA v diferenciální diagnostice karcinomu prostaty (Benefit of dermining [-2] proPSA levels in the defferential diagnosis of prostate cancer). Ces Urol 2014; 18(1): 21–25.
5. Scheenen TWJ, Heijmink SW, Roell SA, et al. Three-dimensional proton MR spectroscopy of human prostate at 3 T without endorectal coil: feasibility. Radiology 2007; 245 : 507–516.
6. Heijmink SW, Futerer JJ, Hambrock T, et al. Prostate cancer: body-array versus endorectal coil MR imaging at 3.0 T – comparison of image quality, localization, and stafing performance. Radiology 2007; 244 : 184–195.
7. Hora M, Stránský M, Trávníček I, Ürge T, Eret V, Kreuzberg B, et al. Three Tesla MRI biphasic angiography – a method for preoperative assessment of the vascular supply in renal tumours – a surgical perspective, World J Urol 2013; 31(5): 1171–1176 [Epub ahead of print 2012 Apr 19].
8. Hora M, Stránský P, Trávníček I, Ürge T, Eret V, Kreuzberg B, et al. Využití dvoufázové 3T MRI angiografie v plánování operační léčby u nádorů ledvin (Biphasic 3T MRI angiography for planning of kidney tumor surgery). Ces Urol 2013; 17(3): 183–192.
9. Franiel T, Hamm B, Hricag H. Dynamic contrast-enhanced magnetic resonance imaging and pharmacokinetic models in prostate cancer. Eur Radiol 2011; 21 : 6116–6126.
10. Bloch BN, Furman-Haran E, Helbich TH, et al. Prostate cancer: accurate determination of extracapsular extention with high-spatial-resolution dynamic contrast-enhanced and T2 weighted MR imaging: intitial results. Radiology 2007; 245 : 176–185.
11. Ikonen S, Kivisaari L, Vehmas T, Tervahartiala P, Salo JO, Taari K, et al. Optimal timing of post-biopsy MR imaging of the prostate. Acta Radiol 2001; 42 : 70–73.
12. Barentsz JO, et al. ESUR prostate MR guidelines 2012. Eur Radiol 2012; 22 : 746–757.
13. Arsov C, Blondin D, Rabenalt R, Antoch G, Albers P, Quentin M. Standardised scoring of a multi-parametric 3-T MRI for a targeted MRI-guided prostate biopsy. Urologe A. 2012; 51(6): 848–856. doi: 10.1007/s00120-012-2825-6.
14. Jager GJ, Ruijter ET, van de Kaa CA, et al. Dynamic TurboFLASH subtraction technique for contrast-enhanced MR imaging of the prostate: correlation with histopathologic results. Radiology 1997; 203 : 645–652.
15. Villers A, Puech P, Mouton D, et al. Dynamic contrast enhanced, pelvic phased array magnetic resonance imaging of localized prostate cancer for predicting tumor volume: correlation with radical prostatectomy findings. J Urol 2006; 176(6 Pt 1): 2432–2437.
16. Myung Sun Choi, Yong Sun Choi, Byung Il Yoon, Su Jin Kim, Hyuk Jin Cho, Sae Woong Kim. The Clinical Value of Performing an MRI before Prostate Biopsy Korean J Urol 2011; 52(8): 572–577.
17. Ferda J, Kastner J, Hora M, Hes O, Fínek J, Topolcan O, Kreuzberg B. A role of multifactorial evaluation of prostatic 3T MRI in patients with elevated prostatic-specific antigen levels: prospective comparison with ultrasound-guided transrectal biopsy. Anticancer Res 2013; 33(6): 2791–2795.
18. Shimizu T, Nishie A, Ro T, Tajima T, Yamaguchi A, Kono S, et al. Prostate cancer detection: the value of performing an MRI before a biopsy. Acta Radiol 2009; 50 : 1080–1088.
19. Pivovarčíková K, Branžovský J, Bauleth K, Trávníček I, Dolejšová O, Šobrová A, Hora M, Hes O. Radikální prostatektomie – sestava vyšetřovaná metodikou whole-mount section. Ces Urol 2014; 18(1): 26–32.
20. Roehl KA, Antenor JA, Catalona WJ. Serial biopsy results in prostate cancer screening study. J Urol 2002; 167 : 2435–2439.
21. Pinto PA, Chung PH, Rastinehad AR, Baccala AA Jr, Kruecker J, Wood BJ. Magnetic resonance imaging/ultrasound fusion guided prostate biopsy improves cancer detection following transrectal ultrasound biopsy and correlates with multiparametric magnetic resonance imaging. J Urol 2011; 186(4): 1281–1285.
22. Hadaschik BA, Kuru TH, Tulea C, Rieker P, Popeneciu IV, Simpfendörfer T, et al. A novel stereotactic prostate biopsy system integrating pre-interventional magnetic resonance imaging and live ultrasound fusion. J Urol 2011; 186(6): 2214–2220.
23. Sonn GA, Natarajan S, Margolis DJ, Macairan M, Lieu P, Marks LS. Targeted biopsy in the detection of prostate cancer using an office based magnetic resonance ultrasound fusion device. J Urol 2013; 189(1): 86–92.
24. Hambrock T, Somford DM, Hoeks C, et al. Magnetic resonance imaging guided prostate biopsy in men with repeat negative biopsies and increased prostate specific antigen. J Urol 2010; 183 : 520–527.
25. Hoeks C, Schouten M, Bomers J, Hambrock T, Henk Vergunst, et al. Three-Tesla magnetic resonance-guided prostate biopsy in men with increased prostate-specific antigen and repeated, negative, random, systematic, transrectal ultrasound biopsies: detection of clinically significant prostate cancers. European urology 2012; 62 : 902–909.
Štítky
Detská urológia Nefrológia Urológia
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2014 Číslo 3- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Současný stav a budoucnost financování urologické péče v České republice
- Varikokéla
- Penis šetřící metody léčby nižších T kategorií karcinomu penisu
- Aktivní sledování u karcinomu prostaty
- Zhodnocení věkově specifického PSA a PSA velocity na základě biopsií prostaty
- Komparace multiparametrické magnetické rezonance se silou magnetického pole 3 Tesla s transrektální sonografií naváděnou biopsií prostaty
- Litotrypse extrakorporální rázovou vlnou – čtyřleté zkušenosti s elektromagnetickým litotryptorem Urontech URO-EMX
- Zánětlivý pseudotumor močového měchýře jako projev aktivity u pacientky s granulomatózou s polyangiitidou (Wegenerovou granulomatózou) – méně obvyklá manifestace ANCA-asociované vaskulitidy
- Ze zahraniční stáže
- Mezioborová spolupráce urologů a neurologů při diagnostice a léčbě pacientů s roztroušenou sklerózou
- První postgraduální workshop o urolitiáze
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Varikokéla
- Zhodnocení věkově specifického PSA a PSA velocity na základě biopsií prostaty
- Aktivní sledování u karcinomu prostaty
- Penis šetřící metody léčby nižších T kategorií karcinomu penisu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



