-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
VÝZNAM STANOVENÍ MOČOVÉ HLADINY TATI (TUMOUR ASSOCIATED TRYPSIN INHIBITOR) PRO DIAGNOSTIKU A PROGNÓZU TUMORŮ MOČOVÉHO MĚCHÝŘE
URINE TUMOUR ASSOCIATED TRYPSIN INHIBITOR (TATI) IN DIAGNOSIS AND PROGNOSIS OF TRANSITIONAL CELL CARCINOMA OF THE BLADDER
Aim:
The aim of this study was to assess the utility of TATI level in urine as a non-invasive method for detecting urinary bladder cancer and evaluating its prognosis.Materials and Methods:
Sixty three patients were enrolled in the study (38 men, 25 women), with a mean age of 66.2 years, and an average follow-up time of 23 months. Patients were divided into groups according to tumour grade, stage, number of lesions, and their size. Thirty three patients with benign urological disease were included as controls.Results:
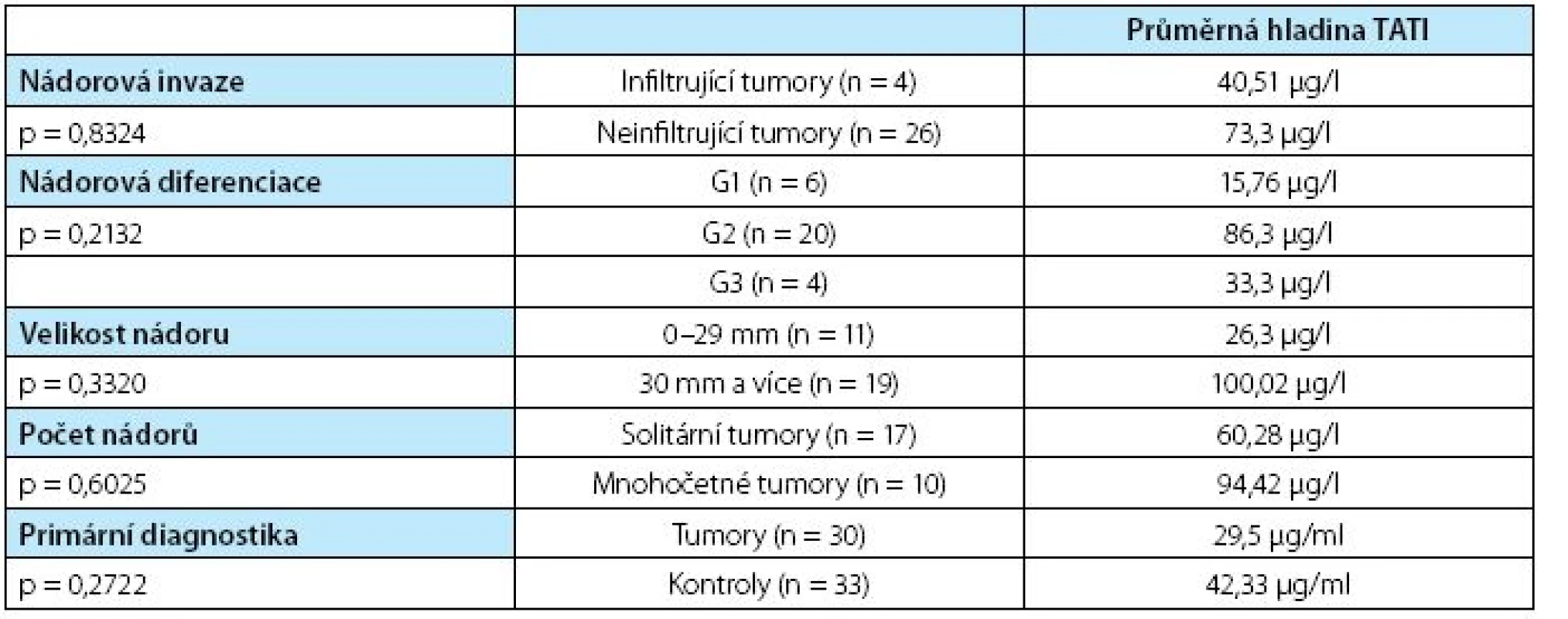
The median TATI level in the group patients with tumours was 68.65 μg/l. In the control group it was 20.38 μg/l. The mean TATI level was 15.76 μg/l in the G1 group, 86.3 μg/l in G2 group, and 33.3 μg/l in G3 group. The mean TATI level in patients with a TaT1 tumour was 73.3 μg/l, and 40.51 μg/l in patients with an invasive carcinoma. The TATI level in solitary tumours was 60.28 μg/l, 94.42 μg/l in multiple tumours, 26.3 μg/l in tumours up to 3 cm, and 100.02 μg/l in larger tumours. The mean TATI level in the group of patients with bladder tumour recurrence during follow-up was 60.3 μg/l, 75.0 μg/l without recurrence, 12.0 μg/l in patients who progressed, and 55.7 μg/l in patients who did not progress.Conclusions:
Our results demonstrate that the level of TATI in the urine does not correlate with the risk of bladder tumour, tumour size, multiplicity or the grade, and recurrence free survival.KEY WORDS:
bladder tumours, non-invasive diagnosis, recurrence, progression, TATI (tumour-associated trypsin inhibitor)
Autoři: Michael Pešl 1; Viktor Soukup 1; Marko Babjuk 3; Otakar Čapoun 1; Zuzana Vaľová 1; Pavel Dundr 2; Tomáš Hanuš 1
Působiště autorů: Urologická klinika VFN a 1. LF UK, Praha 1; Urologická klinika FNM a 2. LF UK, Praha 2; Patologický ústav VFN a 1. LF UK, Praha 3
Vyšlo v časopise: Ces Urol 2015; 19(1): 44-50
Kategorie: Originální práce
Souhrn
Cílem práce je zhodnotit význam stanovení hladiny TATI (tumour associated trypsin inhibitor) v moči pro neinvazivní detekci a odhad prognózy pacientů s tumory močového měchýře.
Soubor, metodika:
Do studie jsme zařadili 63 pacientů, z toho 30 s histologicky verifikovaným tumorem měchýře. Střední doba sledování byla 23 měsíce. Pacienti byli rozděleni do jednotlivých skupin v závislosti na rozdílném stupni buněčné diferenciace, stupni nádorové invaze, počtu nádorů a jejich velikosti. Kontrolní skupinu tvořilo 33 pacientů s benigním onemocněním uropoetického traktu.Výsledky:
Průměrná hladina TATI v moči u pacientů s tumorem močového měchýře byla 68,65 μg/l, zatímco v kontrolní skupině to bylo pouze 20,38 μg/l. Průměrná hladina TATI v moči u pacientů s G1 tumorem byla 15,76 μg/l, u G2 tumorů 86,3 μg/l a 33,3 μg/l u nádorů G3. Průměrná hladina TATI v moči u tumorů s TaT1 tumorem byla 73,3 μg/l, u infiltrujících tumorů 40,51 μg/l. Průměrná hladina TATI v moči u pacientů se solitárním tumorem byla 60,28 μg/l a v případě mnohočet ného postižení 94,42 μg/l, 26,3 μg/l u tumorů do 3 cm velikosti a 100,02 μg/l u tumorů větších než 3 cm. Průměrná hladina TATI v moči ve skupině pacientů, kteří recidivovali v průběhu sledování, byla 60,3 μg/l a 75,0 μg/l ve skupině bez recidivy onemocnění. Neprokázali jsme význam močové hladiny TATI pro odhad rizika recidivy onemocnění.Závěr:
Hodnota TATI v našem souboru nekorelovala s přítomností tumoru močového měchýře. Ve skupině pacientů s tumorem měchýře nekorelovala hladina TATI s jeho velikostí, buněčnou diferenciací ani multiplicitou. Neprokázali jsme význam močové hladiny TATI pro odhad rizika recidivy onemocnění.KLÍČOVÁ SLOVA:
Nádory močového měchýře, neinvazivní diagnostika, recidiva, progrese, TATI (tumour associated trypsin inhibitor).ÚVOD
Karcinom močového měchýře (KMM) je nejčastější malignitou močového traktu, u mužů patří mezi 7. nejčastější, u žen mezi 17. nejčastější karcinom s incidencí 27 na 100 000 u mužů a 6 na 100 000 u žen (1).
Přibližně 75 % pacientů má v době diagnózy nádor ohraničený na sliznici či submukózní pojivo (CIS, Ta, T1). Tato skupina nádorů je označována jako svalovinu detruzoru neinfiltrující karcinomy močového měchýře (non-muscle invasive bladder cancer, NMIBC). Lze je kompletně odstranit transuretrální resekcí (TUR) a je pro ně charakteristická vysoká četnost recidiv, která v nejrizikovější skupině NMIBC v rámci dlouhodobého sledování dosahuje až 80 % (2). Po transuretrální resekci následuje intravezikální terapie cytostatiky, event. intravezikální imunoterapie. Zbylých přibližně 25 % pacientů má tumor infiltrující svalovinu měchýře. V tomto stadiu je onemocnění řešitelné radikální cystektomií či radikální radioterapií.
Diagnostika nádorů močového měchýře je v současné době založena na kombinaci cytologického vyšetření moči a cystoskopie. Jedná se o invazivní, nákladné a pro pacienta nepříjemné vyšetření. Ve snaze nahradit toto vyšetření je v poslední době věnována značná pozornost nádorovým markerům, které by umožnily neinvazivní detekci tohoto onemocnění s přijatelnou senzitivitou a specifitou. Jedním z těchto potenciálních markerů je TATI (tumour associated trypsin inhibitor). Jedná se o peptid (6-kDa), který byl poprvé izolován z moči pacientek s ovariálním tumorem, jeho funkcí je inhibice trypsinu a akrosinu. TATI je v malé míře exprimován v některých tkáních i za fyziologických okolností (GIT, pankreas, játra, urotel a jiné), v případě nádorového postižení těchto tkání se však zvyšuje míra jeho exprese i koncentrace v moči. Zvýšená sérová hladina TATI byla popsána u pokročilých ovariálních a renálních tumorů (3, 4). Několik studií prokázalo zvýšenou hladinu ve tkáni, séru i moči u pacientů s uroteliálními karcinomy v porovnání s kontrolním souborem (5, 6, 7). Zvýšená sérová hladina TATI byla zjištěna u pokročilých a metastatických karcinomů měchýře (8).
Cílem práce je zhodnotit význam močové hladiny TATI pro neinvazivní detekci a odhad prognózy pacientů s tumory močového měchýře.
SOUBOR A METODIKA
Pacienti
Do studie jsme v období od září 2006 do ledna 2007 zařadili celkem 63 pacientů (38 mužů, 25 žen). Ve skupině pacientů s tumorem močového měchýře bylo celkem 30 pacientů, do kontrolní skupiny jsme zařadili 33 jedinců s různými benigními urologickými onemocněními (BPH, kongenitální hydronefróza, striktura uretry). Průměrný věk pacientů s tumorem byl 66,2 let (21–87 let), v kontrolní skupině byl průměr 54 let. Pacienti byli rozděleni do jednotlivých skupin v závislosti na rozdílném stupni buněčné diferenciace (G1 – 6 pacientů, G2 – 20 pacientů, G3 – 4 pacienti), stupni nádorové invaze (Ta – 15 pacient, T1 – 11 pacientů, T2 – 4 pacienti), multiplicitě (solitární tumory – 17 pacientů, mnohočetné tumory – 10 pacientů, u 3 pacientů nebyla informace o multiplicitě k dispozici) a velikosti (do 3 cm – 11 pacientů, nad 3 cm – 19 pacientů). Výsledky byly v jednotlivých skupinách samostatně hodnoceny.
Všichni pacienti s nádory měchýře podstoupili transuretrální resekci (TUR), nádory byly histologicky verifikovány. Pacienti byli dispenzarizování podle doporučení Evropské urologické společnosti (EAU Guidelines), hodnocení recidiv a progrese onemocnění probíhalo v období od září 2006 do dubna 2010 (medián 23 měsíce). Charakteristiku skupiny pacientů s tumory měchýře shrnuje tabulka 1, kontrolní skupinu tabulka 2.
Tab. 1. Charakteristika tumorů Table 1. Tumour characteristics 
Tab. 2. Charakteristika kontrolní skupiny Table 2. Control group characteristics 
Odběr a zpracování vzorků
Vzorky spontánně vymočené moči byly odebírány do 48 hodin před TUR, resp. před výkonem pro benigní onemocnění a byly ihned po odběru zmraženy na -20 °C a uchovány při této teplotě do doby zpracování.
K detekci TATI ve vzorcích moči byla použita metoda radioimunoassay TiterZyme EIA human Total Survivin Enzyme Immunometric Assay, Assay designs, Inc. (USA).
Všichni pacienti v kontrolní skupině měli negativní výsledek cytologického vyšetření moči (PAP I nebo PAP II) a při cystoskopickém vyšetření nebyl nádor močového měchýře prokázán. U všech zařazených do studie byla vyloučena močová infekce aktuálním kultivačním vyšetřením moči.
Statistické zpracování
Při statistickém hodnocení byl použit program SAS, software release 8.2 (SAS Inc., Cary, USA). Hladina statistické významnosti byla stanovena p = 0,05. Korelace mezi hladinou TATI v moči a klinickopatologickými charakteristikami (nádorová invaze, diferenciace, mnohočetnost, velikost nádoru a recidiva onemocnění) byla zkoumána pomocí chi-square testu nebo Fischerova testu.
Výsledky
Průměrná hodnota TATI v moči ve skupině s prokázaným karcinomem močového měchýře byla 68,65 μg/l, zatímco v kontrolní skupině byla průměrná hodnota TATI v moči jen 20,38 μg/l, přesto tento rozdíl nebyl významný. Průměrná hladina TATI nesouvisela s hloubkou nádorové invaze, naopak byla nižší u invazivních nádorů (TaT1 tumory – 73,3 μg/l, infiltrující tumory – 40,51 μg/l, p = 0,8324), nesouvisela se stupněm buněčné diferenciace (G1 tumory – 15,76 μg/l, G2 tumory – 86,3 μg/l a G3 tumory -33,3 μg/l, p = 0,2132). Vyšší hodnoty byly prokázány u větších a mnohočetných nádorů (solitární tumory – 60,28 μg/l, mnohočetné tumory – 94,42 μg/l (p = 0,62), 26,3 μg/l u tumorů do 3 cm velikosti a 100,02 μg/l u tumorů větších než 3 cm, p=0,332). Žádný z rozdílů mezi jednotlivými hodnocenými skupinami nenabyl statistické významnosti (tabulka 3).
Graf 1. Průměrné hodnoty TATI u pacientů s tumorem vs. kontroly Graph 1. The mean TATI level in patiens and screenings 
Graf 2. Průměrné hodnoty TATI u pacientů s tumorem do 3 cm (m) a u větších než 3 cm (v) Graph 2. The mean TATI level in patiens with tumour size up to 3 cm (m) and more than 3 cm (v) 
Graf 3. Průměrné hodnoty TATI v závislosti na rozdílném stupni buněčné diferenciace Graph 3. The mean TATI level according to tumour grade 
Graf 4. Stanovení hraniční hodnoty TATI Graph 4. The ROC curve of TATI urine level 
Hladina TATI v moči nemá téměř žádnou diskriminační schopnost pro odlišení pacientů s tumory od zdravých kontrol.
Patnáct pacientů v průběhu sledování recidivovalo, zbylých 15 bylo bez recidivy. Průměrná hladina TATI v moči ve skupině pacientů, kteří recidivovali v průběhu follow-up, byla 60,3 μg/l a 75,0 μg/l ve skupině bez recidivy onemocnění.
Při hodnocení času do recidivy pomocí Kaplan - Meierových křivek přežití jsme v závislosti na různých hraničních hodnotách (kvartilech) močové hladiny TATI mezi jednotlivými navrženými hraničními hodnotami neprokázali signifikantní rozdíl (log rank test p=0,58).
Diskuze
Ve shodě s jinými autory (4, 6, 9, 10) byla i v naší studii průměrná hladina TATI v moči pacientů s tumorem měchýře vyšší oproti pacientům v kontrolní skupině, i když rozdíl nebyl signifikantní.
Ve skupině pacientů s tumorem měchýře souvisela do jisté míry hladina TATI s velikostí tumorů, stupněm nádorové invaze a multiplicitou, i když tyto rozdíly nebyly signifikantní.
Kelloniemi ve své práci prokázal korelaci močové hladiny TATI s dobou do recidivy (6). V naší studii jsme však tento prognostický význam nepotvrdili. Autoři této práce navrhli jako ideální cut-off koncentraci TATI 21 μg/l. Vzhledem k tomu, že v naší práci neměla ROC křivka téměř žádnou diskriminační schopnost, vhodné cut-off jsme nestanovili (AUC 0,56667).
Jistou nevýhodou ve srovnání našich výsledků s předchozími pracemi je rozdíl ve velikosti souboru pacientů (63 našich pacientů, soubory ostatních prací zahrnují většinou více než 100 pacientů) (6, 9, 10).
Na základě našich výsledků nepovažujeme hodnocení močové hladiny TATI za přínosné pro klinickou praxi. Pro primární diagnostiku tumorů měchýře i pro včasnou detekci recidivy onemocnění stále zůstává zásadní cytologické vyšetření moči v kombinaci s cystoskopií.
ZÁVĚR
V naší studii jsme neprokázali korelaci hladiny TATI v moči s přítomností tumoru močového měchýře. Ve skupině pacientů s tumorem měchýře nekorelovala hladina TATI s jeho velikostí, buněčnou diferenciací ani multiplicitou. Neprokázali jsme význam močové hladiny TATI pro odhad rizika recidivy onemocnění.
Došlo: 13. 10. 2014
Přijato: 30. 1. 2015
Kontaktní adresa:
MUDr. Michael Pešl
FEBU Urologická klinika VFN a 1. LF UK
Ke Karlovu 6
128 00 Praha 2
e-mail: pesl_m@hotmail.com
Střet zájmů: žádný.
Prohlášení o podpoře:
Zpracování tohoto sdělení bylo podpořeno grantem PRVOUK P27/LF1/1.
Zdroje
1. Ferlay JSH, Bray F, Forman D, et al. GLOBOCAN 2008 v1.2, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 10 2010, International Agency for Research on Cancer: Lyon, France.
2. Sylvester RJ, van der Meijden APM, Oosterlinck W, et al. Predicting recurrence and progression in individual patients with stage TaT1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006; 49 : 466–477.
3. Venesmaa P, Lehtovirta P, Stenman UH, et al. Tumour-associated trypsin inhibitor (TATI): comparison with CA 125 as a preoperative prognostic indicator in advanced ovarian cancer. Br J Cancer 1994 : 70 : 1188.
4. Meria P, Toubert ME, Cussenot O, et al. Tumour-associated trypsin inhibitor and renal cell carcinoma. Eur Urol 1995 : 27 : 223.
5. Taccone W, Mazzon W, Belli M. Evaluation of TATI and other markers in solid tumors. Scand J Clin Lab Invest Suppl 1991 : 207 : 25.
6. Kelloniemi E, Rintala E, Finne P, Stenman UH. Tumour-associated trypsin inhibitor as a prognostic factor during follow-up of bladder cncer. Urology 2003 : 62 : 249.
7. Patschan O, Shariat SF, Chade DC, et al. Association of tumor-associated trypsin inhibitor (TATI) expression with molecular markers, pathologic features and clinical outcomes of urothelial carcinoma of the urinary bladder. World J Urol. 2012 Dec; 30(6): 785–794.
8. Pectasides D, Bafaloucos D, Antoniou F, et al. TPA, TATI, CEA, AFP, beta-HCG, PSA, SCC, end CA 19-9 for monitoring transitional cell carcinoma of the bladder. Am J Clin Oncol 1996 : 19 : 271.
9. Diggle CP, Cruickshank S, Olsburgh JD, et al. Identification of gene sup-regulated in urothelial tumors: the 67-kd laminin receptor and tumor-associated trypsin inhibitor. Am J Pathol 2003 : 163 : 493.
10. Gkialas I, Papadopoulos G, Iordanidou L, et al. Evaluation of urine tumor-associated trypsin inhibitor, CYFRA 21-1, and urinary bladder cancer antigen for detection of high-grade bladder carcinoma. Urology. 2008; 72(5): 1159–1163.
Štítky
Detská urológia Nefrológia Urológia
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2015 Číslo 1- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- VLIV VOLNÝCH RADIKÁLŮ NA FERTILITU MUŽE A MOŽNOSTI LÉČBY
- ONKOLOGICKÁ LÉČBA KARCINOMU PENISU Z POHLEDU RADIAČNÍHO ONKOLOGA
- IMUNOSTIMULACE POLYBAKTERIÁLNÍM LYZÁTEM (URIVAC®) V PREVENCI RECIDIVUJÍCÍCH INFEKCÍ DOLNÍCH MOČOVÝCH CEST
- VÝZNAM STANOVENÍ MOČOVÉ HLADINY TATI (TUMOUR ASSOCIATED TRYPSIN INHIBITOR) PRO DIAGNOSTIKU A PROGNÓZU TUMORŮ MOČOVÉHO MĚCHÝŘE
- KOMUNIKACE MEZI UROLOGEM A PACIENTEM S RAKOVINOU PROSTATY V PRŮBĚHU LÉKAŘSKÉ KONZULTACE
- KOMPLIKACE PO RADIKÁLNÍ PROSTATEKTOMII OTEVŘENÝM A LAPAROSKOPICKÝM PŘÍSTUPEM, SROVNÁNÍ VÝSLEDKŮ PODLE CLAVIENOVA SYSTÉMU KLASIFIKACE
- KOMPLIKACE PO LOKÁLNÍ APLIKACI CIZORODÉHO MATERIÁLU DO PODKOŽÍ PENISU
- EMFYZEMATÓZNÍ PYELONEFRITIDA – POPIS ŠESTI PŘÍPADŮ
- RYCHLE PROGREDUJÍCÍ UROTELIÁLNÍ TUMOR PÁNVIČKY LEVÉ LEDVINY S TROMBÓZOU VENA CAVA INFERIOR
- JEDNOPORTOVÁ LAPAROSKOPICKÁ (LESS-LAPARO-ENDOSCOPIC SINGLE-SITE SURGERY) NEFREKTOMIE
- ZPRÁVA Z KONGRESU PRAGUEONCO 2015 – SEKCE KARCINOM PROSTATY
- ZIMNÍ UROLOGICKÉ SYMPOZIUM VE ŠPINDLEROVĚ MLÝNĚ
- VÁŽENÍ ČTENÁŘI A SPOLUTVŮRCI ČASOPISU ČESKÁ UROLOGIE, OFICIÁLNÍHO ČASOPISU ČESKÉ UROLOGICKÉ SPOLEČNOSTI
- DNE 22. LEDNA 2015 NÁS VE VĚKU 74 LET NÁHLE OPUSTIL doc. MUDr. MIROSLAV HANUŠ, CSc.
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- IMUNOSTIMULACE POLYBAKTERIÁLNÍM LYZÁTEM (URIVAC®) V PREVENCI RECIDIVUJÍCÍCH INFEKCÍ DOLNÍCH MOČOVÝCH CEST
- KOMPLIKACE PO LOKÁLNÍ APLIKACI CIZORODÉHO MATERIÁLU DO PODKOŽÍ PENISU
- ONKOLOGICKÁ LÉČBA KARCINOMU PENISU Z POHLEDU RADIAČNÍHO ONKOLOGA
- EMFYZEMATÓZNÍ PYELONEFRITIDA – POPIS ŠESTI PŘÍPADŮ
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy