ORGÁN ŠETRIACA LIEČBA SVALOVINU INFILTRUJÚCICH NÁDOROV MOČOVÉHO MECHÚRA
BLADDER SPARING TREATMENT FOR MUSCLE-INVASIVE BLADDER CANCERS
Objectives:
The aim of this study was to evaluate treatment outcomes of muscle-invasive bladder cancers treated with radical TURB followed by adjuvant chemotherapy, radiotherapy, or their combination in order to preserve functional bladder.
Material and methods:
We retrospectively evaluated patients with muscle-invasive urothelial tumors who were treated at the Department of Urology in Martin from 2005–2016 by radical TURB followed by adjuvant therapy. If histological examination confirmed invasive urothelial carcinoma (pT2a-pT2b) all such patients underwent re-TURB. In the analysis were included only patients who had negative histology (pT0) after re-TURB, the primary solitary tumor was ≤3 cm in size, ureterohydronephrosis was not present, not the presence of diffuse CIS and there was no tumor invaded outside the bladder wall. Thereafter, patients were treated with adjuvant chemotherapy, radiotherapy or their combination. Statistically, we evaluated baseline characteristics of the patients, adjuvant therapy, recurrence rate and overall survival.
Results:
The cohort of 14 patients aged 54–69 years (mean 61 years) consisted of 7 women and 7 men. All of the patients after radical TUR-B had confirmed invasive urothelial carcinoma pT2a-pT2b, G2-G3 After re-TURB no patient had residual tumor from the base (pT0), one patient had CT verified enlargement of obturator LN up to 3 cm. Adjuvant chemotherapy as a monotherapy underwent 6 (42 %) patients, 7 (50 %) underwent concomitant chemoradiotherapy and 1 (8 %) patient refused any treatment. Local recurrence of muscle-invasive bladder tumor was not present in none of the patients, 1 (8 %) patient surgically removed obturator LN (confirmed metastasis) after two years, 3 (21 %) patients had a recurrence of a non-invasive high-grade urothelial carcinoma pT1, G3. 13 (92 %) patients are surviving 1–11 years (median 6 years), no patient has died because of disease progression, 1 (8 %) patient died due to MI.
Conclusion:
The results of our limited study suggest, that in well- selected patients with muscle invasive transitional cell bladder cancers (pT0 after re-TURB) after trimodal therapy we can achieve complete response with minimal risk of local or systemic progression and long-term cancer specific- free survival. It requires multidisciplinary collaboration of urologist, radiation oncologist and medical oncologist as well as close cooperation of patients who require regular long-term cystoscopic and CT / MR surveillance because of a risk of local or systemic recurrence.
Key words:
Muscle-invasive bladder cancers, TURB, chemoradiotherapy, trimodality therapy, bladder sparing, bladder preservation.
Autoři:
Boris Eliáš; Roman Tomaškin; Ján Kliment, ml.; Ján Šulgan; Ján Kliment
Působiště autorů:
Urologická klinika, Jesseniová lekárska fakulta Univerzity Komenského a Martinska fakultná
nemocnica, Martin
Vyšlo v časopise:
Ces Urol 2016; 20(4): 309-316
Kategorie:
Originální práce
Souhrn
Cieľ:
Cieľom práce bolo vyhodnotiť výsledky liečby svalovinu infiltrujúcich nádorov močového mechúra radikálnou TURB s následnou adjuvantnou chemoterapiou, rádioterapiou alebo ich kombináciou so zachovaním funkčného močového mechúra.
Klinický súbor a metódy:
Retrospektívne sme vyhodnotili pacientov so svalovinou infiltrujúcich urotelových nádorov, ktorí boli liečení na urologickej klinike v Martine v rokoch 2005–2016 radikálnou TURB a následnou adjuvantnou liečbou.
Ak histologické vyšetrenie potvrdilo infiltratívny urotelový karcinóm pT2a-pT2b, všetkým pacientom sme urobili re-TURB. Do analýzy boli zaradení len pacienti, ktorí mali po re-TURB negatívne histologické vyšetrenie (pT0), primárny solitárny nádor mal veľkosť menej ako 3 cm, nemali prítomnú ureterohydronefrózu, nádor neprerastal cez stenu močového mechúra a nemali difúzny CIS. Následne boli pacienti liečení adjuvantnou chemoterapiou, rádioterapiou alebo ich kombináciou. Štatisticky sme vyhodnotili základnú charakteristiku pacientov, spôsob adjuvantnej liečby, výskyt recidív a celkové prežívanie.
Výsledky:
Súbor 14 pacientov vo veku 54–69 rokov (priemer 61 r.) tvorilo 7 žien a 7 mužov. Všetci mali po radikálnej TUR-B potvrdený infiltratívny urotelový karcinóm pT2a-pT2b, G2-G3. Po re-TURB nemal žiadny pacient nález reziduálneho nádoru (pT0), jeden pacient mal na CT zväčšené obturátorové LU do 3 cm. Adjuvantnú chemoterapiu ako monoterapiu absolvovalo 6 (42 %) pacientov, 7 (50 %) absolvovalo konkomitantnú chemorádioterapiu a 1(8 %) pacientka odmietla akúkoľvek liečbu. Lokálnu recidívu nádoru s infiltráciou svaloviny nemal za sledované obdobie žiadny pacient, jeden pacient (8 %) mal po dvoch rokoch chirurgicky odstránené obturátorové LU (potvrdené metastázy), 3(21 %) pacienti mali recidívu neinvazívneho high‑ -grade urotelového karcinómu pT1,G3. 13(92 %) pacienti prežívajú 1–11 rokov (medián 6 rokov), žiadny pacient neexitoval na progresiu ochorenia, 1(8 %) pacient exitoval na akútny IM.
Záver:
Z našej limitovanej štúdie vyplýva, že u dobre selektovaných pacientov s infiltratívnymi urotelovými nádormi močového mechúra (pT0 po re-TURB) môžeme po trimodálnej liečbe dosiahnuť kompletnú remisiu ochorenia s minimálnym rizikom lokálnej ako aj systémovej progresie a dlhodobým beznádorovým prežívaním. Pri tejto liečebnej stratégii je nevyhnutná multidisciplinárna spolupráca urológov, radiačných onkológov a klinických onkológov ako aj úzka spolupráca od pacientov, ktorí vyžadujú dlhoročné pravidelné cystoskopické ako aj CT/MR kontroly pre riziko lokálnej alebo systémovej recidívy.
Kľúčové slová:
Infiltratívne nádory močového mechúra, TURB, chemorádioterapia, trimodálna liečba, zachovanie močového mechúra.
ÚVOD
Radikálna cystektómia s panvovou lymfadenektómiou je v súčasnosti považovaná za štandardnú liečbu svalovinu infiltrujúcich nádorov močového mechúra s 5- ročným nádor špecifickým prežívaním u 53 % až 74 % pacientov (1, 2). Kompletné odstránenie močového mechúra s deriváciou moču spôsobuje signifikantnú morbiditu a negatívne ovplyvňuje komfort a kvalitu života pacientov. Výskyt včasných komplikácií do troch mesiacov po radikálnej cystektómii a derivácii moču sa udáva približne u 61 % pacientov s nutnosťou re-hospitalizácie do 90 dní v 32 % prípadov (3, 4). Z týchto dôvodov sa hľadajú alternatívne spôsoby liečby so zachovaním močového mechúra s porovnateľnými onkologickými výsledkami. Takýto postup je vhodný pre dve skupiny pacientov: pacienti so závažnou komorbiditou, pre ktorých je radikálna cystektómia vysoko riziková a pacienti, ktorí si želajú vyhnúť sa radikálnej operácii s cieľom zachovania dobrej kvality života (5). V súčasnosti existuje niekoľko alternatívnych liečebných postupov so zachovaním močového mechúra. Ako súčasť monoterapie sem patria radikálna TURB, parciálna cystektómia, rádioterapia alebo chemoterapia. Existuje konsenzus, že zachovanie močového mechúra v kombinácii s monoterapiou radikálnou TURB, chemoterapiou alebo rádioterapiou sú menej účinné a vedú k horšej lokálnej kontrole a kratšiemu dlhodobému prežívaniu oproti radikálnej cystektómii (5). V súčasnosti je najviac akceptovaná tzv. trimodálna liečba (TMT). Zahŕňa iniciálnu radikálnu TURB s cieľom kompletnej resekcie makroskopicky viditeľného nádoru nasledovaná konkomitantnou chemorádioterapiou s dosiahnutím kompletnej remisie ochorenia so zachovaním močového mechúra. Radikálna cystektómia je vyhradená len pre pacientov s inkompletnou odpoveďou na chemorádioterapiu, alebo pri lokálnej recidíve nádoru ako záchranná cystektómia (salvage cystectomy).
I keď kumulované dáta za posledných dvadsať rokov poukazujú, že radikálna TURB a konkomitantná chemorádioterapia majú v porovnaní s radikálnou cystektómiou približne ekvivalentné výsledky, neboli tieto závery doposiaľ potvrdené v randomizovaných štúdiách (1).
MATERIÁL A METÓDY
Retrospektívne sme vyhodnotili pacientov so svalovinou infiltrujúcich nádorov, ktorí boli liečení na urologickej klinike v Martine v rokoch 2005–2016 radikálnou TURB a následnou adjuvantnou liečbou bez radikálnej cystektómie (tabuľka 1). Ak histologické vyšetrenie potvrdilo infiltratívny urotelový karcinóm do svaloviny močového mechúra (pT2a‑ -pT2b), všetkým pacientom sme urobili re-TURB. Do analýzy boli zaradení len tí pacienti, ktorí mali po re-TURB zo spodiny a okrajov pôvodného nádoru negatívne histologické vyšetrenie (pT0), primárny solitárny nádor mal veľkosť maximálne do 3 cm, nádor neprerastal cez stenu močového mechúra alebo prostaty, nemali difúzny CIS a nemali prítomnú ureterohydronefrózu. Žiadny z pacientov nesúhlasil s radikálnou cystektómiou alebo mali závažnú komorbiditu, ktorá kontraindikovala radikálny chirurgický výkon. Na posúdenie lokálneho rozsahu ochorenia a lymfatických uzlín mali všetci urobené CT resp. MR malej panvy. Následne boli pacienti liečení adjuvantnou chemoterapiou, rádioterapiou alebo ich kombináciou. Štatisticky sme vyhodnotili základnú charakteristiku pacientov, spôsob adjuvantnej liečby, výskyt recidív a celkové prežívanie.
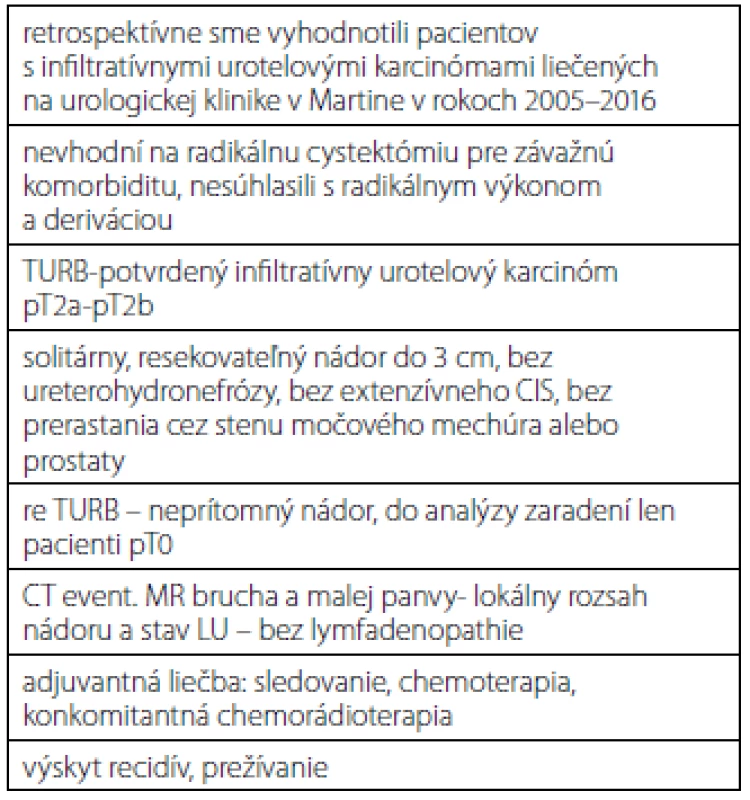
VÝSLEDKY
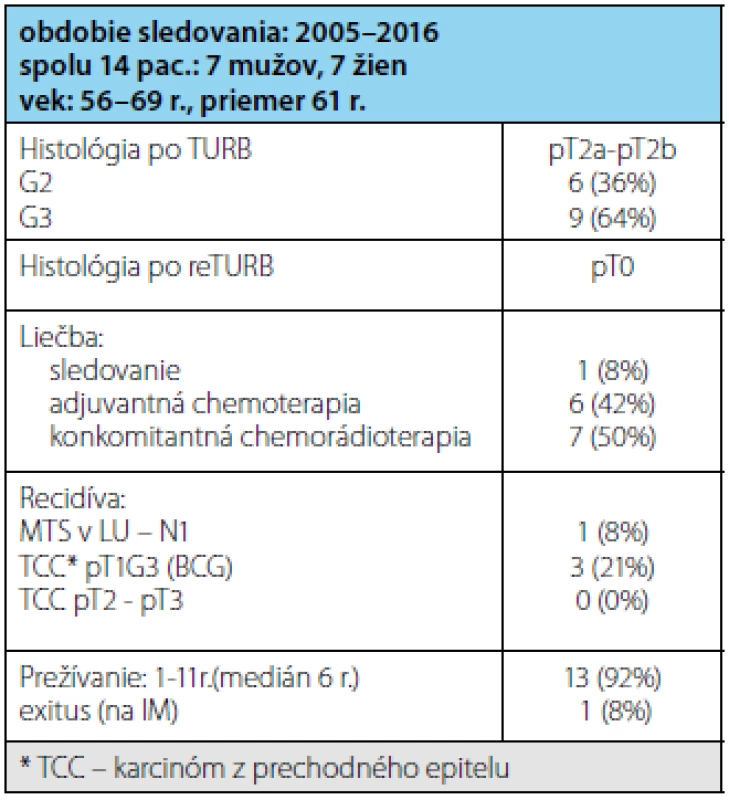
Súbor 14 pacientov vo veku 54–69 rokov (priemer 61 r.) tvorilo 7 žien a 7 mužov (tabuľka 2). Všetci mali po radikálnej TUR-B nález infiltratívneho urotelového karcinómu pT2a-pT2b, v jednom prípade v kombinácii s CIS, 9 (64 %) pacientov malo zle diferencovaný karcinóm-G3 a 5 (36 %) pacientov stredne diferencovaný karcinóm-G2. Po re-TURB nemal žiadny pacient nález reziduálneho nádoru zo spodiny alebo okraja primárneho nádoru (pT0). Až na jedného pacienta, ktorý mal na CT popisované zväčšené obturátorové LU (lymfatické uzliny) do 3 cm (pozitívne PET CT), nemali ostatní pacienti nález na CT resp. MR hodnotený ako prerastanie nádoru cez stenu močového mechúra. Adjuvantnú chemoterapiu ako monoterapiu absolvovalo 6 (42 %) pacientov, 7 (50 %) absolvovalo konkomitantnú chemorádioterapiu a 1 (8 %) pacientka odmietla akúkoľvek liečbu a bola po re-TURB len sledovaná. Po dvoch rokoch mala na CT zistené metastázy v obturátorových LU vpravo, ktoré boli odstránené operačne (potvrdené metastázy), následne absolvovala adjuvantnú chemoterapiu (Gemcitabin + Cisplatina). Všetci pacienti sú pravidelne sledovaní endoskopicky s opakovanými biopsiami z jazvy po predchádzajúcej TURB a zobrazovacími metódami na posúdenie LU v malej panve. Lokálnu recidívu s infiltráciou svaloviny močového mechúra nemal doposiaľ žiadny pacient, 3(21 %) pacienti mali recidívu high-grade urotelového karcinómu pT1,G3, všetci boli následne liečení štandardnou BCG immunoterapiou. 13(92 %) pacientov prežíva od 1 do 11 rokov (medián 6 rokov), žiadny pacient neexitoval na progresiu ochorenia, jeden pacient (8 %) exitoval na akútny IM.
DISKUSIA
V našej retrospektívnej štúdii sme vyhodnotili výsledky liečby pacientov so svalovinu infiltratívnymi urotelovými karcinómami močového mechúra liečených radikálnou TURB a následne rôznymi spôsobmi adjuvantnej liečby so zachovaním močového mechúra. Do štúdie sme zaradili len tých pacientov, pre ktorých by bola radikálna cystektómia vysoko riziková pre závažnú komorbiditu, alebo pacientov, ktorí odmietli radikálny chirurgický výkon a chceli mať zachovanú dobrú kvalitu života. Aby bola zachovaná homogenita nášho súboru do analýzy sme zaradili len pacientov, ktorí mali po re-TURB zo spodiny a okrajov nádoru negatívne histologické vyšetrenie-pT0. Všetci pacienti, u ktorých infiltratívny nádor po re- TURB perzistoval neboli do štúdie zaradení. Do štúdie neboli zaradení ani pacienti, ktorí na CT resp. MR mali popisované prerastanie nádoru cez stenu močového mechúra. Až na jedného pacienta, ktorý mal na CT zistené zväčšené obturátorové LU do 3 cm (odmietol chirurgickú liečbu a bol liečený chemoterapiou), nemali ostatní pacienti popisované zväčšené LU. Najčastejším spôsobom adjuvantnej liečby bola u 50 % pacientov konkomitantná chemorádioterapia (vždy cisplatina) u 42 % monoterapia chemoterapiou (kombinácia M-VAC alebo Gemcitabín + Cisplatina) a v jednom prípade (8 %) bola pacientka len sledovaná pre odmietnutie ďalšej liečby. Hlavným dôvodom takéhoto nejednotného, rôznorodého liečebného postupu v našom súbore bolo, že všetci pacienti boli liečení počas pomerne dlhého časového obdobia, kedy nebola jednoznačne definovaná liečebná stratégia takýchto pacientov. V súčasnosti u všetkých pacientov s cieľom zachovať močový mechúr indikujeme po negatívnej re-TURB adjuvantnú konkomitantnú chemorádioterapiu. Počas sledovaného obdobia 1–11 rokov nemal doposiaľ žiadny pacient lokálnu recidívu svalovinu infiltratívneho nádoru. Jedna pacientka mala po dvoch rokoch zistenú progresiu ochorenia v obturátorovych LU, ktoré boli chirurgicky odstránené (potvrdené metastázy urotelového karcinómu), následne absolvovala adjuvantnú chemoterapiu. Traja pacienti mali detegovanú lokálnu recidívu neinvazívneho urotelového karcinómu pT1,G3, všetci absolvovali štandardnú intravezikálnu BCG immunoterapiu. Pacienti prežívajú od 1–11 rokov (medián 6 rokov), žiadny pacient neexitoval na progresiu ochorenia, jeden pacient exitoval na akútny IM. Výsledky našej štúdie sú limitované tým, že boli do nej selektovaní a zaradení len pacienti, ktorí mali po radikálnej TURB a následnej re-TURB negatívny histologický nález-pT0, bez perzistencie infiltratívneho nádoru. Z tohto dôvodu je diskutabilné priame porovnávanie našich výsledkov s publikovanými štúdiami, do ktorých boli zaradení pacienti s infiltratívnymi urotelovými nádormi pT2-pT4a liečenými trimodálnou liečbou.
Za posledných dvadsať rokov niekoľko retrospektívnych ako aj prospektívnych štúdií potvrdilo, že TMT založená na radikálnej TURB a následnej konkomitantnej chemorádioterapii so zachovaním močového mechúra môže byť efektívna liečba svalovinu infiltrujúcich urotelových karcinómov s dlhodobým celkovým i nádor špecifickým prežívaním. Táto liečebná stratégia má v porovnaní s radikálnou cystektómiou výhodu, že zachováva funkčný močový mechúr a záchranná cystektómia je rezervovaná len pre prípady, keď TMT zlyhá.
Racionálne zdôvodnenie pre kombináciu chemoterapie a rádioterapie po TURB je založené na dvoch hlavných premisách. Prvá, klinické dáta ako aj údaje z autopsií dokazujú, že okultné mikrometastázy pri svalovinu infiltrujúcich nádorov sa môžu vyskytovať už v čase TURB. Od chemoterapie sa očakáva, že bude redukovať výskyt okultných mikrometastáz (6). Druhá premisa vychádza zo zistení, že niektoré chemoterapeutiká-cytostatiká zvyšujú senzitivitu nádorových buniek na rádioterapiu a vedú k lepším výsledkom (7).
Radikálna TURB zahŕňa resekciu makroskopicky viditeľného nádoru až do perivezikálneho tuku (8). Kompletná TURB vedie k 20 % zlepšeniu kompletnej odpovede a zachovaniu močového mechúra, naopak inkompletná TURB s perzistenciou infiltratívneho nádoru má za následok horšie celkové prežívanie (9). Existujú aj opačné názory, že radikálna TURB ako monoterapia je dostatočná liečebná modalita (ak je po re-TURB pT0) bez potreby ďalšej adjuvantnej liečby. Tieto názory vychádzajú z pozorovaní, že niektorí pacienti po radikálnej TURB a následnej radikálnej cystektómii nemali v definitívnej histológii vo viac ako 10 % prípadov nález karcinómu (pT0) a dlhodobo prežívajú bez akejkoľvek progresie ochorenia (10).
Napriek tomu existuje konsenzus, že TURB ako monoterapia nie je adekvátna liečebná metóda pre zvýšené riziko lokálnej ako aj systémovej progresie (6). Podobne externá rádioterapia ako monoterapia nie je v súčasnosti odporúčaná a je používaná len v kombinácii s konkomitantnou chemoterapiou.
V súčasnosti sú po radikálnej TURB používané dva rozdielne liečebné postupy. V USA sa najčastejšie používa tzv. split protokol. Podľa tohto protokolu sú kandidáti na zachovanie močového mechúra selektovaní podľa odpovede na indukčnú chemorádioterapiu. Pacienti s kompletnou odpoveďou, bez perzistencie nádoru absolvujú následne konsolidačnú chemorádioterapiu. V opačnom prípade pri perzistencii infiltratívneho nádoru absolvujú radikálnu cystektómiu (9). Iný postup po radikálnej TURB sa používa v mnohých európskych centrách a spočíva v absolvovaní kompletnej chemorádioterapie. U pacientov bez kompletnej remisie sa následne urobí radikálna záchranná cystektómia (11).
Štandardný protokol pri konkomitantnej chemorádioterapii odporúča celková dávka (TD) od 55 do 66 Gy v rôznych frakciách v kombinácii s rádiosenzitívnou chemoterapiou cisplatinou, karboplatinou, mitomycínom C + 5-FU a iné (12). Arcangeli a spol. publikovali v roku 2015 metaanalýzu 31 prospektívnych ako aj retrospektívnych klinických štúdii po TMT so zachovaním močového mechúra pri svalovine infiltrujúcich nádoroch T2-T4a (13). Vyhodnotili 5- ročné výsledky u 3315 pacientov. Hodnotili kompletnú odpoveď, lokálne zlyhanie, potrebu záchrannej cystektómie a 5-ročné celkové prežívanie. Približne polovica pacientov bola liečená tzv. split režimom a druhá konkomitantnou kontinuálnou chemorádioterapiou.
Kompletná odpoveď bola dosiahnutá u 78 % pacientov, lokálne zlyhanie malo 28 %, potreba záchrannej cystektomie u 21 % a celkové 5-ročné prežívanie u 56 % pacientov. Neboli zistené signifikantné rozdiely medzi oboma liečebnými režimami v 5-ročnom celkovom prežívaní, i keď pri režime konkomitantnej kontinuálnej chemorádioterapie boli dosiahnuté lepšie výsledky v kompletnej odpovedi a nižšom počte záchranných cystektómií.
Mak a spol. publikovali dlhodobé výsledky zo šiestich prospektívnych RTOG štúdií u 468 pacientov, ktorí mali zachovaný močový mechúr (14). Pri mediáne sledovania 7.8 rokov pozorovali 5 a 10ročné nádor špecifické prežívanie u 71 % a 65 % pacientov, 80 % pacientov malo po 5-rokoch zachovaný močový mechúr, lokálnu recidívu invazívneho karcinómu po 10-rokoch malo 14 % pacientov. Kompletná remisia po iniciálnej TURB a indukčnej chemorádioterapii bola dosiahnutá v 69 %, záchranná cystektómia bola urobená u 21 % pacientov. Lokálnu recidívu infiltratívneho karcinómu malo po 5 a 10-rokoch 13 % resp. 14 % pacientov.
Neinfiltratívny urotelový karcinóm pTa,pT1 malo po 5 a 10-rokoch 31 % resp. 36 % pacientov, vzdialené metastázy malo po 5-rokoch 32 % a po 10-rokoch 35 % pacientov. Podobne v štúdii na Univerzite v Erlangene dosiahlo kompletnú odpoveď u 72 % pacientov, 5 a 10- ročné celkové prežívanie malo 51 % a 31 % pacientov, 5 a 10-ročné nádor špecifické prežívanie 56 % a 42 % pacientov, 80 % malo zachovaný funkčný mechúr (11).
Výsledky 5 a 10ročného nádor špecifického a celkového prežívania publikované v odbornej literatúre sú uvedené v tabuľke 3.
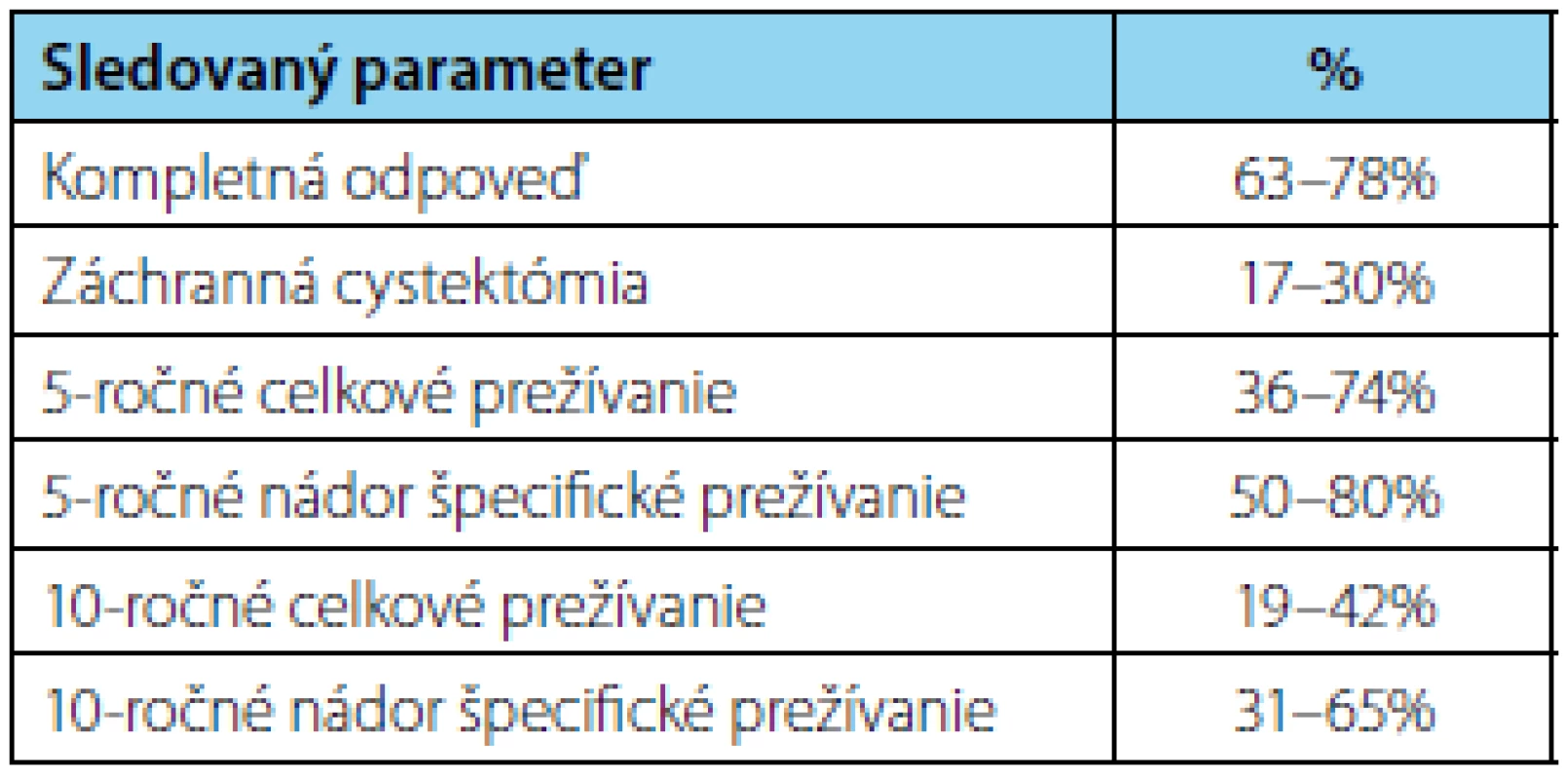
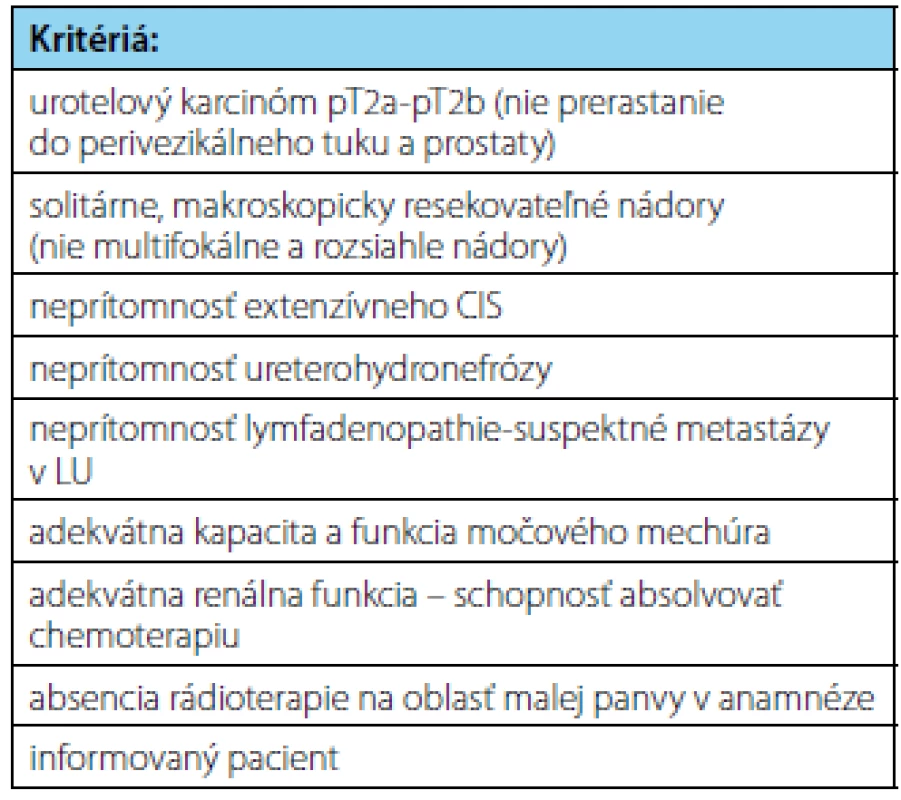
Je potrebné si uvedomiť, že žiadny nový liečebný koncept v onkologickej liečbe nie je bez rizík a obmedzení. Podobne je to aj s trimodálnou liečbou infiltratívnych urotelových nádorov so zachovaním močového mechúra. Všetci pacienti, ktorí po TURB a konkomitantnej chemorádioterapii dosiahnu kompletnú odpoveď sa musia podrobiť celoživotnému cystoskopickému sledovaniu s opakovaným odberom vzoriek na včasné zachytenie lokálnej recidívy ako aj zobrazovacím vyšetreniam na zachytenie systémovej progresie. Okrem recidívy svalovinu infiltrujúcich nádorov sa po TMT aj po 10-rokoch až v 31–36 % môžu vyskytovať recidívy neinfiltratívnych urotelových karcinómov pTa-pT1 (14). Súčasné indikačné kritériá na zaradenie pacientov na trimodálnu liečbu infiltratívnych urotelových nádorov so zachovaním močového mechúra sú uvedené v tabuľke 4.
ZÁVER
Z našej analýzy limitovaného počtu pacientov je zrejmé, že u dobre selektovaných pacientov s infiltratívnymi urotelovými nádormi močového mechúra (pT0 po re-TURB) môžeme po TMT dosiahnuť kompletnú remisiu ochorenia s minimálnym rizikom lokálnej ako aj systémovej progresie. TMT so zachovaním funkčného močového mechúra je v súčasnosti alternatívnou metódou oproti radikálnej cystektómii. Zabezpečuje dobrú lokálnu kontrolu ochorenia s dlhodobým beznádorovým prežívaním. Vyžaduje multidisciplinárnu spoluprácu urológov, radiačných onkológov a klinických onkológov ako aj úzku spoluprácu od pacientov, ktorí vyžadujú dlhoročné pravidelné cystoskopické kontroly a zobrazovacie vyšetrenia pre riziko lokálnej ako aj systémovej progresie.
Podľa odporúčaní EAU a NCCN existujú v súčasnosti dostatočné dáta, na základe ktorých môže byť TMT so zachovaním močového mechúra považovaná za prijateľný a zdôvodniteľný liečebný postup u pacientov, ktorí spľňajú indikačné kritériá, i keď optimálna liečebná stratégia nebola doposiaľ jednoznačne definovaná v randomizovaných štúdiách (2, 16).
Došlo: 7. 10. 2016
Přijato: 3. 12. 2016
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Kontaktní adresa:
MUDr. Boris Eliáš, PhD.
Urologická klinika JLF a MFN
Kollárova 2, 036 59 Martin
e-mail: borelias@yahoo.com
Zdroje
1. Rodel C, Weiss Ch. Organ – sparing multimodality treatment for muscle- invasive bladder cancer: Can we continue to ignore the evidence? J Clin Oncol. 2014; 32: 3787–3789.
2. Gakis G, Efsthatiou J, Lerner SP, et al. ICUD-EAU International Consultation on Bladder Cancer 2012. Radical cystectomy and bladder preservation for muscle-invasive urothelial carcinoma of the bladder. Eur Urol, 2013; 63: 45–57.
3. El Khalil SA. Long term complications following ileal conduit urinary diversion after radical cystectomy. J Egypt Natl Canc Inst, 2010; 22: 13–18.
4. Aghazadeh MA, Barocas DA, Salem S, et al. Determining factors for hospital discharge status after radical cystectomy in a large contemporary cohort. J Urol, 2011; 185(1): 85–89.
5. El-Taji OMS, Alam MS, Hussain SA. Bladder sparing approaches for muscle – invasive bladder cancers. Curr Treat Options in Oncol, 2016; 17: 1–14.
6. Stein JP, Lieskovsky G, Cote R, et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1 054 patients. J Clin Oncol. 2001; 19: 666–675.
7. Bentzen SM, Harari PM, Bernier J. Exploitable mechanisms for combining drugs with radiation: concepts, achievments and future directions. Nat Clin Pract Oncol. 2007; 4(3): 172–180.
8. Grob BM, Macchia RJ. Radical transurethral resection in the management of muscle-invasive bladder cancer. J Endourol. 2001; 15(4): 419–423.
9. Efstathiou JA, Spiegel DY, Shipley WU, et al. Long-term outcomes of selective bladder cancer: the MGH experience. Eur Urol. 2012; 61: 705–711.
10. Volkmer BG, Kuefer R, Bartsch G Jr, et al. Effect of a pT0 cystectomy specimem without neoadjuvant therapy on survival. Cancer. 2005; 104(11): 2384–2391.
11. Rodel C, Grabenauer GG, Kuhn R, et al. Combined-modality treatment and selective organ preservation in invasive bladder cancer: Long-term results. J Clin Oncol, 2002; 20: 3061–3071.
12. Katolická J. Karcinóm močového měchýře z pohledu klinického onkológa. Urol. praxi. 2014; 15(2): 72–76.
13. Arcangeli G, Arcangeli S, Strigari L. A systematic review and meta- analysis of clinical trials of bladder-sparing trimodality treatment for muscle-invasive bladder cancer. Oncol/Hematol. 2015; 94: 105–115.
14. Mak RH, Hunt D, Shipley WU, et al. Long-term outcomes in patients with muscle-invasive bladder cancer after selective bladder-preserving combined-modality therapy. A pooled analysis od Radiation Therapy Oncology Group protocols 8802, 8903, 9506, 9906, a 0233. J Clin Oncol, 2014, 32, s. 3801–3809.
15. Ploussard G, Daneshmand S, Efsthatiou JA, et al. Critical analysis of bladder sparing with trimodal therapy in muscle-invasive bladder cancer: a systematic review. Eur Urol. 2014; 66: 120–137.
16. National Comprehensive Cancer Network: Bladder Cancer. http://www.nccn.org/professionals/ physicians_gls/f_guidelines.asp*site.
Štítky
Detská urológia Nefrológia UrológiaČlánok vyšiel v časopise
Česká urologie

2016 Číslo 4
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
Najčítanejšie v tomto čísle
- PROGNOSTICKÝ VÝZNAM PARAMETRŮ VYCHÁZEJÍCÍCH Z POMĚRU NEUTROFILŮ K LYMFOCYTŮM U INVAZIVNÍCH NÁDORŮ MOČOVÉHO MĚCHÝŘE
- ORGÁN ŠETRIACA LIEČBA SVALOVINU INFILTRUJÚCICH NÁDOROV MOČOVÉHO MECHÚRA
- MIKČNÍ POTÍŽE U PACIENTŮ S ROZTROUŠENOU SKLERÓZOU. JSME V ALGORITMU PÉČE O PACIENTA S ROZTROUŠENOU SKLERÓZOU JAKO UROLOGOVÉ DŮLEŽITÍ?
- HIBERNOM JAKO PŘEKVAPIVÝ NÁLEZ PŘI EXSTIRPACI PERIRENÁLNÍHO TUMORU
