-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
NAŠE PRVNÍ ZKUŠENOSTI S VYUŽITÍM KOMETOVÉHO TESTU PŘI HODNOCENÍ INTEGRITY DNA VE SPERMIÍCH
OUR FIRST EXPERIENCE WITH THE COMET ASSAY IN THE STUDY OF SPERM DNA INTEGRITY
Major statement:
Based on published data, the authors highlight the importance of assessment of sperm DNA integrity in the investigation of causes of infertility. Information is complemented by our own experimental results obtained by comet assay and commercial kit Halosperm.Aim:
Abnormalities in chromatin arrangement and/or structure of the sperm DNA can significantly reduce the fertilizing potential of individuals, even in cases with normal results of conventional sperm analysis. Therefore, evaluation of sperm DNA integrity is currently emphasized in identifying the causes of male infertility. For this purpose, we decided to use comet assay and a commercially available test Halosperm with the aim to compare the two methods in the investigation of control subjects and patients with fertility disorders.Patients and Methods:
Conventional semen analysis was performed in 32 control subjects, 24 men with infertility and 26 men with vascular disorders of male genital organs, and then the levels of DNA fragmentation in the sperm were examined using the comet assay and Halosperm.Results:
Correlation analysis confirmed good agreement between the results of both methods (Pearson coeficient r = 0.241; p < 0.05); unlike the comet assay, the results of Halosperm correlated well with sperm motility (r = 0.4365; p < 0.001). While comet assay showed significantly higher sperm DNA damage in both groups of patients than in the controls (t-test, both p < 0.001), Halosperm demonstrated increased levels of fragmented DNA over control values only in the group of men with infertility (p < 0.001). From the results of comet assay in the control group, 32% of fragmented DNA per sperm was determined as the upper limit of the tolerance interval indicating a reduced fertilizing potential.Conclusion:
The comet assay has proven to be a useful complementary method to the standard examination of sperm quality.Key words:
Comet assay, DNA fragmentation, Halosperm, infertility, sperm.
Autoři: Božena Novotná 1; Lucie Svobodová 2; Marcela Čechová 3; Ladislav Jarolím 3; Matúš Chocholatý 3; Yana Bagryantseva 1; Milan Macek, sr. 2; Milan Macek jr. 2
Působiště autorů: Ústav experimentální medicíny v. v. i., AV ČR, Praha 1; Ústav biologie a lékařské genetiky 2. LF UK a FN Motol, Praha 2; Urologická klinika 2. LF UK a FN Motol, Praha 3
Vyšlo v časopise: Ces Urol 2016; 20(4): 317-325
Kategorie: Originální práce
Souhrn
Hlavní stanovisko práce:
Na základě literárních údajů autoři upozorňují na význam hodnocení integrity DNA ve spermiích při vyšetřování příčin neplodnosti. Informace je doplněna vlastními experimentálními výsledky získanými kometovým testem a komerčním kitem Halosperm.Cíl:
Abnormality v uspořádání chromatinu a/ nebo struktuře DNA spermií mohou výrazně snižovat fertilizační potenciál jedince i při normálním spermiogramu. Při identifikaci příčin mužské neplodnosti je proto v posledních letech kladen důraz i na hodnocení integrity DNA ve spermiích. Na našem pracovišti jsme se rozhodli k těmto účelům použít kometový test a komerčně dostupný test Halosperm s cílem porovnat obě metody při vyšetřování kontrolních jedinců a pacientů s poruchami plodnosti.Soubor pacientů a metody:
U 32 kontrolních jedinců, 24 mužů s neplodností a 26 mužů s cévními poruchami mužských pohlavních orgánů (MPO) byla provedena konvenční analýza semene a následně vyšetřeny hladiny fragmentace DNA ve spermiích pomocí kometového test a Halospermu.Výsledky:
Korelační analýza potvrdila dobrou shodu mezi výsledky obou metod (Pearsonův korelační keficient r=0,241; p<0,05), na rozdíl od kometového testu však výsledky Halospermu korelovaly i s motilitou (r=0,4365; p<0,001). Naproti tomu při hodnocení kometovým testem obě skupiny pacientů vykazovaly výrazně vyšší poškození DNA ve spermiích než kontroly (t-test, v obou případech p < 0,001), zatímco s pomocí Halospermu se podařilo prokázat zvýšení hladin fragmentované DNA oproti kontrolám pouze u skupiny mužů s neplodností (p < 0,001). Z hodnot kometového testu v kontrolním souboru byla stanovena hladina poškození 32 % Tail DNA jako horní mez tolerančního intervalu indikující snížený fertilizační potenciál.Závěr:
Kometový test se osvědčil jako vhodná doplňková metoda ke standardnímu vyšetření kvality spermatu.Klíčová slova:
Fragmentace DNA, Halosperm, kometový test, neplodnost, spermie.ÚVOD
Uvádí se, že přibližně 10–15 % párů v reprodukčním věku má problémy s početím potomka, přičemž mužský faktor je zodpovědný za téměř 50 % případů neplodnosti (1, 2). Lze předpokládat, že toto procento se bude dále zvyšovat v důsledku nepříznivých změn v životním stylu a oddalování reprodukce do vyššího věku. Konvenční analýza semene, tj. stanovení koncentrace, pohyblivosti a morfologie spermií v ejakulátu, umožňuje odhalit některé zásadní příčiny mužské neplodnosti. Nicméně normální spermiogram ještě nemusí garantovat dostatečný fertilizační potenciál, neboť zhruba 15 % neplodných mužů nevykazuje při vyšetření základních parametrů semene odchylky od normy (3, 4). V posledních letech přibývá důkazů, že k reprodukčnímu neúspěchu mohou významně přispívat poruchy v organizaci genetického materiálu spermií (5, 6). Během zrání spermatických buněk dochází k extrémní kondenzaci chromatinu a ztrátě nukleosomální struktury typické pro somatické buňky za vzniku vysoce stabilního a transkripčně inertního komplexu. Při těchto dramatických přestavbách je až 85 % histonů nahrazeno přechodnými proteiny a následně protaminy, které křížovými vazbami prostřednictvím disulfidických můstků stlačují chromatin do výsledného tvaru amerického koblížku („doughnut“ shape). Zbylých 15 % histonů vázaných na DNA je lokalizováno v oblastech geneticky významných pro vývoj časného zárodku (např. promotorové oblasti, lokusy kontrolované imprintingem nebo lokusy kódující mikro-RNA). Kompaktní struktura a nerozpustný charakter chromatinu spermií chrání otcovskou genetickou informaci při přenosu mužským a ženským reprodukčním traktem (7). Změny v jakékoliv fázi reorganizace chromatinu mohou negativně ovlivňovat funkci spermií (8). Přesné mechanizmy vedoucí k abnormalitám chromatinu ve spermiích dosud nebyly zcela objasněny, ale uvažuje se, že důležitou roli může hrát (1) defektní kondenzace chromatinu v průběhu spermatogeneze, (2) selhání apoptotické kontroly, které umožňuje přežití defektních spermií, (3) oxidační stres, (4) fragmentace vyvolaná aktivitou endogenních kaspáz a endonukleáz a (5) další patologické vnitřní a environmentální faktory zahrnující nádorová onemocnění, cytostatika, varikokélu, dlouhodobé horečky, leukocytospermii, profesionální expozici toxickým látkám, pokročilý věk, apod. U infertilních mužů s predispozicí k fragmentaci DNA ve spermiích se mohou uplatňovat i genetické faktory jako polymorfizmus v genech kontrolujících integritu genomu, meiotickou rekombinaci, gametogenezi, opravné dráhy DNA, detoxikační dráhy a antioxidační ochranu (5, 6, 9).
Ve světle těchto poznatků a s rozvojem technologií asistované reprodukce je zjevné, že dosavadní diagnostika mužské infertility založená na konvenční analýze spermií je nedostatečná. Průkaz zvýšené fragmentace DNA ve spermiích může být významný nejen pro posouzení fertilizačního potenciálu spermií in vivo, ale i při hodnocení kvality spermií před jejich využitím pro intrauterinní oplození (IUI), fertilizaci in vitro (IVF) nebo intracytoplazmatickou aplikaci spermie (ICSI). V posledních letech je proto věnována značná pozornost metodám umožňujícím posouzení různých aspektů poškození spermií, včetně poškození DNA. K dispozici jsou jak metody detekující přímo zlomy v DNA, tak metody nepřímé, umožňující stanovení fragmentace DNA na základě průkazu poruch v kondenzaci chromatinu (10). Do první skupiny patří zejména kometový test (Comet assay) neboli jednobuněčná gelová elektroforéza a TUNEL [terminal deoxynucleotidyl transferase-mediated 2`-deoxyuridine 5`-triphosphate (dUTP)-nick end-labeling]. Nejčastěji využívanou nepřímou metodou je tzv. „sperm chromatin integrity assay“ (SCSA) a v poslední době i „sperm chromatin dispersion test“ (SCD).
Kometový test umožňuje kvantifikovat zlomy v DNA na úrovni jednotlivých buněk. Po rozmíchání v agaróze jsou buňky naneseny na podložní sklo a ovlivněny detergentem s vysokou koncentrací solí k extrakci buněčných proteinů a membrán. Následuje denaturace DNA v alkalickém prostředí a elektroforéza, při které dochází v místech zlomů k migraci rozvolněných smyček a fragmentů DNA z jádra ke kladné elektrodě, zatímco intaktní DNA zůstává v jádře (nukleoidu). Množství vycestované DNA tak odráží stupeň jejího poškození (podrobně viz. 11). Na rozdíl od somatických buněk jsou spermie chráněny membránou bohatou na disulfidické vazby a DNA je v nich mnohem kompaktněji kondenzována, což brání buněčné lyzi. Lyzační proces je proto při zpracování spermií kombinován s expozicí silnému antioxidantu, jako je dithiothreitol (DTT) (12) nebo dlouhodobým enzymatickým působením např. proteinázou K (13).
TUNEL
Metoda kvantifikuje inkorporaci značeného deoxyuridin trifosfátu (dUTP) do jedno - a dvouřetězcových zlomů DNA v reakci katalyzované terminální deoxynukletidyl-transferázou. Množství inkorporovaného dUTP pak může být kvantifikováno jak průtokovým cytometrem, tak fluorescenčním nebo světelným mikroskopem (14). Zejména hodnocení FACSem poskytuje klinicky významné výsledky, podobně jako u kometového testu však zatím u této metody nebyla stanovena obecně uznávaná hranice vymezující snížený fertilizační potenciál.
Test na integritu chromatinu ve spermiích (SCSA)
Metoda měří citlivost DNA spermií k denaturaci v kyselém prostředí. Po obarvení akridinovou oranží (AO) je na průtokovém cytometru s pomocí speciálního softwaru stanoven rozsah denaturace DNA in situ měřením posunu barevného spektra od zelené fluorescence (AO interkalovaná do dvouřetězcové intaktní DNA) k červené fluorescenci (AO asociovaná s denaturovanou jednořetězcovou DNA). Procento červeně obarvených spermií neboli fragmentační index DNA (DFI) pak vyjadřuje množství spermií s fragmentovanou DNA a/nebo defekty protamínů (5, 10). Uvádí se, že DFI > 30% znamená velmi nízký fertilizační potenciál a předurčuje pacienta pro techniky asistované reprodukce (14).
Test disperze chromatinu ve spermiích (SCD, Halosperm)
Halosperm je jednoduchý test, který umožňuje určit fragmentaci DNA spermií bez náročného laboratorního vybavení. Metoda je založena na disperzi chromatinu spermií v kyselém prostředí. Po odstranění jaderných protaminů v lyzačním roztoku a obarvení vykazují spermie s intaktní DNA rozsáhlé rozvolnění smyček DNA, které pronikají poškozenou membránou na povrch buňky, kde vytvářejí tzv. „halo efekt“ kolem hlavičky spermie. Fragmentovaná DNA se zobrazuje s malým nebo žádným halo efektem, jelikož neproniká membránou a zůstává uzavřená v hlavičce spermie (15). Pokud více jak 30 % spermií vykazuje fragmentovanou DNA, vzorek je považován za abnormální (16).
Cílem naší studie bylo (1) zavést kometový test pro hodnocení integrity DNA ve spermiích, (2) stanovit touto metodou hladiny poškození DNA ve spermiích kontrolních jedinců a pacientů s poruchami plodnosti a (3) porovnat výsledky získané kometovým testem a komerčně dostupným kitem Halosperm.
MATERIÁL A METODY
Vzorky semene
Vzorky semene poskytli muži vyšetřovaní v Centru reprodukční medicíny a reprodukční genetiky Ústavu biologie a lékařské genetiky 2. LF UK a FN Motol a na Urologické klinice 2. LF UK a FN Motol. Vzorky byly získány masturbací po třídenní abstinenci a po zkapalnění při pokojové teplotě byly dále vyšetřeny standardními postupy, jako je objem ejakulátu, koncentrace, morfologie, vitalita a motilita spermií (17, 18), a metodami na stanovení fragmentace DNA ve spermiích, tj. kometovým testem a Halospermem. Všichni účastníci studie podepsali informovaný souhlas se zařazením do studie a vyplnili dotazník zaměřený na faktory, které by mohly ovlivnit kvalitu semene (19). Jak informovaný souhlas, tak dotazník byly schváleny Etickou komisí FN v Motole.
Celkem bylo vyšetřeno 98 mužů, kteří byli rozděleni do tří skupin. Kontrolní skupina zahrnovala muže vyšetřované pro infertilitu páru s prokázaným ženským faktorem infertility nebo s normálními hodnotami všech sledovaných parametrů při konvenční analýze semene a jedno vyšetření na vlastní žádost. Druhou skupinou byli muži vyšetřovaní pro infertilitu. Do třetí skupiny byli zařazeni muži s cévními poruchami mužských pohlavních orgánů (MPO) – varikokélou.
Kometový test
K přípravě preparátů jsme modifikovali alkalickou verzi kometového testu podle Schmida a kol. (12), tj. po působení lyzačního roztoku (1 hod.) byly preparáty ovlivněny DTT v lyzačním roztoku (0,154 g DTT/100 ml lyzačního roztoku) po dobu 10 min., následovala alkalické denaturace v elektroforetickém pufru (20 min. při 4°C), desetiminutová elektroforéza (1,2 V/cm, 300 mA), 2x neutralizace 1 ml Trisu po 5 min., barvení 100 μl roztoku GelRed (1 μl GelRed/3 ml H2O; 30 min.) a promytí destilovanou H2O (6 min.). Po fixaci 50 μl methanolu se preparáty nechaly uschnout na suchém, tmavém místě. Z každého vzorku byly připraveny dva preparáty podle již dříve popsaného postupu (20). Před hodnocením byly preparáty zvlhčeny destilovanou H2O a přikryty krycím sklem. Měření poškozené DNA bylo prováděno pomocí fluorescenčního mikroskopu BX51 (Olympus, Japonsko) propojeného s kamerou CCD-1300B (VDS, Vosskuhler, Německo) a obrazovou analýzou Lucia Comet Assay 7,00 (Laboratory Imaging, ČR). Stupeň poškození DNA byl v každé buňce stanoven jako procento vycestované DNA z celkového množství DNA v jádře (Tail DNA). Z každého vzorku bylo změřeno 500 buněk a z naměřených hodnot byl spočítán medián, který charakterizoval kvalitu DNA ve spermiích vyšetřovaného jedince. Obrázek 1 dokumentuje vzhled „komet“ připravených ze spermií.
Obr. 1. Spermie zpracované kometovým testem. Šipka ukazuje nukleoid spermie s nepoškozenou DNA, trojúhelník nukleoid spermie s vysokým stupněm fragmentace DNA a hvězdička nukleoid somatické buňky, pravděpodobně leukocytu Fig. 1. Sperm processed by comet assay. The arrow indicates the nucleoid of sperm with intact DNA, the triangle shows the sperm with a high degree of DNA fragmentation and the asterisk shows the nucleoid of somatic cells, presumably leukocyte 
Halosperm
K přípravě preparátů jsme používali komerčně dostupný kit (HalotechDNA, Španělsko) a při zpracování vzorků jsme postupovali podle pokynů výrobce. Po oschnutí preparátů bylo pod světelným mikroskopem hodnoceno procentuální zastoupení zdravých spermií (H), tj. spermií s intaktní DNA, dále fragmentovaných spermií (F), tj. spermií s fragmentovanou DNA a/nebo poruchou kondenzace chromatinu, a degenerovaných spermií (D) v 500 buňkách/osobu (Obrázek 2).
Obr. 2. Spermie zpracované testem na disperzi chromatinu – Halosperm. Bílá šipka ukazuje zdravou spermii (H) s rozptýleným chromatinem kolem hlavičky („halo“ efekt), černá šipka ukazuje spermii s fragmentovanou DNA (F), černý trojúhelník spermii degenerovanou (D) Fig. 2. Sperm processed by chromatin dispersion assay (Halosperm). The white arrow indicates healthy sperm (H) with a dispersed chromatin around the head („halo“ effect), the black arrow indicates the sperm with fragmented DNA (F) and the black triangle shows the degenerated sperm (D) 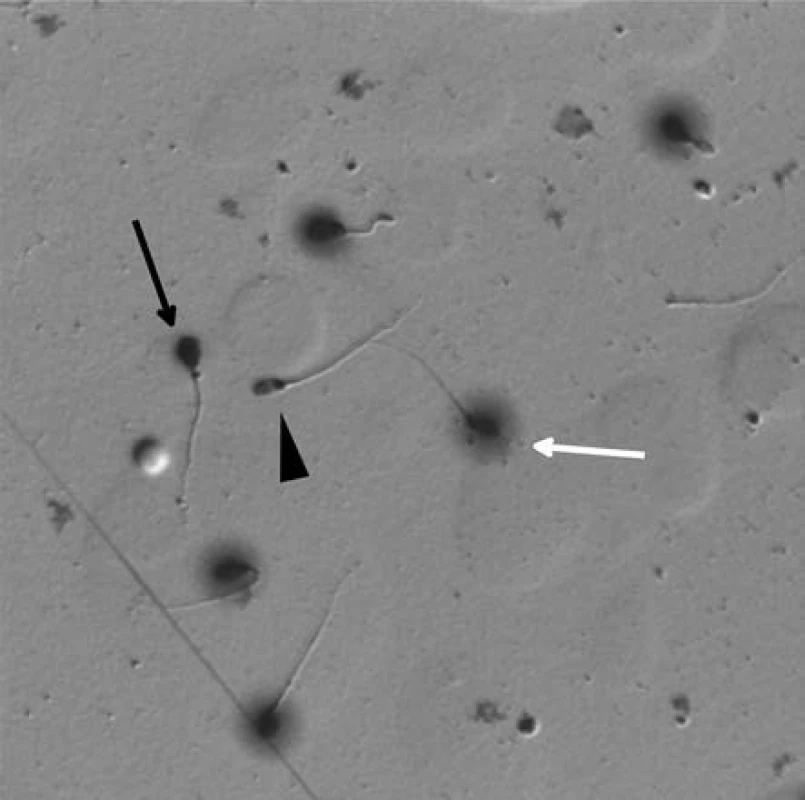
VÝSLEDKY
Porovnání výsledků získaných kometovým testem a Halospermem Korelační analýza potvrdila dobrou shodu mezi výsledky obou metod, tj. nárůst v počtu spermií kategorie F v Halospermu korespondoval s nárůstem hodnot Tail DNA v kometovém testu (Obrázek 3).
Obr. 3. Korelace mezi výsledky kometového testu a testu na disperzi chromatinu (Halosperm), r = Pearsonův korelační koeficient Fig. 3. Correlation between the results of comet assay and chromatin dispersion assay (Halosperm), r = Pearson correlation coefficient 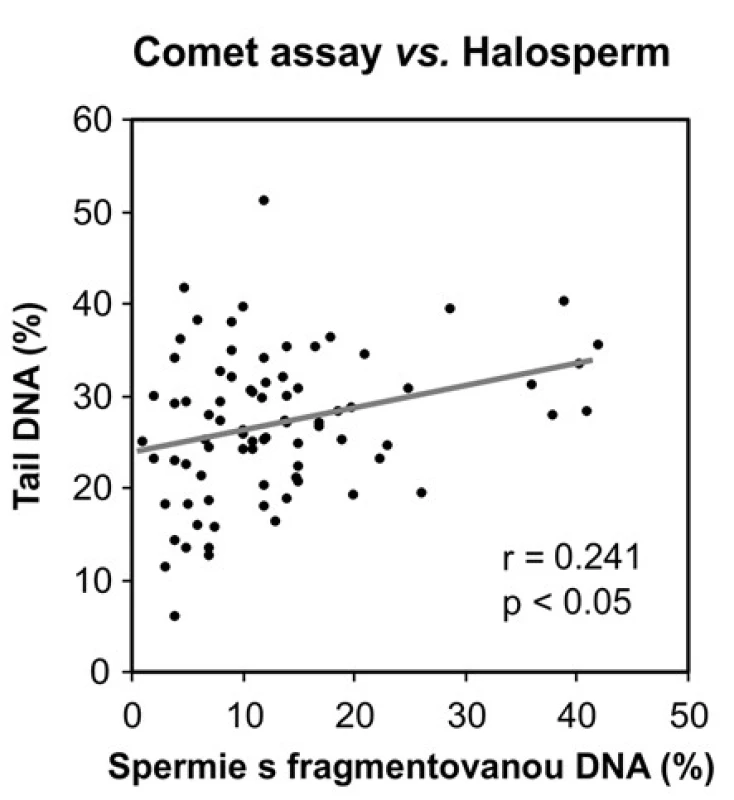
Výsledky Halospermu navíc korelovaly s motilitou, tj. se stoupajícím procentem pohyblivých spermií (kategorie a+b) stoupalo i procento spermií s intaktní DNA (Obrázek 4a). Mezi výsledky kometového testu a motilitou se nám podobný vztah prokázat nepodařilo (Obrázek 4b).
Obr. 4. Korelace mezi pohyblivostí spermií a výsledků testu na (a) disperzi chromatinu – Halosperm a (b) fragmentaci DNA – kometový test; r = Pearsonův korelační koeficient Fig. 4. Correlation between the sperm motility and the results of test on (a) chromatin dispersion – Halosperm and (b) DNA fragmentation – comet assay; r = Pearson correlation coefficient 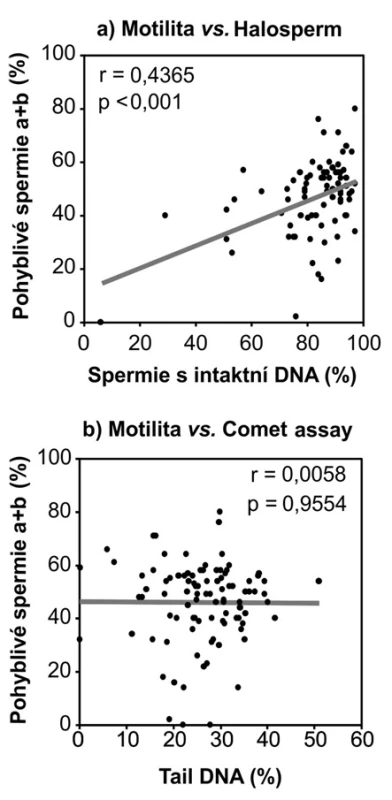
Porovnání integrity DNA ve spermiích v jednotlivých skupinách Výsledky hodnocení integrity DNA v jednotlivých skupinách pacientů shrnuje tabulka 1. Při hodnocení kometovým testem obě sledované skupiny pacientů vykazovaly výrazně vyšší poškození DNA ve spermiích než kontroly, zatímco s pomocí Halospermu se podařilo prokázat statisticky významné zvýšení fragmentované DNA oproti kontrolám pouze u infertilit (Obrázek 5).
Tab. 1. Výsledky vyšetření spermií u kontrol a pacientů s neplodností a cévními poruchami mužských pohlavních orgánů (MPO). Tab. 1. The results of sperm examination in the control subjects and the patients with infertility or vascular disorders of the male reproductive organs (MRO) 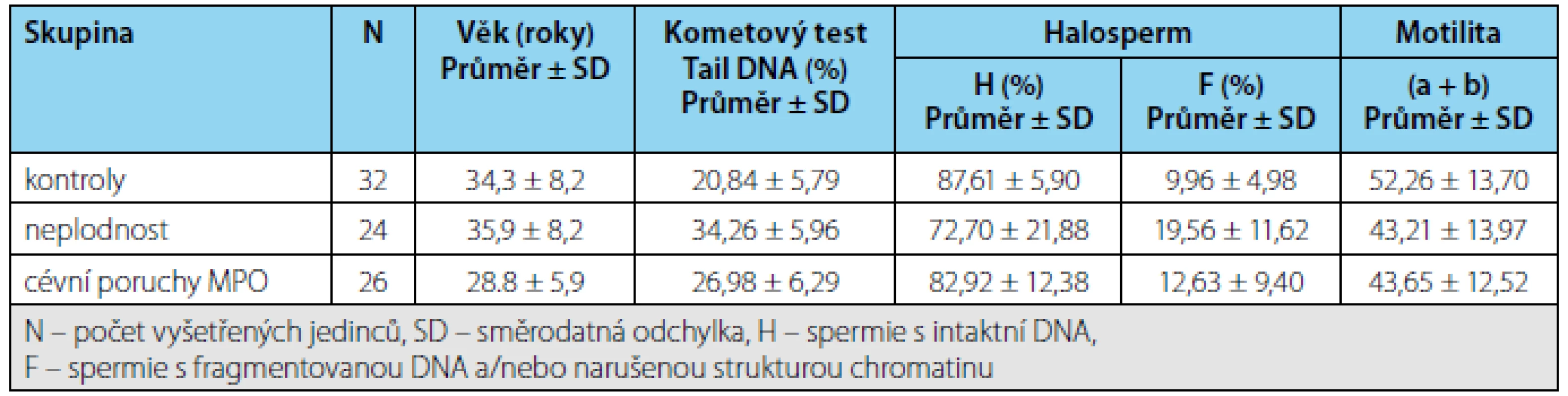
Obr. 5. Srovnání výsledků kometového testu a Halospermu u kontrolních jedinců, pacientů s infertilitou a cévními poruchami mužských pohlavních orgánů. SD – směrodatná odchylka; ***p < 0,001; čísla ve sloupcích uvádějí počet vyšetřených jedinců Fig. 5. Comparison of the results between the comet assay and chromation dispersion assay (Halosperm) in the control subjects and the patients with infertility or vascular disorders of the male reproductive organs. SD – standard deviation; *** p < 0.001; numbers in the columns indicate the number of analyzed subjects 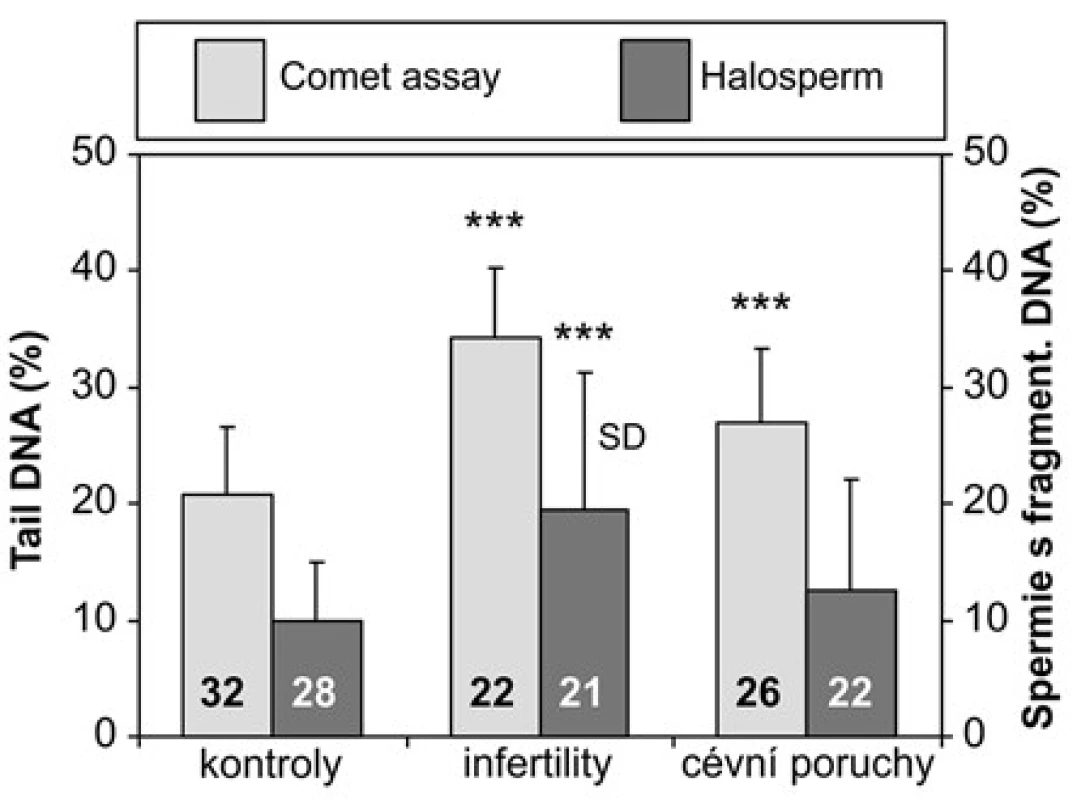
Z hodnot kometového testu v kontrolním souboru byla se spolehlivostí 0,9 stanovena hladina poškození 32% Tail DNA jako horní mez jednostranného 95% tolerančního intervalu (21). Ve skupině infertilit tuto hranici překračovalo 14 z 22 jedinců, u cévních poruch MPO to byli pouze čtyři jedinci ze 26, ale dalších deset mělo hodnoty na horní hranici tolerančního intervalu (28–31,95 % Tail DNA). DISKUZE V naší kontrolní skupině dosáhla průměrná hodnota Tail DNA detekovaná ve spermiích kometovým testem zhruba 21 %, zatímco hodnoty zjištěné u neplodných mužů a mužů s cévními poruchami MPO byly výrazně vyšší. K podobným závěrům, pokud jde o fertilní a infertilní jedince, dospěli také Irvin a kol. (22). Naproti tomu jiní autoři pomocí této metody nezjistili žádné rozdíly mezi fertilními a infertilními muži s normozoospermií a infertilními muži s astenozoospermií, u všech skupin průměrné hladiny fragmentované DNA dosahovaly 20 % (13).
Na základě výsledků kometového testu jsme spočítali hodnotu 32 % Tail DNA jako horní mez tolerančního intervalu vymezující jedince s vysokými hladinami fragmentované DNA, což je hodnota téměř identická s limitem DFI 30 %, stanoveným pro zatím nejpoužívanější metodu k hodnocení integrity DNA ve spermiích – SCSA. Zatímco ve skupině infertilit tuto hranici překročilo více jak 60 % vyšetřených jedinců, u cévních poruch MPO to bylo jen 15 %. Ačkoliv korelační analýza prokázala dobrou shodu mezi výsledky kometového testu a Halospermu, pomocí Halospermu se nám rozdíly ve fragmentaci DNA spermií mezi kontrolní skupinou a skupinou s cévními poruchami MPO nepodařilo prokázat. Přitom u těchto pacientů byla popsána zvýšená instabilita DNA v důsledku zvýšeného oxidačního stresu (23). K objasnění těchto rozdílů je nezbytné rozšíření vyšetřovaných skupin, zpřesnění diagnóz a hlubší analýza anamnézy pacientů. Uvádí se, že se stoupajícím věkem stoupá i poškození DNA ve spermiích, neboť spermie mužů mezi 36 a 57 lety vykazovaly výrazně vyšší hladiny fragmentované DNA než spermie mužů mezi 20 a 35 lety (24). Nelze tedy zcela vyloučit, že určitou roli v rozdílech mezi našimi skupinami mohl sehrát i rozdílný věk, protože kontrolní a zejména neplodní muži v průměru již patřili spíše do starší věkové kategorie (34±8 a 36±8 roků), zatímco většina pacientů s cévními poruchami MPO nepřekročila třicátý rok života (29±6 roků). I v kometovém testu tito pacienti měli nižší hodnoty Tail DNA než infertility, stále se ale statisticky významně lišili od kontrol. V tomto případě se nám kometový test osvědčil jako citlivější metoda než Halosperm.
Uvádí se, že zvýšená fragmentace DNA je spojená se zhoršenou pohyblivostí spermií (16, 25).
V našem souboru skutečně výsledky Halospermu korelovaly s motilitou. Naopak pomocí kometového testu se nám podobný vztah nepodařilo prokázat. Zřejmě je to způsobeno tím, že kometový test – na rozdíl od Halospermu (ale také SCSA) – neodráží počet buněk s fragmentovanou DNA, ale nejčastější hladinu poškození DNA ve vyšetřovaných buňkách.
Závěrem lze shrnout, že se nám kometový test osvědčil jako vhodná doplňková metoda ke standardnímu vyšetření kvality spermatu. Je sice časově náročnější než SCSA a zatím nemá ani mezinárodně standardizovaný protokol, ani definovaný horní limit DFI, takže údaje získané na různých pracovištích se často výrazně liší. Je to ale metoda dostatečně citlivá a umožňuje analýzu i minimálního množství buněk. V praxi by tak mohla významně přispět k identifikaci příčin infertility i k posouzení vhodnosti spermií pro techniky asistované reprodukce.
Poděkování: Podpořeno grantem IGA MZd ČR NT/13770
Došlo: 28. 7. 2016
Přijato: 14. 11. 2016
Střet zájmů: žádný
Prohlášení o podpoře: Práce byla podpořena grantem IGA MZd ČR NT/13770.
Kontaktní adresa:
RNDr. Božena Novotná, CSc.
Ústav experimentální medicíny v.v.i., AV ČR
Vídeňská 1 083, 142 20 Praha 4
e-mail: novotna@biomed.cas.cz
Zdroje
1. Saleh RA, Agarwal A, Nelson DR, et al. Increased sperm nuclear DNA damage in normozoospermic infertile men: a prospective study. Fertil Steril 2002; 78 : 313–318.
2. Nallella KP, Sharma RK, Aziz N, et al. Significance of sperm characteristics in the evaluation of male infertility. Fertil Steril 2006; 85 : 629–634.
3. Agarwal A, Allamaneni SS. Sperm DNA damage assessment: a test whose time has come. Fertil Steril 2005; 84 : 850–853.
4. Lewis SE, Agbaje I, Alvarez J. Sperm DNA tests as useful adjuncts to semen analysis. Syst Biol Reprod Med 2008; 54 : 111–125.
5. Agarwal A, Said M. Role of sperm chromatin abnormalities and DNA damage in male infertility. Hum Reprod Update 2003; 9 : 331–345.
6. Evgeni E, Charalabopoulos K, Asimakopoulos B. Human sperm DNA fragmentation and its correlation with conventional semen parameters. J Reprod Infertil 2014; 15 : 2–14.
7. Lin MH, Kuo-Kuang Lee R, Li SH, et al. Sperm chromatin structure assay parameters are not related to fertilization rates, embryo quality, and pregnancy rates in in vitro fertilization and intracytoplasmic sperm injection, but might be related to spontaneous abortion rates. Fertil Steril 2008; 90 : 352–359.
8. Muriel L, Garrido N, Fernández JL, et al. Value of the sperm deoxyribonucleic acid fragmentation level, as measured by the sperm chromatin dispersion test, in the outcome of in vitro fertilization and intracytoplasmic sperm injection. Fertil Steril 2006; 85 : 371–383.
9. Singh A, Agarwal A. The role of sperm chromatin integrity and DNA damage on male infertility. Open Reprod Sci J 2011; 3 : 65–71.
10. Coccuza M, Sikka SC, Athayade KS, et al. Clinical relevance of oxidative stress and sperm chromatin damage in male infertility: An evidence based analysis. Int Braz J Urol 2007; 33 : 603–621.
11. Dvořák M, Matejovičová M. Principy a využití kometové analýzy při detekci poškození DNA. Chem Listy 2008; 102 : 977–983.
12. Schmid TE, Eskenazi B, Baumgartner A, et al. The effects of male age on sperm DNA damage in healthy nonsmokers. Hum Reprod 2007 : 22 : 180–187.
13. Hughes CM, Lewis SEM, McKelvey-Martin V, et al. A comparison of baseline and induced DNA damage in human spermatozoa from fertile and infertile men, using modified comet assay. Mol Hum Reprod 1996; 2 : 613–619.
14. Evenson DP, Larson KL, Jost LK. Sperm chromatin Structure assay: Its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques. J Androl 2002; 23 : 25–43.
15. Fernández JL, Muriel L, Rivero MT, et al. The sperm chromatin dispersion test: a simple method for the determination of sperm DNA fragmentation. J Androl 2003; 24 : 59–66.
16. Peluso G, Palmieri A, Cozza PP, et al. The study of spermatic DNA fragmentation and sperm motility in infertile subjects. Arch Ital Urol Androl 2013; 85 : 1–13.
17. World Health Organization (1999). WHO laboratory manual for the examination of human semen and semen-cervical mucus interaction, 4th edn. Cambridge University Press, Cambridge, UK, ISBN 9780521645997.
18. World Health Organization (2010). WHO laboratory manual for the examination and processing of human semen, 5th edn. World Health Organization, Geneva, Switzerland, ISBN 978 92 4 154778 9.
19. Rubes J, Rybar R, Prinosilova P, et al. Genetic polymorphisms influence the susceptibiliy of men to sperm DNA damage associated with exposure to air pollution. Mutat Res 2010; 683 : 9–15.
20. Novotná B, Topinka J, Solanský I, et al. Impact of air pollution and genotype variability on DNA damage in Prague policemen. Toxicol Lett 2007; 172 : 34–47.
21. Owen DB. Handbook of Statistical Tables, Addison-Wesley publishing Company, Massachusetts Palo Alto London, 1962.
22. Irvine DS, Twigg JP, Gordon EL, et al. DNA integrity in human spermatozoa: relationships with semen quality. J Androl 2000; 21 : 33–44.
23. Agarwal A, Makker K, Sharma R. Clinical relevance of oxidative stress in male factor infertility: an update. Am J Reprod Immunol 2008; 59 : 2–11.
24. Singh NP, Muller ChH, Berger RE. Effects of age on DNA double-strand breaks and apoptosis in human sperm. Fertil Steril 2003; 80 : 1420–1430.
25. Talebi AR, Vahidi S, Aflatoonian A, et al. Cytochemical evaluation of sperm chromatin and DNA integrity in couples with unexplained recurrent spontaneous abortions. Andrologia 2012; 44 : 462–470.
Štítky
Detská urológia Nefrológia Urológia
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2016 Číslo 4- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- PRÁCE V ZAHRANIČÍ A MOŽNOST STÁŽÍ ČI PRACOVNÍHO POBYTU V BRITÁNII
- SELEKTIVNÍ KLAMPING PŘI ROBOTICKY ASISTOVANÉ RESEKCI LEDVINY
- MIKČNÍ POTÍŽE U PACIENTŮ S ROZTROUŠENOU SKLERÓZOU. JSME V ALGORITMU PÉČE O PACIENTA S ROZTROUŠENOU SKLERÓZOU JAKO UROLOGOVÉ DŮLEŽITÍ?
- DYSFUNKCE DOLNÍCH MOČOVÝCH CEST U DIABETICKÝCH PACIENTŮ
- DOPORUČENÉ POSTUPY PRO DIAGNOSTIKU A LÉČBU NYKTURIE V ČESKÉ REPUBLICE
- PROGNOSTICKÝ VÝZNAM PARAMETRŮ VYCHÁZEJÍCÍCH Z POMĚRU NEUTROFILŮ K LYMFOCYTŮM U INVAZIVNÍCH NÁDORŮ MOČOVÉHO MĚCHÝŘE
- PROGNÓZA PACIENTŮ SE STŘEDNĚ A VYSOCE RIZIKOVÝM SVALOVINU DETROZORU NEINFILTRUJÍCÍM KARCINOMEM MOČOVÉHO MĚCHÝŘE LÉČENÝCH INTRAVEZIKÁLNÍMI INSTILACEMI MITOMYCINU C V OBDOBÍ NEDOSTUPNOSTI BCG VAKCÍNY
- ORGÁN ŠETRIACA LIEČBA SVALOVINU INFILTRUJÚCICH NÁDOROV MOČOVÉHO MECHÚRA
- NAŠE PRVNÍ ZKUŠENOSTI S VYUŽITÍM KOMETOVÉHO TESTU PŘI HODNOCENÍ INTEGRITY DNA VE SPERMIÍCH
- RARITNÍ HISTOLOGICKÝ NÁLEZ MALIGNÍHO TUMORU VYCHÁZEJÍCÍHO Z LOŽISKA ENDOMETRIÓZY LEDVINY
- HIBERNOM JAKO PŘEKVAPIVÝ NÁLEZ PŘI EXSTIRPACI PERIRENÁLNÍHO TUMORU
- VÝSLEDKY SOUTĚŽE ČUS O NEJLEPŠÍ VĚDECKOU PUBLIKACI ZA ROK 2015
- 62ND CZECH UROLOGICAL SOCIETY ANNUAL CONFERENCE IN ČESKÉ BUDĚJOVICE 2016
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- PROGNOSTICKÝ VÝZNAM PARAMETRŮ VYCHÁZEJÍCÍCH Z POMĚRU NEUTROFILŮ K LYMFOCYTŮM U INVAZIVNÍCH NÁDORŮ MOČOVÉHO MĚCHÝŘE
- ORGÁN ŠETRIACA LIEČBA SVALOVINU INFILTRUJÚCICH NÁDOROV MOČOVÉHO MECHÚRA
- MIKČNÍ POTÍŽE U PACIENTŮ S ROZTROUŠENOU SKLERÓZOU. JSME V ALGORITMU PÉČE O PACIENTA S ROZTROUŠENOU SKLERÓZOU JAKO UROLOGOVÉ DŮLEŽITÍ?
- DOPORUČENÉ POSTUPY PRO DIAGNOSTIKU A LÉČBU NYKTURIE V ČESKÉ REPUBLICE
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



