-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Úspěšná léčba těžké formy hidradenitis suppurativa pomocí adalimumabu
Successful Treatment of Severe Hidradenitis Suppurativa with Adalimumab
Hidradenitis suppurativa is a chronic suppurative disease characterized by inflammatory nodules, fistulas and scarring predominantly in the armpits and the groins. Systemic therapy including oral antibiotics, retinoids or antiandrogens has only limited effect, advanced stages require surgical treatment of affected areas. Recently, there were some reports of successfull therapy of hidradenitis suppurativa by TNF-α antagonists. In contrast to infliximab and etanercept, the positive effect of adalimumab was described only in small cohorts of patients. Nine patients with severe, recalcitrant hidradenitis were treated for 1 year with adalimumab in a standard regimen and followed-up for 1 year. All patients improved within 4–6 weeks and laboratory parameters like CRP and leucocyte count were reduced significantly during the treatment. In four patients we observed a long lasting improvement, five patients showed recurrences several months after the therapy discontinuation. Average recurrence-free interval was 9 months. According to our experience therapy with adalimumab is suitable for treatment and induction of long-term remission in severe hidradenitis suppurativa.
Key words:
hidradenitis suppurativa – adalimumab – TNF-α antagonist
Autoři: M. Arenbergerová; S. Gkalpakiotis; T. Frey; P. Arenberger
Působiště autorů: Dermatovenerologická klinika 3. LFUK a FNKV, Praha, přednosta prof. MUDr. Petr Arenberger, DrSc., MBA
Vyšlo v časopise: Čes-slov Derm, 86, 2011, No. 1, p. 18-22
Kategorie: Terapie, farmakologie a klinické studie
Souhrn
Hidradenitis suppurativa je chronické hnisavé onemocnění charakterizované zánětlivými noduly, píštělemi a jizvením, zejména v axilách a inguinách. Systémová terapie ve formě antibiotik, retinoidů nebo antiandrogenů má většinou jen omezený efekt, pokročilá stadia vyžadují chirurgickou léčbu postižených oblastí. V poslední době byla uveřejněna první pozitivní sdělení o úspěšné léčbě hidradenitidy TNF-α antagonisty. Na rozdíl od infliximabu a etanerceptu byla účinnost adalimumabu zatím ověřena pouze na malých souborech pacientů. V našem sledování bylo devět pacientů s těžkou formou hidradenitidy léčeno jeden rok adalimumabem a následně 12 měsíců monitorováno pro posouzení efektu léčby. U všech pacientů došlo ke zlepšení klinického obrazu během 4–6 týdnů a k redukci zánětlivých parametrů jako je C-reaktivní protein a počet leukocytů. U čtyř pacientů jsme zaznamenali dlouhodobou remisi onemocnění, pět pacientů zrelabovalo několik měsíců po vysazení terapie. Průměrná doba remise byla devět měsíců. Léčba adalimumabem je podle našich zkušeností vhodná pro zvládnutí těžké formy hidradenitis suppurativa a k navození delší remise.
Klíčová slova:
hidradenitis suppurativa – adalimumab – antagonisté TNF-αÚVOD
Hidradenitis suppurativa (HS) je chronické, zánětlivé, recidivující onemocnění, které se zpravidla manifestuje po pubertě bolestivými, v hloubce uloženými zánětlivými noduly, abscesy a jizvením v oblastech s apokrinními žlázami, nejčastěji v axilární, inguinální a anogenitální oblasti [16]. Klinický obraz se může u jednotlivých pacientů lišit a manifestuje se přítomností několika pustul nebo nodulů až po hluboce uložené sinusy, abscesy a cysty.
Bez terapie má choroba chronický a rychle progredující charakter. Onemocnění výrazně snižuje kvalitu života postižených zejména vzhledem k masivní hnisavé sekreci, která silně zapáchá a pro nemocné představuje značný společenský problém. Druh terapie volíme podle rozsahu onemocnění. Pro počínající formy menšího rozsahu volíme lokální antiseptickou a protizánětlivou terapii. Pokročilá stadia vyžadují systémová antibiotika, retinoidy, antiandrogeny, kortikosteroidy, cyklosporin A nebo dapson, přičemž všechny tyto léčebné postupy mají pouze omezený efekt [6]. Nejúčinnější formou terapie těžké HS je podle literatury široká excize postižené oblasti včetně cyst, sinů a preparace píštělí [8]. V poslední době se objevila řada studií popisujících příznivý efekt anti TNF-α protilátek, jako je infliximab nebo fúzní protein ze dvou solubilních TNF receptorů vázaných s Fc fragmentem IgG1 (etanercept) [2–4, 11]. V tuto chvíli existuje podle našich informací jen pět literárních publikací o efektu adalimumabu, lidské monoklonální protilátky proti TNF-α [1, 5, 12, 17, 19]. Pro naše sledování jsme si vybrali adalimumab místo infliximabu vzhledem k výhodné možnosti domácí aplikace. Uvádíme naše zkušenosti s vyhodnocením efektu 12měsíční terapie adalimumabem u devíti pacientů s těžkou formou HS. Všichni pacienti byli léčeni ve standardním dávkování bez přidání jiné systémové terapie po dobu 12 měsíců a další rok pozorováni se zaměřením na určení průměrné doby remise choroby.
PACIENTI A METODY
Do sledování bylo zařazeno devět pacientů s těžkou formou HS ve III. stadiu podle Hurleyho trvající minimálně pět let (tab. 1). V klinickém obraze jsme pozorovali mnohočetné zánětlivé noduly, abscesy, komunikující píštěle a rozsáhlé jizvení. Standardní systémová terapie antibiotiky, kortikosteroidy, cyklosporinem A nebo dapsonem byla anamnesticky neúčinná nebo byla vysazena pro nežádoucí účinky. Všichni pacienti před počátkem biologické terapie odmítli chirurgické řešení onemocnění. Všech devět pacientů kouřilo v současnosti nebo v minulosti. Čtyři pacienti měli body mass index (BMI) vyšší než 25. Po důkladném vysvětlení plánované terapie byl pacienty vzhledem k off-label indikaci podepsán informovaný souhlas. Všichni absolvovali screening na latentní tuberkulózu s provedením Mantoux testu, QuantiFERON-TB Gold testu a rentgenového snímku plic.
Tab. 1. Charakteristika pacientů, zmenšení postižené oblasti a doba do relapsu onemocnění v období sledování pacientů 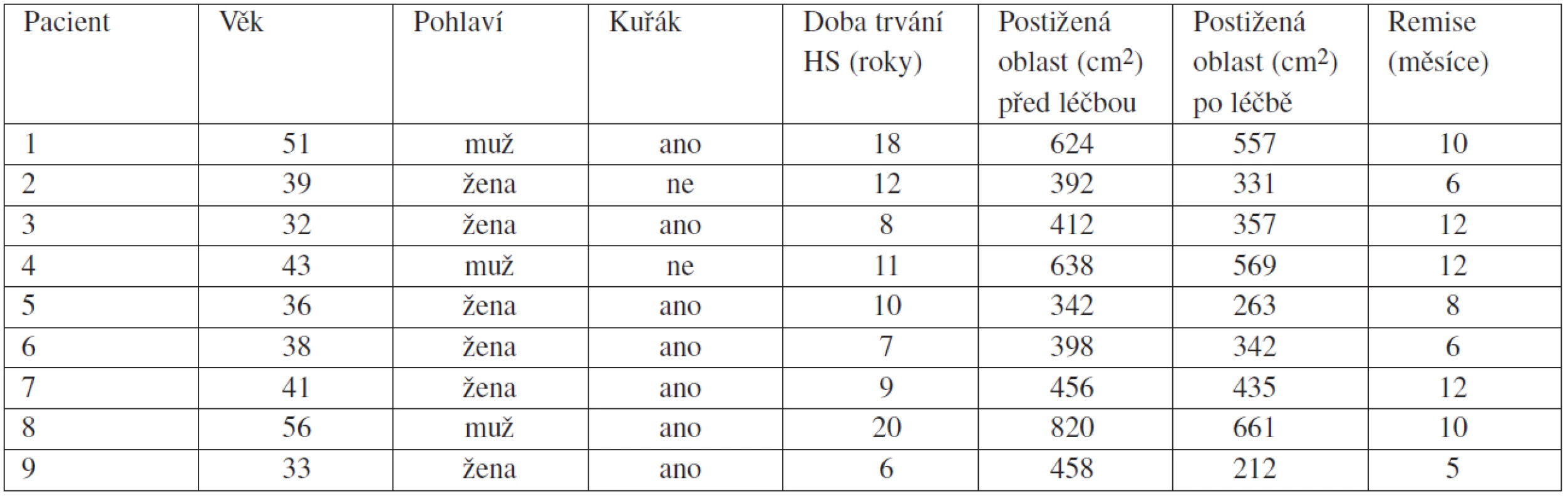
Pacienti byli léčeni rok monoterapií adalimumabem. Dávkování jsme použili stejné jako u psoriázy: na počátku jednorázově 80 mg s. c., pak 40 mg po týdnu a dále 40 mg každý druhý týden. Adalimumab si pacienti aplikovali sami doma subkutánně.
Po roční léčbě jsme pacienty pravidelně sledovali a zaměřili se na délku remise. V tomto období nebyli léčeni žádnou specifickou systémovou terapií, dostávali pouze léčbu místní. Nemocní docházeli měsíčně do naší ambulance na pravidelné kontroly. Klinický obraz byl dokumentován fotografiemi a vyznačován na kontaktních fóliích, které byly vyhodnocovány planimetricky. Aktivita onemocnění byla posuzována pomocí vizuální analogové škály se zaměřením na hodnocení bolesti a sekrece. Zánětlivé laboratorní parametry jako C-reaktivní protein (CRP) a počet leukocytů byly monitorovány v intervalech 3 měsíců.
VÝSLEDKY
Devět pacientů (6 žen a 3 muži) s těžkou formou HS dokončilo terapii i sledování podle navrženého protokolu. Charakteristiky pacientů jsou uvedeny v tabulce 1. U všech nemocných se snížila purulentní sekrece již během 4–6 týdnů a po 4–6 měsících bylo dosaženo poměrně stabilního klinického zlepšení (obr. 1A a 1B). Oblast postižená zánětem se po dvanáctiměsíční terapii v průměru zmenšila o 18 %. Po roční terapii jsme pacienty pravidelně sledovali a hodnotili klinický obraz. Rozdíly mezi jednotlivci byly významné. U třech pacientů jsme zaznamenali dlouhodobé stabilní zlepšení onemocnění během 12 měsíců, dva pacienti zrelabovali po 10 měsících, 1 pacient po 8 měsících, dva po 6 měsících a jeden po 5 měsících (viz tab. 1). Průměrná doba remise byla 9 měsíců. U pacientů s relapsem v době sledování nedošlo ke zhoršení klinického obrazu oproti stavu před léčbou a byla jim nabídnuta intenzivní lokální léčba antiseptiky, antibiotiky nebo protizánětlivými preparáty. Všichni sledovaní pacienti byli kuřáky nebo kouřili v minulosti. Všem bylo doporučeno přestat kouřit. Čtyři pacienti byli obézní s body mass indexem (BMI) vyšším než 25 a byla jim nabídnuta konzultace u obezitologa.
Obr. 1A, 1B. Hidradenitis suppurativa s axilárním a perianálním postižením před terapií a 4 měsíce po nasazení adalimumabu 
Aktivita onemocnění byla posuzována pomocí dvou vizuálních analogových škál hodnotících bolest a sekreci na stupnici od 0 (nepřítomno) do 10 (maximum), jak je patrné na obrázku 2. Všichni pacienti prováděli hodnocení měsíčně po dobu 24 měsíců.
Obr. 1. Aktivita onemocnění byla posuzována pomocí dvou vizuálních analogových škál hodnotících bolest a sekreci na stupnici od 0 (nepřítomno) do 10 (maximum) během roční terapie adalimumabem a ročním sledováním pacientů 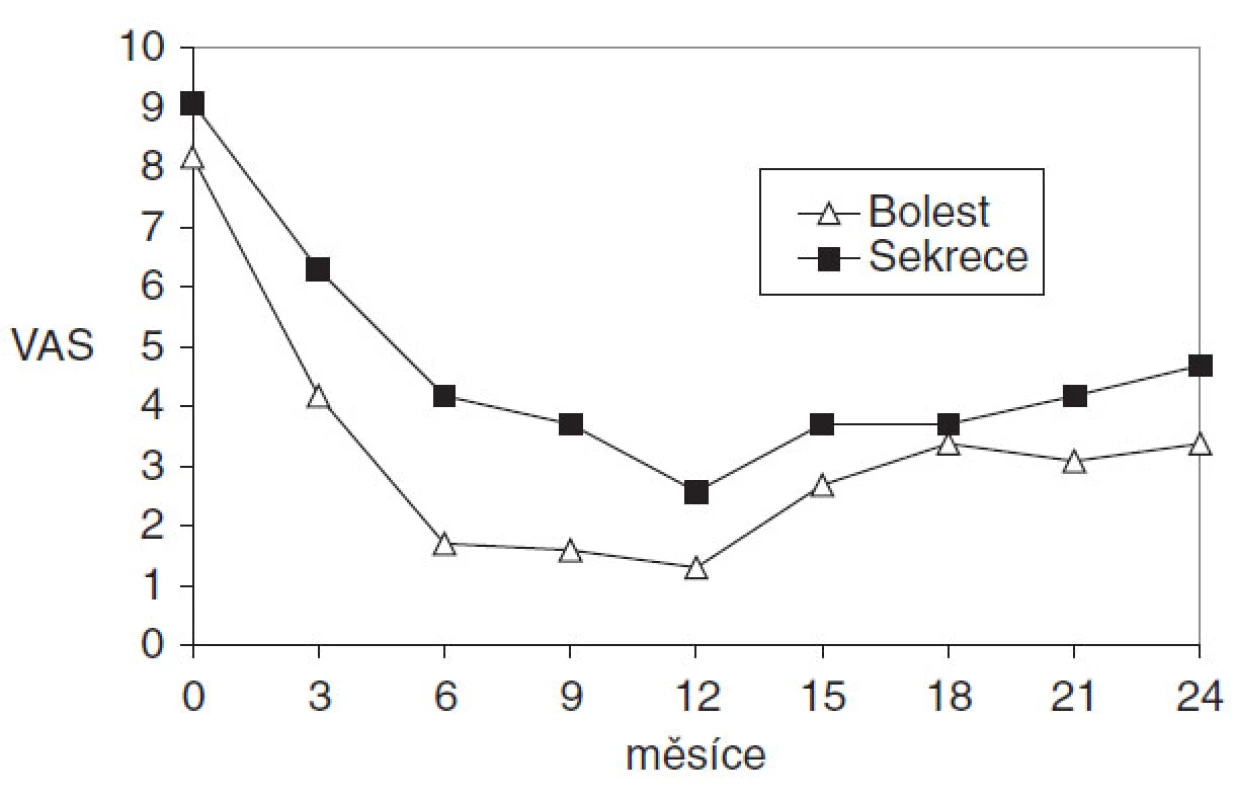
Po šesti měsících léčby adalimumabem byla průměrná redukce bolesti o 81 % a průměrná redukce sekrece o 54 %. Stabilizovaný stav onemocnění byl udržován od 6. do 12. měsíce terapie u všech sledovaných. Stabilizovaný stav se začal opět postupně zhoršovat po vysazení terapie během období sledování a u šesti pacientů jsme v této době zaznamenali relaps. Po 24 měsících byla průměrná redukce bolesti o 59 % a redukce sekrece o 48 %.
Laboratorní hodnoty CRP a počet leukocytů se během terapie snížil a koreloval s klinickým obrazem (obr. 3). Průměrně se hodnota CRP snížila z 41,5 mg/l na 13,3 mg/l po 6 týdnech a na 7,6 mg/l po 6 měsících (norma CRP je 0–10 mg/l). Průměrný počet leukocytů se zredukoval z 14,1 . 109/l na 11,5 . 109/l během 6 týdnů a na 9,2 . 109/l během 6 měsíců (norma počtu leukocytů je 4–109/l).
Obr. 2. Dynamika zánětlivých parametrů: C-reaktivní protein (mg/l) a počet leukocytů (x 10<sup>9</sup>/l) během roční terapie adalimumabem 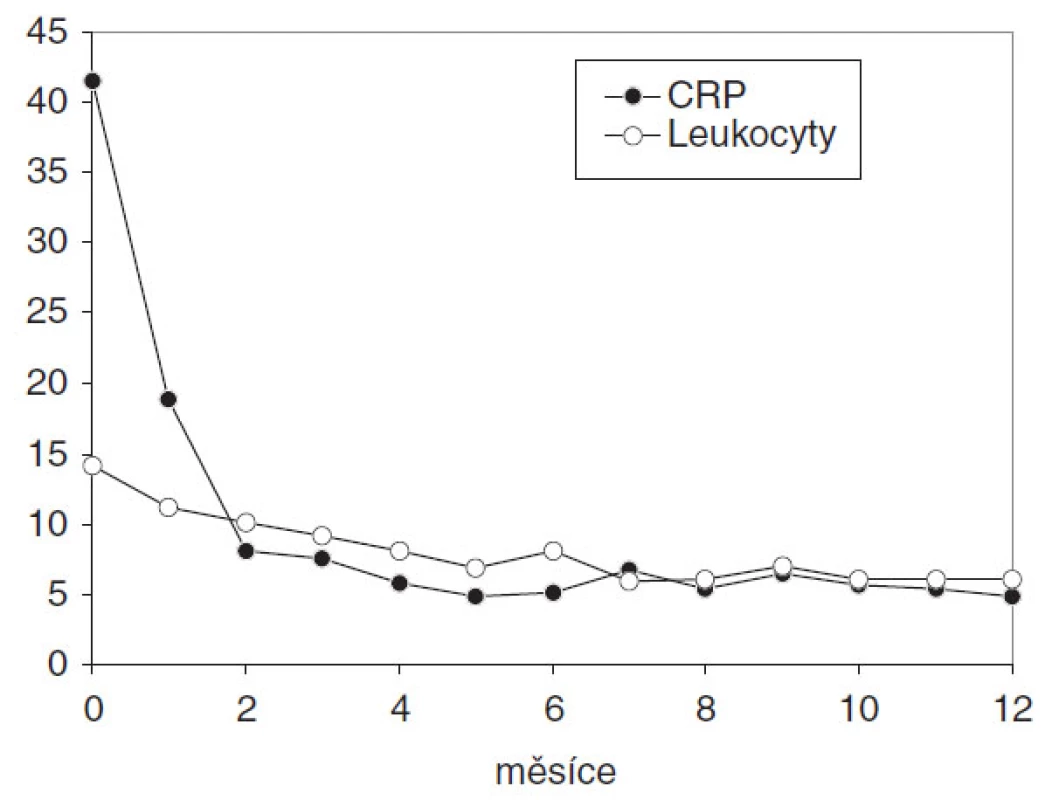
Léčba byla velmi dobře tolerována všemi probandy. Nežádoucí účinky jsme zaznamenali pouze u jednoho pacienta. Onemocněl ve 3. měsíci terapie tonzilitidou a stěžoval si na únavu a subfebrilie. Laboratorní testy prokázaly reaktivaci infekce virem Epstein-Barrové. Příznaky byly mírné povahy a zmizely po šesti týdnech, a proto jsme léčbu adalimumabem nepřerušili.
DISKUSE
Těžká forma hidradenitis suppurativa je značně omezujícím onemocněním, které významně snižuje kvalitu života pacientů a vyžaduje časté hospitalizace nebo pracovní neschopnost. Přesná patofyziologie onemocnění zůstává neznámá. Všichni pacienti v našem sledování byli kuřáci nebo kouřili v minulosti. Cigaretový kouř pravděpodobně obsahuje komedogenní látky, jako je dehet nebo dioxiny [9, 14]. Z toho důvodu je nezbytnou součástí úspěšné léčby i poučení o nutnosti přestat kouřit. Čtyři z našich pacientů byli obézní s body mass indexem (BMI) vyšším než 25 a byla jim doporučena návštěvy obezitologa.
Léčebné výsledky u HS jsou často velmi neuspokojivé a cílená léčba této choroby doposud nebyla jasně definována. Standardní a jedinou kurativní metodou těžké HS III. stadia podle Hurleyho je chirurgická léčba s širokou excizí postižené oblasti ponechané k hojení per secundam nebo kryté transplantátem. Systémová léčba kortikoidy, cyklosporinem A, metotrexátem nebo klindamycinem v kombinaci s rifampicinem se podává v léčebném režimu nebo jako profylaxe před chirurgickým výkonem. Chirurgické řešení není vždy možné vzhledem k rozsahu onemocnění nebo z důvodu odmítnutí pacienta (jak jsme zaznamenali u našich probandů).
V poslední době se objevily publikace popisující úspěch léčby pomocí TNF-α antagonistů u těžké formy HS. TNF-α je důležitým prozánětlivým cytokinem, který se uplatňuje v mnohých zánětlivých onemocněních kůže. Někteří pacienti reagují velmi dobře např. na dlouhodobou léčbu tetracykliny pravděpodobně díky jejich protizánětlivým účinkům [7]. Zajímavá hypotéza uvádí, že příznivý efekt tetracyklinu se děje inhibicí právě TNF-α. TNF-α je produkován intracelulárně jako pro-TNF-α, který je konvertován TNF-α konvertujícím enzymem (TACE) na TNF-α. Jedná se o metaloproteinázu a tato skupina enzymů je inhibována právě doxycyklinem [13]. I v naší skupině jsme zaregistrovali nejlepší efekt terapie adalimumabem u pacientů s významně vyjádřenou zánětlivou složkou v postižených oblastech.
Většina publikací dosud popisovala příznivý efekt infliximabu a etanerceptu na těžkou HS. Zatím existuje jen pět publikací zabývajících se léčbou HS pomocí adalimumabu na menších skupinách pacientů nebo na jednotlivcích [1, 5, 12, 17, 19].
Adalimumab měl ve srovnání s údaji o infliximabu při léčbě HS v našem sledování mírně pomalejší nástup účinku i při snižování laboratorních zánětlivých parametrů, sekrece a bolesti, na druhé straně po léčbě došlo k delšímu období bez relapsu [2, 18]. Účinnost jednotlivých anti-TNF-α preparátů je těžké objektivně posuzovat vzhledem k malým zkušenostem v této oblasti. V jedné publikaci byl infliximab účinný u pacienta s HS, který nereagoval na léčbu etanerceptem [15].
Při léčbě jsme použili dávkování ve standardním režimu jako u psoriázy, iniciálně 80 mg s. c., 40 mg po týdnu a dále v udržovacím režimu 40 mg s. c. každý druhý týden. V poslední době jsme na klinice adalimumabem léčili dva pacienty s těžkou formou HS, kde byl režim 40 mg s. c. nedostačující. Zkrácením intervalu na 40 mg každý týden jsme výrazně urychlili hojení projevů a snížili sekreci. Stejný efekt zaznamenal ve své publikaci Harde et al. [5]. Biologická léčba adalimumabem měla navíc pozitivní vliv na tlumení séronegativní artritidy, která se u našich pacientů s těžkou HS vyskytovala.
Stejně jako u ostatních biologických preparátů s anti-TNF-α účinkem je nutno brát v úvahu i potenciální nežádoucí účinky a rizika spojená s touto terapií. Bezpečnostní profil adalimumabu je z klinických studií znám u diagnóz, jako je revmatoidní artritida, ankylozující spondylitida, Crohnova choroba, těžká a středně těžká psoriáza a psoriatická artritida. Existuje riziko vzniku autoimunních onemocnění, těžkých infekcí, reaktivace tuberkulózy a infekce virem Epstein-Barrové. Neměli bychom zapomínat i na potenciální riziko vzniku demyelinizujících poruch nebo lymfomu [10]. Pacienti pro tuto léčbu by proto měli být vybíráni velmi pečlivě a pravidelně monitorováni. V neposlední řadě je nutno zvážit léčbu i z finančního hlediska, protože biologická terapie je drahá a zdravotní pojištění tuto neregistrovanou indikaci nekryje.
Úspěšná léčba adalimumabem, dokumentovaná na devíti pacientech naší kliniky, otevírá novou možnost konzervativního přístupu pro pacienty s těžkou formou HS. Samozřejmě k jejímu standardnímu zavedení a registraci v této indikační skupině je potřeba efekt tohoto terapeutického přístupu ověřit ještě ve větších, placebem kontrolovaných klinických studiích.
Do redakce došlo dne 22. 12. 2010.
Kontaktní adresa:
MUDr. M. Arenbergerová, PhD.
Dermatovenerologická klinika FNKV a 3. LFUK
Šrobárova 50
100 34 Praha 10
e-mail: ma@avemedica.cz
Zdroje
1. BLANCO, R., MARTINEZ-TABOADA, V. M., VILLA, I., GONZÁLEZ-VELA, M. C., FERNÁNDEZ-LLACA, H., AGUDO, M., GONZÁLEZ-LÓPEZ, M. A. Long-term successful adalimumab therapy in severe hidradenitis suppurativa. Arch. Dermatol., 2009, 145, 5, p. 580–584.
2. BRUNASSO, A. M., DELFINO, C., MASSONE, C. Hidradenitis suppurativa: are tumour necrosis factor-alpha blockers the ultimate alternative? Br. J. Dermatol., 2008, 159, p. 761–763.
3. CUSACK, C., BUCKLEY, C. Etanercept: effective in the management of hidradenitis suppurativa. Br. J. Dermatol., 2006, 154, p. 726–729.
4. GIAMARELLOS-BOURBOULIS, EJ., PELEKANOU, E., ANTONOPOULOU, A. et al. An open-label phase II study of the safety of etanercept for the therapy of hidradenitis suppurativa. Br. J. Dermatol., 2008, 158, p. 567–572.
5. HARDE, V., MROWIETZ, U. Treatment of severe recalcitrant hidradenitis suppurativa with adalimumab. J. DDG., 2009, 7, p. 139–141.
6. JANSEN, T., ALTMEYER, P., PLEWIG, G. Acne inversa (alias hidradenitis suppurtiva). J. Eur. Acad. Dermatol. Venereol., 2001, 15, p. 532–540.
7. JEMEC, G. B. E., WENDELBOE, P. A randomized trial of topical clindamycin vs. systemic tetracycline in hidradenitis suppurativa. J. Am. Acad. Dermatol., 1998, 39, p. 971–974.
8. KAGAN, R. J., YAKUBOFF, K. P., WARDEN, G. D. Surgical treatment of hidradenitis suppurativa: a 10-year experience. Surgery, 2005, 138, p. 734–740.
9. KASAI, A., HIRAMATSU, N., HAYAKAWA, K. et al. High levels of dioxin-likepotential in cigarette smoke evidenced by in vitro and in vivo biosensing. Cancer Res., 2006, 66, p. 7143–7150.
10. LOZERON, P., DENIER, C., LACROIX, C., ADAMS, D. Long-term course of demyelinating neuropathies occurring during tumor necrosis factor-alpha-blocker therapy. Arch. Neurol., 2009, 66, p. 490–497.
11. MEKKES, J. R., BOS, J. D. Long-term efficacy of a single course of infliximab in hidradenitis suppurativa. Br. J. Dermatol., 2008, 158, p. 370–374.
12. MOUL, D. K., KORMAN, N. J. Severe hidradenitis suppurativa treated with adalimumab. Arch. Dermatol., 2006, 142, p. 1110–1112.
13. DE PAIVA, C. S., CORRALES, R. M., VILLARREAL, A. L. et al. Corticosteroid and doxycycline suppress MMP-9 and inflammatory cytokine expression, MAPK activation in the corneal epithelium in experimental dry eye. Exp. Eye Res., 2006, 83, p. 526–535.
14. PANTELEYEV, A. A., BICKERS, D. R. Dioxin-induced chloracne-reconstructing the cellular and molecular mechanisms of a classic environmental disease. Exp. Dermatol., 2006, 15, p. 705–730.
15. POULIN, Y. Successful treatment of hidradenitis suppurativa with infliximab in a patient who failed to respond to etanercept. J. Cutan. Med. Surg., 2009, 13, p. 221–225.
16. REVUZ, J. Hidradenitis suppurativa. J. Eur. Acad. Dermatol. Venereol., 2009, 23, p. 985–998.
17. SCHEINFELD, N. Treatment of coincident seronegative arthritis and hidradenitis suppurativa with adalimumab. J. Am. Acad. Dermatol., 2006, 55, p. 163–164.
18. THIELEN, A. M., BARDE, C., SAURAT, J. H. Long-term infliximab for severe hidradenitis suppurativa. Br. J. Dermatol., 2006, 154, p. 1074–1108.
19. YAMAUCHI, P. A., MAU, N. Hidradenitis suppurativa managed with adalimumab. J. Drugs Dermatol., 2009, 8, p. 181–183.
Štítky
Dermatológia Detská dermatológia
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2011 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- DOŠKOLOVÁNÍ LÉKAŘŮ – KONTROLNÍ TEST
- Kožní změny po transplantaci ledvin – první výsledky klinického sledování
- Úspěšná léčba těžké formy hidradenitis suppurativa pomocí adalimumabu
- Vznik autoimunitní hepatitidy v průběhu léčby psoriázy infiximabem – popis případu
- Klinický prípad: Tuhý belavý uzol v skrotálnej koži
- Evropa a my
- Diagnosticky cenné cévy
- Klinicko-patologické aspekty tzv. pendulujúceho mäkkého fibrómu
- Aktuální informace a zpráva z venerologické sekce ČDS a Národní referenční laboratoře pro syfilis
- Zápis ze schůze výboru ČDS konané dne 9. září 2010
- Hidradenitis suppurativa
- Zápis ze schůze výboru ČDS konané dne 21. října 2010
- Zápis ze schůze výboru ČDS konané dne 2. prosince 2010
- Zápis ze schůze výboru ČDS konané dne 13. ledna 2011
- Zápisnica zo zasadnutia výboru Slovenskej dermatovenerologickej spoločnosti dňa 10. 12. 2010
- K významnému životnímu jubileu prof. MUDr. Věry Semrádové, CSc.
- Sedmdesátiny profesora MUDr. Vladimíra Resla, CSc.
- Odborné akce v roce 2011
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Úspěšná léčba těžké formy hidradenitis suppurativa pomocí adalimumabu
- Hidradenitis suppurativa
- Klinicko-patologické aspekty tzv. pendulujúceho mäkkého fibrómu
- Vznik autoimunitní hepatitidy v průběhu léčby psoriázy infiximabem – popis případu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




