-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Česká doporučení k biologické léčbě závažné chronické ložiskové psoriázy*
Czech Recommendations for Biological Therapy of Severe Plaque Psoriasis (Approved by the Committee of the Czech Society of Dermatology and Venereology)
Psoriasis is a chronic inflammatory systemic disease involving 2–3 % of caucasian population. Severe psoriasis considerably restricts the quality of life, it is associated with other systemic inflammatory diseases and may decrease the life expectancy. Patients need the long-time effective, nevertheless safe, treatment. Recently, our therapeutic possibilities have expanded due to introduction of a new biological therapy affecting main cytokines involved in the pathogenesis of psoriasis. To achieve individual optimal treatment the choice of biologic therapy in particular patient should be based on the clinical picture and type of psoriasis, on the previous therapy and disease course as well as on the presence of the accompanying diseases. Presented Czech guidelines follow the available up-to-date international guidelines for psoriasis treatment created by the renowned dermatology committees, namely the latest Anglo-american and German guidelines for biological treatment of psoriasis and the quidelines of rheumatologic societies. The quidelines had been subjected to expert consultation procedures and were approved by the committee of the Czech Society of Dermatology and Venereology of the Czech Medical Association of J. E. Purkyně.
Key words:
biological therapy – psoriasis – treatment recommendations – adalimumab – etanercept – infliximab - ustekinumab
Autoři: P. Cetkovská 1; M. Kojanová 2
Působiště autorů: Dermatovenerologická klinika LF UK a FN Plzeň, přednosta prof. MUDr. Karel Pizinger, CSc. 1; Dermatovenerologická klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. Jiří Štork, CSc. 2
Vyšlo v časopise: Čes-slov Derm, 87, 2012, No. 1, p. 1-22
Kategorie: Doporučené postupy
Souhrn
Psoriáza je chronické zánětlivé systémové onemocnění, které postihuje 2–3 % populace. Závažná psoriáza výrazně omezuje kvalitu života nemocného, bývá doprovázena dalšími systémovými zánětlivými nemocemi a může podstatně zkrátit průměrnou délku života. Nemocní potřebují dlouhodobou účinnou a přitom bezpečnou léčbu. V posledních letech se rozšířily naše terapeutické možnosti zavedením nové biologické léčby, která je zacílena na hlavní cytokiny účastnící se při vzniku psoriázy. Při výběru biologické terapie u konkrétního pacienta je třeba vycházet nejen ze závažnosti klinického obrazu a formy psoriázy, ze zkušeností s předchozí léčbou a průběhem, ale přihlédnout také k přítomnosti dalších souběžných nemocí, aby mohla být zvolena optimální individualizovaná léčba. Předložená česká doporučení vycházejí z dostupných současných mezinárodních postupů pro léčbu psoriázy vytvořených pracovními skupinami sestávajícími z renomovaných dermatologů, a to zejména z posledních angloamerických a německých doporučení k biologické léčbě psoriázy a z doporučení revmatologických společností. Doporučení prošla připomínkovacím odborným řízením a schválením výborem České dermatovenerologické společnosti České lékařské společnosti Jana Evangelisty Purkyně (ČDS ČLS JEP).
Klíčová slova:
biologická léčba – psoriáza – doporučení k léčbě – adalimumab – etanercept – infliximab – ustekinumab*Schváleno výborem České dermatovenerologické společnosti ČLS JEP.
1. ÚVOD
Biologická léčba je moderní převratnou léčebnou metodou řady zánětlivých a onkologických nemocí. V roce 2002, respektive 2004, byla poprvé použita biologická léčba u nemocných s psoriatickou artritidou a posléze psoriázou. Od té doby bylo publikováno nesmírné množství dat o této nové cílené terapii, vycházejících z výsledků mezinárodních randomizovaných klinických studií, národních registrů, postmarketingových hlášení, klinických hodnocení a jednotlivých popisů případů. V posledních letech byly také vydány různé národní a mezinárodní doporučené postupy pro biologickou léčbu psoriázy, některé z nich pak byly revidovány a doplněny, např. v roce 2011 postupy německé a americké [62, 65].V České republice byly publikovány konsenzuální doporučené postupy České dermatologické společnosti (ČDS) k léčbě psoriázy biologiky v roce 2006 [4]. Doporučení se obecně shodují v tom, že biologická léčba je vzhledem k její nákladnosti vhodná pouze pro závažná onemocnění, u kterých selhala standardní systémová terapie.
Následující česká doporučení vycházejí z dostupných současných mezinárodních postupů pro léčbu psoriázy vytvořených pracovními skupinami sestávajícími z renomovaných dermatologů, a to zejména z posledních angloamerickýcha německých doporučení k biologické léčbě psoriázy [61, 62, 65, 70, 71, 75, 82] a z doporučení revmatologických společností [21, 87], navíc jsou doplněna o poslední data týkajících se jednotlivých léků, které jsou v současnosti schváleny k léčbě psoriázy v České republice. Doporučení prošla připomínkovacím odborným řízením a schválením výborem ČDS ČLS JEP.
Práce nenahrazuje příbalové dokumentace jednotlivých léků a nemůže být považována za komplexní návod zajišťující úspěšnou léčbu v jednotlivých situacích. Vědecké informace týkající se biologické léčby neustále přibývají, proto je naším cílem zajistit recentní doporučení v době publikace a čtenáři jsou laskavě žádáni o sledování nových vědeckých poznatků a z toho vyplývajících upřesnění pokynů.
2. UVEDENÍ DO PROBLEMATIKY LÉČENÍ ZÁVAŽNÉ PSORIÁZY
V posledních letech došlo současně s rozvojem moderní terapie k významnému pokroku v porozumění patogenezi psoriázy. Psoriáza je považována za chronické systémové zánětlivé onemocnění s účastí Th1 a Th17 buněk a vysokou expresí prozánětlivých cytokinů, jako je faktor nekrotizující tumory alfa (TNF-α), interferon gama (IFN-γ), interleukiny (IL)-12, IL-17, IL-23, a jejich receptorů.
Ložisková psoriáza postihuje 2–3 % populace [66], přitom až 80 % nemocných má pouze mírné až středně těžké postižení [62]. Mírné formy onemocnění lze léčit pouze lokálními přípravky, jako jsou kortikosteroidy, deriváty vitaminu D3, retinoidy, popř. inhibitory kalcineurinu, buď v monoterapii, nebo v kombinaci, zatímco středně těžké a těžké formy, které postihují asi 20 % nemocných, vyžadují fototerapii či léčbu systémovou (tabulka 1). Závažná psoriáza výrazně omezuje kvalitu života nemocného, bývá doprovázena dalšími systémovými zánětlivými nemocemi a může podstatně zkrátit průměrnou délku života (o 3,5 u mužů a 4,4 roku u žen) v porovnání s osobami bez psoriázy [70]. Nemocní mají až ve 42 % postižené klouby psoriatickou artritidou (PsA), což dále přispívá ke zhoršení kvality života a často vede k invalidizaci [62]. Pacienti se závažnou psoriázou mají také zvýšené riziko kardiovaskulárních onemocnění a následně i hrozícího úmrtí na tato onemocnění. Závažná psoriáza sama o sobě představuje nezávislý rizikový faktor podobně jako kouření, hyperlipidémie a hypertenze [60]. Navíc se ví, že psoriatici trpí více dalšími nemocemi, které predisponují ke kardiovaskulárním komplikacím, jako je obezita, diabetes mellitus, hyperlipidémie a hypertenze. Častější je i současný výskyt zánětlivých střevních onemocnění (o 3,8–7,5 % vyšší než v běžné populaci) a depresivních stavů [26, 61, 65]. Zhoršení kvality života je srovnatelné s mnohými chronickými nemocemi, jako jsou malignity, artritida, hypertenze, onemocnění srdce, diabetes, deprese [61]. Nemocní proto potřebují dlouhodobou, účinnou a přitom bezpečnou léčbu.
Tab. 1. Terapie chronické ložiskové psoriázy 
(upraveno podle [65]) 3. BIOLOGIKA, MECHANISMUS ÚČINKU, DÁVKOVÁNÍ, ÚČINNOST
V současné době jsou k biologické léčbě chronické ložiskové psoriázy schváleny čtyři preparáty, které ovlivňují cytokiny účastnící se v patogenezi psoriázy.
Jde o tři léky působící proti tumor nekrotizujícímu faktoru α (TNF), což je prozánětlivý cytokin tvořený mnoha buňkami včetně keratinocytů. Hraje hlavní roli v patogenezi psoriázy, PsA a řady jiných nemocí. TNF je uvolňován z buněk jako solubilní cytokin (sTNF) po odštěpení ze svého prekurzoru vázaného na povrch buňky (transmembránový TNF). Oba TNF jsou biologicky aktivní a váží se na dva odlišné receptory: TNF receptor 1 (TNFR1, p55) a TNF receptor 2 (TNFR2, p75).
Vzhledem k více než 10 letům klinických zkušeností a více než dvěma milionům pacientů léčených anti-TNF-α terapií (anti - -TNF) se za základ biologické léčby považovaly anti-TNF přípravky, které vedou k signifikantnímu zlepšení a udržení klinického efektu u většiny pacientů [9, 62]. Jde o dvě skupiny: anti - -TNF-α monoklonální protilátky (adalimumab a infliximab) a solubilní TNF receptory (etanercept). Specificky váží jak solubilní, tak transmembránové formy TNF-α a tím blokují biologický účinek TNF-α [86]. Existují mezi nimi významné rozdíly ve farmakokinetice, imunogenicitě a mechanismech účinku, které jsou pravděpodobně zodpovědné za pozorované rozdíly v profilech účinnosti a nežádoucích účinků, např. etanercept váže i lymfotoxin-α (TNF-β), neváže mono - a dimerickou formu solubilního TNF, neaktivuje komplement a má velice krátký biologický poločas [75].
Novější ustekinumab působí na cytokiny IL-12 a 23, které sdílejí společnou proteinovou podjednotku p40 a jsou secernovány aktivovanými dendritickými buňkami. IL-12 aktivuje Th1 buňky a jejich produkci TNF-α, INF-γ a IL-2, zatímco IL-23 má hlavní roli ve vývoji Th17 buněk, které tvoří IL-17, IL-22 a TNF-α [82].Vzhledem k tomu, že zkušenosti s použitím ustekinumabu jsou nejkratší, byl tento lék dříve používán až v případech, kdy došlo k selhání anti-TNF terapie, podle posledních doporučení se již stává také lékem první linie [62, 65].
Podle nástupu účinku se rozlišují biologika rychleji působící (adalimumab, infliximab a ustekinumab) a pomaleji působící (etanercept) (tabulka 2 a, b).
Tabulka 2a. Biologická léčba psoriázy: dávkování 
Tabulka 2b. Biologická léčba psoriázy: dávkování a účinnost 
Vysvětlivky: účinnost citována podle: *82, **65, ***61, ****27–30 (podle jednotlivých preparátů), *****69; 1dávkování v uvedených mg v 0., 4. týdnu a poté každých 12 týdnů Adalimumab je plně humánní monoklonální protilátka vázající se s vysokou afinitou na solubilní i transmembránový TNF-α. Podává se v dávce 80 mg podkožně na začátku terapie, 40 mg za týden, poté každý druhý týden. Nástup účinku je rychlý a zlepšení je patrné za dva týdny od začátku léčby. Lék si většinou aplikuje sám pacient. Léčebná odpověď onemocnění se hodnotí za 3–4 měsíce. Během počáteční fáze patří adalimumab k vysoce účinným lékům pro terapii psoriázy a je vhodný pro dlouhodobé podávání [65]. Je-li to nutné, může být léčba ukončena bez rizika rebound fenoménu, ačkoli při opakovaném zahájení terapie se nemusí dosáhnout stejné úrovně léčebné odpovědi [61, 82].
Etanercept je plně humánní solubilní fúzní protein skládající se z dimeru extracelulárních částí TNF receptoru 2 (p75) fúzovaného s Fc doménou lidského IgG1, který váže s vysokou afinitou TNF-α, a tím blokuje následnou zánětlivou kaskádu. Terapie etanerceptem se doporučuje zahajovat v dávce 50 mg 2krát týdně vzhledem k rychlejšímu nástupu účinku, popř. se léčba zahajuje v dávce 25 mg 2krát týdně nebo 50 mg 1krát týdně. Pacienti se zavedenou léčbou etanerceptem v dávce 25 mg dvakrát týdně mohou přejít na dávkování 50 mg jednou týdně, jelikož oba tyto dávkovací režimy jsou vzhledem k účinnosti ekvivalentní [71]. Lék si aplikuje sám pacient podkožně a k podávání lze také využít poloautomatického pera. Léčebná odpověď onemocnění se hodnotí za 3 měsíce, ke vzestupu účinnosti však může docházet i poté. Etanercept je možno použít i pro intermitentní léčbu bez rizika rebound fenoménu, ale kontinuální léčba je vhodnější pro lepší kontrolu nad onemocněním, při opakovaném zahájení terapie může být efekt nižší [82].
Etanercept je jako jediný z biologik také doporučen k léčbě těžké psoriázy u dětí ve věku od 6 let, když jsou splněna stanovená kritéria závažnosti onemocnění, a léčba se podává v dávce 0,8 mg/kg (maximálně 50 mg) jednou týdně podle schválení EMEA (European Medicines Agency) a SÚKL (Státního ústavu pro kontrolu léčiv) [27, 61, 69, 82].
Infliximab je chimérická (humánní-myší) monoklonální protilátka, která se váže s vysokou afinitou specificky na solubilní a transmembránový TNF-α. Podává se intravenózně v dávce 5 mg/kg v centru ve zdravotnickém zařízení. Lék se aplikuje ve dvouhodinové infuzi v 0., 2. a 6. týdnu, při dostatečné léčebné odpovědi se podávají následné infuze (5 mg/kg) v osmitýdenních intervalech. Zlepšení lze pozorovat za 1–2 týdny po zahájení léčby a odpověď na léčbu se hodnotí po 3 měsících. Infliximab patří k vysoce účinným lékům pro zahajovací fázi léčby psoriázy, a jeho použití je proto vhodné i u velmi závažné psoriázy (podle doporučení NICE – angl. National Institute for Health and Clinical Excellence, u pacientů s PASI ≥ 20 a DLQI ≥ 18). Lék je určen pro dlouhodobé podávání, u některých pacientů však může posléze dojít ke snížení účinnosti. Léčba by se neměla přerušovat vzhledem ke zvýšenému riziku infuzních reakcí [65, 82].
Ustekinumab je zatím posledním schváleným preparátem pro léčbu chronické ložiskové psoriázy. Jedná se o plně humánní monoklonální protilátku IgG1κ, která působí jako inhibitor IL-12 a 23, který se váže s vysokou afinitou a specificitou na proteinovou podjednotku p40 [49]. Je absorbována a eliminována pomalu s průměrným poločasem 15–45 dní, což umožňuje podávání v delších intervalech. Ustekinumab se aplikuje pacientům s hmotností do 100 kg v dávce 45 mg subkutánně v 0. a 4. týdnu a dále pak každých 12 týdnů a pacientům s hmotností nad 100 kg v dávce 90 mg (u silnějších nemocných je dávka 45 mg také účinná, ale dávka 90 mg je účinnější). Lék se aplikuje v centru. Nástup účinku je rychlý a zřejmý již během dvou týdnů po zahájení léčby, léčebná odpověď onemocnění se hodnotí za 3–4 měsíce, maximální léčebná odpověď bývá patrna mezi 20.–24. týdnem léčby. Po vysazení nedochází k rebound fenoménu a podobná odpověď na léčbu byla dosažena i při opakované terapii [82].
4. INDIKACE BIOLOGICKÉ LÉČBY
Současné čtyři biologické přípravky jsou doporučeny k léčbě pacientů se středně těžkou až těžkou ložiskovou psoriázou, která splňuje kritéria závažnosti onemocnění. Anti-TNF přípravky jsou schváleny také k léčbě PsA, protože mohou – kromě úlevy od bolesti, zmírnění symptomů a zlepšení kvality života – zabránit progresi poškození kloubů [62]. Jednotlivé anti-TNF preparáty vykazují podobnou účinnost na PsA [62, 84]. Při současném výskytu střevních zánětů, popř. uveitidy, jsou účinné monoklonální protilátky na rozdíl od etanerceptu [3, 84].
Podle současných znalostí nelze terapii anti-TNF preparáty doporučit u palmoplantární pustulózy, kdežto u pacientů s těžkou, invalidizující akropustulózou (acrodermatitis continua suppurativa), u kterých selhala standardní systémová terapie, mohou mít antagonisté TNF, popř. ustekinumab, dobrý účinek. U palmoplantární nepustulózní psoriázy může mít anti-TNF léčba také efekt [7]. Dále může být anti-TNF léčba účinná i u pacientů s generalizovanou pustulózní psoriázou a u pacientů s psoriatickou erytrodermií [70, 80, 82], kdy se jako nejvhodnější jeví infliximab vzhledem k jeho nejrychleji nastupujícímu a výraznému efektu [62, 70]. Klinické studie ukazují, že anti-TNF terapie je také účinná při léčení nehtové psoriázy [70, 82].
5. HODNOCENÍ ZÁVAŽNOSTI PSORIÁZY
Definování středně těžké a těžké psoriázy není jednoduché. Obecně lze označit psoriázu za závažnou, jestliže není možné dosáhnout přiměřené kontroly nad nemocí pouze lokální léčbou [70].
Hodnocení závažnosti onemocnění pro účely doporučení biologické léčby by mělo zahrnovat objektivní hodnocení závažnosti kožních změn, ale také zohledňovat individuální parametry (vliv nemoci na kvalitu života nemocného, přítomnost přidružených onemocnění (tzv. komorbidit), údaje o předchozím průběhu nemoci, účinku léčby aj.).
Nejrozšířenějším a obecně uznávaným objektivním hodnocením závažnosti kožních změn je PASI skóre (Psoriasis Area and Severity Index; jeho hodnota se může pohybovat v rozmezí 0 až 72). PASI větší než 10 obvykle znamená závažné onemocnění, které vyžaduje hospitalizaci nebo použití systémové terapie. Kde nelze použít PASI (např. u pustulózní psoriázy), používá se hodnocení BSA (Body Surface Area, hodnota 0–100 %, kdy 1 % znamená postižení v rozsahu jedné pacientovy ruky) a závažné onemocnění je definováno hodnotou přesahující 10 %. Ale i při menším rozsahu postižení (např. při postižení rukou, nohou, obličeje, kštice, genitálu) je možné nemoc považovat za závažnou, neboť může způsobit značné snížení kvality života takto postiženého pacienta [62, 64]. K hodnocení subjektivního vnímání kvality života se používá dotazník kvality života DLQI (Dermatology Life Quality Index, rozmezí 0–30), kdy pro závažné ovlivnění kvality života svědčí hodnota DLQI vyšší než 10.
6. KRITÉRIA K PODÁNÍ BIOLOGICKÉ LÉČBY
Kritériem pro podání biologik je přítomnost závažné ložiskové psoriázy (tj. středně těžké až těžké psoriázy), která je definována PASI > 10 (nebo BSA > 10 %, kde PASI nelze použít) a DLQI > 10. Výjimečně lze zvážit léčbu u pacientů s postižením způsobujícím značné funkční i psychické potíže, kdy nejsou splněna předcházející kritéria, jako je např. úporná psoriáza na dlaních a ploskách, ve kštici, obličeji a na genitálu. Současně je třeba splnit alespoň jednu z následujících podmínek:
- I. Fototerapiea nebo jiná standardní systémová léčbab je kontraindikována nebo nemůže být použita vzhledem k předpokládanému vývoji vážné lékové toxicity.
- II. Standardní systémová léčba není tolerována.
- III. Standardní systémová léčba je neúčinná.
- IV. Souběžná onemocnění předem vylučují možnost použití systémové léčby.
- V. Závažná, nestabilní, život ohrožující psoriáza.
aFototerapie je nevhodná, když:
- Byl dosažen bezpečnostní limit (150–200 ošetření PUVA, 350 ošetření úzkopásmovým UVB zářením).
- Nemá dostatečný účinek, nebo dochází k rychlému návratu kožních změn.
- V anamnéze je výskyt kožních nádorů nebo opakované spálení sluncem.
- Fototerapie není tolerována, zejména u pacientů s fototypem I.
- Fototerapie není dostupná (z místních či časových důvodů).
bStandardní systémová léčba je definována jako podávání cyklosporinu A v dávce 2,5–5 mg/kg/den nebo metotrexátu v dávce 15–25 mg týdně, popř. k zahájení léčby v dávce 7,5–15 mg týdně a k udržovací léčbě v dávce 5–22,5 mg týdně [65], či acitretinu v dávce 25–50 mg/den po dostatečně dlouhou dobu, aby se mohl projevit účinek léčby (většinou jde o 3–4 měsíce).
Trpí-li pacient závažnou psoriázou a současně psoriatickou artritidou, je biologická léčba indikována, jsou-li splněna kritéria revmatologů a dermatologů a současně selhala léčba metotrexátem, nebo jeho podání není možné [62, 64, 65, 71, 62, 82].
7. DEFINICE TERAPEUTICKÝCH CÍLŮ
Léčebným cílem je rychlá terapeutická odezva, dosažení a udržení dlouhodobé remise, zlepšení kvality života a minimum nežádoucích účinků.
Po skončení indukční fáze léčby, tj. za 3–4 měsíce po zahájení léčby, je nutné zhodnotit, zda došlo ke zlepšení stavu nemocného. Adekvátní odpověď na léčbu byla v roce 2009 definována buď jako zlepšení výchozího PASI o 50 % a více (odpověď PASI 50), nebo BSA tam, kde nelze použít PASI, a zlepšení o 5 a více bodů v indexu DLQI nebo jako snížení PASI o 75 % ve srovnání s výchozí hodnotou (odpověď PASI 75) [82].
Podle nového doporučení vycházejícího z konsenzu evropských dermatologů v roce 2010 je stanoveno jako žádoucí cíl léčby dosažení PASI 75. Dojde-li ke zlepšení PASI o méně než 50 %, je nutné léčbu upravit. Zlepší-li se PASI o více než 50 %, ale o méně než o 75 %, záleží na hodnocení kvality života pacienta. Je-li DLQI vyšší než 5, tzn. že dopad na kvalitu života je stále ještě značný, doporučuje se léčbu upravit stejně, jako když nedojde k alespoň 50% zlepšení PASI (schéma). Úpravou léčby se rozumí zvýšení dávky, zkrácení intervalu léčby, přidání lokální či standardní systémové léčby nebo změna biologika [63].
8. KONTRAINDIKACE
Ačkoliv kontraindikace nejsou podle souhrnu informací o léku (SPC – z angl. Summary of Product Characteristics) shodné u všech anti-TNF preparátů, existuje obecná shoda nepodávat tyto přípravky pacientům se srdečním selháním (NYHA III.–IV. stupně), při tuberkulóze (TBC) či jiné vážné infekci a pacientům alergickým na přípravek. Léčba by neměla být zahájena při demyelinizační nemoci, maligních tumorech a lymfoproliferativních chorobách, u vážných jaterních nemocí, u těhotných a kojících žen. Během léčby nesmí být podány živé vakcíny.
Absolutní kontraindikací pro terapii ustekinumabem je TBC či jiná vážná infekce a hypersenzitivita na přípravek. Přípravek by neměl být podán během těhotenství a laktace, při malignitách, lymfoproliferativních nemocech. Kontraindikace očkování živými vakcínami je stejná jako u anti-TNF preparátů (tab. 3) [27 až 30, 65, 75, 82].
Tab. 2. Kontraindikace biologické léčby 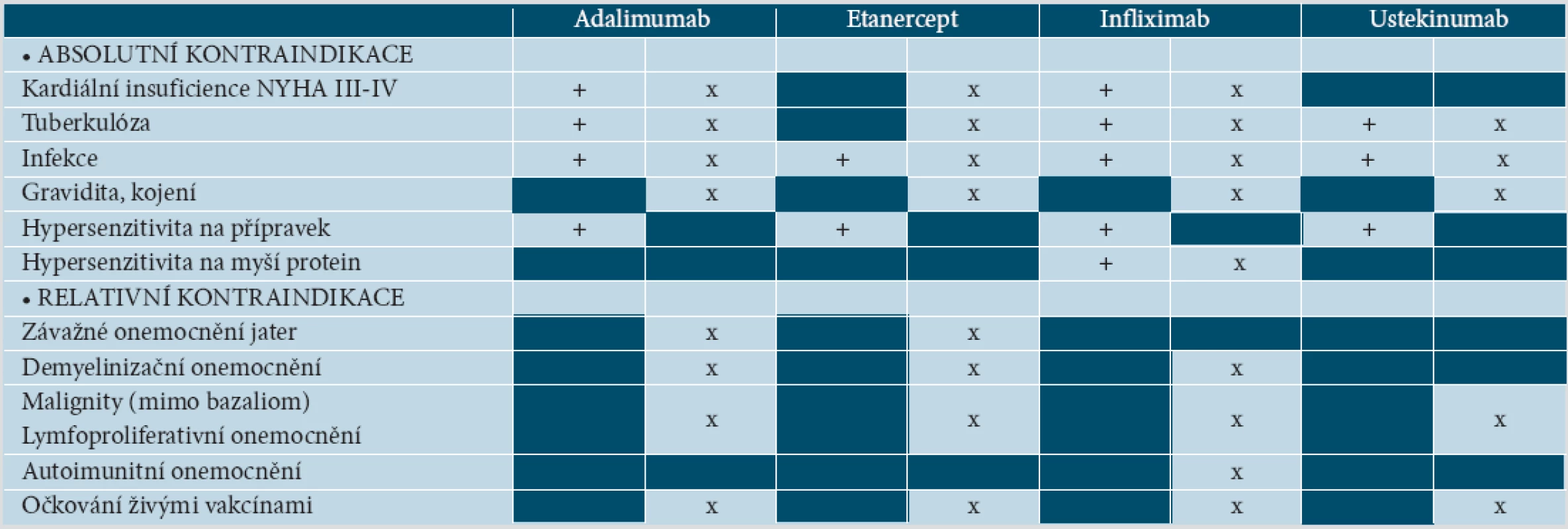
Vysvětlivky: (+) podle SPC EMEA [27–30] a (x) podle [65] 9. DOPORUČENÁ VYŠETŘENÍ
Doporučená vyšetření před zahájením biologické léčby zahrnují pečlivou anamnézu, klinické a laboratorní vyšetření. Při anamnéze je třeba zjistit souběžné nemoci, vyloučit hrozící srdeční selhání, demyelinizační, infekční a maligní onemocnění. Důležité je znát průběh psoriázy, typ, trvání a účinnost předcházející léčby, pátrat po kloubních potížích. Při vyšetření se zhodnotí závažnost kožního postižení jak objektivním hodnocením (PASI, popř. BSA), tak zjištěním vnímání nemoci pacientem (DLQI). Dermatologické vyšetření je důležité pro vyloučení nádorů kůže či jiných kožních změn.
V konkrétních vyšetřeních před léčbou existuje celkem obecná shoda mezi jednotlivými doporučeními. Je nutné laboratorně vyšetřit zejména krevní obraz a jaterní testy, vyloučit aktivní či latentní TBC a graviditu, doporučuje se vyšetřit hepatitidu B a C, HIV a antinukleární protilátky [61, 65, 82].
Co se týče monitorování při léčbě, návrhy kolísají od pravidelně stanovených kontrolních vyšetření v široce daných intervalech až k názorům vyšetření neprovádět [31, 43, 52, 58, 61, 65, 82]. Vždy je však nutné zohlednit konkrétní případ, souběžné nemoci a další, jiné než biologické, medikace. Doporučujeme proto kontrolní vyšetření měsíc po zahájení léčby, 3. měsíc léčby a dále každé 3 měsíce, nevyžaduje-li stav nemocného kontroly v kratších termínech (tab. 4). U pacientů se závažnou psoriázou se vzhledem ke zvýšenému riziku kardiovaskulárních nemocí doporučuje také pravidelně měřit krevní tlak, puls, vyšetřovat krevní lipidy, glukózu a hodnotit index tělesné hmotnosti (BMI, z angl. Body Mass Index) [8].
Tab. 3. Doporučená vyšetření před léčbou a během léčby 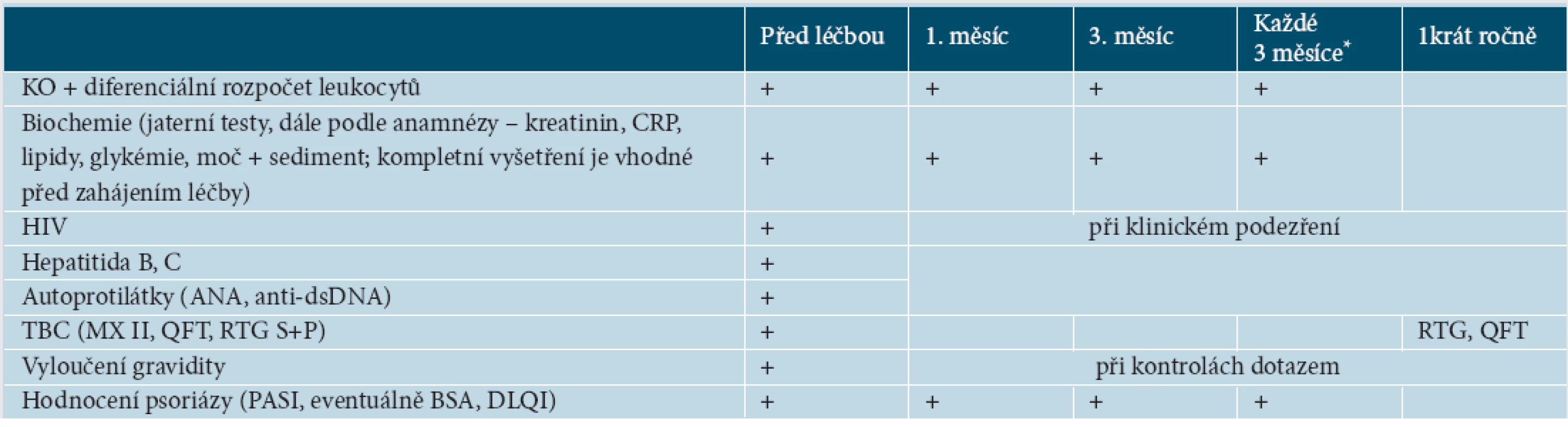
*U infliximabu se kontroly doporučují před každou infuzí, u ustekinumabu před každou aplikací preparátu. Vysvětlivky: KO – krevní obraz, CRP – C reaktivní protein, TBC – tuberkulóza, MX – Mantoux II test, RTG S+P – rentgen srdce a plic, QFT – Quantiferon test, ANA – antinukleární protilátky, anti dsDNA – protilátky proti dvouvláknové DNA Po celou dobu léčení je třeba myslet na možnost vzniku rozličných infekcí a je nutné věnovat pozornost příznakům, jako je zvýšená teplota, únavnost, pokles hmotnosti, noční pocení, kašel, bolest na hrudi, dušnost aj.
10. KOMBINOVANÁ LÉČBA, ZMĚNA BIOLOGIKA, SETRVÁNÍ NA LÉČBĚ, UKONČENÍ A PŘERUŠENÍ LÉČBY
Z dat získaných z registrů se ukazuje, že při dlouhodobé anti--TNF terapii se jako nejčastější důvod pro ukončení léčby jeví nedostatečná terapeutická odezva [36]. V průběhu léčby je možné pozorovat pokles účinnosti anti-TNF léčiv, a tehdy se doporučuje zvážit přidání lokálních či standardních systémových léků.
Probíhají různé studie s kombinovanou léčbou psoriázy s cílem omezit riziko rebound fenoménu při zahájení biologické léčby (při náhlém vysazení standardní terapie), zvýšit účinnost biologické terapie, popř. snížit dávku biologika, a tím omezit náklady na léčbu [26, 38]. Zatím není dostatek důkazů pro jednoznačné doporučení kombinace s jinými standardními léky než s metotrexátem [64, 82]. Zejména infliximab je často podáván s metotrexátem pro zvýšení účinnosti a snížení tvorby protilátek, při psoriáze se popisuje kombinace i v nízkých dávkách (5–10 mg týdně) [65, 75]. Při současné PsA může být kombinace metotrexátu s anti-TNF doporučena kvůli větší účinnosti při prevenci kloubní destrukce [62, 84].
Vhodná je také kombinace s lokální antipsoriatickou terapií [65].
Kombinace anti-TNF s anakinrou či abataceptem se nedoporučuje pro zvýšené riziko vážných infekcí a neutropenie. Souběžné podávání salazopyrinu s etanerceptem se nedoporučuje vzhledem k popisované významné leukopenii [65]. Fototerapie UVB se nyní také nedoporučuje kombinovat s anti-TNF, popř. jen opatrně a krátkodobě, vzhledem k tomu, že anti-TNF preparáty mohou zvyšovat riziko nemelanomových nádorů kůže a navíc pacienti obvykle již byli v minulosti léčeni fototerapií či cyklosporinem [20].
Při změně biologického léku bývá další přípravek obecně účinný a bezpečný a selhání jednoho léku nepředpovídá nižší úroveň následující terapeutické odezvy [15, 68]. Důvody, proč pacient selhává při jedné léčbě a dostatečně odpovídá na jinou, dosud nejsou uspokojivě objasněny. Vysvětlením může být fixní dávkování u některých preparátů bez ohledu na hmotnost pacienta, přítomnost neutralizujících protilátek proti léku či farmakologické rozdíly jednotlivých preparátů a genetická predispozice nemocných [54].
Setrvání na léčbě psoriázy se podle výsledků z 19 studií zdá být nejdelší při léčbě etanerceptem, následované adalimumabem a infliximabem [67], oproti tomu data z dánského registru hodnotící anti-TNF preparáty ukázala nejvyšší setrvání na léčbě u infliximabu [36]. Při porovnání dat v tomto registru o setrvání na léčbě mezi ustekinumabem, adalimumabem a etanerceptem se ukázalo, že nejvíce pacientů zůstává na léčbě ustekinumabem [15].
Biologická terapie by měla být ukončena, pokud nedojde k dostatečné kontrole nad nemocí (primární selhání), či nastane selhání již navozené remise (sekundární selhání) – viz kapitola 7, vznikne vážná nežádoucí reakce, či dojde ke kontraindikaci léčby. Léčba se přerušuje před plánovanou operací, aplikací živé vakcíny, při graviditě pacientky nebo vzniku infekce (viz jednotlivé kapitoly).
11. BIOLOGICKÁ LÉČBA A BEZPEČNOST
Četné informace o anti-TNF léčbě vycházejí ze zkušeností podání preparátů v jiných než kožních indikacích. Adalimumab se podává u revmatoidní artritidy, polyartikulární juvenilní idiopatické artritidy od čtyř let věku, psoriatické artritidy, ankylozující spondylitidy, Crohnovy choroby a psoriázy dospělých. Etanercept se podává u revmatoidní artritidy, polyartikulární juvenilní idiopatické artritidy od dvou let věku, psoriatické artritidy, ankylozující spondylitidy, psoriázy dospělých a dětí od 6 let věku. Infliximab se podává u revmatoidní artritidy, psoriatické artritidy, ankylozující spondylitidy, Crohnovy choroby dospělých a dětí od 6 let věku, ulcerózní kolitidy a psoriázy dospělých. Ustekinumab se podává u psoriázy dospělých.
Následující kapitoly probírají jednotlivé situace týkající se bezpečnosti biologické léčby.V závěru práce (kapitola 17) jsou uvedena příslušná data podle SPC z posledních dostupných údajů EMEA (European Medicines Agency) [27–30] s odkazem u jednotlivých tabulek.
12. BIOLOGICKÁ LÉČBA A RIZIKO INFEKCE
Nemocné s imunitně zprostředkovanými zánětlivými nemocemi léčenými cílenou biologickou léčbou je nutné považovat za imunitně kompromitované pacienty, jimž hrozí zvýšené riziko infekcí [76]. V nedávné metaanalýze vycházející z randomizovaných klinických studií anti-TNF léčby pacientů s psoriázou a PsA se nezjistilo zvýšené riziko vážných infekcí, malignit či povšechných infekcí [24]. Nicméně, data z metaanalýz a jednotlivých registrů u pacientů léčených pro revmatoidní artritidu ukazují zhruba dvojnásobné riziko vážných infekcí, zejména v počátku léčby [21]. Dosud nejsou zcela známa všechna rizika a bezpečnostní data při dlouhodobé biologické léčbě, proto je nutné sledovat všechny nežádoucí účinky léčby nejlépe z údajů získaných v národních registrech.
Biologická léčba nemá být zahájena při přítomnosti vážné aktivní infekce a u již léčených pacientů musí být terapie přerušena do doby vyléčení infekce. Opatrnost a zvážení rizika podání biologické léčby je potřeba zhodnotit např. u pacientů s chronickými infikovanými bércovými vředy, přetrvávajícími nebo recidivujícími hrudními záněty, u septické artritidy či infikované endoprotézy, u osob s permanentním močovým katétrem, bronchiektáziemi a hypogamaglobulinémií [21, 82].
12. 1. Běžné infekce
Ve studiích se ukazuje, že běžné infekce jsou při léčbě časté, ale celkově počty nejsou vyšší než při podávání placeba. Přesto je při biologické léčbě nutné myslet na hrozící vznik vážných virových, bakteriálních a mykotických infekcí. Z běžných infekcí jsou u anti-TNF i u ustekinumabu nejčastější infekce horních cest dýchacích, močové infekce, infekce kůže a měkkých tkání, u anti-TNF navíc i časté infekce dolních cest dýchacích. Data z registrů upozorňují na vážné infekce, jako je pneumonie, septická artritida, erysipel, flegmona, pyelonefritida, zejména u starších pacientů [65, 79, 82]. U revmatologických pacientů bylo hlášeno při terapii monoklonálními anti-TNF protilátkami zvýšené riziko infekce herpes zoster, jehož vyšší, ale statisticky nevýznamný výskyt byl popsán i u psoriatiků při léčbě infliximabem a etanerceptem [25]. Jsou popsány případy varicelly s viscerálním postižením, závažné průběhy herpes simplex či diseminované cytomegalovirové infekce [79].
(Výskyt infekcí podle SPC, viz tab. 17.1.)
Tabulka 17.1. Výskyt infekcí podle SPC EMEA [27–30] ![Tabulka 17.1. Výskyt infekcí podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/fd7e0f984ac12c6e6c965ff200b86cb0.png?version=1537790335)
12. 2. Tuberkulóza
TNF hraje klíčovou úlohu v odpovědi hostitele na mykobakteriální infekci. Je důležitý pro tvorbu a udržení integrity granulomu a následně pro zabránění diseminace mykobakterií. Anti-TNF terapie je proto spojena s vyšším rizikem tuberkulózy (TBC), relativní riziko je 1,6–25,1krát vyšší [83]. Strukturální a funkční odlišnosti preparátů mohou vysvětlovat vyšší riziko TBC při léčbě monoklonálními protilátkami (infliximab a adalimumab) ve srovnání se solubilním receptorem (etanercept), nicméně přesný mechanismus, který způsobuje reaktivaci či vznik nové infekce není známý [50]. Většina případů aktivní TBC je způsobena reaktivací latentní TBC infekce (LTBC), infekce je často atypická a ve více než 50 % případů má extrapulmonální lokalizaci [41, 83]. Nejúčinnější způsob, jak zabránit reaktivaci, je diagnostika a léčba latentní infekce [83]. Pozdní stanovení diagnózy, rozvoj diseminovaného onemocnění a jiná imunosupresivní terapie mohou přispívat k vysoké morbiditě a související mortalitě. Nástup klinické infekce se může lišit podle použitého přípravku. Průměrný čas od zahájení terapie do vzniku infekce jsou 3 měsíce u infliximabu, 4–6 měsíců u adalimumabu a 11,5 měsíců u etanerceptu. Z mechanismu působení ustekinumabu vyplývá, že ustekinumab může také usnadňovat reaktivaci tuberkulózy [82].
Je proto nutné pátrat po latentní či aktivní TBC před zahájením jakékoliv biologické léčby, během léčby a ještě 6 měsíců po jejím ukončení.
Před zahájením léčby je důležité odebrat pečlivou, cílenou anamnézu a provést klinické vyšetření. Zvláštní důraz se klade na skupiny nemocných s vysokým rizikem vzniku TBC (imigranti ze zemí s vysokou prevalencí, intravenózní toxikomani, zaměstnanci zařízení s vysokou kumulací rizikových faktorů – věznice, útulky pro bezdomovce atd., personál mykobakteriologických laboratoří, osoby se zdravotními riziky (diabetes mellitus, chronické selhání ledvin, některé hematologické nemoci, dlouhodobá léčba imunosupresivy) [82].
Na rozdíl od jednotného pohledu na nutnost vyšetřování TBC před biologickou léčbou, postup při volbě metody vyšetření není jednotný a byla vydána řada doporučení [50, 61, 65, 75, 82, 83]. Testy k potvrzení LTBC by měly být dostatečně specifické a minimalizovat falešně pozitivní výsledky vzhledem k možným nežádoucím reakcím při zbytečné léčbě LTBC [50].
U všech nemocných se doporučuje RTG hrudníku před zahájením biologické léčby. Tuberkulinový kožní test (Mantoux II test – MX II) je přednostní screeningové vyšetření u pacientů, kteří nejsou očkováni BCG (Bacille Calmette – Guérin) vakcínou a léčeni imunosupresivy. Falešně pozitivní MX II se může vyskytnout u vakcinovaných BCG nebo u kontaktu s netuberkulózními mykobakteriemi zevního prostředí. Falešně negativní MX II se popisuje u imunosuprimovaných osob vlivem léčby nebo přidružených nemocí (HIV, malignity, chronická renální insuficience, některá virová onemocnění). U obou skupin může být problémem hraniční hodnota indurace při testování [50]. Současně i hranice pozitivity je udávána různě v jednotlivých doporučeních a u různých skupin nemocných [50, 65, 82, 83].
Z těchto důvodů jsou u pacientů očkovaných BCG vakcínou a imunosuprimovaných upřednostňovány testy uvolňování interferonu gama (IGRA – interferon gamma release assay) – QuantiFERON TB-Gold (QFT) aT-SPOT TB. Tyto in vitro prováděné testy měří uvolňování interferonu gama po stimulaci specifickými antigeny Mycobacterium tuberculosis. V našich poměrech dostupnější test QuantiFERON TB-Gold je levnější než T-SPOT TB, ale může mít menší citlivost. Výhodou testů je vyšší specificita, zároveň nevykazují zkříženou reaktivitu s BCG a s většinou atypických mykobakterií (kromě M. kansasii, M. szulgai a M. marinum) [72]. IGRA testy se vzhledem k vyšší senzitivitě osvědčily jako vhodné k identifikaci LTBC u vakcinovaných a imunokompromitovaných pacientů, u nichž tuberkulinový kožní test nemusí být spolehlivý. Je však třeba poznamenat, že se mohou vyskytnout falešně pozitivní či neurčité výsledky v IGRA testech [50, 83] a i opakované kožní tuberkulinové testy mohou posílit uvolňování interferonu gama in vitro a vést k falešně pozitivním výsledkům IGRA [82]. Podle posledního doporučení Evropské respirační společnosti však zatím nelze potvrdit použití IGRA jako jediné diagnostické metody k testování LTBC infekce [83].
V současné době není známo, zda jedinci s negativním výsledkem IGRA a anamnézou TBC nebo s nálezem odpovídajícím prodělané TBC nebo s konverzí IGRA mají nižší riziko TBC než ti, kteří mají IGRA test stále pozitivní. Zároveň není dostatek důkazů, zda IGRA testy mají být upřednostňovány před MX II u osob již léčených anti-TNF [83]. Zdá se, že pozitivní výsledek MX II může nadhodnocovat výskyt LTBC, a proto se IGRA někdy doporučuje k ověření pozitivního výsledku MX II u dospělých s nízkým rizikem infekce [50].
V České republice byly Českou pneumologickou a ftizeologickou společností (ČPFS) vydány v roce 2005 doporučené postupy vyšetřování při anti-TNF léčbě [93]. Doporučují kompletní vyšetření před léčbou (RTG plic, MX II a QFT) a v prvním roce podávání biologika opakované vyšetření každé 3 měsíce. Při negativitě provedených vyšetření a nepřítomnosti klinického podezření se kontroly v dalších letech provádí 1krát ročně (tab. 5).
Tab. 4. Doporučený postup při biologické léčbě anti-TNFα* 
*Sekce pro tuberkulózu – Česká pneumologická a ftizeologická společnosti, 2005. Pozn.: Každý nemocný musí být před zahájením biologické léčby vyšetřen pneumologem za účelem vyloučení LTBC infekce, inaktivní nebo aktivní TBC [93]. Vysvětlivky: MX II – tuberkulinový kožní test Mantoux II, negativní = indurace 0–5 mm, pozitivní = 6–15 mm, hyperergní > 15 mm, QFT – Quantiferon-TB Gold, negativní = pod 0,35 IU/ml, pozitivní = nad 0,35 IU/ml, INH – Isoniazid, AT – antituberkulotika Opatření navržená Sekcí pro tuberkulózu ČPFS nejsou vždy v praxi dodržována, často se liší postupy jednotlivých pneumologických pracovišť i poslední publikovaná národní a mezinárodní doporučení. Riziko vzniku TBC v souvislosti s léčbou biologiky nelze podceňovat a preventivní opatření jsou nutná, proto publikovala Česká revmatologická společnost (ČRS) minimální preventivní postupy, které je zapotřebí vždy dodržovat [87]. Upravená doporučení pro vyšetření a monitorování pacientů s biologickou léčbou psoriázy lze shrnout v následujících bodech:
- Před zahájením terapie provést MX II, QFT, RTG hrudníku a odebrat pečlivou anamnézu z hlediska výskytu a kontaktu s TBC. Po roce léčby a dále 1krát ročně opakovat QFT a RTG plic.
- Pneumolog by měl být konzultován před zahájením biologické léčby vždy, s výjimkou kompletně negativních nálezů včetně negativní anamnézy prodělané TBC nebo recentního kontaktu. Kontrolní vyšetření pneumologem se po 1. roce doporučuje tehdy, pokud již byla konzultace potřebná před zahájením terapie nebo v případě jakéhokoliv nálezu odchylného od normy.
- Na možnost TBC je nutné myslet při každé návštěvě nemocného.
- Při zjištění LTBC, t. j. při MX II nad 15 mm či pozitivním QFT (viz tab. 5), indikuje pneumolog chemoprofylaxi isoniazidem (INH) nebo jinými antituberkulotiky. Nejčastěji se podává INH po dobu 6 měsíců v dávce 5 mg/kg, maximálně 300 mg denně, se současným podáním 10 mg pyridoxinu denně pro prevenci neuropatie (při neuritidě se dávka zvyšuje až na 50 mg denně). Terapii vede ftizeolog či po dohodě dermatolog. Během chemoprofylaxe je nutno provádět pravidelné kontroly jaterních testů vzhledem k možné toxicitě: před zahájením léčby, první 3 měsíce po 4 týdnech, později po 6–8 týdnech. Zvýšení hodnot aminotransferáz, které nepřesáhne dvojnásobek normální hodnoty, nemusí být důvodem k přerušení léčby. Léčbu biologikem je možné zahájit s odstupem 1–2 měsíců.
- V případě, že výsledek QFT je neurčitý, doporučuje se toto vyšetření opakovat. Při dalším neurčitém výsledku se rozhoduje o léčbě podle dalších nálezů (anamnéza, MX II, RTG plic).
- Pokud se během biologické léčby změní QFT či tuberkulinový test na pozitivní, je indikován RTG plic, vyšetření pneumologem a při vyloučení aktivní TBC infekce preventivní antituberkulózní terapie. Ve většině případů se biologická léčba na 1–2 měsíce přerušuje.
- Při podezření na TBC je doporučeno vyšetření podobně jako před zahájením biologické léčby a kontrola pneumologem.
- Pokud vznikne aktivní TBC během biologické léčby, doporučuje se terapii ukončit. Po zhojení TBC a skončení léčby antituberkulotiky je možné v indikovaném případě znovu podat biologickou léčbu.
(Výskyt tuberkulózy podle SPC, viz tab. 17.2.)
Tabulka 17.2. Výskyt tuberkulózy podle SPC EMEA [27–30] ![Tabulka 17.2. Výskyt tuberkulózy podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/7f7a8403e210132bc4315660b127a9af.png?version=1537790335)
12. 3. Atypické mykobakteriální infekce
Výskyt netuberkulózních mykobakteriálních infekcí souvisí, podobně jako u TBC, se zvýšenou tendencí ke vzniku granulomatózních infekcí při anti-TNF léčbě. U revmatologických pacientů byla nejčastěji popsaná infekce Mycobacterium avium s vysokým podílem mimoplicních lokalizací. Méně často se objevila infekce Mycobacterium abscessus, chelonae, fortuitum, mucogenicum, szulgai, xenopi a marinum. Výskyt byl popsán u všech anti-TNF preparátů, častěji u monoklonálních protilátek než u solubilního receptoru s častějším výskytem u infliximabu. Obecně jsou tyto infekce považovány za vzácné a není jasné, zda se jedná o reaktivaci či primární infekci. Progrese onemocnění může být rychlá, ale po vysazení biologika obvykle dobře odpovídá na terapii, nicméně bylo popsáno i úmrtí [21, 79, 87].
(Výskyt atypické mykobakteriální infekce podle SPC, viz tab. 17.3.)
Tabulka 17.3. Výskyt atypické mykobakteriální infekce podle SPC EMEA [27–30] ![Tabulka 17.3. Výskyt atypické mykobakteriální infekce podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/63288dfad29edb8e61dd4acf2633dcb9.png?version=1537790335)
12. 4. Oportunní infekce
Americká FDA (Food and Drug Administration) vydala v roce 2008 varování o riziku vzniku histoplazmózy a jiných invazivních mykotických infekcí a v roce 2011 další varování o riziku vzniku legionářské nemoci a vážných listeriových infekcí při anti-TNF léčbě. Riziko oportunních infekcí může být vyšší u pacientů starších 65 let a u pacientů s další imunosupresivní léčbou [33]. Z údajů z francouzského registru, který sleduje léčbu napříč odbornostmi, bylo popsáno 45 případů oportunních infekcí (zahrnovaly i atypické mykobakteriózy a virové i parazitární infekce) s 10–17krát vyšším rozdílem u monoklonálních protilátek než u etanerceptu, s převahou infliximabu. Přibližná incidence např. u listeriózy a nokardiózy byla 10krát vyšší než v běžné populaci, pětina nemocných vyžadovala intenzivní péči a 4 pacienti (9 %) zemřeli. Prediktivním faktorem vzniku oportunní infekce byla kromě známých faktorů, jako je lymfopenie, diabetes i léčba kortikosteroidy s dávkou nad 10 mg/den, jejichž podání se proto u anti-TNF léčby nedoporučuje [79]. Progresivní multifokální leukoencefalopatie a oportunní demyelinizační infekce jsou zmíněny v kapitole 13. 2.
Z invazivních mykotických infekcí se nejčastěji jedná o histoplazmózu, kandidózu, aspergilózu, kokcidiomykózu, blastomykózu či pneumocystózu a pneumonie je nejčastější manifestací infekce. Výskyt mezi jednotlivými anti-TNF preparáty je podobný jako u atypických mykobakterióz [21, 33, 79, 87]. U pacientů léčených biologiky je nutno pátrat po možných příznacích, jako je horečka, malátnost, úbytek hmotnosti, pocení, kašel, dyspnoe a/nebo plicní infiltráty.
Oportunní bakteriální infekce zahrnují listeriózu, salmonelózu, nokardiózu a legionelózu. Výskyt legionářské nemoci (Legionella pneumoniae) byl popsán u všech anti-TNF preparátů a příznaky nemoci zahrnují celkovou nevůli, bolest na hrudi, kašel, vykašlávání krve, horečku, gastrointestinální příznaky, bolesti hlavy, kloubů, svalů, třesavku a dušnost [33, 55].
Listerióza (Listeria monocytogenes) se klasicky projevuje horečkou, zimnicí, cefaleou, nauzeou a vomitem, při anti-TNF léčbě byly popsány případy meningitidy, sepse, septické artritidy, endoftalmitidy, bakterémie. Listérie je možno nalézt v tepelně neupraveném mase, zelenině a v nepasterizovaném mléce či potravinách z něho připravených [21, 33, 82, 87].
Horečka, průjem, křeče v břiše a bolesti hlavy patří mezi příznaky salmonelózy, při anti-TNF léčbě byly popsány septikémie i septické artritidy. Salmonela se může přenést kontaminovanými syrovými vejci, nepasterizovaným mlékem a tepelně neupraveným masem [21, 82, 87].
Pacienti s anti-TNF léčbou by měli být varováni před infekcemi z nedostatečně upravených potravin. Vzhledem k riziku těchto infekcí by pacienti neměli jíst či pít syrové nebo jen částečně uvařené masné či mléčné výrobky, nepasterizované mléko a měli by důkladně omývat zeleninu a ovoce [21, 82].
(Výskyt oportunních infekcí podle SPC, viz tab. 17.4.)
Tabulka 17.4. Výskyt oportunních infekcí podle SPC EMEA [27–30] ![Tabulka 17.4. Výskyt oportunních infekcí podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/bd10709a3a10541d7129b0630678e63b.png?version=1537790335)
12. 5. Hepatitidy
Před zahájením biologické léčby se doporučuje vyšetření na přítomnost viru hepatitidy B i C (HBV, HCV).
U chronické hepatitidy B vedou zvýšené hodnoty TNF-α k potlačení virové replikace [13]. Podáním anti-TNF může dojít ke zvýšené replikaci viru s následnou možnou reaktivací a zhoršením infekce [45, 82]. Před terapií se proto doporučuje vyšetření HBsAg, anti-HBsAg a anti-HBc. U pacientů s pozitivitou jakéhokoliv předcházejícího testu (kromě izolované pozitivity anti-HBsAg u pacientů očkovaných proti hepatitidě B) je pak indikované kompletní sérologické vyšetření, tj. HBeAg, anti - -HBe a HBV-DNA (tab. 6). Podle výsledků vyšetření je možno posoudit riziko progrese onemocnění a další sledování či indikaci k nasazení antivirové terapie při současné léčbě biologiky (tab. 7).
Tab. 5. Typické nálezy jednotlivých stadií vývoje infekce HBV (upraveno podle [44]) ![Typické nálezy jednotlivých stadií vývoje infekce HBV (upraveno podle [44])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1cf509176572a1a666ebe62161099376.png)
Vysvětlivky: 1sérokonverze HBeAg → anti-HBe; 2sérokonverze HBsAg → anti-HBs, HBeAg → anti-HBe HBV = virus hepatitidy B, HBsAg = povrchový antigen, anti-HBs = protilátky proti povrchovému antigenu, HBeAg = e antigen, anti-HBe = protilátky proti e antigenu, anti-HBc- protilátky proti core antigenu Tab. 6. Rozdělení pacientů podle výsledků screeningových vyšetření HBV (upraveno podle [90]) ![Rozdělení pacientů podle výsledků screeningových vyšetření HBV (upraveno podle [90])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c4a98e6daba24cc0ce81f4b0ca355445.png)
Vysvětlivky: – = negativní, + = pozitivní U pacientů HBsAg negativních a anti-HBc pozitivních se zdá být terapie anti-TNF bezpečná [12, 46] při pravidelných kontrolách HBsAg, HBV DNA a jaterních testů k časnému zachycení eventuální reaktivace infekce [70, 87, 90]. Z jednotlivých anti-TNF preparátů se zdá reaktivace infekce více pravděpodobná při podání infliximabu než etanerceptu či adalimumabu [13]. V případě, že se objeví pozitivita HBsAg, doporučuje se vyšetření hepatologem a léčba lamivudinem [12, 87]. V případě vývoje rezistence na lamivudin s reaktivací infekce je možností léčba entakavirem či tenofovirem [45]. U inaktivních nosičů HBsAg je možno zvážit biologickou léčbu po preventivním podání lamivudinu, které se zahajuje 2–4 týdny před anti-TNF terapií a podává ještě 10–12 měsíců po jejím ukončení [70, 87].
Zvýšené uvolňování prozánětlivých cytokinů, zejména TNF-α u chronické hepatitidy C související s virovou replikací a destrukcí hepatocytů, vysvětluje možnost bezpečného použití anti-TNF terapie u chronických nosičů. Během léčby bylo popsáno zlepšení infekce, ke zhoršení došlo jen v ojedinělých případech. Nejčastějším biologikem používaným u chronické hepatitidy C je etanercept, který nevedl k vedlejším reakcím ani při souběžném podání interferonu-α a ribavirinu [11, 23, 84].
Před zahájením biologické léčby se doporučuje vyšetření hepatitidy C. U pacientů s pozitivním anti-HCV je nezbytné doplnit jaterní testy, kvantitativní vyšetření HCV-RNA a vyšetření hepatologem [70, 71, 82]. U pacientů s chronickou HCV infekcí se doporučuje měsíčně kontrola jaterních testů a pravidelně hladina HCV-RNA. Z některých pokynů vyplývá doporučení k provedení jaterní biopsie před léčbou a její opakování při vzestupu jaterních testů a virové nálože [11].
Před zahájením biologické léčby u pacientů s infekční hepatitidou je vždy vhodná konzultace hepatologa.
(Výskyt infekční hepatitidy podle SPC, viz tab. 17.5.)
Tabulka 17.5. Výskyt infekční hepatitidy podle SPC EMEA [27–30] ![Tabulka 17.5. Výskyt infekční hepatitidy podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/1d23b26104b21f303dc493ef05856681.png?version=1537790335)
12. 6. Virus lidské imunodeficience
Pacienti s HIV pozitivitou mají vyšší prevalenci psoriázy. Při dnešních možnostech léčby vysoce aktivní antiretrovirovou terapií (HAART) jde o dlouhodobé onemocnění, proto potřebují tito nemocní také účinnou a přitom bezpečnou terapii psoriázy [84].
Bezpečnost anti-TNF terapie při současné HIV infekci není dostatečně známá [82]. Zvýšená hladina TNF-α u HIV infekce stoupá s progresí onemocnění a je spojena se zvýšením virové nálože, úbytkem CD4+ a zhoršením klinických symptomů infekce. Potlačením tvorby TNF-α byla v in vitro studiích prokázána inhibice replikace HIV. Přesto je v současné době známo jen omezené množství dat s použitím anti-TNF terapie u HIV pozitivních pacientů. Studie naznačují možnost použití anti-TNF terapie, zejména etanerceptu bez zhoršení morbidity i mortality [23, 84], dokonce může dojít ke zlepšení některých klinických symptomů. Terapii je možno zvážit v indikovaných případech, kde nejsou jiné možnosti léčby, u pacientů se stabilizovanou infekcí (CD4+ > 200, virová nálož < 60000 mm3), se současnou HAART a přísnou kontrolou virové nálože a počtu CD4+ [21]. Zároveň je nutná pečlivá kontrola klinického stavu a laboratorních parametrů, se zvláštním zřetelem na přítomnost oportunních infekcí a malignit [23].
13. BIOLOGICKÁ LÉČBA A NEINFEKČNÍ KOMPLIKACE
13. 1. Srdeční selhání a ischemická choroba srdeční
Anti-TNF terapie se nedoporučuje u pacientů se závažným srdečním selháním (NYHA III. a IV. stupně; tab. 8). Při kompenzovaném srdečním selhání (NYHA I. a II. stupně) by měl být před léčbou proveden echokardiogram a při ejekční frakci s hodnotami nižšími než 50 % by se terapie antagonisty TNF neměla podávat [61, 82]. Léčba by měla být ukončena při nástupu nových symptomů nebo zhoršení dříve existujícího srdečního selhání [18].
Tab. 7. Klasifikace NYHA (New York Heart Association) symptomů srdečního selhání [82] ![Klasifikace NYHA (New York Heart Association) symptomů srdečního selhání [82]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/58a1b5e9920922534cc3f9e08c9d94de.png)
V posledních letech se naopak objevují práce, že anti-TNF léčba by mohla povšechným snížením zánětlivé reakce také působit kardioprotektivně a snížit vysoké kardiovaskulární riziko u pacientů se závažnou lupénkou [8]. V rozsáhlém retrospektivním sledování bylo mnoharozměrovou analýzou zjištěno, že pacienti, kteří dostávali anti-TNF léčbu, měli o 48 % nižší riziko vzniku infarktu myokardu oproti pacientům s psoriázou neléčenou biologiky [92].
Předběžná hlášení varovala před vznikem nežádoucích kardiovaskulárních příhod (MACE – Major Adverse Cardiovascular Events) při léčbě anti-IL-12/23 přípravky. V rozsáhlé metaanalýze randomizovaných klinických studií [78] však nebyly pozorovány signifikantní rozdíly v jejich výskytu při léčbě anti - -IL-12/23 ani anti-TNF v porovnání s placebem. Přesto se doporučuje obezřetnost při biologické léčbě nemocných s anamnézou rizikových kardiovaskulárních faktorů.
(Výskyt nežádoucích kardiovaskulárních účinků podle SPC, viz tab. 17.6.)
Tabulka 17.6. Výskyt nežádoucích kardiovaskulárních účinků podle SPC EMEA [27–30] ![Tabulka 17.6. Výskyt nežádoucích kardiovaskulárních účinků podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/11f982f3012cdc1efa2150711b3593d6.png?version=1537791907)
13. 2. Demyelinizační onemocnění
Při terapii antagonisty TNF je vzácně popsán nástup nebo zhoršení centrálních a periferních demyelinizačních onemocnění s prevalencí 0,05–0,2 % [74], proto by anti-TNF terapie neměla být podána u pacientů s roztroušenou sklerózou či jiným demyelinizačním onemocněním a léčba není doporučována, ani pokud má nemocný nejbližší příbuzné s těmito chorobami [61, 82].U pacientů léčených anti-TNF preparáty byly popsány případy demyelinizace centrálního nervového systému (CNS) svědčící pro roztroušenou sklerózu a jiné autoimunitní demyelinizační stavy jako diseminované encefalomyelitidy, akutní diseminované leukoencefalopatie, nebo tato onemocnění připomínající. Vzácná, obvykle fatální progresivní multifokální leukoencefalopatie (PML) je oportunní demyelinizační infekce způsobená rozvojem infekce poliomavirem JC (John Cunningham), který je přítomen u 50–70 % zdravých osob, ale vlivem imunosupresivní léčby může dojít k rozvoji infekce. V roce 2009 několik případů vedlo ke stažení preparátu Raptiva (efalizumab) z trhu. Recentně byly popsány vzácné případy choroby při terapii natalizumabem a rituximabem a obezřetnost je doporučena i u anti-TNF preparátů a ustekinumabu. K diagnostice je doporučena kromě neurologického vyšetření i magnetická rezonance CNS a vyšetření JC viru z likvoru (např. PCR) [19, 47, 77, 85].
Lokalizované demyelinizační stavy zahrnují např. neuritidu optiku, transverzální myelitidu. Periferní demyelinizační poruchy zahrnují chronické zánětlivé demyelinizační polyneuropatie, multifokální motorické neuropatie, Guillaina-Barrého syndrom (akutní zánětlivá demyelinizační neuropatie) a probíhají pod obrazem akutní zánětlivé demyelinizační polyneuropatie (AIDP), Müllerova-Fisherova syndromu, akutní motorické axonální neuropatie (AMAN) či akutní senzomotorické axonální neuropatie (AMSAN) [19, 21, 27–30, 35, 74]. Předpokládané patologické mechanismy zahrnují autoimunitní reakce zprostředkované T-buňkami nebo protilátkami proti myelinovým proteinům, vaskulitidou vyvolané poškození nervů nebo inhibici axonálního vedení. Po vysazení dochází k úplné či částečné regresi příznaků s možnou recidivou při opakovaném podání [74].
Pokud se během léčby vyvinou symptomy naznačující možnost demyelinizace (např. parestezie, poruchy vidění, zmatenost, sfinkterové poruchy, poruchy rovnováhy a chůze, paréza n. facialis), je nutné léčbu přerušit a pacient by měl být vyšetřen neurologem a podle nálezu podrobně vyšetřen (magnetická rezonance mozku a míchy, lumbální punkce) [82]. Rozhodnutí o případném dalším pokračování anti-TNF léčby musí být posuzováno individuálně podle průběhu události, základního onemocnění a ve spolupráci s neurologem [56].
Podle dat ze studií ustekinumab nevede ke zhoršení roztroušené sklerózy [62], přesto je potřeba myslet na možnou souvislost neurologických potíží s terapií ustekinumabem [37].
(Výskyt neurologických nežádoucích účinků podle SPC, viz tab. 17.7.)
Tabulka 17.7. Výskyt neurologických nežádoucích účinků podle SPC EMEA [27–30] ![Tabulka 17.7. Výskyt neurologických nežádoucích účinků podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/9ba42b0b008ac9c31680ad3816c27da6.png?version=1537790335)
13. 3. Maligní onemocnění
Dosud neexistují přesvědčivé důkazy o zvýšeném riziku maligních onemocnění u pacientů s psoriázou při anti-TNF léčbě [82]. Data z revmatologických sledování nejsou jednotná a některé práce ukazují na zvýšené riziko malignit, zejména lymfomů při terapii anti-TNF. Riziko lymfomů je však u těžké revmatoidní artritidy častější než v běžné populaci, podobně i u psoriázy (častěji nehodgkinské lymfomy, poté Hodgkinova nemoc a několik případů kožního T-buněčného lymfomu) [84]. Při léčbě infliximabem a adalimumabem byl vzácně popsán vznik agresivního a obvykle fatálního hepatosplenického T-lymfomu u adolescentů a mladých dospělých s Crohnovou chorobou, kteří však byli současně léčeni kromě anti-TNF i azathioprinem nebo merkaptopurinem. Existují také zprávy o případech časného vzniku lymfomu po zavedení anti-TNF terapie a o regresi lymfomu po jejím vysazení [6, 21, 82].
U revmatologických pacientů se pozoroval vyšší výskyt nemelanomových nádorů kůže a melanomu při léčbě biologiky [21, 70, 91]. Nemocní s psoriázou, kteří byli dříve léčeni fototerapií, mohou mít vyšší výskyt nemelanomových kožních nádorů při anti-TNF léčbě [57, 62].
Varování o možné zvýšené incidenci některých malignit při biologické léčbě je důvodem kontraindikace jejího podání u pacientů s anamnézou současného nebo nedávného nádorového onemocnění. U pacientů s anamnézou lymfomů či invazivního melanomu by biologická léčba neměla být podána. V situacích, kdy byl solidní maligní tumor zjištěn a léčen před více než pěti lety, je možné zvážit biologickou léčbu po domluvě s onkologem. O biologické léčbě lze uvažovat u osob s anamnézou kožních tumorů s vysokou pravděpodobností vyléčení (bazaliom, melanoma in situ) [82, 84]. Všichni pacienti by měli být sledováni s ohledem na možný vznik malignity včetně pravidelných kontrol kožního povrchu. Při vzniku nádorového onemocnění musí být biologická terapie ukončena [21, 82].
(Výskyt malignit podle SPC, viz tab. 17.8.)
Tabulka 17.8. Výskyt malignit podle SPC EMEA [27–30] ![Tabulka 17.8. Výskyt malignit podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/2663717f6a67d0783359d8aa60e20cbc.png?version=1537790335)
Vysvětlivky: 1primárně u adolescentů a mladších dospělých s Crohnovou chorobou a ulcerózní kolitidou 13. 4. Hematologická onemocnění
Ojediněle se při anti-TNF léčbě popisují hematologické nežádoucí reakce, jako je trombocytopenie, anémie, neutropenie, leukopenie až pancytopenie. Nejčastěji je popisovaná mírná neutropenie, která nevede ke klinickým komplikacím a nevyžaduje ukončení biologické léčby. Během léčby je nutné věnovat pozornost možným příznakům těchto onemocnění (bledost, snadná zranitelnost se vznikem modřin, krvácení, horečka) a v případě vážných hematologických chorob, např. vzácné pancytopenie či aplastické anémie (které mohou být fatální) je nutno anti-TNF léčbu ihned ukončit [21, 61, 82].
(Výskyt hematologických nežádoucích účinků podle SPC, viz tab. 17.9.)
Tabulka 17.9. Výskyt hematologických nežádoucích účinků podle SPC EMEA [27–30] ![Tabulka 17.9. Výskyt hematologických nežádoucích účinků podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/ba0cf6ae0715d3feec21bd30086c3d4d.png?version=1537790335)
13. 5. Onemocnění jater
Psoriatici mají vyšší prevalenci jaterních onemocnění, při častém alkoholismu či při současné obezitě a metabolickém syndromu. TNF-α je klíčový faktor v patogenezi nealkoholické steatózy jater (NAFLD – non-alcoholic fatty liver disease), která může vyústit v nealkoholickou steatohepatitidu (NASH – non-alcoholic steatohepatitis) a následnou cirhózu jater. Zdá se proto, že anti-TNF terapie může příznivě ovlivnit jaterní postižení u psoriatiků. Na druhou stranu anti-TNF léčba, zejména monoklonálními protilátkami, může běžně vést ke zvýšení hladin jaterních testů. FDA v roce 2004 vydala varování o možnosti jaterního onemocnění (popsány případy autoimunitní hepatitidy, cholestázy až vzácně akutní selhání jater) při léčbě infliximabem. Na rozdíl od monoklonálních protilátek etanercept jen vzácně zvyšuje jaterní enzymy, a proto se nabízí jako bezpečná alternativa při hepatotoxicitě způsobené anti-TNF protilátkami [1, 14, 61]. U alkoholické hepatitidy se může také předpokládat příznivé ovlivnění anti-TNF terapií, ale dosud chybí dostatečná data o terapeutickém účinku a bezpečnosti biologik u pacientů s psoriázou a alkoholickou hepatitidou, proto je zatím doporučena velká obezřetnost [14].
(Výskyt poruchy jater a žlučových cest podle SPC, viz tab. 17.10.)
Tabulka 17.10. Výskyt poruchy jater a žlučových cest podle SPC EMEA [27–30] ![Tabulka 17.10. Výskyt poruchy jater a žlučových cest podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/a8af95ffd6496de3d48e19820c951fc2.png?version=1537790335)
13. 6. Protilátky proti biologiku
Během léčby biologiky může dojít ke vzniku protilátek proti léku.
U infliximabu se protilátky objevují až u 10–30 % pacientů s psoriázou a mohou vést ke snížení léčebné odpovědi i větší incidenci infuzních reakcí (viz 13. 7) [29, 53, 65]. Ztráta účinnosti při dlouhodobé léčbě byla popsána až u 25 % léčených a protilátky proti infliximabu se vyskytly u 61 % pacientů nereagujících na léčbu, oproti 19 % ve skupině s dostatečnou léčebnou odpovědí [75].
Protilátky proti adalimumabu mohou zvyšovat clearance léku a snižovat účinnost, jejich přítomnost však nevede k většímu riziku nežádoucích reakcí. Jejich výskyt je popsán u 8,4 % pacientů s psoriázou [28, 75].
Výskyt protilátek proti léku je nižší při souběžné jiné imunosupresivní léčbě, nejčastěji metotrexátem (tab. 9).
Tab. 8. Výskyt protilátek proti adalimumabu a infliximabu [28, 29] ![Výskyt protilátek proti adalimumabu a infliximabu [28, 29]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8a796d25bfcc258c6761414038ccd573.png)
Vysvětlivky: JIA – juvenilní idiopatická artritida, RA – revmatoidní artritida, PsA – psoriatická artritida, MC – morbus Crohn, PSO – psoriáza 1údaj podle [75] Při léčbě etanerceptem se u 6 % objevují protilátky, které nejsou neutralizační, jejich výskyt může být přechodný a neovlivňují účinnost ani bezpečnost léčby [65].
Protilátky proti ustekinumabu jsou popsány u 5 % pacientů s psoriázou a jsou častější u osob s horší léčebnou odpovědí [65].
Vyšetření protilátek proti biologiku nemusí být běžně dostupné, proto by určitou výpovědní hodnotu mohly mít stoupající titry antinukleárních protilátek (ANA) a protilátek proti dvouvláknové DNA (anti-dsDNA), které by mohly ukazovat na snižující se účinnost léčby monoklonálními protilátkami [42, 62].
13. 7. Injekční a infuzní reakce
Častou nežádoucí reakcí při podkožní aplikaci anti-TNF terapie a ustekinumabu je reakce v místě vpichu, projevující se erytémem nebo bolestivým erytémem a otokem v místě a okolí aplikace, nejčastěji v prvních týdnech [61].
Infuzní reakce po aplikaci infliximabu s různými symptomy se objevují u 3–22 % pacientů s psoriázou. Většina reakcí probíhá jako mírné či středně těžké akutní reakce, vznikající během prvních 24 hodin po aplikaci. Nejčastěji se objevuje náhlá dyspnoe, bolesti hlavy, zimnice, nauzea, pocení, změny krevního tlaku.
Vzácné pozdní hypersenzitivní reakce vznikají 24 hodin až 14 dnů po infuzi (nejčastěji za 5–7 dní) a projevují se myalgií, artralgií, teplotou, popř. exantémem, otokem, kopřivkou.
Předpokládané mechanismy vzniku zahrnují anafylaktoidní/anafylaktické reakce, reakce připomínající sérovou nemoc a vznik IgG protilátek proti infliximabu. Pravděpodobnost vzniku protilátek proti infliximabu je nižší při kontinuálním podávání oproti intermitentnímu. Současná aplikace metotrexátu tvorbu protilátek proti infliximabu tlumí. Mírné či středně těžké reakce ustupují při zpomalení podávání infuze či dočasném přerušení a v léčbě je možné pokračovat za zvážení premedikace antihistaminiky, paracetamolem či kortikosteroidy [71], nicméně zatím neexistují jasné důkazy, že premedikace může zabránit vzniku infuzní reakce [53, 87].
Závažné reakce vyžadují ukončení infuze a intenzivní terapii (adrenalin, antihistaminika, kortikosteroidy, kyslík, monitorování) a jsou absolutní kontraindikací dalšího podávání. Důležité je sledovat pacienta během infuze a ještě 1–2 hodiny po infuzi ve zdravotnickém zařízení s resuscitačním vybavením.
(Výskyt celkových poruch, reakce v místě aplikace a poruch imunitního systému podle SPC, viz tab. 17.11.)
Tabulka 17.11. Výskyt celkových poruch, reakce v místě aplikace a poruch imunitního systému podle SPC EMEA [27–30] ![Tabulka 17.11. Výskyt celkových poruch, reakce v místě aplikace a poruch imunitního systému podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/153a1b4ca8e3bd91903ca1e4e5502cef.png?version=1537791918)
13. 8. Antinukleární protilátky, autoimunitní onemocnění
Anti-TNF terapie může vyvolat vznik cirkulujících antinukleárních autoprotilátek (ANA), protilátek proti dvouvláknové DNA (anti-dsDNA) a vzácně rozvoj syndromu připomínajícího lupus erythematosus (LLS – lupus-like syndrom). Anti-TNF vyvolaný LLS se liší od klasického, léky indukovaného lupusu a připomíná spíše idiopatický systémový lupus erythematosus s mírným průběhem. Projevuje se nejčastěji horečkou, motýlovým erytémem tváří, bolestmi kloubů a abnormálními laboratorními nálezy [74]. Objevuje se většinou v prvním roce anti-TNF léčby. Po vysazení terapie obvykle dochází k ústupu projevů [21, 82].
Jako další syndromy připomínající autoimunitní onemocnění se popisují vaskulitidy, antifosfolipidový syndrom, sarkoidóza, neuritida optiku, demyelinizační onemocnění připomínající roztroušenou sklerózu a periferní neuropatie [74] – viz příslušné kapitoly.
Pacienti, kteří mají pouze laboratorně pozitivní antinukleární protilátky, mohou v léčbě pokračovat. Při rozvoji klinických známek autoimunitních syndromů se léčba ukončí a opakované podání anti-TNF je možno zvážit v indikovaných případech s velkou opatrností [21]. Zároveň se doporučuje pátrat po současné možné virové či bakteriální infekci, která by mohla být důvodem spuštění autoimunitní reakce, či by mohla autoimunitní syndromy napodobovat [74]. Pravidelné vyšetřování autoprotilátek bez klinické symptomatologie se nevyžaduje [65, 82, 87].
(Výskyt poruch pojivové tkáně podle SPC, viz tab. 17.12.)
15 Tabulka 17.12. Výskyt poruch pojivové tkáně podle SPC EMEA [27–30] ![15 Tabulka 17.12. Výskyt poruch pojivové tkáně podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/709073784872e96f7ed9be17de26d9ab.png?version=1537790335)
Vysvětlivky: LE – lupus erythematosus 13. 9. „Paradoxní reakce“
Určitá onemocnění včetně psoriázy, která běžně reagují na terapii antagonisty TNF, mohou být „paradoxně“ vyvolána, nebo zhoršena anti-TNF terapií. U pacientů na biologické léčbě, zejména z revmatologické indikace, byly popsány různé granulomatózní reakce nejčastěji postihující plíce, nemoci podobné či neodlišitelné od sarkoidózy, vaskulitidy malých cév převážně v kůži a uveitidy.
Dále jsou ve stále vzrůstající míře hlášeny případy nového vzniku či zhoršení psoriázy při terapii anti-TNF, převážně z revmatologické a gastroenterologické indikace. Nejčastěji se popisuje rozvoj pustulózní psoriázy na dlaních a ploskách [82] a psoriáza kštice. Při anti-TNF léčbě střevních zánětů jsou ženy touto reakcí postiženy dvakrát častěji než muži a psoriáza se může objevit až po několika letech léčby. Většina nemocných nemá v osobní ani v rodinné anamnéze uvedenou psoriázu [17]. Podle britských revmatologů se odhaduje, že tato reakce postihuje 1 z 1000 léčených pacientů. V patogenezi se předpokládá, že blokace TNF-α vede ke zvýšené produkci IFN-α dendritickými buňkami a následné indukci psoriázy [3, 54]. Léčebně se doporučuje kombinovaná lokální antipsoriatická terapie a u úporných případů vysazení či změna biologika. U popsaných případů mělo největší efekt vysazení anti-TNF a zahájení systémové léčby [21], při změně anti-TNF léčby totiž může psoriáza až v 52 % přetrvávat či recidivovat [17].
(Výskyt tzv. paradoxních reakcí podle SPC, viz tab. 17.13.)
Tabulka 17.13. Výskyt tzv. paradoxních reakcí podle SPC EMEA [27–30] ![Tabulka 17.13. Výskyt tzv. paradoxních reakcí podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/a29b79e9591181f03d344add90b6be45.png?version=1537790335)
13. 10. Jiné reakce a nežádoucí účinky
Při anti-TNF terapii, zejména při léčbě etanerceptem, se pozoruje zvyšování hmotnosti pacientů s chronickou psoriázou [32, 81]. Obézní pacienti pak nemusí dosahovat optimální léčebné odpovědi [75].
Při léčbě anti-TNF preparáty a ustekinumabem se mohou vyskytnout další možné reakce, jejichž výskyt není obvykle udáván v jednotlivých doporučených postupech. Pro úplnost shrnujeme tyto situace v tabulce 17.14. podle SPC jednotlivých preparátů.
Tabulka 17.14. Výskyt dalších nežádoucích účinků (nezařazené výše) podle SPC EMEA [27–30] ![Tabulka 17.14. Výskyt dalších nežádoucích účinků (nezařazené výše) podle SPC EMEA [27–30]](https://pl-master.mdcdn.cz/media/image/ef4355ffaf8c99e8080306e7a16f156e.png?version=1711873658)
Vysvětlivky: APTT – aktivovaný parciální tromboplastinový čas, LD – laktát dehydrogenáza, CK – kreatin fosfokináza, GIT – 0 gastrointestinální 14. BIOLOGICKÁ LÉČBA V RŮZNÝCH KLINICKÝCH SITUACÍCH
14. 1. Těhotenství a laktace
Léčba psoriázy u těhotných žen pomocí antagonistů TNF nebyla dosud řešena v prospektivní nebo retrospektivní studii, nicméně byly publikovány práce, které se týkají průběhu těhotenství a důsledků pro plod při anti-TNF léčbě u jiných onemocnění (zejména Crohnova choroba a revmatoidní artritida). Dosavadní data připouštějí nadějné výsledky, nicméně nadále trvá doporučení k přerušení biologické léčby před plánovaným početím [88]. Popisují se případy nekomplikovaného průběhu těhotenství s předcházející nebo kontinuální biologickou léčbou, zároveň však byly publikovány některé zprávy o zvýšené četnosti spontánních abortů a předčasných porodů [21, 88]. Publikovaný článek, vycházející z databáze FDA, který popisoval kauzální roli anti-TNF ve výskytu kongenitálních abnormalit (srdeční vrozené vady a jedna nebo více anomálií tvořících součást syndromu VACTERL – vertebrální, anální, kardiovaskulární, tracheoezofageální, renální a končetinové abnormality) u dětí matek, léčených v těhotenství infliximabem a etanerceptem, byl podroben kritice [21, 82].
O použití ustekinumabu u gravidních žen nejsou dostupné informace, bylo publikováno pouze použití u březích makaků [59].
Výrobci etanerceptu, infliximabu, adalimumabu a ustekinumabu nedoporučují podávat tyto přípravky u těhotných a kojících žen. Ve zvířecích studiích sice nebyla hlášena toxicita nebo teratogenita, při úvahách o použití antagonistů TNF během těhotenství je však přesto zapotřebí zvýšená opatrnost. Anti-TNF preparáty i ustekinumab [62, 70] jsou řazeny do kategorie „B“ podle FDA klasifikace pro použití léků v těhotenství [34, 70] a podle SPC je během biologické léčby doporučena antikoncepce u žen fertilního věku při léčbě infliximabem ještě alespoň 6 měsíců, při léčbě adalimumabem 5 měsíců, při terapii etanerceptem 3 týdny a při léčbě ustekinumabem ještě 15 týdnů po ukončení léčby [27–30].
Anti-TNF monoklonální protilátky, podobně jako imunoglobuliny G, prostupují placentou až během druhého trimestru gravidity. U dětí žen, které byly během gravidity léčeny infliximabem, byl preparát prokázán až do 6 měsíců věku, a mohl by proto teoreticky ovlivnit např. vnímavost novorozence k infekcím [51]. Dosavadní data zatím nepopisují zvýšený počet infekcí a ukazují normální odpověď na neživé vakcíny u novorozenců, opatrnost je však třeba při aplikaci živých vakcín, které by neměly být podány před úplnou eliminací anti-TNF preparátu [22, 51].
Přestože se dosud jasně nedoporučuje podávání biologické léčby v graviditě, je nutno v případě neočekávaného i plánovaného početí postupovat individuálně s uvědoměním si rizika ukončení léčby pro matku, ale i možného ovlivnění zdraví plodu [21, 82].
I když nejsou dostupná dostatečná data potvrzující rizika kojení u žen léčených anti-TNF preparáty, není kojení doporučováno [82]. IgG z mléka nepřestupuje do cirkulace kojence ve významném množství, a proto se nepředpokládá ani významný přestup anti-TNF preparátů. Infliximab v mateřském mléce nebyl detekován [16, 87, 89], hladina etanerceptu v mateřském mléce odpovídala 0,1–4% hladině sérové koncentrace matky [16, 21] a adalimumabu 0,01% hladině matky [5]. Současně se předpokládá, že anti-TNF protilátky jsou odbourány v zažívacím traktu dítěte [89].
U ustekinumabu není známo, zda se vylučuje do mateřského mléka, ani zda se absorbuje po požití. Studie na zvířatech prokázaly nízké hladiny v mateřském mléce. Vzhledem k nedostatku dat se kojení nedoporučuje, případně je možno postupovat s ohledem na neznámá rizika pro matku i plod [30].
14. 2. Biologická léčba u mužů a početí dítěte
Existuje jen několik málo publikací, které řeší, zda TNF nebo antagonisté TNF mohou ovlivňovat spermatogenezi, počet nebo kvalitu spermií. Je proto obtížné vyvozovat jakékoli definitivní závěry. Některé údaje naznačují, že TNF či jeho antagonisté mohou mít jistý biologický účinek na motilitu spermií, klinický význam těchto zjištění je však v současné době nejasný [21, 82]. Některé práce doporučují přerušit léčbu u mužů podobně jako u žen plánujících graviditu se zohledněním rizika vysazení preparátu [21].
14. 3. Očkování
Před zahájením léčby je doporučené zkontrolovat a doplnit předepsaná očkování. Během biologické léčby (2 týdny před ukončením a 6 měsíců po ukončení) není možné podávat živé ani oslabené vakcíny (BCG, spalničky, příušnice, zarděnky, orální poliomyelitida, orální tyfus, žlutá zimnice, varicella, zoster). U pacientů z rizikových skupin se doporučuje očkování proti hepatitidě B před zahájením biologické léčby. Stejně jako u imunosuprimovaných pacientů se doporučuje každoroční očkování inaktivovanou vakcínou proti chřipce a očkování proti pneumokokům. Očkování tetanickým toxoidem má u imunosuprimovaných osob srovnatelnou účinnost jako u zdravých [2, 21, 76, 82].
14. 4. Plánované operace
Rizika perioperačních a pooperačních komplikací dosud nebyla sledována v randomizovaných klinických studiích či prospektivních sledováních a dostupná data vycházejí obvykle z retrospektivního sledování revmatologických a gastroenterologických pacientů a neukazují jednoznačné závěry [39, 40, 48, 82]. Zkušenosti se týkají především ortopedických operací u revmatologických pacientů, u kterých chronický zánět či souběžná jiná imunosupresivní léčba může zvyšovat riziko infekcí. Zároveň i vzplanutí onemocnění po vysazení biologické léčby může vést k elevaci zánětlivých parametrů a znesnadňuje interpretaci výsledků [39, 40].
Dostupná data z provedených sledování ukazují jak vyšší riziko infekce rány, případně zpomalené hojení ran, zejména u osob se stejnými komplikacemi či infekcí kůže v minulosti, tak častěji nezvýšené riziko komplikací i při perioperační aplikaci anti-TNF [10, 21, 48, 73, 82].
Doporučení z literatury k přerušení biologické léčby nemají jednotný charakter a rozhodnutí by mělo zohledňovat typ operace, celkový stav pacienta i přidružených onemocnění, infekční komplikace v minulosti a zároveň i riziko zhoršení nemoci [39, 40]. Doporučená spolupráce lékaře indikujícího biologickou léčbu, operatéra a lékařů dalších specializací k rozhodnutí o vysazení biologika jsou podle našeho názoru v praxi obtížně realizovatelná. Doba rozhodující o vysazení se obvykle přepočítává podle biologického poločasu preparátu (T ½), což je doba, za kterou se množství léku v organismu sníží na polovinu. K úplnému vyloučení je obvykle potřeba pětinásobek T ½. V předoperačním období je doporučeno vysadit biologikum na dobu odpovídající 3–5násobku T ½. U operací s minimálním rizikem infekčních komplikací (např. operace katarakty) je možno zvážit vysazení před operací odpovídající 2násobku T ½, naopak u septických výkonů či operací s vyšším rizikem infekce (kolorektální operace, totální náhrady kloubů) zvážit dobu vysazení odpovídající 5násobku T ½ [10, 21, 48, 73, 82]. Průměrná doporučená doba vysazení je udávána 2 týdny u etanerceptu, 6–8 týdnů u adalimumabu, 4–6 týdnů u infliximabu a 12 týdnů u ustekinumabu [21, 70, 82] – tabulka 10. Podle doporučení českých revmatologů odpovídá minimální doba vysazení jednomu intervalu podání biologika [87]. Po operaci, pokud nedošlo k infekční komplikaci a rána se uspokojivě hojí, je možné opět pokračovat v léčbě (obvykle za 10–14 dní) [21, 70, 82, 87]. U stomatologických výkonů s rizikem infekce se doporučuje preventivní podání antibiotik [87].
Tab. 9. Biologický poločas a doporučená doba vysazení biologik před operací [21, 70, 82, 87] ![Biologický poločas a doporučená doba vysazení biologik před operací [21, 70, 82, 87]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ce895df99ac4f4088822dab583a8c5f1.png)
Vysvětlivky: T ½ – biologický poločas, d – den, tý – týden 15. REGISTR
Léčba psoriázy biologiky je v ČR vedena dermatology v Centrech pro biologickou léčbu a předpis je vázán na zadání příslušných údajů do národního registru BIOREP. Tento registr, spravovaný Českou dermatovenerologickou společností, byl založen v roce 2005 s cílem evidovat pacienty s biologickou léčbou psoriázy. Registry jsou nezastupitelným zdrojem dat a jsou jednoznačně doporučeny odbornými společnostmi. Obsahují data k hodnocení léčby, sledují krátkodobé i dlouhodobé efekty léčby, sledují nežádoucí účinky léčby, informují o účinnosti a bezpečnosti jednotlivých preparátů a poskytují reálné klinické zkušenosti. Sledují skupinu všech léčených pro dané onemocnění i s ohledem na přidružená onemocnění a bez ohledu na vyřazovací kritéria studií. Do provozu registru BIOREP jsou zapojena všechna centra pro biologickou léčbu psoriázy v České republice a registr v současné době eviduje 1000 pacientů s nejdelší dobou podávání Enbrelu (přes 6 let), Remicade (necelých 6 let), Humiry (5 let) a Stelary (2,5 roku). Vstup do databáze je umožněn pouze registrovaným uživatelům, všechna práva pacientů jsou plně zachována a centrální sběr dat probíhá anonymně, bez osobních údajů. Provedená aktualizace se začleněním nových parametrů sledování umožňuje získat dlouhodobá data o účinnosti a bezpečnosti biologické léčby v České republice.
16. ZÁVĚR
Rozvoj moderní biologické léčby v posledních letech umožnil prohloubit znalosti o patogenezi psoriázy, rizicích souvisejících se závažnou psoriázou a o často sdružených dalších zánětlivých chorobách, ale také podávat mnohem účinnější cílenou léčbu pacientům, která umožní dosažení dlouhodobé remise onemocnění a výrazné zlepšení kvality jejich života.
Výběr biologického léku by měl vždy vycházet z klinické potřeby, pečlivého zhodnocení rizik a přínosu každého přípravku. V každém individuálním případě je třeba zvážit nejen závažnost psoriázy, její klinickou formu, zkušenosti s předchozí léčbou a průběhem nemoci, ale také přítomnost souběžných nemocí. Pro rozhodování o zahájení, vedení, ale i ukončení biologické terapie psoriázy mohou pomoci předkládané doporučené postupy České dermatovenerologické společnosti ČLS JEP. Vzhledem k rychlému přibývání nových poznatků se plánuje revize a aktualizace stávajících doporučených postupů v následujících letech.
17. NEŽÁDOUCÍ ÚČINKY PODLE SPC EMEA
Následující kapitola uvádí v tabulkovém přehledu údaje z posledních dostupných SPC EMEA (European Medicines Agency) [27–30] – viz odkazy v textu. Tyto informace uvádíme pro úplnost článku a mohou obsahovat odlišná data než citované práce. Současně je nutné zohlednit indikační rozsah jednotlivých preparátů, dobu jejich používání, počet léčených pacientů a z toho vyplývající množství možných nežádoucích účinků, které jsou v SPC hodnoceny napříč indikacemi a činí je neporovnatelnými. Je třeba si uvědomit, že také mohou zatím chybět údaje hlášených nežádoucích reakcí ustekinumabu díky kratší době používání pouze u jedné indikace. Jak již bylo uvedeno výše, je nutné nadále sledovat aktuální informace.
Uvedené symboly ukazují četnost reakcí: ++++ velmi časté (> 1/10); +++ časté (≥ 1/100 <1/10); ++ méně časté (≥ 1/1 000 </100); + vzácné (≥ 1/10000 < 1/1000); +*velmi vzácné (< 1/10000); **četnost neznámá; prázdné pole = nežádoucí účinek dosud nebyl popsán.
Podpořeno výzkumným záměrem UK v Praze MSM0021620819.
Do redakce došlo dne 13. 2. 2012.
Kontaktní adresa:
Doc. MUDr. Petra Cetkovská, Ph.D.
Dermatovenerologická klinika FN a LFUK
Dr. E. Beneše 13
305 99 Plzeň
e-mail: cetkovska@fnplzen.cz
Zdroje
1. AITHAL, G. P. Hepatotoxicity related to antirheumatic drugs. Nat. Rev. Rheumatol., 2011, 7, 3, p. 139–150.
2. VAN ASSEN, S., AGMON-LEVIN, N., ELKAYAM, O. et al. EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann. Rheum. Dis., 2011, 70, p. 414–422.
3. BELL, G. M., REYNOLDS, G., ISAACS, J. D. Biologic therapies in non-rheumatic diseases: lessons for rheumatologists? Nat. Rev. Rheumatol., 2011, 7, p. 507–516.
4. BENÁKOVÁ, N., ŠTORK, J. et al. Léčba psoriázy biologiky. Konsenzuální doporučené postupy České dermatologické společnosti ČLS JEP 2006. Čes-slov Derm., 2006, 81, 4, s. 1–11.
5. BEN-HORIN, S., YAVZORI, M., KATZ, L. et al. Adalimumab level in breastmilk of a nursing mother. Clin. Gastroenterol. Hepatol., 2010, 8, 5, p. 475–476.
6. BEYER, M., STEINHOFF, M., ANAGNOSTOPOULOS, I. et al. Hepatosplenic T-cell lymphomas and therapy with TNF-alpha-blocking biologics: a risk for psoriasis patients? J. Dtsch. Dermatol. Ges., 2009, 7, 3, p. 191–194.
7. BISSONNETTE, R., POULIN, Y., GUENTHER, L. et al. Treatment of palmoplantar psoriasis with infliximab: a randomized, double-blind placebo-controlled study. J. Eur. Acad. Dermatol. Venereol., 2011, 25, 12, p. 1402–1408.
8. BOEHNCKE, S., SALGO, R., GARBARAVICIENE, J. et al. Effective continuous systemic therapy of severe plaque-type psoriasis is accompanied by amelioration of biomarkers of cardiovascular risk: results of a prospective longitudinal observational study. J. Eur. Acad. Dermatol., 2011, 25, p. 1187–1193.
9. BOEHNCKE, W. H., KATSAMBAS, A., ORTONNE, J. P. et al. EADV preceptorship: advances in dermatology. J. Eur. Acad. Dermatol., 2010, 24, suppl. 5, p. 2–24.
10. DEN BROEDER, A. A., CREEMERS, M. C., FRANSEN, J. et al. Risk factors for surgical site infections and other complications in elective surgery in patients with rheumatoid arthritis with special attention for anti-tumor necrosis factor: a large retrospective study. J. Rheumatol., 2007 34, 4, p. 689–695.
11. BRUNASSO, A. M., PUNTONI, M., GULIA, A., MASSONE, C. Safety of anti-tumour necrosis factor agents in patients with chronic hepatitis C infection: a systematic review. Rheumatology, 2011, 50, 9, p. 1700–1711.
12. CAPORALI, R., BOBBIO-PALLAVICINI, F., ATZENI F. et al. Safety of tumor necrosis factor alpha blockers in hepatitis B virus occult carriers (hepatitis B surface antigen negative/anti-hepatitis B core antigen positive) with rheumatic diseases. Arthritis Care Res., 2010, 62, 6, p. 749–754.
13. CARROLL, M. B., HOLMES, R. Safety of anti-tumor necrosis factor therapy in patients with chronic hepatitis B. Hep B Annual., 2009, 6, p. 89–109.
14. CASSANO, N., VESTITA, M., APRUZZI, D. et al. Alcohol, psoriasis, liver disease and anti-psoriasis drugs. Int. J. Dermatol., 2011, 50, p. 1323–1331.
15. CLEMMENSEN, A., SPON, M., SKOV, L. et al. Responses to ustekinumab in the anti-TNF agent-naive vs. anti-TNF agent exposed patients with psoriasis vulgaris. J. Eur. Acad. Dermatol., 2011, 25, p. 1037–1040.
16. CLOWSE, M. E. B. The use of anti-TNFα medications for rheumatologic disease in pregnancy. Int. J. Womens Health, 2010, 2, p. 199–209.
17. CULLEN, G., KROSHINSKY, D., CHEIFETZ, A. S. et al. Psoriasis associated with anti-tumour necrosis factor therapy in inflammatory bowel disease: a new series and a review of 120 cases from the literature. Aliment. Pharmacol. Ther., 2011, 9 p., online early.
18. DANILA, M. I., PATKAR, N. M., CURTIS, J. R. et al. Biologics and heart failure in rheumatoid arthritis: are we any wiser? Curr. Opin. Rheumatol., 2008, 20, p. 327–333.
19. DI LERNIA, V. Progressive multifocal leukoencephalopathy and antipsoriatic drugs: assessing the risk of immunosuppressive treatments. Int. J. Dermat., 2010, 49, 6, p. 631–635.
20. DI LERNIA, V., ALBERTINI,G. Is antitumour necrosis factor therapy combined with ultraviolet B phototherapy safe? Br. J. Dermatol., 2010, 162, 5, p. 1147–1148.
21. DING, T., LEDINGHAM, J., LUQMANI, R. BSR and BHPR rheumatoid arthritis guidelines on safety of anti-TNF therapies. Rheumatology, 2010, 49, p. 2217–2219 a suppl., 2010, 9, p. 14.
22. DJOKANOVIC, N., KLIEGER-GROSSMANN, C., PUPCO, A. et al. Safety of infliximab use during pregnancy. Reprod. Toxicol., 2011, 32, 1, p. 93–97.
23. DOMM, S., CINATL, J., MROWIETZ, U. The impact of treatment with tumour necrosis factor-α antagonists on the course of chronic viral infections: a review of the literature. Br. J. Derm., 2008, 159, p. 1217–1228.
24. DOMMASCH, E. D., ABUABARA, K., SHIN, D. B. et al. The risk of infection and malignancy with tumor necrosis factor antagonists in adults with psoriatic disease: A systematic review and meta-analysis of randomized controlled trials. J. Am. Acad. Dermatol., 2011, 64, p. 1035–1050.
25. DREIHER, J., KRESCH, F. S., COMANESHTER, D. et al. Risk of herpes zoster in patients with psoriasis treated with biologic drugs. J. Eur. Acad. Dermatol., 2011, online early.
26. DRIESSEN, R. J. B., BOEZEMAN, J. B., VAN DE KERKHOF, P. C. M. et al. Three-year registry data on biological treatment for psoriasis: the influence of patient characteristics on treatment outcome. Br. J. Derm., 2009 160, p. 670–675.
27. EMEA. Enbrel, aktualizace 26/09/2011. Dostupné na www: http://www.emea.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000262/WC500027361.pdf
28. EMEA. Humira, aktualizace 17/11/2011. Dostupné na
www:http://www.emea.europa.eu/docs/cs_CZ/document_library/EPAR_Product_Information/human/000481/WC500050870.pdf
29. EMEA. Remicade, aktualizace 13/12/2011. Dostupné na www:
http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000240/WC500050888.pdf
30. EMEA. Stelara, aktualizace 20/09/2011. Dostupné na www. http://www.emea.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000958/WC500058513.pdf
31. EMER, J. J., FRANKEL, A., ZEICHNER, J. A. A practical approach to monitoring patients on biological agents for the treatment of psoriasis. J. Clin. Aesthet. Dermatol., 2010, 3(8), p. 20–26.
32. ESPOSITO, M., MAZZOTTA, A., SARACENO, R. et al. Influence and variation of the body mass index in patients treated with etanercept for plaque-type psoriasis. Int. J. Immunopathol. Pharmacol., 2009, 22, p. 219–225.
33. FDA Drug Safety Communication: Drug labels for the Tumor Necrosis Factor-alpha (TNFα) blockers now include warnings about infection with Legionella and Listeria bacteria. 2011. Dostupné na www: http://www.fda.gov/Drugs/DrugSafety/ucm270849.htm
34. FDA Use-in-Pregnancy Ratings. Dostupné na www: http://www.perinatology.com/exposures/Drugs/FDACategories.htm.
35. FROMONT, A., DE SEZE, J., FLEURY, M. C. et al. Inflammatory demyelinating events following treatment with anti-tumor necrosis factor. Cytokine, 2009 Feb, 45, 2, p. 55–57.
36. GNIADECKI, R., KRAGBALLE, K., DAM T. N. et al. Comparison of drug survival rates for adalimumab, etanercept and infliximab in patiens with psoriasis vulgaris. Br. J. Dermatol., 2011, 164, p. 1091–1096.
37. GRATTON, D., SZAPARY, P., GOYAL, K. et al. Reversible posterior leukoencephalopathy syndrome in a patient treated with ustekinumab: case report and review of the literature. Arch. Dermatol., 2011, 147, 10, p. 1197–1202.
38. GUENTHER, L. C. Combination Therapy of Biologics with Traditional Agents in Psoriasis. Skin Therapy Lett., 2011, Jun, 16, 6, p. 1–3.
39. HÄRLE, P., STRAUB, R. H., FLECK, M. Elective surgery in rheumatic disease and immunosuppression: to pause or not. Rheumatol., 2010, 49, 10, p. 1799–1800.
40. HÄRLE, P., STRAUB, R. H., FLECK, M. Perioperative management of immunosuppression in rheumatic diseases – what to do? Rheumatol. Int., 2010, 30, 8, p. 999–1004.
41. HERNANDEZ CRUZ, B., CETNER, A. S., JORDAN, J. E. et al. Tuberculosis in the age of biologic therapy. J. Am. Acad. Dermatol., 2008, 59, p. 363–380.
42. HOFFMANN, J. H. O., HARTMANN, H., ENK, A. H. Autoantibodies in psoriasis as predictors for loss-of-response and anti-infliximab antibody induction. Br. J. Dermatol., 2011, Aug 1. doi: 10.1111.
43. HUANG, W., CORDORO, K. M., TAYLOR, S. L. et al.To test or not to test? An evidence-based assessment of the value of screening and monitoring tests when using systemic biologic agents to treat psoriasis. J. Am. Acad. Dermatol., 2008, 58, 6, p. 970–977.
44. HUSA, P., PLÍŠEK, S., ŠPERL, J. et al. Diagnostika a léčba chronické hepatitidy B. Doporučený postup České hepatologické společnosti a Společnosti infekčního lékařství ČLS J. E. Purkyně. Dostupné na www: http://www.infekce.cz/DoporVHB09t.htm.
45. CHUNG, S. J., KIM, J. K., PARK, M. CH. Reactivation of hepatitis B viral infection in inactive HBsAg carriers following anti-tumor necrosis factor-alpha therapy. J. Rheumatol., 2009, 36, 11, p. 2416–2420.
46. JANSEN, T. L. When rheumatology meets hepatology: Are anti-TNFs safe in hepatitis B virus carriers? Arthritis Res. Therapy, 2010, 12, p. 103.
47. JARAND, J., ZOCHODNE, D. W., MARTIN, L. O. et al. Neurological complications of infliximab. J. Rheumatol., 2006, 33, p. 1018–1020.
48. KAWAKAMI, K., IKARI, K., KAWAMURA, K. et al. Complications and features after joint surgery in rheumatoid arthritis patients treated with tumour necrosis factor-alpha blockers: perioperative interruption of tumour necrosis factor-alpha blockers decreases complications? Rheumatol., 2010, 49, 2, p. 341–347.
49. VAN DE KERKHOF, P. C. Novel biologic therapies in development targeting IL-12/IL-23. J. Eur. Acad. Dermatol., 2010, 24 (suppl. 6), p. 5–9.
50. KEYSTONE, E. C., PAPP, K. A., WOBESER, W. Challenges in diagnosing latent tuberculosis infection in patients treated with tumor necrosis factor antagonists. J. Rheumatol., 2011, 38, 7, p. 1234–1243.
51. KWAN, Y. L., MAHADEVAN, U. Inflammatory Bowel Disease and Pregnancy: An Update. Expert Rev. Clin. Immunol., 2010, 6, 4, p. 643–657.
52. LEBWOHL, M., BAGEL, J., GELFAND, J. M. et al. From the Medical Board of the National Psoriasis Foundation: monitoring and vaccinations in patients treated with biologics for psoriasis. J. Am. Acad. Dermatol., 2008, 58, 1, p. 94–105.
53. LECLUSE, L. L. A., DOWLATSHAHI, E. A., LIMPENS, J. M. et al. Etanercept. An overview of dermatologic adverse events. Arch. Dermatol., 2011, 147, p. 79–94.
54. LECLUSE, L. L., DE GROOT, M., BOS, J. D. et al. Experience with biologics for psoriasis in daily practice: switching is worth a try. Br. J. Dermatol., 2009, 161, 4, p. 948–951.
55. Legionnaire’s disease. Dostupné na:
http://www.nlm.nih.gov/medlineplus/ency/article/000616.htm.
56. LOZERON, P., DENIER, C., LACROIX, C. et al. Long-term course of demyelinating neuropathies occurring during tumor necrosis factor-alpha-blocker therapy. Arch. Neurol., 2009, 66, 4, p. 490–497.
57. VAN LÜMIG, P., DRIESSEN, R., BERENDS, M. et al. Safety of treatment with biologics for psoriasis in daily practice: 5-year data. J. Eur. Acad. Dermatol. Venereol., 2011, Mar 24. doi: 10.1111/j.1468-3083.2011.04044.x. [Epub ahead of print].
58. VAN LÜMIG, P. P., DRIESSEN, R. J., ROELOFS-THIJSSEN, M. A. et al. Relevance of laboratory investigations in monitoring patients with psoriasis on etanercept or adalimumab. Br. J. Dermatol., 2011, 165, 2, p. 375–382.
59. MARTIN, P. L., SACHS, C., IMAI, N. et al. Development in the cynomolgus macaque following administration of ustekinumab, a human anti-IL-12/23p40 monoclonal antibody, during pregnancy and lactation. Birth Defects Res. B. Dev. Reprod. Toxicol., 2010, 89, 5, p. 351–363.
60. MEHTA, N. N., AZFAR, R. S., SHIN, D. B. et al. Patients with severe psoriasis are at increased risk of cardiovascular mortality: cohort study using the General Practice Research Database. Eur. Heart J., 2010, 31, p. 1000–1006.
61. MENTER, A., GOTTLIEB, A., FELDMAN, S. R. et al. Guidelines of care for the management of psoriasis and psoriatic arthritis. Section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics. J. Am. Acad. Dermatol., 2008, 58, p. 826–850.
62. MENTER, A., KORMAN, N. J., ELMETS, C. A. et al. Guidelines of care for the management of psoriasis and psoriatic arthritis. Section 6. Guidelines of care for the treatment of psoriasis and psoriatic arthritis: Case-based presentations and evidence-based conclusions. J. Am. Acad. Dermatol., 2011, 65, p. 134–174.
63. MROWIETZ, U., KRAGBALLE, K., REICH, K. et al. Definition of treatment goals for moderate to severe psoriasis: a European consensus. Arch. Dermatol. Res., 2011, 303, p. 1–10.
64. MROWIETZ, U., KRAGBALLE, K., NAST, A. et al. Strategies for improving the quality of care in psoriasis with the use of treatment goals - a report on an implementation meeting. J. Eur. Acad. Dermatol., 2011, 25, suppl. 3, p. 1–13.
65. NAST, A., BOEHNCKE, W. H., MROWIETZ, U. et al. S3-Guidelines on the treatment of psoriasis vulgaris. Update 2011. JDDG, 2011, 9, suppl. 2, p. S1–S95.
66. NESTLE, F. O., KAPLAN, D. H., BARKER, J. Psoriasis. N. Engl. J. Med., 2009, 361, p. 496–509.
67. Noiles, K., Vender, R. Biologic survival. J. Drugs Dermatol., 2009, 8, 4, p. 329–333.
68. ORTONNE, J. P., CHIMENTI, S., REICH, K. et al. Efficacy and safety of adalimumab in patients with psoriasis previously treated with anti-tumour necrosis factor agents: subanalysis of BELIEVE. J. Eur. Acad. Dermatol., 2011, 25, p. 1012–1020.
69. PALLER, A. S., SIEGFRIED, C., LANGLEY, R. G. et al. Etanercept treatment for children and adolescens with plaque psoriasis. N. Engl. J. Med., 2008, 358, p. 241–251.
70. PAPP, K. A. et al. Canadian Guidelines for the Management of Plaque Psoriasis. 2009; June. Dostupné na: http://www.dermatology. ca/guidelines/cdnpsoriasisguidelines.pdf.
71. PATHIRANA, D., ORMEROD, AD., SAIAG, P. et al. European S3-guidelines on the systemic treatment of psoriasis vulgaris. J. Eur. Acad. Dermatol., 2009, 23, p. 1–70.
72. PERLMUTTER, A., MITTAL, A., MENTER, A. Tuberculosis and tumour necrosis factor-a inhibitor therapy: a report of three cases in patients with psoriasis. Comprehensive screening and therapeutic guidelines for clinicians. Br. J. Derm., 2009, 160, p. 8–15.
73. PIERINGER, H., STUBY, U., BIESENBACH, G. Patients with rheumatoid arthritis undergoing surgery: how should we deal with antirheumatic treatment? Semin. Arthritis Rheum., 2007, 36, 5, p. 278–286.
74. PRINZ, J. C. Autoimmune-like syndromes during TNF blockade: does infection have a role. Nat. Rev. Rheumatol., 2011, 7, p. 429–434.
75. PUIG, L., CARRASCOSA, J. M., DAUDÉN E. Spanish evidence-based guidelines on the treatment of moderate to severe psoriasis with biologic agents. Actas Dermosifiliogr., 2009, 100, p. 386–413.
76. RAHIER, J. F., MOUTSCHEN, M., VAN GOMPEL, A. et al. Vaccinations in patients with immune-mediated inflammatory diseases. Rheumatology, 2010, 49, p. 1815–1827.
77. ROOS, J. C., OSTOR, A. J. Neurological complications of infliximab. J. Rheumatol., 2007, 34, 1, p. 236–237.
78. RYAN, C., LEONARDI, C. L., KRUEGER, J. G. et al. Association between biologic therapies for chronic plaque psoriasis and cardiovascular events. A meta-analysis of randomized controlled trials. JAMA, 2011, 306, p. 864–871.
79. SALMON-CERON, D., TUBACH, F., LORTHOLARY, O. et al. Drug-specific risk of non-tuberculosis opportunistic infections in patients receiving anti-TNF therapy reported to the 3-year prospective French RATIO registry. Ann. Rheum. Dis., 2011, 70, p. 616–623.
80. SANTOS-JUANES, J., COTO-SEGURA, P., MAS-VIDAL, A. et al. Ustekinumab induces rapid clearing of erythrodermic psoriasis after failure of antitumour necrosis factor therapies. Br. J. Dermatol., 2010, 162, p. 1144–1146.
81. SARACENO, R., SCHIPANI, C., MAZZOTTA, A. et al. Effect of anti-tumor necrosis factor-alpha therapies on body mass index in patients with psoriasis. Pharmacol. Res., 2008, 57, p. 290–295.
82. SMITH, C. H., ANSTEY, A. V., BARKER, J. N. et al. British Association of Dermatologists’ guidelines for biologic interventions for psoriasis 2009. Br. J. Dermatol., 2009, 161, p. 987–1019.
83. SOLOVIC, I., SESTER, M., GOMEZ-REINO, J. J. et al. The risk of tuberculosis related to tumour necrosis factor antagonist therapies: a TBNET consensus statement. Eur. Respir. J., 2010, 36, p. 925–949.
84. STROBER, B., BERGER, E., CATHER, J. et al. A series of critically challenging case scenarios in moderate to severe psoriasis: A Delphi consensus approach. J. Am. Acad. Dermatol., 2009, 61, p. S1–S46.
85. TAN, C. S., KORALNIK, I. J. Progressive multifocal leukoencephalopathy and other disorders caused by JC virus: clinical features and pathogenesis. Lancet Neurol., 2010, 9, 4, p. 425–437.
86. TRACEY, D., KLARESKOG, L., SASSO, E. H. Tumor necrosis factor antagonist mechanisms of action: A comprehensive review. Pharmacol. Ther., 2008, 117, p. 244–279.
87. VENCOVSKÝ, J. a výbor České revmatologické společnosti. Bezpečnost biologické léčby – doporučení České revmatologické společnosti. Čes. Revmatol., 2009, 17, s. 146–160.
88. VERSTAPPEN, S. M. M., KING, Y., WATSON, K. D. et al. Anti-TNF therapies and pregnancy: outcome of 130 pregnancies in the British Society for Rheumatology Biologics Register. Ann. Rheum. Dis., 2011, 70, p. 823–826.
89. VINET, E., PINEAU, C., GORDON, C. et al. Biologic therapy and pregnancy outcomes in women with rheumatic diseases. Arthritis Rheum., 2009, 15, 61, 5, p. 587–592.
90. WINTHROP, K. L., CALABRESE, L. H. Let the fog be lifted: screening for hepatitis B virus before biological therapy. Ann. Rheum. Dis., 2011, 70, p. 1701–1703.
91. WOLFE, F., MICHAUD, K. Biologic treatment of rheumatoid arthritis and the risk of malignancy: analyses from a large US observational study. Arthritis Rheum., 2007, 56, p. 2886–2895.
92. WU, S. AAD 69th Annual Meeting. Abstract P400. February, 2011.
93. Zápis z jednání Sekce pro tuberkulózu ČPFS dne 1. 12. 2005. Dostupné na www:
http://www.pneumologie.cz/zapisy/2005/sekce-TBC-20051201.php.
Štítky
Dermatológia Detská dermatológia
Článek Odborné akce v roce 2012Článek Syndrom Churgův-Straussové
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2012 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- Česká doporučení k biologické léčbě závažné chronické ložiskové psoriázy*
- Doškolování lékařů – Kontrolní test
- Syndrom Churgův-Straussové
-
Klinický případ:
Nažloutlé axilární ochlupení -
Morbus Bowen a spinocelulární karcinom:
dermatoskopické charakteristiky -
Zápis ze schůze výboru ČDS
konané dne 15. prosince 2011 - Zápisnica zo zasadnutia výboru SDVS
- Lokální léčba psoriázy I: psoriasis vulgaris. Doporučené postupy České dermatovenerologické společnosti
- Zpráva z 6. mezinárodního kongresu From Gene to Clinic
- Všechno nejlepší k devadesátinám
- Zevní komprese v terapii lymfedému. Standard léčebného plánu
- Odborné akce v roce 2012
- Andrologie – součást dermatovenerologie. Základy andrologického vyšetření
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Morbus Bowen a spinocelulární karcinom:
dermatoskopické charakteristiky -
Klinický případ:
Nažloutlé axilární ochlupení - Česká doporučení k biologické léčbě závažné chronické ložiskové psoriázy*
- Andrologie – součást dermatovenerologie. Základy andrologického vyšetření
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




