-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Latentná tuberkulózna infekcia a biologická liečba
Latent Tuberculosis Infection and Biological Therapy
Latent (subclinical) tuberculosis infection means tuberculosis mycobacteria harbor in the organism, but do not cause disease. Only about 10–15% of latently infected persons actually become ill with active tuberculosis. The transition to active disease is influenced by circumstances which weaken the immune system, especially the cellular immunity. This problem took on added importance today, when the number of patients treated with biological drugs increases. These patients are extremely susceptible to tuberculous disease. Latent tuberculosis infection is not diagnosed by conventional diagnostic methods. In the past only the tuberculin skin test was used for diagnosis. Currently we have two available immunoassays – IGRA (Interferon Gamma Release Assay) with higher sensitivity and specificity able to rule out false positives due to BCG vaccination, which may occur in the tuberculin skin test.
Keywords:
latent tuberculosis infection – biological therapy – IGRA tests
Autori: I. Solovič 1; Z. Klimentová 2
Pôsobisko autorov: Fakulta zdravotníctva Katolíckej univerzity, Ružomberok, NUTPCHaHCH Vyšné Hágy 1; Klinika pneumológie a ftizeológie SZU Bratislava 2
Vyšlo v časopise: Čes-slov Derm, 90, 2015, No. 3, p. 112-118
Kategória: Terapie, farmakologie a klinické studie
Súhrn
Latentná (subklinická) tuberkulózna infekcia znamená usídlenie tuberkulóznych mykobaktérií v organizme, ktoré však nevyvolávajú ochorenie. Len asi 10–15 % latentne infikovaných osôb skutočne ochorie na aktívnu tuberkulózu. Prechod do aktívneho ochorenia podporujú okolnosti organizmu spojené s oslabením imunitného systému, hlavne v oblasti bunkovej imunity. Tento problém nadobudol na závažnosti v súčasnosti, kedy pribúda pacientov liečených biologikami, ktoré môžu zvyšovať vnímavosť organizmu voči tuberkulóze. Latentná tuberkulózna infekcia sa nedá diagnostikovať bežnými diagnostickými prostriedkami. V minulosti sa používal na diagnostiku len tuberkulínový kožný test. V súčasnosti máme však už k dispozícii 2 imunologické testy – IGRA (Interferon Gama Release Assay), ktoré majú podstatne vyššiu senzitivitu aj špecificitu a je vylúčená falošná pozitivita v dôsledku BCG vakcinácie, ktorá môže nastať pri tuberkulínovom kožnom teste.
Kľúčové slová:
latentná tuberkulózna infekcia – biologická liečba – IGRA testyÚVOD
Tuberkulóza je granulomatózne ochorenie, ktoré zapríčiňuje Mycobacterium tuberculosis. U väčšiny ľudí s predpokladanou infekciou M. tuberculosis sa vzhľadom na dobrý imunitný systém hostiteľa tuberkulóza nikdy nevyvinie. Latentná (subklinická) tuberkulózna (TBC) infekcia vzniká po usídlení tuberkulóznych bacilov v exponovanom hostiteľovi. Charakterizuje ju vytvorenie špecifických obranných mechanizmov, ktoré zabraňujú množeniu usídlených a prežívajúcich tuberkulóznych bacilov. Prebieha asymptomaticky a nie je detekovateľná obvyklými diagnostickými metódami, neexistuje tzv. zlatý štandard, t.j. metóda, ktorá by ju spoľahlivo identifikovala. Jediným dôkazom expozície a usídlenia tuberkulóznych bacilov je imunobiologická prestavba organizmu hostiteľa [1, 2].
Najčastejšou bránou vstupu Mycobacterium (M.) tuberculosis (TBC) sú dýchacie cesty (DC), kde prvú obrannú bariéru zabezpečujú mechanizmy špecifickej aj nešpecifickej imunity. Epitelové štruktúry dolných DC zabezpečujú tvorbou hlienu samoočisťovanie týchto povrchov. Prípadné adherujúce M. tuberculosis sú pohltené alveolovými makrofágmi. K účinnému vnútrobunkovému zabíjaniu mykobaktérií v makrofágoch je však nutná kooperácia medzi špecifickou T-bunkovou imunitou a makrofágmi. Protilátková odpoveď pravdepodobne nezohráva protektívnu úlohu v obrane proti M. tuberculosis.
Biologické vlastnosti mykobaktérií vo vzťahu k imunitnému systému sú určované hlavne povrchovými baktériovými štruktúrami [2]. Imunitná odpoveď na infekciu M. tuberculosis má svoje špecifiká. Je spôsobená hlavne unikátnym zložením buniek mykobaktérií. Imunogénne látky, ktoré sú lokalizované v cytoplazme, ako aj v povrchových štruktúrach, sa uvoľňujú vo veľkom množstve v priebehu bunkovej proliferácie.
V krajinách s vysokou prevalenciou tuberkulózy sa kontrola TBC sústreďuje predovšetkým na vyhľadávanie chorých a zbavenie ich infekčnosti účinnou liečbou. V krajinách, kde sa množstvo infekčných zdrojov už podarilo znížiť (krajiny s nízkou a strednou prevalenciou tuberkulózy, ku ktorým patríme aj my), sa v súčasnosti venuje čoraz väčšia pozornosť vyhľadávaniu latentnej tuberkulóznej infekcie (LTBI), pretože je ďalším zdrojom tuberkulóznej infekcie. Latentná tuberkulózná infekcia postihuje 1/3 ľudstva, a ak sa nediagnostikuje a nelieči, (preventívna chemoterapia) môže neskôr prejsť do aktívnej choroby (cca 10–15 %), a to kedykoľvek v priebehu života ( z toho cca 50 % do 5 rokov po iniciálnej infekcii). Riziko sa zvýši, ak sa pridruží komorbidita, ktorá oslabuje imunitný systém. Preventívnou liečbou latentnej infekcie je možné znížiť počet ochorení na tuberkulózu, a tak zabrániť ďalšiemu šíreniu tuberkulóznej infekcie v populácii [5].
DIAGNOSTIKA LATENTNEJ TUBERKULÓZNEJ INFEKCIE
Doteraz jediným spôsobom detekcie latentnej tuberkulóznej infekcie bola prítomnosť precitlivenosti oneskoreného typu (IV. typu), ktorú možno in vivo dokázať kožnou tuberkulínovou skúškou (TST). Objaviteľ pôvodcu tuberkulózy Róbert Koch pripravil v roku 1890 koncentrovaný filtrát z usmrtených tuberkulóznych bacilov nazvaný tuberkulín. Tuberkulín i po mnohých technologických úpravách, je stále polyvalentnou zmesou proteínov a proteínových fragmentov, z ktorých len niektoré sú špecifické pre M. tuberculosis complex (t. j. komplex mykobaktérií vyvolávajúcich tuberkulózu: M. tuberculosis, M. bovis a M. africanum), ale väčšina z nich je spoločná s podmienene patogénnymi mykobaktériami (PPM), resp. BCG kmeňmi. Tuberkulín vyvolá za 72 hodín po vpichu intradermálne špecifický kožný zápal a induráciu, ktorá vzniká lokálnym nahromadením buniek senzibilizovaných mykobakteriálnymi antigénmi (po predchádzajúcej expozícii a usídlení mykobaktérií).
Tuberkulínová skúška má mnohé nevýhody a obmedzenia. Interpretácia je totiž sťažená u osôb s postvakcinačnou imunitou po BCG vakcinácii. Má teda nízku špecifickosť (falošne pozitívny po BCG vakcinácii a infekcii PPM), ale aj nízku senzitívnosť (falošne negatívny po prekonaní vírusovej infekcie, po očkovaní živou vírusovou vakcínou, pri imunosupresii aj liekmi navodenej, infekcii HIV, ale aj paradoxne u pacientov s miliárnou TBC a rozsiahlymi formami tuberkulózy, ktoré práve tuberkulózna infekcia relatívne imunokompromituje a imunokompetentné bunky sú sústredené v mieste infekcie.
Problémom môže byť aj fenomén booster – vzostup veľkosti reakcie pri opakovanom testovaní, ktorý je spôsobený senzibilizáciou na intradermálne aplikované mykobaktériové antigény, spôsobenou opakovaným testovaním. V tomto prípade sa nejedná o konverziu tuberkulínovou skúškou [5].
Využitím najnovších poznatkov z imunológie a molekulovej biológie a genetiky je v súčasnosti možné okrem tuberkulínovej skúšky požiť aj nové sérologické ex vivo testy, tzv. IGRA (Interferon Gama Release Assay) testy na diagnostiku hlavne latentnej TBC infekcie. Nakoľko je už dávnejšie známy genóm M. tuberculosis, bolo možné syntetizovať peptidové antigény – stimulujúci sekrečný antigén ESAT-6 (early secretory antigenic target-6), proteínový filtrát CFP-10 (culture fibrate protein –10), ako aj a TB7.7 (p4), ktoré sa nachádzajú len v M. tuberculosis, M. bovis, M. africanum, M. szulgai, M. marinum. Nie sú prítomné v M. BCG bovis a iných netuberkulóznych mykobaktériách (M. avium complex, atď.). Testy využívajú skutočnosť, že jedinci infikovaní M. tuberculosis complex, ev. M. kansasii, M. marinum a M. szulgai, majú v krvi senzibilizované T-lymfocyty. Ak sú tieto lymfocyty vystavené účinku vyššie uvedených antigénov, uvoľňujú efektorové T-lymfocyty cytokín interferón-γ (IFN-γ). Už dávnejšie sa zistilo, že stimulácia a pomnožovanie efektorových T-lymfocytov vyžaduje trvalú prítomnosť mykobaktériových antigénov. Ak sú tieto antigény odstránené vlastnou obranou organizmu, alebo účinnou liečbou antituberkulotikami, väčšina efektorových buniek podľahne apoptóze a prežívajú len pamäťové T-bunky, ktorých je len 10 %. Navyše efektorové T-lymfocyty produkujú IFN-γ už behom niekoľkohodinovej stimulácie, ale pamäťové bunky až po dostatočnej diferenciácii, trvajúcej viac ako 24 hodín.
V súčasnosti máme u nás k dispozícii 2 druhy IGRA testov: QuantiFERON TB-Gold In-Tube test (vyrábaný firmou Cellestis, Victoria, Australia) a T-SPOT.TB test (Oxford, Immunotec, Veľká Británia) [1, 4, 5]. Pri T-SPOT.TB teste sa z odobratej periférnej krvi najskôr separujú mononukleárne bunky, inkubujú sa s antigénmi (ESAT-6 a CFP-10) a následne sa zisťuje počet buniek, ktoré produkujú IFN-γ metódou ELISPOT, test využíva aj pozitívnu kontrolu, kde sa lymfocyty inkubujú spolu s mitogénom (fytohemaglutinín) a negatívnu kontrolu s fyziologickým roztokom [6].
QuantiFERON TB-Gold In-Tube test sa používa na Slovensku cca od r. 2006. Pri tomto teste sa odoberie periférna krv do 3 špeciálnych skúmaviek, v jednej sú antigény M. tuberculosis (ESAT-6, CFP-10 a TB 7,7), v druhej je mitogén – t. j. pozitívna kontrola, tretia označená ako NIL – negatívna kontrola s fyziologickým roztokom. Množstvo produkovaného IFN-γ sa stanovuje pomocou testu ELISA [8].
Prítomnosť pozitívnej kontroly testov je dôležitá preto, že niektorí jedinci nemajú v krvi dostatok suficientných lymfocytov, alebo imunosupresívnou liečbou majú oslabenú IFN-γ odpoveď T-lymfocytov na stimuláciu antigénmi, majú potom nízku koncentráciu IFN-γ v skúmavke s mitogénom a potom výsledok testu je vyhodnotený ako neurčitý a ak pri negatívnej kontrole sa zistí vysoká koncentrácia IFN-γ v krvi pred stimuláciou rovnako sa výsledok vyhodnotí ak neurčitý.
Pri odbere krvi na QuantiFERON TB-Gold In-Tube test je dôležité správne načasovanie od aplikácie tuberkulínu, nakoľko po aplikácii tuberkulínového testu stúpa koncentráciu špecifického IFN-γ po 48 hodinách s maximom v 1.–5. týždni. Odber krvi na QuantiFERON by sa mal uskutočniť najneskôr v deň odčítania TST, aby test nestratil výpovednú hodnotu. Pri T-SPOT.TB teste sa nedokázalo ovplyvnenie výsledku aplikáciou tuberkulínu. Senzitívnosť aj špecifickosť IGRA testov je pri latentnej tuberkulóznej infekcii ťažké vyhodnotiť, nakoľko neexistuje ten tzv. zlatý štandard, t. j. metóda, ktorá na 100 % deteguje latentnú tuberkulóznu infekciu, a tieto testy detegujú len imunologickú odpoveď na mykobaktériový antigén, nie mykobaktérie samotné. Senzitívnosť testu bola testovaná u osôb s aktívnou tuberkulózou potvrdenou bakteriologicky, ktorí boli liečení menej ako 1 týždeň antituberkulotikami a špecifickosť bola vyhodnocovaná na súboroch BCG-vakcinovaných pacientov v krajinách s nízkym výskytom tuberkulóznej infekcie. Senzitívnosť v štúdiách sa pohybuje okolo 80 % a špecifickosť vyše 90 % [8, 11].
Na identifikáciu latentných foriem TBC bol medzinárodne prijatý konsenzus vyšetrovať v krajinách, kde je populácia BCG vakcinovaná okrem štandardných diagnostických postupov (klinické vyšetrenie, RTG, bakteriologické vyšetrenie, tuberkulínový test) aj imunologické vyšetrenie IGRA.
Tento test je indikovaný:
- a) u každého pacienta počas biologickej liečby hlavne preparátmi anti-TNF alfa a antagonistami IL12 a IL23,
- b) u zdravotníckych pracovníkov vystavených otvoreným formám tuberkulózy,
- c) pri návrate vojakov pôsobiacich na misiách v krajinách s vysokou prevalenciou tuberkulózy,
- d) pri vyšetrení rizikových skupín obyvateľstva pri podozrení na výskyt tuberkulózy (obyvatelia žijúci v oblastiach s vysokým výskytom tuberkulózy),
- e) v rámci diferenciálnej diagnostiky pri pľúcnej a mimopľúcnej tuberkulóze,
- f) opakovane raz ročne u pacientov dlhodobo liečených preparátmi anti-TNF alfa a antagonistami IL12 a IL23,
- g) kontakty (osoby, ktoré boli v styku s pacientom s aktívnou formou pľúcnej a mimopľúcnej tuberkulózy) [8].
Klinické pozorovania aj vedecké výskumy opakovane a konzistentne potvrdzujú, že tuberkulínová skúška v subpopulácii imunodeficientných pacientov a/alebo BCG vakcinovaných pacientov má menší diagnostický význam a nižšiu výpovednú hodnotu, ako IGRA test. BCG vakcinácia v detskom veku vedie ku konverzii tuberkulínovej skúšky, ale intenzita kožnej reakcie rokmi klesá. Keďže neexistujú žiadne štúdie, ktoré by dokazovali vzťah medzi stupňom ochrany pred tuberkulóznou infekciou a veľkosťou indurácie pri TST a pozitivita tuberkulínovej skúšky nedokáže rozlíšiť medzi reakciou na BCG (vakcináciu) alebo na infekciu divým kmeňom či odlíšiť booster efekt od vzplanutia LTBI.
Britská hrudníková spoločnosť neodporúča tuberkulínový test u imunodeficientných pacientov ako diagnostický test LTBI vzhľadom na vysoké riziko falošne negatívnych výsledkov. Tiež varuje, že predchádzajúca vakcinácia BCG môže byť zodpovedná za falošne pozitívne výsledky tuberkulínovej skúšky [5]. Vo Švajčiarsku sa v diagnostike aktivácie LTBI tiež uprednostňujú IGRA testy pred tuberkulínovým testom. V súčasnosti sú v Európe dostupné spomínané 2 typy týchto ex vivo IGRA testov. Oba testy sú svojou senzitívnosťou a špecifickosťou v zdravej populácii porovnateľné, ale v populácii imunodeficientných pacientov sa presnejšie výsledky získavajú QuantiFERON® TB Gold Testom. Tieto testy sú viac špecifické ako tuberkulínová skúška, pretože ich neovplyvňuje predchádzajúca vakcinácia BCG ani kontakt s atypickými mykobaktériami, môžu sa opakovať bez rizika booster efektu a majú menej falošne negatívnych výsledkov. Pozitívny výsledok IGRA testu je vždy pozitívny a nemôže byť spochybňovaný a považovaný za „falošne pozitívny“. Podobné úvahy u pacientov na biologickej liečbe mali v minulosti fatálne následky. Výhodou IGRA testov je ich pozitivita pri LTBI aj vtedy, ak je tuberkulínová skúška negatívna [11].
BIOLOGICKÁ LIEČBA A TUBERKULÓZA
Monoklonálne protilátky proti faktoru nádorovej nekrózy (TNF) alebo solubilný TNF viažuci receptor sa stali neoceniteľnou liečbou chronických zápalových ochorení, ako sú reumatoidná artritída, zápalové ochorenie čreva a psoriáza. Jedným z kľúčových cytokínov v imunitnej odpovedi na infekciu M. tuberculosis je TNF, ktorý má kľúčový význam najmä pre integritu granulómu. Pacienti, liečení TNF-antagonistami, majú zvýšené riziko reaktivácie latentných infekcií, najmä tuberkulózy. Relatívne riziko vzniku tuberkulózy stúpa po liečbe TNF-antagonistami až 25-násobne, podľa klinického prostredia a použitého TNF-antagonistu. Po aplikácii anti TNF alfa liečby dochádza k „rozpúšťaniu obranného valu“ vytvoreného práve TNF alfa.
Väčšina prípadov tuberkulózy, ktoré súvisia s biologickou liečbou, sa objaví v krátkom časovom odstupe od začiatku liečby a reaktivácia latentnej tuberkulóznej infekcie sa vyznačuje rýchlou progresiou. U všetkých pacientov s perzistujúcou špecifickou imunitnou odpoveďou na M. tuberculosis, ktorí sa podrobujú liečbe TNF antagonistami, sa odporúča následná cielená preventívna chemoterapia, ktorá významne znižuje riziko progresie do tuberkulózy.
V prípade pacientov liečených antagonistami IL12 a IL23 je riziko reaktivácie latentnej tuberkulóznej nízke, doteraz neboli popisované štúdie o jej výskyte, avšak nedá sa vylúčiť, a preto z bezpečnostných dôvodov pre pacienta sa odporúča postupovať aj pri tomto lieku ako pri prípravkoch zo skupiny TNF antagonistov. Mykobaktériové infekcie neboli hlásené u pacientov liečených ustekinumabom, títo pacienti sú bez reaktivácie latentnej tuberkulóznej infekcie pri preventívnej chemoterapii INH [3, 4, 5, 9, 13].
Obr. 1. Úloha TNF v antibakteriálnej a zápalovej odpovedi na infekciu vyvolanú Mycobacterium tuberculosis 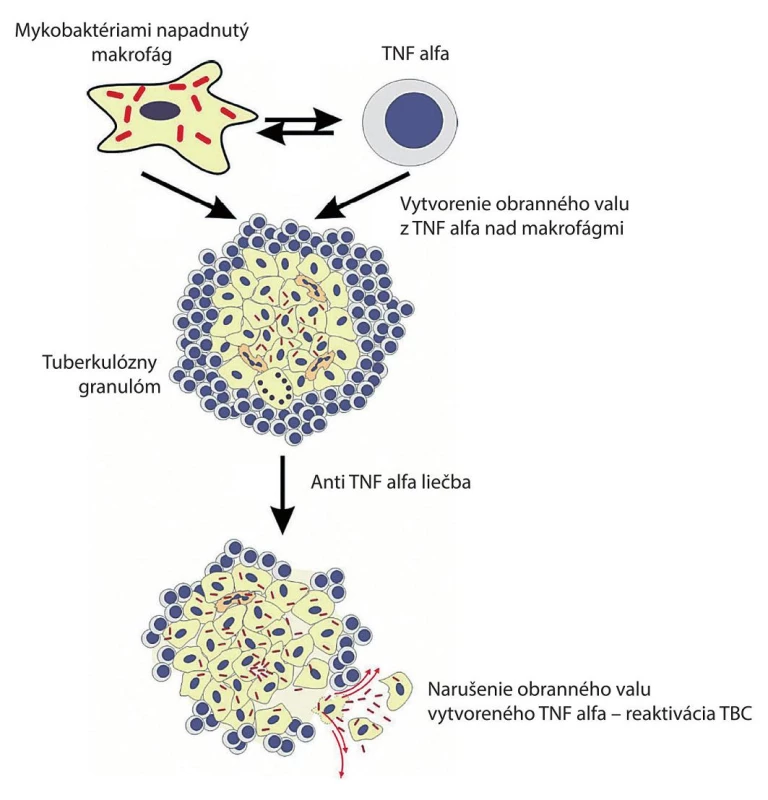
Tab. 1. Vplyv TNF antagonizmu a IL-12/Il-23 antagonizmu na vrodenú a získanú imunitu 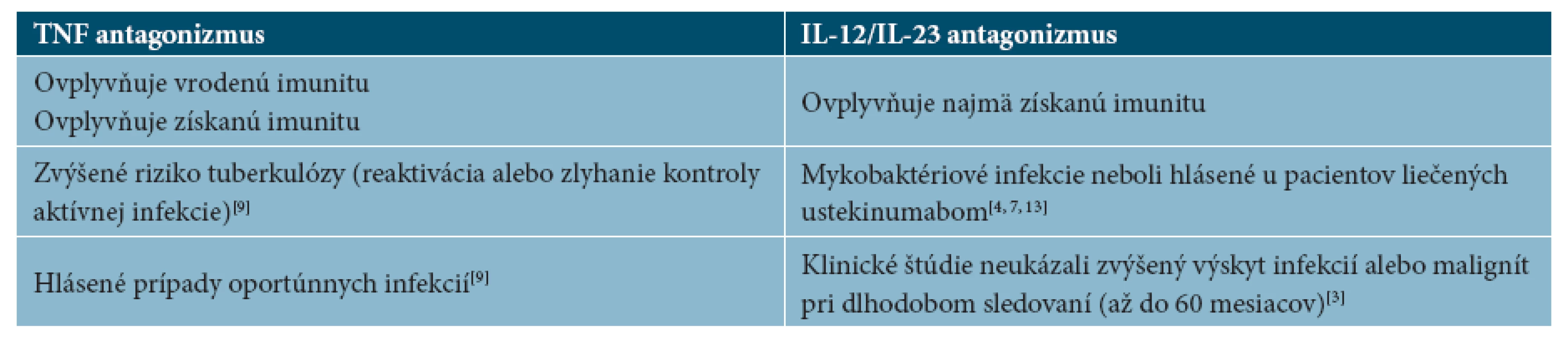
Odporúča sa, aby všetci pacienti, u ktorých sa plánuje liečba TNF antagonistami a inhibítormi IL-12 a IL-23, boli vyšetrení pre možnú latentnú tuberkulóznu infekciu, a to pomocou IGRA testu, prípadne pomocou kožného tuberkulínového testu u pacientov, ktorí neboli v minulosti očkovaní proti tuberkulóze (BCG vakcinácia).
Typy biologík, pri ktorých podávaní je nutná pneumoftizeologická dispenzarizácia:
- Anti TNF alfa
adalimumab – Humira
certolizumab –Cimzia
etanercept – Enbrel
golimumab – Simponi
infliximab – Remicade
- Inhibítory IL-12 a IL-23
ustekinumab – Stelara
U väčšiny ľudí s predpokladanou infekciou M. tuberculosis sa vzhľadom na dobrý imunitný systém hostiteľa tuberkulóza nikdy nevyvinie. Blokáda TNF ovplyvní široké spektrum imunitných funkcií - tak vrodenú imunitu vrátane kaskády septického šoku, ako aj získanú imunitu vrátane dráh Th1 a Th17. Blokáda p40 (IL-12 a IL-23) ovplyvní najmä Th1 a Th17 dráhu získanej imunity (3,13).
Obr. 2. Selektívnosť účinku biologických liekov 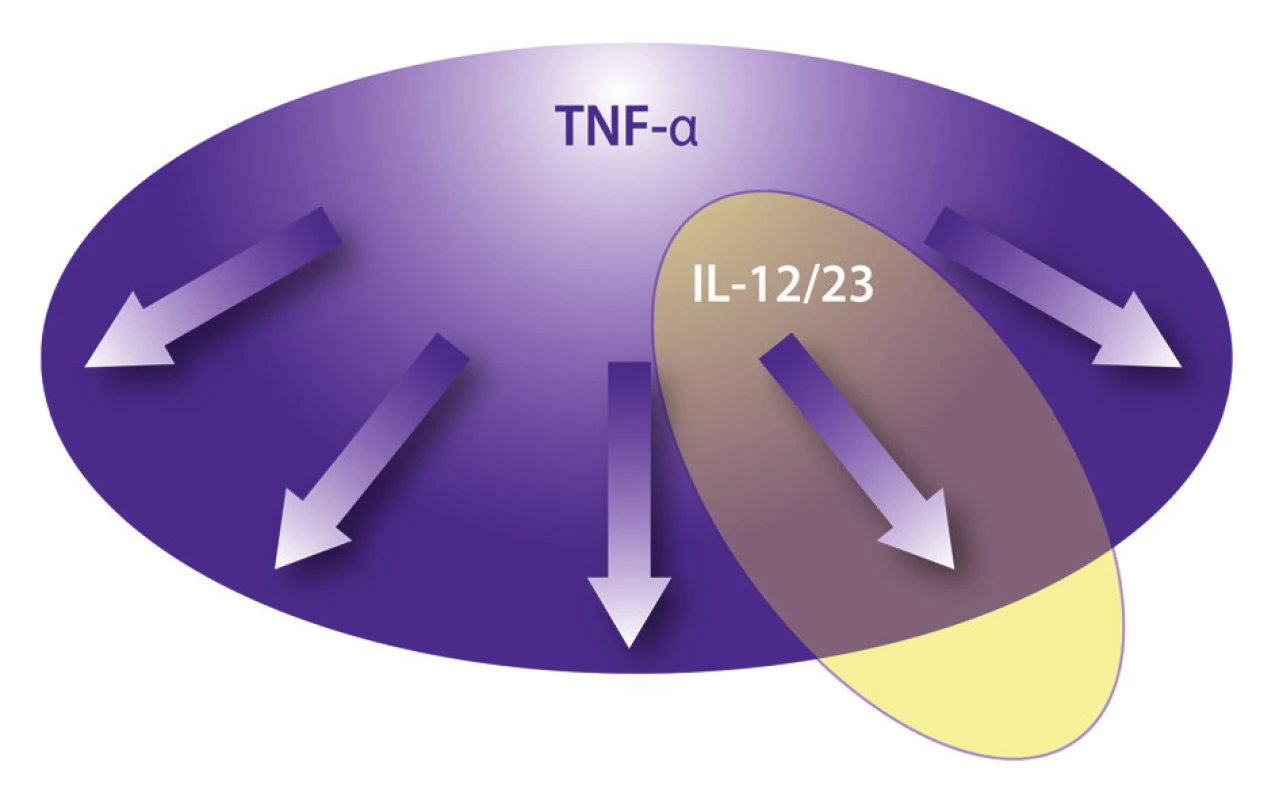
PRAKTICKÉ ODPORÚČANIA PRE KLINICKÚ PRAX
1. Ktoré osoby by sa mali vyšetrovať na latentnú tuberkulóznu infekciu pred liečbou monoklonálnymi protilátkami proti TNF, inhibítormi IL 12a 23, resp. protilátkami proti ľudskému IL-1beta?
„Všetci“
Všetci kandidáti na liečbu by mali byť vyšetrení na prítomnosť špecifickej imunitnej odpovede na M. tuberculosis, najlepším ukazovateľom latentnej tuberkulóznej infekcie. (Úroveň dôkazu C.)
U všetkých kandidátov na liečbu by sa malo v anamnéze pátrať po tuberkulóze alebo kontakte s tuberkulózou a mali by mať urobený röntgen hrudníka na dôkaz prípadnej prekonanej alebo aktívnej tuberkulózy [12].
2. Mala by sa preventívna liečba tuberkulózy odporúčať u všetkých kandidátov so špecifickou imunitnou odpoveďou na M. tuberculosis, ktorí sa podrobujú biologickej liečbe?
„ÁNO“
V prípade dôkazu latentnej tuberkulóznej infekcie by sa mala preventívna chemoterapia tuberkulózy podávať všetkým pacientom pred nasadením liečby, vrátane pacientov, ktorí dostávajú etanercept. U pacientov s možnosťou podania liečby antagonistu Il-12/IL-23 ako prvej voľby je vhodné zvážiť túto alternatívu u pacientov, ktorí pochádzajú z „rizikového prostredia“ (výskyt TBC v rodine, v komunite, kontakt s aktívnou TBC) [12].
3. Odporúčajú sa rôzne postupy pri rozdielnych základných ochoreniach (reumatoidná artritída, psoriáza, zápalová choroba čreva)?
„Nie“
Skríning na latentnú infekciu a preventívna chemoterapia tuberkulózy by sa nemali líšiť u pacientov s rôznymi základnými ochoreniami (reumatoidná artritída, psoriáza, zápalová choroba čreva), u ktorých sa plánuje liečba biologikami [12].
4. Má sa latentná tuberkulózna infekcia diagnostikovať na základe tuberkulínového testu alebo IGRA testu alebo oboch?
Vo všeobecnosti sa v zisťovaní antimykobakteriálnej odpovede u osôb s imunodeficienciou považuje IGRA test za spoľahlivejší ako tuberkulínový test. Okrem toho mitogénové kontroly v IGRA teste majú výhodu pred tuberkulínovým testom, pretože sa dajú použiť na rozlíšenie medzi anergiou a ozajstnou negatívnou špecifickou imunitnou odpoveďou.
Pre diagnostiku špecifickej imunitnej odpovede na M. tuberculosis (latentnej tuberkulóznej infekcie) navrhujú odborníci použiť QuantiFERON TB Gold test alebo TSPOT. TB test, prípadne ako alternatívu kožný tuberkulínový test u osôb, ktoré neboli nikdy očkované proti tuberkulóze.
Okrem toho v pediatrickej praxi sa odporúča súčasné použitie všetkých troch diagnostických metód – tuberkulínového kožného testu, IGRA testu a röntgenu hrudníka, pričom pozitivitu ktoréhokoľvek výsledku brať ako dôkaz latentnej infekcie, po vylúčení aktívnej tuberkulózy. Ak sú však negatívne, samy osebe majú len slabú prediktívnu hodnotu [12].
5. Ak sa na diagnostiku latentnej tuberkulínovej infekcie použije IGRA test pred začatím liečby TNF-antagonistami, dáva sa v tejto konkrétnej situácii prednosť testu QuantiFERON TB Gold in-tube alebo TSPOT.TB?
Aj keď pri diagnostike špecifickej imunitnej odpovede na M. tuberculosis (latentnej tuberkulóznej infekcie) u pacientov so závažnou imunodeficienciou existujú dôkazy o vyššej senzitivite T-SPOT.TB testu v porovnaní s testom QuantiFERON TB Gold in-tube, súčasné klinické dôkazy z prierezových a kohortových štúdií, vrátane pacientov, ktorí dostávajú liečbu TNF-antagonistami, nedávajú jasne prednosť jednému testu pred druhým.
Oba testy sa presadzujú v diagnostike latentnej infekcie pred začatím liečby TNF antagonistami a antagonistu IL-12/IL-23 [12].
6. Ako sa treba rozhodnúť, keď vyšetrenie latentnej infekcie pred začatím liečby ukáže nesúhlasné výsledky (napr. pozitívny tuberkulínový test a negatívny IGRA test)?
Pri interpretácii výsledkov testov by sa mali brať do úvahy anamnéza pacienta, jeho pôvod a stav BCG vakcinácie.
IGRA testy by sa mali uprednostňovať pred kožným tuberkulínovým testom u osôb s BCG vakcináciou v anamnéze vždy, keď je to možné.
U osôb bez predchádzajúcej BCG vakcinácie by jeden pozitívny výsledok testu (buď tuberkulínového alebo IGRA testu) mal stačiť na to, aby mal pacient nárok na preventívnu liečbu [12].
7. Kedy sa môže začať liečba biologikami po začatí preventívnej chemoterapie?
„Za 4 týždne“
Po začatí preventívnej chemoterapie sa 4 týždne považujú za bezpečné pre nasadenie liečby [12].
8. Ktorý režim preventívnej chemoterapie je najúčinnejší v redukcii rizika tuberkulózy u osôb so špecifickou imunitnou odpoveďou na M. tuberculosis, ktoré dostávajú liečbu TNF antagonistami a antagonistami Il-12/IL-23?
Najlepší klinický dôkaz o účinnosti svedčí pre voľbu medzi dvoma režimami preventívnej liečby:
- isoniazid po dobu 6–9 mesiacov alebo isoniazid plus rifampicin po dobu 3 mesiacov.
Účinnosť oboch režimov prekračuje 90 % [12].
9. Ako sa majú sledovať pacienti, ktorí začali preventívnu chemoterapiu, najmä v súvislosti so začatím liečby TNF-antagonistami a antagonistami Il-12/IL-23?
Pacienti by mali byť informovaní o včasných príznakoch a prejavoch tuberkulózy a o možných nežiaducich účinkoch liekov, používaných v preventívnej liečbe.
Kontrolný röntgen hrudníka je indikovaný aj u asymptomatických osôb s preventívnou chemoterapiou. V prípadoch pochybností treba urobiť CT vyšetrenie hrudníka. Toto vyšetrenie je v detekcii včasných rádiologických zmien pri aktívnej tuberkulóze jednoznačnejšie ako röntgen hrudníka.
Pred nasadením preventívnej chemoterapie treba vyšetriť hladinu pečeňových enzýmov v krvi a kontrolovať ich každé 3–4 týždne počas liečby, a navyše ešte aj vtedy, ak sa u pacienta objavia nejaké príznaky.
Odporúčané je opakované vyšetrenie na latentnú tuberkulóznu infekciu (každý rok) ale neodporúča sa použiť tuberkulínový test, pretože výsledky môžu byť ovplyvnené booster efektom [12].
10. Kedy sa má začať liečba s TNF-antagonistami a antagonistami Il-12/IL-23 (ak je indikovaná) u pacientov s aktívnou tuberkulózou?
Optimálny čas pre začatie liečby TNF-antagonistami a antagonistami Il-12/IL-23 u osôb, ktoré sú liečené pre aktívnu tuberkulózu, nie je celkom jasný.
Odborníci väčšinou odporúčajú začať liečbu TNF-antagonistami a antagonistami Il-12/IL-23 po ukončení celého priebehu antituberkulóznej liečby podľa medzinárodných štandardov [12].
11. Majú pacienti s primerane preliečenou tuberkulózou zvýšené riziko reaktivácie tuberkulózy pri liečbe biologikami?
„NIE“
Zdá sa, že pacienti, ktorí absolvovali primeranú liečbu pre tuberkulózu, nemajú po nasadení liečby zvýšené riziko tuberkulózy [12].
V súčasnosti sa preventívna chemoterapia neodporúča u pacientov s pozitívnou špecifickou imunitnou odpoveďou na M. tuberculosis, ktorí boli v minulosti primerane liečení pre tuberkulózu, a teraz majú dostať liečbu biologikami, pokiaľ nie je u nich podozrenie na reinfekciu M. tuberculosis.
12. Aké je optimálne trvanie antituberkulóznej chemoterapie u pacientov, u ktorých sa vyvinula tuberkulóza v súvislosti s liečbou?
Optimálne trvanie antituberkulóznej liečby u pacientov, u ktorých sa vyvinula tuberkulóza v súvislosti a liečbou biologikami nie je stanovené.
Neexistuje dôkaz o tom, že sa antituberkulózna liečba musí predĺžiť, ak tuberkulóza vznikla v súvislosti s liečbou [12].
13. Ak bol pacient už jedenkrát preliečený preventívnou chemoterapiou pred biologickou liečbou alebo počas biologickej liečby, má sa opakovať raz ročne IGRA test a čo robiť v prípade opakovanej pozitivity?
Opakovaná realizácia IGRA testu po ukončení preventívnej chemoterapie nie je indikovaná a už sa neodporúča kontrola IGRA testu jedenkrát ročne. Pozitivita môže pretrvávať dlhodobo [14, 15].
14. Treba prerušiť biologickú liečbu u pacienta, ak pri kontrolnom vyšetrení došlo ku konverzii IGRAtestu ale RTG nález, klinický nález je negatívny?
Biologickú liečbu nie je nutné prerušiť, odporúča sa iba pridať preventívnu chemoterapiu LTBI, ktorá môže byť podávaná súčasne s biologickou liečbou [14, 15].
15. Ako postupovať po preliečení aktívnej tuberkulózy, resp. pri zvažovaní zámeny biologického lieku?
Ak bol pacient preliečený pre aktívnu TBC, resp. zvažuje sa zámena biologického lieku u pacientov s možnosťou podania liečby antagonistu Il-12/IL-23 ako prvej voľby je vhodné zvážiť túto alternatívu. V prípade pacientov liečených antagonistami IL12 a IL23 je riziko reaktivácie latentnej tuberkulóznej nízke, doteraz neboli popisované štúdie o jej výskyte. Mykobaktériové infekcie neboli hlásené u pacientov liečených ustekinumabom, títo pacienti sú bez reaktivácie latentnej tuberkulóznej infekcie pri preventívnej chemoterapii INH [3, 4, 7, 9, 13].
ZÁVER
Pre klinika je dôležité, že infekcia M. tuberculosis vedie u 10–30 % ľudí k infekcii a len u 10 % nakazených ku klinicky zjavnej chorobe. Ostáva nám teda isté percento latentne infikovaných ľudí. Aby sme predišli neskoršej reaktivácii choroby, a teda následnému nárastu nových prípadov TBC spojených so zbytočným úmrtím, ako aj výskytu vzniku TBC rezistentnej na lieky, je potrebné aktívne vyhľadávanie týchto latentne infikovaných. V dnešnej dobe, správnou, rýchlou a účelnou diagnostikou, s následne adekvátnou a efektívnou liečbou možno zabrániť progresii vzniku aktívnej TBC, a ďalšiemu šíreniu choroby [12, 15, 16].
Do redakce došlo dne 27. 2. 2015.
Adresa pro korespondenci:
Doc. MUDr. Ivan Solovič, CSc.
konzultant WHO pre TBC
primár I. oddelenia pneumoftizeológie
Národný ústav tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie
059 84 Vyšné Hágy
Slovenská republika
e-mail: solovic@hagy.sk
Zdroje
1. FERRARA, G., LOSI, M., MEACCI, M. Routine Hospital Use of a New Commercial Whole Blood Interferon γ Assay for the Diagnosis of Tuberculosis Infection. Am. J. resp. crit. Care Med., 172, 2005, 1, p. 631–635.
2. JENSEN, P. A., LAMBERT, L. A., IADEMARCO, M. F., RIDZON, R.: CDC. Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care settings, 2005. MMWR Recomm. Rep., 2005, 54, s. 1–141.
3. KIMBAL, A. B. et al.: Long-term efficacy and safety of ustekinumab in patients with moderate to severe psoriasis through 5 years of follow-up: results from the PHOENIX 1 long-term extension. Br. J. Dermatol., 2012; 167 (suppl.1), p. 63–64.
4. LEONARDI, C. L., KIMBALL, A. B., PAPP, K. A. et al. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1). Lancet, 2008, 371, p. 1665–1674.
5. MACK, U., MIGLIORI, G. B., SESTER, M. et al. LTBI – latent tuberculosis infection or lasting immune response to M. tuberculosis? A TB NET consensus statement. Eur. Respir. J., 33, 2009, 5, p. 956–973.
6. MAZUREK, G. H., JEREB, J., LOBUE, P. et al. Division of Tuberculosis Elimination, National Center for HIV, STD, and TB Prevention, Centers for Disease Control and Prevention (CDC). Guidelines for using the QuantiFERON-TB Gold test for detecting Mycobacterium tuberculosis infection,United States. MMWR Recomm. Rep., 2005, 54, p. 49–55.
7. PAPP, K. A., LANGLEY, R. G., LEBWOHL, M. et al. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 52-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 2). Lancet, 2008, 371, p. 1675–16.84
8. ROZBORILOVÁ, E., SOLOVIČ, I., CHOVAN, L. Metodické odporúčanie hlavného odborníka na vyšetrovanie Quantiferon TB Goldtestu u pacientov liečených biologickou liečbou. 2007, s. 10. (http://spfs.cme.sk/sz/content/545-31816/metodicke-odporucanie-hlavneho-odbornika-mz-sr-pre-odbor-pneumologia-a-ftizeologia-na-vysetrovanie-q.html).
9. SCOTT, D. L., KINGSLEY, G. H. Tumor necrosis factor inhibitors for rheumatoid arthritis. N. Engl. J. Med., 2006, Aug 17, 355 (7), p. 704–712.
10. SOLOVIČ, I.: Nová diagnostická metóda na vyšetrenie latentnej ako aj aktívnej tuberkulóznej infekcie: Interferon γ release assay – IGRA. Stud. Pneumol. Phtiseol., 2006, 66, s. 221–222.
11. SOLOVIČ, I. Spoločné vyhlásenie TBNET – Riziko vzniku tuberkulózy pri liečbe TNF antagonistami. Stud. Pneumol. Phtiseol., 71, 2011, 1, s. 15–21.
12. SOLOVIČ, I., SESTER, M., GOMEZ-REINO, J. J. et al. The risk of tuberculosis related to tumour necrosis factor antagonist therapies: a TBNET consensus statement. Eur. Respir. J., 2010, 36, s. 1185–1206.
13. TSAI, T. F., HO, V., SONG, M. et. al. The safety of ustekinumab treatment in patients with moderate-to-severe psoriasis and latent tuberculosis infection. Br. J. Dermatol., 2012, Nov;167 (5), p. 1145–1152.
14. TRNKA, L., WALLENFELS, J. Latentní tuberkulózní infekce, její význam v kontrole tuberkulózy v zemích s hromadnou BCG vakciinací. Stud. Pneumol. Phtiseol., 2006, 66, s.196–202.
15. UK National Institute for Health and Clinical Excellence (NICE) Tuberculosis. Clinical diagnosis and management of tuberculosis and measures for its prevention and control. Clinical Guideline, 33, 2006, s. 51 (www.nice.org.uk/CG033).
16. WHO Guidelines on the management of latent tuberculosis infection. ISBN: 978 92 4 154890 WHO reference number: WHO/HTM/TB/2015.01, 2014, s. 38.
Štítky
Dermatológia Detská dermatológia
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2015 Číslo 3- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
-
DOŠKOLOVÁNÍ LÉKAŘŮ
KONTROLNÍ TEST - Latentná tuberkulózna infekcia a biologická liečba
- Agminátní histiocytomy
- Pinkusův fibroepitelióm
- Klinický případ: erytém glans penis
-
Zápis ze schůze výboru ČDS
konané dne 19. března 2015 -
Zápis ze schůze výboru ČDS
konané dne 23. dubna 2015 v Praze - Setkání Center biologické léčby psoriázy
- Odborné akce v roce 2015
- Neurofibromatóza z pohledu dermatologa
-
DOŠKOLOVÁNÍ LÉKAŘŮ
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Neurofibromatóza z pohledu dermatologa
- Klinický případ: erytém glans penis
- Latentná tuberkulózna infekcia a biologická liečba
- Agminátní histiocytomy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy