-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Autoinflamatorní syndromy s kožními projevy
Autoinflammatory Syndromes with Skin Manifestations
The autoinflammatory syndromes represent a newly classified heterogenous subset of familiar or sporadic diseases, that are characterized by seemingly unprovoked episodes of inflammation due to excessive interleukin-1β activation. They manifest mainly in childhood with skin lesions, recurrent attacks of fever and joint symptoms. Their immunopathogenic mechanisms are gradually being revealed due to increasing level of knowledge and it appears that even common dermatoses might have present autoinflammatory signs. Recognition of the pathogenetic role of inflammasomes and key mediators of innate immune system opens the possibility for new targeted therapies.
Key words:
autoinflammatory syndromes – inflammasome – interleukin 1 – periodic fevers – anti IL-1 biologics
Autori: P. Cetkovská 1; N. Benáková 2
Pôsobisko autorov: Dermatovenerologická klinika FN a LF UK v Plzni, přednosta prof. MUDr. Karel Pizinger, CSc. 1; Dermatovenerologická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. Jiří Štork, CSc. 2
Vyšlo v časopise: Čes-slov Derm, 90, 2015, No. 4, p. 144-155
Kategória: Souborné referáty (doškolování lékařů)
Súhrn
Autoinflamatorní syndromy představují relativně novou heterogenní skupinu familiárních či sporadických chorob klinicky charakterizovaných opakujícími se epizodami zánětlivých změn souvisejících většinou s nadměrnou aktivací dráhy interleukinu-1β. Projevují se většinou již v dětství, a to zejména kožními změnami, periodickými horečkami a kloubním postižením. S postupujícím vývojem poznání se jejich imunopatogenetické mechanismy průběžně odhalují a současně se ukazuje, že i běžné dermatózy mohou mít autoinflamatorní rysy. Rozpoznání úlohy inflamasomů a klíčových prozánětlivých mediátorů vrozeného imunitního systému v patogenezi těchto nemocí rozšiřuje možnosti nové cílené léčby.
Klíčová slova:
autoinflamatorní syndromy – inflamasom – interleukin 1 – periodické horečky – biologická léčba inhibující IL-1ÚVOD
Název autoinflamatorní onemocnění a jejich koncept poprvé navrhl kolektiv autorů pod vedením McDermotta v roce 1999 pro skupinu vzácných nemocí, které se patogeneticky i klinicky liší od alergických a autoimunitních chorob [11]. Šlo zejména o dědičné neinfekční nemoci s nejasnými horečkami a zánětlivými změnami postihujícími různé orgány, zejména klouby a kůži. První příznaky těchto nemocí počínají v dětství, bývají intermitentní, periodicky se opakují s různou frekvencí, a proto byly v roce 1948 pojmenovány syndromy periodické horečky Hobartem Reimannem [15].
Dnes se mezi autoinflamatorní nemoci řadí klasické monogenní autoinflamatorní syndromy, jako jsou hereditární periodické horečky, dědičné pyogenní artritidy, syndromy s akné, idiopatické urtikariální syndromy jako syndrom Schnitzlerové či Stillova choroba (tab. 1), ale i polygenní nemoci (BehÇetův syndrom, Crohnova nemoc, spondyloartropatie). Autoinflamace se účastní i v patogenezi běžných imunitně zprostředkovaných dermatóz (ekzém, psoriáza, akné, neutrofilní dermatózy aj.), ale též civilizačních chorob jako např. u chorob metabolického syndromu (diabetes 2. typu, dna, obezita, ateroskleróza). A dokonce i proces stárnutí kůže vykazuje autoinflamatorní rysy [2, 13, 15].
Tab. 1. Přehled autoinflamatorních chorob s kožními projevy 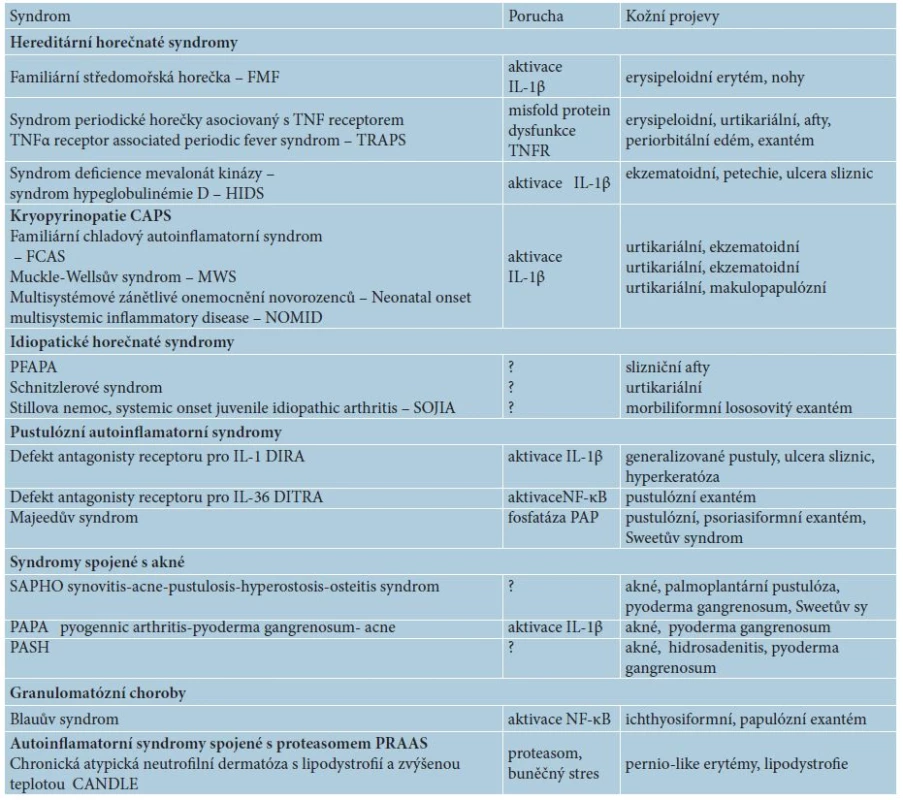
Při autoinflamatorních nemocech dochází opakovaně ke vzplanutí systémového zánětu, a to bez primární účasti infekčních agens, alergenů, autoantigenů, autoprotilátek či specifických T lymfocytů na podkladě poruchy regulace nespecifické imunity [12, 13, 15]. Původně byly tyto nemoci označované jako idiopatické, bez známé příčiny, avšak díky rozvoji molekulární biologie a genetiky se jejich patogenetické mechanismy průběžně odhalují. Většina má dědičný podklad, monogenní či polygenní, který způsobuje nepřiměřené reakce vrozené, nespecifické imunity a vede k poškození vlastních tkání. Společným znakem je aktivace neutrofilních leukocytů anebo makrofágů [4, 15].
Buňky jsou vybaveny speciálními receptory PRP (pattern recognition receptors) pro zachycení signálů nebezpečí či poškození (PAMP/DAMP – pathogen/danger associated molecular patterns) [12]. Hlavními představiteli PRP jsou na povrchu buňky jako první linie kontaktu membránové receptory TLR (Toll-like receptors) a jako druhá linie pak přímo v buňce cytoplazmatické receptory NLR (nucleotide-binding oligomerization domain receptors, zkráceně NOD like receptors). Tyto receptory se řadí mezi složky vrozené, nespecifické imunity. Spuštění vrozených imunitních mechanismů mikrobiálními i nemikrobiálními stimuly se děje cestou aktivace těchto rozeznávacích receptorů. Po vazbě ligandu (PAMP/DAMP) na receptory TLR se aktivuje dráha nukleárního faktoru kappa B (NF-κB) s následnou tvorbou pro-interleukinu-1 (pro-IL-1) v jádře. Současně dochází vazbou ligandu k aktivaci receptorů NLRP3 v cytoplazmě a prostřednictvím NF-κB k jejich další stimulaci. NLRP3 je nejznámější člen z rodiny NLR (NOD-like receptor family, pyrin domain containing 3), který poté atrahuje adaptérový ASC protein (apoptosis associated speck like protein), jež obsahuje další důležitý protein – CARD (caspase activation and recruitment domain). Společně aktivují prokaspázu 1 na aktivní formu – kaspázu 1. Tyto tři funkční složky tvoří v cytoplazmě buněk multiproteinový komplex, tzv. inflamasom [6, 9, 12, 13]. Jeho aktivace představuje druhý signál v zánětlivé nespecifické reakci buňky, vedoucí k aktivaci a uvolnění IL-1 a 18 – obrázek 1.
Obr. 1. Mechanismus aktivace IL-1 cestou aktivace inflamasomu 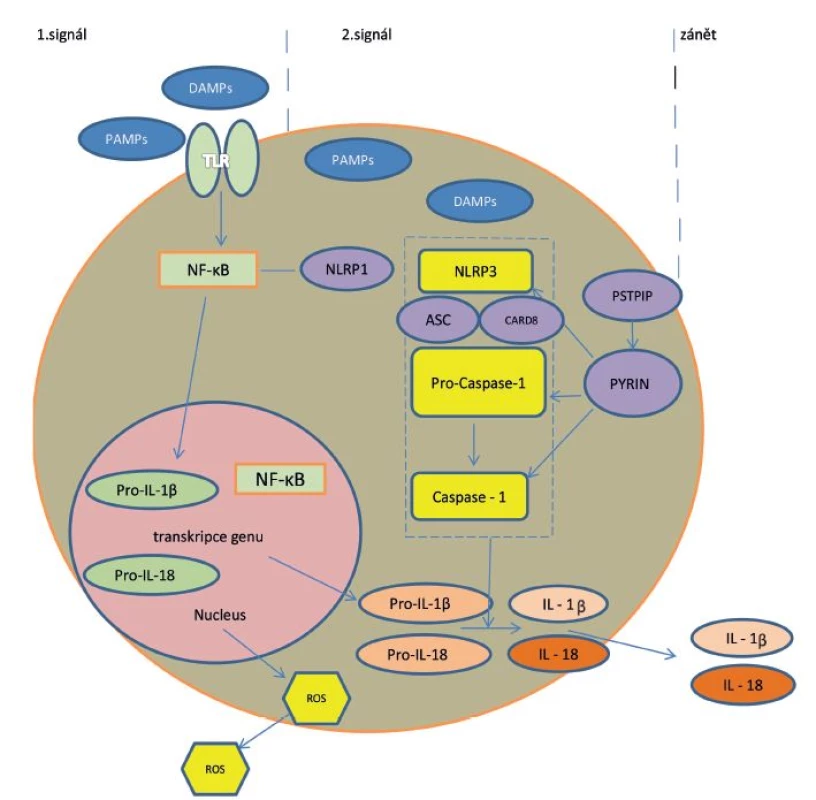
Legenda: PAMP = pathogen associated molecular patterns; TLR = Toll-like receptors; NF-κB= nukleární faktor kappa B; NLR = NOD like receptor family – proteiny obsahující doménu NOD (nucleotide- binding oligomerisation domain) a část rozeznávající ligandy LRR (leucin-rich repeat), synonymum NLRP (nucleotide-binding domain leucin-rich repeat-containing protein); Pro-casp 1 = prokaspáza 1; CARD = caspase activation and recruitment domain; ROS = reaktivní formy kyslíku Poprvé byly struktura a funkce inflamasomu popsány až v roce 2002. Inflamasom je evolučně starý detekční a obranný systém, přítomný intracelulárně u buněk epiteliálního a myeloidního původu. Tento systém rozeznává signály nebezpečí – mikrobiální patogeny nebo nemikrobiální noxy – a reaguje na ně. Prostřednictvím IL-1 a dalších cytokinů spustí zánět namířený proti vyvolávajícímu agens, případně se celá buňka i s noxou sama destruuje mechanismem tzv. pyroptózy („zánětová apoptóza“). Posléze se s pomocí regulačních molekul zánět utlumí a reparuje poškození („hojení ran“) [6].
Centrální mechanismus v patogenezi autoinflamace cestou inflamasomu představuje tedy aktivace enzymu kaspázy 1, která enzymaticky aktivuje prekurzory pro-IL-1 a 18 na aktivní formy těchto cytokinů, které jsou pak secernovány extracelulárně mimo buňku. Excesivní IL-1 je pro autoinflamatorní choroby charakteristický. Je to velmi silný, zásadní zánětlivý cytokin – stimuluje tvorbu dalších zánětlivých cytokinů IL-6 a TNF-α, stimuluje proliferaci zánětlivých buněk, vede cestou snížení apoptózy k delšímu přežívání T lymfocytů a dalších zánětlivých elementů. V keratinocytech indukuje tvorbu antimikrobiálních peptidů. Tedy působí mohutnou mobilizaci humorálních i buněčných složek nespecifické zánětlivé reakce [6].
Regulace inflamasomu je zásadním, ale křehkým bodem v udržování rovnováhy prozánětlivých a protizánětlivých procesů, mohou ji narušit mutace genetické i spontánní, epigenetické vlivy a v zásadě jakékoliv porušení rovnováhy. Bez této regulace by každá buňka zanikla po jakémkoliv kontaktu nejen s cizorodými, ale i netolerovanými vlastními molekulami (autoantigeny) vlastní destrukcí a organismus jako celek by podlehl systémovému zánětu. Mutace genů pro proteiny inflamasomu, mohou nesprávně aktivovat či inhibovat jeho funkci („molekulární patologie“), což vede ke konstitučně zvýšené aktivitě inflamasomu, která způsobuje chronický, systémový, rekurentní zánět [6]. Za fyziologických podmínek jsou tvorba, aktivace i funkce IL-1 regulovány složitým systémem agonistů a antagonistů. Pokud je z jakýchkoliv důvodů zvýšena jeho tvorba či aktivace anebo selhává jeho regulace, dochází k excesivnímu zánětu a v konečném důsledku k poškození tkání, v extrémních případech až k hemodynamickému šoku. IL-1 je tedy „dobrý sluha, ale zlý pán“.
K autoinflamatornímu zánětu mohou kromě výše uvedených mutací v oblasti inflamasomu a jeho regulace (NLR, CARD, IL-1RA = interleukin-1 receptor antagonist) vést též mutace jiných složek nespecifické imunity, např. transkripčního intracelulárního faktoru NF-κB, receptoru pro TNF (TNFR1), proteasomu, abnormality v regulaci komplementové kaskády, poruchy v signálních dráhách cytokinů či aktivaci makrofágů (macrophage activation syndromes) – tabulka 2 [15].
Tab. 2. Genetika vybraných monogenních autoinflamatorních syndromů 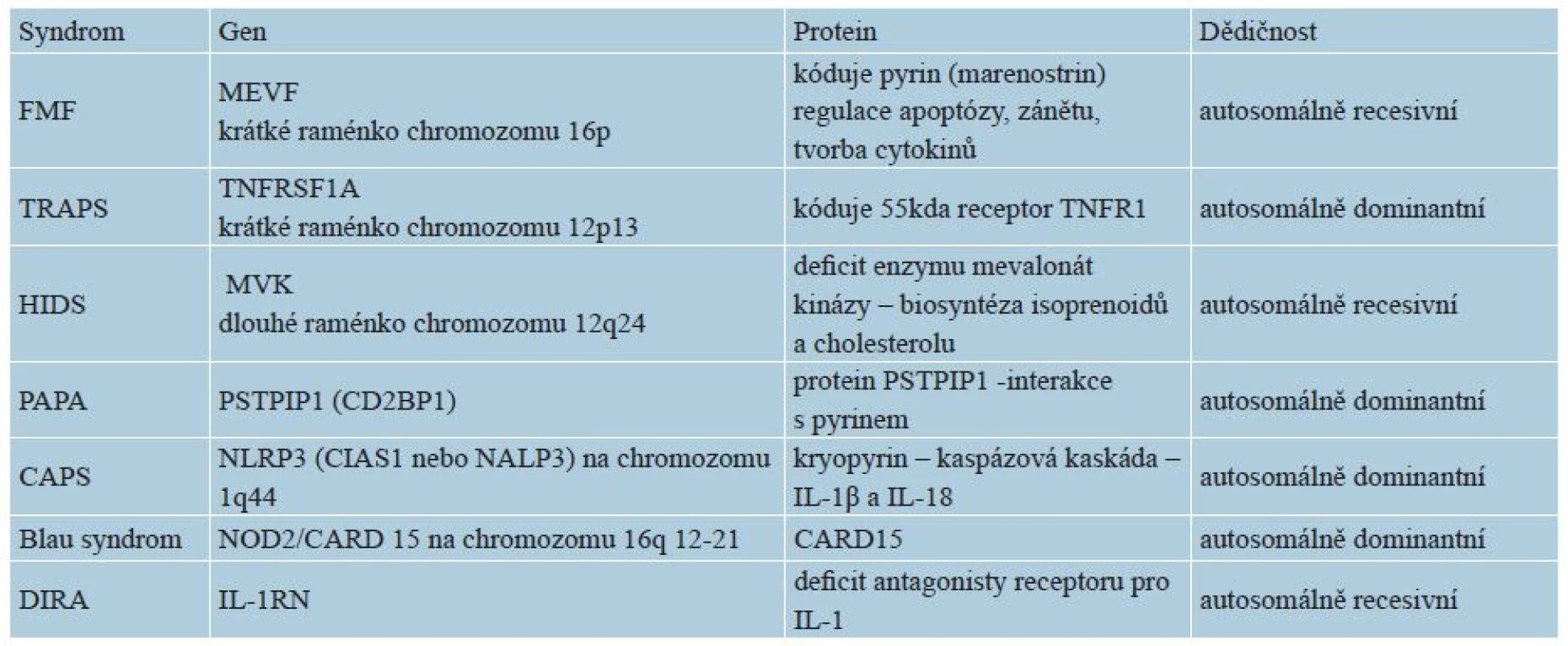
„KLASICKÉ“ AUTOINFLAMATORNÍ SYNDROMY S KOŽNÍMI PROJEVY
Monogenní syndromy vznikají na podkladě mutací genů pro proteiny vrozené imunity, které jsou součástmi NLRP3 inflamasomu, cytokinových receptorů či jejich antagonistů, nejčastěji jde o geny pro pyrin a TNF receptory. Výsledkem mutací je porušená regulace vrozené imunity s abnormální aktivitou interleukinu 1β a přetrváváním leukocytů ve tkáních, takže i mírné podněty pak mohou vyvolat nepřiměřenou zánětlivou reakci. Laboratorně se nachází velké zvýšení C reaktivního proteinu (CRP), sérového amyloidu A a leukocytóza, zejména neutrofilie [5, 12–14]. V léčbě se uplatňuje moderní biologická léčba inhibující IL-1. Prvním lékem, schváleným v roce 2001 také k léčbě revmatoidní artritidy, je anakinra – solubilní antagonista receptoru IL-1, dále rilanocept – solubilní fuzní protein zachytávající IL-1 a kanakinumab – plně lidská monoklonální protilátka proti IL-1β, ve vývoji jsou další inhibitory aktivace inflamasomu [9]. Léky se podávají podkožně a jejich nejčastějším nežádoucím účinkem jsou kožní reakce v místě aplikace injekce (obr. 2).
Obr. 2. Reakce v místě aplikace injekcí anakinry u pacientky léčené pro HIDS 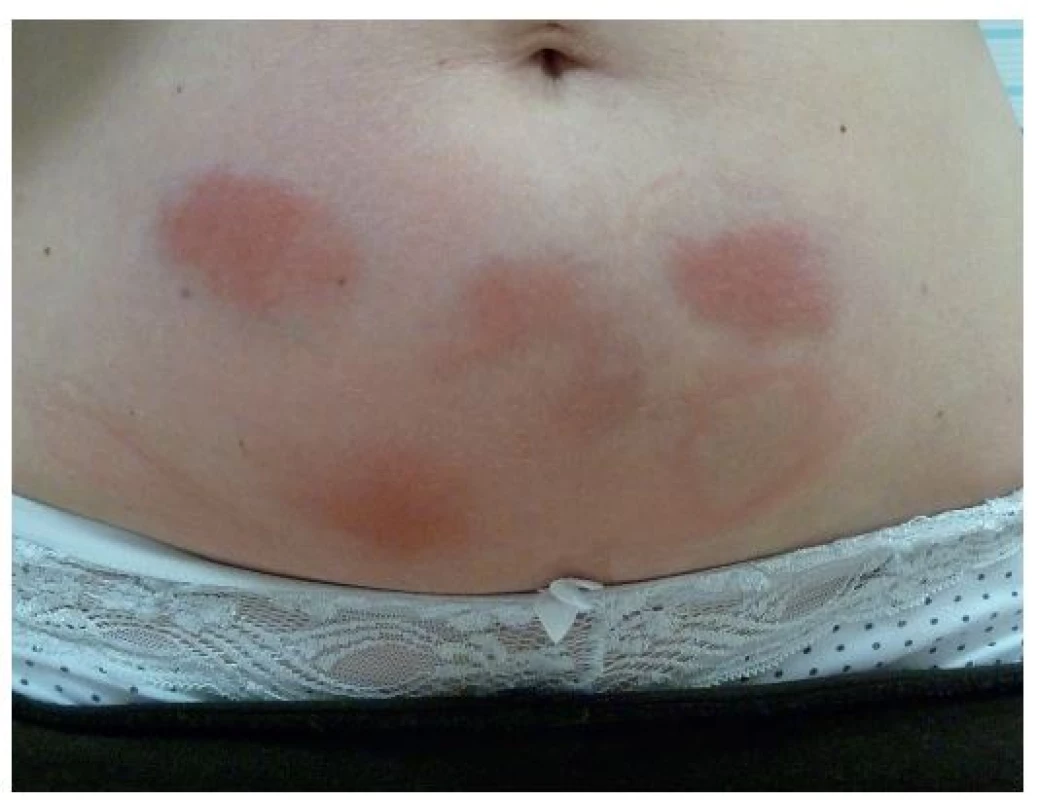
HEREDITÁRNÍ PERIODICKÉ HOREČKY
Familiární středomořská horečka – FMF
(Familial Mediterranean Fever)
Toto nejčastější onemocnění z klasických autoinflamatorních syndromů je autosomálně recesivní a postihuje specifické etnické skupiny okolo Středozemního moře, především ze severní Afriky, Itálie, Turecka, včetně Arménů, Židů a Arabů [5, 15]. Příčinou je mutace MEFV genu, kódujícího protein pyrin (marenostrin) na krátkém raménku chromozomu 16p. Pyrin je hlavní regulační součást NLRP3 inflamasomu v cytoplazmě neutrofilů, jež jsou přítomny, zejména v době ataky, v hojném počtu v serózní tekutině [5].
Podle typu mutace, nekompletní penetrace či působením zevních a genetických vlivů se nemoc projeví různě vyjádřenými klinickými příznaky. Jde o epizody horečky, bolesti břicha či na hrudi (peritonitida, pleuritida, vzácněji perikarditida a skrotitida) a artritidy velkých kloubů. Záchvaty horeček mohou trvat hodiny až tři dny, mezi atakami nemocní nemají příznaky nebo mají jen kloubní potíže.
Charakteristickým kožním příznakem jsou dobře ohraničená erytémová, edematózní ložiska až plochy velikosti do 15 cm, připomínající erysipel, na přední straně bérce, nártu, oblasti kotníku vznikající po delším stání či chůzi [13]. Na tvářích, trupu i končetinách dětí se může objevit i krvácení do kůže, častěji u těchto nemocných byla popsána Henochova-Schönleinova purpura a polyarteriitis nodosa [5].
Nemoc začíná již v dětství, ve většině případů před 20. rokem života, ve dvou třetinách se projeví již před 5. rokem [15]. Spouštěcím faktorem bývá fyzická či emoční zátěž, hormonální změny či vliv extrémních teplot. Během atak dochází k leukocytóze, zvýšení sedimentace erytrocytů, CRP, sérového amyloidu A. Vážnou komplikací u neléčených pacientů je rozvoj amyloidózy, která vzniká bez ohledu na frekvenci a intenzitu zánětlivých atak, zejména u pacientů s homozygótní mutací MEFV a jejímž prvním varovným příznakem je proteinurie [16].
K profylaxi se musí celoživotně podávat kolchicin v dávce 0,5–2 mg/den, který potlačuje zánětlivé ataky a snižuje riziko rozvoje amyloidózy [5, 9]. Pouze u refrakterních případů jsou alternativou biologika, jako je anakinra, kanakinumab, infliximab, etanercept [15].
Syndrom periodické horečky spojovaný s receptorem tumor nekrotizujícího faktoru – TRAPS
Toto autosomálně dominantní onemocnění je druhý nejčastější autoinflamatorní syndrom [9], prevalence v Evropě činí jeden případ na milion obyvatel. Podobá se FMF, ale záchvaty horeček trvají déle - 7 dní až 3 týdny [13]. Nemoc je způsobena mutacemi genu velké rodiny TNF receptorů 1A (TNFR1/TNFRSF1A), lokalizovaném na krátkém raménku chromozomu 12p13. Postihuje nemocné především ze severní Evropy s propuknutím v průměru okolo 10 let věku [9].
Nemocní mají kromě atak horeček i migrující bolesti svalů, kloubů, bolesti břicha, hrudníku či skróta. Až v polovině případů může dojít k unilaterálnímu periorbitálnímu edému, uveitidě či konjunktivitidě [9]. Na kůži horních a proximálně dolních končetin se velmi často objeví teplá, erytémová bolestivá ložiska stěhující se nad bolestivými svaly distálně. Dalšími kožními změnami jsou kopřivka či makulózní exantém, různě tvořící anulární a serpiginózní konfigurace, často s krvácením do kůže. Část pacientů má chronický průběh nemoci s denními bolestmi a trvale zvýšenými laboratorními známkami zánětu, pak hrozí vznik amyloidózy. Histologicky se zjistí perivaskulární a intersticiální mononukleární infiltrát, při přímé imunofluorescenci se najdou depozita komplementu C3 a IgM pod epidermis či difuzní depozita IgA, IgG a C3 [5].
Hlavní linií léčby jsou zejména u nemocných s jen občasnými atakami kortikosteroidy. Kupodivu anti-TNF léčba nemusí být účinná nebo účinnost postupně klesá [9, 15], proto se zkouší i anakinra a nově i tocilizumab – monoklonální lidská protilátka proti IL-6 receptoru [13, 15].
Syndrom hyperimunoglobulinémie D – HIDS
Toto autosomálně recesivní onemocnění bylo poprvé popsáno v 1984 u pacientů původem z Nizozemska. Nově se označuje jako syndrom deficience mevalonát kinázy. Mutace postihují gen pro mevalonát kinázu (MVK) na dlouhém raménku chromozomu 12q24. MVK je enzym účastnící se při syntéze cholesterolu a isoprenoidů. Při jeho afunkčnosti dochází k mevalonické acidurii. Mutace MVK způsobuje snížení aktivity enzymu se vzrůstající teplotou, takže např. při úrazu, očkování či stresu, kdy dojde ke zvýšení tělesné teploty, se defekt plně projeví [5, 13, 15].
Nemoc začíná během prvního roku života, je charakterizována atakami horeček nad 38,5 °C se zimnicí, trvajícími 4–7 dní. Horečky jsou doprovázené akutními bolestmi břicha se zvracením a průjmy, symetrickými bolestmi kloubů a krční lymfadenopatií, recidivují obvykle po 1–2 měsících. Hladiny IgD bývají zvýšené, ale přitom nekorelují se závažností nemoci, spíše jde o druhotný jev při systémovém zánětu (hladiny mohou být vyšší i u FMF a TRAPS). Během ataky bývá vyšší i hladina IgA, CRP, sedimentace erytrocytů a leukocytóza. Pro diagnózu je cenný nález mevalonátu v moči během typické ataky [15].
Na kůži se najdou rozličné změny: splývající erytémové makuly nejvíce na končetinách a trupu, papuly, petechie, noduly a kopřivka. Na sliznicích dutiny ústní a vaginy mohou být aftózní vřídky. Byly popsány i případy Henochovy-Schönleinovy purpury a projevů připomínajících erythema diutinum, Sweetův syndrom aj. Při imunofluorescenci se najdou perivaskulárně uloženiny IgD a C3, histologicky vaskulitida [5].
V léčbě se nejčastěji podávají nesteroidní antiflogistika během atak, popř. krátce kortikosteroidy, zkouší se také etanercept a anakinra [9, 15]. V léčbě se s úspěchem zkoušel také simvastatin inhibující produkci kyseliny mevalonové v dávce 20–80 mg denně.
KRYOPYRINOPATIE – CAPS
(Cryopyrin Associated Periodic Syndrome)
Tyto vzácné klinické jednotky jsou charakterizovány rozvojem většinou nesvědících pomfů až mapovitých urtikariálních ploch objevujících se u dětí. Jsou způsobeny autosomálně dominantními nebo náhodně vzniklými mutacemi NLRP3 (CIAS1) genu na chromozomu 1q44, jehož produktem je protein kryopyrin (součást NLRP3 inflamasomu), což vede k abnormální aktivaci kaspázové kaskády a tvorbě prozánětlivých cytokinů, zejména IL-1β a IL-18 [4, 5, 12, 13, 15]. Již v roce 1940 byla popsána familiární chladová kopřivka, v 1962 závažnější Muckle-Wellsův syndrom a 1981 nejzávažnější chronický infantilní neuro-kutánní-artikulární syndrom [15].
Familiární chladová kopřivka FCAS
(Familiární chladem vyvolaný autoinflamatorní syndrom)
Jde o autosomálně dominantně dědičnou, chladem vyvolanou kopřivku s pozdním nástupem, kdy se symptomy se objeví v průměru za 52 minut po celkovém vystavení chladnému vzduchu a trvají až 24 hodin [16]. Představuje nejmírnější onemocnění ze skupiny kryopyrinopatií. Začíná většinou již do 6 měsíců věku. Samotný kontakt se studeným předmětem projevy nenavodí, takže test s přiložením zkumavky s ledem je negativní. Kopřivka je často doprovázena horečkou, zimnicí, pocením a bolestí kloubů. Méně často se objevují i oční příznaky (konjunktivitida, episkleritida, uveitida) a neurologické potíže (bolesti hlavy). V laboratoři se najdou zvýšené zánětlivé parametry a vysoký IL-6, kdežto počty mastocytů a tkáňová hladina histaminu jsou normální. Při histologickém vyšetření se najde perivaskulární neutrofilní infiltrát a otok koria [5]. Onemocnění může vyústit v sekundární amyloidózu.
Muckleův-Wellsův syndrom
(MWS)
Toto autosomálně dominantní onemocnění je známé také jako syndrom kopřivka-amyloidóza-hluchota. Nemoc začíná hned po narození, nejčastěji po vystavení se změnám teplot, ale i bez expozice chladu. Klinicky má obdobné příznaky jako FCAS. Epizody horeček, bolestí hlavy s nauzeou, kopřivky, kloubních bolestí a konjunktivitidy trvají déle než u FCAS (12–36 hodin) a intervaly nejsou pravidelné. Postupně se rozvíjí senzorineurální hluchota a hrozí vznik nefropatie na podkladě sekundární amyloidózy.
NOMID
(Neonatal Onset Multisystem Inflammatory Disease)
Synonymem je CINCA (Chronic Infantile Neurologic Cutaneous and Artricular Syndrome). Představuje nejzávažnější, ve většině případů sporadické, onemocnění ze skupiny kryopyrinopatií [5]. Objevuje se u novorozenců, často již po porodu, jako chronický makulopapulózní či urtikariální exantém s horečkou, lymfadenopatií, hepatosplenomegalií a aseptickou meningitidou. Postupně dochází k faciální dysmorfii (plochý sedlovitý nos, makrocefalie, frontální výčnělky, protruse bulbů), poruchám růstu, mentální retardaci, k rozvoji různě intenzivních bolestí kloubů (až u poloviny pacientů vede závažná artropatie k funkčním a myoskeletárním následkům) a sekundární amyloidóze. Exantémy jsou chronické a perzistují po celý život. V histologickém nálezu jsou v perivaskulárním infiltrátu charakteristické neutrofily, jinak je dále složen z lymfocytů a občasných eozinofilů.
V léčbě kryopyrinopatií se nejvíce uplatňuje moderní biologická léčba inhibující IL-1. Anakinra je schopna zabránit atakám a snížit zánětlivou reakci i riziko vzniku amyloidózy. Rilanocept a kanakinumab se ukazují také jako účinné léky, nicméně v léčbě NOMID je třeba podávat vyšší dávky [9]. Kanakinumab je u nás schválen k léčbě CAPS od roku 2011 pro podání pacientům od 4 let [14]. Antihistaminika i ve čtyřnásobných dávkách při léčbě kopřivkových výsevů nepomáhají.
IDIOPATICKÉ HOREČNATÉ SYNDROMY
Periodická horečka s aftózní stomatitidou, faryngitidou a adenitidou – PFAPA
Jde o nejčastější onemocnění z této skupiny, které nebývá považováno za pravý syndrom hereditární horečky, a proto se řadí někdy odděleně od ostatních autoinflamatorních syndromů [5, 15]. Etiologie je neznámá a dosud nebyly nalezeny žádné související mutace, i když pacienti mohou mít pozitivní rodinnou anamnézu.
Objevuje se typicky u malých dětí mezi 2.–5. rokem věku a spontánně odeznívá okolo 10 let. Nemocní mají ataky 3–6denních horeček v intervalu 3–4 týdnů, u 40 až 70 % pacientů se objeví malé afty na rtech nebo v dutině ústní. Mezi další příznaky patří faryngitida, krční lymfadenopatie, únava a bolesti břicha. V mezidobí dítě dobře prospívá a je bez obtíží. V léčbě se používají antipyretika, popř. jednorázově kortikosteroidy, po nichž dojde k rychlé úlevě. V některých doporučeních se objevuje i tonzilektomie, ale i po tomto výkonu mohou bolesti v krku recidivovat [5].
Syndrom Schnitzlerové
Toto vzácné onemocnění s neznámou etiologií je charakteristické recidivujícími urtikariálními projevy doprovázenými intermitentně záchvaty horečky, bolestí kostí a kloubů a monoklonální IgM gamapatií. Řadí se v klasifikaci chronických urtikárií mezi tzv. neutrofilní urtikárie, resp. urtikariální syndromy, jako jsou kryopyrinopatie a Stillova choroba [17]. Kožní projevy jsou asymptomatické – nesvědí, nebolí a nejsou doprovázeny angioedémem. Současně bývá přítomna lymfadenopatie a hepatopatie, laboratorně je zvýšená sedimentace erytrocytů a CRP. Až ve 20 % se může objevit lymfoproliferativní onemocnění a vzácně závažná anémie a trombofilie. Histologicky se zjistí perivaskulární infiltrát sestávající z lymfocytů, histiocytů a neutrofilů, při imunofluorescenci IgM uloženiny v papilách koria a podél bazální membrány (obr. 3).
Obr. 3. Schnitzlerové syndrom s urtikariálním výsevem (z archivu) 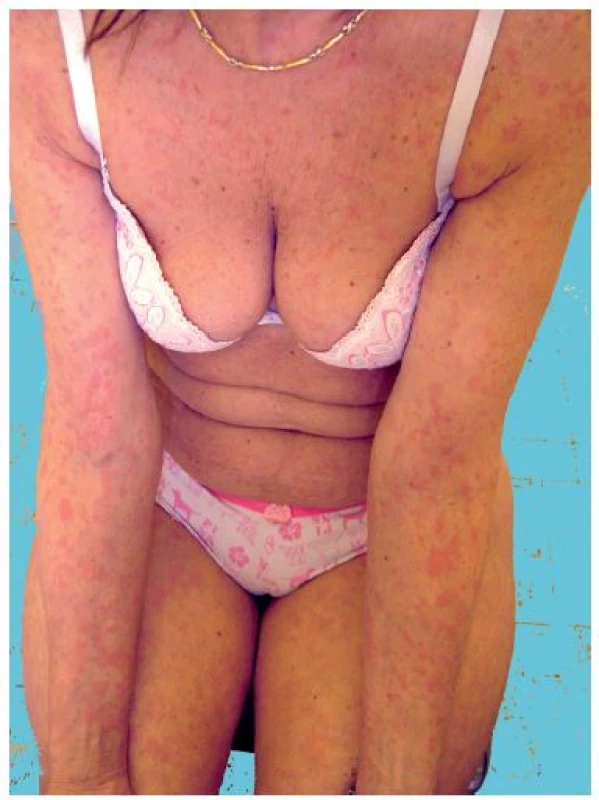
Mezi novou terapii patří anakinra, kanakinumab a tocilizumab, dále se zkoušela PUVA terapie, thalidomid, kolchicin, kortikosteroidy a anti-TNF biologika s různým efektem [13].
Systémová juvenilní idiopatická artritida (systemic-onset – SOJIA, sJIA) a Stillova choroba
Podle dnešních platných klasifikačních kritérií je toto dětské revmatické onemocnění považováno za podtyp juvenilní idiopatické artritidy, čítající asi 5–9 % ze všech případů [9, 12–14]. Bývá asociované s polymorfismy NLRP3 a v patogenezi hraje hlavní roli IL-1β a IL-18 [9]. Nemoc byla popsána pediatrem Stillem, podle něhož se dnes nazývá také syndrom s nástupem v dospělosti. Jde o zánětlivé onemocnění objevující se nejvíce okolo 2 let věku, charakterizované horečkou, každodenním výsevem morbiliformního lososově zbarveného exantému a polyartikulární artritidou. Současně se může pozorovat lymfadenopatie, hepatosplenomegalie či serositida. Nemocní jsou ohroženi vznikem syndromu aktivace makrofágů s významnou morbiditou a mortalitou [9].
Stillova nemoc se objevuje v pozdějším věku a projevuje se také horečkami, polyartritidou, exantémem (obr. 4), lymfadenopatií a faryngitidou [9]. Histologicky se v kůži najde perivaskulární a intersticiální infiltrát tvořený neutrofily, monocyty, lymfocyty a eozinofily [13]. Při febrilních špičkách je zvýšená hladina IL-6 (13). Hlavní léčbou SOJIA je anakinra, studie s dalšími biologiky zacílenými proti IL-1 probíhají [93].
Obr. 4. Exantém při Stillově nemoci (z archivu prim. MUDr. Olgy Filipovské) 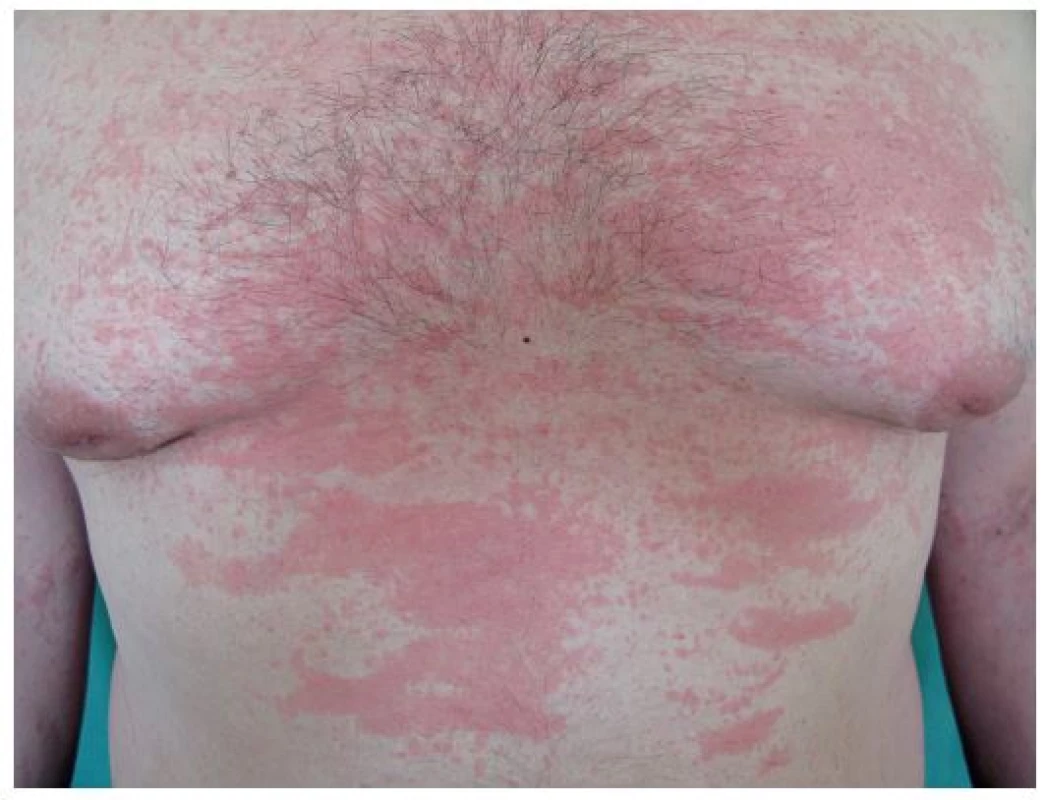
PUSTULÓZNÍ AUTOINFLAMATORNÍ SYNDROMY
Syndrom deficience antagonisty IL-1 receptoru – DIRA
Toto vzácné autosomálně recesivní onemocnění bylo prvně popsané v roce 2009 autory Ivona Aksentijevich et al. [1]. Vzniká v důsledku deficitu antagonisty receptoru pro-IL-1 na podkladě homozygotních mutací IL1RN. Mutacemi vzniká afunkční protein, takže není regulován receptor pro-IL-1, čímž dochází k trvalé aktivaci zánětlivého signálu.
Záhy po narození se tvoří otoky kloubů na podkladě rekurentní multifokální aseptické osteomyelitidy a periostitidy. Dále se objevuje generalizovaná pustulózní psoriáza doprovázená horečkou, hojící se difuzní deskvamací. Na nehtech bývá dolíčkování, na sliznici dutiny ústní puchýřky až vřídky. Histologicky se zjistí parakeratóza, subkorneální pustuly s neutrofily, neutrofilní infiltráty v koriu, popř. neutrofilní ekrinní hidradenitida. Léčebně se pak doporučuje denní aplikace anakinry v dávce 1 až 5 mg/kg [5, 13].
Syndrom deficience antagonisty IL-36 receptoru – DITRA
Jde o zcela nově objevené, autosomálně recesivní či sporadické onemocnění projevující se akutním vzplanutím generalizované pustulózní psoriázy. Příčinou je mutace IL-36RN genu, což je protein rodiny IL-1 cytokinů, který reguluje, antagonizuje receptor pro-IL-36 a hraje důležitou roli v přenosu zánětlivých signálů, jako je NF-κB [15].
Syndrom je charakterizován náhlými recidivujícími výsevy pustul na erytémovém podkladě doprovázenými horečkou a únavou. Onemocnění začíná většinou v dětství, ale jsou popsány i případy vzniku v dospělosti. Současně se může vyskytovat chronická psoriáza s postižením nehtů. V léčbě se opět zkouší anakinra [5].
SAPHO syndrom
(Synovitis, Acne, Pustulosis, Hyperostosis, Osteitis syndrome) – zařazen také v následující kapitole.
AUTOINFLAMATORNÍ SYNDROMY SPOJENÉ S AKNÉ
PAPA syndrom
(Pyogenic Arthritis, Pyoderma gangrenosum, Acne syndrome)
Toto velmi vzácné autosomálně dominantní onemocnění popsané Lindorem v roce 1997 je vyvolané mutacemi proteinu PSTPIP1 (proline-serine-threonine phosphatase interacting protein 1), také zvaného jako CD2BP1 [8]. Tento způsobuje zvýšenou vazbu pyrinu na pyrinovou doménu NLRP, což vede k aktivaci inflamasomu a následně zvýšené tvorbě IL-1β. Laboratorně je kromě něj zvýšený i TNF-α, CRP a sedimentace erytrocytů, objevuje se hypogamaglobulinémie [13]. Nemocní trpí už od dětství vážnou destruktivní sterilní artritidou, v pubertě se rozvíjí jizvící nodulocystická akné. Typický je fenomén patergie, kdy se v místě aplikace injekcí či jiných traumat tvoří sterilní abscesy. Na končetinách či obličeji se tvoří ojedinělé či mnohočetné vředy připomínající pyoderma gangrenosum, které se hojí kribriformními jizvami (obr. 5). Léčba zahrnuje kortikosteroidy (15–60 mg/den), anti-TNF biologika (infliximab, etanercept), zkouší se i anakinra, cyklosporin, thalidomid [9, 13].
Obr. 5. Kribriformní jizvy po zhojeném pyoderma gangrenosum u pacientky s PASH 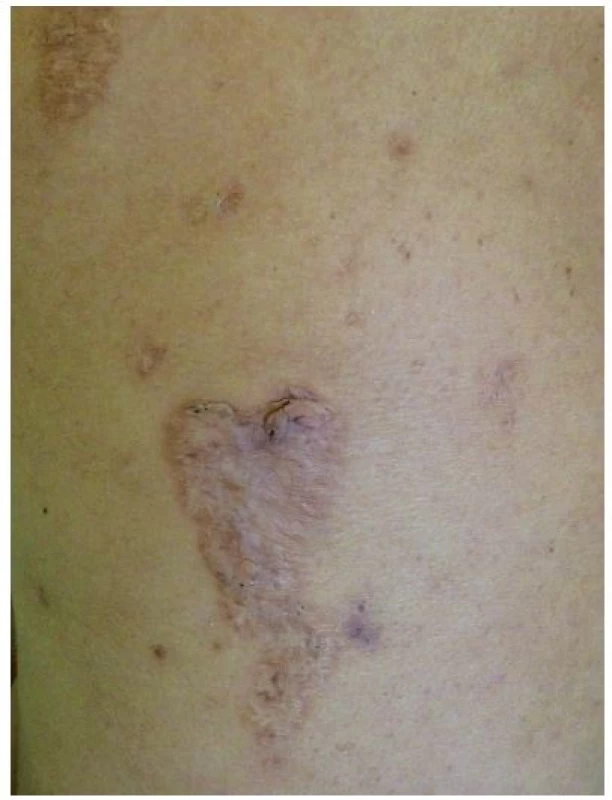
PASH syndrom
(Pyoderma gangrenosum, Acne, Hidradenitis Suppurativa)
Tento autoinflamatorní syndrom patří mezi zcela nově popsané autoinflamatorní onemocnění, a to v roce 2012 Braun-Falcem, jr. Liší se od PAPA syndromu absencí epizod pyogenní artritidy. Pacienti mají acne conglobata a hidrosadenitis suppurativa, v těchto lokalitách může následně vzniknout pyoderma gangrenosum [3] – obr. 6, 7. Tyto syndromy se mohou různě sdružovat s dalšími nemocemi, takže se hovoří už o dalších nových akronymech: PAPASH (PASH a pyogenní arthritis), PsAPASH (psoriatická artritida a PASH) [Růžička T.: Autoinflamatorní syndromy, 23rd World Congress of Dermatology, Vancouver 2015].
Obr. 6. Hidrosadenitis suppurativa v tříslech u téže pacientky 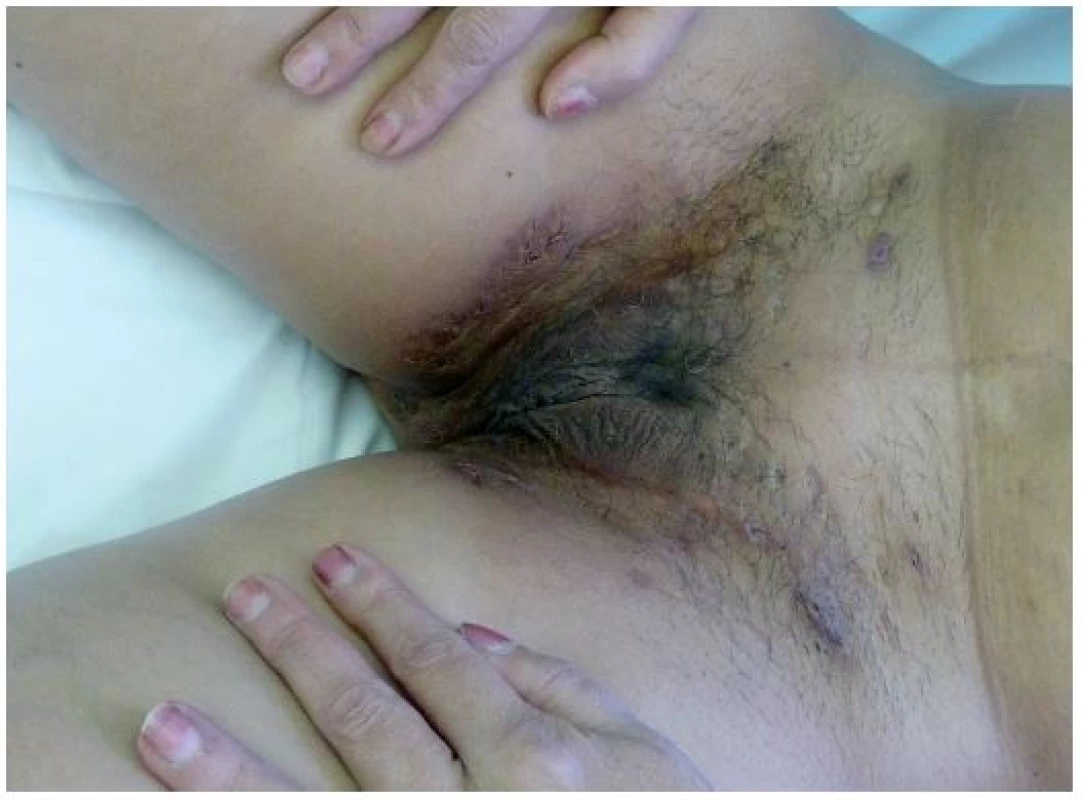
Obr. 7. Hojící se projevy pyoderma gangrenosum u stejné pacientky 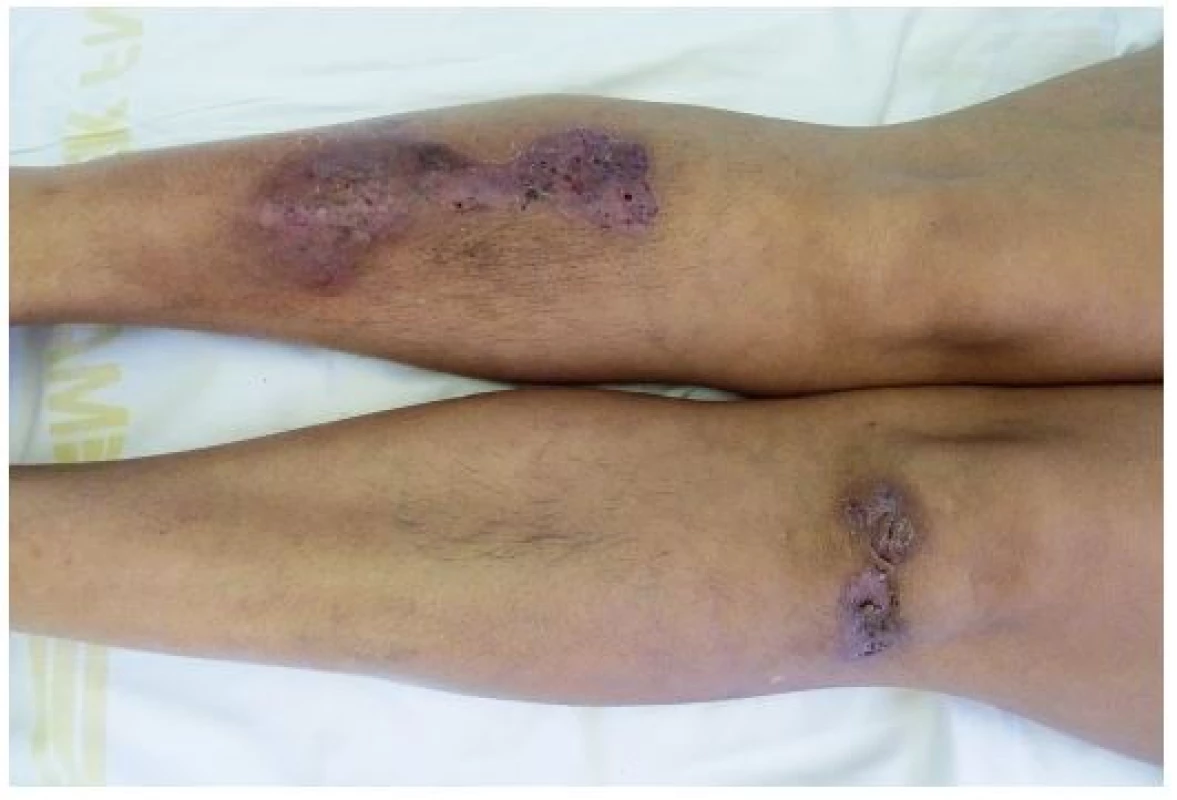
SAPHO syndrom
(Synovitis, Acne, Pustulosis, Hyperostosis, Osteitis syndrome)
Jde o vzácné, pravděpodobně poddiagnostikované komplexní onemocnění nejasné etiopatogeneze. Může se vyskytnout ve všech věkových kategoriích, dominuje bolestivé postižení kostí, kloubů a kožní projevy [12]. Nejčastěji to bývá těžká akné (acne conglobata, fulminans, inversa), palmoplantární pustulóza. Zánětlivé projevy akné jsou na obličeji i hrudníku. Ve vzorcích kůže i kostí byly vykultivovány Propionibacterium acnes či Staphylococcus aureus. Na dlaních a ploskách se najdou drobné pustuly se sterilním obsahem a olupováním. Osteoartikulární postižení zahrnuje chronický zánět sternoklavikulárního či sternokostálního skloubení, dále je přítomna hypertrofická osteitida obratlů a femurů a predominantně axiální synovitida, popř. synovitida loketních, kolenních či drobných ručních kloubů. K diagnostickým kritériím též patří chronická rekurentní multifokální osteomyelitida [13].
Léčba je neuspokojivá. Podávají se tetracyklinová antibiotika či isotretinoin k léčbě akné, lokální kortikosteroidy a acitretin k léčbě palmoplantární pustulózy. Osteoartikulární projevy se léčí nesteroidními antiflogistiky, kortikosteroidy, metotrexátem, sulfasalazinem, zkouší se anti-TNF biologika (infliximab) a bifosfonáty [12, 13].
Majeedův syndrom
Toto onemocnění je charakterizováno chronickou rekurentní multifokální osteomyelitidou a vrozenou dyserytropoetickou anémií. Začíná již záhy po narození a průběh je chronicky exacerbující. V etiologii syndromu hrají roli různé homozygotní mutace LPIN2 genu, jež narušují funkci fosfatázy (PAPs).
Při exacerbaci dochází k vysoké horečce, bolestem a otokům kloubů, což vede k poruchám růstu a trvalým kontrakturám. Pacienti mohou mít i kožní zánětlivé změny, dosud byly popsány dva případy Sweetova syndromu a jeden případ pustulózy a psoriázy [5].
GRANULOMATÓZNÍ NEMOCI
Blauův syndrom (familiární juvenilní systémová granulomatóza) a časná sarkoidóza
Jde o fenotypicky shodná onemocnění s mutacemi NOD2/ CARD15 genu na chromozomu 16q12-21. Protein NOD2 (nucleotide-binding oligomerization domain) se vyskytuje v cytoplazmě hematopoetických buněk a v enterocytech tenkého střeva. Hraje roli ve vrozené imunitě – funguje jako receptor vážící bakteriální peptidoglykany, po jehož stimulaci se aktivuje transkripční faktor NF-κB a kaspáza s následnou tvorbou a uvolněním pro-IL-1 do cytoplazmy. Jeho mutace vedou u Crohnovy choroby ke snížení funkce NOD2, zatímco při uvedených nemocech dochází k nekontrolované samoaktivaci NOD2, k trvalé aktivaci NF-κB, a tak i perzistenci zánětlivého stavu.
Blauův syndrom je autosomálně dominantní choroba, časná sarkoidóza je sporadické onemocnění. Obě choroby jsou asociovány s pediatrickou granulomatózní artritidou, a proto se doporučuje používat raději název pediatrická granulomatózní artritida asociovaná s NOD2 [5].
Typické jsou nespecifické granulomatózní záněty kloubů, kůže a oka. Klinická manifestace je pak tvořena triádou: polyartikulární synovitida, oční (akutní přední granulomatózní uveitida) a kožní změny [5, 12]. Již v dětském věku se tvoří progresivní cystické otoky na nohou, zápěstí, loktech a deformity prstů. Postižení očí může progredovat, vede ke vzniku katarakty, glaukomu až k oslepnutí [5]. Dále se objevují horečky a četná granulomatózní postižení vnitřních orgánů, lymfadenopatie, infiltrace slinných žláz, glomerulonefritida a hepatosplenomegalie.
Kožní změny jsou zcela nenápadné – nesvědící, drobné, někdy lichenoidní papuly v hustém výsevu, kůže má ichthyosiformní vzhled, a to na trupu či končetinách, kromě dlaní a plosek. Popisují se i bolestivé nehojící bércové vředy [13]. Histologicky se zjistí nekaseifikující granulomy v koriu s mnohočetnými epiteloidními a mnohojadernými obrovskými buňkami jako při sarkoidóze. Mezi další změny patří panikulitida připomínající erythema nodosum a leukocytoklastická vaskulitida s makulopapulózním či urtikariálním exantémem.
Léčebně se používají nesteroidní antiflogistika, kortikosteroidy, metotrexát, thalidomid a anti-TNF léky či anakinra. Kožní projevy se mohou zlepšit dlouhodobým podáváním erytromycinu [5].
AUTOINFLAMATORNÍ SYNDROMY SPOJENÉ S PROTEASOMEM – PRAAS
Chronická atypická neutrofilní dermatóza s lipodystrofií a zvýšenou teplotou
(CANDLE syndrom)
Tato velice vzácná klinická jednotka byla popsaná v roce 2010 [10]. Klinicky se projevuje recidivami teplot, kožními projevy, lipodystrofií a záněty vnitřních orgánů. Příčinou jsou autosomálně recesivní mutace proteasomu PSMB8, vedoucí k poruše jeho aktivity. Proteasom je cylindrická organela hrající základní roli v degradaci bílkovin [15]. Poškozené proteiny nejsou správně rozeznávány a odbourány, působí buněčný stres, jehož důsledkem jsou chronické zánětlivé změny. Tyto mutace také vyvolávají JMP syndrom (kloubní kontraktury, atrofie svalů, mikrocytická anémie a lipodystrofie) a podobný Nakajo - -Nishimura syndrom a Japonský autoinflamatorní syndrom s lipodystrofií (JASL). U všech syndromů je zvýšen IL-6 a u některých je hypergamaglobulinémie [5, 11].
Onemocnění začíná již v dětském věku. Pacienti mají denní epizody horeček, hepatosplenomegalii, artralgie a další zánětlivé změny postihující různé vnitřní orgány. Kožní změny zahrnují otoky víček a projevy připomínající oznobeniny: recidivující anulární erytémová ložiska na trupu, ale i na obličeji a končetinách, zvláště nad interfalangeálními klouby, která se spontánně hojí s hyperpigmentacemi. Současně se rozvíjí progresivní lipodystrofie na obličeji, pažích a trupu jako výsledek chronického zánětu tukové tkáně [13].
Léčba je málo úspěšná a nezabrání progresi systémových příznaků, především kardiorespiračnímu selhání. Zkoušejí se nesteroidní antiflogistika, kortikosteroidy, bortezomib (nespecifický inhibitor proteasomu). Biologická léčba zatím nevedla ke zlepšení [5].
DERMATÓZY S AUTOINFLAMATORNÍMI RYSY
Podle nejnovějších poznatků se ukazuje, že pojem autoinflamace může být rozšířen i nad rámec skupiny vzácných monogenních syndromů. U řady častých dermatóz, s polygenní dědičností, se pozorují autoinflamatorní rysy. Patří k nim psoriáza, atopický i kontaktní ekzém, neutrofilní dermatózy, akné, areátní alopecie, vitiligo a lupus erythematosus – a v budoucnosti přibudou patrně i další. Tyto imunitně zprostředkované zánětlivé nemoci vykazují smíšený charakter zánětu s podílem poruch jak získané, tak vrozené imunity [9, 12, 13].
Autoimunitní a autoinflamatorní mechanismy se prolínají a lze jen těžko odlišit, které z nich u dané choroby a konkrétního jedince převažují. Například v nedávné studii psoriázy autoři tento proces charakterizovali jako bimodální imunitní aktivaci: počáteční fáze vzniku akutních psoriatických lézí je autoinflamatorní se zánětlivými změnami vyvolanými IL-1 a TNF s převahou neutrofilů, poté se objevuje časný T-buněčný infiltrát s Th17 a Th22 buňkami a až postupně vznikají chronická ložiska s dominancí Th1 buněk [7]. U psoriázy, podobně jako u Crohnovy nemoci, je prokázána mutace CARD, jež je složkou inflamasomu, respektive dalších signálních drah (CARD je součástí řady proteinů, podílejících se na imunitní odpovědi a zánětu, např. dráhy NF-κB). Některé práce ukazují i na mutaci genů pro IL-1RA a úlohu IL-36 [13, 15]. Takže u psoriázy dochází nejen k abnormální, zvýšené aktivaci inflamasomu, ale i k jeho snížené regulaci. To se potvrdilo i v experimentálních modelech, neboť mutace genů pro IL-1RA vyvolává u pokusných zvířat psoriasiformní fenotyp. Role IL-1 u psoriázy představuje další krok v poznávání patogeneze této choroby, svědčí pro ni úspěšná léčba pustulózní psoriázy a acrodermatitis continua Hallopeau anakinrou [13]. Díky výzkumu biologické léčby se v posledních letech akcentuje role IL-17. Jeho tvorbu v lymfocytech ale kromě známého IL-23 indukuje právě IL-1. Oba zánětlivé cytokiny IL-1 a IL-17 se vzájemně potencují a zpětnovazebně ovlivňují, a tak IL-1β působí jako regulátor zánětlivé aktivity právě Th17 lymfocytů [2].
ZÁVĚR
Dermatolog může přispět ke stanovení správné diagnózy klasických autoinflamatorních nemocí, i když jsou velmi vzácné, diagnostika většinou probíhá v dětském věku a pravděpodobnost nového záchytu u dospělých pacientů je v běžné klinické praxi malá. V dospělém věku se s autoinflamatorními nemocemi můžeme setkat v podobě atypické chronické urtikárie, těžké akné, pyoderma gangrenosum či pustulózní dermatózy, doprovázené různými systémovými příznaky.
U řady nemocných se tyto vzácné nemoci nemusely v dětství rozpoznat. Pro diagnózu autoinflamatorních syndromů svědčí dlouhodobá anamnéza nevysvětlitelných opakovaných horeček bez respiračních potíží, provázených zánětlivými změnami především kloubů, nejasné kožní exantémy, podobné potíže v rodině, zvýšené laboratorní hodnoty zánětlivých parametrů, negativita autoprotilátek, refrakternost na léčbu antibiotiky. Diferenciálně diagnosticky je třeba vždy nejdříve vyloučit chronické infekce, systémové autoimunitní choroby či paraneoplastické syndromy.
S rozvojem dalšího vědeckého poznání inflamasomu a dalších klíčových mediátorů vrozené imunity se v léčbě těchto nemocí objevují účinné biologické přípravky zacílené proti IL-1 či TNF. Přibývá důkazů, že autoinflamatorní podíl na patogenezi mohou mít i některé chronické dermatózy, které byly dosud vnímány jako převážně autoimunitní, čímž se nabízí nové potenciální možnosti léčby těchto nemocí.
Pro systematické získání klinických a genetických informací a pro vytvoření lepší klasifikace těchto zcela nových nemocí probíhá evropský projekt Eurofever s databázemi pacientů a genetických mutací spjatých s autoinflamatorními syndromy [15]. Pro zlepšení diagnostiky a léčby autoinflamatorních nemocí je vzhledem k systémovému charakteru zánětu a multiorgánovému postižení důležitá spolupráce mezi dermatology, pediatry, revmatology, imunology a dalšími specialisty.
Do redakce došlo dne 13. 7. 2015.
Adresa pro korespondenci:
Prof. MUDr. Petra Cetkovská, Ph.D.
Dermatovenerologická klinika LFUK a FN
Dr. E. Beneše 13, 305 99 Plzeň
e-mail: cetkovska@fnplzen.cz
Zdroje
1. AKSEKSENTIJEVICH, I., MASTERS, SL., FERGUSON, PJ., et al. An Autoinflammatory Disease with Deficiency of the Interleukin-1 – Receptor Antagonist. N. Engl. J. Med., 2009, 360, p. 2426–2437.
2. BENÁKOVÁ, N. Zpráva z 6. mezinárodního kongresu Psoriasis from gene to clinic. Čes - slov Derm, 2012, 87, 1, s. 27–28 .
3. BRAUN-FALCO, M., KOVNERYSTYY, O., LOHSE, P., RUZICKA, T. Pyoderma gangrenosum, acne, and suppurative hidradenitis (PASH) – a new inflammatory syndrome distinct from PAPA syndrome. J. Am. Acad. Dermatol., 2012, 66 (3), p. 409–415.
4. BUCHVALD, D. Monogénové autozápalové syndrómy v detskej dermatológii. Referátový výběr, 2014, 56, s. 12–20.
5. DÁVILLA-SEIJO, P., HERNÁNDEZ-MARTÍN, A., TORRELO, A. Autoinflammatory syndromes for the dermatologist. Clinics in Dermatology, 2014, doi: 10.1016/j.clindermatol.2014.02.004.
6. DAVIS, B. K., WEN, H., TING, J. P. I. The inflammasome NLRs in immunity, inflammation and associated diseases. An. Rev. Immunol., 2011, 29, p. 707–735.
7. CHRISTPHERS, E., METZLER, G., RöCKEN, M. Bimodal immune activation in psoriasis. Br. J. Dermatol., 2014, 170, 1, p. 59–65.
8. LINDOR, N. M., ARSENAULT, T. M., SOLOMON, H. et al. A new autosomal dominant disorder of pyogenic sterile arthritis, pyoderma gangrenosum, and acne: PAPA syndrome. Mayo Clin. Proc., 1997, 72 (7), p. 611–615.
9. McCOY, S. S., STANNARD, J., KAHLENBERG, J. M. Targeting the inflammasome in rheumatic diseases. Translational Research, 2015, DOI: http://dx.doi.org/10.1016/j.trsl.2015.06.006
10. McDERMOTT, A., JACKS, J., KESSLER, M. et al. Proteasome-associated autoinflammatory syndromes: advances in pathogeneses, clinical presentations, diagnosis and management. Int. J. Dermatol., 2015, 54, p. 121–129.
11. McDERMOTT, M. F., AKSENTIJEVICH, I., GALON, J. et al. Germline mutations in the extracellular domains of the 55 kDa TNF receptor, TNFR1, define a family of dominantly inherited autoinflammatory syndromes. Cell, 1999, 97, 1, p. 133–144.
12. MEIER, B., FRENCH, L. E. Autoinflammationssyndrome – kutanne Manifestationen. Dtsch. Med. Wochenschr., 2014, 139, p. 1468–1472.
13. NGUYEN, T. V., COWEN, E. W., LESLIE, K. S. Autoinflammation: From monogenic syndromes to common skin diseases. J. Am. Acad. Dermatol., 2013, 68 (5), p. 834–853. http://dx.doi.org/10.1016/j.jaad.2012.11.002.
14. PAVELKA, K., ARENBERGER, P., LUKÁŠ, M., ZIMA, T., DOLEŽAL, T., OLEJÁROVÁ, M., CETKOVSKÁ, P. et al.: Biologická léčba zánětlivých autoimunitních onemocnění. 1.vyd. Praha: Grada, 2014, 384 s.
15. SAVIC, S., DICKIE, L. J., WITTMANN, M., McDERMOTT, M. F. Autoinflammatory syndromes and cellular responses to stress: pathophysiology, diagnosis and new treatment perspectives. Best Practice and Research Clinical Rheumatology, 2012, 26, 4, p. 505–533. http://dx.doi.org/10.1016/j.berh.2012.07.009.
16. SHINAWI, M., SCAGLIA, F., WINDLE, M. L. Hereditary Periodic Fever Syndromes. http://emedicine.medscape.com/article/952254-overview, 2013, 31 p.
17. ZUBERBIER, T., ABERER, W., ASERO, R. et al. EAACI/GA(2)LEN/EDF guideline for the definition, classification, diagnosis and management of urticaria: the 2013 revision and update. Allergy, 2014, 7, p. 868–887.
Štítky
Dermatológia Detská dermatológia
Článek Akné a obličejové dermatózyČlánek Odborné akce v roce 2015
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2015 Číslo 4- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- Autoinflamatorní syndromy s kožními projevy
-
DOŠKOLOVÁNÍ LÉKAŘŮ
KONTROLNÍ TEST - Současný výskyt pěti primárních melanomů u jednoho pacienta
- Klinický případ: Perzistující makulózní ložiska na trupu
-
Zápis ze schůze Výboru ČDS
Praha 21. května 2015 - Zápis ze schůze výboru ČDS konané dne 18. června 2015 v Praze
- Akné a obličejové dermatózy
- Odborné akce v roce 2015
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Autoinflamatorní syndromy s kožními projevy
- Současný výskyt pěti primárních melanomů u jednoho pacienta
- Klinický případ: Perzistující makulózní ložiska na trupu
- Akné a obličejové dermatózy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



