-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Klinický případ: Puchýře a eroze na rukou
Autori: M. Důra 1,2; I. Krajsová 1; J. Štork 1; O. Kodet 1,3
Pôsobisko autorov: Dermatovenerologická klinika 1. LF UK a VFN Praha přednosta prof. MUDr. Jiří Štork, CSc. 1; Ústav patologie 1. LF UK a VFN, Praha přednosta doc. Pavel Dundr, Ph. D. 2; Anatomický ústav 1. LF UK, Praha přednosta prof. MUDr. Karel Smetana, DrSc. 3
Vyšlo v časopise: Čes-slov Derm, 91, 2016, No. 2, p. 76-78
Kategória: Repetitorium
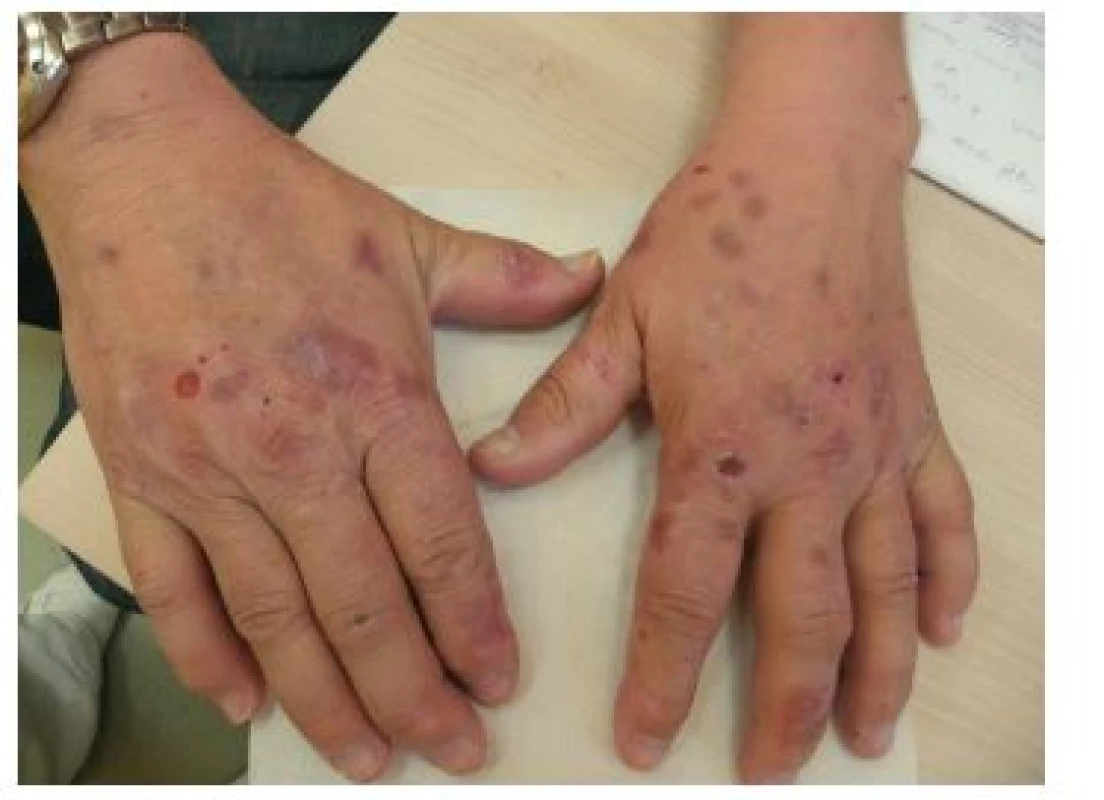
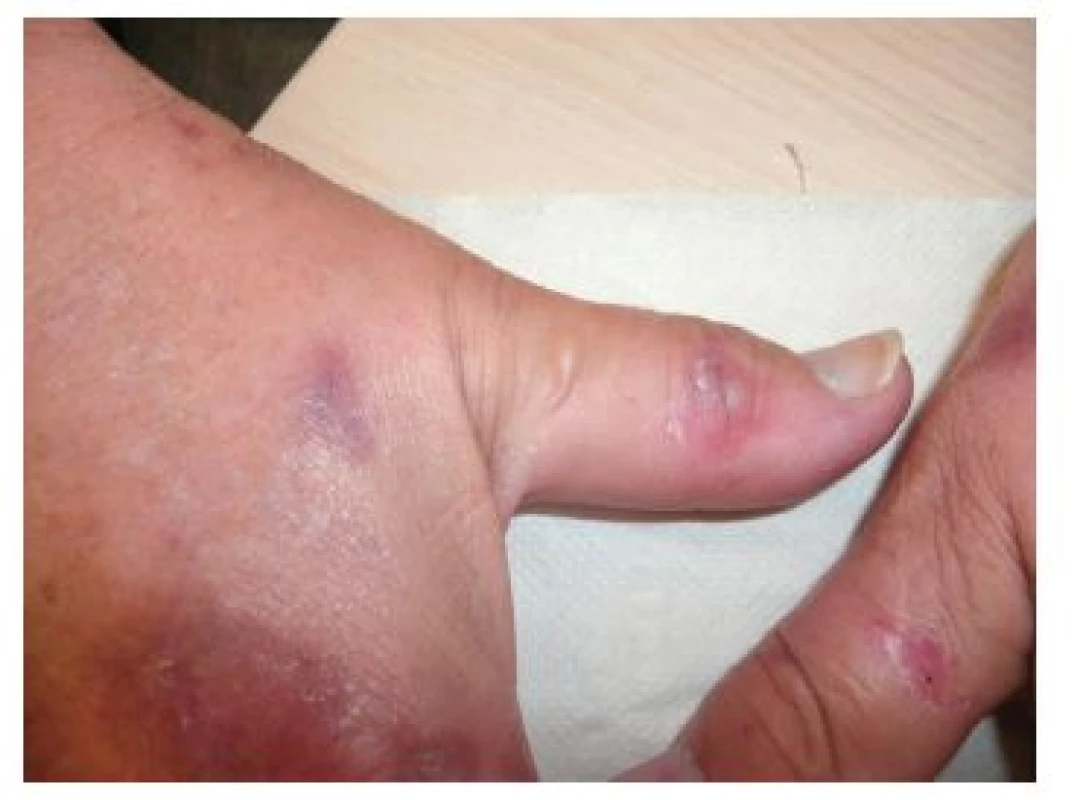
Pacient, 59letý muž, který se dlouhodobě s ničím neléčil a neužíval žádné léky, se dostavil na naše pracoviště po neširoké excizi nodulárního melanomu pravé paže (Breslow 2,8; Clark IV, bez ulcerace a regrese) před dvěma měsíci. Po provedené reexcizi jizvy a mapování sentinelové uzliny, která byla negativní, byla zahájena adjuvantní imunoterapie interferonem alfa v dávce 9 mil. 5krát týdně. Při zahájení bylo pozorováno mírné zvýšení jaterních testů, které se během léčby výrazně neměnilo. Tři týdny po zahájení léčby pozoroval tvorbu ojedinělých erozí a nesvědivých vezikul na dorzech rukou, dávaných do souvislosti s fotosenzibilizujícím účinkem rostlin při práci na zahradě. Tři měsíce po zahájení léčby CT vyšetření břicha vykázalo difuzní přítomnost splývajících ložisek do několika milimetrů v průměru charakteru metastatického procesu jater. Současně byla provedena biopsie vezikuly na dorzu ruky k histologickému vyšetření a vyšetření přímou imunofluorescencí (obr. 1–4).
HISTOPATOLOGICKÉ VYŠETŘENÍ
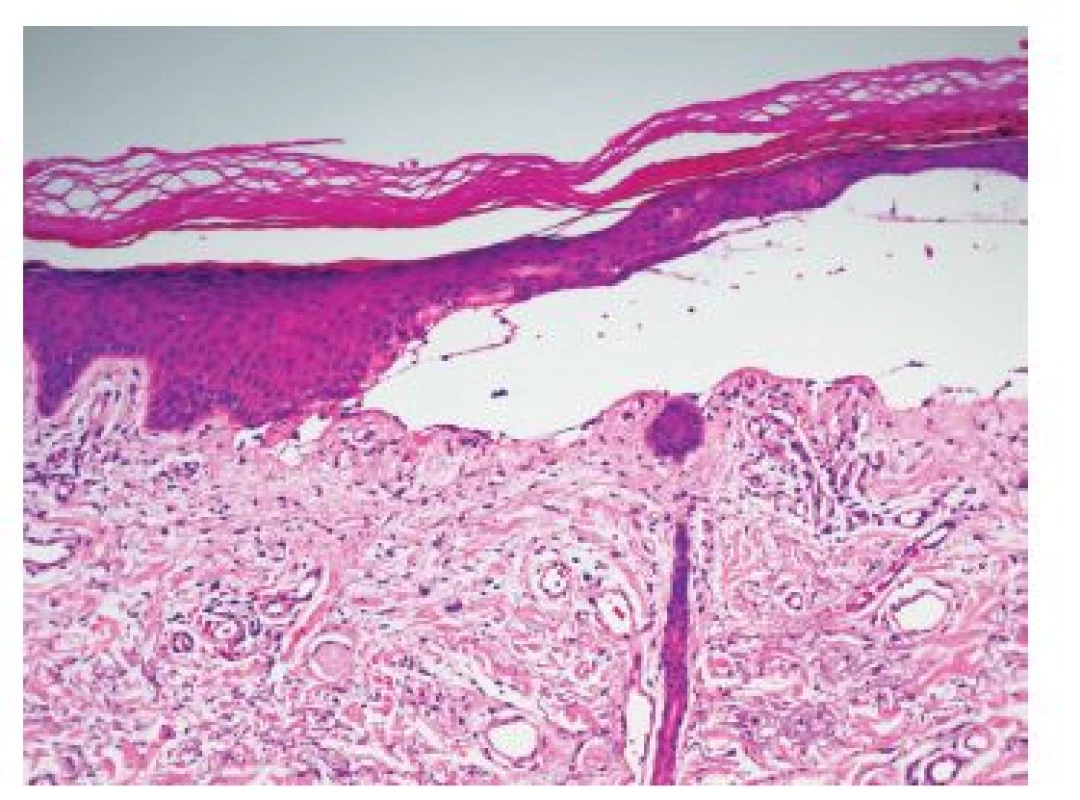
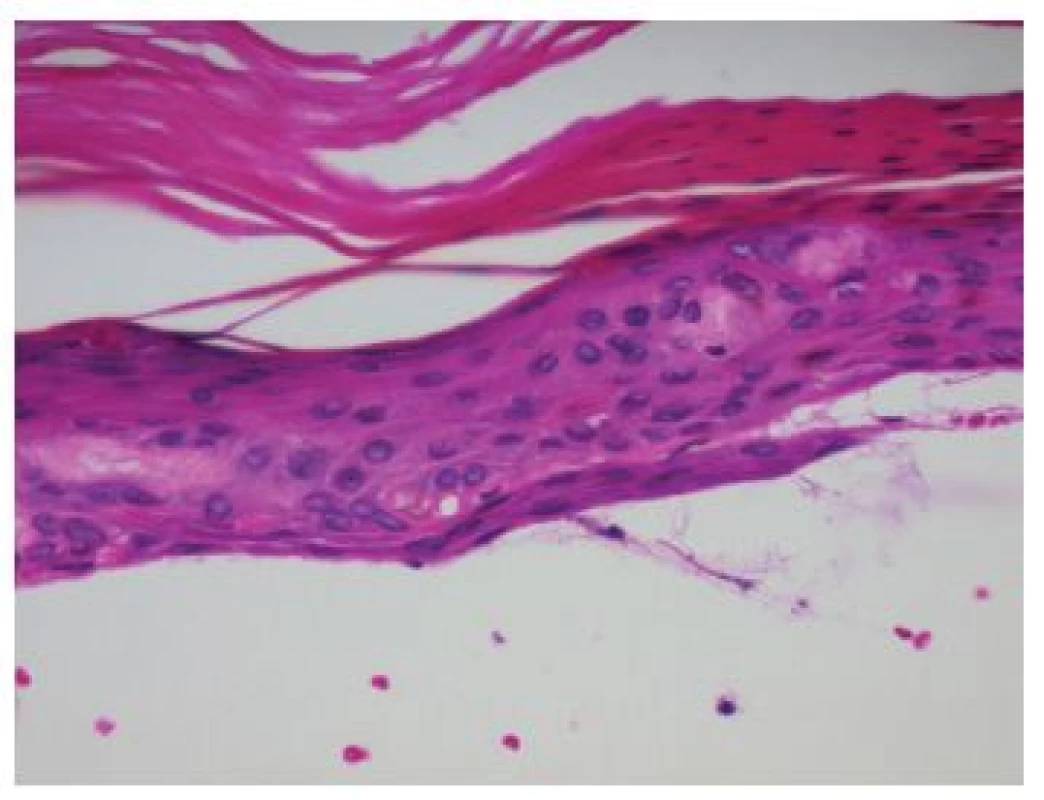
V centru excize byl zastižen subepidermální puchýř s dobře vykreslenou spodinou krytý atrofickou epidermis s parakeratózou a přítomností eozinofilních hrudkovitých tělísek (obr. 3, 4). V horním koriu byly patrny ojedinělé erytrocytární extravazáty a bazofilní degenerace vaziva. Přímá imunoflorescence prokázala ve třídě IgG imunofluorescenci stěn kapilár horního koria a bazální membrány epidermis (obr. 5), pozitivitu IgM stěn některých kapilár horního koria a shluky hrubých granul a cytoidních tělísek subepidermálně, ve třídě IgA, C3 komplementu a fibrinogenu imunoflorescenci stěn kapilár horního koria.
Závěr
Nález podporuje diagnózu porphyria cutanea tarda.
PRŮBĚH
Adjuvantní imunoterapie interferonem alfa byla ukončena pro leukopenii. Biopsie jater prokázala chronickou hepatopatii ve stadiu středně těžké fibrózy s nálezem jehlicových inkluzí, steatózy a střádáním železa slučitelné s diagnózou porphyria cutanea tarda, metastatické postižení nebylo přítomno. Vyšetření moče prokázalo: zvýšené celkové porfyriny (1772, norma: 1–200), jejich celkový odpad (2658 – norma: 0–200), vyšetření vysokoúčinnou kapalinovou chromatografií (U-HPLC) prokázalo: koproporfyrin: 8 (0–80), pentakarboxyporfyrporfyrin: 8 (0–0), hexakarboxyporfyrin: 3 (0–0), heptakarboxyporfyrin: 28 (0–7), uroporfyrin: 53 (0–20). Vyšetření na hepatitidu B a C bylo negativní. Pacient byl nekuřák, udával konzumaci tří piv denně a příležitostně destilátů. Hepatolog pro symptomatickou jaterní porfyrii s počínající jaterní cirhózou zahájil léčbu plaquenilem v dávce 1 tbl 2krát týdně.
DISKUSE
Porphyria cutanea tarda (PCT), označovaná též jako symptomatická jaterní porfyrie, patří mezi tzv. hepatální porfyrie. Porfyrie jsou vrozené nebo získané poruchy enzymů účastnící se syntézy hemoglobinu vedoucí k zvýšenému vylučování porfyrinů [2, 8, 17]. Porfyriny následně působí jako fotodynamický senzibilizátor. Porfyrie se dělí podle místa enzymové poruchy na porfyrie erytropoetické s poruchou enzymu v kostní dřeni a na porfyrie hepatální s poruchou v jaterním parenchymu. Biosyntéza hemoglobinu zahrnuje 8 enzymatických kroků, které postupně konvergují glycin a sukcinyl-koenzym A na hemoglobin [2, 13]. Tyto enzymy jsou kódovány 9 různými geny, jejichž poruchy vedou k vrozeným porfyriím s autozomální i recesivní dědičností, méně pak vázanou na chromozom X [2, 15]. PCT patří mezi porfyrie především získané (typ 1) méně často vrozené (familiární, typ 2). Jedná se o poruchu uroporfyrinogen-dekarboxylázy (UROD) s hromaděním porfyrinů v játrech, séru, moči a ve stolici. U získané formy, při snížení funkce UROD pod 20 %, dochází ke vzniku klinických příznaků. Familiární forma je charakterizovaná mutací genu pro UROD s autozomálně dominantní dědičností s částečnou penetrací (je detekováno více než 105 mutací UROD) [2, 15]. U heterozygotů je enzym UROD z poloviny funkční a její průběh je proto asymptomatický. Vzhledem k nízké penetraci této mutace je rodinná anamnéza často negativní a postižení je považováno za získanou formu (rodinná anamnéza je pozitivní asi jen u 7 % pacientů). Na vzniku PCT se u predisponujících pacientů mohou podílet i zevní faktory, konzumace alkoholu (asi u 2 % cirhotiků), infekční hepatitidy (hepatitida C), syntetické deriváty estrogenů, nadměrný přísun železa a především aromatické chlorované uhlovodíky (hexachlorbenzen) používané jako pesticidy [3, 4, 8, 11, 13, 14]. Takto vyvolané porfyrie se označují jako toxické. Z jiných metabolických onemocnění se nejvíce popisuje homozygotní forma mutace (Cys282Tyr) pro hereditární hemochromatózu [5, 10, 17]. Z méně častých vyvolávajících faktorů je popsána hemodialýza u pacientů s chronickou renální insuficiencí (pseudoporfyrie), dále pak infekce HIV v koincidenci s hepatitidou typu C, méně pak infekce hepatitidou A a B [2, 9, 11, 13]. Ojedinělé případy jsou popsány u pacientů s hematologickou malignitou nebo systémovým erytematodem [2, 6].
Získaná forma PCT se klinicky manifestuje v dospělosti, u familiární formy je nástup onemocnění u mladších jedinců, častěji postihuje muže. Typickým klinickým obrazem je rozvoj vezikul a bul na nezánětlivé spodině se špatně se hojícími erozemi a jizvami. Kůže je snadno zranitelná, v pozdějších fázích atrofická a hyperpigmentovaná s přítomností jizev, milií a vystupňovanou solární elastózou. Postižení je přítomno v solární lokalizaci, na dorzech rukou, prstů, na předloktí, v obličeji, méně pak ve kštici a na ramenou. Bývá ložisková hypertrichóza zejména nad zygomy a spáncích, vzácněji se nachází jizvící alopecie, onycholýza či pseudosklerodermické projevy histologicky nerozeznatelné od sklerodermie [1, 2, 7, 13, 16, 18].
Histologicky je charakteristický nezánětlivý subepidermální puchýř s dobře vykreslenou spodinou a někdy patrnými eozinofilními hrudkovitými („housenkovitými“) hmotami v epidermální krytbě, které představují materiál bazální membrány obsahující kolagen IV znázorňujícím se při barvení metodou PAS, která někdy prokazuje i zesílení stěn kapilár a bazální membrány epidermis. Jsou patrné známky chronického solárního poškození, bazofilní degenerace vaziva. Přímou imunofluorescencí lze detekovat pozitivitu IgG, méně IgM, komplementu a fibrinogenu ve stěnách cév a případně v oblasti bazální membrány epidermis [13, 17]. Z laboratorních vyšetření je rozhodující vyšetření moče na přítomnost porfyrinů, zejména uroporfyrinu I a III. Možný je i průkaz koproporfyrinů ve stolici a průkaz karboxylovaných porfyrinů v séru. Laboratorně bývá přítomna polyglobulie, vyšší hladina železa, zvýšené jaterní transaminázy a obstrukční jaterní enzymy. Familiární formu PCT může odlišit stanovení aktivity UROD v erytrocytech, které je u získané formy v normě [2, 13, 17, 18].
V diferenciální diagnostice je nutné odlišit jiná puchýřnatá onemocnění, zejména epidermolysis bullosa acquisita, a jiné porfyrie s kožní manifestací (kongenitální erytropoetickou porfyrii, erytropoetickou protoporfyrii, hereditární koproporfyrii a porfyrii variegátní), případně pseodoporfyrie vznikající při chronické renální insuficienci a lékově indukované (tetracyklinem, nesteroidními antirevmatiky) [9, 11, 13].
Terapeuticky se uplatňují nízké dávky antimalarik v dávce 125–250 mg chlorochinu (hydroxy-chlorochinu) 2krát týdně, které jsou méně účinné u pacientů s PCT při hemochromatóze. Účinnou metodou jsou venepunkce 500 ml krve opakované po týdnu až 14 dnech, dlouhodoběji po měsíci. Cílem této terapie je snížení hladin saturace transferinu na 15 %, redukce hemoglobinu na hladiny 110–120 g/l a snížení plazmatické hladiny ferritinu pod 25 µg/l [2, 5, 8, 12, 17]. Rozvoj puchýřnatých projevů na této terapii odeznívá do 3 měsíců, fragilita kůže se zlepšuje do 9 měsíců a hladiny porfyrinů se normalizují po roce terapie. Ložiska hypertrichózy odeznívají až po letech terapie [18]. U pacientů s renálním selháním a výraznou anémií je alternativou terapie erytropoetinem, který mobilizuje jaterní depozita železa do nově syntetizovaného hemoglobinu. Významnou součástí terapie je eliminace rizikových faktorů, abstinence, vysazení substituce estrogeny, terapie případné infekční hepatitidy C a důsledná fotoprotekce [17, 18]. Prognóza pacientů závisí na závažnosti jaterního postižení. Remise onemocnění se pohybuje v průměru okolo 2–2,5 let od ukončené terapie, nutné je dlouhodobé sledování pro možnost rozvoje jaterní cirhózy a hepatocelulárního karcinomu [10, 18].
Do redakce došlo dne 10. 3. 2016.
Adresa ke korespondenci:
MUDr. Ondřej Kodet, Ph.D.
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 2
128 00 Praha 2
e-mail: ondrej.kodet@vfn.cz
Zdroje
1. AMEZYANE, T., ABOUZAHIR, A., FATIHI, J. et al. A sclerodermiform porphyria cutanea tarda. Intern. Med., 2010, 49, p. 205–206.
2. BALWANI, M., DESNICK, R. J. The porphyrias: advances in diagnosis and treatment. Blood, 2012, 120, p. 4496–4504.
3. CABALLES, R. F., SENDI, H., BONKOVSKY, H. L. Hepatitis C, porphyria cutanea tarda and liver iron: an update. Liver Int., 2012, 32, p. 880–893.
4. EGGER, N. G., GOEGER, D. E., PAYNE, D. A. et al. Porphyria cutanea tarda: multiplicity of risk factors including HFE mutations, hepatitis C, and inherited uroporphyrinogen decarboxylase deficiency. Dig Dis Sci., 2002, 47, p. 419–426.
5. FEVANG, S. A., KROON, S., SKADBERG, O. Pseudoporphyria or porphyria cutanea tarda? Diagnostic and treatment difficulties. Acta Derm. Venereol., 2008, 88, p. 426–427.
6. HAENDCHEN, L., JORDAO, J. M., HAIDER, O. et al. Porphyria cutanea tarda and systemic lupus erythematosus. An Bras. Dermatol., 2011, 86, p. 173–175.
7. KAPOOR, R. JOHNSON, R. A. Images in clinical medicine. Porphyria cutanea tarda and hypertrichosis. N. Engl. J. Med., 2013, 369, 1356.
8. MALINA, L. K otázkám etiopatogeneze a mechanismů terapie pozdní kožní porfyrie. Čes-slov Derm., 2003, 78, s. 192–196.
9. MALINA, L. Pseudoporfyrie. Čes-slov Derm., 2007, 82, s. 12–15.
10. MOGL, M. T., PASCHER, A., PRESSER, S. J. et al. An unhappy triad: hemochromatosis, porphyria cutanea tarda and hepatocellular carcinoma-a case report. World J. Gastroenterol., 2007, 13, p. 1998–2001.
11. QUANSAH, R., COOPER, C. J., SAID, S. et al. Hepatitis C - and HIV-induced porphyria cutanea tarda. Am. J. Case Rep., 2014, 15, p. 35–40.
12. RATNAIKE, S., BLAKE, D., CAMPBELL, D. et al. Plasma ferritin levels as a guide to the treatment of porphyria cutanea tarda by venesection. Australas J. Dermatol., 1988, 29, p. 3–7.
13. SARKANY, R. P. The management of porphyria cutanea tarda. Clin. Exp. Dermatol., 2001, 26, p. 225–232.
14. SINGAL, A. K., PARKER, C., BOWDEN, C. et al. Liver transplantation in the management of porphyria. Hepatology, 2014, 60, p. 1082–1089.
15. STENSON, P. D., MORT, M., BALL, E. V. et al. The Human Gene Mutation Database: 2008 update. Genome Med., 2009, 1, p. 13.
16. ŠTORK, J. VOSMÍK, F. Sklerodermiformní změny kůže hlavy, krku a hrudníku – pseudosklerodermie při porfyria cutanea tarda. Čes-slov Derm., 1996, 71, s. 119–121.
17. THADANI, H., DEACON, A., PETERS, T. Diagnosis and management of porphyria. BMJ. 2000, 320, p. 1647–1651.
18. THUNELL, S., HARPER, P. Porphyrins, porphyrin metabolism, porphyrias. III. Diagnosis, care and monitoring in porphyria cutanea tarda: suggestions for a handling programme. Scand. J. Clin. Lab. Invest., 2000, 60, 561–579.
Štítky
Dermatológia Detská dermatológia
Článek Tuberózní sklerózaČlánek Odborné akce v roce 2016
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2016 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- Tuberózní skleróza
-
DOŠKOLOVÁNÍ LÉKAŘŮ
KONTROLNÍ TEST - Spinocelulární karcinom dolního rtu: naše zkušenosti a přehled literatury
- Pityriasis lichenoides et varioliformis acuta popis dvou – případů a přehled literatury
- Klinický případ: Puchýře a eroze na rukou
-
Dermatoskopie nepigmentovaných kožních nádorů.
Benigní nemelanocytové nádory -
Zápis ze schůze výboru ČDS
Praha 7. ledna 2016 - Odborné akce v roce 2016
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Tuberózní skleróza
- Pityriasis lichenoides et varioliformis acuta popis dvou – případů a přehled literatury
- Spinocelulární karcinom dolního rtu: naše zkušenosti a přehled literatury
-
Dermatoskopie nepigmentovaných kožních nádorů.
Benigní nemelanocytové nádory
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy