-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mastocytózy
Mastocytoses
Mastocytosis is a group of diseases arising from the pathological increase of mast cells in tissues leading to local and/or systemic symptoms. The disease most commonly affects the skin with appearance of typical skin manifestations due to an accumulation of mast cells, the mediator symptoms arise from the release of the mast cell granule content.
Diagnosis of skin manifestations of mastocytoses is clinical and histological. In adult mastocytosis, systemic involvement should be excluded by laboratory examination, imaging methods and bone marrow biopsy. In children, the systemic form is rare and the skin manifestations mostly disappear to puberty. Systemic disease in children is considered if symptoms persist after puberty, or severe mediatory symptoms or hepatosplenomegaly are present. The mast cell therapy is based on the severity of the symptoms. It includes local treatment, phototherapy, systemic symptoms are treated by antimediator remedies and immunosuppressive therapy, anti-receptor antibodies, kinase inhibitors, in aggressive forms by cytoreductive therapy. Equally important is prevention based on elimination of physical, food or drug triggers of degranulation of mastocytes.
Key words:
mastocytosis – mast cell mediators – skin mastocytosis – systemic mastocytosis – c-kit mutation – mediator release symptoms – prognosis – dianosis – therapy
Autori: Z. Plzáková; J. Štork
Pôsobisko autorov: Dermatovenerologická klinika 1. LF UK a VFN, Praha přednosta prof. MUDr. J. Štork, CSc.
Vyšlo v časopise: Čes-slov Derm, 93, 2018, No. 3, p. 91-100
Kategória: Souborné referáty (doškolování lékařů)
Súhrn
Mastocytózy jsou skupinou onemocnění vznikajících na podkladě patologického zmnožení mastocytů ve tkáních vedoucí k lokálním a/nebo systémovým příznakům. Onemocnění nejčastěji postihuje kůži se vznikem typických kožních projevů v důsledku nahromadění mastocytů, mediátorové příznaky vznikají v důsledku uvolnění obsahu granul mastocytů.
Diagnostika kožních projevů mastocytóz je klinická a histologická. U mastocytózy dospělých je vždy nutné vyloučení systémového postižení včetně laboratorního vyšetření, zobrazovacích metod a biopsie kostní dřeně. U dětí je systémová forma vzácná a kožní projevy většinou do puberty mizí. Systémové onemocnění u dětí vylučujeme, pokud projevy přetrvávají po pubertě anebo jsou přítomny závažné mediátorové příznaky či hepatosplenomegalie.
Terapie mastocytóz se odvíjí od závažnosti příznaků. Zahrnuje lokální léčbu, fototerapii, u systémových příznaků celkovou antimediátorou a imunosupresivní terapii, antireceptorové protilátky, inhibitory kináz u agresivních forem cytoreduktivní terapii. Neméně důležitá je prevence založená na eliminaci fyzikálních, potravinových či lékových spouštěčů degranulace mastocytů.
Klíčová slova:
mastocytóza – mediátory mastocytů – kožní mastocytóza – systémová mastocytóza – c-kit mutace – příznaky uvolnění mediátorů – prognóza – dianóza – terapie
ÚVOD
Žírné buňky – mastocyty, jejich charakteristika a funkce
Mastocyty (MC) pocházejí z kostní dřeně a sídlí v různých tkáních, zejména těch, které jsou v kontaktu se zevním prostředím, tj. v kůži a sliznicích. MC se soustřeďují zejména kolem cév a nervů. Nejsou totožné z bazofily. Jejich název byl navržen koncem 19. století Paulem Ehrlichem na základě přítomnosti intracelulárních granulí, které byly původně považovány za zásobní – mast z němčiny – výkrm, krmení. Funkce MC je nám známá zejména u alergických reakcí I. typu, fyziologická funkce MC pravděpodobně spočívá v ochraně proti bakteriálním a parazitárním infekcím, jedům hmyzu a hadů a v regulaci hojení kůže. Novější studie poukazují na jejich účast v regulaci imunitních procesů i v angiogenezi u nádorů [8]. Také za určitých podmínek uvolňují algogenní a pruritogenní mediátory a aktivací nervových receptorů se podílejí na udržování bolestivých a svědivých reakcí u různých onemocnění [6]. Na povrchu mastocytů se nachází celá řada receptorů, které jsou schopny identifikovat jednotlivé imunologické i neimunologické podněty a zahájit sled odpovědí. Patří mezi ně vysoce afinitní IgE receptory FcγR, jejichž aktivace vede k okamžité degranulaci všech mediátorů a anafylaktickému typu reakce. Dále nízkoafinitní IgG receptory FcεRI, ale také receptory identifikující tzv. s mikroby/patogeny asociované molekulární vzory (M/PAMP – microbe/patogen associated molecular patterns) a molekulární vzory asociované s nebezpečím/poškozením tkáně (DAMP – danger associated molecular patterns). Tyto receptory se nazývají vzory rozeznávající receptory (PRR – pattern recognition receptors) a řadíme k nim i známou rodinu membránových toll-like receptorů. Mastocyty mají i receptory pro hormony, cytokiny, anafylatoxiny (včetně C3a a C5a složek komplementu). Ukazuje se, že aktivací různých receptorů se mohou selektivně uvolňovat určité mediátory, a to různými způsoby (exocytózou, pomocí intermediárních sekretorických granulí, cestou signálních drah) nebo je odpověď tkáňově specifická, a proto je manifestace mastocytóz tak heterogenní. To vyplývá i ze skutečnosti, že ve tkáních se nachází několik typů mastocytů:
- MCT – zejména ve sliznici GIT a bronchů – tvoří jenom tryptázu;
- MCTC – zejména v dermis a podslizničních oblastech GIT – tvoří tryptázu a chymázu, karboxypeptidázu a katepsinu G podobnou proteázu;
- MCC-tvoří chymázu a katepsin G a karboxypeptidázu.
Seznam mediátorů obsažených v mastocytech je rozsáhlý, nejdůležitější z nich jsou: enzymy (tryptáza, chymáza, katepsin G, karboxypeptidáza), biogenní aminy (histamin, serotonin) glykosaminoglykan heparin, lipidové mediátory (leukotrieny, prostaglandin, destičky aktivující faktor), cytokiny a chemokiny (interleukiny, monocytární chemotaktický faktor, TNF alfa) a další.
Tryptáza je důležitým mediátorem (uplatňuje se při kontrakci a dilataci cév, bronchů, stěny GIT), její hladina úzce koreluje s průběhem a aktivitou onemocnění (odráží množství a aktivitu MC). Měří se sérová hladina bazální totální tryptázy, která je tvořena pro-tryptázou, která je kontinuálně uvolňována z nestimulovaných MC – odráží jejich množství v těle a zralou tryptázou, která je zadržována v sekretorických granulích a uvolňuje se při aktivaci MC, odráží aktuální aktivitu MC. Hladina tryptázy při monitorování aktivity mastocytózy proto musí být měřená v klidovém stavu. Naopak měření v době anafylaktického šoku odpovídá akutnímu zvýšení při degranulaci MC a může být použito k odlišení šokového stavu závislého na mastocytech, např. od šoku kardiogenního, ale nevypovídá o dlouhodobé aktivitě mastocytózy. Normální hladina tryptázy se pohybuje do 10–11ng/ml. Za patologickou se považuje hodnota nad 20 ng/ml. Bohužel tryptázu vyšetřují pouze vybrané laboratoře. Dalším mediátorem, který lze použít k monitorování onemocnění je N-metylhistamin a 11 beta PGF2α v moči sbírané za 24 hodin.
Etiopatogeneze onemocnění
Podstatou vzniku onemocnění je zmnožení MC (při jejich zvýšené proliferaci nebo snížené apoptóze). U většiny systémových mastocytóz se jedná o klonální expanzi MC podmíněnou mutací c-kit transmembránového tyrozinkinázového receptoru regulujícího přežívání a apoptózu MC. Gen je lokalizován na dlouhém raménku 4. chromozomu. Nejčastější je záměna aminokyselin v exonu 17 na 816. pozici (Asp816Val). Jsou popsány i jiné mutace c-kit, které nejsou lokalizovány v kodonu 816, a vyskytují se zejména u familiálních forem mastocytóz. V některých studiích se zvažuje, jestli je tato mutace primární příčinou onemocnění a předpokládají se i mutace jiných operátorových a regulačních genů, které vedou k mutaci c-kit, či ovlivní funkci MC jinou cestou. U nesystémových forem mastocytóz se předpokládalo, že tato mutace přítomna není, studie však ukazují, že je přítomna minimálně u 80 % pacientů. Dětské mastocytózy většinou systémové nejsou, i tak jsou v kožních MC přítomny mutace zejména extracelulární části c-kit receptoru až u 75 % pacientů, mutace D816V jsou detekovány jen u 25 % dětských mastocytóz [11]. Běžně se však mutace c-kit u dětí nevyšetřuje.
Zejména alergologům je znám pojem “nemoc z aktivace mastocytů“ – mast cell activation disease (MCAD), který zahrnuje všechna onemocnění způsobená zmnožením mastocytů (způsobená klonální expanzí mutovaných MC nebo sníženou apoptózou morfologicky normálních MC) sníženým prahem aktivace MC nebo abnormální odpovědí tkání. Jedná se tedy o různé manifestace dysfunkce MC. MCAD dělíme na systémovou mastocytózu, mastocytární leukémii a tzv. mast cell activation syndrome (MCAS), u kterého jsou přítomny symptomy z uvolnění mediátorů (např. flush, gastrointestinální potíže – např. typu dráždivého tračníku), zvýšená hladina mastocytárních mediátorů v moči či v séru a zvýšené množství MC určitých morfologických a histochemických charakteristik ve tkáních mimo kůži, které však nesplňuje kritéria systémové mastocytózy [17]. Tito pacienti nemívají typické fixní kožní projevy, ale objevuje je u nich flush, urtikarie, pruritus, urtikariální dermografismus. Bývají postiženy nejméně 2 systémy, kromě kůže je to hlavně systém dýchací, kardiovaskulární, trávicí či nervový. Diferenciálně diagnosticky je nutné vyloučit další onemocnění s obdobnými příznaky (feochromocytom, karcinoid, nádor secernující VIP, medulární karcinom štítné žlázy, idiopatickou anafylaxi). Také u MCAD se popisují familiální případy [16].
Epidemiologie
Prevalence onemocnění v Evropě se odhaduje na 1 : 360 000 podle počtu oficiálně registrovaných pacientů s touto diagnózou. Skutečná prevalence bude pravděpodobně mnohem vyšší vzhledem k heterogenitě příznaků a menšímu povědomí o onemocnění i mezi odbornou veřejností. Obě pohlaví jsou mezi nemocnými zastoupena přibližně stejně.
Nejčastěji jsou postižené děti, dokonce 15–25 % dětských mastocytóz je kongenitálních, dalších 55 % se objevuje do 2 let věku, většina regreduje do puberty a jen 10–15 % perzistuje do dospělosti – častěji jsou to případy, kdy se onemocnění projeví po 10. roce věku. U dětí se většinou jedná o kožní mastocytózu, jen zřídka je onemocnění systémové s postižením vnitřních orgánů. Je popsaných i několika desítek případů familiální mastocytózy, pravděpodobně se jedná o autozomálně dominantní typ dědičnosti s inkompletní penetrací, možná je i dědičnost multifaktoriální [10].
Mastocytóza dospělých mnohem častěji splňuje kritéria systémového onemocnění, ale často se primárně manifestuje kožními příznaky, a to ve 4.–5. dekádě života. Projevy jsou na rozdíl od dětí stacionární nebo progredují.
Klasifikace
Vzhledem ke specifickým klinickým a patologickým znakům zahrnujícím spektrum od indolentních kožních forem až k agresivním formám systémovým vyčlenila WHO v roce 2016 mastocytózy do samostatné kategorie nespadající pod myeloidní neoplazie [2].
Aktuálně platná revidovaná WHO klasifikace (2016)
- Kožní mastocytóza (CM)
- Systémová mastocytóza (SM)
- a) indolentní systémová mastocytóza (ISM)
- b) doutnající systémová mastocytóza (SSM)
- c) SM s asociovaným klonálním hematologickým postižením (SM-AHN)
- d) agresivní SM (ASM)
- e) MC leukémie (MCL)
- Mastocytární sarkom (MCS)
KLINICKÉ PROJEVY A DIAGNOSTIKA ONEMOCNĚNÍ
Kožní projevy mastocytózy
Kožní projevy jsou nejčastější manifestací mastocytóz. Pokud je kůže jediným orgánem, kde dochází ke zmnožení MC, mluvíme o kožní mastocytóze. Pokud není pacient s kožními projevy náležitě vyšetřen (není vyloučeno, či potvrzeno systémové onemocnění), mluvíme o mastocytóze v kůži. Rozsah kožních projevů ne vždy koreluje s tíží mediátorových příznaků, tj. morfologické změny kůže mohou, ale nemusí být doprovázeny systémovými symptomy. Pokud je prokázáno zmnožení mastocytů i v jiných orgánech, mluvíme o systémové mastocytóze.
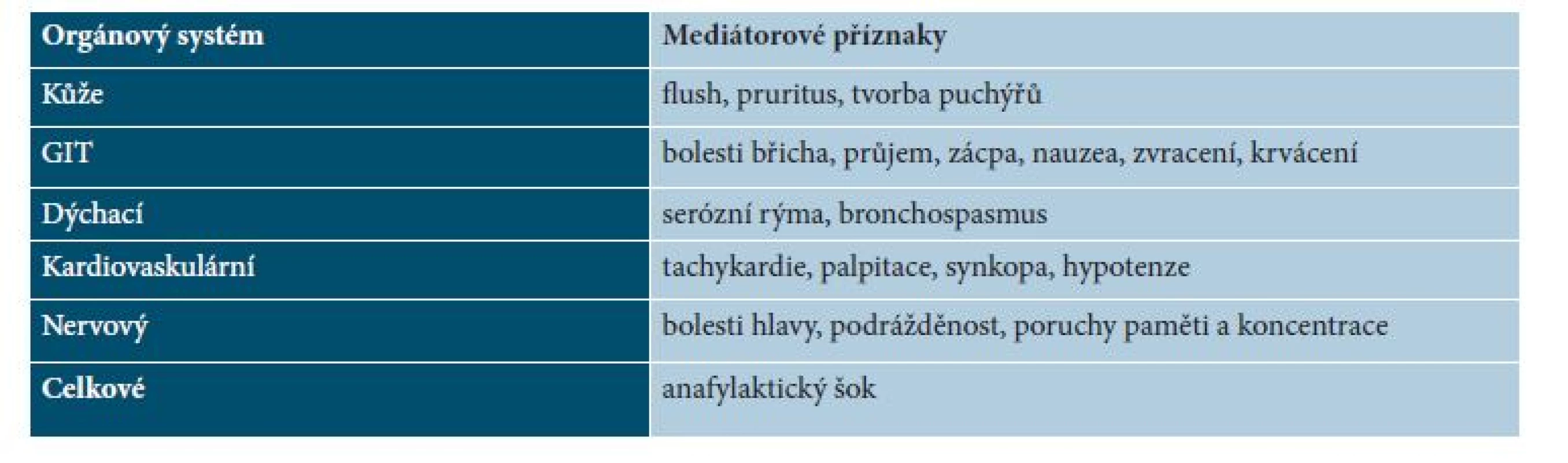
K diagnostice přispívá typický vzhled projevů a pozitivita Darierova příznaku (u 90 % pacientů, nemusí být pozitivní u zcela plochých projevů). Bioptické ověření u dětí se většinou neindikuje, u dospělých je biopsie kožních projevů s barvením na mastocyty součástí komplexního vyšetření. Dariérův příznak se vyvolá třením tupým předmětem (např. tupým koncem pera) – po několika minutách projev zčervená a zduří, v okolí se objeví erytém (obr. 1), někdy dochází k tvorbě puchýře. Zduření přetrvává 30 minut až několik hodin.
Obr. 1. Dariérův příznak – zduření projevů a erytém 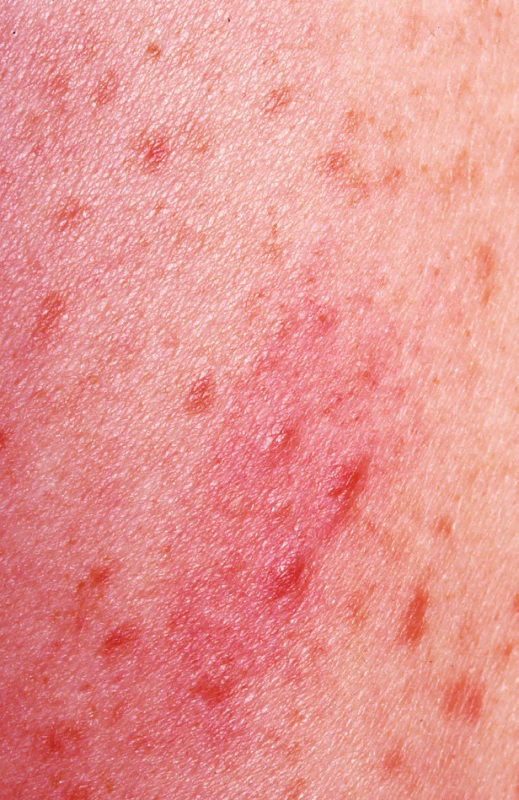
Makulopapulózní forma – urticaria pigmentosa (obr. 2a)
Je nejčastější kožní manifestací onemocnění u dětí i dospělých (50–75 %). Makuly a papuly jsou velikosti několik milimetrů až centimetrů (obr. 2B), červenohnědé barvy. Mohou být přítomny na celém těle, většinou s vynecháním dlaní a chodidel. Objevují se v počtu desítek až stovek, někdy jsou dokonce splývající. Vysévají se často v průběhu několika měsíců, méně často přibývají léta. Mohou mít purpurický charakter, někdy se tvoří puchýře (asi v 25 % případů), zřídka hemoragické. Tvorba puchýřů je vzácnější po 2. roce věku. Komplikací může být sekundární infekce, dochází většinou k hojení bez jizev. Makulopapulózní forma může perzistovat do dospělosti.
Obr. 2. Urticaria pigmentosa a) Červenohnědé makulopapuly o velikosti několika mm
b) makulopapuly o velikosti několika cm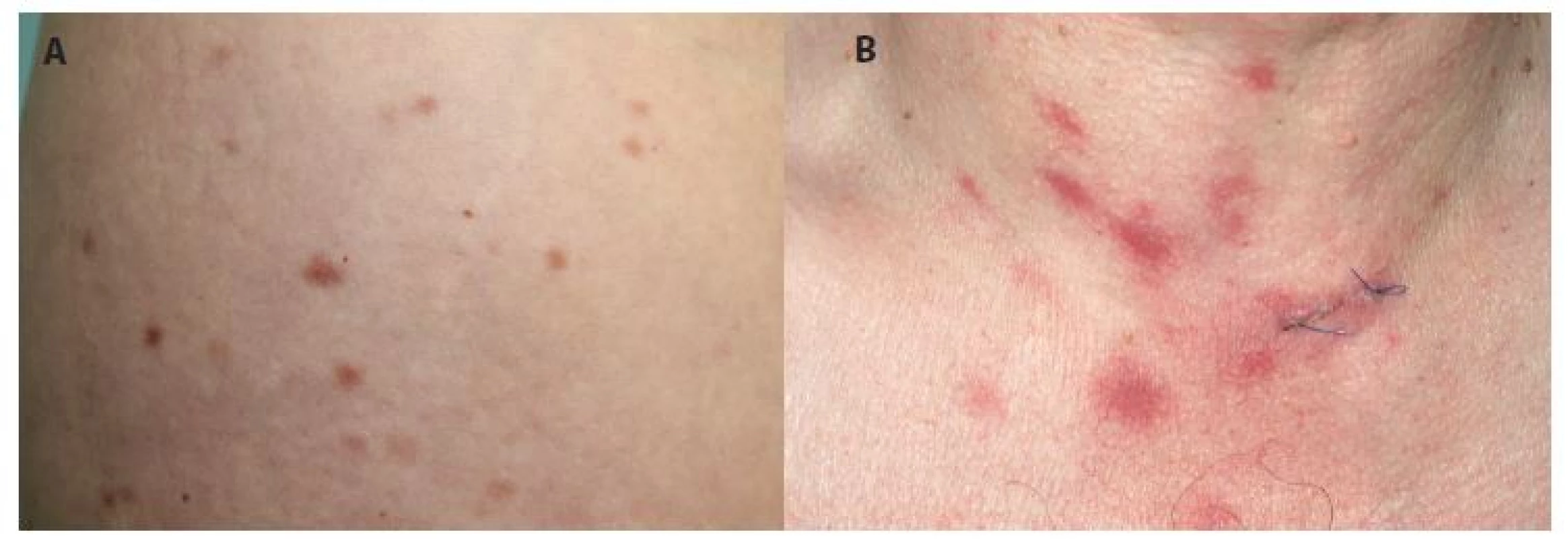
Mastocytom
Je druhým nejčastějším kožním projevem mastocytózy. Většinou se jedná o solitární žlutohnědý/červenohnědé ložisko či nodulus, často má povrch charakteru pomerančové kůže. Pokud je plochý, může připomínat modřinu. Projev je přítomen už při narození, nebo se objeví v prvních měsících života. Zřídka se popisují i mnohočetné mastocytomy. Často se vyskytuje na trupu a hýždích, méně často na končetinách a hlavě, málokdy je ve dlaních a na ploskách. Asi v polovině případů se v něm tvoří puchýře, spontánně nebo často po mechanickém dráždění (obr. 3). Flush je popisován asi u 30 % případů. Edém v místě projevu může být příčinou diagnostických potíží např. na víčku [7]. Do puberty dochází ke spontánní regresi bez jizvení.
Obr. 3. Mastocytom s naznačenou vezikulací 
Difuzní kožní mastocytóza (DCM)
Je nejzávažnější z kožních mastocytóz. Bývá kongenitální nebo se objevuje v útlém dětském věku. Kůže postižených dětí je difuzně infiltrovaná, erytrodermická, má vzhled usně. Objevují se až nodulární žlutohnědé infiltráty. Jde o kombinaci infitrace mastocyty a edému z uvolnění mediátorů. Často dochází ke tvorbě puchýřů a bul, může proto připomínat stafylokokový syndrom opařené kůže. Často se objevuje generalizovaný flush a svědění, vzhledem k vysoké náloži MC se objevují i mediátorové příznaky: průjmy, serózní rýma, hypotenze, bronchospasmus, anafylaktický šok. S věkem se často příznaky i infiltrace kůže zmírňují, paralelně klesá i hladina tryptázy. Systémová forma onemocnění je u dětí nejčastěji potvrzena právě při DCM.
Teleangiectasia macularis eruptiva perstans (TMEP)
Je zřídkavou formou kožního postižení, objevuje se zejména u dospělých. Projevy mají vzhled červených až hnědých teleangiektatických makul. Bývají distribuované symetricky na trupu a končetinách, vynechávají obličej, dlaně a chodila. Dariérův příznak může být někdy pozitivní.
V diagnostice může být nápomocná dermatoskopie, která u makulopapulózní formy ukáže hnědou pigmentovou síť, u TMEP retikulárně uspořádané lineární cévy.
Mediátorové příznaky
Příznaky, které vznikají uvolněním mediátorů, jsou velmi různorodé (tab. 1). Mají lokalizovaný nebo systémový charakter. Jak bylo vysvětleno v úvodních kapitolách – mohou se lišit svojí intenzitou, mohou být různorodé až protichůdné u jednoho pacienta v čase, dokonce i ve stejnou dobu v různých orgánových systémech jednoho pacienta. Jejich intenzita koreluje s rozsahem kožních projevů, ale neplatí to absolutně. Nejzávažnější je anafylaktický šok. Prediktorem výskytu systémových mediátorových příznaků u dětí je rozsah kožních projevů a zvýšená hladina tryptázy (obr. 4) [1]. Příznaky anafylaktického šoku u dětí se mnohem hůře rozpoznávají a mohu být méně nápadné než u dospělých, často chybí kardiovaskulární složka [13].
Obr. 4. Čtyřletý chlapec s projevy od čtyř měsíců věku
a) projevy na trupu ve 2 letech,
b) ve 4 letech věku
Mediátorové příznaky: v anamnéze 1krát anafylaktický šok po poštípání hmyzem, jiné mediátorové příznaky neudává, tryptáza 24 nm/l, bez organomegalie, pravidelně sledován na dětské kožní ambulanci, vyšetření u hematologa bez suspekce na systémové postižení, biopsie kostní dřeně neindikována, patrná progrese kožních projevů v průběhu 2 let.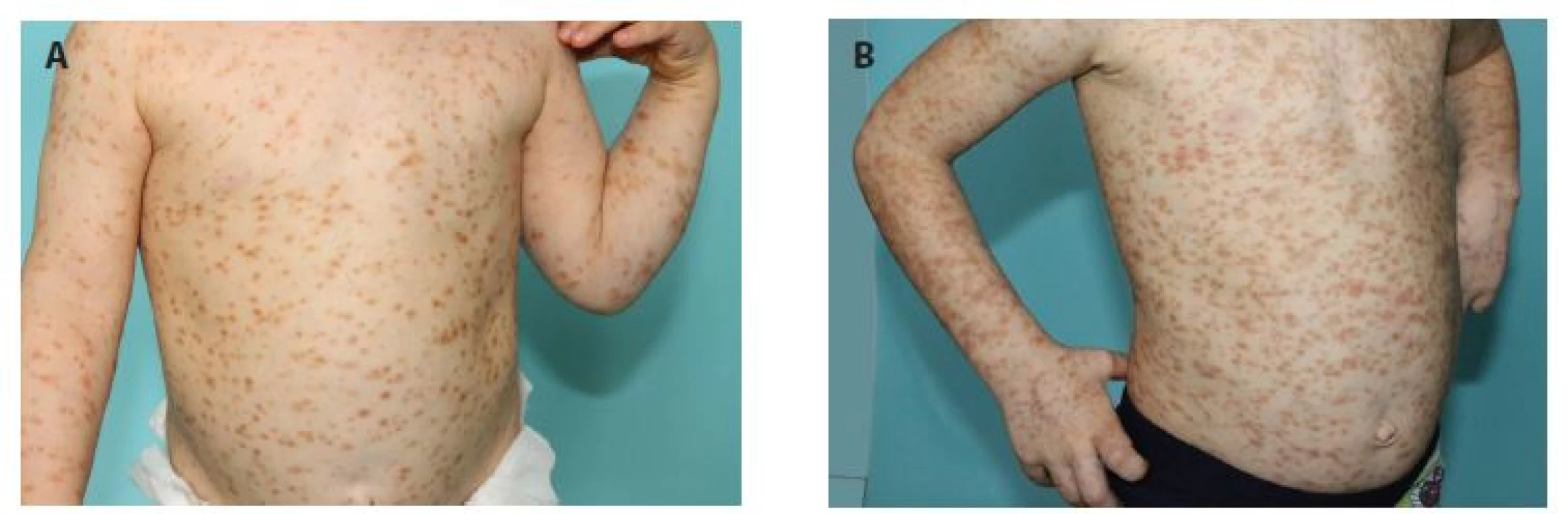
Někdy se mediátorové příznaky objeví i po výraznějším podráždění většího mastocytomu. U dětí s mastocytomy nebo urticaria pigmentosa je nejčastější flush, jiné příznaky jsou vzácnější. Spouštěče jsou také velmi různorodé (tab. 2). Systémové mediátorové příznaky nejsou synonymem pro systémovou formu mastocytózy.
Tab. 2. Možné spouštěče mediátorových reakcí 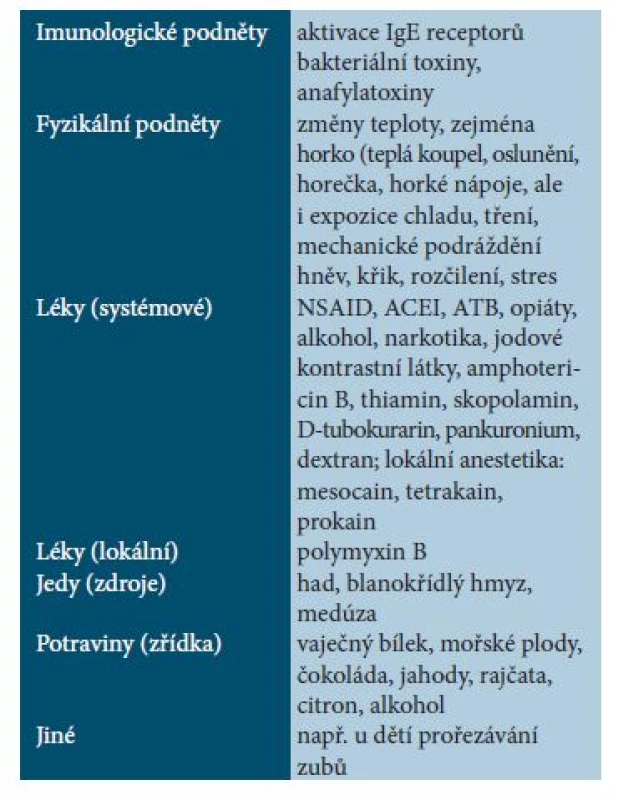
Systémová mastocytóza (SM)
Systémové onemocnění je přítomno u velké části dospělých s kožním příznaky mastocytózy, ale je zřídkavé u dětí. SM u dospělých je mnohem častější (obr. 5), než se dříve předpokládalo, protože ne všichni pacienti s kožními příznaky jsou náležitě vyšetřeni. Diagnostický postup je uveden v tabulce 3, diagnostická kritéria v tabulce 4, nejčastěji se SM potvrdí na základě biopsie kostní dřeně, normální hladina tryptázy u dospělých (do 20 ng/ml) SM nevylučuje. Prediktorem systémového postižení u dětí je rozsah kožních projevů, výrazně zvýšená hladina tryptázy nad 100 ng/ml a zejména hepatosplenomegalie [4].
Tab. 3. Diagnostický postup u dospělého pacienta s mastocytózou 
Obr. 5. Pacient s projevy od 36 let
Mediátorové příznaky nemá, splňuje diagnostická kritéria pro systémovou mastocytózu – indolentní formu, potvrzena mutace c-kit D816V, t. č. bez mediátorových příznaků, bez léčby, pouze pravidelně sledován na hematologii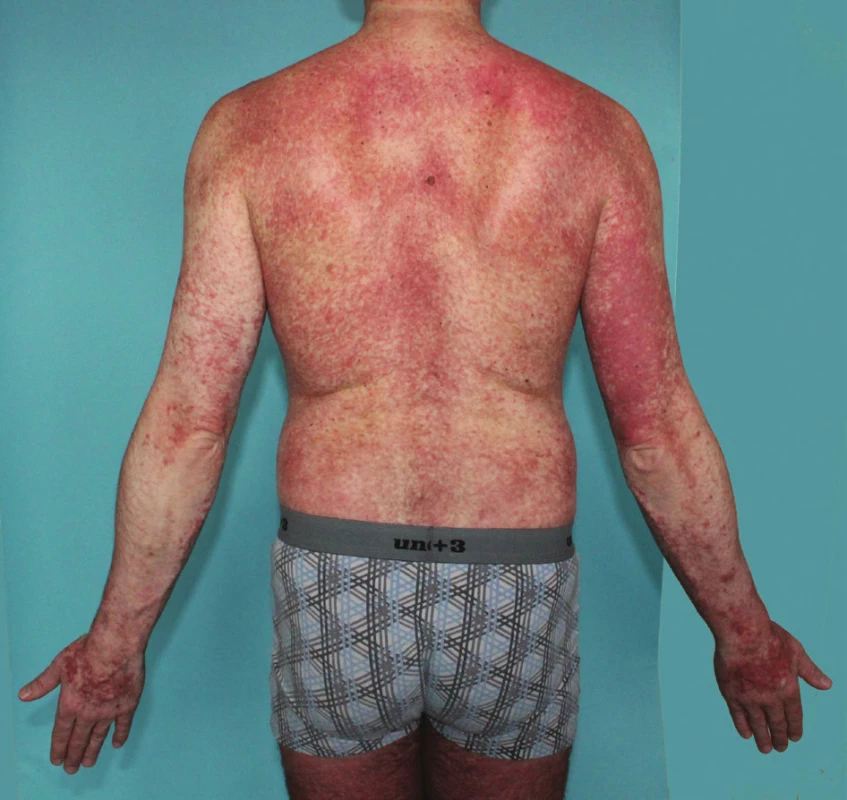
U dětí se vzhledem k prognosticky příznivému průběhu standardně neprovádí denzitometrie (jen u nevysvětlitelných bolestí kostí), genetické vyšetření a biopsie kostní dřeně (jen při hladině sérové tryptázy nad 100 μg/ml nebo jejím progresivním zvyšování, abnormálním nálezu v periferní krvi a při organomegalii (játra, slezina, lymfatické uzliny).
U 10–20 % pacientů se SM jsou patrny změny v krevním obraze (anémie, leukocytóza, trombocytopenie/trombocytóza, eozinofilie, bazofilie, monocytóza), cirkulující mastocyty bývají nalezeny vzácně, a to u agresivních onemocnění (ASM a MCL) či u SM asociované s klonálním hematologickým onemocněním (SM-AHN).
Pravidelné kontroly u dospělých i dětí jsou nutné většinou 1–2krát ročně. U dospělých zahrnují anamnézu, klinické vyšetření, krevní obraz, základní biochemické parametry, hladinu sérové tryptázy a sonografii břicha [12]. U dětí je obdobně vždy vyšetřována kůže, lymfatické uzliny, pohmatově a poklepově břicho – velikost jater a sleziny. Pokud jsou přítomny mediátorové příznaky (flush, průjem, bolesti břicha) bez ohledu na rozsah kožního postižení je doporučeno vyšetření krevního obrazu, jaterních testů a sérové tryptázy. Biopsie kostní dřeně, sonografie břicha a denzitometrie jsou indikovány v případě abnormalit předchozích vyšetření nebo v případě, když kožní projevy a elevace tryptázy přetrvávají po pubertě [19].
Anamnesticky vždy zjišťujeme přítomnost mediátorových příznaků či závažných celkových příznaků, jako je např. únava, úbytek na hmotnosti, horečnaté stavy. Při změně klinického stavu či těžkých symptomatických formách je frekvence kontrol individuální podle tíže stavu.
SCORMA index
Byl navržen nizozemskými autory v roce 2001 a je užíván k semikvantitativnímu hodnocení rozsahu onemocnění. Sleduje:
- A: rozsah projevů (postižený povrch těla v %);
- B: intenzitu infiltrace, barvy, Darierova příznaku, tvorby vezikul v rozsahu 0–3 u každé položky;
- C: přítomnost a intenzitu subjektivních příznaků, či provokačních faktorů (flush, průjem, svědění, lokalizované bolesti kostí) na vizuální analogové škále 0–10.
Výsledná hodnota vypočítaná ze vzorce: A/5 + 5B + 2C/5 se pohybuje v rozmezí 5,2–100 [9].
Histologický obraz
V kožní biopsii nacházíme oválné nebo vřetenité mastocyty v papilární a horní retikulární dermis perivenulárně, eventuálně s menší příměsí eozinofilů. Je přítomna hyperpigmentace stratum basale. K vizualizaci mastocytů je možné využit barvení Giemsa, toluidinovou modř (obr. 6), či protilátky proti tryptáze. U mimokožních tkání, které se vyšetřují v rámci diagnostiky SM, se většinou provádí vyšetření kostní dřeně a infitrát musí splňovat specifická morfologická i imunohistochemická kritéria (viz tab. 4). Biopsie kostní dřeně a vyšetření tryptázy je indikováno i u dospělých pacientů s idiopatickou anafylaxí a anafylaxí po štípnutí blanokřídlým hmyzem, zvláště při negativitě IgE.
Tab. 4. Diagnostická kritéria pro SM podle WHO 
Musí být splněno 1 velké a 1 malé nebo alespoň 3 malá kritéria. Obr. 6. Histologický obraz Urticaria pigmentosa 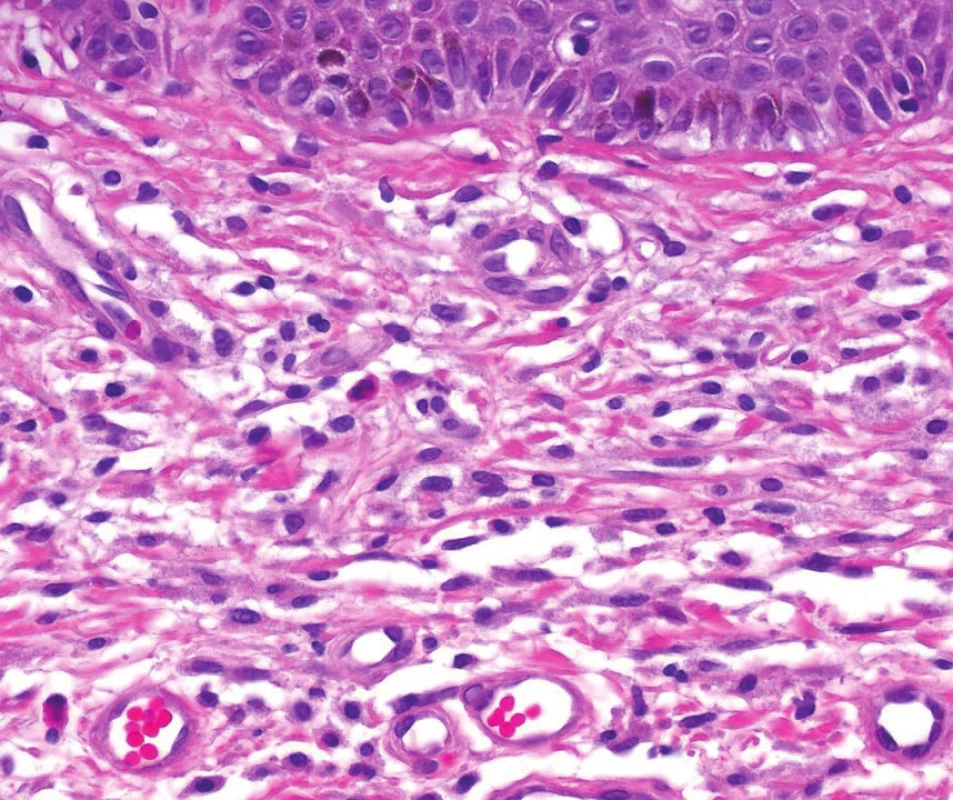
Prognóza
Dětská mastocytóza často regreduje do puberty, více než u 60 % případů dochází k úplné regresi, u 20 % ke zmírnění projevů. Difuzní kožní mastocytóza může být spojena se závažnými mediátorovými projevy a komplikacemi, ale i v těchto případech často dochází k redukci kožního postižení a systémových příznaků s věkem, perzistuje zde často ztluštění a hyperpigmentace kůže. U dospělých je onemocnění chronické, systémové formy jsou časté, ale většinou mají indolentní průběh, agresivní formy jsou vzácné.
Riziko alergických reakcí a anafylaxe u mastocytóz
Frekvence výskytu astmatu, alergické rinitidy a potravinové alergie je u pacientů s mastocytózou stejná jako v normální populaci. Je ale vyšší výskyt alergie na poštípání blanokřídlým hmyzem, a to nejvíce u dětí mužského pohlaví. Častěji se vyskytuje anafylaxe nejvíce idiopatická, ale také po potravinách, lécích a poštípaní blanokřídlým hmyzem (tato je častější u dětí). Mediátorové symptomy u anestezie se vyskytují častěji u dětí (4 %) než u dospělých (2 %), taktéž je vyšší výskyt anafylaktické reakce u anestezie lokální či celkové, a to více u dětí (2 %) než u dospělých (0,4 %), toto riziko koreluje s tíží výkonu. Zcela nelze vyloučit ani psychické vlivy, protože při náležité premedikaci se tyto reakce neobjeví ani při podání stejného léku. U normální populace je riziko anafylaxe u anestezie 0,004–0,03 % [14].
Režimová opatření a prevence
Všechny pacienty a rodiče dětí s mastocytózou musíme poučit o možných spouštěčích mediátorových reakcí a doporučit jim, aby byli preventivně vybaveni antihistaminiky, a to i v případě, že pacient anamnesticky zatím žádné příznaky nepopisuje. Je vhodné vyhýbat se výraznému oslunění, změnám teploty, poštípání blanokřídlým hmyzem a určitým lékům, jak je uvedeno v tabulce 2. Také je nutné, aby všichni ošetřující lékaři včetně anesteziologa a operatéra byli informování o tomto onemocnění. Pacienti se závažnou mediátorovou reakcí v anamnéze musí být vybaveni epinefrinovým autoinjektorem.
Terapie
Léčbou ovlivňujeme kožní příznaky, lokální či systémové mediátorové příznaky a v nejkrajnějším případě léčíme agresivní systémové formy.
Vzhledem k širokému spektru a individualitě příznaků a také k různorodým genetickým/epigenetickým alteracím u jednotlivých pacientů musí být i terapie individualizovaná. V podstatě neexistuje jednoznačné oficiální doporučení pro léčbu. Taktéž množství studií věnujících se léčbě mastocytóz a MCAS je omezené a přináší někdy rozporuplné výsledky. Jako první krok je nutné vyloučit provokující faktory, posléze zvolit druh použitého léčiva podle typu potíží a jejich intenzity. Nejdříve je nutné vyzkoušet toleranci léku, poté jeho efekt, který by se měl projevit během 1–2 měsíců. Rozumná individuální úprava dávkování a frekvence aplikace je také možná.
Obecně se můžeme řídit doporučením, že u pacientů se žádnými nebo mírnými lokálními a systémovými příznaky trvalá léčba není nutná. Při střední intenzitě příznaků je vhodné volit antimediátorovou terapii, při větší intenzitě příznaků nereagujících na tuto léčbu je potřebné přistoupit k další linii terapie a u závažných příznaků je nutná intenzivní péče. SM indolentní jsou pouze pravidelně sledovány hematologem, léčba agresivních forem je také v kompetenci hematologa a využívá chemoterapii (cladribin, hydroxyureu), interferon alfa či cílově specifické inhibitory (např. imatinib mesylát, midostaurin).
Mezi léky první volby patří zejména antihistaminika, zejména nesedativní H1 preparáty (cetirizine, levoceririzin, loratadine) a při intenzivní symptomatologii i sedativní H1 zástupci (bisulepin). K dalším vhodným preparátům patří ketotifen, antileukotrieny – montelukast ve dvou denních dávkách, kromoglykát sodný. Kromoglykát je účinný zejména na gastrointestinální projevy, ale uplatňuje se na pruritus a flush při inhalačním podání, někdy účinkuje i na bolesti hlavy. Při gastrointestinálních symptomech lze podávat H2 anthistaminika a hlavně inhibitory protonové pumpy tlumící sekreci žaludeční kyseliny, která je u mastocytózy často zvýšená.
Při perzistentním flush lze s velkou opatrností (patří k možným spouštěčům mediátorové reakce) využít kyselinu acetylosalicylovou inhibující cyklooxygenázu v dávkách 50–350 mg denně. Je nutné začínat nízkou dávkou a tuto postupně navyšovat.
Druhou linií terapie jsou imunosupresivní léky. Celkové kortikosteroidy se užívají v dávce 20 mg až 1 mg/kg denně, většinou po dobu několika týdnů s následným postupným snižováním dávky. Může je indikovat také hematolog u SM, zejména v počátku léčby jinými cytoreduktivními látkami. Mají inhibiční vlivy na růst mastocytů mimo jiné i potlačením tvorby stem cell faktoru ve tkáních (ligand pro c-kit receptor) a taktéž zlepšují malabsorpci a redukují systémové příznaky [18]. Alternativně lze využít cyklosporin A, azathioprin, metotrexát v parenterální formě.
Třetí linií terapie je omalizumab – humanizovaná monoklonální protilátka proti IgE.
Čtvrtá linie je pak reprezentována inhibitory (tyrozin)kináz.
Další linie zahrnuje cytoreduktivní terapii, experimentální léky a intenzivní péči u pacientů se závažnými mediátorovými příznaky (anafylaktický šok). Pacienti, u kterých jsou tyto projevy v anamnéze, musí být vybaveni epinefrinovým autoinjektorem.
Lokální terapie se většinou opírá o lokální kortikosteroidy i v okluzi, po dobu několika týdnů, či při akutních příznacích. Zejména u dětí je pak nutné dbát na velikost postižené plochy, aplikace je omezená na 1/3 plochy těla. V zahraniční literatuře se zmiňuje i lokální aplikace kromoglykátu sodného, 4% emulze je v některých zemích dostupná i pro léčbu atopické dermatitidy [20]. Některé studie uvádějí možné využití miltefosinu (syntetický derivát fosfocholinu využívaný v paliativní léčbě kožních metastáz karcinomu prsu) vzhledem k jeho inhibičnímu efektu na aktivitu MC [15].
Fototerapie systémová nebo bath PUVA dnes bohužel v ČR není dostupná a u dětí je sporná pro vysoké riziko nežádoucích účinků. Lze zkusit úzkopásmové UVB nebo UVA1.
Preventivní opatření u chirurgických výkonů v lokální či celkové anestezii a při vyšetřeních s použitím kontrastních látek jsou většinou premedikace benzodiazepiny a antihistaminiky, eventuálně kortikosteroidy před výkonem. U pacientů, u kterých je pozitivní anamnéza mediátorové reakce při předchozím operačním výkonu, se doporučuje alergologické vyšetření včetně dostupných IgE protilátek a intradermálních testů u podezřelých spouštěčů. Doporučuje se používat léky s nízkým potenciálem k degranulaci MC (syntetické opioidy) a vyhnout se lékům, které mají vysoký potenciál k degranulaci MC (morfin, kodein, některá histamin uvolňující myorelaxancia, zejména atrakurium a mivacurium, analgetikum nefopam). Chybí však randomizované kontrolované studie a metaanalýzy [5]. Anxiolýza a analgezie samozřejmě snižuje psychický stres pacienta, který může být spouštěčem degranulace MC. Je potřeba vyhnout se hypo/hypertemii (monitorování teploty je nutné) a mechanickému dráždění pacienta. Jednoznačný doporučený postup na našem pracovišti neexistuje. U dětské mastocytózy je tato problematika velmi přehledně rozpracována v [3].
DISKUSE
Mastocytózy jsou heterogenní skupinou onemocnění vyvolanou patologickým zmnožením mastocytů, většinou na podkladě mutace c-kit. Onemocnění se velmi často manifestuje v kůži. U dětí může být kožní postižení přítomné už při narození, často se manifestuje v prvních měsících, či letech života. Velká část dětských mastocytóz mizí do puberty a chybí u nich systémové postižení. U kožních mastocytóz perzistujících po pubertě a u dospělého pa-cienta je vždy nutné systémové postižení vyloučit náležitým vyšetřením včetně biopsie kostní dřeně. Kromě kožních projevů jsou s mastocytózou spojeny i mediátorové příznaky. Nesetkáváme se s nimi v praxi často, ale je nutné vést anamnézu pacienta cílenými dotazy. Mediátorové příznaky jsou různě intenzivní a jsou vyvolané infiltrací orgánů, či uvolněním mastocytárních mediátorů. S rozsahem kožního postižení a stoupající hladinou tryptázy stoupá i riziko mediátorových příznaků. Léčba mastocytóz závisí od druhu a intenzity příznaků. Důležitá je prevence degranulace mastocytů, která spočívá ve vyloučení provokujících faktorů a náležitých opatřeních při chirurgických a invazivních diagnostických výkonech.
Do redakce došlo dne 6. 6. 2018.
Adresa pro korespondenci:
MUDr. Zuzana Plzáková, Ph.D.
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 499/2
128 00 Praha 2
e-mail: zuzana.plzakova@lf1.cuni.cz
Kontrolní test
1. Mastocytózy se mohou projevovat
- a) solitárními ložisky v kůži
- b) solitárními ložisky mimo kůži
- c) mnohočetnými ložisky v kůži
- d) difuzním postižením kůže
2. Mastocytózy u dětí
- a) se typicky projevují jako tzv. teleangiectasia macularis eruptiva perstans
- b) jsou zřídka systémové
- c) se často manifestují už v prvních 2 letech života
- d) vždy perzistují do dospělosti
3. K tvorbě puchýřů může dojít u
- a) mastocytomu
- b) urticaria pigmentosa
- c) difuzní kožní mastocytózy
- d) žádného z výše uvedených
4. K monitorování aktivity mastocytózy využíváme
- a) tryptázu v séru
- b) tryptázu v moči
- c) metabolity histaminu v moči
- d) serotonin v séru
5. Kožní mastocytóza může být doprovázena
- a) lokálními mediátorovými příznaky
- b) infiltrací kostní dřeně atypickými mastocyty
- c) zmnožením atypických mastocytů v krvi
- d) systémovými mediátorovými příznaky
6. U dospělého pacienta s mastocytózou v kůži vylučujeme systémovou mastocytózu
- a) vždy
- b) jen při přítomnosti mediátorovým příznaků
- c) jen při hladině sérové tryptázy vyšší než 100 ng/ml
- d) jen pokud měl anafylaktický šok
7. Ke stanovení diagnózy
- a) kožní mastocytózy je nutné histologické vyšetření projevů
- b) systémové mastocytózy je nutná biopsie kostní dřeně
- c) systémové mastocytózy bohužel neexistují přesná kritéria
- d) kožní mastocytózy je nutné vyšetření sérové tryptázy
8. Kožní projevy mastocytóz
- a) často krvácí při mechanickém podráždění
- b) jsou většinou lokalizovány ve dlaních a v tříslech
- c) mají typické šedomodré zbarvení
- d) většinou zduří a zarudnou při mechanickém podráždění
9. Pacienti s mastocytózou
- a) mají často také atopickou dermatitidu
- b) mají zvýšené riziko alergické reakce u anestezie
- c) musí být vždy vybaveni epinefrinovým autoinjektorem
- d) musí o onemocnění informovat ošetřující lékaře a anesteziologa
10. V léčbě mastocytóz
- a) využíváme léky tlumící mediátorové příznaky
- b) se řídíme rozsahem onemocnění a intenzitou mediátorových příznaků
- c) vždy indikujeme systémové kortikosteroidy
- d) je cílem úplné vymizení kožních příznaků
Správným zodpovězením otázek kontrolního testu získáte 2 kredity kontinuálního vzdělávání lékařů ČLK, které budou zasílány redakcí jedenkrát ročně po uzavření ročníku časopisu. Správné odpovědi na otázky kontrolního testu budou uveřejněny v příštím čísle časopisu. Odpovědi posílejte na e-mailovou adresu kozni@lf1.cuni.cz vždy nejpozději do jednoho měsíce od vydání daného čísla.
Odpovědi na otázky kontrolního testu v č. 2/2018: Nováková J.: Erysipel a celulitida
Správné dopovědi: 1b, 2b, 3d, 4c, 5d, 6a, 7c,d, 8a,c, 9a, 10c.
Zdroje
1. ALVAREZ-TWOSE, I., VAÑÓ-GALVÁN, S., SÁNCHEZ-MUÑOZ, L. et al. Increased serum baseline tryptase levels and extensive skin involvement are predictors for the severity of mast cell activation episodes in children with mastocytosis. Allergy, 2012, 67, 6, p. 813–821.
2. ARBER, D. A., ORAZI, A., HASSERJAN, R. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood, 2016, 127, 20, p. 2391–2405.
3. BUČKOVÁ, H., FEJT, J. Mastocytózy u dětí. Čes-Slov Derm, 2010, 85, 3, p. 120–138.
4. CARTER, M. C., CLAYTON, B. S., KOMAROW, H. D. Assesment of clinical findings, tryptase level, and bone marrow histopathology, in the management of pediatric mastocytosis. J. Allergy Clin. Immunol., 2015, 136, 6, p. 1673–1679.
5. DEWACHTER, P., CASTELS, M. C., HEPNER, D. L. et al. Perioperative management in patients with mastocytosis. Anesthesiology, 120, 3, p. 753–759.
6. GUPTA, K, HARVIMA, I. K. Mast cell-neurogenic interactions contribute to pain and itch. Immunol. Rev., 2018, 282, 1, p. 168–187.
7. HANNADOES, R., ROGERS, M. Presentation of cutaneous mastocytosis in 173 children. Australas J. Dermatol., 2001, 42, 1, p. 15–21.
8. HARVIMA, I. K., NILSSON, G. Mast cells as regulators of skin inflammation and immunity. Acta Derm. Venereol., 2011, 91, 6, p. 644–650.
9. HEIDE, R., MIDDELKAMP HUP, M. A., MULDER, P. G. H. et al. Clinical scoring of cutaneous mastocytosis. Acta Derm. Venereol., 2001, 81, 4, p. 273–276.
10. CHAN, A., TUNG, R. C., SCHLESINGER, T. et al. Familial cutaneous mastocytosis. Ped. Dermatol., 2001, 18, 4, p. 271–276.
11. CHATTERJEE, A., GHOSH, J., KAPUR, R. Mastocytosis – a mutated KIT receptor induced myeloprotiferative distorder. Oncotarget, 2015, 6, 21, p. 18250–18264.
12. LANGE, M., NEDOSZYTKO, B., GORSKA, A. et al. Mastocytosis in children and adults: clinical disease heterogeneity. Arch. Med. Sci., 2012, 8, 3, p. 533–541.
13. MATITO, A., CARTER, M. Cutaneous and systemic mastocytosis in children: a risk factor for anaphylaxix. Curr. Allergy Asthma Rep., 2015, 15, 5, 22. doi: 10.1007/s11882-015-0525-1.
14. MATITO, A., MORGADO, J. M., SÁCHEZ-LÓPEZ, P. et al. Management of anesthesia in adult and pediatric mastocytosis: a study of the Spanish network on mastocytosis (REMA) based on 726 anasthetic procedures. Int. Arch. Allergy Immunol., 2015, 167, 1, p. 47–56.
15. MAURER, M. MAGERL, M., METZ, M. Miltefosine a novel treatment option for mast cell-mediated disease. J. Dermatol. Treat., 2013, 24, 4, p. 244–249.
16. MOLDERINGS, G. J., HAENISCH, B., BOGDANOW, M. et al. Familial occurrence of systemic mast cell activation disease. PLOS One, 2013, 8, 9, doi: 10.1371/journal.pone.0076241. eCollection 2013.
17. MOLDERINGS, G. J., HAENISCH, B., BRETTNER, S. et al. Pharmacological treatment options for mast cell activation disease. Arch. Pharmacol., 2016, 389, 7, p. 671–694.
18. Nováková, L., Kučera, P. Systémová mastocytóza Transfuze Hematol dnes, 2009, 15, 1, p. 31–38.
19. ROTHE, M. J., GRANT_KELS, J. M., MAKKAR, H. S. Mast cell disorders: Kids are not just little people. Clin. Dermatol., 2016, 34, 6, p. 760–766.
20. STEVENS, M. T., EDWARDS, A. M. The effect of 4% sodium cromoglicate cutaneous emulsion compared to vehicle in atopic dermatitis in children-A meta analysis of total SCORAD scores. J. Dermatol. Treat., 2015, 26, 3, p. 284–290.
Štítky
Dermatológia Detská dermatológia
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2018 Číslo 3- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- Prurigo pigmentosa – popis případu
- Klinický případ: Bolestivý nodulus na rameni
- Zhodnocení výskytu dermatoskopických struktur bazaliomu s možnou predikcí histopatologického typu
- LYMFEDÉM
- Zápis ze schůze výboru ČDS Praha 8. 2. 2018
- Zpráva z výročního mítinku Americké akademie dermatologie (AAD) San Diego (Kalifornie, USA) 16.–20. 2. 2018
- Odborné akce 2018
- Mastocytózy
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mastocytózy
- LYMFEDÉM
- Klinický případ: Bolestivý nodulus na rameni
- Zhodnocení výskytu dermatoskopických struktur bazaliomu s možnou predikcí histopatologického typu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy