-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Biopsie v dermatovenerologii
Biopsy in Dermatovenereology
The biopsy plays a crucial role in dermatovenereology in the diagnostics of skin diseases. Biopsy pathway includes its indication, tissue sampling, transport and processing, clinicopathological correlation by the dermato-pathologist, interpretation of the histological finding and final clinicopathological correlation by the dermatovenereologist. The benefit of the biopsy is conditioned by the proper execution of the individual actions. The article presents a description of the individual steps of the biopsy process and their pitfalls.
Key words:
skin biopsy – fixation – dermatopathology – excision – artefact – pitfalls
Autoři: M. Důra 1,2; J. Štork 1
Působiště autorů: Dermatovenerologická klinika 1. LF UK a VFN v Praze, přednosta prof. MUDr. Jiří Štork, CSc. 1; Ústav patologie 1. LF UK a VFN v Praze, přednosta prof. MUDr. Pavel Dundr, Ph. D. 2
Vyšlo v časopise: Čes-slov Derm, 93, 2018, No. 4, p. 127-135
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Biopsie zaujímá v dermatovenerologii zásadní úlohu v diagnostice kožních onemocnění. Proces biopsie zahrnuje její indikaci, odběr, transport a zpracování tkáně, klinicko-patologickou korelaci dermato-patologem, interpretaci histologického nálezu a finální klinicko-patologickou korelaci dermatovenerologem. Přínos biopsie je podmíněn správným provedením jednotlivých úkonů. Článek předkládá popis jednotlivých kroků procesu biopsie a jejich úskalí.
Klíčová slova:
kožní biopsie – fixace – dermatopatologie – excize – artefakt – úskalí
Biopsie představuje jeden z nejčastějších a nejdůležitějších výkonů prováděných v dermatologické klinické praxi, jehož nedokonalé provedení může vést ke zkreslení jejího výsledku. Předkládaný text upozorňuje na úskalí spojené s tímto úkonem a shrnuje hlavní zásady, které jsou předpokladem zajištění přínosu tohoto vyšetření.
Řetězec úkonů při získání, zpracování a hodnocení bioptického materiálu začíná již samotným zhodnocením přínosu výkonu a končí aplikací klinicko-patologické korelace dermatovenerologem pro další diagnosticko-terapeutický postup. Každý článek tohoto řetězce vykazuje své specifické aspekty a požadavky (tab. 1).
Tab. 1. Proces biopsie – řetězec úkonů spjatých s provedením biopsie 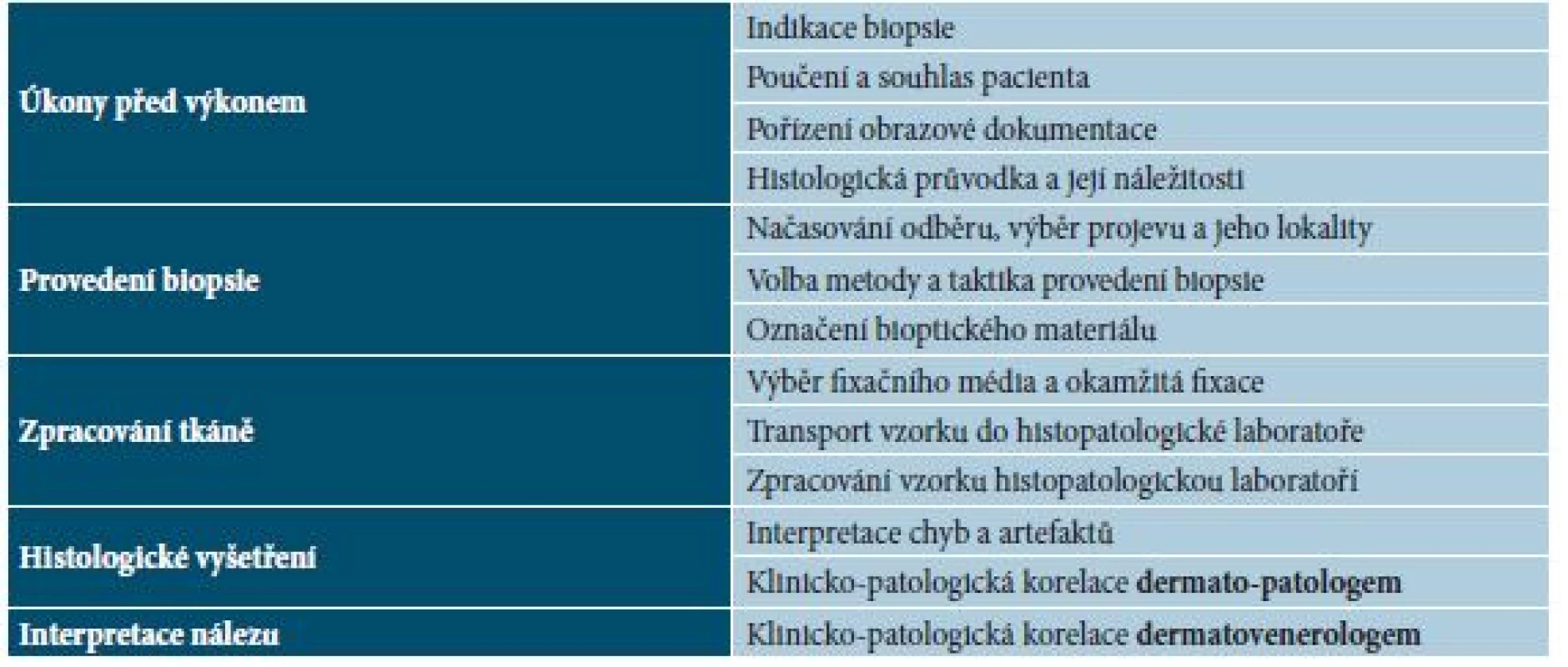
ÚKONY PŘED VÝKONEM
Indikace biopsie
Provedení biopsie indikujeme při nejednoznačnosti klinické diagnózy, kdy s histologickým výsledkem očekáváme potvrzení či vyvrácení pracovní diagnózy či zúžení diferenciální diagnózy, při dokladování diagnózy z forenzních důvodů, vyžaduje-li to léčebné rozhodnutí (např. molekulárně-genetické vyšetření mutace v genu BRAF před nasazením BRAF inhibitorů pro metastazující melanom či molekulárně-genetická detekce mikroorganismů), při kontrole účinnosti léčby (např. reexcize tumoru), či výsledek slouží jako důležitý prognostický ukazatel. Vždy je nutno zhodnotit poměr riziko/přínos výkonu. Biopsie není indikována, pokud je stanovena diagnóza klinickým a případně paraklinickým vyšetřením a výsledek biopsie neovlivní léčebný proces či prognózu pacienta, který by tak byl zbytečně zatížen případnými operačními komplikacemi.
Poučení a souhlas pacienta
Pacienta poučíme před provedením biopsie o přínosu, rizicích a o samotném průběhu výkonu včetně modifikace případné antiagregační či antikoagulační terapie. Po slovní edukaci pacienta, zodpovězení případných otázek a prostudování písemného informovaného souhlasu stvrdí pacient svůj souhlas vlastnoručním podpisem.
Pořízení obrazové dokumentace
Fotodokumentace klasickým fotoaparátem či digitálním dermatoskopem je významnou součástí diagnosticko-terapeutického procesu. Při pořizování fotodokumentace provádíme přehledný snímek umožňující zhodnotit predilekční lokalizaci, polodetail zachycující uspořádání exantému a detail umožňující hodnocení typu eflorescence vybraného k bioptickému vyšetření.
Histologická průvodka a její náležitosti
Řádně vyplněná histologická průvodka je zásadním předpokladem přínosu vyšetření. Kromě základních údajů o pacientovi je nutné uvést relevantní anamnestické údaje (zejména základní interní onemocnění a úplnou lékovou anamnézu, což lze doplnit přiloženou zprávou), trvání a případný vývoj projevu, typ odebrané eflorescence (např. makula, papula, solitární – generalizovaný výsev), klinickou diferenciálně-diagnostickou rozvahu (obecně platí, že i zdánlivě absurdní nápad někdy muže být přínosným), výsledek případné předchozí biopsie a též údaje, které mohou ovlivnit histologický obraz, a to zejména traumatizace, systémová a lokální terapie.
Kupříkladu terapie systémovými či lokálními kortikosteroidy může ovlivnit intenzitu zánětlivého infiltrátu v koriu, vede k atrofii epidermis s telangiektaziemi. Údaj o předchozí probatorní biopsii při reexcizi vysvětluje nález jizvy různého stáří či zánětlivých změn. Lokálně aplikovaný podofylin vede k apoptóze keratinocytů a zvýšenému množství mitóz ve spodních vrstvách epidermis [10].
Při asymetrickém či neobvyklém lokálním nálezu je vhodné provést na samotnou žádanku velmi jednoduchý schematický nákres léze či přiložit obrazovou dokumentací (klinickou nebo dermatoskopickou) a upozornit na okrsky, které by při rutinním zpracování mohly být přehlédnuty a nemusely být řádně prokrájeny a zhodnoceny.
PROVEDENÍ BIOPSIE
Načasování odběru, výběr projevu a jeho lokality
Každá eflorescence prodělává během svého „života“ různé fáze změn, z nichž pouze některé mohou být mikroskopicky diagnostické. Z tohoto důvodu je naprosto zásadní správné načasování odběru projevu v diagnostické fázi vývoje, v drtivé většině případů se jedná o čerstvou lézi. Kupříkladu rozvíjející se lichen ruber planus je charakterizován lichenoidním zánětlivým infiltrátem různé intenzity, jeho pozdní fáze však může vykázat pouze minimální histologické změny charakteru melanofágů v horním koriu a přítomnost cytoidních tělísek v oblasti dermoepidermální junkce [12]. V obrazu nově vzniklé leukocytoklastické vaskulitidy do 48 hod. od jejího vzniku nacházíme neutrofilní perivaskulární infiltrát, po této době je infiltrát postupně nahrazován lymfocyty a makrofágy. Jaderná debris pocházející z neutrofilních granulocytů spolu s depozity fibrinu zde však perzistují. Z tohoto důvodu má biopsie kožní vaskulitidy pro přímou imunofluorescenci největší výtěžnost v době do 24 hodin od vzniku léze. Avšak pro klasické histologické vyšetření je nejvhodnější plně rozvinutá eflorescence starší než 72 hodin [4]. Názory na načasování odběru biopsie kožní vaskulitidy se však poněkud liší.
Při výběru vhodného projevu se snažíme zvolit k excizi primární eflorescence charakterizující typickou neporušenou lézi daného exantému. Vyhýbáme se místům sekundárně změněným, exkoriovaným či impetiginizovaným, krustám a dalším sekundárním změnám, které mohou změnit histologický obraz. K označení vybraného místa můžeme před výkonem užít alkoholem nesmazatelný fix či fix přímo určený k tomuto účelu.
Máme-li možnost výběru lokalizace k odběru biopsie, např. při výsevu exantému na trupu a končetinách, volíme přednostně odběr z trupu. Odběr z dolní končetiny je obecně zatížen vyšším rizikem zkresleného výsledku a prodloužením doby hojení, zejména v terénu varikózních žil. Při výsevu pouze na dolních končetinách volíme proximální léze. Pokud to rozložení exantému umožní, snažíme se vyhnout oblastem chronicky osvětleným (zejména kůži hlavy) a oblastem nad prominujícími kostmi, případně kůže dlaní a plosek. Při výběru místa zvažujeme též hledisko jednoduššího odběru a hledisko kosmetické.
Výběr místa odběru u specifických diagnóz
Při výběru místa pro probatorní excizi z pigmentové léze (např. v oblasti obličeje, kde zvažujeme v diferenciální diagnostice lentigo maligna či lentigo maligna melanom) vybíráme místa, která se podle dermatoskopického nálezu jeví jako nejvíce suspektní, tato místa můžeme s výhodou dermatochirurgovi označit výše zmíněným fixem. Je-li pigmentová léze vícebarevná, neváhejme provést vícečetný odběr z okrsků rozdílné barvy. Nejtmavší místo pigmentové léze koreluje s největším množstvím melaninu v epidermis či melanofázích koria, nemusí však nutně korelovat s „maligním“ obrazem. Podle literatury při probatorní excizi pigmentové léze nedochází k rozsevu nádorových buněk či zvýšení pravděpodobnosti postižení spádových lymfatických uzlin [11].
U bulózních dermatóz má největší přínos odběr malého puchýře (např. takový, jehož průměr je o něco menší než průměr zvoleného průbojníku) s odběrem perilezionální kůže k vyšetření přímou imunofluorescencí. Perilezionální tkáň je obecně definována jako lem tkáně kolem eflorescence do 1 cm. U větší buly je nejvhodnější místo při jejím okraji (v místě štěpení) se současným odběrem perilezionální tkáně (obr. 1). Stáří vytipovaného puchýře by nemělo přesáhnout 10–12 hod., jelikož starší bula vykazuje nekrózu epidermální krytby a reepitelizaci spodiny. U puchýře staršího data může též dojít k proteolytickému štěpení antigenů. Čerstvý puchýř je možno vyvolat před výkonem i arteficiálně (tlakem či třením) např. u epidermolysis bullosa [4].
Obr. 1. Vícečetné buly při onemocnění ze skupiny bulózních dermatóz V levém dolním kvadrantu je čerstvá bula s napnutou krytbou, tečkou je vyznačeno místo, které by bylo vhodné k perilezionálnímu odběru vzorku pro vyšetření přímou imunofluorescencí. Vpravo a nahoře jsou buly staršího data se sekundárními změnami, které k odběru vhodné nejsou. 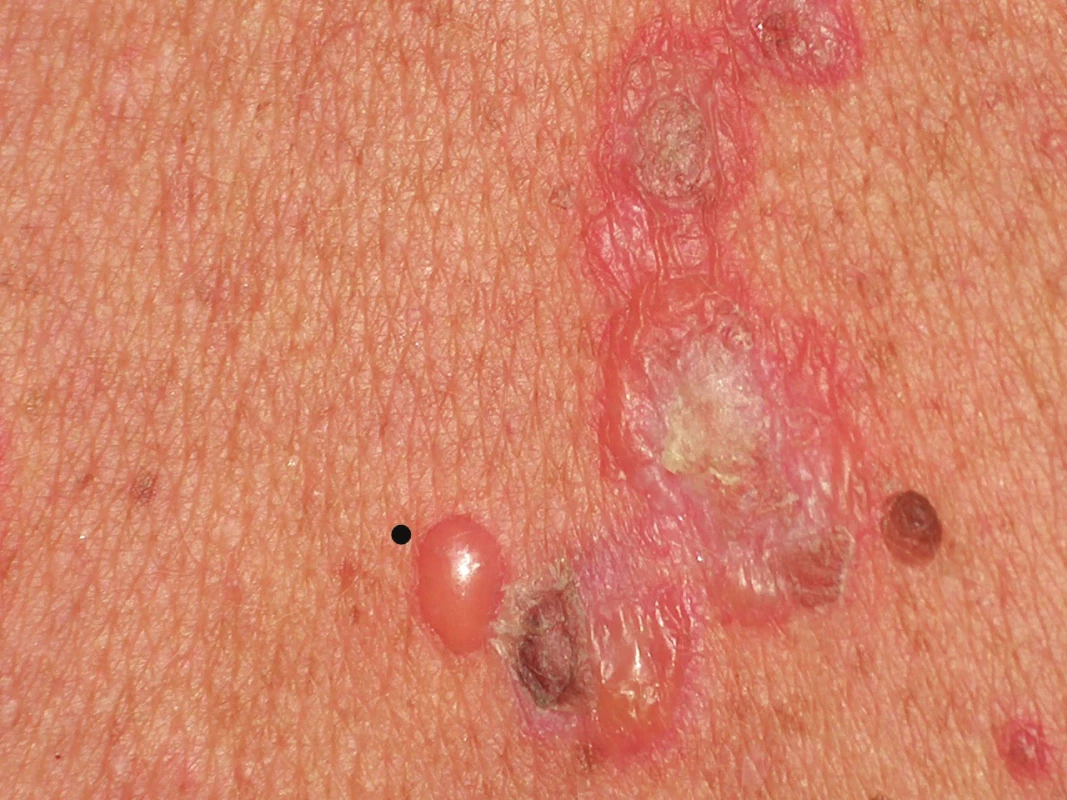
Jako nejlepší místo probatorní excize ze sliznice se u bulózních dermatóz jeví intaktní mukóza vzdálená asi 3–5 mm od nově vzniklé eroze.
U anulárních projevů většinou přistupujeme k odběru z periferního elevovaného lemu (např. v případě porokeratózy je nález kornoidní lamely na periferii léze pro stanovení diagnózy nezbytný [15]). Alternativně můžeme přistoupit k provedení odběru dvou vzorků – z periferie a centra léze.
U diagnózy livedo reticularis či livedo racemosa se odběr provádí z bledého centra jednotlivých okrsků síťovitého erytému, kde očekáváme vystupňované diagnostické změny cévních stěn. Případně můžeme opět přistoupit k odběru dvou vzorků (bledá a erytematózní část), někdy si nález vyžádá opakování biopsie.
V případě morfey je nutné uvést, která část léze byla zavzata do biopsie – erytematózní, indukovaná či přechodná. Erytém značí aktivitu choroby s probíhajícím zánětem, indurace svědčí pro již započatý fibrotizující proces, diagnostická bývá přechodná část se zánětem a již hmatnou indurací.
U alopecií vybíráme přednostně místa na erytematózní periferii alopetického ložiska, kde se ještě nachází vlasové kmeny, a to zejména v případě alopecií jizvících. Při výběru vhodného ložiska můžeme využít dermatoskop. Biopsie z plně vyvinuté jizvící alopecie zachytí pouze nespecifický jizvící proces již bez zánětlivých změn a bez vlasových folikulů, takový materiál proto nedovolí určit typ onemocnění. Při klinické dg. jizvící alopecie provádíme též vyšetření přímou imunofluorescencí z lezionální tkáně.
K odběru vzorku z nepostižené neosvětlené kůže (nejčastěji hýždě) přistupujeme v případě systémových autoimunitních onemocnění pojiva, zejména pak při klinickém podezření na SLE, u kterého očekáváme při vyšetření přímou imunofluorescencí tzv. lupus band (imunofluorescenční pozitivita bazální membrány). Tento test je u LE omezeného na kůži v drtivé většině případů negativní. Jeho pozitivita je spjata s vyšším rizikem renálního postižení při SLE [13].
U diagnóz, jako je např. panikulitida či dermatofibrosarcoma protuberans, je pro validní hodnocení naprostou nutností dostatečná hloubka excize, s výhodou provedená skalpelem. I tento, zdánlivě zbytný požadavek by měl být v histologické průvodce zdůrazněn před provedením výkonu.
Ve všech případech platí, že požadavek na odběr z konkrétního vybraného místa by měl být jasně specifikován v histologické průvodce (např. požadavek na odběr z lezionální versus perilezionální tkáně, z periferie versus z centra označené léze, označený okrsek pigmentové léze, indurovaná část versus erytematózní lem u morfey atd.)
Tabulka 2 shrnuje stručná doporučení pro odběr bioptického materiálu určeného k vyšetření přímou imunofluorescencí.
Tab. 2. Doporučení pro odběr bioptického materiálu pro vyšetření přímou imunofluorescencí 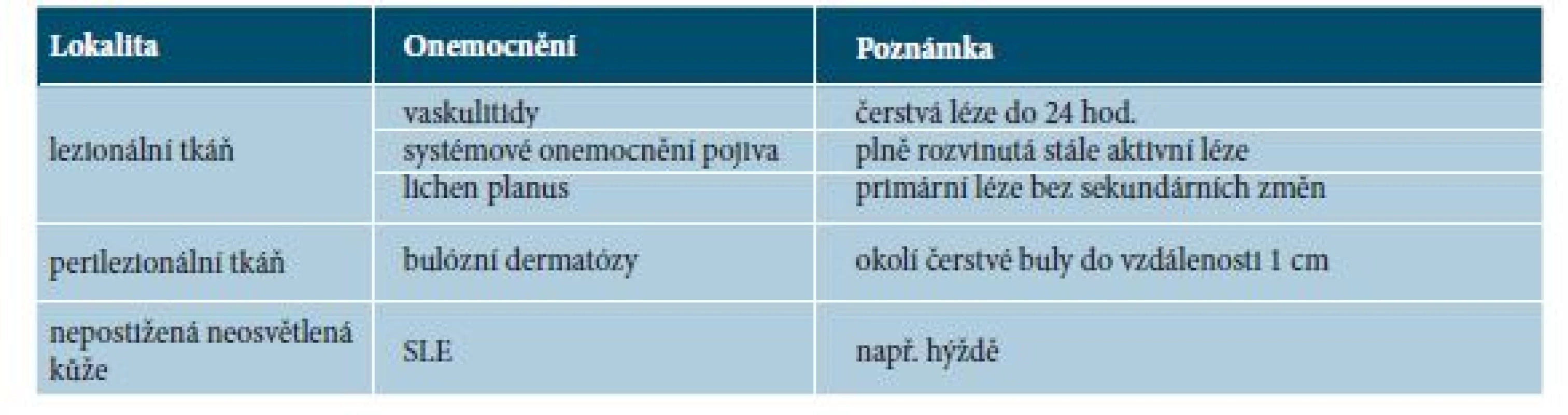
Volba metody a taktika provedení biopsie
Mezi rutinně užívané bioptické metody patří parciální či totální excize skalpelem, průbojníkem, případně kyretou či povrchová (shave) excize skalpelem či žiletkou.
Průbojníková excize je vhodná pro povrchnější léze s očekávanými změnami v epidermis a koriu. Metoda využívá kruhového průbojníku různého průměru, v praxi od 2 od 10 mm, existují však průbojníky o průměru menším než 2 mm. Jedná se o rychlou metodu k provádění probatorní excize s dobrým výsledným kosmetickým efektem, která umožňuje uzavření jizvy v určitých lokalitách želatinovou plombou. Při vyjímání vzorku však hrozí zhmoždění vzorku nástrojem, zejména při nešetrném sevření branžemi pinzety (obr. 2), které vede k rozdrcení buněk zánětlivého infiltrátu znemožňujícímu jejich hodnocení, či stlačení kolagenních snopců znemožňujícímu možnost hodnocení fibrózy. Hrozí zde též odběr mělké biopsie.
Obr. 2. Deformace průbojníkové excize pinzetou a pseudolipomatosis cutis – mnohočetné vakuoly v koriu 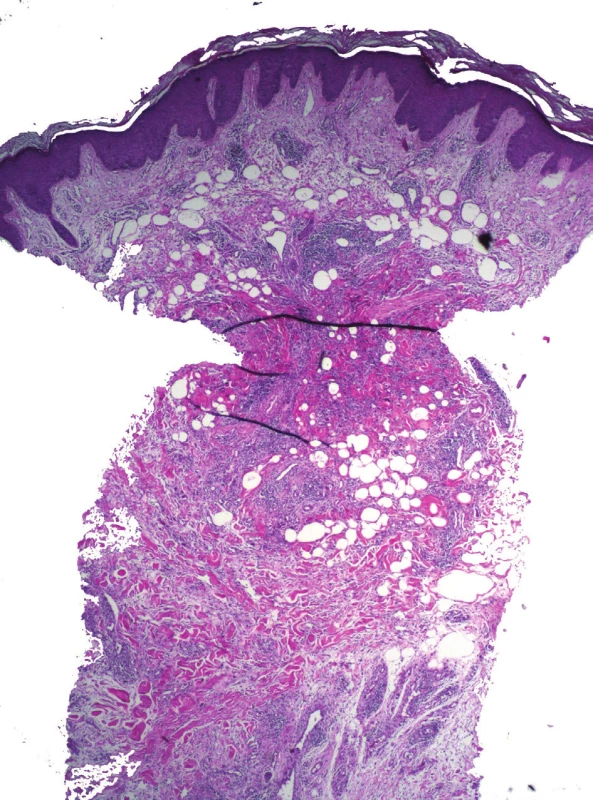
Totální či parciální excize skalpelem umožňuje oproti průbojníku volbu tvaru provedené excize a šíře bezpečnostního lemu, umožňuje histologické zhodnocení celé léze, což může být zásadní pro stanovení správné diagnózy (např. keratoakantomu versus spinocelulární karcinom). Výkon je však zatížen delší dobou hojení s větším kosmetickým dopadem a vyšším rizikem pooperačních komplikací. Parciální excize skalpelem je zejména v zahraniční literatuře nazývána incizionální biopsie.
Tangenciální („shave“) excize odebírá epidermis a horní korium skalpelem či žiletkou. Tato metoda je populární zejména v zahraničí, a to i k excizím kožních tumorů typu bazaliomu či lentigo maliga. Tato metoda má dobrý kosmetický efekt, zásadní nevýhodou je však povrchnost a nemožnost hodnocení spodních vrstev kůže a podkoží.
Kyretáž je povrchové seříznutí exofytické kožní eflorescence kyretou. Uplatňuje se při snesení benigních kožní lézí typu seboroické veruky s dobrým kosmetickým efektem. Při kyretáži však dochází k fragmentaci snesené tkáně a často nedojde k totálnímu odstranění celého projevu.
Zvláštní pozornost si zaslouží taktika odběru biopsie pigmentových lézí a alopecií.
Při excizi pigmentových lézí (stejné jako u jiných lézí) vedeme řez v čarách štěpitelnosti. Tyto čáry, zejména na končetinách, korespondují s průběhem lymfatických cest. Orientace provedení excize je tedy důležitá pro případnou reexcizi a mapování sentinelových uzlin v druhé době. Nadměrné podminování spodiny řezu při adaptaci okrajů se při excizi pigmentové léze nedoporučuje, jelikož může dojít k destrukci jemných lymfatických cest a k opětnému zkreslení výsledku případného mapování sentinelových uzlin v druhé době [4].
Při odběru vzorku ze kštice pro hodnocení alopecií je doporučován minimální průměr průbojníku 4 mm, při tomto průměru bude plocha vzorku (v čerstvém stavu) přibližně 0,126 cm2. Směr řezu by měl být rovnoběžný se směrem růstu vlasů, při nedodržení sklonu může dojít k příčnému řezu, „transsekci“ vlasových folikulů. Při odběru dvou vzorků lze zvážit odběr obou biopsií průbojníkem těsně vedle sebe (s ponecháním můstku mezi nimi šířky asi 1 mm). Vznikne tak léze tvaru čísla 8. Následným protnutím můstku a adaptací jizvy s mírným posunem vznikne jizva ve tvaru písmene „S“ [16].
Označení bioptického materiálu
Pro lepší orientaci k dalšímu zpracování má chirurg možnost označit materiál stehem, jehož lokalitu uvede v průvodce k histologickému vyšetření. Například při člunkovité excizi bazaliomu obličeje chirurg označí stehem kraniální konec excidátu. Různý typ stehu umožní označení více částí jedné excize (např. krátký jednoduchý steh – kraniální část, dlouhý jednoduchý steh – kaudální část, dlouhý dvojitý steh – laterální část, krátký dvojitý steh – mediální část). Toto označení se však rutinně užívá při označování objemnějšího a topograficky členitějšího bioptického materiálu.
ZPRACOVÁNÍ ODEBRANÉ TKÁNĚ
Výběr fixačního média a okamžitá fixace
Zlatým standardem pro fixaci materiálu určeného pro klasické histologické vyšetření je formaldehyd (chemicky HCHO). Formalín (syn. formol) je 40% roztok formaldehydu. Pro samotnou fixaci se v praxi užívá 10% roztok pufrovaného formalínu.
Přenos do fixativa by měl být okamžitý. Časné prosycení vzorku zabrání autolýze centrální části tkáně. Množství fixativa v nádobě by mělo být dostatečné, minimálně 10násobek objemu vzorku.
Formaldehyd však svými vlastnostmi destruuje epitopy proteinů, stupeň této destrukce je závislý na době pobytu vzorku ve fixativu. Doba fixace tkáně do formalínu by tedy neměla přesáhnout 24 hodin. Tato skutečnost je extrémně důležitá pro případné následné imunohistochemické vyšetření. Například zachování pozitivity vimentinu (užívaný zejména v diagnostice mezenchymálních tumorů) indikuje dobré zachování antigenů ve fixované tkáni [5].
Pro transport vzorků určených pro vyšetření přímou imunofluorescencí je možno použít fyziologický roztok, který se jeví jako nejlepší médium pro tkáň, která bude zpracována do 24–48 hod. [4]. Přenesení do tohoto média by mělo být co nejrychlejší, aby nedošlo k oschnutí povrchu tkáně. Fyziologický roztok s sebou nese výhodu snížení nespecifické a zesílení specifické fluorescence. Při nechtěném vložení vzorku určeného pro přímou imunofluorescenci do formalínu je vyšetření zatíženo vyšší pravděpodobností falešně negativního výsledku, a to zejména při detekování intercelulárních depozit u pemfigu. Depozita v oblasti dermoepidermální junkce jsou k destrukci méně náchylná [4]. Při této skutečnosti se doporučuje okamžité vyjmutí z formalínu a přemístění do fyziologického roztoku. Další možností transportního média je speciální médium – Michelovo médium se složením: 55 g síranu amonného, 100 ml Michelova pufru (1mol citronan draselný 2,5 ml; 0,1mol síran hořečnatý 5ml; 0,1mol N-ethylmaleimid 5ml; destilovaná voda 87,5ml), na dopufrování 1mol KOH na cílové pH 7,0–7,2.
Pro elektronovou mikroskopii je klasickým fixativem 2,5% glutaraldehyd. Postavení transmisní elektronové mikroskopie (TEM) v dermatopatologii je spíše marginální. Svoje uplatnění může najít v diagnostice typů epidermolysis bullosa congenita, u lysozomálních střádavých onemocnění či v diagnostice vzácných tumorů [6].
Molekulárně genetické vyšetření (např. vyšetření přestavby TCR genu) je možno provést z čerstvé tkáně stejně tak jako z tkáně fixované ve formalínu [9]. Přehled nejčastěji užívaných médií shrnuje tabulka 3.
Tab. 3. Nejčastěji užívaná média v dermatopatologii 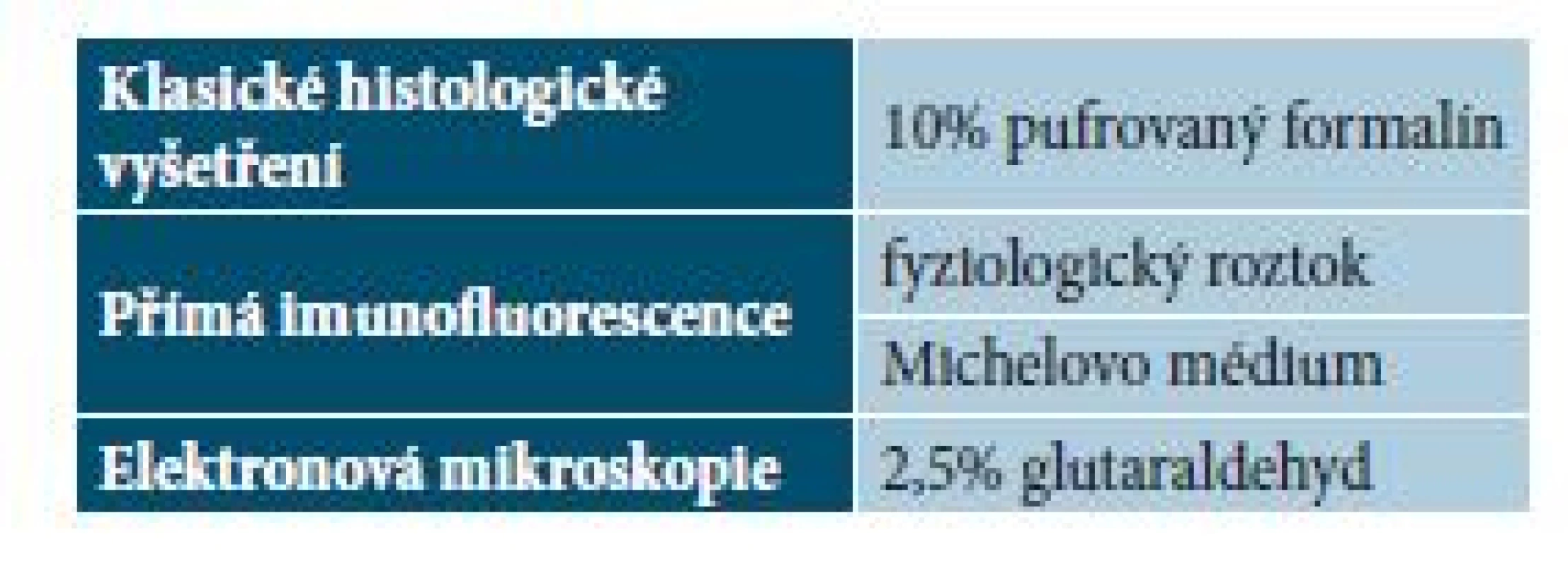
Transport vzorku do histopatologické laboratoře
Transport by měl proběhnout bez otálení. V mezidobí je označený vzorek společně se žádankou uložen při pokojové teplotě nevystavený přímému slunečnímu světlu. Transport by měl být šetrný, neboť zde hrozí fragmentace fixované tkáně. Zranitelná je zejména oblast horního koria, kde může dojít k oddělení epidermis a stratum papillare od spodní části vzorku (např. tkáň pocházející z předloktí). Náchylné k oddělení je také zánětlivě změněné podkožní vazivo u panikulitid [4].
Při transportu může též dojít k nežádoucímu ulpění drobného vzorku na stěně nádoby nad hladinou fixativa, takový vzorek rychle propadá autolýze a znehodnocení. Tomuto jevu můžeme předejít dostatečným množstvím média v nádobě (viz výše).
Zpracování vzorku histopatologickou laboratoří
Zpracování odebrané tkáně v histopatologické laboratoři se sestává z přikrojení odebraného vzorku, zhotovení parafinových bločků a histologického preparátu.
Při procesu přikrojení se upravuje odebraný bioptický materiál in vitro tak, aby mohl být volně vložen do tkáňového bločku. Vzhledem k velikosti rutinně užívaných bločků může být maximální výška tkáně cca 4 mm.
Není-li excidovaná tkáň chirurgem označena orientačním stehem, zpracuje se v sériových řezech v lamelách po 2–3 mm. Při zpracování akrálních lézí se provádí řezy kolmo k průběhu dermatoglyfů [4]. Některá pracoviště před samotným zpracováním spodinu excizí barví tkáňovým barvivem, při mikroskopickém hodnocení je pak jasně viditelné, které řezy byly provedeny chirurgem (obarvené) a které byly provedeny přikrájením materiálu in vitro (neobarvené). Při barvení je nutno úzkostlivě zachovávat čisté pracovní pole. Ulpění barviva na řezné ploše provedené patologem znamená dezinterpretaci resekčních okrajů. Ze zkušenosti se jako nejlépe viditelné barvy jeví modrá a zelená. V případě, že excidát není označen stehem, je možno vložit koncové lamely excidátu z protilehlých stran do jednoho bloku [8].
Je-li excize označena stehem, je nutno toto označení „převést“ do podoby, kterou bude moci dermatopatolog identifikovat pod mikroskopem. K tomuto účelu se užívají též výše zmíněná tkáňová barviva. Je-li např. člunkovitá kožní excize označena stehem na jednom konci, označeném v průvodce jako kraniální, dvě tkáňové barvy se nanesou na dvě longitudinální poloviny excize, tedy poloviny oddělené podélnou osou. Laterální strana bude tedy označena např. modře, mediální straně zeleně. Při sériových řezech kolmých na podélnou osu vzniknou tedy lamely, které jsou na spodině vždy označeny dvěma barvami. Zpracování do bloku zpravidla začíná od místa, které bylo označeno stehem (tzn. konec označený stehem je v prvním bloku). Dermatopatolog poté může jednoduše lokalizovat případný dosah do resekčního okraje (např. kaudální laterální, kraniální mediální atd.) [8].
Vzorek při vyšetřování alopecie může být zpracován do parafínového bloku více způsoby. Excize může být do bloku přikrojena vertikálně (rovnoběžně k průběhu vlasového folikulu) či transverzálně (kolmo k jeho průběhu). Vertikální řez umožňuje hodnocení celého průběhu vlasového folikulu od infundibula po bulbus, dochází však zde k nežádoucí transsekci. Uvádí se, že při vertikálním řezu je zhodnoceno jen 10–15 % vlasových folikulů obsažených ve vzorku [2]. Transverzální řez umožní zhodnotit veškeré vlasové folikuly obsažené ve vzorku, hodnotí však patologické změny pouze v jedné etáži folikulu. Obecně řečeno, vertikální řez hodnotí vlasové folikuly spíše kvalitativně, transverzální spíše kvantitativně. Transverzální a vertikální řez by měl být zpracován ve dvou blocích. Vertikální řez je výhodný pro hodnocení superficiálních, junkčních a lichenoidních zánětlivých změn (jizvící alopecie jako např. lupus erythematodes či lichen planopilaris). Transverální řez umožnuje přehlednější hodnocení zastoupení fází vlasového cyklu a diagnostiku nejizvících alopecií jako např. telogenní efluvium. Při odběru dvou vzorků může být jeden vzorek zpracován pro histologické vyšetření (HE) a druhý pro vyšetření přímou imunofluorescencí (PIF), případně může být jeden vzorek rozdělen transverzálně a druhý vzorek vertikálně, z něhož se jedna polovina užije pro HE a druhá pro PIF. Při zpracování jednoho vzorku je popisováno zpracování podle Tylera a technika HoVert [4], způsobů zpracování je však celá řada. Podle Tylera se tkáňový váleček rozřízne vertikálně, z čehož jedna polovina se dále rozřízne transverzálně 1 mm od dermoepidermální junkce. Podle techniky HoVert se tkáňový váleček rozřízne transverzálně ve dvou úrovních na celkově tři části, horní část se dále rozřízne vertikálně.
HISTOLOGICKÉ VYŠETŘENÍ
Interpretace chyb a artefaktů
Znalost potenciálních chyb a příčin artefaktů při odběru a zpracování bioptického materiálu umožní jejich účinnou prevenci a spolehlivé zhodnocení. Artefakty jsou uměle vzniklé nálezy v histologickém obrazu, vznikající v důsledku nesprávného:
- a) odběru,
- b) fixace a transportu,
- c) zpracování bioptického materiálu.
Velmi častým artefaktem je deformace vzorku, nejčastěji tkáňového válečku, který byl odebrán průbojníkem. Při neopatrné manipulaci pinzetou dochází ke stisknutí tkáně do obrazu „přesýpacích hodin“ (viz obr. 2, též průbojníková biopsie).
Artefakty vznikající při použití speciálních metod, jako je elektrokoagulace, mají v histologickém obrazu typický obraz, a to protažení jader buněk, oddělení epidermis od bazální membrány a koagulační nekróza (obr. 3). V literatuře se tento jev nazývá fulgurační artefakt.
Obr. 3. Fulgurační artefakt u melanocytárního névu – odloučení epidermis s protažením jader keratinocytů 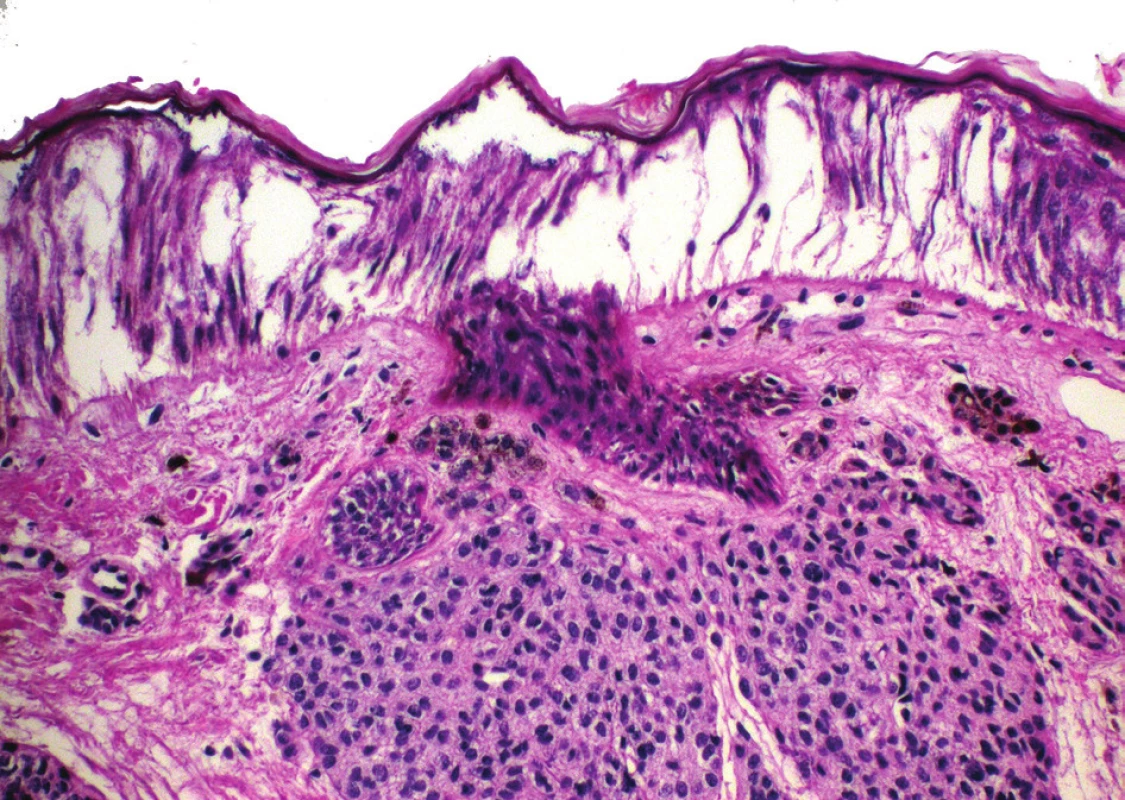
Při užití nádobky neadekvátní velikosti může dojít k „odlitkové deformaci“ kopírující reliéf nádoby. Vzorek by se tedy měl v nádobě volně pohybovat.
Při fixaci ve formalínu dochází ke zmenšení (retrakci) vzorku in vitro. Podle literatury může dojít ke zmenšení až o 18 % [3]. Tento fakt je nutno vzít v úvahu např. při měření eflorescencí na povrchu kožní excize in vitro při procesu přikrajování (obr. 4). K většímu smršťování vzorku dochází u lokalit z končetin. Ke zmenšení dochází tím více, čím je vzorek delší a užší [1].
Obr. 4. Měření rozměrů tkáně in vitro na příkrajovně před samotným přikrájením 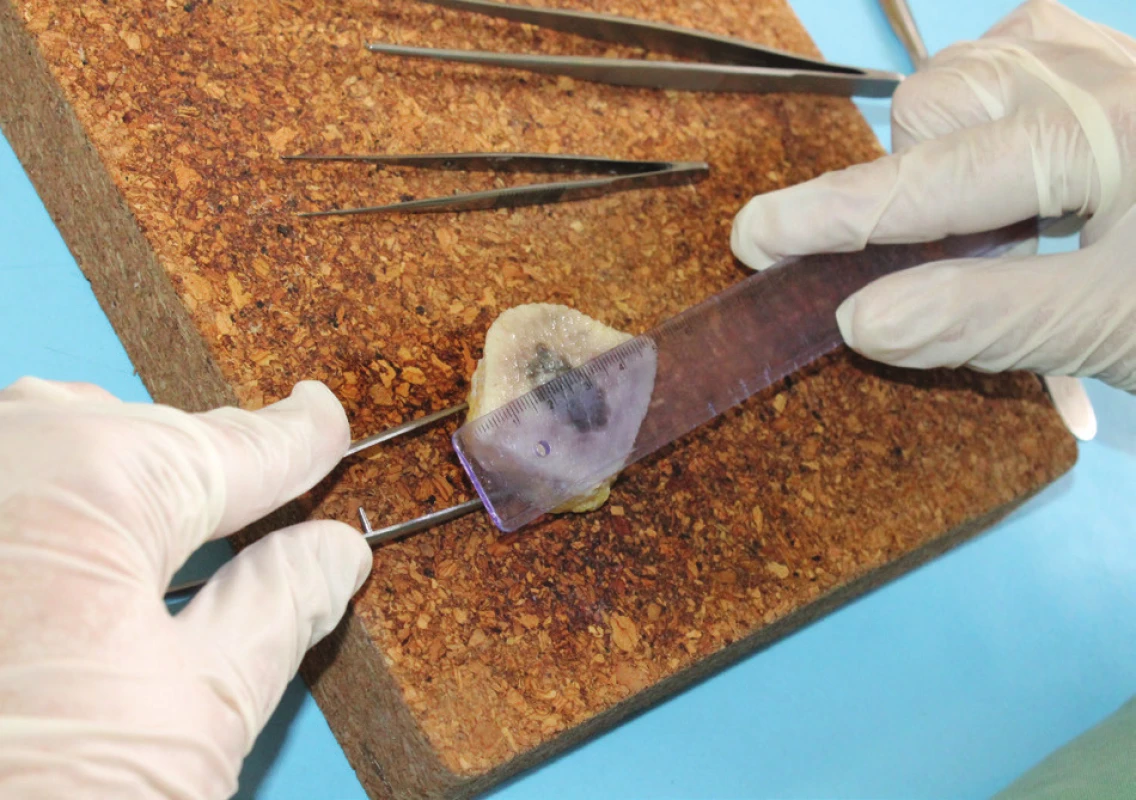
Pseudolipomatosis cutis je artefakt, který se vyznačuje přítomností vícečetných „vakuol“ velikosti zralého adipocytu v koriu. Tyto prostory nemají svůj klinicko-patologický význam. Etiologie vzniku je nejasná, udává se možná souvislost s aplikací infiltrační anestezie[7]. Některé chorobné jednotky, např. acrodermatitis chronica atrophicans, mají k tvorbě pseudolipomatózy vyšší náchylnost (obr. 5).
Obr. 5. Pseudolipomatosis cutis horního koria 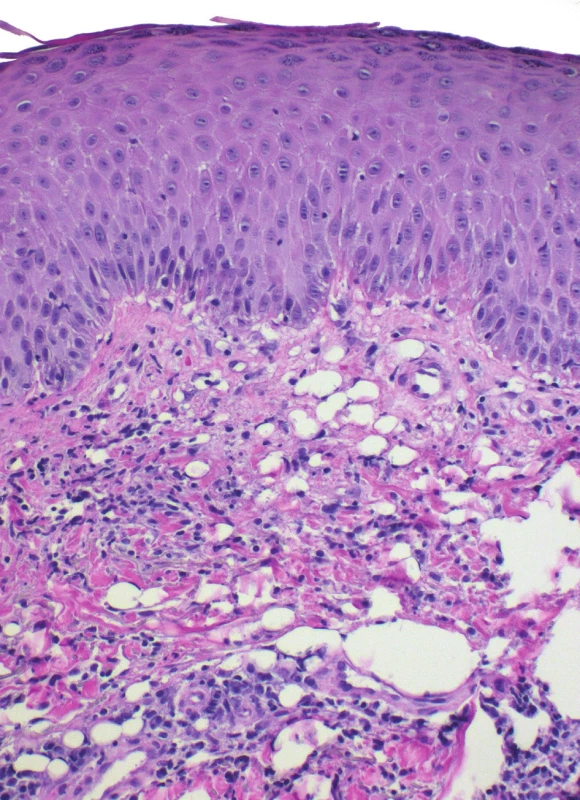
Klinicko-patologická korelace dermato-patologem
Dermatopatolog na konci svého hodnocení provádí klinicko-patologickou korelaci a formuluje histologický závěr. V případě nejasností a možných klinických souvislostí, např. s interními chorobami, je vhodná komunikace s indikujícím dermatologem či dermatochirurgem, která ušetří mnohá potenciální nedorozumění či dezinterpretace.
INTERPRETACE NÁLEZU
Klinicko-patologická korelace dermatovenerologem
Jedná se o konečný krok „procesu biopsie“. Dermatovenerolog posuzuje sourodost histologické diagnózy a klinického obrazu a stanovuje závěrečnou diagnózu a další postup. Při interpretaci histologického závěru je nutno striktně dodržovat jeho původní znění, bez zkrácení či parafráze („histologický obraz svědčí pro klinickou diagnózu, je slučitelný či ji jen umožňuje zvážit?“) a vnímat přesný smysl slov vyjadřujících různý stupeň nejistoty. Při zjevném rozporu klinického a histologického nálezu je vhodné konzultovat dermatopatologa. Při neslučitelnosti nálezů je nutné zvážit opakování biopsie. Její opakování v časovém odstupu připadá v úvahu při ne zcela jisté diagnóze, přes léčbu přetrvávajícího onemocnění či změně klinických projevů.
ZÁVĚR
V literatuře se uvádí, že celý proces biopsie vyžaduje přibližně dvacet kroků, manipulací, z nichž každý krok v sobě skrývá potenciální slabiny s konečným dopadem na stanovení správné diagnózy [14]. Znalost celého procesu a jeho úskalí je předpokladem maximálního přínosu kožní biopsie.
Do redakce došlo dne 23. 7. 2018.
Adresa pro korespondenci:
MUDr. Miroslav Důra
Dermatovenerologická klinika 1. LF UK a VFN v Praze
U Nemocnice 499/2
128 00 Praha 2
email: miroslav.dura@vfn.cz
Kontrolní test
1. Michelovo transportní médium se užívá k fixaci vzorku pro:
- a) klasické histopatologické vyšetření
- b) vyšetření přímou imunofluorescencí
- c) vyšetření elektronovým mikroskopem
- d) v dnešní době se již nepoužívá
2. Transverzální řez při zpracován vzorku z alopetického ložiska:
- a) umožňuje hodnocení fází vlasového cyklu
- b) umožňuje hodnocení zánětlivých změn při dermoepidermální junkci
- c) zachytí přibližně 10 % vlasových folikulů
- d) užívá se při hodnocení jizvících alopecií
3. Pseudolipomatosis cutis – jedná se o:
- a) přítomnost zralých adipocytů v koriu
- b) artefakt ne zcela jasného původu
- c) typ hamartomu
- d) nález typický pro lysozomální střádavá onemocnění
4. Objem fixativa v nádobě pro zpracování HE by měl být minimálně:
- a) 2násobek objemu vzorku
- b) 5násobek objemu vzorku
- c) 10násobek objemu vzorku
- d) na množství fixativa nezáleží
5. Při výběru místa pro probatorní excizi z pigmentové léze je nejvhodnější:
- a) nejtmavší místo
- b) místo označené na základě dermatoskopického nálezu
- c) nejsvětlejší okrsek
- d) na výběru lokality nezáleží
6. Optimální stáří buly vhodné k mikroskopickému a fluorescenčnímu vyšetření je:
- a) méně než 12 hod.
- b) 12–24 hod.
- c) 24–48 hod.
- d) více než 48 hod.
7. Artefakt charakteru „přesýpacích hodin“ vzniká:
- a) při aplikaci infiltrační anestezie
- b) při zhmoždění chirurgickými nástroji
- c) při transportu vzorku do laboratoře
- d) při zalití do parafinu
8. Nesprávné tvrzení o fulguračním artefaktu:
- a) vzniká po předchozí kryoterapii
- b) vyznačuje se protáhlými jádry buněk
- c) vzniká při použití elektrokoagulace
- d) může být doprovázen koagulační nekrózou
9. Fyziologický roztok jako transportní médium:
- a) se jeví jako nejlepší médium pro vzorky určené k přímé imunofluorescenci zpracované do 24–48 hod.
- b) způsobuje destrukci epitopů
- c) tlumí specifickou imunofluorescenci
- d) je standardním médiem pro vzorky určené k elektronové mikroskopii
10. Máme-li možnost výběru lokality, odkud provedeme probatorní excizi, postupujeme podle těchto preferencí (sestupně):
- a) čelo, stehno, břicho, ploska
- b) paže, lýtko, hrudník, brada
- c) bérec, předloktí, břicho, kštice
- d) záda, paže, stehno, tvář
Správným zodpovězením otázek kontrolního testu získáte 2 kredity kontinuálního vzdělávání lékařů ČLK, které budou zasílány redakcí jedenkrát ročně po uzavření ročníku časopisu. Správné odpovědi na otázky kontrolního testu budou uveřejněny v příštím čísle časopisu. Odpovědi posílejte na e-mailovou adresu kozni@lf1.cuni.cz vždy nejpozději do jednoho měsíce od vydání daného čísla.
Odpovědi na otázky kontrolního testu v č. 3/2018:
Plzáková Z.: Mastocytózy
Správné dopovědi : 1a, b, c, d, 2b, c, 3a, b, c, 4a, c, 5a, d, 6a, 7b, 8d, 9b, d, 10a, b.
Zdroje
1. BLASCO-MORENTE, G., GARRIDO-COLMENERO, C., PÉREZ-LÓPEZ, I. et al. Study of shrinkage of cutaneous surgical specimens. J. Cutan. Pathol., 2015, Apr;42(4), p. 253–257.
2. CALONJE, J. E., BRENN, T., LAZAR, A. et al. McKee’s Pathology of the Skin. 4th Edition. Amsterdam: Saunders/Elsevier 2012, 2 vol., p. 969–971, ISBN: 978-1-4160-5649-2.
3. DAUENDORFFER, J. N., BASTUJI-GARIN, S., GUÉRO, S. et al. Shrinkage of skin excision specimens: formalin fixation is not the culprit. Br. J. Dermatol., 2009, Apr;160(4), p. 810–814.
4. ELSTON, D. M., STRATMAN, E. J., MILLER, S. J. Skin biopsy: Biopsy issues in specific diseases. J. Am. Acad. Dermatol., 2016 Jan, 74(1), p. 1–16; quiz 17–18.
5. FUERTES, L., SANTONJA, C., KUTZNER, H. et al. Immunohistochemistry in dermatopathology: a review of the most commonly used antibodies (part I). Actas Dermosifiliogr., 2013, Mar, 104(2), p. 99–127.
6. HOSLER, G. A. Diagnostic Dermatopathology – a guide to ancillary tests blond the H&E. London: JP Medical Publishers, 2017, p. 155, ISBN: 978-1-909836-12-9.
7. JOSHI, R. Pseudo-lipomatosis cutis: A singular dermal artifact. Indian J. Dermatol. Venereol. Leprol., 2015, 81, p. 504–505.
8. LESTER, S. C. Manual of Surgical Pathology. Edinburgh: Elsevier Churchill Livingstone, 2006, p. 310–313, ISBN: 978-0-323-06516-0.
9. LI, N., BHAWAN, J. New insights into the applicability of T-cell receptor gamma gene rearrangement analysis in cutaneous T-cell lymphoma. J Cutan Pathol. 2001 Sep, 28(8), p. 412–418.
10. MARTIN, L. K., RUBIN, A. I., THEOCHAROUS, C. et al. Podophyllin reaction mimicking Bowen’s disease in a patient with delusions of verrucosis. Clin Exp Dermatol. 2008, Jul, 33(4), p. 443–445.
11. MARTIN, R. C., SCOGGINS, C. R., ROSS, M. I. et al. Is incisional biopsy of melanoma harmful? Am. J. Surg., 2005 Dec, 190(6), p. 913–917.
12. PATTERSON, J. W. Weedon’s Skin Pathology. 4th Edition. Philadelphia: Churchill Livingstone Elsevier, 2016, p. 39–43, ISBN 978-0-7020-5183-8.
13. REICH, A., MARCINOW, K., BIALYNICKI-BIRULA, R. The lupus band test in systemic lupus erythematosus patients. Ther Clin Risk Manag., 2011 Jan, 7, p. 27–32.
14. STRATMAN, E. J., ELSTON, D. M., MILLER, S. J. Skin biopsy: Identifying and overcoming errors in the skin biopsy pathway. J. Am. Acad. Dermatol., 2016 Jan, 74(1), p. 19–25; quiz 25–26.
15. SZÉP, Z. Priebojnikové excízie v dermatológii a dermatopatologii. 1. vydání. Euroverlag, 2013, s. 63, ISBN 978-80-7177-963-6.
16. ZAIAC, M. N., BLOOM, R., MORRISON, B. W. et al. The figure 8: a new hair biopsy technique. J. Am. Acad. Dermatol., 2014 Nov, 71(5), e201.
Štítky
Dermatológia Detská dermatológia
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2018 Číslo 4- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
Najčítanejšie v tomto čísle- Biopsie v dermatovenerologii
- Atopický ekzém
- Papulonekrotický tuberkulid – popis případu
- Klinický případ: Anulární ložisko na paži
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



