-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Liekové hypersenzitívne reakcie: diagnostika a liečba (2. časť)
Drug Hypersensitivity Reactions: Diagnosis and Treatment (Part II)
The diagnosis of drug hypersensitivity reactions (DHRs) is primarily based on a thorough case history, skin tests and drug provocation tests (challenge tests) in indicated cases. Skin tests are integral to the culprit drug diagnostics. Skin prick tests (SPT) and intradermal tests (IDT) are recommended for immediate-type hypersensitivity reactions and patch test and late-reading IDT for delayed-type hypersensitivity reactions. In vitro tests can provide valuable additional information and yield decisive results for the diagnosis, especially in cases of severe drug reactions, when provocation tests are contraindicated. In vitro tests can either help to diagnose the DHR itself or to identify the culprit drug. Determination of tryptase, histamine and its metabolits, PAF (Platelet activating factor) and CPA3 (Carboxypeptidase A3) in immediate - -type DHRs and the cellular analysis of skin biopsies and peripheral blood in delayed-type DHRs belong to the first group of tests. The most commonly used tests to identify the culprit drug is determination of specific IgE, Basophil activation test, Lymphocyte transformation test and HLA allele determination. Treatment is based on permanent avoidance of the culprit drug and replacement for a structurally different, non-cross-reacting compound if needed. Drug desensitization represents a treatment option in cases, where there is no alternative drug available.
Keywords:
diagnosis – drug hypersensitivity – skin test – in vitro test – provocation test – desensitization
Autoři: J. Nemšovská
Působiště autorů: Dermatovenerologická klinika LF UK a UNB, Bratislava, prednostka prof. MUDr. Mária Šimaljaková, PhD., MPH, MHA
Vyšlo v časopise: Čes-slov Derm, 94, 2019, No. 5, p. 192-201
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Diagnostika liekových hypersenzitívnych reakcií (DHRs; Drug hypersensitivity reactions) je založená na podrobnej anamnéze, kožných testoch a v indikovaných prípadoch na testoch provokačných (expozičných). Kožné testy sú neoddeliteľnou súčasťou diagnostiky príčinného lieku. Pri skorých DHRs sa odporúčajú testy vpichom a intradermálne testy, pri neskorých DHRs: epikutánne testy a intradermálne testy s neskorým odčítaním. In vitro testy môžu poskytnúť doplňujúce informácie a v prípadoch závažného priebehu DHRs, kedy sú provokačné testy kontraindikované, môžu významnou mierou prispieť k rozhodujúcemu výsledku v dôkaze príčinného lieku. In vitro testy môžeme rozdeliť na testy nápomocné v diagnostike samotnej DHR a testy na dôkaz príčinného lieku. Do prvej skupiny patrí, pri podozrení na skorý typ reakcie, stanovenie hladiny sérovej tryptázy, histamínu, metabolitov histamínu, z novších markerov je to PAF (Plateled activating factor) a CPA3 (karboxylpeptidáza A3) a pri podozrení na neskorý typ reakcie vyšetrenia založené na bunkových analý-zach v bioptických vzorkách alebo v periférnej krvi. Najčastejšie používanými testmi pri dôkaze príčinného lieku je vyšetrenie prítomnosti špecifických IgE protilátok, test aktivácie bazofilov, lymfocyto-transformačný test a genetické vyšetrenie. Základom liečby je trvalé vylúčenie príčinného lieku z medikácie a v prípade potreby, jeho náhrada za liek štrukturálne odlišný, skrížene nereagujúci. Desenzibilizácia predstavuje liečebnú modalitu v situáciách, kedy nie je k dispozícii alternatívna liečba.
Klíčová slova:
diagnostika – hypersenzitivita na lieky – kožný test – in vitro test – provokačný test – desenzibilizácia
DIAGNOSTIKA LIEKOVÝCH HYPERSENZITÍVNYCH REAKCIÍ
Diagnostika liekových hypersenzitívnych reakcií (Drug hypersensitivity rections; DHRs) je veľmi zložitá a komplikovaná. Môžeme ju rozdeliť na diagnostiku samotného ochorenia a diagnostiku príčinného lieku.
Základom vyšetrenia je podrobná anamnéza a zhodnotenie lokálneho nálezu so zameraním sa na symptómy charakteristické pre DHRs. Významná je časová súvislosť medzi nasadením lieku a vznikom ťažkostí. Pri kožných a slizničných prejavoch je dôležitý ich detailný opis: morfológia, lokalizácia, zmeny v čase. Všímame si celkové symptómy, ako je teplota, únava, bolesti, pátrame po postihnutí vnútorných orgánov a orgánových systémov, hodnotíme laboratórne nálezy. Sleduje sa ústup prejavov a ťažkostí po vysadení lieku, tzv. eliminačný test, v prípadoch potreby nasadenia symptomatickej liečby jej charakter a dĺžka trvania. Pátra sa po liekových reakciách v minulosti, známych kofaktoroch DHRs, vyšetruje sa prítomnosť iných ochorení, vrátane alergických, v osobnej aj v rodinnej anamnéze. Pozornosť treba venovať všetkým liekom, ktoré pacient užíva, nielen jeho pravidelnej medikácii, ale aj liekom užívaným sporadicky. Nevyhnutné je vylúčiť iné príčiny vzniku ťažkostí [8].
Diagnostika ochorenia
Vzhľadom na to, že DHRs majú veľmi pestrú symptomatológiu a pozoruhodnú schopnosť napodobňovať iné kožné ochorenia, môže byť niekedy ich diagnostika problematická. V sporných prípadoch stanovenia diagnózy DHR môžu byť nápomocné niektoré in vitro vyšetrenia.
Vyšetrenie hladiny sérovej tryptázy môže pomôcť pri potvrdení reakcií, ktoré vznikajú v dôsledku degranulácie mastocytov a bazofilných leukocytov. Tryptáza je jednou z najvýznamnejších proteáz mastocytov a do krvného obehu sa uvoľňuje po ich aktivácii. Na rozdiel od histamínu je však uvoľňovaná a odbúravaná pomalšie, preto je považovaná za vhodný marker anafylaktickej reakcie. Najvyššiu koncentráciu dosahuje 15–120 minút po alergickej reakcii, k východiskovým hodnotám sa vracia po 12–24 hodinách. Prvý odber je potrebné realizovať 15 min – 2 h od rozvoja reakcie, druhý odber za 12–24 hodín. Za pozitívny výsledok sa považuje jej zvýšenie o ≥ 20 % + 2 μg/l v priebehu 4 hodín od rozvoja symptomatológie. Senzitivita vyšetrenia kolíše medzi 30 až 94,1 % a špecificita medzi 92,3–94,4 % [23, 26, 34]. Nevýhodou stanovenia hladiny histamínu v sére je jeho krátky biologický polčas (20 minút), preto je nevyhnutné odber krvi u pacienta realizovať najneskôr do 1 hodiny od vzniku symptómov. Senzitivita vyšetrenia sa udáva medzi 61–92 %, špecificita medzi 51–91 % [5]. Stanovenie hladiny metabolitov histamínu: N-metylhistamínu a kyseliny imidazoloctovej v moči do 24 hodín od reakcie patrí k nepriamym metódam vyšetrenia histamínu. Nevýhodou vyšetrenia je, že hladina metabolitov histamínu v moči môže byť ovplyvnená prítomnosťou baktérii v močovom trakte ako aj konzumáciou potravy s vysokým obsahom histamínu [21]. Stanovenie hladiny novšie identifikovaných biomarkerov, ako je PAF (Plateled activating factor) alebo CPA3 (karboxylpeptidáza A3), by mohlo v budúcnosti prispieť k zlepšeniu diagnostiky DHRs skorého typu. PAF sa ukazuje ako najdôležitejší mediátor v prípade reakcií spúšťaných IgG protilátkami a CPA3 je obsiahnutá v sekrečných granulách mastocytov, z ktorých sa spolu s ostatnými mediátormi uvoľňuje pri ich degranulácii [14].
Pri neskorých typoch liekových hypersenzitívnych reakcií je možné na potvrdenie diagnózy využiť vyšetrenia založené na bunkových analýzach. Ide o postupy odporúčané Európskou akadémiou alergológie a klinickej imunológie (EAACI) vhodné predovšetkým v diferenciál-nej diagnostike, kedy je potrebné odlíšiť liekový exantém od exantému iného pôvodu.
Pri diagnostike neskorých reakcií typu Stevens-Johnsonovho syndrómu (SJS) a toxickej epidermálnej nekrolýzy (TEN) je jedným z najdôležitejších biomarkerov granulyzín. Ide o kľúčovú cytotoxickú molekulu, produkovanú cytotoxickými T lymfocytmi a NK bunkami, zodpovednú za diseminovanú nekrózu keratinocytov. Granulyzín je prítomný v tekutine vezikúl, pričom jeho množstvo koreluje so závažnosťou priebehu ochorenia. Jeho zvýšenú hladinu možno dokázať aj v sére pacientov pred objavením sa kožných prejavov. Na stanovenie hladiny granulyzínu v sére bol pre prax vyvinutý jednoduchý rýchly imunochromatografický test. Vyšetrenie je nutné realizovať vo včasnom štádiu SJS alebo TEN, najlepšie do 5 dní od začiatku ochorenia, lebo hladina granulyzínu v sére po objavení sa kožných symptómov veľmi rýchlo klesá [15]. S progresiou ochorenia a mortalitou pri SJS a TEN koreluje aj sérová hladina IL-15 [38].
Pri skorej diagnostike DRESS (Drug Reaction with Eosinophilia and Systemic Symptoms) a DIHS (Drug-Induced Hypersensitivity Syndrome), môže byť potenciálnym markerom TARC (Thymus and activation-regulated chemokine), ktorého zvýšená hladina v sére odzrkadľuje aktivitu ochorenia a môže slúžiť ako prognostický marker závažnosti priebehu reakcie [29].
V biopsii z postihnutej kože sa sleduje zastúpenie jednotlivých buniek, ako aj prítomnosť a frekvencia špecifických povrchových markerov týchto buniek, s použitím histologických, imunohistochemických alebo molekulárno-biologických metód. V kožnej biopsii z ložísk exantému sú dominantne zastúpené CD4
+ lymfocyty a variabilný počet neutrofilných a eozinofilných leukocytov. Pri akútnej generalizovanej exantematóznej pustulóze (AGEP) môže byť prítomná subkorneálna spongióza, intradermálne pustuly, edém v papilárnej vrstve kória a perivaskulárne infiltráty s neutrofilmi aktivovanými IL-8. Pri DRESS a DIHS býva dermálny edém, lymfocytové infiltráty s CD4+ aj s CD8+ lymfocytmi produkujúcimi IL-5, ktorý vedie k chemotaxii eozinofilov. SJS a TEN charakterizuje nekróza keratinocytov, subepidermálne vezikuly, v derme perivaskulárne lymfohistiocytárne infiltráty s CD8+ lymfocytmi produkujúcimi veľké množstvá granzýmu B, perforínu, FasL a granulyzínu. V periférnej krvi môžu byť počas akútnej fázy zvýšené aktivačné markery T-lymfocytov, ako je HLA-DR, kožné usídlovacie receptory, patriace do skupiny adhezívnych molekúl (CLA – cutaneous lymphocyte-associated antigen, CCR6 – C-C chemokine receptor type 6, CCR10 – C-C chemokine receptor type 10), IFN-γ a TNF-α [21, 26].
In vivo testy na dôkaz príčinného lieku
Kožné testy sú neoddeliteľnou súčasťou diagnostiky príčinného lieku. Pri skorých liekových hypersenzitívnych reakciách sa odporúčajú testy vpichom (SPT; Skin prick test) a následne, v prípade negatívneho záveru, intradermálne testy (IDT; Intradermal test) s odčítaním po 15–20 minútach (obr. 1). Pri neskorých reakciách sú to epikutánne testy a IDT s neskorým odčítaním (hodiny – dni) (obr. 2) [41]. Vyšetrovanie príčinného lieku musí byť správne načasované. Bezprostredne po prebeh-nutej alergickej reakcii, môže byť pacient v tzv. refraktérnej fáze, prípadne môžu byť výsledky testov skreslené účinkom liekov ordinovaných v liečbe hypersenzitívnej reakcie. Naopak s predlžujúcim sa odstupom času po DHR klesá senzitivita testov, rýchlejšie pri in vitro testoch ako pri in vivo testoch.
Obr. 1. Pozitívny SPT s Morphinom s rozvojom systémovej anafylaktickej reakcie do 5 minút po SPT s Morphinom v 1-% koncentrácii M – Morphin:
1. 0,1-% koncentrácia
2. 1-% koncentráciaPozitívny SPT s Morphinom s rozvojom systémovej anafylaktickej reakcie do 5 minút po SPT s Morphinom v 1-% koncentrácii
M – Morphin:
1. 0,1-% koncentrácia
2. 1-% koncentrácia
NK – negatívna kontrola)
NK – negatívna kontrola)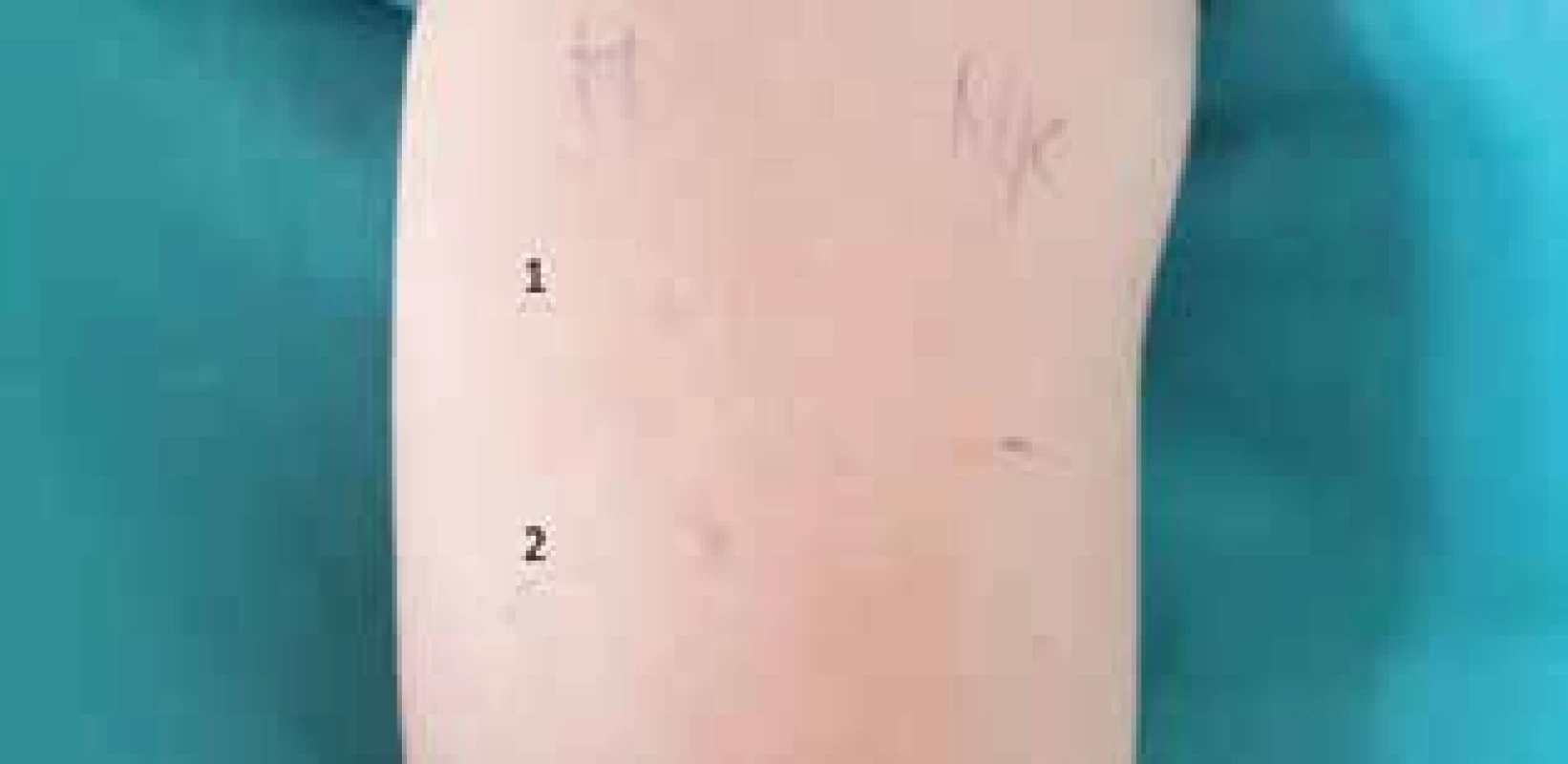
Obr. 2. Pozitívny IDT s neskorým odčítaním po 24 hodín so Solu-Medrolom (v riedení 1/100 originálne pripraveného Solu-Medrolu 40 mg plv) 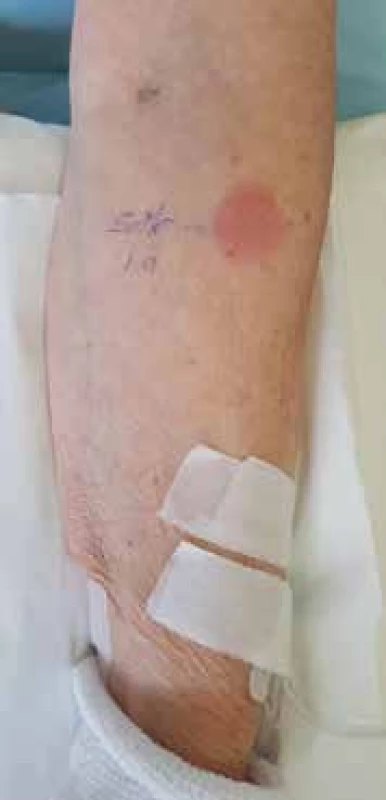
V prípade kožných testov s liekmi nie je doteraz stanovená štandardizácia postupu najmä s ohľadom na správnu koncentráciu testovaného lieku. Látky vo vysokej koncentrácii môžu viesť k pozitívnej reakcii aj u zdravých jedincov, preto je kľúčové realizovať testy s takou koncentráciou lieku, ktorá nemá iritačné účinky. Správna koncentrácia pre mnohé lieky nebola dodnes stanovená. Vo všeobecnosti je koncentrácia alergénu pri SPT 10-krát vyššia ako pri IDT. Pozitívna reakcia je pri veľkosti pupenca ≥ 3 mm pri SPT a ≥ 5 mm pri IDT. Prítomnosť erytému bez pupenca sa považuje za nešpecifickú a prítomnosť pseudopódií za prejav silnej senzibilizácie. Napriek tomu, že súvislosť medzi veľkosťou pupenca a stupňom senzibilizácie pacienta je sporná, väčšina autorov sa prikláňa k názoru, že priemer pupenca koreluje so stupňom senzibilizácie. Stanovenie hraníc pozitivity je arbitrárne a pri negativite negatívnej kontroly aj pupence s menším priemerom, najmä pri testovaní liekovej precitlivenosti, môžu byť považované za pozitívne, lebo odrážajú imunologickú reaktivitu organizmu [13]. SPT má v porovnaní s IDT vyššiu špecificitu, ale nižšiu senzitivitu. Pri IDT hrozí vyššie riziko systémovej reakcie a bývajú častejšie falošne pozitívne reakcie. SPT je jednoduchší, rýchlejší a bezpečnejší, preto v súčasnosti predstavuje metódu prvej voľby a až v prípade jeho negatívneho výsledku sa odporúča realizovať IDT.
Kožné testy vykazujú najvyššiu senzitivitu pri beta-laktámových antibiotikách, liekoch používaných pri celkovej anestézii, heparínoch a rádiokontrastných látkach. Pri SPT a IDT sa prednostne využíva parenterálna forma testovaného lieku, najlepšie forma určená na intravenóznu aplikáciu v zodpovedajúcej koncentrácii. V prípade, keď je liek dostupný výlučne v tabletovej alebo kapsulovej forme, je možné realizovať len SPT. Ide o neštandardizovaný postup používaný v bežnej praxi, kedy sa tableta alebo obsah kapsuly rozpustí v malom množstve fyziologického roztoku a následne sa SPT realizuje prostredníctvom „prick to prick“ testu [7].
Epikutánne testy pri podozrení na neskorú reakciu môžu byť realizované s komerčne pripravenými substanciami, ktoré sú dostupné len v obmedzenom počte, alebo so zarábanými prípravkami. Pri zarábaných prípravkoch sa ako vehikulum používa vazelína alebo voda, zriedkavejšie alkohol. V prípade, že je liek k dispozícii v čistej chemickej forme, pripravuje sa v 1–20-% koncentrácii, pri nedostupnosti čistej chemickej formy možno použiť originálny liek v 30-% koncentrácii. Technika a odčítavanie testov sú rovnaké ako pri klasických epikutánnych testoch, podľa odporučení ICDRG (International Contact Dermatitis Research Group). Výnimku tvorí testovanie pri fixnom liekovom exantéme. V tomto prípade sa test okrem zdravej kože aplikuje aj na zvyškovú léziu, hyperpigmentované ložisko a výsledky oboch testov sa porovnávajú [16]. Senzitivita epikutánnych testov sa pohybuje do 70 %, vyššia senzitivita sa udáva pri AGEP, fixnom liekovom exantéme a pri reakciách vyvolaných karbamazepínom a abakavirom [3]. Epikutánne testy používané v diagnostike DHR nie sú štandardizované, preto ich interpretácia musí byť opatrná. Napriek tomu môžu byť nápomocné v stanovení príčinného lieku. Ich výhodou je relatívna bezpečnosť, lebo riziko vyvolania symptómov DHR pri epikutánnom testovaní je veľmi nízke (obr. 3, 4).
Obr. 3. Pozitívny epikutánny test so Zinnatom
30-% koncentrácia originálneho lieku Zinnat 250 mg tbl v bielej vazelíne, odčítavanie po 72 hodinách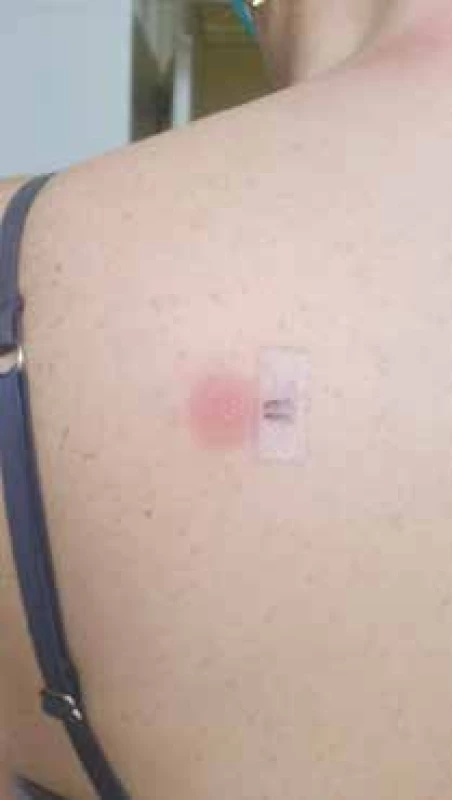
Obr. 4. Pozitívne epikutánne testy s jódovými kontrastnými látkami
1. Betadine 10-%
2. Betadine 1-%
3. Betadine 0,1-%
4. negatívna kontrola
5. Visipaque 270
6. Iomeron 350
7. Omnipaque 300
8. Ultravist 370
9. Optiray 350
(jódové kontrastné látky aplikované neriedené)
Odčítavanie po 72 hodinách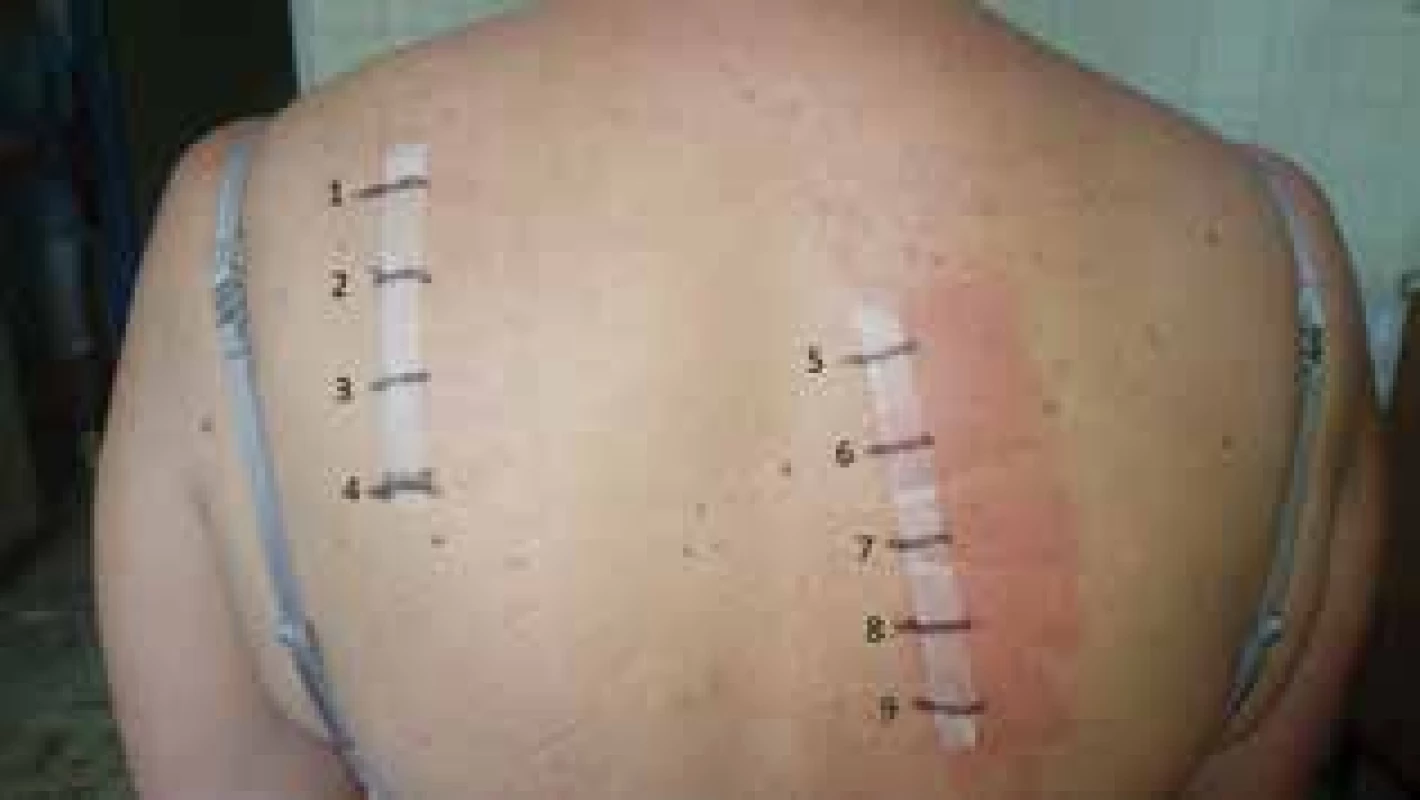
Kožné testy, vzhľadom na limitovanú senzitivitu, pri negatívnom výsledku nevylučujú precitlivenosť na testovaný liek. V prípade potreby užívania podozrivého lieku je preto nevyhnutné, podľa odporučení ENDA (European Network for Drug Allergy), doplniť kožné testy expozičným testom [1].
In vitro testy na dôkaz príčinného lieku
In vitro testy na stanovenie príčinného lieku sa odporúčajú u pacientov s anamnestickým údajom ťažkého priebehu DHR pred realizáciou kožných testov, u ktorých aj kožné testy prestavujú vysoké riziko vyvolania závažnej reakcie a u ďalších vysokorizikových pacientov, ako sú pacienti s vážnymi ochoreniami orgánov a orgánových systémov. In vitro testy sa využívajú pred expozičným testovaním aj v prípadoch, kedy sa kožné testy pre liekovú formu nedajú realizovať, príp. sú nedostupné [21].
Vyšetrenie prítomnosti špecifických IgE protilátok (sIgE) pri alergických reakciách sprostredkovaných týmto typom protilátok je založené na metódach typu imuno-esejí: rádioizotopových, enzymatických, fluorescenčných. Najrozšírenejšou metódou je FEIA (fluoroimunoesej). Detekcia sIgE je vhodná len pri limitovanej skupine liekov: beta-laktámové antibiotiká, blokátory nervovosvalového prenosu, chlorhexidín, niektoré biologiká. Senzitivita vyšetrenia sa pohybuje okolo 62,9 % a špecificita 89,2 % [41].
Test aktivácie bazofilov je alternatívnou metódou na diagnostiku IgE protilátkami sprostredkovanej alergickej reakcie. Testy zamerané na aktiváciu bazofilov môžu byť založené na meraní aktivačných znakov na povrchu týchto buniek (BAT; Basophil activation test), alebo na detekcii látok uvoľnených pri degranulácii bazofilov (CAST; Cel-lular allergen stimulation test). V praxi častejšie využívaný BAT je založený na dôkaze aktivačného znaku (CD 63, CD 203c) exprimovaného na povrchu bazofilov po inkubácii plnej nezrazenej krvi pacienta s vodným roztokom predpokladaného alergénu za pomoci prietokovej cytometrie. Test môže byť použitý pri mnohých liekoch, podmienkou je ich rozpustnosť, ale jeho nevýhodou je chýbanie celkovej štandardizácie pracovného postupu [27]. Validovaný je v prípade beta-laktámových a fluorochinolónových antibiotík a v prípade blokátorov nervovosvalového prenosu. Špecificita vyšetrenia je vyššia ako špecificita v prípade vyšetrenia sIgE, udáva sa okolo 94,6 % [22]. Pri CAST sa v odobratej vzorke inkubovanej s alergénom stanovuje hladina uvoľnených mediátorov, a to sulfidopeptidových leukotriénov alebo histamínu. CAST metóda sa v rutinnej praxi využíva menej. Nevýhodou je nutnosť izolácie buniek na hustotovom gradiente, čo vedie k nešpecifickej stimulácii bazofilov. Pokiaľ je CAST realizovaný s plnou krvou, nemeria len mediátory uvoľnené z bazofilných leukocytov, ale aj z iných krvných elementov [4].
Vzhľadom na silnú asociáciu medzi niektorými HLA alelami a vznikom závažných liekových hypersenzitívnych reakcií, indukovaných abakavirom, karbamazepínom a alopurinolom, sa odporúča pred pridaním uvedených liekov do terapie realizovať u rizikových pacientov genetické vyšetrenie [41]. Skríning HLA-B*57 : 01 sa odporúča u väčšiny etnických populácií pred zahájením liečby abakavirom, skríning HLA-B*15 : 02 pred pridaním karbamazepínu u pacientov ázijského pôvodu a skríning HLA-B*58 : 01 pred zahájením liečby alopurinolom u pacientov ázijskej a kaukazskej populácie [21].
Lymfocyto-transformačný test (LTT) je založený na proliferácii T lymfocytov špecifických pre alergén u pacientov s bunkami sprostredkovaným typom liekovej hypersenzitívnej reakcie, po stimulácii príčinným liekom. Senzitivita a špecificita testu je variabilná, závisí od vyvolávajúceho lieku, ale aj od typu liekovej hypersenzitívnej reakcie. Senzitivita testu je vyššia pri hypersenzitívnych reakciách typu makulopapulózneho exantému, AGEP, DRESS a DIHS, ale nižšia pri SJS a TEN [21, 41]. Lymfocyty po stimulácii exprimujú na svojom povrchu aktivačné znaky, ktoré sa dajú detegovať v teste aktivácie lymfocytov. Meranie znaku CD69 prostredníctvom prietokovej cytometrie koreluje s výsledkami LTT pri vyšetrení neskorých liekových hypersenzitívnych reakcií indukovaných beta-laktámovými antibiotikami, sulfametoxazolom a karbamazepínom.
ELISpot (Enzyme-linked immunosorbent spot assay) slúži na detekciu buniek reagujúcich na podnet špecifického antigénu (alergénu) produkciou príslušného cytokínu. Ide o veľmi citlivú metódu, ktorá umožňuje detegovať < 25 buniek produkujúcich určitý cytokín v milióne mononukleárnych buniek periférnej krvi, a to niekoľko rokov po prekonanej liekovej hypersenzitívnej reakcii. IFN-γ ELISpot môže byť použitý na potvrdenie neskorej reakcie vyvolanej beta-laktámovými antibiotikami. Vyšetrenie granzymu B a granulysinu môže byť použité na dôkaz cytotoxického mechanizmu pri neskorých liekových hypersenzitívnych reakciách. Na vyšetrenie hladiny niektorých zápalových mediátorov ako sú IL-5, IL-10, IFN-γ sa môže využiť aj ELISA metodika. Na zvýšenie citlivosti testu sa odporúča stanovenie hladiny dvoch a viacerých cytokínov [17, 21].
Pri liekových hypersenzitívnych reakciách vyvolaných nesteroidovými antireumatikami (NSAIDs; Nonsteroidal anti-inflammatory drugs) typu SNIDR (single NSAID-induced delayed reaction) a SNIUAA (single NSAID-induced urticaria/angioedema or anaphylaxis) sa na dôkaz príčinného lieku využívajú vyššie uvedené vyšetrenia, ktoré ale nie sú odporúčané v prípade reakcií ne-alergického typu. Podľa niektorých autorov výskyt troch a viac epizód DHRs vyvolaných štrukturálne odlišnými NSAIDs s vysokou pravdepodobnosťou svedčí pre ne-alergický typ reakcií vznikajúci inhibíciou cyklooxygenázy 1 [19]. Na niektorých pracoviskách sa na dôkaz tohto typu reakcií vyšetruje ELISA metódou hladina cysteinylových leukotriénov a 15-HETE (kyselina 15-hydroxyeikosatetraenoiková) v supernatante izolovaných ľudských leukocytov stimulovaných NSAIDs [21]. Najpriekaznejším vyšetrením na potvrdenie príčinného lieku pri oboch typoch reakcií vyvolaných NSAIDs ostáva expozičný test.
In vitro testy slúžia ako doplnkové testy, na báze ktorých nie je možné vylúčiť precitlivenosť na testovaný liek a výsledky in vitro testov musia byť vždy interpretované s ohľadom na anamnézu a kliniku pacienta, ako aj s ohľadom na výsledky kožných testov, pokiaľ sa tieto dajú realizovať.
Expozičný test
Expozičný test, označovaný aj ako provokačný test, predstavuje napriek svojej limitácii tzv. „zlatý štandard“ diagnostiky liekových hypersenzitívnych reakcií alergického aj nealergického typu. Podľa odporučení v Európe aj v Severnej Amerike sa testy realizujú s cieľom vylúčiť hypersenzitivitu na lieky v anamnesticky sporných prípadoch, kde benefit vyšetrenia výrazne prevyšuje jeho riziko, u pacientov s údajom polyvalentnej liekovej precitlivenosti, kde sú veľmi obmedzené možnosti v medikácii pacienta, alebo v prípadoch, kedy je u pacienta potrebné nájsť bezpečnú alternatívu lieku [41]. K provokačným testom sa pristupuje v prípadoch vitálnej indikácie lieku, kedy je alternatívna terapia nedostupná, alebo neefektívna a kedy iné, menej rizikové metódy nevedú k jednoznačnému záveru. Expozičné testy je nevyhnutné realizovať za hospitalizačných podmienok v zdravotníckom zariadení, ktoré má skúsenosti a znalosti v danej oblasti a je dostatočne personálne a prístrojovo vybavené pre prípad potreby riešenia závažnej DHR. Pacient musí byť podrobne oboznámený s účelom a povahou testov, musí byť upozornený na možné riziká expozičného testovania, možnosť podania placeba a musí podpísať informovaný súhlas.
Testy sú kontraindikované u tehotných žien a kojacich matiek, u pacientov s akútnym infekčným ochorením, nekontrolovanou bronchiálnou astmou, závažným kardiálnym ochorením alebo ochorením obličiek a pečene. Neodporúčajú sa, prípadne sú kontraindikované, aj v prípade údaja o predchádzajúcej závažnej liekovej hypersenzitívnej reakcii, ako je napr. ťažká anafylaxia, SJS, TEN, DRESS/DIHS, systémová vaskulitída, špecifické orgánové postihnutie alebo v prípadoch liekmi indukovaného autoimunitného ochorenia [8].
Postupy pri expozičnom testovaní nie sú štandardizované, závisia od lieku, spôsobu jeho podania, typu a závažnosti reakcie, času nástupu symptómov, zdravotného stavu jednotlivca, pravidelnej medikácie a mnohých ďalších faktorov. Cesta podania lieku pri expozičnom teste môže byť orálna, parenterálna (intravenózna, intramuskulárna, podkožná) alebo lokálna (sliznice, koža). Ak je to možné, preferuje sa orálne podanie lieku pred jeho parenterálnou aplikáciou, lebo v dôsledku pomalšej absorbcie lieku sa príznaky DHR rozvíjajú postupne a prípadná antialergická liečba môže byť indikovaná skôr, ako je to pri parenterálnom podaní, kedy sa symptómy rozvíjajú rýchlejšie [1]. Testy sa realizujú s komerčne pripravenými substanciami, iba v prípade zarábaných prípravkov je vhodnejšie testovať jednotlivé zložky oddelene. Provokačný test by mal byť prednostne realizovaný ako placebom kontrolovaný jednoducho zaslepený, v osobitných situáciách ako dvojito zaslepený test. Vo všeobecnosti, v prípade predchádzajúcej skorej liekovej hypersenzitívnej reakcie sa štartovacia dávka lieku pohybuje medzi 1 : 10 000 až 1 : 10 terapeutickej dávky a interval medzi jednotlivými dávkami je minimálne 30 minút. Pri podozrení na neskorú reakciu by úvodná dávka nemala prekročiť 1 : 100 terapeutickej dávky a v závislosti od lieku môže testovanie trvať hodiny, dni až týždne [1].
Pozitívny výsledok expozičného testu by mal byť stanovený preferenčne na základe objektívnych príznakov. V prípade, že symptómy sú len subjektívne, je nutné realizovať test s placebom a ak je tento krok negatívny, retestovať poslednú dávku lieku [8].
V prípade vzniku reakcie počas testovania sa ako doba potrebná k následnému bezpečnému sledovaniu pacienta vo všeobecnosti udáva 24 hodín od stabilizácie stavu. Najväčšie riziko pri skorých reakciách v tomto období predstavuje vznik druhého ataku bifázickej anafylaktickej reakcie, ktorý môže mať letálne následky, ak nie je včas rozpoznaný a adekvátne liečený. V prípade bifázickej anafylaktickej reakcie nastupuje druhá fáza s odstupom 6–12 hodín po fáze akútnej. Je vyvolaná sekundárnymi mediátormi, ktoré sa syntetizujú de novo z bunkových membrán. Ide predovšetkým o produkty metabolizmu kyseliny arachidónovej, tzv. eikosanoidy. Výskyt bifázickej reakcie sa popisuje v 1–20 % prípadov anafylaxie. Medzi rizikové faktory patrí veľmi rýchly nástup ťažkostí v prvej fáze reakcie, oneskorená aplikácia adrenalínu, nedostatočná dávka adrenalínu, kardiovaskulárne a respiračné ochorenia, ako aj terapia betablokátormi [40]. Aj po ukončení hospitalizácie a observácie musí byť pacient poučený o možnosti vzniku symptómov v rámci neskorej precitlivenosti, najmä ak pokračuje naďalej v užívaní testovaného lieku. Pre skoré rozpoznanie symptómov musí poznať ich charakter a musí byť oboznámený ako postupovať v prípade ich objavenia sa.
Pri provokačných testoch treba brať do úvahy farmakologický efekt testovaného lieku ako aj jeho maximálnu odporúčanú dávku (narkotiká, antidiabetiká, antikoagulanciá atď.). V prípadoch, kedy ochorenia pacienta môžu mať vplyv na metabolizmus alebo elimináciu testovaného lieku, napr. pri poruchách funkcie pečene a obličiek, je nutné dávku testovaného lieku upraviť. Pozornosť treba venovať aj liekom, ktoré pacient užíva, a ktoré by mohli ovplyvniť výsledky testov. V prípade, že nie sú kontraindikácie, je potrebné vysadiť antihistaminiká 5 dní, antidepresíva 5 dní, glukokortikosteroidy v závislosti od dávky a dĺžky podávania 1–3 týždne, betablokátory 1 deň a ihibítory angiotenzín-konvertujúceho enzýmu 1 deň pred zahájením expozičných testov [1]. Betablokátory ako látky inhibujúce beta-adrenergné receptory zvyšujú pohotovosť bazofilov a mastocytov k degranulácii a obmedzujú účinok protišokovej terapie betamimetikami, čo môže viesť k vystupňovaniu alergickej reakcie a zníženiu účinku antialergickej liečby. Problémom sú aj inhibítory angiotenzín-konvertujúceho enzýmu, ktoré bránia odbúravaniu bradykinínu, ako aj kompenzačnej mobilizácii angiotenzínu II počas anafylaxie [35].
Je nutné si uvedomiť, že aj výsledok expozičného testu je limitovaný možnosťou výskytu falošne pozitívnych a falošne negatívnych reakcií. K falošne pozitívnej reakcii môže viesť napr. objavenie sa psychogénnych symptómov, prítomnosť už existujúcich ťažkostí (urtikária), agravácia pre-existujúceho ochorenia liekom. Príčinou falošne negatívneho výsledku môže byť užívanie antialergickej liečby, chýbanie kofaktorov DHR (vírusová infekcia, fyzická záťaž, stres pred stomatologickým výkonom a pod.), veľmi krátky alebo naopak dlhý interval od reakcie [8]. Ako príčina falošne negatívneho výsledku prichádza do úvahy aj desenzibilizácia indukovaná postupne sa zvyšujúcimi dávkami lieku počas testovania, hoci takýto prípad doteraz v literatúre opísaný nebol [1]. Navyše, negatívny záver expozičného testu nevylučuje možnosť rozvoja hypersenzitívnej reakcie indukovanej daným liekom v budúcnosti.
TERAPIA LIEKOVÝCH HYPERSENZITÍVNYCH REAKCIÍ
Terapiu liekových hypersenzitívnych reakcií môžeme rozdeliť na symptomatickú liečbu už vzniknutých reakcií a dlhodobé liečebné stratégie, ktorých cieľom je minimalizovať riziko nasledujúcich reakcií. Základom liečby je ukončenie medikácie s liekom podozrivým z vyvolania reakcie a prípadná symptomatická liečba závislá na type, charaktere a závažnosti reakcie.
V prípade vzniku celkovej anafylaktickej reakcie je nevyhnutná farmakoterapia, oxygenoterapia a udržanie vitálnych funkcií. V prvej línii liečby stojí intramuskulárne podanie a v prípade neadekvátnej odpovede na niekoľko intramuskulárnych dávok, intravenózne podanie adrenalínu. V druhej línii je to odstránenie spúšťača, polohovanie pacienta, vysoko-prietoková oxygenoterapia, doplnenie cirkulujúceho objemu a inhalácia krátko pôsobiacich beta-2-agonistov. V tretej línii sú to antihistaminiká a systémové kortikosteroidy [25]. Podanie antihistaminik a kortikosteroidov môže byť nápomocné v zmiernení symptómov, ale nikdy nepredstavuje náhradu podania adrenalínu, ani nesmie jeho podanie oddialiť. Glukagón je indikovaný u pacientov s refraktérnymi symptómami, ktorí užívajú betablokátory [39].
Pri liečbe SCAR nie sú k dispozícii optimálne odporučenia. V prípade SJS a TEN sú najčastejšou liečebnou modalitou systémové kortikosteroidy. Intravenózne imunoglobulíny sa podávajú pri ťažkom priebehu a u detských pacientov, napriek tomu, že u detí s TEN je pozorovaná vo všeobecnosti nižšia mortalita a lepšia prognóza ako u dospelých. Z ďalších často podávaných liekov je to cyklosporín a anti-TNF-α biologická liečba. Nedávna štúdia ukázala, že v liečbe SJS a TEN sú najúspešnejšie kortikosteroidy a cyklosporín, na rozdiel od intravenóznych imunoglobulínov, plazmaferézy, talidomidu, cyklofosfamidu, hemoperfúzie, anti-TNF-α liečby či faktoru stimulujúceho granulocytové kolónie [44]. V liečbe DRESS/DIHS sa podľa odporučení Francúzskej dermatovenerologickej spoločnosti odporúčajú systémové kortikosteroidy, pri ťažkom priebehu intravenózne imunoglobulíny a pri vírusovej reaktivácii antivirotiká [12, 18].
Podstatou prevencie vzniku opakovaných reakcií je edukácia pacienta o povahe, príčinách a dôsledkoch liekovej hypersenzitívnej reakcie a permanentné vylúčenie príčinného lieku z medikácie, v prípade potreby jeho náhrada za liek štrukturálne odlišný, skrížene nereagujúci [32]. Poučenie o vylúčení príčinného lieku z medikácie má mať písomnú formu a okrem názvu lieku má obsahovať aj informáciu o charaktere a závažnosti reakcie spolu s uvedením dátumu jej výskytu. V prípade, že bol pacient testovaný, treba uviesť dátum a metódu, ktorou bola precitlivenosť na liek potvrdená, eventuálne odporučiť bezpečnú alternatívu lieku. K dispozícii je pracovnou skupinou ENDA/EAACI (European Network for Drug Allergy, European Academy of Allergy and Clinical Academy) vypracovaný formulár takéhoto poučenia v anglickom jazyku [6].
Pri DHRs nealergického typu vyvolaných NSAIDs sa ako bezpečná alternatíva aj bez predchádzajúceho provokačného testu odporúčajú opiáty, ktorých mechanizmus účinku, je kompletne odlišný, analgetický účinok je dosiahnutý inhibíciou µ-opiátových receptorov v nervovom systéme. Menšiu skríženú reaktivitu s ostatnými NSAID majú aj molekuly, ktoré majú väčšiu tendenciu k inhibícii cyklooxygenázy 2, oxikamy. Ich podanie ale vyžaduje predchádzajúci expozičný test [43].
Permanentné vynechanie príčinného lieku z medikácie môže niekedy viesť k vylúčeniu lieku v rámci liečby prvej línie a znížiť kvalitu života pacienta. V prípadoch, kedy je alternatívna liečba málo efektívna, alebo neefektívna možno zvážiť desenzibilizáciu. Desenzibilizácia je definovaná ako indukcia stavu dočasnej tolerancie na liek zodpovedný za hypersenzitívnu reakciu. Ide o vysoko rizikovú procedúru, preto je nevyhnutné starostlivo zvážiť riziká a benefity tejto liečby [10]. Desenzibilizácia sa nesmie zamieňať s alergénovou imunoterapiou (v minulosti označovanou aj ako desenzibilizácia alebo hyposenzibilizácia) peptidovými alergénmi, ako sú aeroalergény a jed blanokrídleho hmyzu. V prípade liekovej desenzibilizácie mechanizmus účinku terapie nie je presne známy a indukovaná tolerancia je dočasná. Jej trvanie je ohraničené na obdobie podávania lieku a v prípade prerušenia alebo vynechania liečby sa hypersenzitivita na liek objavuje opätovne v priebehu niekoľkých dní a vyžaduje nový proces desenzibilizácie [26]. Pri väčšine substancií sa ako bezpečná doba vynechania lieku udáva interval do 24–48 hodín.
K indikáciám liečby patria prípady, kedy príčinný liek nemožno nahradiť iným liekom, prípadne alternatíva lieku nie je dostatočne účinná, predchádzajúca lieková hypersenzitívna reakcia nebola život ohrozujúca a benefity liečby prevažujú jej riziká. Desenzibilizácia je absolútne kontraindikovaná v prípadoch SCAR, ako sú SJS alebo TEN, lebo aj nízke dávky lieku môžu indukovať exacerbáciu potenciálne fatálnej deskvamačnej reakcie a v prípadoch, kedy hypersenzitívna reakcia viedla k orgánovému postihnutiu alebo indukovala autoimunitné ochorenie [24]. Liečba sa realizuje na jednotkách intenzívnej starostlivosti alebo anesteziologicko-resuscitačných oddeleniach s monitorovaním pacientov. Desenzibilizácia sa najčastejšie využíva u pacientov s precitlivenosťou na antibiotiká (prednostne penicilín), inzulíny, sulfonamidy, chemoterapeutiká a biologiká, a to hlavne v prípadoch hypersenzitivity sprostredkovanej IgE protilátkami, menej pri iných typoch reakcií, z nich najmä pri makulopapulóznom exantéme, fixnom liekovom exantéme a pri reakciách indukovaných NSAIDs [9, 36].
Postupy nie sú štandardizované, líšia sa v dávkovaní a spôsobe aplikácie lieku, v intervale medzi jednotlivými dávkami, v počte dní potrebných na dosiahnutie terapeutickej dávky, či v podávaní premedikácie. Vo všeobecnosti sa štartovacia dávka lieku pohybuje medzi 10 až 0,00001 % terapeutickej dávky (väčšinou 0,001 %). Cesta podania môže byť orálna alebo parenterálna. V pravidelných intervaloch 15–120 minút (zvyčajne 30 minút) sa dávka zdvoj - až zdesaťnásobí (najčastejšie strojnásobí). Celková dĺžka trvania desenzibilizácie je od 2 hodín do 21 dní (zvyčajne 6 hodín). Pri intravenóznej aplikácii lieku je vo všeobecnosti štartovacia dávka nižšia: 1/1 000 000-ina až 1/1 000-ina terapeutickej dávky, pri orálnom podaní je štartovacia dávka vyššia, do 1/100-iny terapeutickej dávky. Interval medzi podaniami je pri intravenózne podávaných liekoch 15–30 minút, pri orálne podávaných liekoch, vzhľadom na ich pomalšiu absorbciu, môže byť interval dlhší (až do 12 hodín pri kotrimoxazole) [10, 11]. Pri tzv. rýchlej desenzibilizácii sa v praxi najčastejšie využívajú 12–20-stupňové protokoly s 2–2,5-násobným zvyšovaním alergénu v každom nasledujúcom kroku s 15–30-minútovými intervalmi. Kratšie protokoly (napr. 8-stupňové) sa zvyknú využívať v prípadoch, kedy liek viedol k DHR s miernejším priebehom [9]. V premedikácii sa najčastejšie podáva metylprednizolón alebo prednizolón, antihistaminiká, ranitidín, zriedkavejšie montelukast, ale protektívny efekt premedikácie doteraz nebol systematicky študovaný [11]. Úspešnosť desenzibilizácie sa udáva v závislosti na literárnom zdroji v 50–100 % a riziko vzniku reakcií približne v 50 % prípadov [10, 11].
Príkladom konkrétneho postupu môže byť desenzibilizácia s kyselinou acetylosalicylovou (ASA), ktorá sa robí v prípadoch nevyhnutnosti duálnej antiagregačnej liečby, kedy stačí dosiahnuť nižšiu udržiavaciu dávku 100 mg. Štartovacia dávka býva zvyčajne 1 mg a menej a každých 30 minút sa dávka zdvoj - alebo strojnásobí. V prípade úspešnej desenzibilizácie pacient pokračuje v pravidelnom každodennom užívaní ASA s maximálnou dĺžkou pauzy v užívaní do 48 hodín. Pri dlhšom vysadení lieku stúpa riziko straty efektu desenzibilizácie [43].
Premedikácia využívaná pri rizikových diagnostických a terapeutických výkonoch má podľa posledných odporučení sporný význam. Môže ovplyvniť priebeh miernych až stredne ťažkých včasných reakcií, ale má len limitovaný význam pri závažných včasných a neskorých reakciách. Väčšina protokolov pri premedikácii je založená na podávaní kortikosteroidov a antihistaminík. Protokoly nie sú štandardizované, líšia sa v konkrétnom type molekuly podávaného kortikosteroidu alebo antihistaminika, v spôsobe ich aplikácie, ako aj v dávkovaní [26, 28].
NEŽIADUCE ÚČINKY LIEKOV
DHRs patria do veľkej skupiny nežiaducich účinkov liekov (NÚL). Podľa definície je nežiaduci účinok humán-neho lieku: „reakcia na humánny liek, ktorá je škodlivá a nechcená. Medzi NÚL tak nepatria intoxikácie, omyly vo farmakoterapii, reakcie, ktoré vznikli na základe nesprávneho podávania liekov a použitie liekov v samovražednom úmysle. Závažný nežiaduci účinok humánneho lieku je každý nežiaduci účinok humánneho lieku, ktorý spôsobuje smrť, ohrozuje život chorého, vyžaduje poskytovanie ústavnej zdravotnej starostlivosti alebo jej predĺženie, vyvoláva zdravotné postihnutie alebo pracovnú neschopnosť, invaliditu chorého alebo sa prejavuje vrodenou úchylkou alebo znetvorením“ [45].
V roku 1977 a 1981 Rawlins a Thompson navrhli klasifikáciu NÚL na typ A a typ B, ktorá sa postupne rozšírila o NÚL typu C, D a E [31].
NÚL A-typu vznikajú farmakologickou aktivitou lieku. Sú dávkovo závislé a dobre predvídateľné. Ich výskyt je častý (1 prípad NÚL na 10–100 podaní lieku) a stúpa s výškou dávky a dĺžkou podávania lieku. Mortalita je zriedkavá. Reakcie sú ovplyvnené farmakokinetikou lieku, komorbiditami pacienta a liekovými interakciami. Typickým príkladom je sedatívny účinok antihistaminík prvej generácie, hypoglykemický účinok inzulínu a iných antidiabetík a pod. [20, 26].
Výskyt liekových interakcií (DDI; Drug-drug interaction) stúpa s polypragmáziou najmä u pacientov vyššieho veku. Udáva sa, že viac ako 40 % pacientov starších ako 65 rokov užíva 5 a viac liekov a až 12 % užíva viac ako 10 rozličných liekov. Okrem veku pacienta a s ním spojenými fyziologickými zmenami, vznik DDI ovplyvňuje aj pohlavie, etnikum a zdravotný stav jednotlivca na jednej strane, ale aj dávka, spôsob podania a frekvencia užívania lieku na strane druhej [33]. Navyše, ako ukazujú posledné výskumy, pri DDI, rovnako ako pri iných NÚL, treba brať do úvahy aj potenciálny efekt génového polymorfizmu. V literatúre sa tak čoraz častejšie stretávame s označením drug-drug-gene interaction (DDGI), pomenúvajúcim kombináciu interakcií medzi génmi a viacerými liekmi navzájom. Ako najdôležitejšie sa v tomto smere javia polymorfizmy génov kódujúcich tri hlavné enzýmy zodpovedné za metabolizmus liekov: CYP2C9 (cytochróm P450 2C9), CYP2C19 (cytochróm P450 2C19) a CYP2D6 (cytochróm P450 2D6) [2].
NÚL B-typu sa vyskytujú u jedincov s určitou predispozíciou a zvyknú sa označovať aj ako idiosynkratické reakcie. Sú dávkovo nezávislé, neočakávané, zle predvídateľné a bývajú závažné. Ich výskyt je zriedkavý (1 prípad NÚL na 100–1 000 podaní lieku) [20]. Niektoré môžu byť spôsobené enzýmovými poruchami. Príkladom je vznik hemolytickej anémie po antimalarikách alebo sulfónamidoch u jedincov s deficitom enzýmu glukóza-6-fosfát-dehydrogenázy v erytrocytoch. Najväčší počet reakcií B-typu predstavujú reakcie, ktoré vznikajú v dôsledku pôsobenia lieku na imunitný systém – hypersenzitívne reakcie [26, 30].
Nežiaduce reakcie typu C, D a E sa objavujú po zvyčajných terapeutických dávkach liekov aplikovaných štandardným postupom. C-typ reakcií býva vážny, relatívne často sa vyskytujúci, s nejasným mechanizmom vzniku. Reakcie sú nepredvídateľné a vznikajú v rôznom časovom intervale od podania lieku. Príkladom je vyššie riziko vzniku tromboembolických komplikácii u pacientiek užívajúcich orálne kontraceptíva, alebo analgetická nefropatia. Reakcie typu D sa prejavujú s odstupom niekoľkých rokov, prípadne až celej generácie. Príkladom je častejší výskyt karcinómu vagíny u dievčat pubertálneho veku, ktorých matky počas gravidity užívali dietystilbestrol. NÚL E-typu označované aj ako reakcie z vynechania, prípadne „rebaund fenomén“, sa objavujú po náhlom ukončení dlhodobo podávanej terapie v dôsledku „up-regulácie“ zodpovedných receptorov. Typickým príkladom je vznik adrenokortikálnej insuficiencie po náhlom vysadení kortikosteroidov, alebo vznik akútneho koronárneho syndrómu po náhlom vysadení betablokátorov [20, 26].
ZÁVER
Frekvencia liekových DHRs sa za posledných desať rokov zvýšila [9]. DHRs spolu s ostatnými nežiaducimi účinkami liekov významne ovplyvňujú morbiditu a mortalitu a predstavujú vážny medicínsky a ekonomický problém.
V prevencii výskytu hypersenzitívnych reakcií je kľúčové správne stanovenie diagnózy a vyvolávajúcej príčiny ochorenia. Napriek vývoju nových sérologických a bunkových testov ostáva rizikový provokačný test najspoľahlivejšou metódou v diagnostike DHRs. Preto je do budúcnosti nevyhnutné, za účelom zlepšenia diagnostiky a eliminácie rizika súvisiaceho s realizáciou provokačných testov, hľadať nové vyšetrovacie metódy a postupy, zamerať sa na štandardizáciu už existujúcich protokolov, stanoviť senzitivitu, špecificitu, ako aj pozitívnu a negatívnu prediktívnu hodnotu jednotlivých testov, či realizovať rozsiahle multicentrické štúdie.
Vzhľadom na to, že génový polymorfizmus a ekologické faktory zohrávajú významnú úlohu pri rozvoji DHRs, ďalší rozvoj farmakogenomiky by mohol v budúcnosti viesť k pokroku v rámci personalizovanej medicíny. S cieľom zvýšiť účinnosť liečby, prípadne obmedziť riziko vzniku DHR u predisponovaných jedincov by bolo indikované farmakogenetické vyšetrenie pred zahájením terapie vybranými liekmi [37]. V súčasnosti sa v klinickej praxi s cieľom individualizácie farmakoterapie využíva stanovenie len niekoľkých vybraných génových polymorfizmov. Predpokladom zníženia výskytu DHRs preto v dnešnej dobe aj naďalej ostáva racionálna farmakoterapia s obmedzením preskripcie na skutočne potrebné, kauzálne lieky a veľký dôraz, ktorý sa pri vývoji nových liekov kladie nielen na ich účinnosť, ale aj bezpečnosť.
Prehlásenie o konflikte záujmov
Autor v súvislosti s témou práce v posledných 12 mesiacoch nespolupracoval so žiadnou farmaceutickou firmou.
Do redakce došlo dne 16. 5. 2019.
Adresa pro korespondenci:
MUDr. Jana Nemšovská, MPH, MHA
Dermatovenerologická klinika LF UK a UNB
Mickiewiczova 13
813 69 Bratislava
Slovenská republika
e-mail: jana.nemsovska@sm.unb.sk
Zdroje
1. ABERER, W., BIRCHER, A., ROMANO, A. et al. Drug provocation testing in the dignosis of drug hypersensitivity reactions: general considerations. Allergy, 2003, 58(9), p. 856–863.
2. BAHAR, M. A., SETIAWAN, D., HAK, E., WILFFERT, B. Pharmacogenetics of drug-drug interaction and drug-drug-gene interaction: a systematic rebiew on CYP2C9, CYP2C19, CYP2D6. Pharmacogenomics, 2017, 18(17), p. 701–739.
3. BARBAUD, A., COLLET, E., MILPIED, B. et al. A multicentre study to determine the value and safety of drug patch tests for the three main classes of severe cutaneous adverse drug reactions. Br. J. Dermatol., 2013, 168(3), p. 555–562.
4. BARTŮŇKOVÁ, J., PAULÍK, M. a kol. Vyšetřovací metody v imunologii. 2. vyd. Praha: Grada, 2011. 168 s. ISBN 978-80-247-3533-7.
5. BERROA, F., LAUFUENTE, A., JAVALOYES, G. et al. The usefulness of plasma histamine and different tryptase cut-off points in the diagnosis of peranaesthetic hypersensitivity reactions. Clin. Exp. Allergy, 2014, 44, p. 270–277.
6. BROCKOW, K., ABERER, W., ATANASKOVIC--MARKOVIC, M. et al. Drug allergy passport and other documentation for patients with drug hypersensitivity – An ENDA/EAACI Drug Allergy Interest Group Position Paper. Allergy, 2016, 71, p. 1533–1539.
7. BROCKOW, K., GARVEY, L. H., ABERER, W. et al. Skin concentrations for systemically administred drugs – an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy, 2013, 68, p. 702–712.
8. BROCKOW, K., PRZYBILLA, B., ABERER, W. et al. Guideline for the diagnosis of drug hypersensitivity reactions. Allergo J. Int., 2015, 24(3), p. 94–105.
9. CASTELLS GUITART, M. C. Rapid drug desensitization for hypersensitivity reactions to chemotherapy and monoclonal antibodies in the 21st century. J. Invesig. Allergol. Clin. Immunol., 2014, 24(2), p. 72–79.
10. CERNADAS, J. R., BROCKOW, K., ROMANO, A. et al. General considerations on rapid desensitization for drug hypersensitivity – a consensus statement. Allergy, 2010, 65(11), p. 1357–1366.
11. DE GROOT, H., MULDER, W. M. C. Clinical practice. Drug desensitization in children. Eur. J. Pediatr., 2010, 169(11), p. 1305–1309.
12. DESCAMPS, V., BEN-SAID, B., SASSOLAS, B. et al. Management of drug reaction with eosinophilia and systemic symptoms (DRESS). Ann. Dermato. Venerol., 2010, 137, p. 703–708.
13. HRUBIŠKO, M. et al. Alergológia. Martin: Osveta, 2003. 519 s. ISBN 80-8063-110-7.
14. CHEN, CH. B., ABE, R., PAN, R. Y. et al. An Up--dated review of the Molecular Mechanisms in Drug Hypersensitivity. J. Immunol. Res., 2018, ID 6431694, 22 pages. Dostupné na www: https://doi.org/10.1155/2018/6431694.
15. CHUNG, W. H., HUNG, S. I., YANG, J. Y. et al. Granulysin is a key mediator for disseminated keratinocyte death in Stevens-Johnson syndrome and toxic epidermal necrolysis. Nat. Med., 2008, 12, p. 1343–1350.
16. JOHANSEN, J. D., FROSCH, P. J., LEPOITTEVIN, J. P. Contact Dermatitis. 5th Edition. Springer Berlin Heidelberg, 2011, ISBN 978-3-642-03827-3.
17. KATO, K., KAWASE, A., AZUKIZAWA, H. et al. Novel inerferon-γ enzyme-linked immunoSpot assay using activated cells for identifying hypersenitivity-inducing drug culprits. J. Dermatol. Sci., 2017, pii: S0923-1811(16)31063-5. doi: 10.1016/j.jdermsci.2017.03.007.
18. KOVÁČOVÁ, S. DIHS – liekmi indukovaný hypersenzitívny syndróm. Dermatol. Prax, 2014, 8(2), p. 40–64.
19. KOWALSKI, M. L., ASERO, R., BAVBEK, S. et al. Classification and practical approach to the diagnosis and management of hypersensitivity to nonsteroidal antiinflammatory drugs. Allergy, 2013, 68, p. 1219–1232.
20. LAŠŠÁNOVÁ, M., PETROVÁ, M., LAŠŠÁN, Š., HUDEC, R. Nežiaduce účinky liekov, riziko farmakoterapie. Via pract., 2008, 5(2), p. 87–89.
21. MAYORGA, C., CELIK, G., ROUZAIRE, P. et al. In vitro tests for drug hypersensitivity reactions: an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy, 2016, 71, p, 1103–1134.
22. MAYORGA, C., DONA, I., PEREZ-INESTROSA, E. et al. The value of in vitro tests to diminish drug challenges. Int. J. Mol. Sci., 2017, 18(6).
23. McNEIL, B. D., PUNDIR, P., MEEKER, S. et al. Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions. Nature, 2015, 519, p. 237–241.
24. MIN-HYE, K., JONG-MYUNG, L. Diagnosis and Management of Immediate Hypersensitivity Reactions to Cephalosporins. Allergy Asthma Immunol. Res., 2014, 6(6), p. 485–495.
25. MURARO, A., ROBERTS, G., WORM, M. et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy, 2014, 69, p. 1026–1045.
26. NEMŠOVSKÁ, J., ŠVECOVÁ, D. Hypersenzitívne reakcie vyvolané liekmi. Dermatol. Prax, 2017, 11(3), p. 112–116.
27. NEMŠOVSKÁ, J. Test aktivácie bazofilov u pacientov alergických na jed blanokrídleho hmyzu. Klinická imunológia a alergológia, 2016, 2, p. 11–17.
28. NEMŠOVSKÁ, J., ŠVECOVÁ, D. Precitlivenosť na jódové kontrastné látky. Dermatol. Prax., 2017, 11(1), p. 8–10.
29. OGAWA, K., MORITO, A., HASEGAWA, A. et al. Identification of thymus and activation-regulated chemokine (TARC/CCL17) as a potential marker for early indication of disease and prediction of disease activity in drug-induced hypersensitivity syndrome (DIHS)/drug rush with eosinophilia and systemic symptoms (DRESS). J. Dermatol. Sci., 2013, 69(1), p. 38–43.
30. PICHLER, W. J., HAUSMANN, O. Classification of Drug Hypersensitivity into Allergic, p-i, and Pseudo-Allergic Forms. Int. Arch. Allergy Immunol., 2016, 171, p. 166–179.
31. RAWLINS, M. D. Clinical pharmacology: adverse reactions to drugs. B. M. J., 1981, 282, p. 974–976.
32. RIEDL, M. A., CASILLAS, A. M.. Adverse drug reactions: types and treatment options. Am. Fam. Physician., 2003, 68(9), p. 1781–1790.
33. RODRIGUES, M. C. S., DE OLIVEIRA, C. Drug--drug interactions and adverse drug reactions in polypharmacy among older adults: an integrative review. Rev. Lat. Am. Enfermagen, 2016, 24, p. e 2800.
34. ROMANO, A., TORRES, M. J., CASTELLS, M. et al. Diagnosis and management of drug hypersensitivity reactions. J. Allergy Clin. Immunol., 2011, 127(3), p. S67–S73.
35. RUËFF, F., BILÓ, M. B., MŰLLER, U. R. Risk of severe anaphylaxis for patients with Hymenoptera venom allergy: Are angiotensin-receptor blockers comparable to angiotensin-converting enzyme inhibitors? Reply. J. Allergy Clin. Immunol., 2010, 125, p. 1171–1172.
36. SCHERER, K., BROCKOW, K., ABERER, W. Desensitization in delayed drug hypersensitivity reactions – an EAACI position paper of Drug Allergy Interest Group. Allergy, 2013, 68(7), p. 844–852.
37. SLANAŘ, O. Farmakogenomika – současnost, budoucnost, perspektiva. Klin. Farmakol. Farm., 2012, 26(3), p. 126–130.
38. SU, S. C., MOCKENHAUPT, P., WOLKENSTEIN, P. et al. Interleukin-15 is associated with severity and mortality in Stevens-Johnson syndrome/toxic epidermal necrolysis. J. Invest. Dermatol., 2017, 137, p. 1065–1073.
39. THOMAS, M., CRAWFORD, I. Best evidence topic report. Glucagon infusion in refractory anaphylactic shock in patients on beta-blockers. Emerg. Med. J., 2005, 22(4), p. 272–273.
40. TOLE, J. W., LIEBERMAN, P. Biphasic anaphylaxis review of incidence, clinical predictors, and observation recommendations. Immunol. Allergy Clin. North Am., 2007, 27(2), p. 319–326.
41. TORRES, M. J., ROMANO, A., CELIK, G. et al. Approach to the dignosis of drug hypersensitivity reactions: similarities and differences between Europe and North America. Clin. Transl. Allergy, 2017, 7, p. 7–25.
42. WHEATLEY, L. M., PLAUT, M., SCHWANINGER, J. M. et al. Report from the National Institute of Allergy and Infectious Diseases workshop on drug allergy. J. Allergy Clin. Immunol., 2015, 136(2), p. 262–271.
43. WÖHRL, S. NSAID hypersensitivity – recommendations for diagnostic work up and patient management. Allergo. J. Int., 2018, 27(4), p. 114–121.
44. ZIMMERMANN, S., SEKULA, P., VENHOFF, M. et al. Systemic immunomodulating therapies for Stevens-Johnson syndrome and toxic epidermal necrolysis: a systematic review and metha-anylysis. JAMA Dermatology, 2017, 137(5), p. 514–522.
45. Zákon NR SR č. 362/2011 Z. z. o liekoch a zdravotníckych pomôckach a o zmene a doplnení niektorých zákonov, § 68 ods.1 a 2, 2011.
Štítky
Dermatológia Detská dermatológia
Článek Století je dlouhá dobaČlánek KONTROLNÍ TESTČlánek ErrataČlánek Kožní nádoryČlánek Odborné akce
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2019 Číslo 5- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- Století je dlouhá doba
- Liekové hypersenzitívne reakcie: diagnostika a liečba (2. časť)
- KONTROLNÍ TEST
- Lineární IgA bulózní dermatóza. Popis případu
- Průsvitná papula na prstu nohy. Stručný přehled
- Errata
- Rekurentní melanocytové léze – diagnosticky obtížné situace. Série případů
- Kožní nádory
- Neotigason: „Program prevence těhotenství a expozice plodu“
- Odborné akce
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kožní nádory
- Liekové hypersenzitívne reakcie: diagnostika a liečba (2. časť)
- Lineární IgA bulózní dermatóza. Popis případu
- Průsvitná papula na prstu nohy. Stručný přehled
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



