-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Primární maligní obrovskobuněčný nádor pažní kosti mikroskopicky napodobující chondroblastom – kazuistika
Chondroblastoma-like primary malignant giant cell tumor of the humerus – a case report
35-year-old woman suffered prolonged pain in the left shoulder, where an aggressively growing tumor of the proximal humerus was revealed thereafter. The lesion caused massive osteolysis of the metaepiphysis with cortical disruption, but no soft tissue extension was evident. Given the unsatisfactory effect, the ongoing neoadjuvant chemotherapy was prematurely ceased and the resection 13 cm long segment of bone with modular prosthesis replacement followed. Histologically, clear-cut malignant tumor with both the presence of numerous reactive osteoclast-like giant cells and geographic structural deposition of chondroid matrix bore a close resemblance to chondroblastoma. Dominant cellular composition formed solid mosaic clusters of large, atypical, frequently binucleated cells with voluminous eosinophilic cytoplasm. Impressive nuclear pleomorphism was accentuated by both the grooving and atypical mitotic figures. Thorough sampling disclosed limited, but sharply contrasting parts, where biphasic arrangement of small uniform stromal elements together with regularly distributed, reactive osteoclasts suggested putative precursor giant cell lesion. Except the osteoclasts, all matrical and stromal cells were strongly SOX9 and D2-40 positive; in contrary desmin, SATB2, S100 and p63 yielded completely negative results. Detected H3F3A c.103G>T mutation in exon 2 finally established true nature of that peculiar neoplastic proliferation and lead to descriptive term of primary chondroblastoma-like malignant giant cell tumor. In the setting of all the microscopic variability, histogenesis and complex differential diagnosis of skeletal (malignant) giant cell lesions, there are discussed e.g. aggressive/malignant chondroblastoma, chondroblastoma-like osteosarcoma or giant cell-rich osteosarcoma and practical impact of specific mutational analysis results as well.
Keywords:
Humerus – primary malignant giant cell tumor of the bone – chondroblastoma – chondroblastoma-like – H3F3A mutation
Autori: Zdeněk Kinkor 1; Petr Grossmann 1; Zuzana Špůrková 2; Zuzana Věcková 2; Zdeněk Matějovský 3
Pôsobisko autorov: Bioptická laboratoř s. r. o., Šiklův ústav patologie, LF UK, Plzeň 1; Oddělení patologie, Nemocnice na Bulovce, Praha 2; Ortopedická klinika, Nemocnice na Bulovce, Praha 3
Vyšlo v časopise: Čes.-slov. Patol., 55, 2019, No. 1, p. 42-47
Kategória: Původní práce
Súhrn
Prezentován je případ třicetipětileté ženy s neustávající bolestí v rameni, u které byl zjištěn agresívně rostoucí tumor proximálního humeru. Nádor způsobil rozsáhlou cystickou osteolýzu metaepifýzy s destrukcí kortikalis, avšak bez známek šíření do přilehlých měkkých tkání. Po předčasně ukončené neoadjuvantní chemoterapii s nulovým efektem následovala resekce 13 cm kosti s aplikací modulární endoprotézy. Mikroskopicky se jednalo o jasně maligní nádor s vysokou reaktivní účastí osteoklastů a hojnou produkcí extracelulární chondroidní matrix, připomínající nezvyklým organoidním strukturálním uspořádáním chondroblastom. Naprosto převládaly velké atypické, solidně mozaikovité uspořádané, převážně dvoujaderné elementy s objemnou eozinofilní cytoplazmou. Jadernou pleomorfii zvýrazňovalo rýhování a přítomnost atypických mitotických figur. Extenzívní zpracování vzorku odhalilo ostře kontrastující miniaturní oblasti s duální kompozicí malých uniformních stromálních elementů a reaktivních osteoklastů, které budily dojem původní prekurzorové obrovskobuněčné léze. Nádorové elementy (vyjma osteoklastické příměsi)vykazovaly difúzní silnou pozitivitu s protilátkami SOX9 a D2-40; kompletně negativní byly p63, S100 protein, SATB2 a desmin. Podstatu nádorové proliferace odhalila až prokázaná mutace c.103G>T v exonu 2 genu H3F3A vedoucí k popisnému označení maligní obrovskobuněčný kostní tumor napodobující chondroblastom. Na pozadí mikroskopické variability, histogeneze a složité diferenciální diagnostiky (maligních) obrovskobuněčných kostních lézí jsou diskutovány např. agresívní/maligní chondroblastom, chondroblastoma-like osteosarkom či giant cell-rich osteosarkom a přínos specifické mutační analýzy v běžné praxi.
Klíčová slova:
humerus – primární maligní obrovskobuněčný kostní nádor – chondroblastom – chondroblastom napodobující – mutace H3F3A
Obrovskobuněčný kostní nádor (OKN) a chondroblastom (CHB) představují relativně časté léze v rámci rozmanité škály kostních nádorů s významnou účastí osteoklastů v histologickém obraze. Jejich vzájemná diferenciální diagnostika většinou nečiní orientovanému patologovi obtíže, zejména v kontextu věkové distribuce, topografie a alespoň základního povědomí o radiologickém obraze. Zdánlivá podobnost celulární kompozice OKN a CHB se rychle vytrácí při pečlivém posouzení rozdílných cytomorfologických detailů – např. celkové množství a geografická distribuce osteoklastů, mozaikovitá skladba větších oválných stromálních elementů s objemnější, jasně konturovanou cytoplazmou a jaderným rýhováním, produkce chondroidní matrix s charakteristikou mineralizací, osteoidní depozita primitivní vláknité kosti v denzní stromální složce při infrakci atd. Fenotyp vlastní nádorové mononukleární stromální komponenty se rovněž liší; v CHB se primitivní chrupavčitá orientace odráží např. v expresi S100 proteinu, D2-40 a SOX9; naopak OKN pak bývá ložiskově/slabě p63 pozitivní. Vícejaderné osteoklasty jsou pak společnou (histogeneticky a funkčně totožnou) univerzální reaktivní nenádorovou příměsí. Přesto existující proměnlivost typické mikroskopie obou proliferací může způsobit rozpaky – a to nejen v malých, nedostatečně reprezentativních vzorcích probatorní biopsie. Významnou pomoc v těchto situací přinesla mutační analýza genů H3F3A a H3F3B, kde konkrétní molekulární alterace jsou pro OKN a CHB jedinečné (vzájemně exkluzívní)(1-9). Vzácnou možností komplikující diagnostiku obrovskobuněčných lézí skeletu je tzv. maligní OKN (MOKN); jednak protože různá míra účasti osteoklastů či osteoclast-like elementů není neobvyklá v maligních tumorech všeobecně, tedy nejen v kostech, ale i proto, že dokázat přímou patogenetickou souvislost konkrétního maligního nádoru s původním OKN není výhradně z histologického výrazu vůbec jednoduché. Chceme se podělit o zkušenost s unikátním případem MOKN, který klinicky a mikroskopicky napodoboval CHB a bez průkazu jedinečné genetické aberace by patrně zůstal nerozpoznán.
METODIKA
Materiál byl fixován v 10 % formolu a zalit do parafínu (FFPE); pro barvení hematoxylinem eozinem a molekulární analýzu byly krájeny řezy silné 2 mm, pro imunohistochemické vyšetření (IHC) řezy silné 4 mm.
Odvápnění tkáňových bloků z resekátu se provádělo roztokem, který tvořila 37 % kyselina chlorovodíková – 85 ml, 85 % kyselina mravenčí – 50 ml, aluminium chloratum – 35 g a destilovaná voda – 1000 ml. Roztok se vzorky bych kontinuálně promícháván magnetickou míchačkou; stupeň odvápnění byl 2x denně pečlivě kontrolován.
IHC bylo prováděno elektronicky nastaveným protokolem v automatu BenchMark ULTRA, VENTANA/Roche. K vizualizaci reakce byl použit diaminobenzidin tetrahydrochlorid, k dobarvení jader metylénová modř. Použity byly protilátky clusterin (Biocare Medical, klon 41D, ředění 1 : 100), desmin (Dako, klon D33, předředěno), D2-40 (Dako, klon D2-40, předředěno), p63 (Ventana, klon 4A4, předředěno), SATB2 (Sigma-Aldrich, polyklonální, ředění 1 : 100), SOX9 (AbCam, klon EPR14335, ředění 1 : 1500) a S100 protein (Ventana, polyklonální, předředěno).
DNA byla izolována z FFPE tkáně za použití QIAsymphony DNA Mini kitu (Qiagen, Hilden, Germany) a automatizovaného extrakčního systému QIAsymphony SP (Qiagen) dle instrukcí výrobce pro FFPE vzorky (Purification of genomic DNA from FFPE tissue using the QIAmp DNA FFPE Tissue Kit and Deparaffinization Solution). Mutační analýza exonu 2 genu H3F3A a exonů 4 genů IDH1 a IDH2 byla provedena PCR amplifikací s FastStart PCR Master Mix (Roche, Mennheim, Germany) a primery H3F3A-2F: 5´-CATGGCTCGTACAAAGCAGA-3´/H3F3A-2R: 5´-CAAGAGAGACTTTGTCCCATTTTT-3´; IDH1-FN: 5´-TGATGAGAAGAGGGTTGAGGA-3´/IDH1-R: 5´-CACATACAAGTTGGAAATTTCTGG-3´; IDH2-F: 5´-TCAAGCTGAAGAAGATGTGGAA-3´/IDH2-R: 5´-GTGCCCAGGTCAGTGGAT-3´ a následným přímým sekvenováním pomocí Big Dye Terminator Sequencing kitu (Applied Biosystems, Foster City, CA, USA) a analýzou v automatickém sekvenátoruABI Prism 3130xl (Applied Biosystems).
VLASTNÍ POZOROVÁNÍ
Klinicko-radiologická data
35letá žena přichází pro neustávající a zesilující bolesti pravého ramene. Na RTG/CT vyšetření byl zjištěn rozsáhlý, jasně maligní osteolytický proces metaepifýzy levého humeru se ztenčením a permeativní destrukcí kortikalis, avšak bez zjevné transkortikální propagace (obr. 1). Vzhledem k chybění charakteristických osteoplastických projevů se diagnóza konvenčního osteosarkomu zdála nepravděpodobná. V probatorní biopsii bylo pak vysloveno podezření na možný maligní chondroblastom, chondroblastoma-like osteosarkom, resp. giant cell-rich osteosarkom, což bylo důvodem zahájení neoadjuvantní chemoterapie (NCHT)pro osteosarkom. Po II. čtení biopsie a změně diagnózy byla provedena marginální resekce 13 cm proximálního humeru, včetně části neporušené kapsuly s náhradou modulární endoprotézou. Histologické vyšetření resekátu ukázalo limitovanou odpověď na NCHT (nekróza do 10 %), což společně s proměnou původního histologického závěru vedlo k modifikaci protokolu adjuvantní CHT (ACHT). V resekční linii nádorové struktury zjištěny nebyly. Pooperační restaging dle UICC (TNM klasifikace, 8 edice) byl určen jako T3, N0, M0.
Obr. 1. Rozsáhlý, agresívně rostoucí osteolytický tumor, deformující metaepifýzu hlavice pažní kosti s uzurací kortikalis, avšak bez progrese do měkkých tkání (RTG). 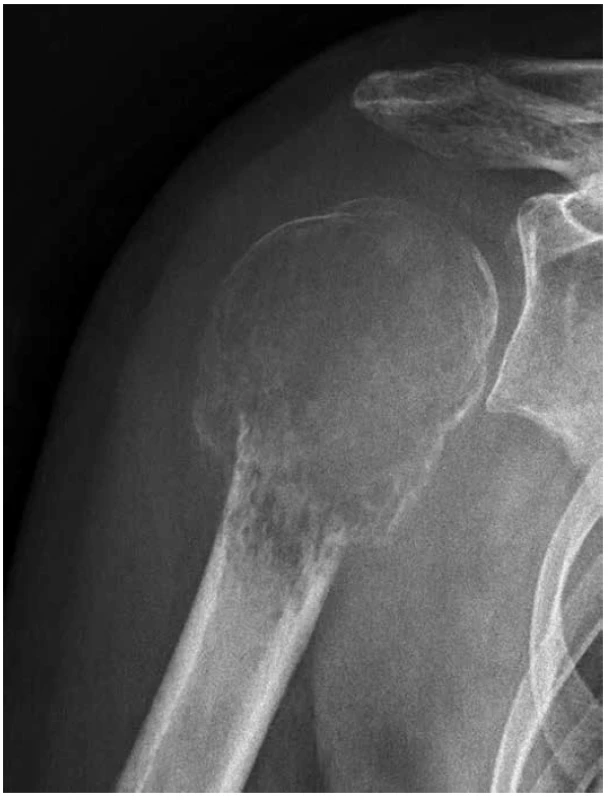
Nemocná je 10 měsíců po operaci resp. 7 měsíců po ukončení ACHT bez známek recidivy tumoru, hybnost v ramenním kloubu je významně omezena.
Morfologie, imunohistochemie a molekulární genetika
V resekátu proximálního humeru byl patrný rozsáhlý osteolytický dutinový/cystický proces destruující celou metaepifýzu s pokročilou usurací kortikalis, ale bez zjevného prorůstání do okolních měkkých tkání (obr. 2). Na histotopogramu však tumor jasně rozrušoval kompaktní kost a pronikal až pod přilehlou kloubní synoviální výstelku (obr. 3).
Obr. 2. Resekát proximální části humeru s expanzívní nádorovou kavitací ztenčující a místně rozrušující kortikální kost, bez známek šíření do okolí. 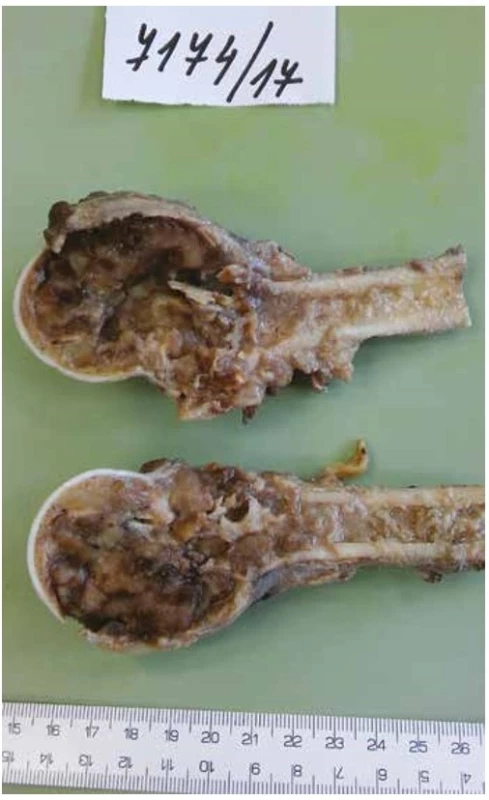
Obr. 3. Tumor na několika místech destruoval kompaktní kost a jazykovitě pronikal těsně pod kloubní synovii (HE, 20x). 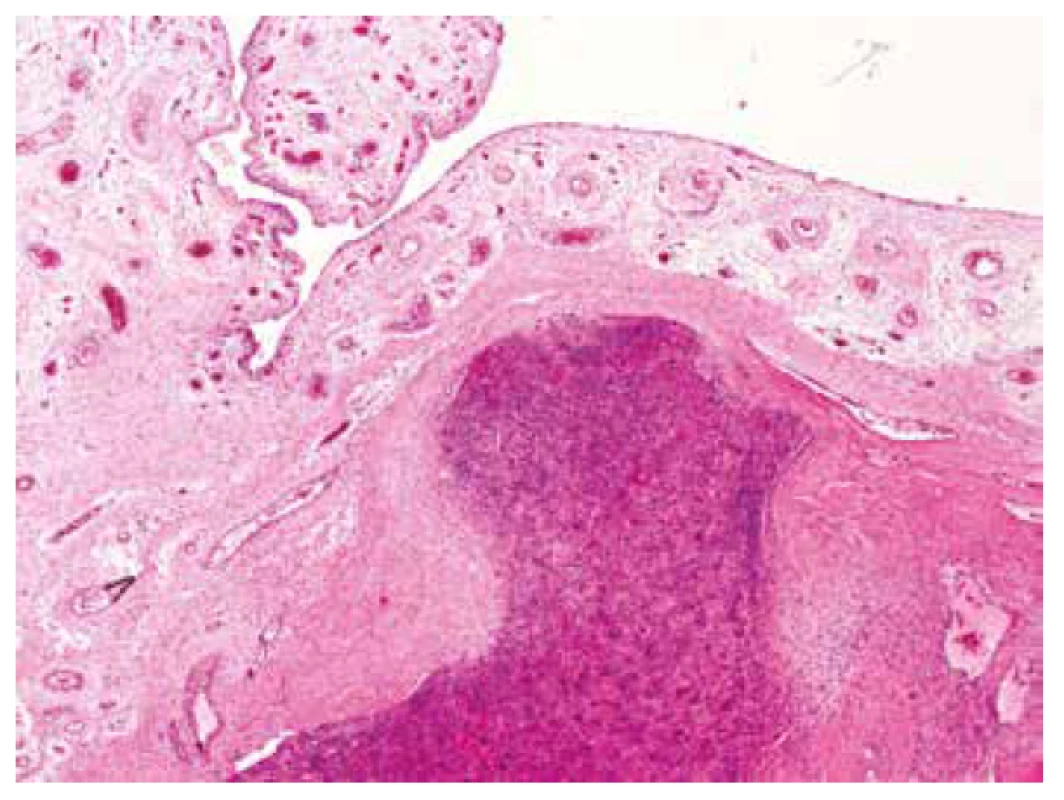
V mikroskopickém obraze převažovalo organoidní uspořádaní vytvářené ohraničenými uzlovitými depozity eozinofilního extracelulárního materiálu připomínajícího hyalinní chondroidní matrix. Tyto útvary pak vzájemně oddělovala tenká bazofilně se barvící septa, v jejichž buněčné kompozici jasně vystupovaly do popředí četné obrovské vícejaderné elementy typu osteoklastů doprovázené kompaktnější masou jednojaderných stromálních buněk (obr. 4). Tato strukturovaná základní stavba na první pohled silně připomínala chondroblastom. Detailnější pohled na buněčnou skladbu chondroidních hmot ukázal zjevné atypie a jaderný pleomorfismus velkých, kulatých, mozaikovitě nakupených buněk s hojnou, růžově matně sklovitou, ostře konturovanou cytoplazmou, které běžně obsahovaly dvě až tři jádra (obr. 5). Vzhled kompaktního mezibuněčného materiálu místy vzbuzoval pochyby o pravosti jeho původu a v hematoxylin eozinovém barvení jej nebylo možné spolehlivě odlišit od osteoidu; jeho mineralizaci/kalcifikaci jsme však nikde nezastihli (obr. 6). Jednojaderné stromální buňky temněji se barvicích dělících sept pak byly mnohem menší, s pravidelnými, bazofilními jádry, místy s evidentním rýhováním. Přesvědčivě reaktivního charakteru byly pak frekventované, místy až plachtovitě bizarní, stejnoměrně rozprostřené osteoklasty, s jadernými charakteristikami kopírujícími sousedící mononukleární stromální elementy (obr. 7). Tento základní strukturální koncept se pak volně prolínal se solidními partiemi jasně maligního pleomorfního sarkomu tvořeného objemnými, epiteloidně rhabdoidními buňkami, opět s více než jedním jádrem (obr. 8). I přes relativně nízkou mitotickou aktivitu (do 10 mitóz /10 HPF), převládaly zejména atypické/bizarní mitotické figury. Tumor byl zpracován téměř celý v desítkách bloků a pouze ve dvou z nich se nalezly nepatrné mikroskopické oblasti napodobující běžný OKN, což poprvé vzbudilo podezření na možnou existenci původní obrovskobuněčné léze a její následnou maligní proměnu (obr. 9).
Obr. 4. Při malém zvětšení převládající organoidní uzlovitá úprava eozinofilních chondroidních partií s rovnoměrně rozptýlenými četnými osteoklasty silně připomínala chondroblastom (HE, 200x). 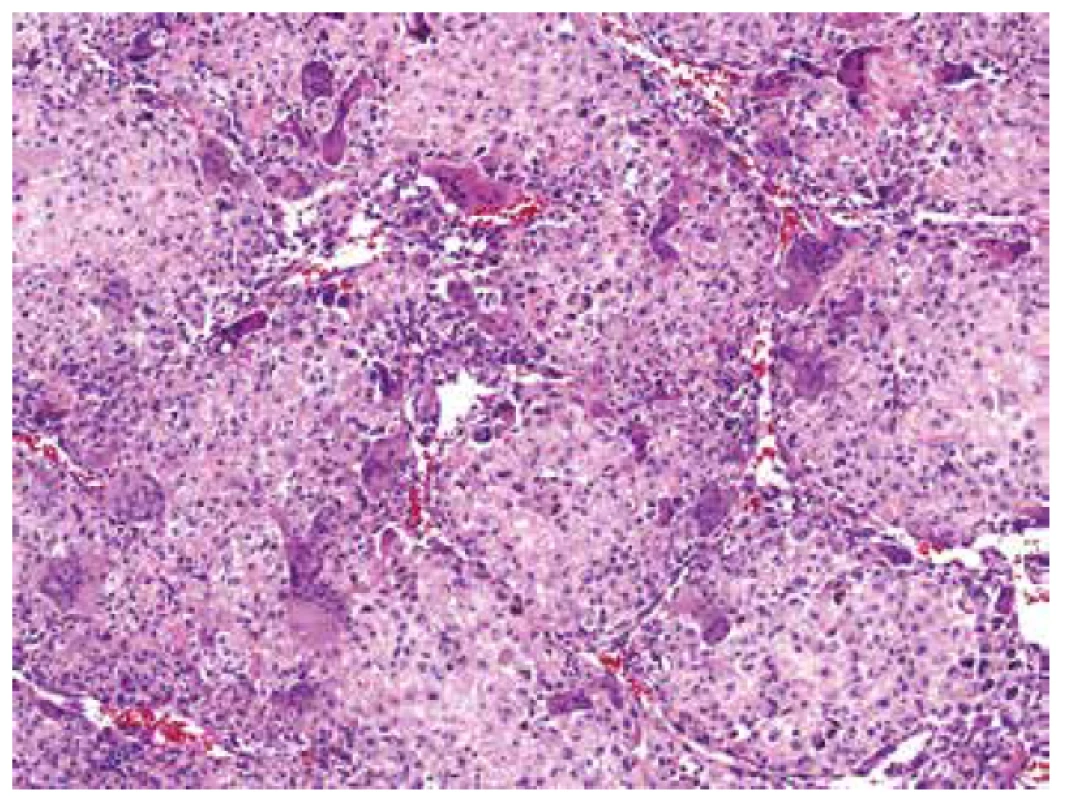
Obr. 5. Detailní vzhled chondroidních oblastí tvořených mozaikovitě uspořádanými, atypickými buňkami většinou se dvěma až třemi jádry a objemnou, jasně konturovanou, oxyfilní cytoplazmou; pozornost poutaly nepravidelné mitotické figury (HE, 400x). 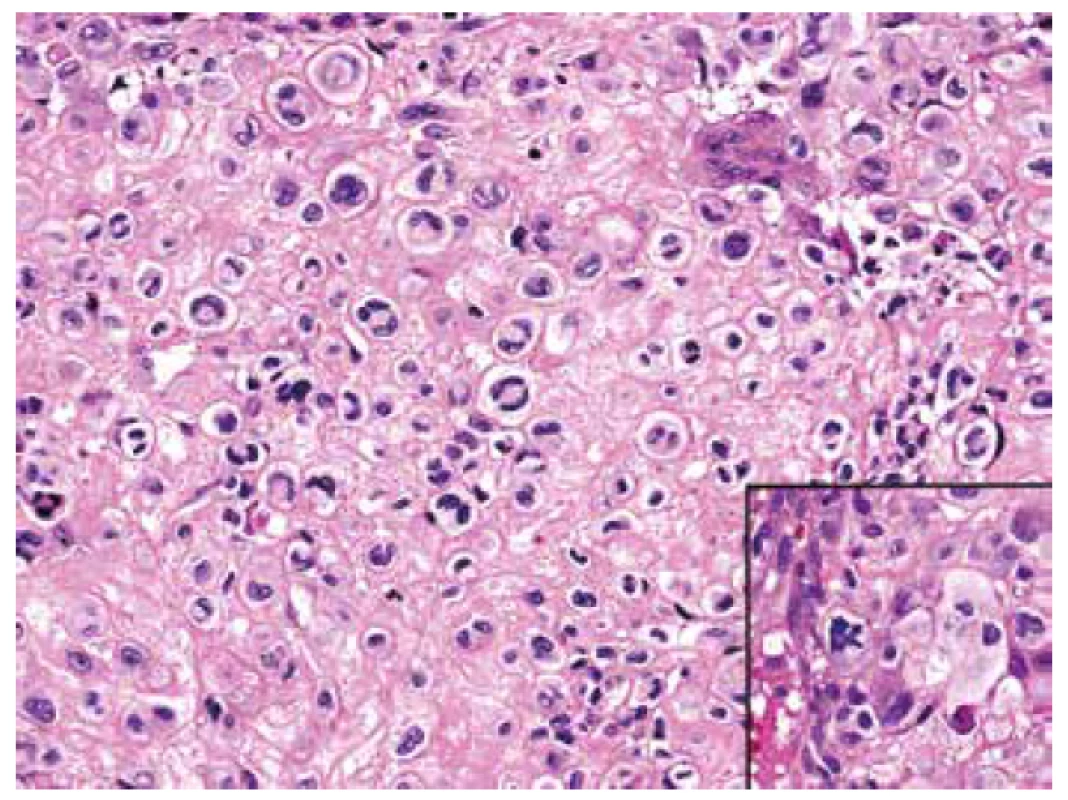
Obr. 6. V HE barvení bylo místy prakticky nemožné určit pravou podstatu extracelulární matrix, resp. vyloučit drobná depozita osteoidu od převládající chondroidní komponenty (HE, 200x). 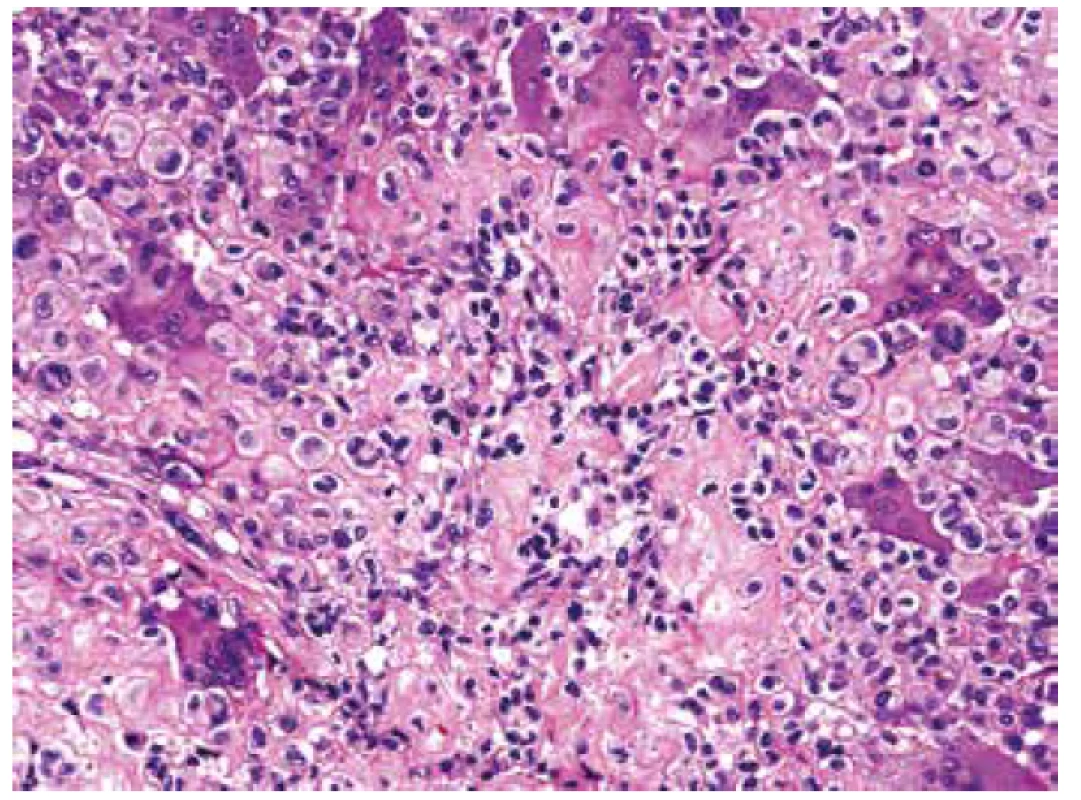
Obr. 7. Buněčnou kompozici menšinových dělících sept formovaly vedle osteoklastů bazofilní jednojaderné, zdánlivě uniformní stromální buňky, přesto se zjevnou anizokaryózou, hyperchromázií a místy s rýhováním (HE, 400x). 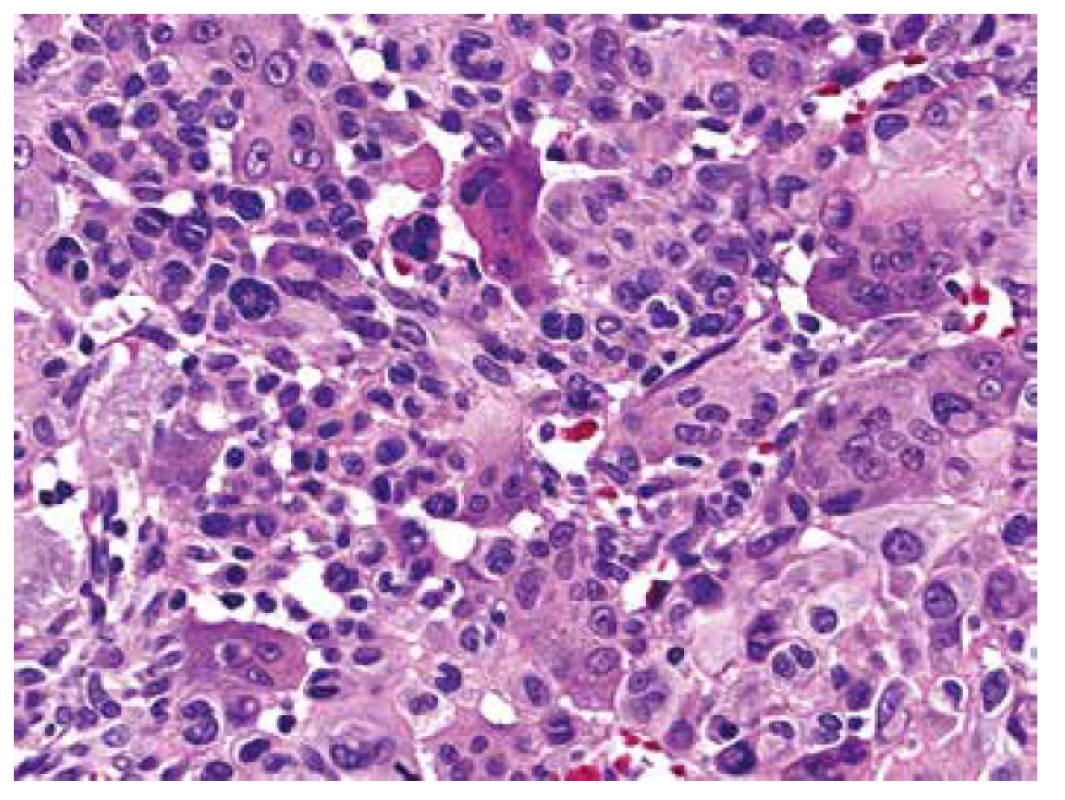
Obr. 8. Difúzní partie pleomorfního sarkomu s bizardními vícejadernými elementyepiteloidně rhabdoidního vzhledu, kde se téměř ztrácely izolované nenádorové osteoklasty (HE, 200x). 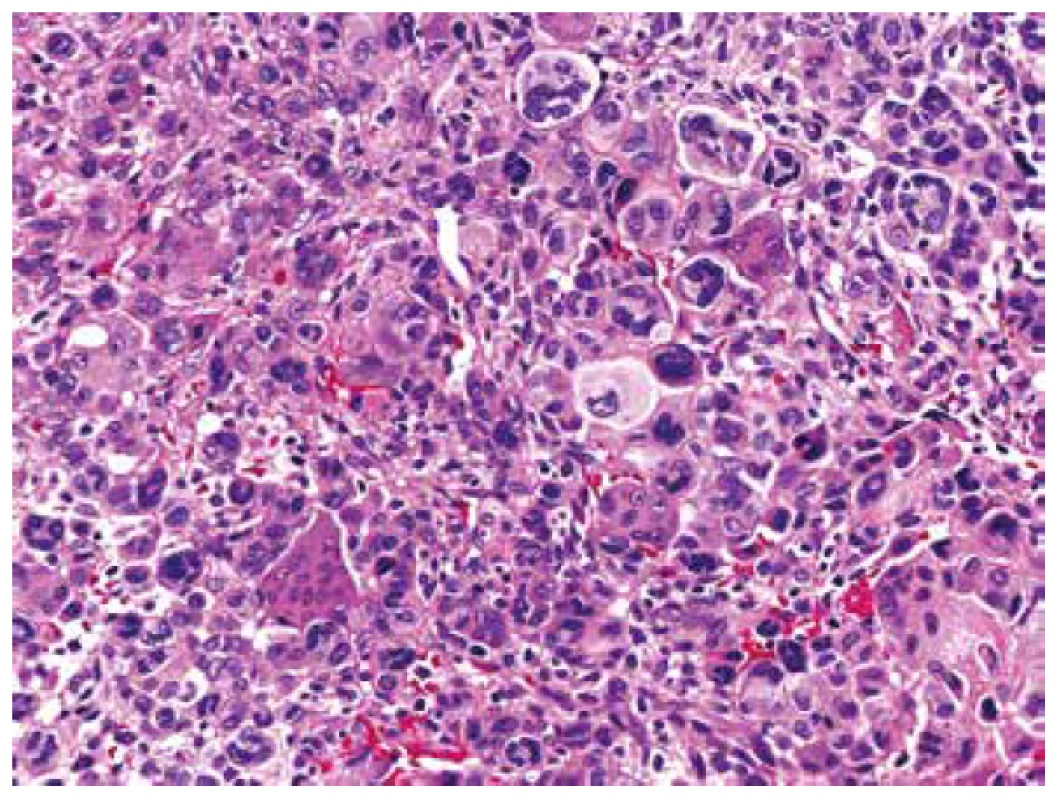
Obr. 9. S obrazem sarkomu ostře kontrastovaly naprosto výjimečné, kompaktní, bazofilní partie, které vzdáleně připomínaly možnou prekurzorovou obrovskobuněčnou lézi (HE, 100x). 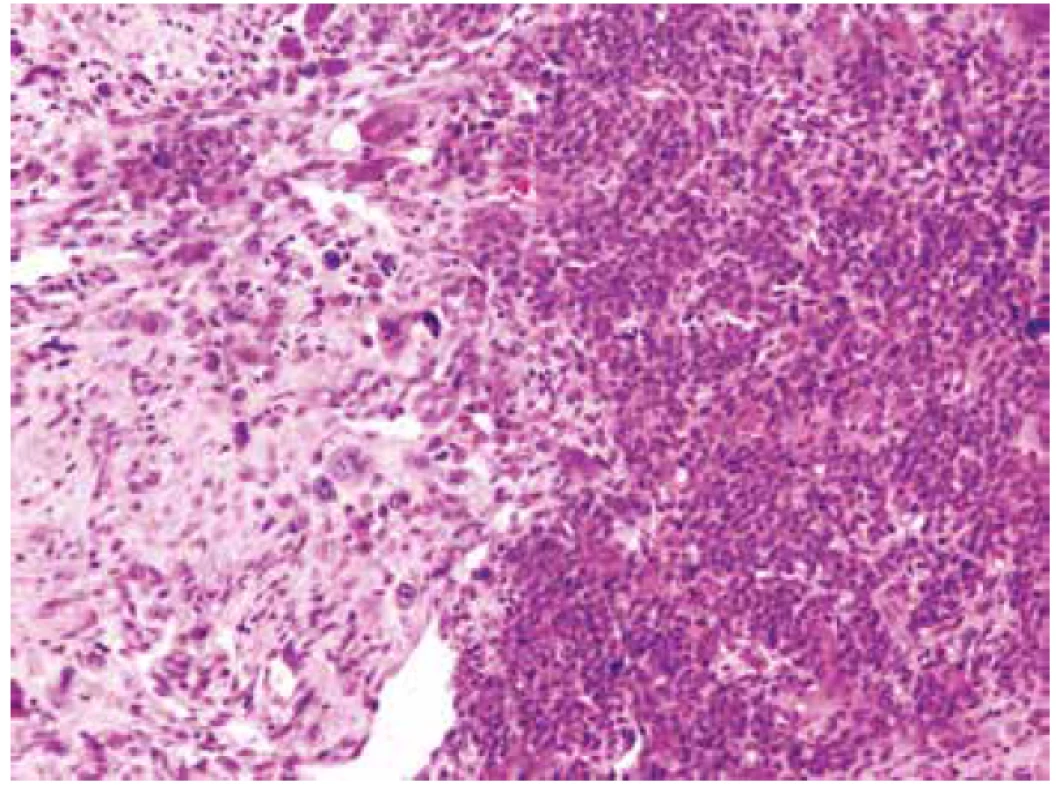
IHC vyšetřením jsme zaznamenali difuzní pozitivitu SOX9 a D2-40, ložiskově též clusterinu; exprese byla omezena pouze na „stromální“ maligní buňky, osteoklastická příměs byla vždy přísně negativní (obr. 10). Další použité markery (S100 protein, SATB2, p63 a desmin) byly kompletně negativní.
Obr. 10. Difúzní jaderná pozitivita s protilátkou SOX9 přítomná jak v chondroidních oblastech, tak v malých stromálních buňkách dělících sept; reaktivní osteoklasty byly vždy negativní (IHC; 200x). 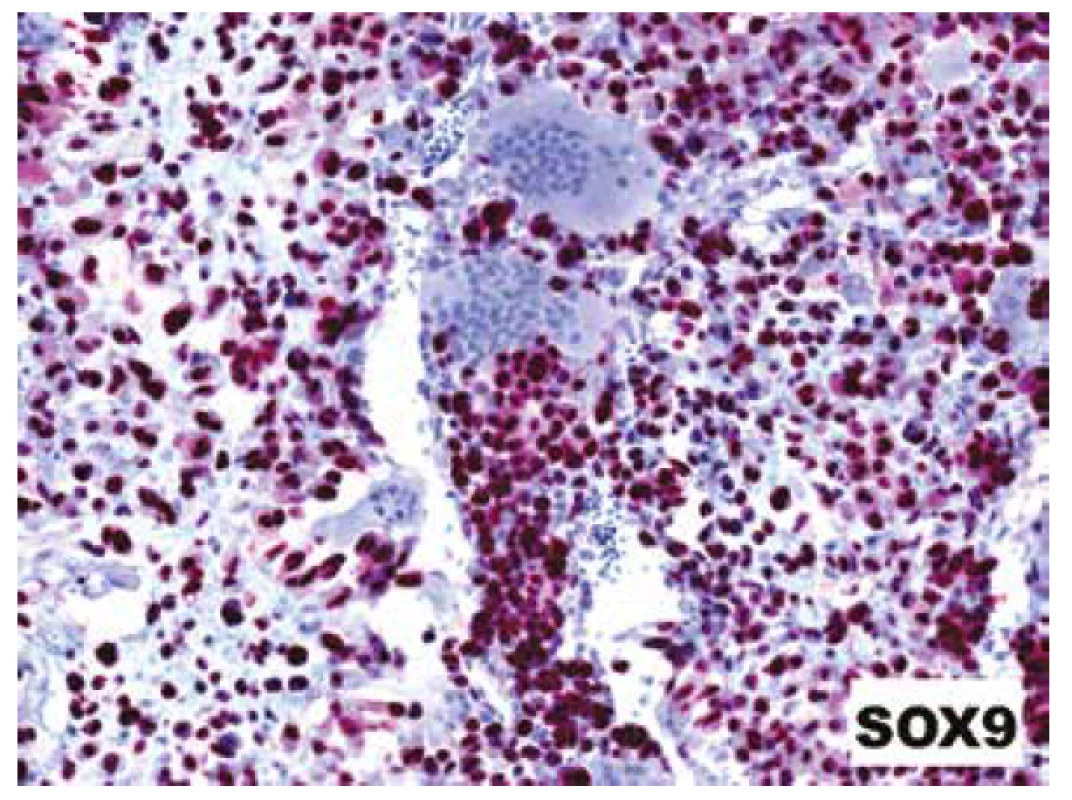
Mutační analýza prokázala bodovou/substituční mutacic.103G>T v exonu 2 genu H3F3A; přítomnost ev. mutace genů IDH1/2 nebyla nalezena (obr. 11).
Obr. 11. Sekvenční analýza exonu 2 genu H3F3A; šipka označuje heterozygotní substituční mutaci v pozici c.103G>T; resp. náhradu aminokyselin glycin za tryptofan (p.Gly35Trp; dle původního označení G34W). 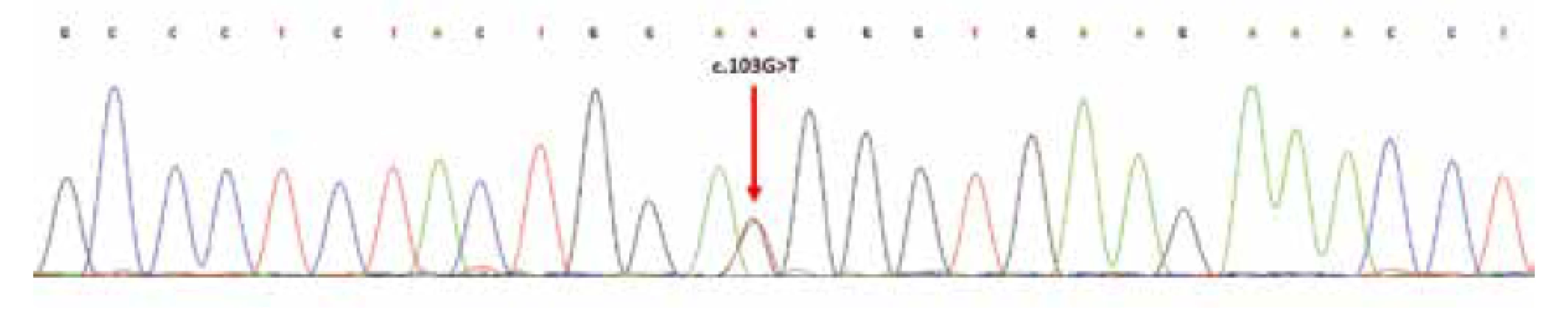
Konečná diagnóza pak zněla - primární maligní obrovskobuněčný kostní nádor připomínající chondroblastom.
DISKUZE
Zavedení mutační analýzy genů H3F3A a H3F3B do rutinní diagnostiky podstatně usnadnilo a zpřesnilo diferenciální diagnostiku obrovskobuněčných lézí kostí v mezních situacích – netypická lokalizace a věkové rozložení, neurčitý radiologický obraz, malý vzorek, sporná interpretace biologické povahy atd. (1-8). Nejde jen o to rozlišit OKN a CHB vzájemně, ale i v rámci celé škály jejich histologických mimikrů – to například vedlo ke zjištění, že OKN kraniofaciálního skeletu je vzácný, centrální obrovskobuněčný granulom mimo gnatickou oblast prakticky neexistuje, primární aneuryzmatická cysta je mnohdy „solidní“ a extenzívní příměs osteoklastů v maligním tumoru v naprosté většině případů není maligní OKN, ale něco úplně jiného.H3F3A a H3F3B jsou dva ze skupiny čtyř histonů spoluvytvářejících strukturu nukleozomů a společně s DNA výsledně formují jaderný chromatin. Nukleozomální remodelace pak sehrává klíčivou roli v chromozomální stabilitě, replikaci a opravě DNA a transkripčních regulacích. Patogenní mutace genů H3F3A a H3F3B jsou pak výlučným znakem více jak 95 % případů OKN, resp. CHB a v ostatních typech (obrovskobuněčných) neoplázií se prakticky nevyskytují (1-4). Mutace je v obou případech omezena pouze na vlastní stromální složku nádoru, obrovské vícejaderné buňky jsou wt. V OKN naprosto převládá mutace H3F3A p. G34W; varianty pG34L, M a V se popisují u lézí malých kostí ruky, pately a axiálního skeletu. Chondroblastom je definován unikátní mutací H3F3B p.K36M, přibližně v 10 % pak alternativní mutací genu H3F3A v totožné pozici p. K36M (1-6). Tyto aberace jsou pro OKN a CHN vzájemně exkluzívní, mutace genu H3F3B nebyla u OKN popsána. Pro skríning přítomnosti nejběžnějších mutací (H3F3A p. G34W u OKN, resp. H3F3B p. K36M u CHB) lze efektivně využít IHC vyšetření s „mutačně specifickými“ protilátkami (5-8). Zjištěná distinktní nukleární pozitivita příslušného antigenu ve stromálních buňkách (osteoklasty jsou přísně negativní) pomůže usměrnit pochybnosti u morfologicky nejednoznačných případů. Literatura rovněž dokumentuje sporadický výskyt mutace genu H3F3A p. G34W u maligních nádorů kostí. Tyto léze byly původně diagnostikovány jako giant cell rich-osteosarkomy (GCR-OS), MOKN či maligní tumory, blíže neurčené, s účastí obrovských buněk (2,4,6). Dále existuje pouze 6 případů konvenčního, resp. chondroplastického osteosarkomu s doloženou mutací H3F3A p. G34W, resp. raritní p. G34R (4,9). Porovnání DNA metylačního profilu této skupiny osteosarkomů (zde paradoxně bez příměsi osteoklastů…) a H3F3A wt běžných high-grade ostesarkomů navíc ukázalo jejich příbuznost právě s OKN (8). Panuje tedy shoda o tom, že naprostá většina těchto neoplázií jsou ve skutečnosti nejspíše primární či sekundární MOKN, i když originální benigní OKN nelze již přesvědčivě histologicky doložit. Jako paralela zde může posloužit např. koncept dediferencovaného chondrosarkomu, liposarkomu, resp. solitárního fibrózního tumoru. Zde průkaz mutace IDH1/2, amplifikace MDM2, resp. rearanže STAT6 jsou důkazem správné diagnózy i v situaci, že aktuální biopsii tvoří pouze nediferencovaný/pleomorfní sarkom a určující patognomonické partie již nejsou přítomny. Obráceně platí, že absence mutací H3F3A a H3F3B u domnělého OKN, resp. CHB by měla vést k zásadním pochybnostem. Sami jsme se o tom opakovaně přesvědčili při mylném výkladu solitární obrovskobuněčné léze skeletu v rámci hyperparathyreoidismu (tuto informaci klinik na průvodce paradoxně neuvedl…).
Výjimečnost našeho pozorování spatřujeme jednak v mimořádné a matoucí chondroidní diferenciaci v MOKN (dosud nebyla publikována - 4 izolovaná pozorování mutace H3F3A p. G34W v údajném dediferencovaném chondrosarkomu s obrovskobuněčnou složkou v rámci spektra použitých kontrolních skupin důsledně nezmiňuji IDH1/2 status! – pozn. autora) (2,9), jednak v rozhodující úloze molekulární analýzy v potvrzení finální diagnózy. Jsme přesvědčeni, že bez průkazu mutace genu H3F3A by přesný histologický závěr bohužel zůstal v úrovni teoretických diferenciálně diagnostických spekulací.
Bližší komentář si zaslouží spektrum diagnóz konzultujícího patologa. V písemnictví se lze ojediněle setkat s označením agresívní, metastazující či maligní chondroblastom nebo dokonce chondroblastoma-like osteosarkom, což je heterogenní skupina neoplázií, které spolu nemusí mít nutně mnoho společného (10-19,20-24).
CHB se zcela jistě umí chovat místně agresívně a vzácně „benigně“ metastazovat do plic, podobně jako OKN; bona fide maligní zvrat CHB či tzv. chondroblastoma-like osteosarkom ale zůstávají rozporuplné (10-24). Lze si např. představit, že chondroplastický osteosarkom může napodobit CHB neobvyklým organoidním uspořádáním chondroidní matrix a vlastní osteoblastické „stromální“ složky s minimální produkcí osteoidu. Analogií je třeba osteoblastoma-like osteosarkom, kde strukturální úprava matrix je téměř nerozpoznatelná od benigního osteoblastomu. Ať už takto pojmenované, maligně se chovající/vypadající léze jsou ve skutečnosti čímkoliv, u žádné nebyla dosud přesvědčivě doložena mutace H3F3B. Úvaha o možném GCR-OS byla u našeho případu zcela oprávněná – jednak rozlišení chondroidní a osteoidní matrix nebylo na mnoha místech jednoznačné, jednak GCR-OS je nejtypičtější malignitou s významnou příměsí osteoklastů a zároveň vedle nediferencovaného sarkomu nejběžnějším mikroskopickým projevem MOKN. Překvapivě však referující patolog možnost MOKN ve výčtu diferenciálně diagnostických možností nezmiňoval. Pokusíme se shrnout důvody, které nás vedly k tomu, že i před provedením genetického testování jsme tuto alternativu preferovali:
- věk nemocné, epifyzární uložení, značná velikost léze bez známek šíření do měkkých tkání – nezvyklé např. pro osteosarkom
- přesvědčivé cytomorfologické známky maligního nádoru, včetně atypických mitóz – nepatří do obrazu CHB
- silná exprese antigenů D2-40 a SOX9; úplná negativita SATB2 – zpochybňovaly pravděpodobnost osteoblastické diferenciace (paradoxně jsme však v praxi zjistili, že stromální komponenta typického OKN nezřídka reaguje s antigenem SOX9 i při absenci jakékoliv chrupavčité diferenciace?!)
- při bifázické, chondroidně stromální kompozici, ale bez extenze tumoru do okolí mimo kost a nepřítomnosti mutace IDH1/2 jsme vyloučili např. dediferencovaný chondrosarkom
- masivní účast osteoklastů v mikroskopickém obraze, radiologický nález a makroskopický vzhled principiálně nabádaly k úvaze o OKN – i při maligní morfologii a masivní extracelulární matrix; toto podezření pak zesílilo při identifikaci miniaturních oblastí, které vzdáleně připomínaly možný původní OKN
To vše nás nakonec vedlo k vyšetření mutace H3F3A a H3F3B; i přesto byl pozitivní výsledek pro nás překvapením; MOKN s masivní produkcí chrupavčité matrix totiž dosud nebyl popsán. Při zvážení všech okolností si však nemyslíme, že se jedná a priori o (chondroplastický) GCR-OS vzniklý malignizací OKN.
Stále nejasnou otázkou zůstává nejvhodnější terapie; většina se přiklání k aplikaci standardního „osteosarkomového“ protokolu u MOKN, neboť převládajícím morfologickým obrazem je zde právě GCR-OS (9). Širší empirii však limituje incidence MOKN; aplikace Denosumabu (anti-RANKL blokátor rutinně používaný v léčbě OKN) má zatím jen teoretický potenciál.
ZÁVĚR
Zdokumentovali jsme vzácný případ MOKN, kde nezvyklá, organoidně uspořádaná, extracelulární chondroidní matrix vzdáleně připomínala chondroblastom. Diferenciálně diagnostické rozpaky a konfúznost volby optimálního/přesného názvu léze definitivně vyřešil až nález mutace genu H3F3A. Naše pozorování, v písemnictví dosud nezaznamenané, potvrzuje, že molekulární analýzu (společně např. s rearanží genu USP6) lze efektivně využít i v diagnostice sporných obrovskobuněčných neoplázií skeletu. K její racionální indikaci pak spolehlivě poslouží IHC detekce jaderné exprese příslušného „mutovaného“ proteinuH3F3A, resp. H3F3B. Je však potřeba mít na paměti, že spolehlivost potvrzení aberace předpokládá šetrný postup při odvápnění vzorku.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Zdeněk Kinkor, Ph.D.
Bioptická laboratoř s.r.o.
Mikulášské nám. 4, 326 00 Plzeň
tel.: +420 737 220 449
e-mail: kinkor@medima.cz
Zdroje
- Presneau N, Baumhoer D, Behjati S, Pillay N, et al. Diagnostic value of H3F3A mutations in giant cell tumor of bone compared to osteoclast-rich mimics. J Pathol Clin Res 2015; 16 : 113-123.
- Kervarrec T, Collin C, Larousserie F, Bouvier C, et al.H3F3 mutation status of giant cell tumors of the bone, chondroblastomas and their mimics: a combined high-resolution melting and pyrosequencing approach. Mod Pathol 2017; 30 : 393-406.
- Nohr E, Lee LH, Cates JM, Perizzolo M, et al. Diagnostic value of histone 3 mutations in osteoclast-rich bone tumors. Hum Pathol 2017; 68 : 119-127.
- Righi A, Mancini I, Gambarotti M, Picci P, et al. Histone 3.3 mutations in giant cell tumor and giant cell-rich sarcomas of bone. Hum Pathol 2017; 68 : 128-135.
- Amary MF, Berisha F, Mozela R, Gibbons R, et al. The H3F3 K36M mutant antibody is a sensitive and specific marker for the diagnosis of chondroblastoma. Histopathology 2016; 69 : 121-127.
- Amary MF, Berisha F, Ye H, Gupta M, et al. H3F3A (histone 3.3) G34W immunohistochemistry: a reliable marker defining benign and malignant giant cell tumor of bone. Am J Surg Pathol 2017; 41 : 1059-1068.
- Lüke J, van Baer AS, Schreiber J, Lübbehüsen C, et al. H3F3A mutation in giant cell tumor of the bone is detected by immunohistochemistry using a monoclonal antibody against the G34W mutated site of the histone H3.3 variant. Histopathology 2017; 71 : 125-133.
- Yamamoto H, Iwasaki T, Yamada Y, Matsumoto Y, et al. Diagnostic utility of histone H3.3 G34W, G34R and G34V mutant-specific antibodies for giant cell tumors of bone.
- Koelsche C, Schrimpf D, Tharun L, Roth E, et al. Histone 3.3 hotspot mutations in conventional osteosarcomas: a comprehensive clinical and molecular characterization of six H3F3A mutated cases. Clin Sarcoma Res 2017; 7 : 9.
- Kiriakos M, Land VJ, Penning HL, Parker SG. Metastatic chondroblastoma. Report of a fatal case with a review of the literature on atypical, aggressive and malignant chondroblastoma. Cancer 1985; 55 : 1770-1789.
- Kunze E, Graewe T, Peitsch E. Histology and biology of metastatic chondroblastoma. Report of a case with a review of the literature. Pathol Res Pract 1987; 182 : 113-123.
- Povysil C, Matejovsky Z, Zidkova H, Trnka V. Aggressive chondroblastoma. Acta Chir Orthop Traumatol Cech 1993; 60 : 232-236.
- Pösl M, Werner M, Amling M, Ritzel H, et al. Malignant transformation of chondroblastoma. Histopathology 1996; 29 : 477-480.
- Rodgers WB, Mankin HJ. Metastatic malignant chondroblastoma. Am J Orthop 1996; 25 : 846-849.
- Jambhekar NA, Desai PB, Chitale DA, Patil P, et al. Benign metastasizing chondroblastoma.: a case report. Cancer 1998; 82 : 675-678.
- Elek EM, Grimer RJ, Mangham DC, Davies AM, et al. Malignant chondroblastoma of the os calcis.Sarcoma 1998; 2 : 45-48.
- Ostrowski ML, Johnson ME, Truong LD, Hicks MJ, et al. Malignant chondroblastoma presenting as a recurrent pelvic tumor with DNA aneuploidy and p53 mutation as supportive evidence of malignancy. Skeletal Radiol 1999; 28 : 644-650.
- Viswanathan S, Jambhekar NA, Merchant NH, Puri A, et al. Chondroblastoma of bone – not a “benign disease”: clinic-pathologic observations on sixty cases. Indian J Pathol Microbiol2004; 47 : 198-201.
- Kirchhoff C, Buhman S, Mussack T, Müller-Höcker J, et al. Aggressive scapular chondroblastoma with secondary metastasis - a case report and review of the literature. Eur J Med Res 2006; 11 : 128-134.
- Bacchini P, Inwards C, Bisceglia R, Picci P, Bertoni F. Chondroblastoma-like osteosarcoma. Orthopedics 1999; 22 : 337-339.
- Byatnal AA, Rao AC, Solomon MC, Radhakrishnan RA. A guise of osteosarcoma: chondroblastoma-like. Indian J Dent Res 2013; 24 : 631-634.
- Martin KL, Firestone DE, McGarry SV, Dorfman HD, et al. Chondroblastoma-like osteosarcoma. Pathol Int 2014; 64 : 409-411.
- Aycan OE, Vanel D, Righi A, Arikan Y, et al. Chondroblastoma-like osteosarcoma: a case report and review. Skeletal Radiol 2015; 44 : 869-873.
- Ramos Pascula LR, Casas Ramos P, Arias Martin F, Izquierdo Garcia FM. Aggressive curettage of a chondroblastoma-like osteosarcoma of the proximal end of the tibia. A case report with seven-year follow-up. Skeletal Radiol 2018; 47(6): 853-857.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Jaká je vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2019 Číslo 1-
Všetky články tohto čísla
- Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
- Pneumologická cytodiagnostika – state of the art 2019
- Cytopatologie - State of the Art (2. část)
- Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
- Primární maligní obrovskobuněčný nádor pažní kosti mikroskopicky napodobující chondroblastom – kazuistika
- Noonanovej syndróm z pohľadu fetopatológa
- MONITOR, aneb nemělo by vám uniknout, že...
- Imunohistochemická diagnostika morbus Hirschsprung pomocí kalretininu
- Opavské Muzeum patologie je moje srdeční záležitost
- Jaká je vaše diagnóza?
- Nový systém pro sjednocené hodnocení tenkojehlových aspiračních cytologií slinných žláz: Co nového přinesl „tzv. Milánský systém reportování“ do cytodiagnostiky lézí slinných žláz?
- Jaká je vaše diagnóza? Odpověď: Difúzny leptomeningeálny glioneuronálny tumor (diffuse leptomeningeal glioneuronal tumor)
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
- Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
- Noonanovej syndróm z pohľadu fetopatológa
- Pneumologická cytodiagnostika – state of the art 2019
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



