Cytologické vyšetření mozkomíšního moku
Cytological examination of cerebrospinal fluid
Cytological examination of cerebrospinal fluid (CSF) has some specifics. In the pre-analytical phase, due to collection into a tube without fixation and hypooncotic nature with rapid cell degradation, processing is required within 2-3 hours. In the subsequent analytical phase it is necessary to take into account the quantitative limit of the sample due to regular parallel cytological processing and non-morphological methods. A regular entry step of cytological examination is the quantification of cellularity. Even oligocellular samples may exhibit severe cytological findings.
In the category of inflammatory processes, the cytological diagnosis of purulent meningitis within a few hours has a fundamental influence on prognosis of the disease. Non-purulent inflammations with a broad differential diagnosis are specified not only by cytological images, but also by parallel non-morphological examinations aimed at detecting an infectious agent or autoimmune nature of inflammation.
Neoplastic processes in the intermeningeal space generally require immunocytochemical verification. The minimum amount of CSF for immunocytochemical examinations is 3-5 ml. The requirement for these examinations resulting from the baseline assessment may indicate the need for another sample.
If the appropriate procedures and interpretations are followed in the context of parallel non-morphological examinations, the cytological examination of MM can contribute significantly to the diagnosis of pathological conditions in CSF spaces.
Keywords:
Multiple sclerosis – Meningitis – cytology of the cerebrospinal fluid – intracranial bleeding – meningeal carcinosis
Autori:
Jaroslava Dušková 1,2; Ondřej Sobek 2
Pôsobisko autorov:
Ústav patologie 1. LF UK a VFN
1; Laboratoř pro likvorologii, neuroimunologii, patologii a speciální diagnostiku, Topelex s. r. o., Praha
2
Vyšlo v časopise:
Čes.-slov. Patol., 55, 2019, No. 3, p. 145-157
Kategória:
Přehledový článek
Súhrn
Cytologické vyšetření mozkomíšního moku (MM) má určitá specifika. V preanalytické fázi vzhledem k odběru do zkumavky bez fixace a hypoonkotické povaze s rychlou degradací buněk vzniká nutnost zpracování do 2-3 hodin. V analytické fázi je třeba počítat s kvantitativním limitem při pravidelném paralelním zpracování cytologickém a metodami nemorfologickými. Pravidelným vstupním krokem cytologického vyšetření je zjištění celularity. I oligocytární vzorky mohou vykazovat závažné cytologické nálezy.
V kategorii zánětlivých procesů má cytologická diagnóza hnisavé meningitis stanovená v řádu několika málo hodin zásadní vliv na prognózu onemocnění. Nehnisavé záněty jsou v širší diferenciální diagnóze specifikovány nejen cytologickým obrazem, nýbrž i paralelními nemorfologickými vyšetřeními cílenými na průkaz infekčního agens nebo autoimunní povahy zánětu. Nádorové procesy v intermeningeálním prostoru vyžadují zpravidla imunocytochemickou verifikaci. Minimální množství MM pro imunocytochemická došetření je 3-5 ml, požadavek na tato vyšetření vzniklý základním zhodnocením může znamenat nutnost odběru dalšího vzorku.
Při dodržení odpovídajících postupů a interpretaci v kontextu paralelních nemorfologických vyšetření může cytologické vyšetření MM zásadním způsobem přispět k diagnóze patologických stavů v likvorových prostorech.
Klíčová slova:
cytologie mozkomíšního moku – Meningitis – roztroušená skleróza – intrakraniální krvácení – karcinóza mening
Mozkomíšní mok představuje ve spektru cytologických vyšetření velmi specifický materiál z hlediska přístupu. Propojení morfologických a nemorfologických vyšetření se zde uplatňovalo od počátku. Prosazuje se v poslední době větší měrou i do jiných typů vzorků (výpotky, obsahy pankreatických cyst). To, co činí mozkomíšní mok (MM) výjimečně cenným v diagnostice širokého spektra onemocnění likvorových prostor, resp. mozku a míchy, je relativně obtížnější získávání a skoro vždy přítomné omezení dané aktuálně získaným množstvím MM ve vztahu k potřebám komplexního vyšetření.
Anatomie a fyziologie: MM je čirá bezbarvá tekutina v množství přibližně 150 ml produkovaná v choroidálních plexech (malou měrou i v ependymu a endotelu) postranních mozkových komor o objemu 25ml; z nich se cestou třetí a čtvrté komory mozkové dostává skrz foramen Magendie a foramina Luschkae do subarachnoidálního prostoru - zde se nachází zbylých 125 ml. Je resorbována ve villi duroarachnoidales podél sinus sagitalis superior.
Úloha MM se neomezuje pouze na mechanickou ochranu a nadlehčení mozku. Plní i významné funkce metabolické. Během 24 hodin se obmění čtyřikrát. Normální tlak MM vleže u dospělého se pohybuje mezi 10-15 mm Hg, 3-4 mm Hg u dětí (1).
Historická poznámka
Přítomnost tekutiny v mozku byla sice známa již Hippokratovi a Galénovi, považovali ji však za jev patologický. První skutečně vědecké pojednání o MM napsal mezi roky 1741-1744 švédský důlní inženýr Emanuel Swedenborg, který se rozhodl, inspirován hledáním zdrojů podzemních vod i svou teologickou orientací, nalézt sídlo duše. Po důkladném studiu anatomie mozku u nejlepších anatomů ve Francii, Německu a Itálii napsal vědecké pojednání o MM. Vzhledem k odlišné profesi však pro ně nenalezl důvěru u oslovených nakladatelů. Jeho dílo bylo nalezeno, po právu oceněno a publikováno v překladu až o 150 let později v roce 1887 (2). Další vývoj poznání anatomických detailů nám připomínají jména, která jsou zvěčněna v anatomické terminologii: foramen Magendie (francouzský fyziolog Francois Magendie -1783-1855), foramina Luschkae (německý anatom Hubert von Luschka - 1820-1875).
Lumbální punkce byly prováděny již koncem 19. století (3,4). Ve dvacátém století vznikají několikasetstránkové monografie o MM (5,6).
Vývoj našeho písemnictví o MM je smutně poznamenán osudem profesora české části Karlovy university Leo Taussiga ( 1884-1944), rodáka z Tlustic na Hořovicku. Jeho pozoruhodně komplexní monografie o mozkomíšním moku o 440 stranách psaná česky a publikovaná v Praze již v roce 1926 (7) je ve světových databázích prakticky nevyhledatelná. Taussigův osud se tragicky podobá osudu dr. Oskara Fischera – krátce patologa, později profesora psychiatrie a neurologie německé části pražské lékařské fakulty Karlovy university. Tento autor průlomových prací o nemoci pojmenované později po mnichovském vědci Alzheimerovi zahynul v roce 1942 v Terezíně. Jeho studie o demenci zvané dnes Alzheimerova byly doceněny mnohem později (8). Leo Taussig byl do Terezína deportován v roce 1942, zahynul v roce 1944 v Osvětimi.
Výzkum likvorového prostoru pokračuje; recentně např. studiem signálních kaskád a vztahů mozkomíšního moku a intersticiální tekutiny (1,9).
Jaká je současná úloha likvorové cytologie?
Vzhledem k intimnímu vztahu MM k nervové tkáni a patologickým procesům v ní a poměrně malému objemu (cca 150 ml) odráží MM biochemické, energeticko-metabolické, imunologické a celulární procesy v CNS mnohem citlivěji a specifičtěji než případné vyšetření krve. Je zcela běžnou klinickou situací, kdy při hrubě patologickém likvorovém nálezu nejsou přítomny žádné patologické alterace krevních laboratorních parametrů.
Přehled indikací k vyšetření MM podává schéma č. 1.
Kontraindikací odběru MM je nitrolební hypertenze, kterou vyloučí vyšetření očního pozadí před odběrem, popř. CT / MRI mozku. Před provedením odběru MM je nutné též korigovat případné poruchy krevní srážlivosti (např. závažnou trombocytopenii).
Technika odběru MM a transport
MM se získává rutinně z páteřního kanálu lumbální punkcí v prostoru L3/4, L4/5, popř. L5/S1 v množství zpravidla 10-15 ml u dospělého pacienta. Používá se sterilní odběrový materiál (zkumavky bez protisrážlivých aditiv!). Atraumatická jehla minimalizuje postpunkční únik likvoru odpovědný za likvorovou hypotenzi a související obtíže (bolesti hlavy, závratě, nauzeu). Paralelně (tj. do cca 30 min.) s odběrem MM je odebírána i plná - srážlivá krev (opět 10-15 ml), neboť pro výpočet a interpretaci řady laboratorních likvorologických parametrů je nutné znát jejich paralelní sérové hodnoty.
Méně obvyklou a nyní již rutinně prakticky nepoužívanou metodou odběru MM je subokcipitální punkce cisterna magna prováděná pod os occipitale mediálně přes atlantookcipitální membránu; rizikem je nabodnutí aberantně probíhajících cév (a. vertebralis, a. cerebelli inf. post.) s potenciálně fatálním intrakraniálním krvácením. Odběr MM přímo z mozkových komor (komorová punkce) je již řazen mezi neurochirurgické výkony.
Akreditovaná laboratoř vyšetřující MM má požadavky na odběrové nádobky, množství MM a zejména nutnost rychlého transportu do laboratoře popsánu v požadavcích na preanalytickou fázi vyšetření. MM je výjimečně citlivým materiálem pro svou hypoonkotickou povahu vedoucí k rychlé degradaci buněk a limitovaný objem vzorku, který je po odběru dělen pro vyšetření nemorfologická a vyšetření cytologické; jím se bude převážně zabývat následující text. Zpracování MM pro cytologické vyšetření by mělo být provedeno do dvou, maximálně tří hodin po odběru – je tedy nanejvýš žádoucí, aby byl požadavek klinického pracoviště na zpracování MM do laboratoře hlášen s předstihem s ohledem na skutečnost, že se zpravidla nejedná o pracoviště s nepřetržitou pracovní dobou a hrozí znehodnocení vzorku.
Zpracování MM pro cytologické vyšetření
Kvantitativní hodnocení - stanovení buněčnosti
Provádí se ve Fuchsově-Rosenthalově komůrce o obsahu 3,1 ul.:
K 100 µl MM přidat do zkumavky 10 µl barvicího roztoku.
Složení barvicího roztoku: metylenová modř 0,1g, ledová kyselina octová 2,02 ml, čištěná voda ad 50 ml (vydrží 1 rok)
Postup stanovení počtu jaderných elementů:
- Ve zkumavce smícháme 100 µl MM a 10 µl barvicího roztoku, opatrně protřepeme.
- Pipetou směs opatrně naneseme do Fuchsovy-Rosenthalovy počítací komůrky pod umístěné krycí sklíčko. Vhodná doba k počítání je asi 5 až 10 minut po opatrném promíchání (při vyšší krevní příměsi se doporučuje čas prodloužit, aby došlo k dokonalé hemolýze erytrocytů). Jaderné elementy lze počítat i z nativního materiálu – barvení je doporučováno hlavně při vyšší arteficiální krevní příměsi, nebo při zvýšeném množství nečistot.
Stanovení počtu erytrocytů se provádí z nativního vzorku.
Kvalitativní hodnocení
Cytologický preparát MM je vytvořen nejčastěji cytocentrifugací (s nižším počtem otáček 1100/min.), případně cytosedimentací. Trvalý preparát je pro základní hodnocení standardně barven dle Giemsy, hematoxylinem-eozinem případně polychromem. Laboratoř cytopatologie provede na likvorový vzorek podle klinického zadání a diferenciálně diagnostické rozvahy diagnostika i speciální barvení k identifikaci předpokládaných substrátů fagocytózy (barvení na železo, olejová červeň), barvení bakterioskopická a k vyšetření kvasinek (Gram, Ziehl- Neelsen, PAS) a imunocytochemické průkazy v souladu s diferenciálně diagnostickým zadáním. Omezení představuje výše zmíněná nutnost dělení vzorku pro vyšetření cytologická a nemorfologická. V současné realitě narůstajících nároků na detailní vyšetření je způsob krokového postupu se šetřením vzorku limitovaného rozsahu i ekonomických vstupů nezbytností nejen cytologických, ale i bioptických vyšetření. Praktickým krokem při vyšetření MM je proto zajištění dostatečného počtu rezervních preparátů pro speciální došetření; zejména při diferenciálně diagnostické úvaze o možném nádorovém postižení likvorového prostoru pak rezervních preparátů na adhezivní podložní skla pro imunocytochemické postupy.
Fyziologický nález
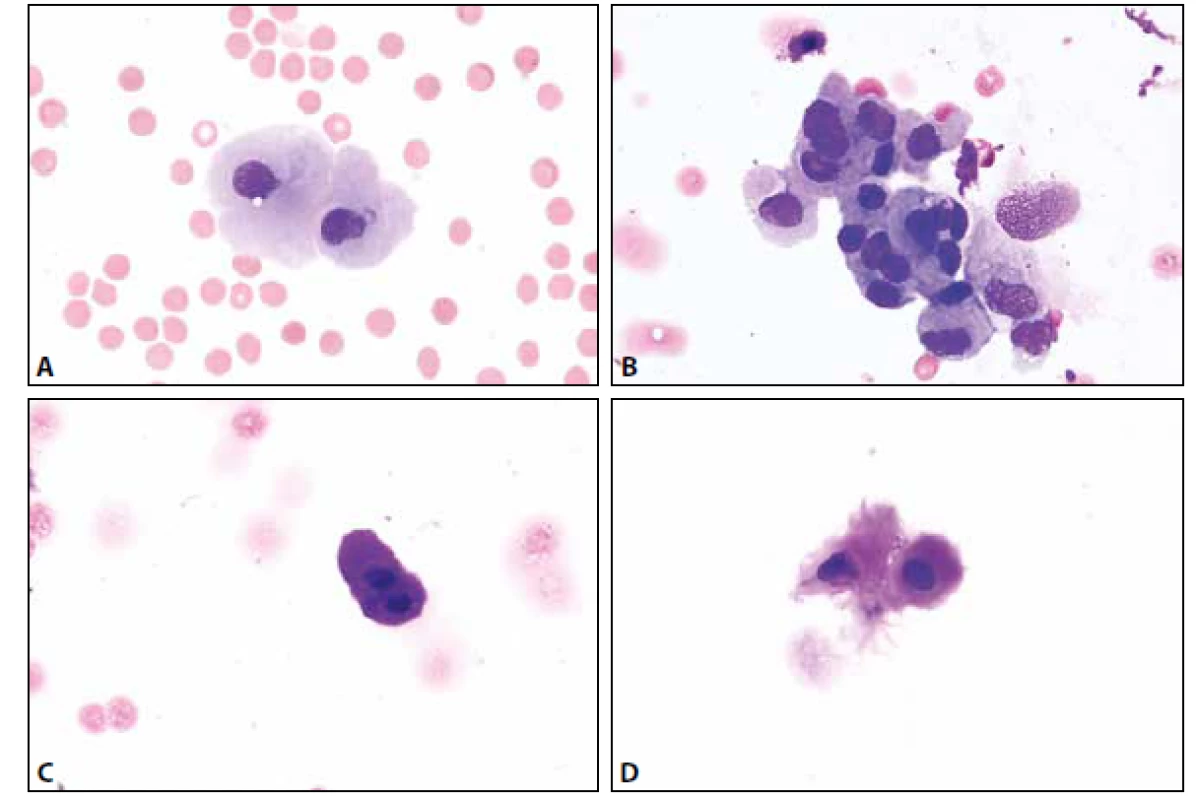
MM je čirá tekutina s malým obsahem buněk – normální celularita nepřesahuje 4 elementy /1 ul. Z tohoto množství 65-80 % tvoří malé lymfocyty, zbytek monocyty. Nejsou přítomny aktivované formy (plasmatické buňky, makrofágy s projevy fagocytární aktivity). Další krevní elementy včetně erytrocytů mohou být přítomny v důsledku traumatické kontaminace při odběru, nebo jsou nálezem patologickým – viz dále. Ve vztahu k přítomným erytrocytům (bez známek úklidové reakce) lze jako kontaminaci interpretovat ojedinělé neutrofilní a eozinofilní granulocyty, buňky ependymální výstelky přítomné někdy v drobných můstky propojených skupinkách. Další možné kontaminanty s ojedinělým výskytem představují metachromatické elementy chrupavky, dlaždicové epitelie, cylindrické buňky – vesměs s pravidelnými cytologickými charakteristikami usnadňujícími jejich správné zařazení (obr. 1 A-D).
Nejčastější patologické stavy a ilustrační kazuistiky
Převážná většina patologických cytologických nálezů v MM vykazuje zvýšený počet buněk – pleocytózu, patologické buněčné složení však může mít i MM oligocytární. Podle převažující buněčné řady klasifikujeme jak pleocytární, tak oligocytární MM dále jako lymfocytární, monocytární, granulocytární nebo tumorózní.
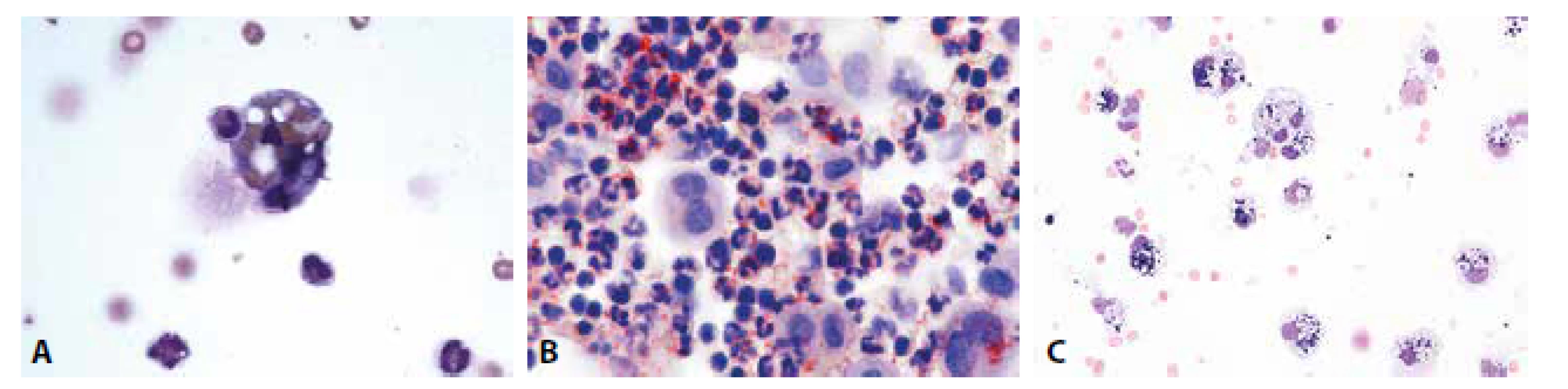
Obrazy úklidové reakce posthemoragické, lipofagické spolu s klasickými metodami jejich ověření i fagocytóza neutrofilních granulocytů v hojení hnisavého zánětu jsou patologům dobře známé z mnoha jiných běžně vyšetřovaných lokalit (obr. 2A-C).
Záněty v likvorovém prostoru vykazují rovněž společné znaky s cytologickými obrazy např. v coelomových dutinách. Určitým specifikem při vyšetření MM je nezbytnost diferenciálně diagnostického pohledu zahrnujícího neuropatologické diagnostické jednotky (např. autoimunní demyelinizace, systémové degenerace, neuroinfekce). Zde představuje zřejmý přínos úzká spolupráce patologa a klinického neurologa pro mezioborovou interpretaci nálezů cytopatologických a výsledků (ilustrační kazuistiky 1-3).
Ilustrační případ 1 – hnisavá meningitida
19letá žena. Náhlý vzniklá nauzea, zvracení, během 12 hodin rozvoj poruchy vědomí.
Příjem materiálu do laboratoře (15:33h)
Základní likvorologický nález: (16:31h)
- jaderné elementy: 9130 /µl , Erytrocyty: 1109 /ul
- granulocytární pleocytóza v cytologickém obraze s přítomností extra- a intracelulárních bakterií (obr. 3A,B)
- výrazně zvýšená permeabilita hematolikvorové bariery (celková bílkovina v MM 6,9 g/l),
- anaerobní metabolismus v likvorovém kompartmentu (glukóza v MM <0,01 mmol/l, laktát MM 11,69 mmol/l, KEB -21004).
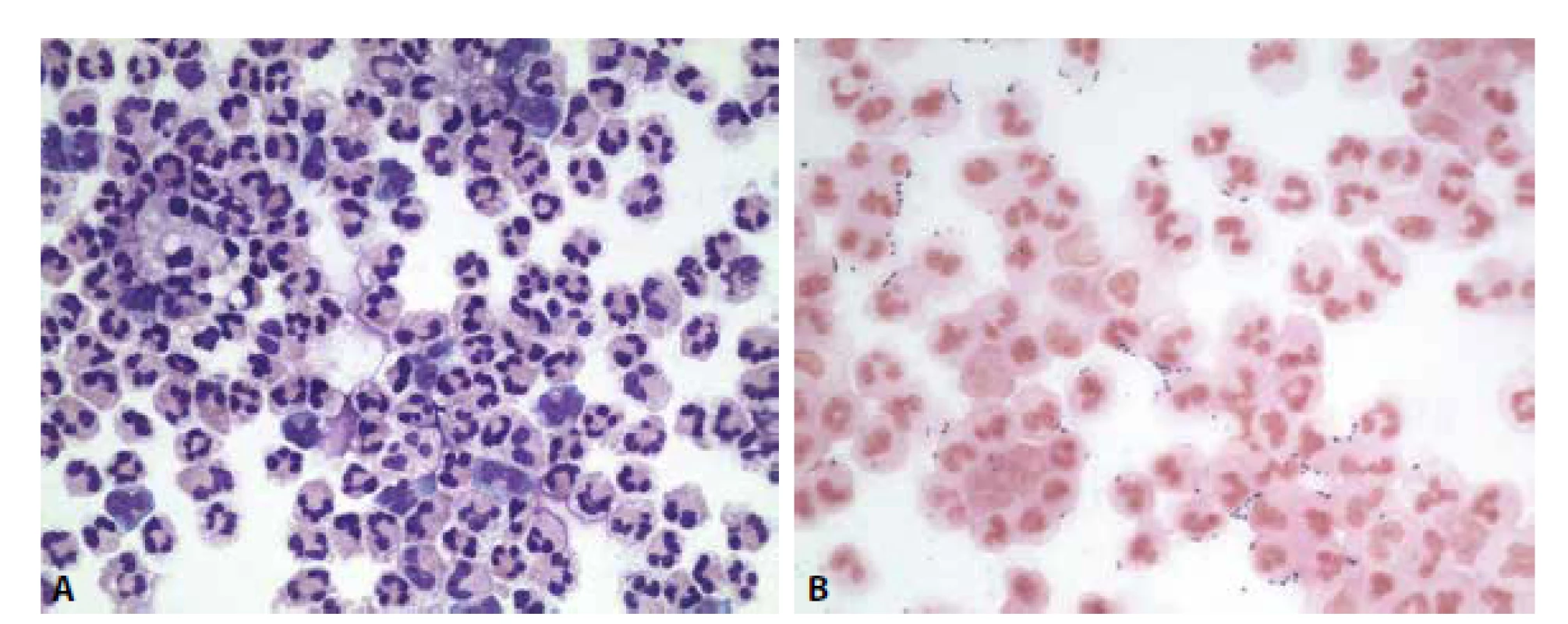
Laboratorní nález zhodnocen jako purulentní bakteriální zánět.
PCR detekována přítomnost Neisseria meningitidis v MM (19:47h)
Definitivní laboratorní závěr: meningokoková neuroinfekce
Komentář: Časové údaje uvedené v této kazuistice dokumentují zásadní význam rychlé diagnózy hnisavé meningitidy pro prognózu onemocnění. Vlastní cytopatologický nález neutrofilní pleocytózy není náročný na rozpoznání. Diagnózu doplní základní a rozšířené laboratorní parametry neuroinfekce (tab. 1A, B).


Hrubě alterované jsou základní biochemické parametry - výrazné zvýšení celkové bílkoviny
v likvoru, dané extrémně zvýšenou permeabilitou hemato-likvorové bariery při tomto typu zánětu. Dochází rovněž k výrazným metabolicko - energetickým změnám s rozvojem anaerobního metabolismu, daným vysokou energetickou náročností zánětlivého procesu – zejména oxidativním vzplanutím neutrofilních granulocytů při fagocytóze bakterií. Jako funkční parametr intenzity fagocytární aktivity slouží výpočet tzv. koeficientu energetické bilance (KEB), vycházející z metabolismu aerobní vs. anaerobní glykolýzy:
Výpočet udává de facto průměrný počet molekµl ATP vyprodukovaných za aktuálních energetických poměrů v likvoru z jedné molekuly glukózy. Jeho hodnoty se za fyziologických okolností pohybují v rozmezí 28 – 38. U bakteriálních neuroinfekcí (a zpravidla i u nádorových infiltrací) jsou jeho hodnoty velmi nízké až záporné a informují nás o oxidačním vzplanutí profesionálních fagocytů (neutrofilní granulocyty, makrofágy). U serózních neuroinfekcí jsou hodnoty KEB snížené podstatně méně či vůbec (10)
K identifikaci bakteriálního původce slouží primárně bakterioskopický nález – Gramovo barvení. Rychlý, citlivý a specifický je průkaz PCR. Následuje kultivace a zjištění citlivosti na antibiotika.
Ilustrační případ 2 – neuroborelióza
Pacient 60 let. Klinická symptomatologie atypického lumboischiadického syndromu, artralgie, subfebrilie. Udává klíště s erytémem v anamnéze. Pro podezření na neuroboreliózu indikována lumbální punkce a laboratorní vyšetření MM.
Cytologický obraz lymfocytární pleocytózy 118/µl s četnými lymfoplazmocyty, zralými plazmatickými buňkami a monocyty. Příměs neutrofilních granulocytů a kontaminantně erytrocytů. (obr. 4 A, B). Výsledky komplementárních vyšetření (biochemického, imunoglobulinů, hematolikvorové bariéry, zánětlivých markerů a zejména identifikace borelií) podávají tabulky č. 2 A-E.
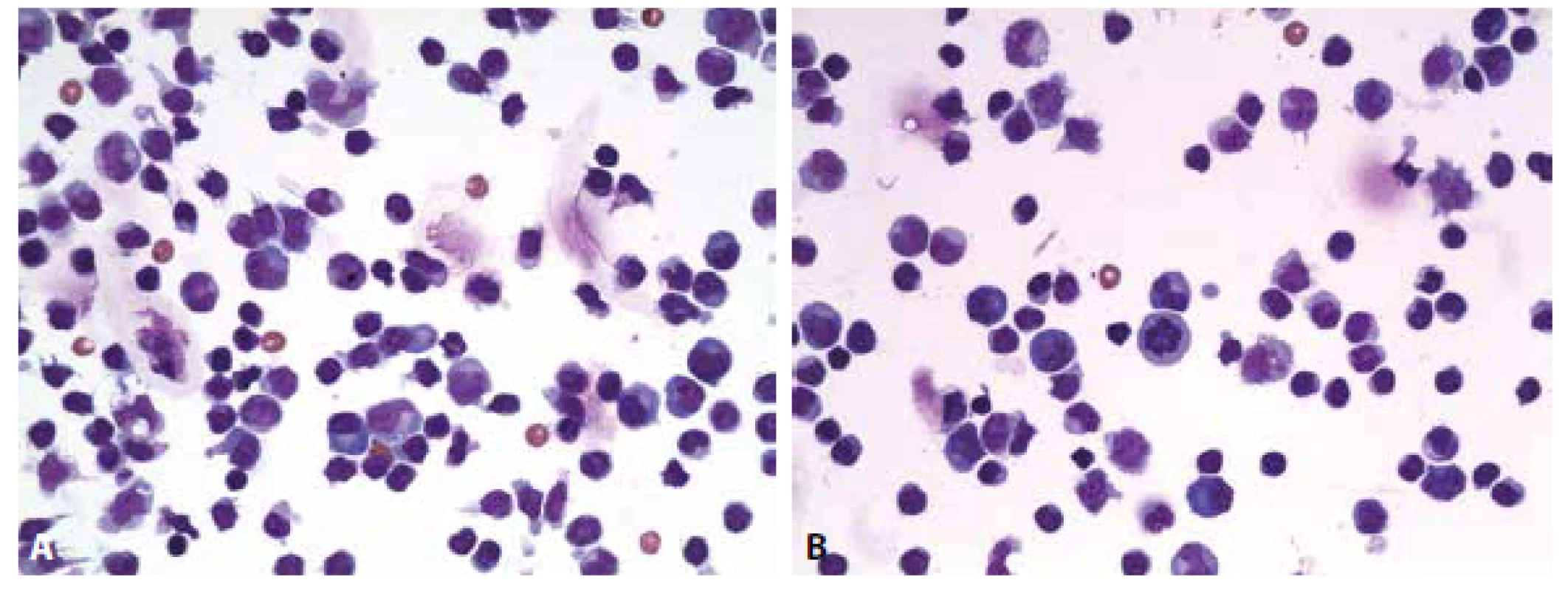


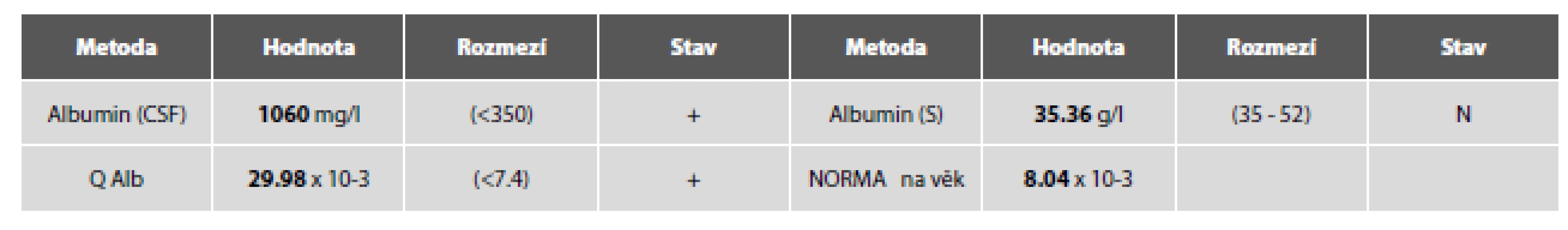


Komentář: Laboratorní nález serózně zánětlivého obrazu v mozkomíšním moku má velmi širokou diferenciální diagnózu. Od tzv. serózních neuroinfekcí způsobených viry a některými bakteriemi (borelie, treponemy a leptospiry) popř. i mykotickými agens (kandida, kryptokok, aspergilus…) po záněty autoimunitní etiologie jako roztroušená skleróza, neuromyelitis optica, autoimunitní paraneoplastické encefalitidy aj.
Neuroborelióza, jako typický představitel serózní bakteriální neuroinfekce vykazuje v likvoru oproti virovým neuroinfekcím výraznější zánětlivé změny - vyšší stupeň celulizace se zralými plazmocyty, energetika s jasně sníženým KEB v pásmu serózního zánětu, elevací humorálních zánětlivých markerů, zvýšenou permeabilitou hematolikvorové bariéry. Za zmínku stojí zejména vysoké hodnoty chemokinu CXCL13, pro floridní zánět boreliové etiologie typické (nikoliv však patognomonické!). V tomto případě byl kromě vysokých titrů specifických protilátek také pozitivní i přímý průkaz boreliové DNA s. l. (11) metodou PCR.
Ilustrační případ 3 – roztroušená mozkomíšní skleróza (RS)
Pacient 28 let. Klinicky levostranná spastická hemiparéza. Na MRI mozku a cervikální páteře mnohočetná vs. demyelinizační ložiska v bílé hmotě. Pro podezření na RS indikována lumbální punkce a laboratorní vyšetření MM.
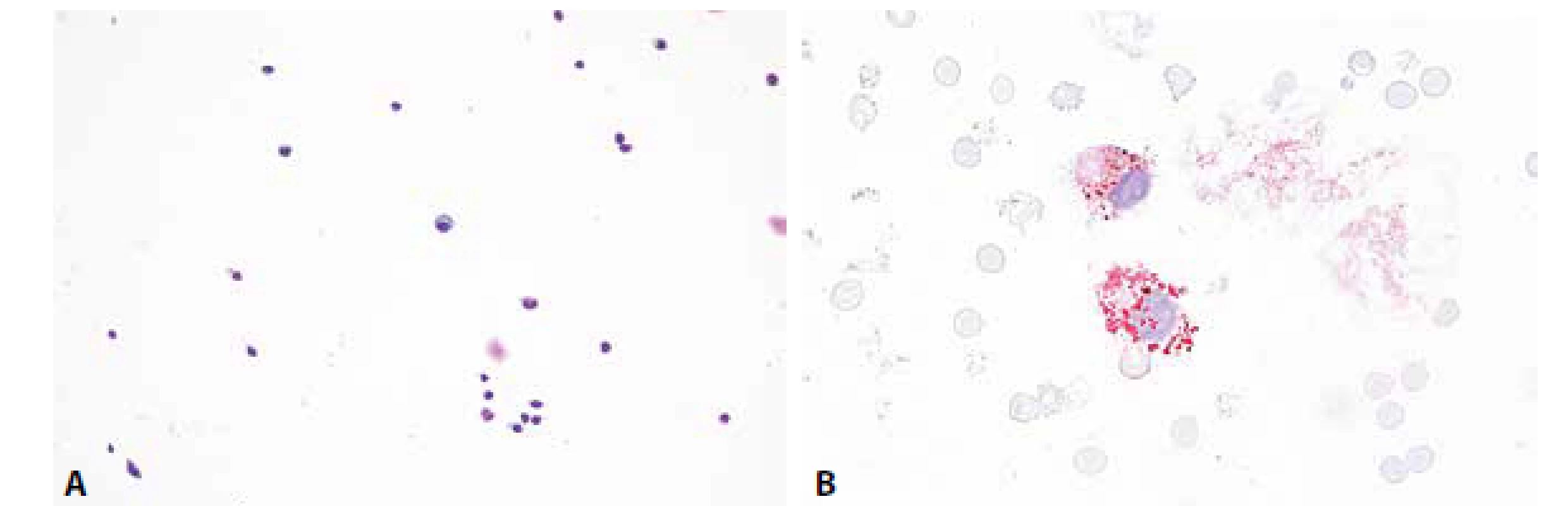
Cytologicky obraz mírné pleocytózy – 8/ul, převaha lymfocytů se známkami aktivace a nečetnými zralými plazmocyty. V monocytární řadě vakuolizace cytoplazmy, v barvení olejovou červení lipofagická úklidová reakce (obr. 5A,B).
Vyšetření laboratorních parametrů paralelně v MM a séru podávají tabulky 3a-g.


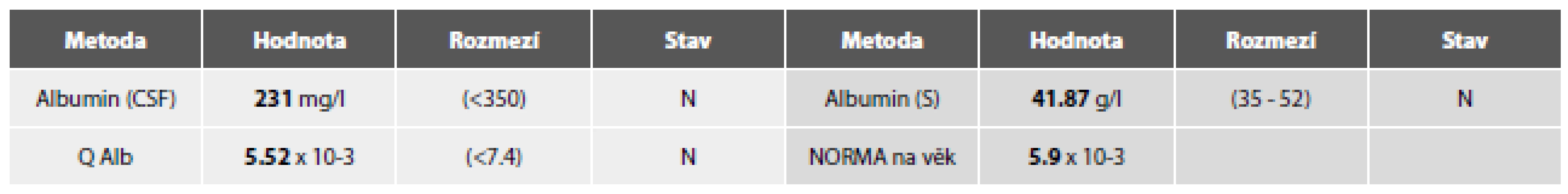




Komentář: RS jakožto autoimunitní demyelinizační onemocnění vykazuje zpravidla v MM spíše diskrétní zánětlivé změny- nízký stupeň zánětlivé celulizace, normální permeabilitu hematolikvorové bariéry. Rovněž lipofagická úklidová reakce bývá v porovnání s destrukčními tkáňovými procesy méně výrazná. Typická je přítomnost oligoklonální intratekální syntézy imunoglobulinů.
Nádorové postižení intermeningeálního prostoru představuje jednoznačně nejnáročnější diagnostickou problematiku cytologie MM. Klinické projevy, které vedou k odběru MM, mohou skrývat široké spektrum diferenciálně diagnostických situací. Jen zdánlivě přímočará je úvaha u recentně léčené malignity s předpokládaným postižením likvorových prostor. Jsou-li v MM zjištěny atypické buňky, jejichž základní morfologie připouští původ v léčeném procesu, lze zúžit panel protilátek pro potvrzující imunocytochemické vyšetření (obr. 6 A, B). Přínosná je v takové situaci znalost imunoprofilu anamnestické malignity.
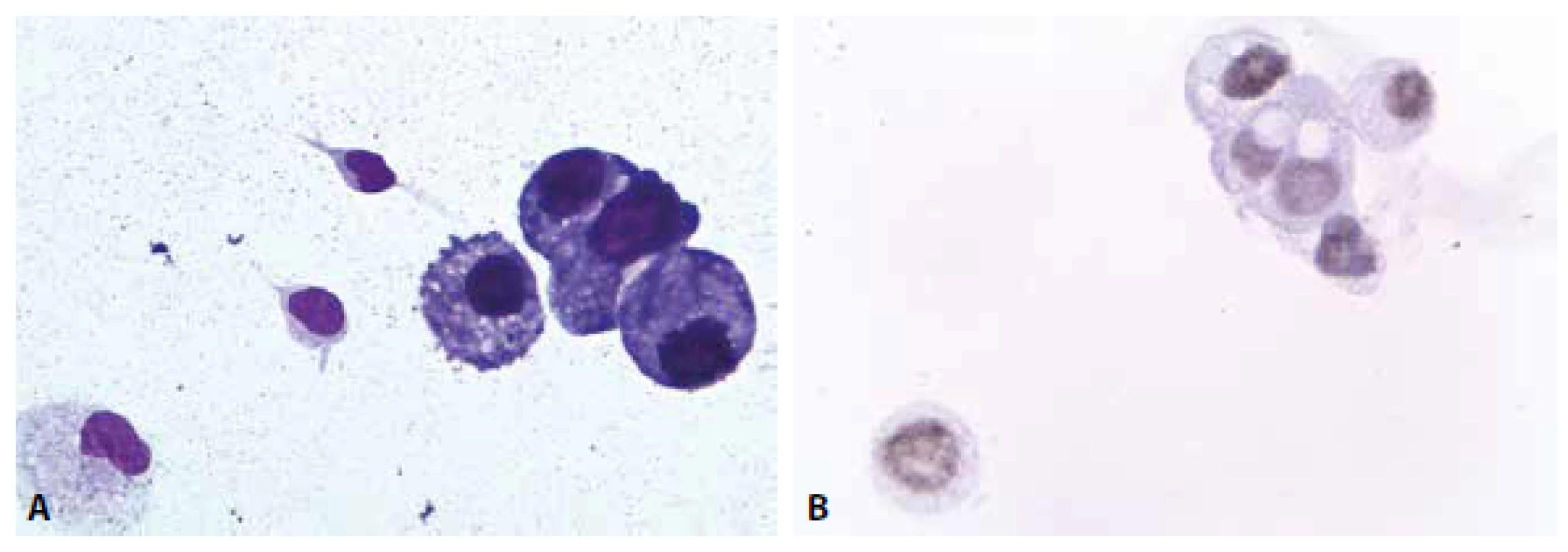
I zde je však třeba počítat s těžkostmi – imunoreaktivita nádorových buněk v MM bývá často oslabená, postupy nejsou zatím standardizované, chybí odpovídající kontrola. Potvrzení nádorové buněčné populace pro následnou léčbu je přitom zásadní, a to i v oligocytárním vzorku. Diferenciální diagnózu patologického nálezu v MM představují stále častěji se vyskytující nádorové duplicity a multiplicity u imunokompromitovaných pacientů. Ze stejné příčiny je nutno uvažovat procesy zánětlivé a opominout nelze v úvaze ani paraneoplastickou encefalitis. Nádorová anamnéza vyšetřovaného pacienta s nálezem atypických buněk v MM může být němá – buď skutečně, je-li neurologické postižení prvním projevem nádorového procesu, nebo zdánlivě, kdy informace o nádorovém procesu v minulosti (někdy před řadou let) úspěšně léčeném není součástí recentní zdravotnické dokumentace.
Ilustrační případ 4 – pozdní diseminace nádorového procesu
Žena 53 let. Bez anamnestických údajů o nádorovém onemocnění. Instabilita a dekompenzace arteriální hypertenze. Cervikokraniální syndrom nejprve bez známek meningeální iritace, později nauzea, zvracení. Porucha okohybných nervů. Zhoršení v průběhu posledních 14 dnů.
Cytologický nález: nádorová pleocytóza. Atypické buňky jednotlivě i ve skupinkách s kohezí.
Imunocytochemicky vykázaly atypické buňky pozitivitu v průkazu cytokeratinů (CKAE), estrogenních receptorů, slabě sporně pozitivní byl průkaz TTF-1. Cytokeratin CK 20 negativní (obr. 7A-D).
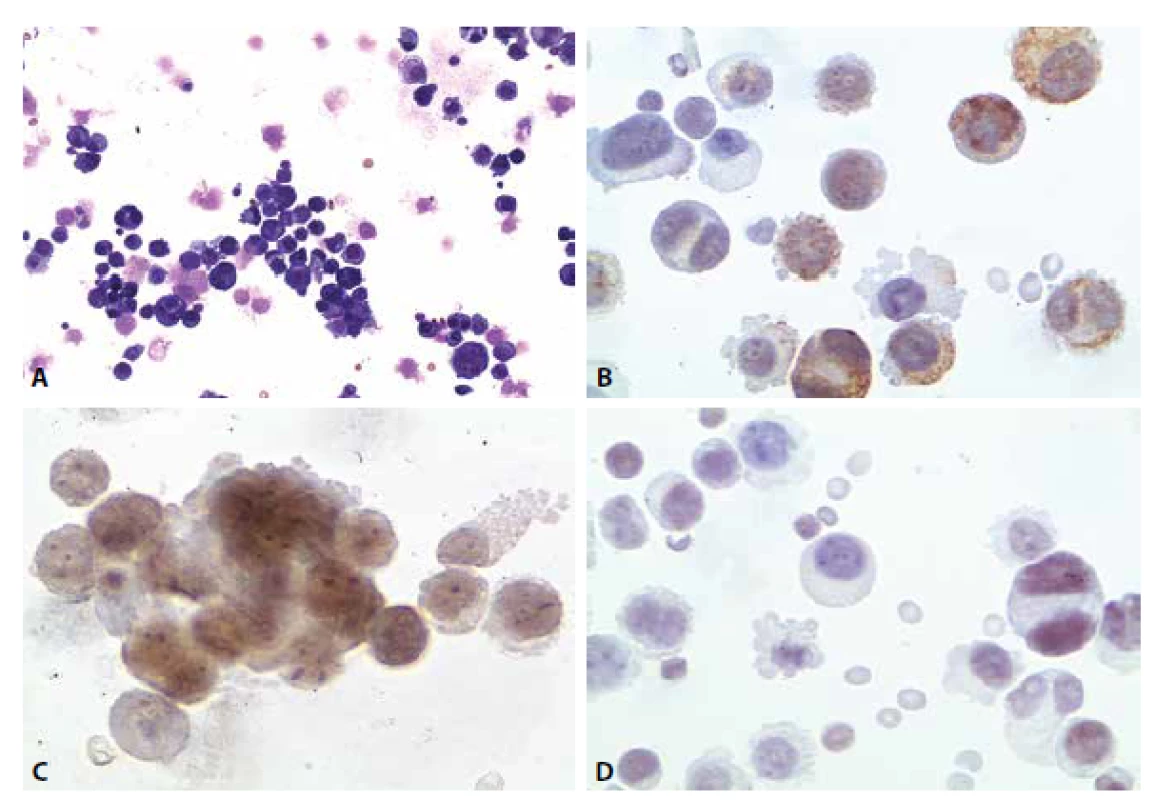
Pacientka zemřela o měsíc později. Pitva prokázala generalizaci duktálního karcinomu s víceletou latencí.
V případě negativní nádorové anamnézy s nálezem suspektních buněk v MM nezbývá než použít rozřazovací imunocytochemický „minipanel“ (tab. č. 4). Nejsou-li k dispozici rezervní preparáty z primárního vzorku MM, je opodstatněné požadovat paralelně s rozšířeným vyšetřováním klinickými zobrazovacími metodami odběr dalšího vzorku navzdory skutečnosti, že lumbální punkce představuje invazivní zákrok (12). V souladu s publikovanými postupy jsme využili i postupy „recyklace“ buněk – opakovaného imunocytochemického testu na negativních preparátech (13).

Vysloveně slabým místem diagnostiky je oligocytární vzorek s účastí suspektních buněk u pacienta s hematologickou malignitou. Poněkud snazší je situace u vzorku s předpokládaně nádorovou pleocytózou.
Ilustrační případ 5
Pacientka 72 let. Difuzní velkobuněčný lymfom ( DLBCL) léčený chemoterapií. Podezření na nádorové postižení CNS.
Cytologický nález: Monomorfní infiltrace dyskohezivními elementy, jejichž morfologie je konsistentní s anamnesticky udaným DLBCL. Imunocytochemicky v nádorových buňkách negativní CD20 a PAX 5, pozitivní CD 79a. CD3 řídce dispersně pozitivní na malých lymfocytech, nádorové buňky negativní (obr. 8A-C). Nález podporuje předpokládané postižení likvorových prostor anamnesticky udaným lymfomem.
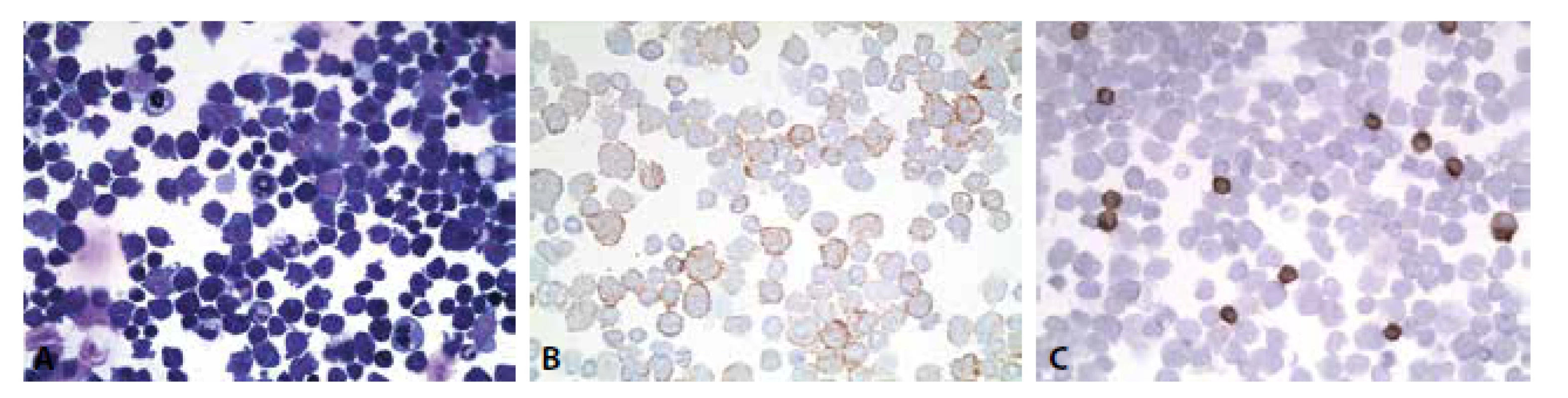
Spolehlivější identifikaci nádorové populace hematologické však představuje průtoková cytometrie (14-17).
Primární mozkové tumory představují pouze přibližně 10% nádorového postižení mening. Vzhledem k jejich hlubokému uložení v tkáni CNS je nález v MM často negativní i při prokázané lézi mozkové.
Podrobnější popis konkrétních diagnostických situací je předmětem obsáhlejších kapitol o cytologii MM (18, 19). Pro denní praxi považujeme za užitečný přehled oligocytárních a pleocytárních likvorových nálezů s diferenciálně diagnostickou interpretací (tab. 5). Pracoviště patologie je schopno poskytnout kvalitní cytopatologický nález. Ten se stává součástí komplexního diagnostického postupu, v němž další části vzorku děleného po odběru jsou předmětem specializovaných nemorfologických vyšetření (20). Základní biochemické a energetické parametry: celková bílkovina, glykorhachie, koncentrace laktátu, spektrofotometrické vyšetření hematogenních pigmentů (oxyhemoglobin, bilirubin) při podezření na intrakraniální krvácení, resp. SAK.


Stanovení kvocientu albuminu (Q Alb) jako parametru permeability hemato-likvorové bariéry:
Věkově vázané referenční hodnoty Qalb (orientační hodnoty).
Od 5 let věku lze použít rovnici pro horní hranici referenčního rozmezí podle Reibera:
(21) Stanovení koncentrace imunoglobulinů (vč. kvantifikace volných lehkých řetězců – FLC kappa a lambda) se stanovením jejich intratekální oligoklonální syntézy (OCB) metodou izoelektrické fokusace (IEF)- minimálně ve třídě IgG; k dispozici jsou i metodiky pro stanovení OCB ve třídách IgM, IgA a volných lehkých řetězců (FLC) kappa a lambda.
Stanovení protilátek proti mikrobiálním patogenním agens nebo stanovení přítomnosti mikrobiální DNA či RNA v likvoru metodou PCR (polymerase chain reaction).
Detekce neurálních autoprotilátek, kam patří např. onkoneurální- paraneoplastické protilátky, protilátky proti NMDA či AMPA receptorům, iontovým kanálům (LGI-1, caspr-2) a proti dalším buněčným strukturám jako AQP-4, MOG, MBP atd.
Stanovení koncentrací markerů zánětu (IL 1,6, 8, 10, CXCL13, proteiny akutní fáze, složky komplementu aj.)
Stanovení markerů tkáňové destrukce (protein S100B, NSE – neuron-specifická enoláza, NF- neurofilamenta atd.).
Vyšetření specifických markerů CNS: např. tau- protein, fosforylovaný tau- protein a beta- amyloid (tzv. likvorový triplet u Alzheimerovy choroby), protein 14-3-3 (rozsáhlá destrukce CNS, Jakob-Creutzfeldtova choroba), beta-trace protein (detekce likvorey).
Formulace cytologického nálezu
Rychlý rozvoj mezinárodně standardizovaných cytologických klasifikací (22-26) se zatím vyšetření MM nedotkl. Je tedy žádoucí postupovat podle obecných pravidel přehlednosti cytologického nálezu:
- Zařazení kvantitativní – oligo/ pleocytární MM spolu s uvedením případných kvalitativních limitů pro hodnocení buněčného složení vzorku
- Popis zastoupených buněk ze základní morfologie
- Výsledky speciálních barvení a případně imunocytochemických průkazů
- Interpretace ve vztahu k poskytnutým anamnestickým datům a zadání na žádance k vyšetření
- Případné doporučení dalšího vyšetřovacího postupu – pokud plyne z cytologického nálezu.
ZÁVĚR
Cytologické vyšetření MM má určitá specifika ve fázi preanalytické (nutnost rychlého zpracování nefixovaného vzorku) i analytické (limitovaný objem vzorku, oligocytární nálezy nádorových buněk). Při dodržení odpovídajících postupů a interpretaci v kontextu paralelních nemorfologických vyšetření může zásadním způsobem přispět k diagnóze patologických stavů v likvorových prostorech, potažmo CNS.
PODĚKOVÁNÍ
Autoři děkují Mgr. Blance Veselé a Miloslavě Milerové za pomoc se zpracováním fotodokumentace.
Podpořeno Univerzitou Karlovou - projekt Progres Q28/LF1 Podpořeno MZ ČR – projekt RVO VFN64165
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Prof. MUDr. Jaroslava Dušková, CSc., FIAC,
Ústav patologie 1. LF UK a VFN
Studničkova 2, 128 00 Praha 2
tel.: +420224968688
fax: +420224911715
e-mail: jaroslava.duskova@lf1.cuni.cz
Zdroje
1. Sakka L, Coll G, Chazal J. Anatomy and physiology of cerebrospinal fluid. Eur Ann Otorhinolaryngol Head Neck Dis 2011; 128(6): 309-316.
2. Hajdu SI. A note from history: Discovery of the cerebrospinal fluid. Ann Clin Lab Sci 2003; 33(3): 334-336.
3. Wynter W. Four cases of tubercular meningitis in which paracentesis of the theca vertebralis was performed for the relief of fluid pressure. Lancet 1891; 137(3531): 981-982.
4. Quincke H. Die Lumbalpunction des Hydrocephalus. Berl klin Wochenschr 1891; 28(929-933; 965-968.
5. Merritt HH, Fremont-Smith F. The cerebrospinal fluid ed.). Philadelphia, London,: W. B. Saunders Company; 1937:
6. Herndon RM, Brumback RA. The cerebrospinal fluid ed.). Boston: Kluwer Academic Publishers; 1989:
7. Taussig L. Liquor cerebrospinalis: Lumbální punkce v diagnostice, prognostice a terapii. Praha: Mladá Generace Lékařů; 1926: 440.
8. Goedert M. Oskar Fischer and the study of dementia. Brain 2009; 132(Pt 4): 1102-1111.
9. Abbott NJ, Pizzo ME, Preston JE, Janigro D, Thorne RG. The role of brain barriers in fluid movement in the cns: Is there a ‘glymphatic’ system? Acta Neuropathol 2018; 135(3): 387-407.
10. Kelbich P, Hejčl A, Selke Krulichová I, Et Al. Coefficient of energy balance, a new parameter for basic investigation of the cerebrospinal fluid. Clin Chem Lab Med 2014; 52(7): 1009-1017.
11. Kybicová K, Lukavská A, Balátová P. Lymeská borrelióza – kultivace Borrelia burgdorferi sensu lato. Zprávy CEM (SZÚ, Praha) 2018; 27(5): 113-115.
12. Duskova J, Sobek O. Assisting the neurologist in diagnosis of cns malignancies - current possibilities and limits of cerebrospinal fluid cytology and immunocytochemistry. Brain Behav 2017; 7(10): e 00805 https://doi.org/00810.01002/brb00803.00805.
13. Chivukula M, Dabbs DJ. Immunocytology. In: Dabbs DJ, eds. Diagnostic immunohistochemistry. Theranostic and genomic applications ed). Philadelphia: Saunders - Elsevier; 2010: 901-922.
14. Chamberlain MC, Glantz M, Groves MD, Wilson WH. Diagnostic tools for neoplastic meningitis: Detecting disease, identifying patient risk, and determining benefit of treatment. Semin Oncol 2009; 36(4 Suppl 2): S35-45.
15. Chandra A, Cross P, Denton K, et al. The BSCC code of practice--exfoliative cytopathology (excluding gynaecological cytopathology). Cytopathology 2009; 20(4): 211-223.
16. Weston CL, Glantz MJ, Connor JR. Detection of cancer cells in the cerebrospinal fluid: Current methods and future directions. Fluids Barriers CNS 2011; 8(1): 14.
17. Zhao H, Ma M, Zhang L, et al. Diagnosis of central nervous system lymphoma via cerebrospinal fluid cytology: A case report. BMC Neurol 2019; 19(1): 90.
18. De May RM. The art and science of cytopathology (1st ed.). Chicago: ASCP Press; 1995: 427-462.
19. Spieler P, Rössle M. Nongynecologic cytopathology (1st ed.). Berlin- Heidelberg: Springer; 2012: 491-513.
20. Sobek O, Adam P, Koudelková M, Štourač P, Mareš J. Algoritmus vyšetření likvoru v návaznosti na doporučení sekce neuroimunologie a likvorologie české neurologické společnosti jep. Cesk Slov Neurol N 2012; 75/108 (2): 159-163.
21. Reiber H. Flow rate of cerebrospinal fluid (csf)- a concept common to normal blood-csf barrier function and to dysfunction in neurological diseases. J Neurol Sci 1994; 122: 189-203.
22. Ali SZ, Cibas ES. The Bethesda system for reporting thyroid cytopathology. Definition, criteria, and explanatory notes. (2nd ed.). Springer; 2018: 236.
23. Nayar R, Wilbur DC. The Bethesda system for reporting cervical cytology (3rd ed.). Cham, Heidelberg, New York, Dordrecht, London: Springer; 2015:
24. Pitman MB, Leyfield LJ. The Papanicolaou society of cytopathology system for reporting pancreaticobiliary cytology (1st ed.). Cham Heidelberg, New York, London: Springer; 2015:
25. Rosenthal DL, Wojcik EM, Kurtycz DFI. The Paris system for reporting urinary cytology (1st ed.). Cham, Heidelberg, New York, Dordrecht, London: Springer 2016:
26. Faquin WC, Rossi ED. The Milan system for reporting salivary gland cytopathology (1st ed.). New York, NY: Springer 2018:
Štítky
Patológia Súdne lekárstvo ToxikológiaČlánok vyšiel v časopise
Česko-slovenská patologie

2019 Číslo 3
Najčítanejšie v tomto čísle
- Cytologické vyšetření mozkomíšního moku
- Neuronálna ceroidná lipofuscinóza s postihnutím srdca
- Adenómy hypofýzy – praktický prístup k histopatologickej diagnostike a zmeny v poslednej WHO klasifikácii z roku 2017
- Metanefrický adenóm. Kazuistika a prehľad literatúry




