Změny angiogeneze a imunitních regulací ve stromálním mikroprostředí kožních melanomů
The changes of angiogenesis and immune regulations in stromal microenvironment of cutaneous melanomas
Tumour microenvironment contributes to growth and metastasis, where angiogenesis and immune alteration suppressing its effectory function belong to main factors. Our study is focused on an analysis of microvascular density (MVD), quantification of FOXP3+ T regulatory lymphocytes (Tregs) and PD-L1 lymphocytes, which are associated with a tumour-cells immune escape mechanism. We examined 95 cutaneous melanomas devided in four groups according to TNM classification - pT1 (35), pT2 (21), pT3 (21), pT4 (18) and 25 melanocytic nevi as a control group. Investigated parameters were detected on paraffin embedded tissues by indirect immunohistochemistry, and evaluated by light microscope in central (C) and at peripheral regions (P) on a 1mm2 „hot spot“ region (the area of the highest density). We found a significant MVD increase correlating with a stage of disease, mostly at the edge of tumours (p=0,0001). Lymphocytic PD-L1 expresion was increased in melanomas of pT3 and pT4 stages, also predominantly at the periphery of lesions (p=0,0001). Numbers of FOXP3 lymphocytes positively correlated with a melanoma stage, where higher values were observed in central areas (p=0,008). Our study documents that stimulation of angiogenesis and induction of an adaptive immune response correlate with a melanoma stage. The most prominent changes are at the tumour periphery confirming heterogeneity of a tumour stroma, which is more prominent in advanced tumours, and which may contribute to higher agresivity of these stages.
Keywords:
Nestin – Angiogenesis – CD90 – FOXP3 – Tregs – PD-L1 – TIL
Autori:
Vladimír Židlík 1,2,3; Magdalena Uvírová 1; Robert Ondruššek 1,2; Jana Dvořáčková 1,2; Svetlana Brychtová 3,4
Pôsobisko autorov:
CGB laboratoř, a. s., Ostrava
1; Ústav patologie FN Ostrava, Ostrava
2; Ústav klinické a molekulární patologie LF UP Olomouc
3; Ústav molekulární a translační medicíny LF UP Olomouc
4
Vyšlo v časopise:
Čes.-slov. Patol., 55, 2019, No. 3, p. 170-175
Kategória:
Původní práce
Súhrn
Nádorové mikroprostředí výrazně ovlivňuje růst a metastazování nádorových buněk, přičemž k hlavním faktorům patří angiogeneze a inhibice imunitního systému potlačující jeho efektorovou funkci. V naší analýze jsme se zaměřili na stanovení mikrovaskulární denzity (MVD), kvantifikaci FOXP3+ T regulačních lymfocytů (Treg) a PD-L1 lymfocytů, které jsou spojovány s mechanismem imunitního úniku nádorových buněk. Vyšetřili jsme 95 kožních melanomů a 25 melanocytárních névů jako kontrolní skupinu. Melanomy byly rozděleny do čtyř skupin dle klasifikace TNM – pT1 (35), pT2 (21), pT3 (21), pT4 (18). Sledované parametry detekovány na parafínových řezech metodou nepřímé imunohistochemie a hodnoceny světelným mikroskopem v centru (C) i na periferii (P) nádoru na ploše 1mm2, v místě největšího zastoupení (tzv. „hot spot“). Zaznamenali jsme signifikantní vzestup MVD korelující se stádiem onemocnění, a to zejména na periferii nádorů (p=0,0001). Exprese PD-L1 na lymfocytech byla zvýšena u melanomů pT3 a pT4 stádií, rovněž zejména na periferii lézí (p=0,0001). Množství FOXP3 lymfocytů pozitivně korelovalo se stádiem onemocnění, přičemž vyšší hodnoty byly zaznamenány v centru nádorů (p=0,008). Naše práce prokazuje, že stimulace angiogeneze a navození adaptivní imunitní odpovědi korelují se stádiem melanomu. K nejvýraznějším změnám dochází na periferii tumoru, což potvrzuje heterogenitu nádorového stromatu, která je výraznější u pokročilejších nádorů a která může přispívat k vyšší agresivitě těchto stádií.
Klíčová slova:
Angiogeneze – Nestin – CD90 – FOXP3 – T regulační lymfocyty – PD-L1 – TIL
Nádorová transformace tkáně je komplexní a vícestupňový proces, ve kterém je podstatně porušen rovnovážný stav organismu a koordinace proliferace buněk (1). Podstatnou a neoddělitelnou součást každého maligního nádoru tvoří nenádorová hostitelská tkáň označovaná jako stroma, které vytváří optimální podmínky pro růst nádorových buněk (2).
Stroma zahrnuje fibroblasty, endotelie, imunitní buňky, solubilní molekuly a extracelulární matrix. Za fyziologických podmínek je stromální mikroprostředí považováno za hlavní faktor udržující tkáňovou homeostázu. Je zdrojem růstových faktorů, živin, kyslíku, dále prostředím pro difúzi tekutin, iontů, hormonů, plynů i odpadních produktů. U maligních nádorů dochází k jeho významným alteracím fenotypu. Mediátory a růstové faktory produkované nádorovým parenchymem indukují stromální změny, které následně recipročně přispívají k malignímu chování nádorových buněk - proliferaci, invazi, angiogenezi, migraci a metastazování (1-3).
V rámci tumoru jsou jednotlivé komponenty stromatu distribuovány nepravidelně, což vede k výrazné heterogenitě mikroprostředí. Nádorová angiogeneze, neboli tvorba nových cév je považována za jeden z hlavních procesů nezbytných pro růst a výživu rychle rostoucí nádorové tkáně, a důležitá je i pro vytváření metastáz (4). Angiogeneze v tumoru je dynamický proces v čase a její hodnocení není proto jednoduché (5,6).
Do určité velikosti tumoru, cca 1-2mm získávají nádorové buňky živiny difúzí z okolních nenádorových cév. Jakmile se velikost nádoru zvyšuje, zvyšují se i nároky na výživu nádorových buněk a nádor začíná tvořit síť svých vlastních cév (3,7,8).
Ve stromálním mikroprostředí tumoru jsou tyto cévy distribuovány nepravidelně a morfologicky jsou heterogenní. Typicky bývají tenkostěnné, s inkompletní bazální membránou s redukovaným množstvím lamininu. Endotelie jsou aktivované a chybí lem pericytů na periferii. Podstatným znakem nádorových cév je jejich vysoká permeabilita. Efektivním markerem pro posouzení těchto novotvořených krevních cév je nestin. Jedná se o protein ze skupiny intermediálních filament, exprimovaný kromě neuroektodermových buněk také v buňkách kmenových, progenitorových a proliferujících (9).
Kromě nestinu byl jako ukazatel aktivovaných krevních endotelií identifikován adhezní glykoprotein CD90 (Thy-1). Jde o N-glykofosfatidylinositol exprimovaný na buněčném povrchu thymocytů, mesenchymových a hemopoetických kmenových buněk, NK buněk a neuronů. CD90 působí buněčnou adhezi leukocytů na aktivované endotelie a jejich extravazaci. Stejným způsobem umožňuje i adhezi nádorových buněk s jejich následnou invazí do tkání (10,11).
Morfologickým standardem pro stanovení míry angiogeneze je hodnocení mikrovaskulární denzity (MVD). Je prokázáno, že zvýšená MVD u primárních tumorů je přímo asociována s metastazováním a horší prognozou (12).
Další důležitou složkou nádorového mikroprostředí jsou buňky imunitního systému, z nichž k nejdůležitějším patří lymfocyty prostupující nádor a na jeho hranici sousedící se zdravou tkání označované jako tumor infiltrující lymfocyty (TIL) (13). Počty TIL se u jednotlivých tumorů výrazně liší. U pacientů s melanomy s vyšší lymfocytární koncentrací je prokázáno až trojnásobně delší pětileté přežití, než u melanomů s absencí TIL. Složení lymfocytárního infiltrátu však není homogenní, ale je tvořeno různými podtypy lymfocytů (14).
Za hlavní součást efektivní protinádorové buněčné imunitní odpovědi jsou považovány zejména cytotoxické CD8+ T lymfocyty, jejichž aktivací je navozena specifická destrukce nádorových buněk. Důležitou roli v generování a udržování imunitní reakce proti nádorovým buňkám však mají i CD4+ T lymfocyty. Tyto lymfocyty působením cytokinů zvyšují cytotoxický efekt CD8 T lymfocytů (15). Ukazuje se však, že tyto buňky mohou mít v imunitě nádorů i protichůdnou, imunosupresivní roli. Jedná se zejména o T regulační lymfocyty (Treg), které představují přibližně 5-10% CD4+ buněk (16,13). Treg jsou populací T lymfocytů s vysokou hladinou exprese proteinu CD25. Druhým, neméně důležitým, proteinem tvořeným na povrchu regulačních T lymfocytů byl transkripční faktor FOXP3. Jeho exprese představuje klíčový mechanismus řízení diferenciace a imunosupresivních funkcí CD4+CD25+ T regulačních lymfocytů a mutace nebo delece genu kódujícího FOXP3 způsobují těžké autoimunitní choroby (17).
Hlavní funkcí regulačních buněk je navození tolerance imunitního systému v reakci na autoantigeny i alloantigeny. Jak na myších modelech, tak u lidí bylo prokázáno, že vyšší množství těchto buněk snižuje riziko vzniku autoimunitních chorob (18,19). Díky této vlastnosti mají však tyto buňky zároveň negativní vliv na snižování obranyschopnosti u nádorových onemocnění. Vysoké počty Treg byly zjištěny přímo v tumorech nebo krvi pacientů s nádory asociovanými se špatnou prognózou. Zvýšená exprese FOXP3 u T regulačních lymfocytů byla například prokázána v adenokarcinomu pankreatu, žaludku, jater a maligním melanomu, avšak FOXP3 může být exprimován též v samotných nádorových buňkách a tato exprese nemusí korelovat s expresí na lymfocytech (20,21). V dalších studiích na zvířecích modelech se ukázalo, že blokování Treg aktivity mělo pozitivní vliv na regresi tumoru a celkové přežití (22). Mechanismus imunosuprese je závislý na vzájemném buněčném kontaktu Tregů s jinými buňkami, po kterém pak granzym-dependentní nebo perforin-dependentní cestou dojde k inhibici proliferace T buněk pomocí cytokinů IL-10 a TGFβ (23,24). Působení TGFβ má za následek jednak zvýšení senzitivity CD4 a CD8 buněk pro účinek Treg, dále u těchto regulačních lymfocytů zvyšuje expresi FOXP3 (25)
Absolutní počty Tregů nelze považovat za nezávislý prognostický marker onemocnění, jak uváději některé studie, proto byl počítán poměr CD3+/FOXP3+.
Slibným terapeutickým cílem se jeví blokáda imunitních kontrolních bodů důležitých pro udržení imunotolerance. Jedním z důležitých proteinů je protein programované buněčné smrti (PD-1). PD-1 je transmembránový glykoprotein typu 1 patřící do velké imunoglobulinové rodiny proteinů CD28/B7. Na vnitřní straně membrány se nachází intracelulární doména receptoru se dvěma konzervovanými tyrozinovými motivy – ITIM (immunoreceptor tyrosin-based inhibitory motif) neboli inhibiční motiv receptoru imunitního systému založený na tyrozinu – a ITSM (immunoreceptor tyrosin-based switch motif) neboli „přepínatelný“ motiv receptoru imunitního systému založený na tyrozinu. Inhibiční funkce PD-1 je vázána především na ITSM motiv a jeho význam byl potvrzen nalezením mutace, která potlačila inhibiční schopnost PD-1. Naopak mutace v sekvenci ITIM funkci PD-1 neovlivnila a předpokládá se, že ITIM je pravděpodobně zapojen do jiných regulačních dějů nesouvisejících s aktivací T lymfocytů. PD-1 je exprimován především na aktivovaných T a B lymfocytech, monocytech, NK buňkách, dendritických buňkách a na tumor infiltrujících lymfocytech. K expresi PD-1 může docházet taky u Tregů a to na membráně i v cytoplazmě. Za klidových podmínek byla pozorována jen minimální exprese PD-1. Pravděpodobně nejdůležitější funkci zaujímá tento protein jako inhibiční receptor na T lymfocytech (26). PD-1 se váže na dva různé ligandy, PD-L1 a PD-L2, jejichž exprese se výrazně liší. PD-L1 je exprimován na relativně širokém spektru buněk, od klidových i aktivovaných T buněk (včetně Tregů) přes B buňky, dendritické buňky až po nehematopoetické buňky (např. endotelové či epitelové buňky), což ukazuje na důležitou roli PD-L1 v regulaci periferní tolerance a v prevenci autoimunitních onemocnění. Oproti tomu PD-L2 exprese je spíše omezená na hematopoetické buňky (hlavně dendritické buňky a makrofágy). Prozánětlivé signály včetně INF-γ indukují expresi PD-L1 a ukazuje se, že celá řada nádorů exprimuje PD-L1 molekulu jako „ochranu“ před protinádorovou odpovědí T buněk. Po vazbě PD-1 na své ligandy tedy dochází k „vypnutí“ imunitní odpovědi, ke snížené produkci cytokinů a inhibici proliferace. Zajímavé je však zjištění, že blokáda PD-1 monoklonálními protilátkami nejen zvrátí anergii na úrovni T buněk, ale je naopak schopna i vyvolat zesílenou T buněčnou odpověď. Na základě preklinických a klinických studií je blokáda těchto interakcí vhodným terapeutickým cílem řady tumorů (27-29).
V naší práci jsme se zaměřili na sledování mikrovaskulární denzity aktivovaných krevních cév a změn tumor infiltrujících lymfocytů (TIL), se zaměřením na jejich imunosupresivní funkce. Vzhledem k výše zmiňované heterogenitě stromálního prostředí v rámci nádorů, byly změny hodnoceny jak uvnitř lézí, tak na jejich hranici s okolní nenádorovou tkání.
MATERIÁL A METODIKA
V našem souboru jsme vyšetřili 95 kožních superficiálních a nodulárních melanomů rozdělených podle TNM klasifikace do čtyř skupin – pT1 (35), pT2 (21), pT3 (21) a pT4 (18) a 25 pigmentových névů. Všechny vyšetřované vzorky byly standardně fixované formalinem, zality do parafinových bločků a po nakrájení na 5um silné řezy následně barveny metodou nepřímé imunohistochemie v imunoautomatu (VENTANA BENCHMARK XT). Jako primární protilátku jsme použili monoklonální králičí anti-FOXP3 protilátku (Novus Biologicals, clone SP97, NBP2-12498, ředění 1:150, čas inkubace 20 min.), polyklonální králičí protilátku anti-CD3 (DakoCytomation, kód 1580, ředění 1:50, čas inkubace 32 min.), monoklonální králičí protilátku anti-PD-L1 antibody (Abcam, klon 28-8, ab205921, ředění 1:50, čas inkubace 16 min.), monoklonální protilátku anti-Nestin (Millipore, klon 10C2, ředění 1:75, čas inkubace 20 min.) a monoklonální králičí protilátku anti-CD90 (Abcam, klon EPR3133, ředění 1:100, čas inkubace 30 min.). Pro detekci protilátek Nestin, CD90, FOXP3 a CD3 byl použit detekční kit VENTANA (VENTANA iVIEW™ DAB Detection Kit, Katalogové číslo 760-091), pro protilátku PD-L1 detekční kit VENTANA (OptiView DAB IHC Detection Kit, Ventana Medical System, Katalogové číslo 760-700). Exprese všech sledovaných parametrů pak byla vyhodnocována světelným mikroskopem na jednotce plochy 1mm2 v místech největšího zastoupení (tzv. „hot spot“). A to jednak v centru léze (C) a dále i na její periferii (P). Za periferii byl považován invazivní okraj nádoru celkové šíře 1 mm, zahrnující jak periferní oblast nádoru, tak přilehlé, těsně naléhající stroma (30). V naší studii jsme také vyhodnotili poměr lymfocytů CD3+/FOXP3+ a CD3+/PD-L1+. Kvantifikace PD-L1 byla vyhodnocena pomocí tzv. H-skore složeného z intenzity a denzity barvení. Denzita je označená jako kategorie A a bodována 0-3 (0=0-4%, 1=5-24%, 2=25-49%, 3=50-100%). Intenzita (negativní, nízká, střední, silná) označená jako skupina B bodována taktéž 0-3 body. Bodové hodnocení obou skupin bylo navzájem vynásobeno (AxB) do výsledného H-skore (0 = negativní, 1-2 = nízká exprese, 3-5 = střední exprese, 6-9 = silná exprese) (31).
Výsledky byly statisticky vyhodnoceny pomocí Kruskal–Wallisova testování s Bonferroniho korekcí, p-hodnoty 0,05 nebo nižší byly považovány za statisticky signifikantní.
VÝSLEDKY
Souhrn hodnot sledovaných parametrů je uveden v tab.1.
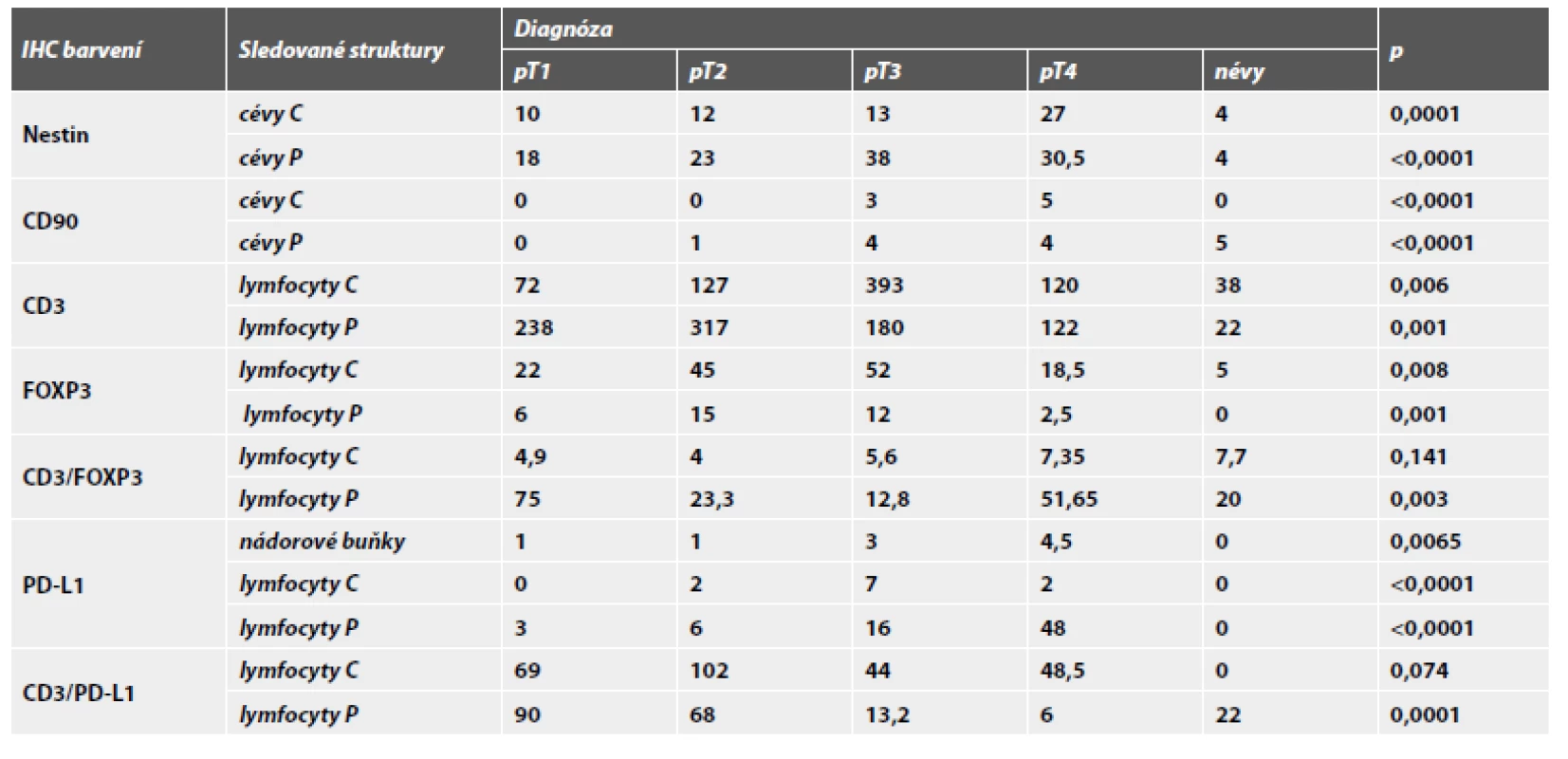
Hodnocení mikrovaskulární denzity protilátkami anti-Nestin a anti-CD90
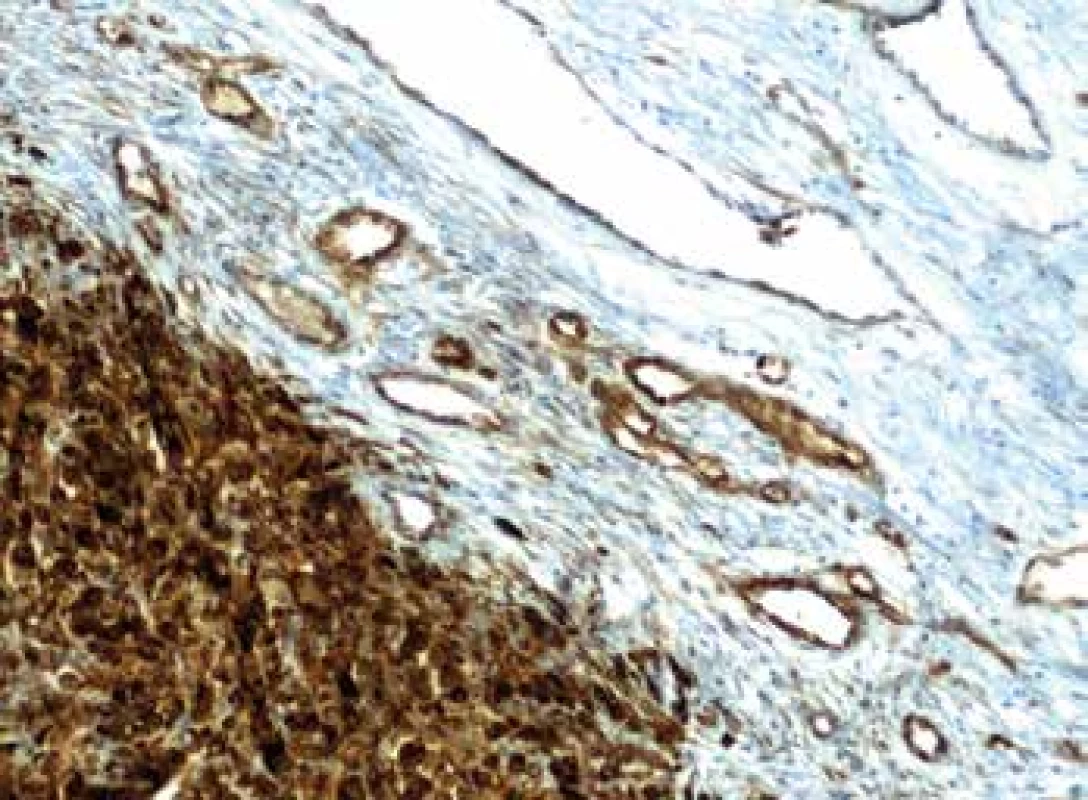
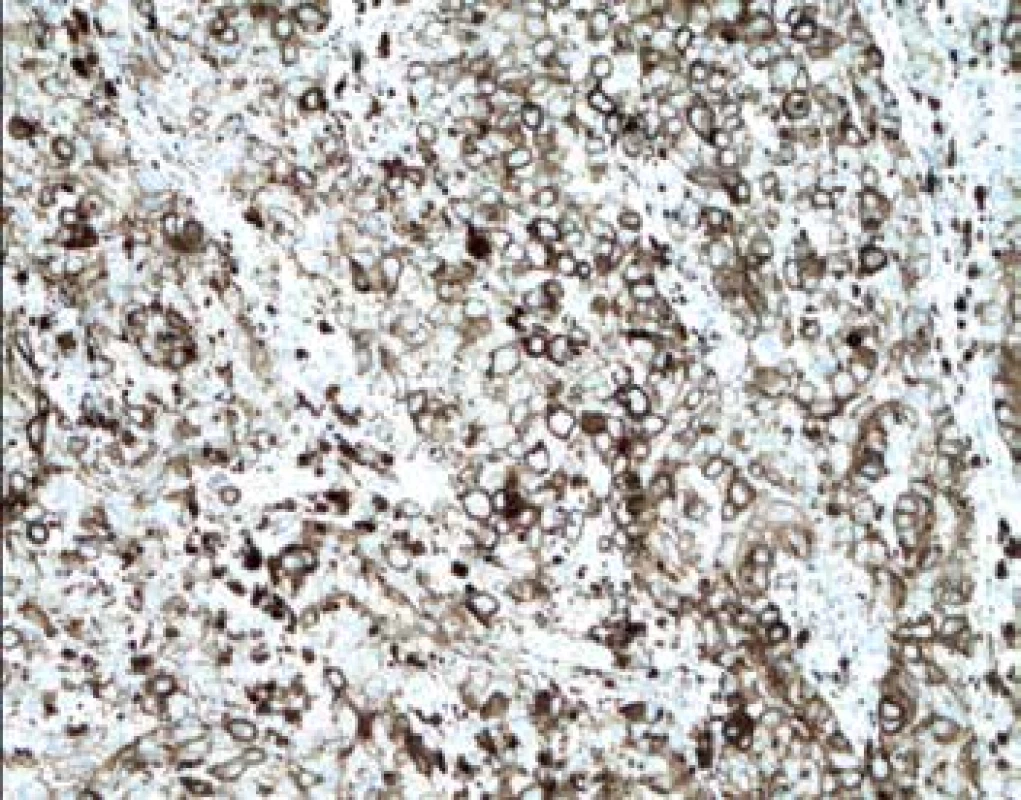
MVD při hodnocení exprese Nestinu (obr. 1) v zastoupení cévních lumin na jednotkové ploše byla velmi nízká v melanocytárních névech s mediánem 4 na 1mm2, shodně v centru i na periferii léze. Její signifikantní nárůst zaznamenán zvláště na periferii melanomů, s maximem u pokročilých stadií, a je tak patrná pozitivní korelace mezi MVD a hloubkou invaze (p=0,0001). U protilátky CD90 (obr. 2) nebyly detekovány žádné pozitivní cévy v melanocytárních névech. Zcela ojediněle byla pozorována u nižších stádií melanomu (pT1, pT2). Její nárůst bez rozdílu mezi centrem a periferií (p=0,0001) je patrný u melanomů stádií pT3 a pT4.
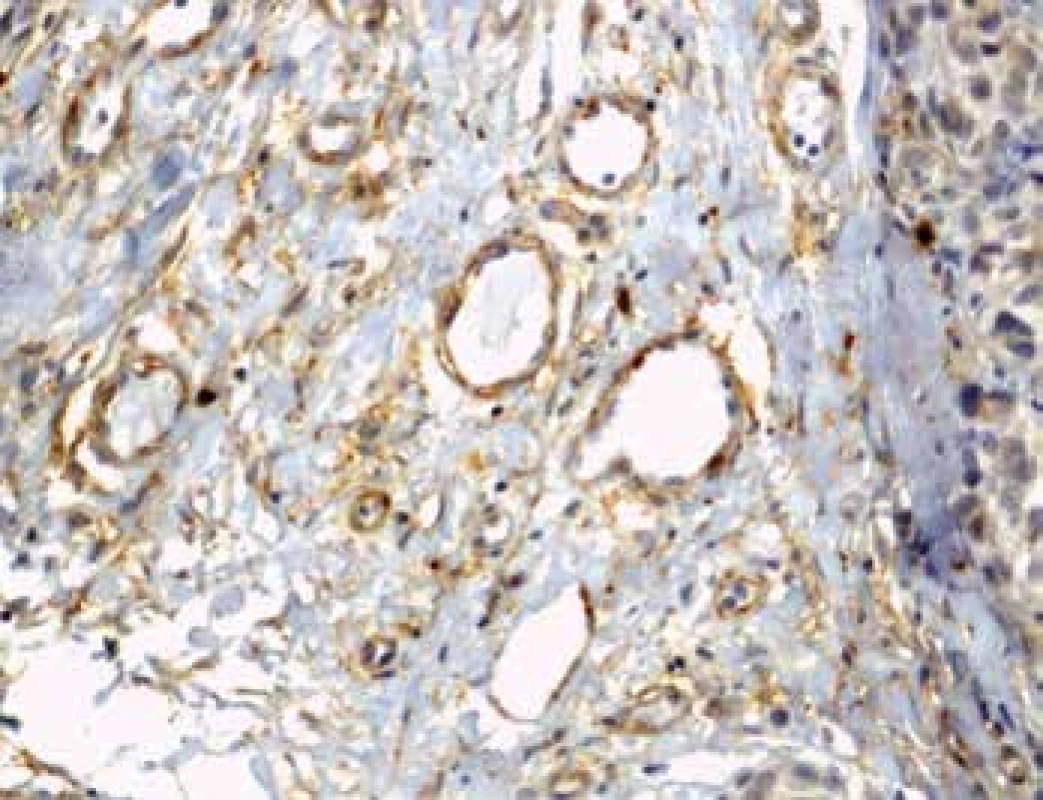
Hodnocení tumor infiltrujících lymfocytů
U množství CD3+ T lymfocytů je patrný nárůst mezi skupinami pT1-pT3 s náhlým poklesem u skupiny pT4 a to jak na periferii (p=0,001) tak v centru (p=0,006). Podobné změny v mediánu exprese jsme zaznamenali také u Tregů (obr. 3) s významým nárůstem u skupin pT1-pT3 zvláště v centru léze (p=0,008) s jejich výrazným poklesem ve skupině pT4. Zajímavým zjištěním je snižování poměru CD3+/FOXP3+Treg, které je signifikantní u skupin pT1-pT3 obvzláště na jejich periferii (p=0,003).
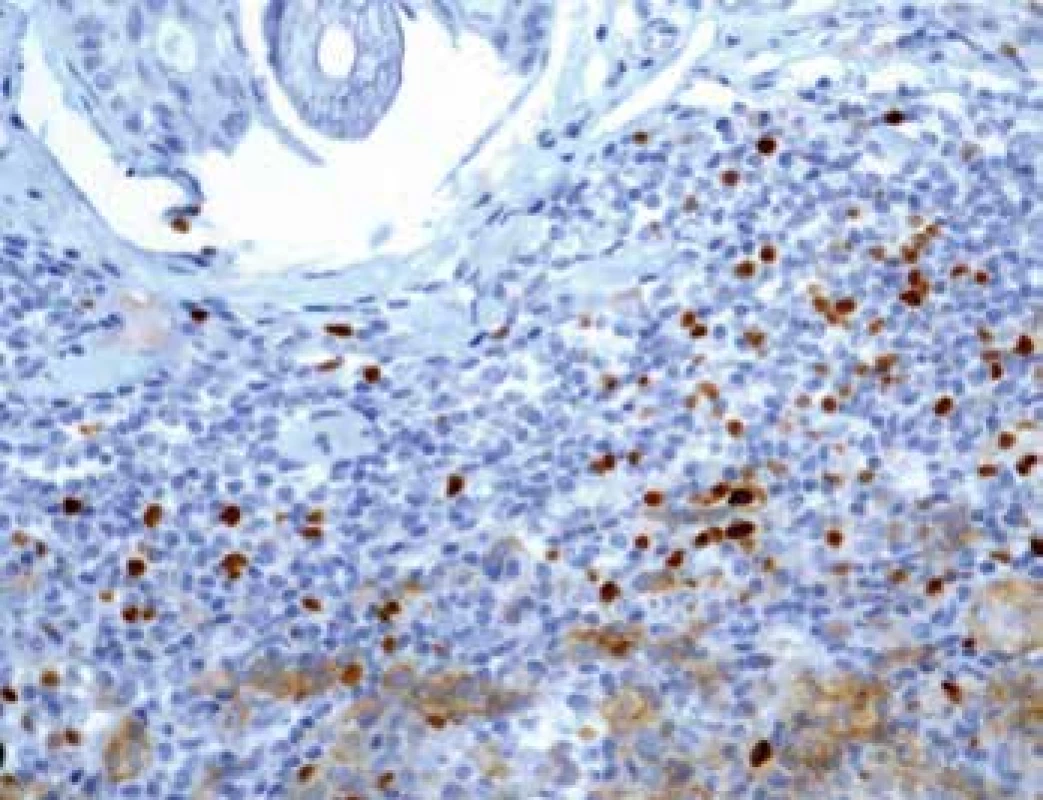
Stanovení exprese PD-L1
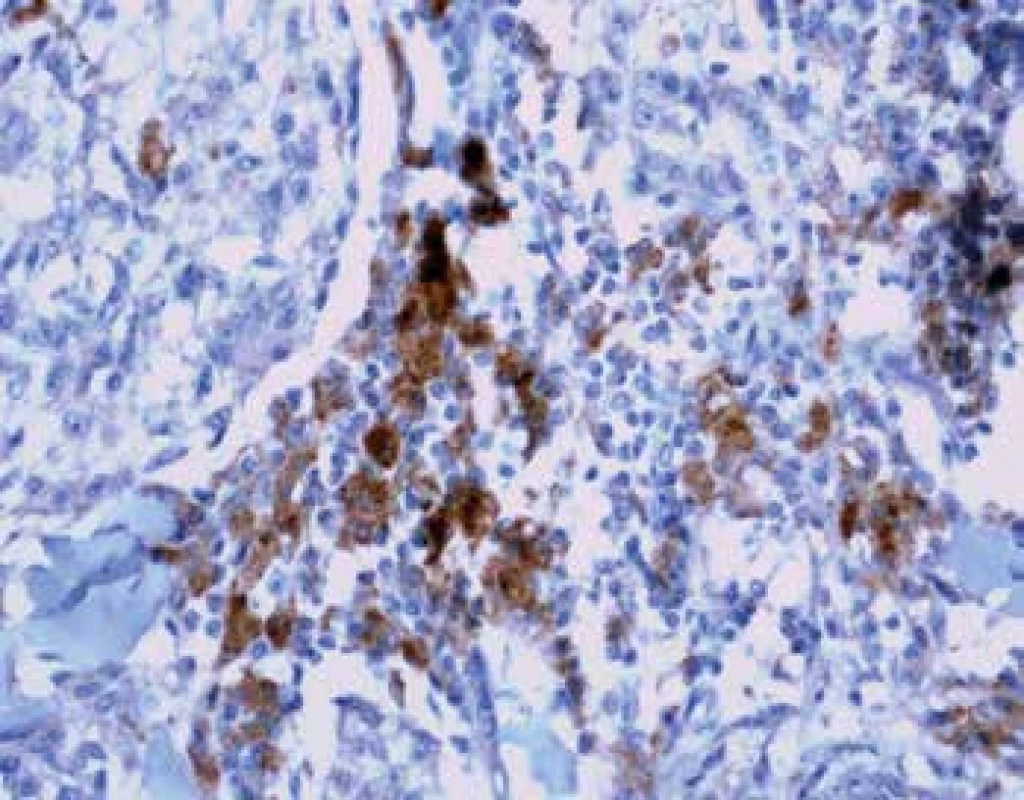
Exprese tohoto proteinu byla sledována jednak u nádorových buněk (obr. 4) a také u TIL (obr. 5). U melanomů nižších stádií pT1 a pT2 byla exprese nízká. Nápadné bylo zvýšení exprese u pokročilých stádií pT3 a pT4 (p=0,0065). Podobné rozdíly exprese jsme zaznamenali též u lymfocytů zvláště na periferii léze se signifikantním nárůstem u skupin pT3 a pT4 (p<0,0001). U névů nebyla exprese PD-L1 zaznamenána. Poměr CD3+/PD-L1+ ukazuje postupný pokles na periferii tumoru mezi skupinami pT1-pT4 (p=0,0001).
DISKUZE
Maligní nádory si vytvářejí vlastní „aktivní“ stroma, které podstatným způsobem přispívá k progresi tumoru prostřednictvím řady intercelulárních interakcí, produkcí solubilních faktorů, remodelací extracelulární matrix a neoangiogenezí (32). Dochází k alteraci imunologického dozoru a změně buněčného metabolismu, což vede k replikačnímu stresu, genomové a chromozomové nestabilitě. Bylo prokázáno, že nádorové prostředí významně přispívá k buněčné plasticitě a heterogenitě nejen mezi jednotlivými tumory, ale i v rámci tumoru jednoho. K jednomu z klíčových faktorů ovlivňujícího prognózu je nádorová neoangiogeneze. Množství cév převážně u high grade nádorů je důležitým prognostickým faktorem, který koreluje s celkovým přežitím např. u nádorů mléčné žlázy, ovaria, jícnu, žaludku, melanomu a nemalobuněčných plicních tumorů. Na druhé straně tyto nádory s bohatou vaskularizací jsou dobrými kandidáty pro antiangiogenní terapii (9).
Angiogenezi jsme sledovali pomocí MVD. Běžně užívanými protilátkami pro její stanovení jsou CD34 a CD31. Bylo však prokázáno, že volba endoteliálního markeru může ovlivnit závěry, protože různé markery mají odlišnou specificitu (5). V naší studii jsme použili protilátky nestin a adhezní protein CD90 (Thy-1), které jsou typicky exprimovány u aktivovaných endotelií krevních cév. U obou proteinů jsme zaznamenali signifikantní zvýšení MVD v přímé korelaci se stádiem onemocnění. Denzita vaskulární sítě byla vyšší na periferii tumorů, oproti centrálním oblastem, což potvrzuje heterogenitu stromálního mikroprostředí, která navíc koreluje se stádiem onemocnění. Heterogenní distribuce krevních cév má za následek rozdílnou koncentraci kyslíku a živin v různých oblastech tumoru. V souvislosti s poklesem kyslíkového a nutričního gradientu dochází k vytvoření selektivní subpopulace buněk se zpomaleným buněčným cyklem, lokalizovaných převážně v centru tumorů, ve větší vzdálenosti od cév. Tyto buňky jsou vysoce agresivní, nabývají chování kmenových buněk a mají zvýšený metastatický potenciál. U melanomu se předpokládá, že tyto buňky představují pouze 0,5-5% celé nádorové populace (33,34). Tyto klidové buňky vykazují i vysokou míru lékové rezistence, jsou rezistentní na inhibitory MAPK, které typicky působí na populaci s vysokým proliferačním fenotypem. Bylo prokázáno, že jedním z mechanismů odpovědným za změny fenotypu jsou změny hladin faktoru MITF (microphtalmia-associated transcription factor), jehož vysoké hodnoty (MITFhigh) u proliferujících nádorových buněk se vlivem hypoxie snižují a dochází k přepnutí fenotypu na buňky (MITFlow) se zpomaleným buněčným cyklem (32,33).
V této souvislosti je nutné zmínit poměrně nový fenomén, kterým jsou tzv. vaskulogenní mimikry. Za vhodných podmínek jsou některé typy agresivních tumorů schopné tvořit pseudovaskulární kanály lemované nádorovými buňkami, bez přítomnosti buněk endotelových. Tyto pseudovaskulární struktury bývají lokalizovány zejména v centrálních oblastech nádoru, což může umožnit výživu a možnost migrace buněk i v místech s nižší MVD (12,35).
Zajímavým zjištěním je řádově nižší exprese CD90 v endotelu cév ve srovnání s nestinem. Protein byl detekován až v cévách melanomů stádií pT3 a pT4. Prokázali jsme takto, že během progrese nádoru aktivované endotelie mohou měnit svůj fenotyp. CD90 se u melanomu vyskytuje v místech s vyšší tvorbou VEGF a TNF-α, které zřejmě působí jako jeho induktory (11). Interakcí s integrinem αvβ3 exprimovaným na povrchu nádorových buněk melanomu usnadní jejich metastazování. Potvrzujeme tak model fenotypové plasticity stromálního mikroprostředí, která koreluje se stádiem melanomu a která nezávisle na MVD přispívá k progresi.
Neméně důležitou součást stromálního mikroprostředí tvoří buňky imunitního systému, přičemž v naší práci jsme se zaměřili na T lymfocyty. Jejich kvantitativní hodnocení v tumoru i jeho okolí se pokládá za nezávislý nádorový prediktor. Bylo však prokázáno, že nejen kvantita tumor infiltrujících lymfocytů, avšak i jejich složení jsou podstatné pro adekvátní efektorovou funkci nebo naopak ke vzniku tolerance či rezistence. Aktivace T lymfocytů je regulována rovnováhou mezi ko-stimulačními a inhibičními signály označovanými jako klíčové body imunity. Jedním z hlavních regulátorů omezujícím proliferaci a efektorové funkce velkého množství imunitních buněk jsou T regulační lymfocyty (Treg) s transkripčním faktorem FOXP3 jako jejich přirozeným markerem (19,22).
Ve shodě s publikovanými autory (36) jsme prokázali, že melanom má schopnost vytvářet ve svém stromálním mikroprostředí mechanismy potlačující imunitní reakce, které jsou závislé na expresi FOXP3., a navíc, že tyto změny korelují se stádiem onemocnění. Na rozdíl od névů, kde byly Tregy zcela sporadické, u melanomů jsou jejich počty signifikantně zvýšeny a to zejména u stadií pT2 a pT3. Zvýšení počtu FOXP3+ lymfocytů jsme detekovali zvláště v centrálních oblastech nádorů, kde však byla zároveň sledována zvyšující se množství CD3+ lymfocytů, což způsobilo v této lokalitě stabilní hodnoty poměru CD3+/FOXP3+.. K disproporcionálnímu složení TIL ve prospěch imunosupresivní populace dochází na periferii léze. To znamená jeho invazivní oblasti. Zvýšená hustota Tregů u pokročilejších melanomů by tak potvrzovala navození rezistence imunitního systému, související s horší prognózou těchto stádií. Navíc se zdá, že změna infiltrátu ve prospěch imunosupresivního fenotypu je nejvýraznější v oblasti invazivní proliferující linie, kde nádorové buňky pronikají dále do okolí. Ve skupině pT4 byly překvapivým zjištěním nižší hodnoty Tregů. Tento jev může být paradoxně považován za součást progrese onemocnění. Přítomnost Tregů může být odrazem alespoň částečně zachovalé efektorové funkce imunity. Snižování jejich množství u stádia pT4 může být tak vysvětleno navozením pro nádor dostatečné imunotolerance a vyjadřovat selhávání lokální tkáňové imunity. Potvrzením by bylo i námi zjištěné snižování denzity TIL u pT4 stádia ve srovnání se stádii nižšími. Množství regulačních lymfocytů se tak zdá být dynamickým procesem odrážejícím adaptaci imunitního systému. Je logické, že nádory vyššího stádia mají tuto adaptaci nejvíce alterovanou (17,20,37).
V poslední době se ukazuje, že ke klíčovým bodům imunitního sytému jsou změny exprese PD-1 a PD-L1 vedoucí k navození tolerance vůči cytotoxickým CD8+ T lymfocytům (38). Míra exprese PD-L1 se u jednotlivých nádorů liší a nejednoznačný je i význam exprese proteinu ve vztahu k prognóze. PD-L1 je exprimován jak na nádorových buňkách, tak na buňkách imunitního systému. Exprese na jednotlivých typech buněk může mít různý význam. Zvýšená exprese PD-L1 stanovená pomocí imunohistochemických vyšetření v buňkách solidních nádorů korelovala s horší prognózou u karcinomu jícnu a žaludku, hepatocelulárních a uroteliálních karcinomů. Naopak některé kontroverzní práce (39,40) spojují zvýšenou PD-L1 expresi na buňkách imunitního systému s delším přežitím pacientů s karcinomy hlavy a krku. Tato paradoxně lepší prognóza se vysvětluje alespoň částečně zachovalou antigenní stimulací a efektorovou imunitní reakcí. Asociace mezi PD-L1 expresí a prognózou není jednoznačná ani u maligních melanomů (41,42). Ukazuje se, že se u jednotlivých typů melanomů může lišit, když Kraft a kol. (43) prokázali horší prognózu u dezmoplastických melanomů PD-L1 pozitivních. V naší studii jsme prokázali jednoznačné zvýšení PD-L1 exprese jak na nádorových buňkách, tak na lymfocytech na periferní, tj. invazivní linii u melanomů pokročilých stádií pT3 a pT4, zatímco lymfocyty centrálně a vlastní nádorové buňky tento protein exprimují málo. Prokázali jsme heterogenitu distribuce exprese tohoto proteinu v závislosti na stádiu onemocnění. Zdá se důležité, aby byl protein hodnocen zvlášť na nádorových buňkách a lymfocytech. Spíše než prediktivní hodnota progrese, pomůže stanovování PD-L1 exprese selektovat vhodné kandidáty pro cílenou imunoterapii. I zde však zůstává mnoho nejasností, protože část pacientů s negativitou PD-L1 na léčbu odpovídá (28). K přesnějším závěrům bude potřeba dalších klinických studií.
ZÁVĚR
Prokázali jsme významnou heterogenitu stromálního mikroprostředí, s nejvýraznějšími změnami na periferii tumoru, kde dochází k přesmyku ve prospěch imunosupresivního fenotypu. Tato heterogenita se zvyšuje u pokročilejších stádií melanomu a může být jedním z mechanismů přispívajících k jejich vyšší agresivitě. Zejména u těchto stádií tak bude také nejspíše účinnější cílená biologická léčba.
PODĚKOVÁNÍ
Tato práce byla podpořena grantem NPU I LO1304 od Ministerstva školství, mládeže a tělovýchovy ČR a grantem LF_2018_001.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Svetlana Brychtová, PhD.
Ústav klinické a molekulární patologie FN Olomouc
Hněvotínská 3, Olomouc 77715
tel.: +420 585 632 449
e-mail: svetlana.brychtova@seznam.cz
Zdroje
1. Rejthar A, Vojtěšek B. Obecná patologie nádorového růstu. GRADA Publishing, spol. s r. o., 2002, 24-25.
2. Tarin D. Role of the host stroma in cancer an its therapeutic significance. Cancer Metastasis Rev 2013; 32(3-4): 553-566.
3. Brychtová S, Bezděková M, Hirňák J, Sedláková E, Tichý M, Brychta T. Stromal microenvironment alterations in malignant melanoma. IntechOpen, https://www.intechopen.com/books/research-on-melanoma-a-glimpse-into-current-directions-and-future-trends/stromal-microenvironment-alterations-in-malignant-melanoma.
4. Bhowmick NA, Neilson EG, Moses HL. Stromal fibroblasts in cancer initiation and progression. Nature 2004;18; 432(7015): 332–337.
5. Pastushenko I, Vermeulen PB, Carapeto FJ, et al. Blood microvessel density, lymphatic microvessel density and lymphatic invasion in predicting melanoma metastases: systematic review and meta-analysis. Br J Dermatol 2014; 170(1): 66-77.
6. Ria R, Reale A, Castrovilli A, et al. Angiogenesis and progression in human melanoma. Dermatol Res Pract 2010; 2010: 185687.
7. Matsuda Y, Hagio M, Ishiwata T. Nestin: A novel angiogenesis marker and possible target for tumor angiogenesis. World J Gastroenterol 2013; 19(1): 42–48.
8. Kerr EH, Wang D, Lewis JS Jr., Said-Al-Naief N, Hameed O. Lack of correlation between microvascular density and pathological features and outcomes in sinonasal and oral mucosal melanomas. Head and Neck Pathol 2011; 5: 199-204.
9. Ishiwata T, Matsuda Y, Naito Z. Nestin in gastrointestinal and other cancers: effects on cells and tumor angiogenesis. World J Gastroenterol 2011; 17(4): 409–418.
10. Kumar A, Bhanja A, Bhattacharyya J, Jaganathan BG. Multiple roles of CD90 in cancer. Tumour Biol 2016; 37(9): 11611-11622.
11. Schubert K, Gutknecht D, Köberle M, Anderegg U, Saalbach A. Melanoma cells use Thy-1 (CD90) on endothelial cells for metastasis formation. Am J Pathol 2013; 182(1): 266-276.
12. Nico B, Benaggiano V, Mangieri D, Maruotti N, Vacca A, Ribatti D. Evaluation of microvascular density in tumors: pro and contra. Histol Histopathol 2008; 23(5): 601-607.
13. Ohkura N, Sakaguchi S. Regulatory T cells: roles of T cell receptor for their development and function. Semin Immunopathol 2010; 32: 95-106.
14. Oble DA, Loewe R, Yu P, Minhm MC Jr. Focus on TILs: prognostic significance of tumor infiltrating lymphocytes in human melanoma. Cancer Immun 2009; 9: 3.
15. Titu LV, Monson JRT, Greenman J. The role of CD8(+) T cells in immune responses to colorectal cancer. Cancer Immunol Immunother 2002; 51: 235-247.
16. DiPaolo RJ, Glass DD, Bijwaard KE, Shevach EM. CD4+CD25+ T cells prevent the development of organ-specific autoimmune disease by inhibiting the differentiation of autoreactive effector T cells. J Immunol 2005; 175: 7135-7142.
17. Tan B, Anaka M, Deb S, et al. FOXP3 over-expression inhibits melanoma tumorigenesis via effects on proliferation and apoptosis. Oncotarget 2014; 5(1):264-276.
18. Fu S, Zhang N, Yopp AC, et al. TGF-β induces FOXP3+ T-regulatory cells from CD4+CD25- precursors. Am J Transplant 2004; 4: 1614-1627.
19. Wang X, Cui Y, Luo G, et al. Activated mouse CD4+FOXP3- T cells facilitate melanoma metastasis via Qa-1-dependent suppression of NK-cell cytotoxicity. Cell Research 2012; 22: 1696-1706.
20. Floess S, Freyer J, Siewert C, et al. Epigenetic control of the FOXP3 locus in regulatory T cells. PLOS Biology, 2007; 5(2), e38.
21. Kim M, Grimmig T, Grimm M, et al. Expression of FOXP3 in colorectal cancer but not in Treg cells correlates with disease progression in patients with colorectal cancer. PLOS ONE, January 2013; 8(1), e53630.
22. Niu J, Jiang C, Li C, et al. FOXP3 expression in melanoma cells as a possible mechanism of resistance to immune destruction. Cancer Immunol Immunother 2011; 60: 1109-1118.
23. Apostolou I, Verginis P, Kretschmer K, Polansky J, Hühn J, von Boehmer H. Peripherally induced Treg: mode, stability, and role in specific tolerance. J Clin Immunol 2008; 28: 619-624.
24. Pacholczyk R, Kern J. The T-cell receptor repertoire of regulatory T cells. Immunology 2008; 125: 450-458.
25. Sakaguchi, S, Wing K, Onishi Y, Prieto-Martin P, Yamaguchi T. Regulatory T cells: how do they suppress immune responses? Int Immunol 2009; 21(10): 1105-1111.
26. Zatloukalová P, Pjechová M, Babčanová S, Hupp TH, Vojtěšek B. Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi. Klin Onkol 2016; 29(Suppl 4): 72-77.
27. Šťastný M, Říhová B. Únikové strategie nádorů pozornosti imunitního systému. Klin Onkol 2015; 28 (Suppl 4): 28–37.
28. Remon J, Chaput N, Planchard D. Predictive biomarkers for programmed death-1/programmed death ligand immune checkpoint inhibitors in nonsmall cell lung cancer. Curr Opin Oncol/CZ 2016; 28: 122-129.
29. Baptista MZ, Sarian LO, Derchain SF, Pinto GA, Vassallo J. Prognostic significance of PD-L1 and PD-L2 in breast cancer. Hum Pathol 2016; 47(1): 78-84.
30. Galon J, Costes A, Sanchez-Cabo F, Kirilovsky A, Mlecnik B, Lagorce-Pagès C, Tosolini M, et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science 2006; 313(5795): 1960-1964.
31. Brychtová S, Fiurášková M, Hlobilková A, Brychta T, Hirňák J. Nestin expression in cutaneous melanomas and melanocytic nevi. J Cutan Pathol 2007; 34(5): 370-375.
32. Albini A, Bruno A, Gallo C, Pajardi G, Noonan DM, Dallaglio K. Cancer stem cells and the tumor microenvironment: interplay in tumor heterogeneity. Connect Tissue Res 2015; 56(5): 414-42.
33. Ahmed F, Haass NK. Microenvironment-driven dynamic heterogeneity and phenotypic plasticity as a mechanism of melanoma therapy resistance. Front Oncol 2018; 8: 173.
34. Veselá P, Tonar Z, Boudová L. Mikrovaskulární denzita v lymfomech – hodnocení a klinický význam. Cesk Patol 2015; 51(2): 94-98.
35. Zhang S, Zhang D, Sun B. Vasculogenic mimicry: current status and future prospects. Cancer Lett 2007; 254(2): 157-164.
36. Baumgartner J, Wilson C, Palmer B, Richter D, Banerjee A, McCarter M. Melanoma induces immunosuppression by upregulating FOXP3+ regulatory T cells. J Surg Res 2007; 141(1): 72-77.
37. Wilke CM, Wu K, Zhao E, Wang G, Zou W. Prognostic significance of regulatoy T cells in tumor. Int Cancer 2010; 127(4): 748-758.
38. Li Z, Dong P, Ren M, et al. PD-L1 expression is associated with tumor FOXP3+ reglatory T-cell infiltration of breast cancer and poor prognosis of patient. J Cancer 2016; 7(7): 784–793.
39. Vassilakopoulou M, Avgeris M, Velcheti V, et al. Evaluation of PD-L1 expression and associated tumor-infiltrating lymphocytes in laryngeal squamous cell carcinoma. Clin Cancer Res 2016; 22(3): 704-713.
40. Kim HR, Ha SJ, Hong MH, et al. PD-L1 expression on immune cells, but not on tumor cells, is a favorable prognostic factor for head and neck cancer patients. Scientific Reports 2016; 6: 36956.
41. Gadiot J, Hooijkaas AI, Kaiser AD, van Tinteren H, van Boven H, Blank C. Overall survival and PD-L1 expression in metastasized malignant melanoma. Cancer 2011; 117(10): 2192-2201.
42. Chlopik A, Selim MA, Peng Y, et al. Prognostic role of tumoral PDL-1 expression and peritumoral FOXP3+ lymphocytes in vulvar melanomas. Hum Pathol 2018; 73: 176-183.
43. Kraft S, Fernandez-Figueras MT, Richarz NA, Flaherty KT, Hoang MP. PD-L1 expression in desmoplastic melanoma is associated with tumor aggressiveness and progression. J Am Acad Dermatol 2017; 77(3): 534-542.
Štítky
Patológia Súdne lekárstvo ToxikológiaČlánok vyšiel v časopise
Česko-slovenská patologie

2019 Číslo 3
Najčítanejšie v tomto čísle
- Cytologické vyšetření mozkomíšního moku
- Neuronálna ceroidná lipofuscinóza s postihnutím srdca
- Adenómy hypofýzy – praktický prístup k histopatologickej diagnostike a zmeny v poslednej WHO klasifikácii z roku 2017
- Histopatologické hodnocení intenzity a aktivity zánětu u zánětlivých střevních onemocnění: Důležitý doplněk endoskopie nebo marná snaha?
