Henochova-Schönleinova purpura z pohľadu preventívneho podávania kortikoidov
Henoch-Schönlein Purpura from the Standpoint of Preventive Corticoid Administration
Henoch-Schönlein purpura (HSP) is the most frequent vasculitis of the child age, with 75% of the affected patients diagnosed at the age of 2 to 11 years. HSP is the IgA-mediated autoimmune, non-thrombocytopenic, a systemic, leukocytoclastic and hypersensitive vasculitis of predominantly child age, affecting small vessels of the skin, joints, gastrointestinal tract and kidneys.
It is clinically characterized of classical triad of symptoms:
skin rash (purpura), abdominal pain, and possibly renal affection and arthritis. HSP may occur also at the adult age and the nosological unit should be considered especially in combination of skin symptoms and abdominal pain resembling abdominal emergency. There is no specific therapy of HSP. A long-term topic of discussion is the administration of corticoids from the point of view of prevention of subsequent renal affection and its progression.
Key words:
Henoch-Schönlein purpura, corticoids, renal affection, vasculitis
Autoři:
M. Jeseňák
; M. Antonyová; M. Brndiarová
; J. Buchanec; Peter Bánovčin
Působiště autorů:
Klinika detí a dorastu, Univerzita Komenského v Bratislave, Jesseniova lekárska fakulta
a Martinská fakultná nemocnica, Martin
prednosta prof. MUDr. P. Bánovčin, CSc.
Vyšlo v časopise:
Čes-slov Pediat 2008; 63 (10): 557-564.
Kategorie:
Přehledový článek
Souhrn
Henochova-Schönleinova purpura (HSP) je najčastejšou vaskulitídou detského veku, pričom 75 % postihnutých pacientov je vo veku 2–11 rokov. HSP je IgA-mediovaná, autoimunitná, non-trombocytopenická, systémová, leukocytoklastická, hypersenzitívna vaskulitída predovšetkým detského veku, ktorá postihuje malé cievy kože, kĺbov, gastrointestinálneho traktu a obličiek.
Klinicky je charakterizovaná klasickou triádou príznakov:
kožný rash (purpura), abdominálna bolesť, ev. renálne postihnutie a artritída. HSP sa môže vyskytovať však aj v dospelom veku, pričom na túto nozologickú jednotku treba myslieť najmä pri kombinácii kožných príznakov a abdominálnej bolesti pripomínajúcej náhlu brušnú príhodu. Špecifická terapia HSP neexistuje. Dlhodobo diskutovanou témou je podávanie kortikoidov z hľadiska prevencie neskoršieho renálneho postihnutia a jeho progresie.
Kľúčové slová:
Henochova-Schönleinová purpura, kortikoidy, renálne postihnutie, vaskulitída
Úvod
Henochova-Schönleinova purpura (HSP) je typickým ochorením detského a adolescentného veku. Toto ochorenie je známe pod mnohými synonymami odrážajúcimi jednotlivé orgánové prejavy HSP, ako je napr. anafylaktoidná purpura, purpura abdominalis alebo rheumatica, alergická purpura, purpura necrotisans. HSP je IgA-mediovaná, autoimunitná, non-trombocytopenická, systémová, leukocytoklastická, hypersenzitívna vaskulitída detského veku, ktorá postihuje malé cievy kože, kĺbov, GIT-u a obličiek [1, 2].
História
Asi pred 200 rokmi Heberden opísal prípad 5-ročného chlapca s abdominalgiami, emesis, melénou, artralgiami, purpurickým rashom a hematúriou. Toto zoskupenie neskôr dostalo pomenovanie Henochova-Schönleinova purpura. V r. 1837 Johann Schönlein opísal asociáciu medzi artralgiami a purpurou a ochorenie nazval „peliosis rheumatica“. Zároveň ako prvý poukázal na úlohu respiračných infekcií pri vyvolaní tohto ochorenia. Jeho žiak Eduard Henoch pozoroval asociáciu kožných a kĺbnych prejavov s bolesťami brucha a s krvavými hnačkami. Neskôr doplnil tento syndróm o výskyt hemoragickej nefritídy a definoval, že renálne postihnutie je rozhodujúcim aspektom pre prognózu tohto ochorenia. Termín „anafylaktoidná purpura“ bol prvý krát použitý v roku 1915 Frankom, neskôr Gairdner dokázal vaskulitickú podstatu ochorenia. Patofyziologický význam abnormalít IgA sa dokázal v 60. a 70. rokoch 20. storočia.
Etiológia
Pôvod HSP je dodnes neznámy, ale uvažuje sa o kombinácii viacerých faktorov [3]:
- genetická podmienenosť: možná asociácia s antigénmi HLA BW35, DR4, DQW7;
- abnormality imunitného systému: abnormality IgA (• IgA v sére, IgA cirkulujúce komplexy, IgA reumatoidný faktor, IgA autoprotilátky proti cytoplazme neutrofilov, IgA antiendoteliálne autoprotilátky, aberantná glykozylácia IgA1, abnormality IgA1 receptora) [4–8]; abnormality komplementu (C2 deficiencia, C4B deficiencia, ‚ CH50 a properdínu, • C3d v sére) [9]; ↑• celkových IgE [10]. HSP je asociovaná s abnormalitami protilátok IgA len prvej triedy [7, 11].
- spúšťače („triggers“) imunologickej reakcie: vírusové, bakteriálne a parazitárne choroby (Mycoplasma pneumoniae, EBV, HIV, varicella, Parvovírus B19, Coxsackie, Adenovírusy, Rubeola, Vírusy hepatitíd A, B, C, Streptokoky skupiny alfa, Campylobacter jejuni, Helicobacter pylori, Lamblia intestinalis, Pseudomonas aeruginosa, Salmonella hirshfeldii, Toxocara canis); vakcinácia (týfus, cholera, žltá zimnica, osýpky); alergická reakcia na potraviny, lieky, hmyz; drogy a toxíny; aplikácia streptokinázy po infarkte myokardu; expozícia chladu; systémové ochorenia, malignity a iné [1, 12–17].
HSP postihuje predovšetkým malé cievy (arterioly, venuly, kapiláry) a tieto zmeny sú asociované s ukladaním IgA imunokomplexov do steny ciev. Podobne v obličkách nachádzame IgA depozity aj pri primárnej IgA-nefropatii (Bergerova choroba). Stále prebieha diskusia, či ide o dve rozdielne ochorenia s viacerými spoločnými príznakmi, alebo ide o jedno ochorenie s rôznym klinickým obrazom [8, 18]. Niektorí autori striktne rozlišujú nefritídu pri HSP (HSPN) a IgA nefropatiu, pri ktorých pozorovali rôzny výskyt anamnestických a laboratórnych parametrov [10].
Epidemiológia
V našich podmienkach ide o najčastejšiu vaskulitídu detského veku (cca 14 prípadov na 100 000), pričom až 75 % všetkých pacientov je medzi 2. a 11. rokom (vrchol 5 rokov). [8, 19]. V dospelosti je HSP veľmi zriedkavá a obyčajne máva ťažší priebeh (cca 10 % pacientov). Chlapci bývajú postihnutí až dva krát častejšie ako dievčatá [20]. Pre HSP je typický sezónny výskyt, najmä v zimných mesiacoch (často nasleduje po prekonanej infekcii horných dýchacích ciest). Existujú aj geografické rozdiely vo výskyte a klinickej manifestácii tohto ochorenia. Intenzita tohto ochorenia klesá údajne zo západu na východ Európy.
Patofyziológia
Ochorenie je sprevádzané subendotelovým ukladaním IgA-imunokomplexov v stenách malých ciev (imunokomplexy vznikajú pravdepodobne ako odpoveď na vyššie vymenované spúšťače). Následne dochádza k aktivácii komplementu alternatívnou cestou, poškodeniu cievnej steny a nekróze, prípadne oklúzii postihnutých ciev. Toto vedie k extravazácii erytrocytov v postihnutých orgánoch. Do komplexnej patogenézy HSP sú zapojené aj mnohé iné, známe či menej známe mechanizmy najmä na imunologickom podklade.
Klinický obraz
Klinicky sa HSP manifestuje predovšetkým triádou príznakov:
- rash (purpura),
- abdominálna bolesť, ev. renálne postihnutie,
- artritída.
Typické je, že so zvyšujúcim sa vekom dochádza k zmene vo frekvencii klinických príznakov (tab. 1), pričom pre deti do 2 rokov je typický edém a purpurický rash (často na tvári). Postihnutie GIT-u, obličiek a kĺbov je v tomto veku zriedkavé a ochorenie má excelentnú prognózu [21]. Ochorenie oveľa ťažšie prebieha u starších detí a dospelých, najmä vzhľadom na obličkové postihnutie [8].
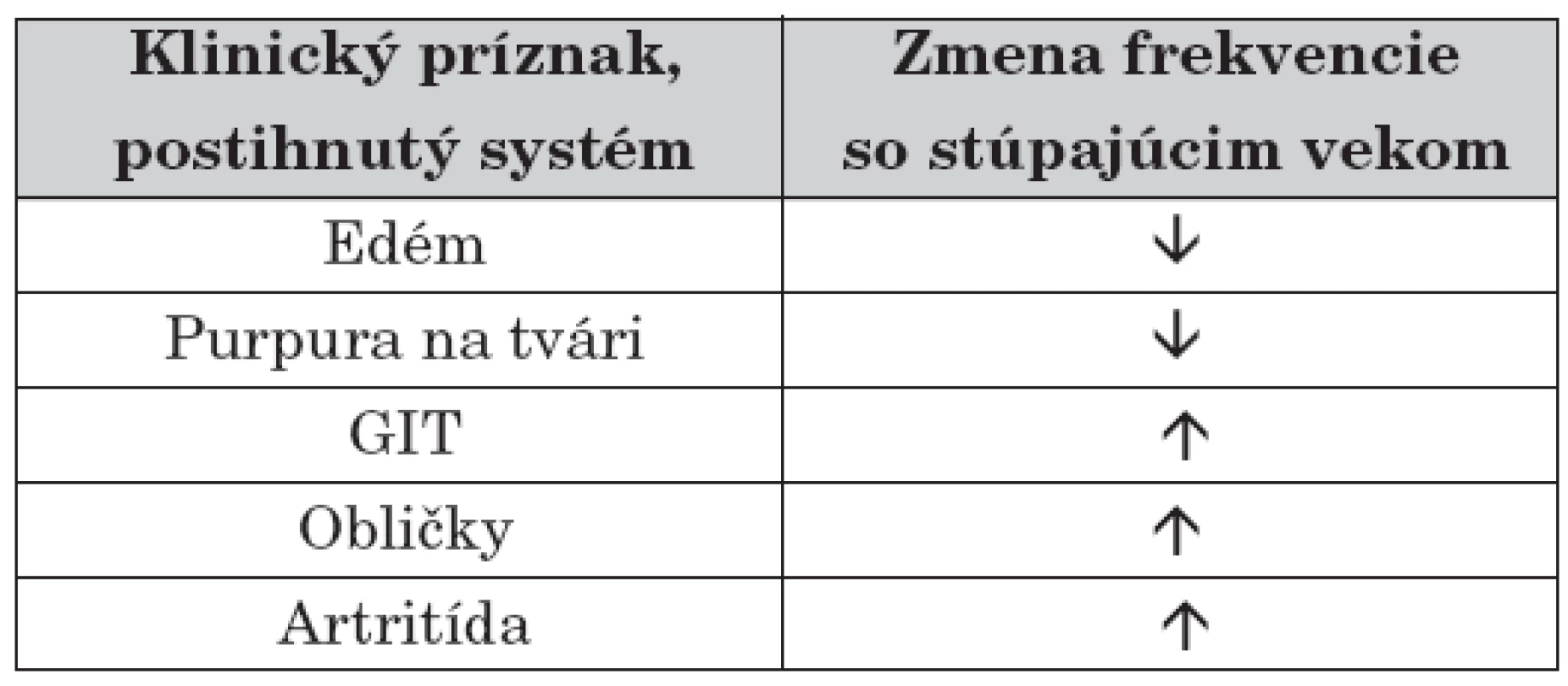
Najmarkantnejším príznakom sú kožné lézie, viscerálne postihnutie sa diagnostikuje ťažšie, ale je o to závažnejšie. Priebeh HSP môže byť akútny (so simultánnym sa objavením príznakov) alebo gradujúci (so sekvenčným rozvojom klinického obrazu). HSPN môže prejsť do chronicity. Typický klinický obraz tvoria symptómy zhrnuté v tabuľke 2 [9, 11, 21–23].
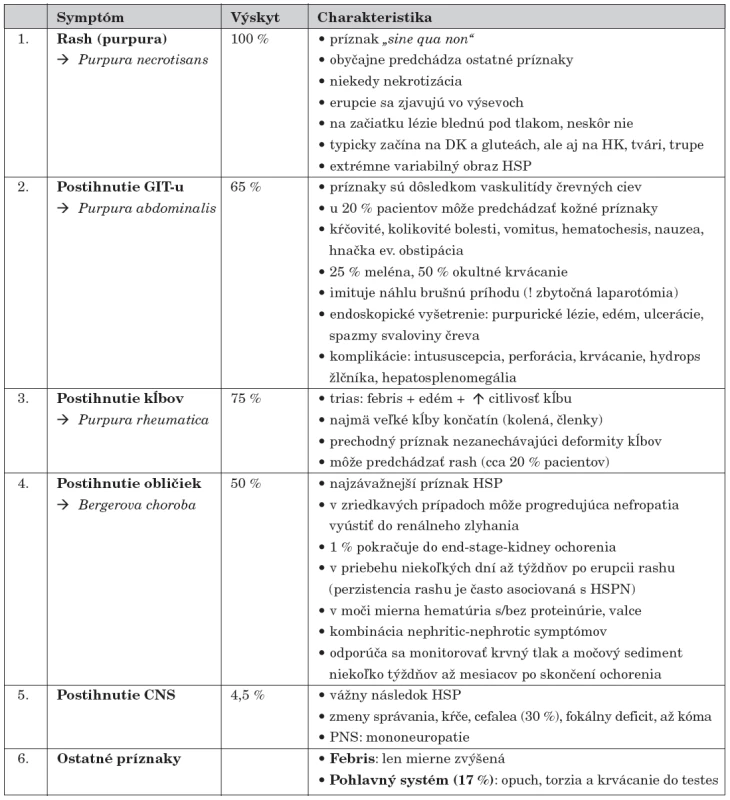
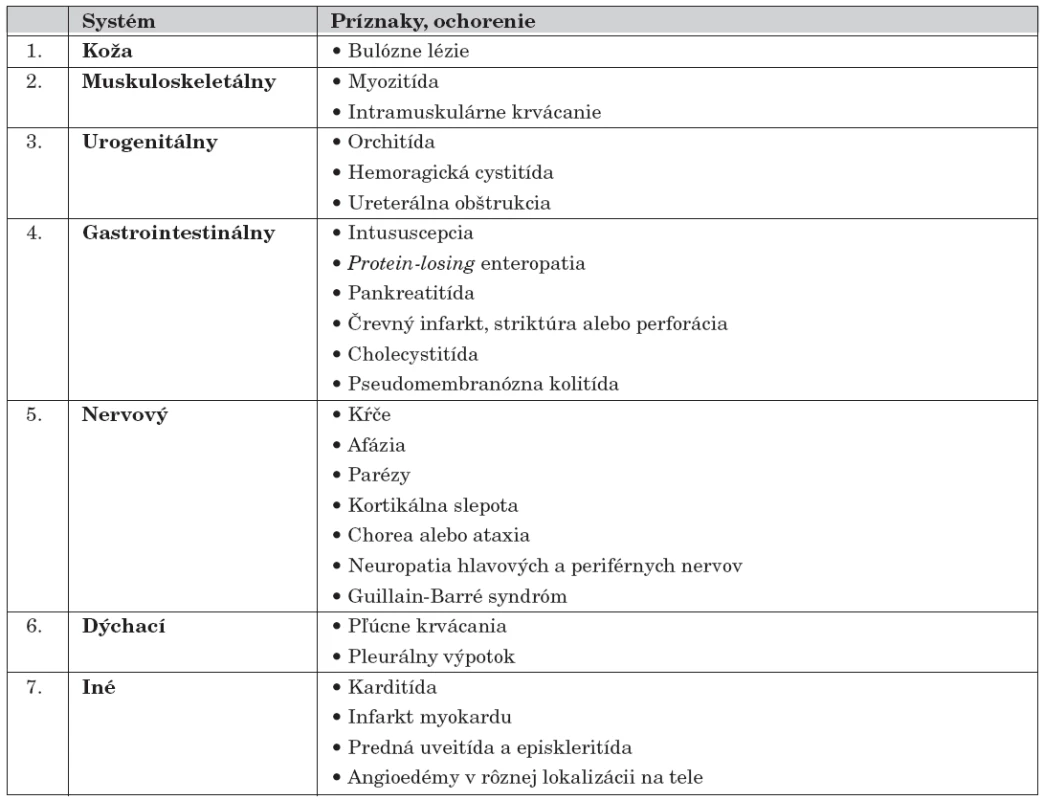
Medzi menej typické príznaky a komplikácie Henochovej-Schönleinovej purpury patrí postihnutie svalov, niektoré gastrointestinálne a neurologické symptómy, ev. postihnutie respiračného traktu (tab. 3) [23].
Diagnóza
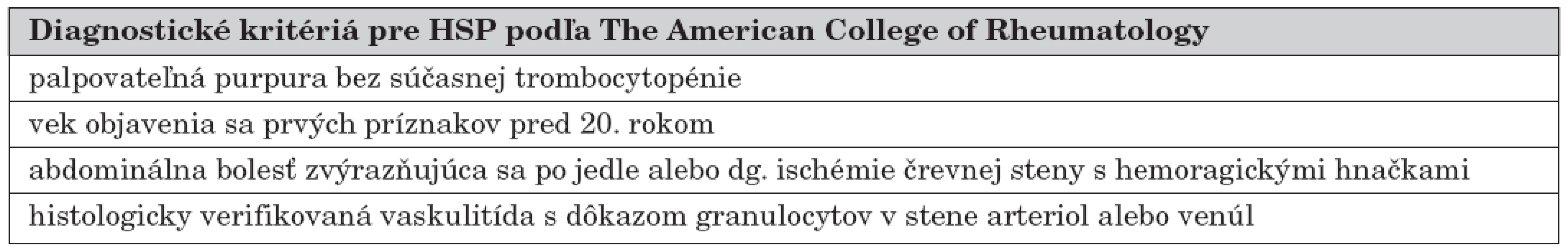
Pri diagnostike HSP vychádzame z klinického obrazu a vhodne ju dopĺňame laboratórnymi (•proteíny akútnej fázy, •FW, leukocytóza, eozinofília, •komplement, ‚properdín, ‚celková aktivita komplementu, •IgA u cca 50 % pacientov, •CIK, •Von Willebrandov faktor, •trombomodulín, ‚faktor XIII, • ASLO, anémia, hematúria a proteinúria, stolica pozitívna na okultné krvácanie alebo makroskopická prímes krvi) a klinickými neinvazívnymi (USG abdomenu, RTG kontrastné a natívne vyšetrenie abdomenu, EEG prípadne NMR mozgu) aj invazívnymi (biopsia kože s nálezom IgA depozitov v stene ciev a biopsia obličiek s dôkazom depozitov IgA, IgG, C3 a fibrínu a mezangiálnej proliferatívnej glomerulonefritídy) metódami [8, 9, 11, 16, 18]. Neexistuje žiadny typický laboratórny marker pre HSP. V tabuľke 4 sú diagnostické kritériá pre HSP podľa The American College of Rheumatology [24].
Liečba
Neexistuje špecifická terapia HSP, podávame skôr symptomatickú liečbu na zvládnutie jednotlivých príznakov. Odporúča sa kľud na lôžku, dostatočná hydratácia, sanácia fókusov, liečba ev. infekcií, eliminácia vyvolávajúcich faktorov, analgetiká, antihistaminiká, venofarmaká, vitaminoterapia. Pri ťažšom priebehu HSP sa odporúča podávať intravenózne kortikosteroidy (KS) (obyčajne nasledované rôzne dlhou perorálnou liečbou), ACE-inhibítory (antiproteinurický efekt), dapson (antileprotikum), imunosupresíva (azatioprín, cyklofosfamid) alebo plazmaferéza. Inú možnosť u časti pacientov predstavuje skoré podanie intravenóznych imunoglobulínov počas prvých 48 hodín ochorenia [25]. U pacientov s ťažkým renálnym postihnutím je možné použiť kombinovanú intravenóznu pulznú terapiu metylprednizónom (30 mg/kg/deň tri dni po sebe, potom perorálne prednizón) s azatioprínom alebo cyklofosfamidom [8, 26, 27] alebo s antikoagulanciami [28]. Poslednou možnosťou je transplantácia obličiek, ale recidíva ochorenia sa môže objaviť aj v štepe, preto treba vyčkať 1–2 roky od posledného výsevu rashu. Pri objavení sa GIT komplikácií je indikovaná chirurgická intervencia.
Stále diskutovanou otázkou je včasné preventívne podanie kortikoidov (viď ďalej) [16]. Podanie KS nemá vplyv na kožné príznaky, trvanie ochorenia alebo frekvenciu recidív, na druhej strane môže maskovať náhlu brušnú príhodu (intususcepsia, krvácanie) [11]. Zatiaľ žiadna terapia nepreukázala jednoznačný benefit pri urýchlení odoznenia ochorenia [8, 11].
Recidíva ochorenia
HSP je akútne, self-limited ochorenie, väčšinou odoznievajúce spontánne. Asi u tretiny pacientov sa objaví v priebehu 4 mesiacov od vzniku ochorenia recidíva (možnosť aj viacerých recidív). KS môžu urýchliť odoznenie kĺbnych a gastrointestinálnych príznakov, ale nemajú preventívny vplyv na rekurenciu symptómov. Pacienti s renálnym postihnutím majú signifikantne vyššiu frekvenciu recidív. Nenašla sa korelácia medzi frekvenciou recidív a eleváciou sérových IgA alebo vekom [8, 11].
Recidíva HSPN je možná aj v transplantáte. V jednej štúdii pozorovali histologickú recidívu ochorenia u 50 % pacientov (je zaujímavé, že riziko recidívy ochorenia v alografte je vyššie po transplantácii orgánu od živého, príbuzenského darcu, ako pri štepe od kadávera). Klinickú rekurenciu našli u 20 %, zlyhanie štepu u 12 % a jeho stratu u 9 % pacientov s transplantovanou obličkou [29].
Renálne postihnutie pri Henochovej-Schönleinovej purpure
Frekvencia renálneho postihnutia pri HSP sa udáva v literatúre od 10 až do 100 % v závislosti od toho-ktorého autora a jednotlivých diagnostických kritérií pre nefropatiu [16, 31–34]. Približne 2 % detí s HSPN neskôr progreduje až do obličkového zlyhania. Zo všetkých detí zahrnutých v Európskom transplantačnom obličkovom programe je 1,7 % s diagnózou HSPN [35].
U menších detí je obličkové postihnutie pomerne zriedkavé. Naopak, v dospelom veku je renálne postihnutie oveľa častejšie a máva aj horšiu prognózu [16]. Väčšina detí pri HSPN má iba hematúriu a/alebo miernu proteinúriu a má pomerne veľkú šancu na úpravu stavu ad integrum. Pacienti s masívnou proteinúriou pri akútnom vzniku ochorenia majú veľké riziko progresie nefropatie [50]. Proporcia detí s HSPN v špecializovaných centrách, ktorá progreduje do RI alebo end-stage renálneho ochorenia, je od 12–19 % [26, 37], zatiaľ čo v centrách s neselektovanou populáciou len 0 až 3 % [33, 34]. 35 % pacientov, ktorí mali ťažký priebeh HSPN, majú renálne postihnutie aj v dospelosti, naopak, u tých, čo mali len mierne alebo žiadne obličkové príznaky na začiatku ochorenia, sa nefropatia vyvinula len u 7 %. Stupeň histologických zmien nekoreluje s neskoršou prognózou pacienta [38]. U 75 % pacientov so vzniknutou HSPN pozorovali NP v priebehu prvých štyroch týždňov od začiatku ochorenia, u zvyšných 25 % medzi 4. až 9. týždňom [8]. Meadow et al. [32] zaznamenali klinický nástup 80 % HSPN počas prvých 4 týždňov a zvyšok v priebehu nasledujúcich 2 mesiacov, menšiu časť aj neskôr. Saulsbury pozoroval vo svojom súbore HSPN až u 40 % detí: 83 % malo mikroskopickú hematúriu, 17 % makroskopickú. U 63 % detí našli aj proteinúriu [8]. 30–50 % pacientov s HSPN má perzistujúci močový nález [34, 39].
Predpokladá sa, že frekvencia renálneho postihnutia môže byť v niektorých štúdiách podhodnotená, pretože u časti pacientov sa dokáže len hypertenzia bez močového nálezu [8, 40].
Všetky deti s ťažkým priebehom HSP s alebo bez nefropatie a tehotné ženy, ktoré v minulosti prekonali HSP, majú byť následne dispenzarizovaní (meranie krvného tlaku a analýza moča) [6].
Prognóza
Prognóza HSP v detskom veku je excelentná a okolo 94 % detí sa uzdraví bez následkov. V dospelom veku je úplné uzdravenie u cca 93 % pacientov. Prognóza ochorenia závisí predovšetkým od postihnutia obličiek. Zlá prognóza je asociovaná s príznakmi HSPN pri akútnom priebehu HSP, ale naopak nie je v korelácii s histologickým stupňom postihnutia obličiek pri prvej biopsii [38]. Informácie získané pri hodnotení výsledkov z renálnych biopsií sú následovné: intersticiálna fibróza, glomerulárna fibrinoidná nekróza a glomerulárna skleróza sú nezávislé prediktívne faktory predpovedajúce ťažké renálne postihnutie, naopak, akútne glomerulárne lézie nemali nezávislú prediktívnu hodnotu [41]. V inej štúdii ako signifikantné prediktory definovali renálne zlyhanie, nefrotický syndróm alebo stupeň histologického postihnutia [36]. Kaku et al. [31] za nezávislé predisponujúce faktory považuje vek začiatku ochorenia nad 7 rokov, prudké GIT ťažkosti, perzistujúcu purpuru a pokles koncentrácie koagulačného faktora XIII.
Prognóza detí s HSPN s minimálnym močovým nálezom a pri stabilnom histologickom obraze je excelentná. Prítomnosť renálnej insuficiencie, nefrotického syndrómu alebo crescendo glomerulonefritídy dáva týmto pacientom vyššie riziko vzniku progresívnej nefropatie [36]. U detí a dospelých s HSP je dôležité dlhoročné sledovanie z hľadiska renálneho poškodenia, pretože HSPN môže byť pozorované až mnoho rokov po stanovení iniciálnej diagnózy. Renálna biopsia je dôležitá na definovanie dlhodobej prognózy pre týchto pacientov [36, 42].
Pacienti s izolovanou hematúriou s/bez proteinúrie majú dobrú prognózu. Naopak, 50 % detí s HSPN asociovanou s nefrotickým syndrómom môže progredovať do renálnej insuficiencie [8].
Prognóza HSPN je dobrá u detí ako aj u dospelých, ale u dospelých je lepšie predpovedateľná (negatívne prediktívne faktory sú: proteinúria viac ako 1,5 g/deň, hypertenzia, kreatinín viac ako 120 μmol/l, glomerulárna nekróza viac ako 10 %, glomerulárna skleróza viac ako 20 % alebo intersticiálna fibróza viac ako 10 %), pretože u detí na rozdiel od dospelých nepozorovali významnú prediktívnu hodnotu u žiadneho sledovaného laboratórneho alebo klinického parametra [41, 43].
U detí oveľa častejšie pozorovali minimálne renálne postihnutie s prechodnou hematúriou bez alterácie obličkových funkcií ako u dospelých [43]. Prežívanie bolo s odstupom času rovnaké medzi skupinou detí a dospelých, ale dospelí častejšie vyžadovali hemodialyzačnú liečbu [43].
Preventívne podanie kortikoidov
Stále diskutovanou témou je, či včasné podanie KS u detí len s extrarenálnymi príznakmi HSP ich chráni pred vznikom neskoršej nefropatie, ktorá je z hľadiska dlhodobej prognózy ochorenia rozhodujúca [12, 44, 45]. Touto problematikou sa zaoberalo niekoľko autorov, ktorých na základe výsledkov možno rozdeliť do dvoch skupín:
1. Autori potvrdzujúci, že včasné podanie KS pri HSP chráni pred vývojom neskoršej nefropatie:
Mollica et al. [46] publikovali prospektívnu, randomizovanú, kontrolovanú štúdiu týkajúcu sa prevencie nefropatie včasným podaním KS. V skupine detí s KS (1 mg/kg/deň počas 14 dní) pozorovali signifikantne nižší výskyt neskoršej nefropatie (0 %), hoci aj v skupine detí bez KS bolo postihnutie obličiek relatívne zriedkavé (12 %).
Kaku et al. [31] pri multivariantnej analýze prognostických faktorov pri prevencii HSPN ukázali, že KS znižujú riziko neskoršej nefropatie, avšak pri univariantnej analýze tých istých dát nebol tento benefit dokázaný. Táto retrospektívna štúdia pracovala s údajmi od pacientov s ťažkou abdomenalgiou, pre ktorú sa im podávali KS (samotné GIT postihnutie je rizikový faktor pre vznik HSPN). Perzistujúca purpura a pokles faktora XIII boli signifikantné rizikové faktory pre rozvoj HSPN a autori odporúčajú u týchto pacientov liečbu s KS.
V našej retrospektívnej štúdii sme pozorovali vznik neskoršej nefropatie u 5/10 (50 %) neliečených pacientov, a len u 1/23 (4,3 %) pacientov, u ktorých sa aplikoval prednizón hneď na začiatku vzniku ochorenia [47]. Všetci zahrnutí pacienti mali na začiatku negatívny močový nález. Rozšírenú správu potvrdzujúcu predchádzajúce výsledky (54,5 % versus 3,5 %) sme publikovali o tri roky neskôr [12, 48, 49].
Reinehr et al. [45, 50] podávali prednizón (dávka 2 mg/kg/deň, ktorú zvýšili na 3–5 mg ak GIT príznaky pretrvávali viac ako 24 hodín po nasadení liečby, pričom liečba začala počas prvých troch týždňov ochorenia a trvala minimálne 1 týždeň) u detí s výraznými abdomenalgiami. 77 % detí nemalo bolesti v priebehu 24 hodín po nasadení KS, naopak, deti, ktoré KS nedostali, mali priemerne trvanie bolestí brucha 5 dní (rozsah 1–28 dní). Nepozorovali žiadny vedľajší účinok KS liečby. Abdominálna bolesť je signifikantný rizikový faktor pre rozvoj NP, ktorá naopak určuje prognózu HSP. Skoré podanie prednizónu (aspoň 1-týždňová liečba počas prvých 3 týždňov vzniku ochorenia) redukovalo signifikantne neskoršie renálne postihnutie u takto liečených pacientov (8 % versus 52 %).
Iní autori skúšali preventívny efekt heparínu. Jeho aplikácia v dávke 120–150 IU/kg tri dni na začiatku ochorenia a pri recidíve u detí s extrarenálnymi príznakmi HSP signifikantne redukovala vznik neskoršej nefropatie u tejto skupiny detí [51].
2. Autori nepotvrdzujúci benefit podania KS pri prevencii nefropatie pri HSP:
Saulsbury [33] dokumentuje rovnakú incidenciu renálneho postihnutia u pacientov s alebo bez KS, a preto včasné podanie KS nemá podľa neho preventívny vplyv na vznik neskoršej nefropatie.
Taktiež Bona et al. [52] nepozorovali podstatné rozdiely medzi pacientmi liečenými alebo neliečenými KS, s alebo bez antitrombotík.
Huber et al. [53] sa vo svojej randomizovanej, dvojito-slepej, placebom kontrolovanej štúdii zamerali na to, či skoré podanie prednizónu (do 7 dní od začiatku ochorenia) v dávke 2 mg/kg/deň počas jedného týždňa, s následným znižovaním dávky počas druhého týždňa, má vplyv na redukciu vzniku neskorších renálnych alebo GIT komplikácií. V ich výsledkoch nepozorovali benefit skorého podania prednizónu pri redukcii renálneho postihnutia v priebehu prvého roka alebo pri prevencii akútnych GIT komplikácií. Rutinné, skoré podanie KS pri nekomplikovanej HSP nie je t.č. možné vo všeobecnosti odporučiť. KS môžu ale preventívne pôsobiť pri niektorých GIT komplikáciách.
Ďalšie tri štúdie taktiež nepotvrdili benefit preventívnej liečby KS [54–56].
Záver
Otázka včasného podania KS ostáva naďalej otvorená. Výsledky jednotlivých štúdií je ťažké porovnať, pretože súbory sú nehomogénne, čo sa týka časového odstupu vyšetrení, stupňa nefropatie, type a dĺžky liečby, ev. prevedenia biopsie obličky. Do úvahy treba brať i regionálne rozdiely vo výskyte a priebehu ochorenia, ako i časové rozdiely, v ktorých sa jednotlivé štúdie realizovali (ako i možnú zmenu priebehu vlastného ochorenia s tendenciou k „benígnejšiemu priebehu v súčasnosti v porovnaní s minulosťou) [12, 48]. Metaanalýza 4 jednotlivých štúdií dokázala zníženie relatívneho rizika o 75 % pri preventívnom podaní KS, avšak 95% interval spoľahlivosti bol 0,05–1,32, čo nedovoľuje formulovať konečný záver, čo sa týka pozitívneho účinku preventívneho podania KS pri HSP [57]. Táto otázka stále vyžaduje realizáciu veľkej, multicentrickej, randomizovanej, dvojito-slepej, placebom kontrolovanej štúdie s potvrdením alebo vyvrátením protektívneho efektu KS pred vznikom neskoršej nefropatie u chorých s HSP.
Vzhľadom na výsledky doterajších štúdií nemožno zatiaľ paušálne odporúčať včasné podanie kortikoidov u pacientov s HSP ako preventívny terapeutický zásah pred vznikom neskoršej nefropatie.
MUDr. Miloš Jeseňák, PhD.
Klinika detí a dorastu UK JLF a MFN
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: jesenak@gmail.com
Zdroje
1. Buchanec J, Minárik J. Purpura Schönlein-Henoch. In: Buchanec J, et al. Vademékum pediatra. Martin: Osveta, 2001: 1115.
2. Miller ML, Pachman LM. Henoch-Schönlein purpura. In: Behrman E, Kliegman RM, Jenson HB. Nelson Textbook of Pediatrics. 17th ed. New York: W.B. Saunders Copany, 2004.
3. Williams DG. Pathogenesis of idiopathic IgA nephropathy. Pediatr. Nephrol. 1993;7: 303–311.
4. Allen AC, Willis FR, Beattie TJ, et al. Abnormal IgA glycosylation in Henoch-Schönlein purpura restricted to patients with clinical nephritis. Nephrol. Dial. Transplant. 1998;13: 930–934.
5. Lin J-J, Stewart CL, Kaskel FJ, et al. IgG a IgA classes of antineutrophil cytoplasmatic antibodies in a 13 year old girl with reccurent Henoch-Schönlein purpura. Pediatr. Nephrol. 1993;7: 143–146.
6. Ronda N, Esnault VLM, Layward L, et al. Antineutrophil cytoplasmatic antibodies (ANCA) of IgA izotype in adult Henoch-Schönlein purpura. Clin. Exp. Immunol. 1994;95: 49–55.
7. Saulsbury FT. The role of IgA, rheumatoid factor in the formation of IgA-containing immune complexes in Henoch-Schönlein purpura. J. Clin. Lab. Immunol. 1987;23: 123–127.
8. Saulsbury FT. Henoch-Schönlein purpura in children: Report of 100 patients and review of the literature. Medicine (Baltimore) 1999;78: 395–409.
9. Tizard EJ. Henoch-Schönlein purpura. Arch. Dis. Child. 1999;80: 380–383.
10. Davin JC, Pierard G, Dechenne C, et al. Possible role of IgE in Henoch-Schönlein purpura. Pediatr. Nephrol. 1994;8: 169–171.
11. Saulsbury FT. Henoch-Schönlein purpura [Vasculitis syndromes]. Curr. Opin. Rheumatol. 2001;13: 35–40.
12. Buchanec J, Zibolen M. Naše skúsenosti s prevenciou vzniku nefropatie pri Schönleinovej-Henochovej purpure včasným podaním prednisonu. Aktual. Nefrol. 1998;4: 24–25.
13. Crowson AN, Mihm MC, Magro CM. Cutaneous vasculitis: a review. J. Cutan. Pathol. 2003;30: 161–173.
14. Magro CM, Crowson AN. A clinical and histologic study of 37 cases of immunoglobulin A-associated vasculitis. Am. J. Dermatopathol. 1999;21: 234–240.
15. Pertuiset E, Lioté F, Launay-Russ E, et al. Adult Henoch-Schönlein purpura associated with malignancy. Semin. Arthritis Rheum. 2000;29: 360–367.
16. Rostoker G. Schönlein-Henoch purpura in children and adults: diagnosis, pathophysiology and management. BioDrugs. 2001;15(2): 99–138.
17. Sinha A, Sood J, Kumra VP. Henoch-Schönlein purpura and anaesthesia – a case report. Indian J. Anaesth. 2005;49: 47–48.
18. Hughes FJ, Wolfish NM, McLaine PN. Henoch-Schönlein syndrome and IgA nephropathy: a case report suggesting a common pathogenesis. Pediatr. Nephrol. 1988;2: 389–392.
19. Neilsen HE. Epidemiology of Schönlein-Henoch purpura. Acta Paediatr. 1988;77: 125–131.
20. Robson WLM, Leung AKC. Henoch-Schönlein purpura. Adv. Pediatr. 1994;41: 163–194.
21. Al-Sheyyab M, El-Shanti H, Ajlouni S, et al. The clinical spectrum of Henoch-Schönlein purpura in infants and young children. Eur. J. Pediatr. 1995;154: 969–972.
22. Olson JC, Kelly K, Pan CG, et al. Pulmonary disease with hemorrhage in Henoch-Schönlein purpura. Pediatrics 1992;89: 1177–1181.
23. Verrina E, Perfumo F, Canepa A, et al. Clinical aspects of the nephropathy in Schoenlein-Henoch syndrome. Pediatr. Med. Chir. 1986;8: 317–320.
24. Mills JA, Michel BA, Bloch DA, et al. The American College of Rheumatology 1990 criteria for the classification of Henoch-Schönlein purpura. Arthritis Rheum. 1990;33: 1114–1121.
25. Ruellan A, Khatibi M, Staub T, et al. Rheumatoid purpura and intravenous immunoglobulins. Rev. Med. Intern. 1997;18: 727–729.
26. Niaudet P, Murcia I, Beaufils H, et al. Primary IgA nephropathies in children: prognosis and treatment. Adv. Nephrol. 1993;22: 121–140.
27. Oner A, Tinaztepe K, Erdogan O. The effect of tripple therapy on rapidly progressive type of Henoch-Schönlein nephritis. Pediatr. Nephrol. 1995;9: 6–10.
28. Belovezhdov N. Treatment of diffuse glomerulonephritis in adults with Schönlein-Henoch disease using a combination of anticoagulants, corticosteroids and immunosuppressants. Vutr. Boles. 1986;25: 21–25.
29. Meulders Q, Pirson Y, Cosyns J-P, et al. Course of Henoch-Schönlein nephritis after renal transplantation. Transplant. 1994;58: 1179–1186.
30. Blanco R, Martinez-Taboada VM, Rodruguez-Valverde V, et al. Henoch-Schönlein purpura in adulthood and children: two different expessions of the same syndrome. Arthritis Rheum. 1997;40: 438–442.
31. Kaku Y, Nohara K, Honda S. Renal involvement in Henoch-Schönlein purpura: a multivariate analysis of prognostic factors. Kidney Int. 1998;53: 1755–1759.
32. Meadow SR. The prognosis of Henoch Schönlein nephritis. Clin. Nephrol. 1978;9: 87–90.
33. Saulsbury FT. Corticoid therapy does not prevent nephritis in Henoch-Schönlein purpura. Pediatr. Nephrol. 1993;7: 69–71.
34. Stewart M, Savage JM, Bell B, et al. Long-term renal prognosis of Schönlein-Henoch purpura in an unselected childhood population. Eur. J. Pediatr. 1988;147: 113–115.
35. Loirat C, Ehrich JHH, Geerlings W, et al. Report on management of renal failure in children in Europe, 1992. Nephrol. Dial. Transplant. 1994;9: 26-40.
36. Schärer K, Krman R, Querfeld U, et al. Clinical outcome of Schönlein-Henoch nephritis in children. Pediatr. Nephrol. 1999;13: 816–823.
37. Goldstein AR, White RHR, Akuse R, et al. Long-term follow-up of childhood Henoch-Schönlein nephritis. Lancet 1992;1: 280–282.
38. Ronkainen J, Nuutinen M, Kosomies O. The adult kidney 24 years after childhood Henoch-Schönlein purpura: a retrospective cohort study. Lancet 2002;360: 666–670.
39. Koskimes O, Mir S, Rapola J, et al. Henoch-Schönlein nephritis: long-term prognosis of unselected childhood population. Arch. Dis. Child. 1981;56: 482–484.
40. Kapoor A, Mowbray JF, Porter KA, et al. Significance of haematuria in hypertensive patients. Lancet 1980;1: 231–232.
41. Pillebout E. Thervet E, Hill, et al. Henoch-Schönlein purpura in adults: outcome and prognostic factors. J. Am. Soc. Nephrol. 2002;13: 1271–1278.
42. Thervet E, Pillebout E, Guillevin L. Outcome after childhood Henoch-Schönlein purpura. Lancet 2003;361: 81.
43. Coppo R, Mazzucco G, Cagnoli L, et al. Long-term prognosis of Henoch-Schönlein nephritis in adults and children. Nephrol. Dial. Transplant. 1997;12: 2277–2283.
44. Buchanec J, Minárik M. Jak léčit Schoenleinovu (Schönleinovu)-Henochovu anafylaktoidnú purpuru? [Dotazy a odpovědi]. Čes.-slov. Pediat. 2000;55: 478–480.
45. Reinehr T, Burk G, Werner A. Does steroid treatment of abdominal pain prevent renal involvement in Henoch-Schönlein purpura? J. Pediatr. Gastroenterol. Nutr. 2000;31: 323–325.
46. Mollica F, Li Volti S, Garozzo R, et al. Effectiveness of early prednisone therapy in preventing the development of nephropathy in anaphylactoid purpura. Eur. J. Pediatr. 1992;151: 140–144.
47. Buchanec J, Galanda V, Belakova S, et al. Incidence of renal complications in Schoenlein-Henoch purpura syndrome in dependence of an early administration of steroids. Int. Urol. Nephrol. 1988;20: 409–412.
48. Buchanec J, Galanda V, Belaková S, et al. Možno zabrániť nefropatii pri Schoenleinovej purpure včasným podaním prednisonu? Čes.-slov. Pediat. 1989;44: 145–146.
49. Buchanec J, Zibolen M, Hyrdelová E, et al. Možná prevencia vzniku nefropatie pri Schoenlein-Henochovej purpure včasným podaním prednisonu – dôvody pre a proti. Čes.-slov. Pediat. 1998;53: 256–259.
50. Reinehr T, Burk G, Berger T, et al. Steroids for prophylaxis of nephropathy in Schönlein-Henoch purpura? Follow-up of 171 patients. Klin. Pädiatr. 2000;212: 99–102.
51. Szelid Z, Bereczky J, Nagymanyai Z, et al. Heparin prophylaxis of Henoch-Schoenlein nephropathy. Acta. Paediatr. Hung. 1986;27: 57–60.
52. Bona G, Monti G. Schönlein-Henoch syndrome in children. Clinico-epidemiological analysis of 170 cases. Minerva Pediatr. 1989;41: 587–592.
53. Huber AM, King J, McLaine P, et al. A randomized, placebo controlled trial of prednisone in early Henoch-Schönlein purpura. BMC Med. 2004;2: 7–14.
54. Counahan R, Winterborn MH, White RHR, et al. Prognosis of Henoch-Schönlein nephritis in children. Brit. Med. J. 1977;2: 11–14.
55. Sano H, Izumida M, Shimizu H, et al. Risk factors for renal involvement and significant proteinuria in Henoch-Schönlein purpura. Eur. J. Pediatr. 2002;161: 196–201.
56. Temmel AFP, Emminger W, Schroth B, et al. Early prednisone therapy and nephropathy in anaphylactoid purpura. Eur. J. Pediatr. 1993;152: 782–783.
57. Feber J, Dušek J, Janda J. Preventivní podání kortikoidu u Henoch-Schoenleinovy purpury. In Jurko A, et al. Diagnostika a terapia v pediatrii III. Martin: JLF UK, 1996: 41–42.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorastČlánok vyšiel v časopise
Česko-slovenská pediatrie

2008 Číslo 10
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- Využití hodnoticích skóre a objektivních nástrojů při léčbě astmatu
- Nech brouka žít… Ať žije astma!
Najčítanejšie v tomto čísle
- Henochova-Schönleinova purpura z pohľadu preventívneho podávania kortikoidov
- Hodnotenie klinických príznakov intrakraniálnej hypertenzie vo vzťahu k indikácii drenážneho výkonu u novorodencov a dojčiat s hydrocefalom
- Prader-Williho syndróm u novorodenca – dve kazuistiky
- Heterotopia žalúdočnej sliznice – literárny prehľad a naše skúsenosti
