-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti manažmentu diabetickej neuropatie v detskom veku
Possible Management of Diabetic Neuropathy in Childhood
Diabetic neuropathy (DN) presents one of the most common chronic complications of diabetes mellitus (DM). Incidence of DN depends on metabolic control and duration of diabetes, however genetic and other factors are very important, too. Several pathways of neuropathy onset and development have been found – polyol pathway, non-enzymatic glycation of proteins, oxidative stress, decreased function of trans-membrane pump Na+K+ATP-ase, lower concentration of neural growth factor (NGF), activation of protein-kinase C and others. These processes lead to functional or structural damage of nerves either directly or through vasa nervorum microangiopathy.
In childhood, subclinical forms and cardiovascular autonomic neuropathy are often met. The therapy of DN is despite of extensive trials still insufficient. Diabetes control is regarded as the only proved therapeutic intervention improving chronic diabetic complications. Using of thioctic acid and vitamins group B is quite frequent however the beneficial effect is controversial. Other possible interventions are in experimental trials, till now. Recent studies have proved beneficial influence of C-peptide substitution which can increase Na+K+ATP-ase function and prevent development of microangiopathy vasa nervorum by induction of NO-synthetase. Inhibitors of aldose-reductase (epalrestat, fidarestat) inhibit the rate-limiting enzyme in polyol pathway. Low amount of NGF can be influenced by its substitution or stimulation by all-trans retinoic acid. Capturers of carbonyl groups (pyridoxamine, aminoguanidine) act in prevention of advanced glycation end products origin. Protein-kinase C activity can be influenced by its inhibitors (ruboxistaurin). New possibility in future therapy presents therapy “made-to-measure” according to known gene polymorphisms for certain enzymes.
Unfortunately, despite extensive theoretical knowledge, practical possibilities with proved beneficial effect on DN consist in optimal diabetes control. Thioctacid and vitamins have only supportive effect. Additional clinic studies are necessary to confirm the benefit of other methods.Key words:
diabetic neuropathy, glycemic control, pathogenesis, therapy
Autoři: J. Vojtková; P. Ďurdík; M. Čiljaková; L. Vojarová; Peter Bánovčin
Působiště autorů: Klinika detí a dorastu, Jesseniova lekárska fakulta Univerzity Komenského a Martinská fakultná nemocnica, Martin prednosta prof. MUDr. P. Bánovčin, CSc.
Vyšlo v časopise: Čes-slov Pediat 2010; 65 (4): 186-194.
Kategorie: Přehledový článek
Souhrn
Diabetická neuropatia (DN) je jednou z najčastejších chronických komplikácií ochorenia diabetes mellitus (DM). Výskyt DN súvisí s kompenzovanosťou a s trvaním diabetu, veľký význam majú aj genetické a iné faktory. Popisované sú viaceré patologické cesty vzniku a rozvoja DN – polyolová cesta, neenzýmová glykácia proteínov, oxidačný stres, zníženie funkcie transmembránovej pumpy Na+K+ATP-ázy, zníženie neurálneho rastového faktora (NGF), aktivácia proteín kinázy C a iné. Tieto procesy buď priamo alebo prostredníctvom mikroangiopatie vasa nervorum vedú k funkčnému a štrukturálnemu poškodeniu nervových vlákien.
V detskom veku sa často stretávame so subklinickými formami DN a s kardiovaskulárnou autonómnou neuropatiou. Liečba DN je napriek rozsiahlemu výskumu stále nedostatočná. Jediným dokázaným liečebným zásahom ovplyvňujúcim chronické diabetické komplikácie je udržanie kompenzovanosti diabetu. Obvyklé je podávanie kyseliny thiooktovej a vitamínov skupiny B, avšak ich efekt je kontroverzný. Ďalšie nádejné možnosti terapeutického ovplyvnenia sú v rovine experimentálnej. Nedávne štúdie ukázali prospešný vplyv substitúcie C-peptidu, ktorý zvyšuje funkciu Na+K+ATP-ázy a indukciou NO-syntázy zabraňuje vzniku mikroangiopatie vasa nervorum. Inhibítory aldózoreduktázy (epalrestat, fidarestat) inhibujú rýchlosť-limitujúci enzým polyolovej cesty. Nízka hladina NGF môže byť ovplyvnená jeho substitúciou, alebo stimuláciou jeho tvorby kyselinou all-trans retinovou. Ako prevencia vzniku produktov neenzýmovej glykácie proteínov pôsobia vychytávače karbonylových skupín, napr. pyridoxamín, aminoguanidín. Aktivitu proteín kinázy C je možné ovplyvniť jej inhibítormi (ruboxistaurín). Nové možnosti terapie v budúcnosti predstavuje terapia „na mieru“ podľa poznania konkrétnych génových polymorfizmov pre jednotlivé enzýmy patologických ciest.
Napriek rozsiahlym teoretickým možnostiam spočívajú súčasné efektívne postupy ovplyvnenia DN jedine v udržaní kompenzovanosti DM. Kyselina thiooktová a B vitamíny majú len podporný význam. Na potvrdenie účinnosti ďalších postupov sú potrebné širšie klinické štúdie.Kľúčové slová:
diabetická neuropatia, kompenzovanosť, patofyziológia, terapiaÚvod
Diabetes mellitus (DM) je chronické metabolické ochorenie stávajúce sa pandémiou. V súčasnosti žije na svete viac ako 250 miliónov ľudí a z toho asi 430 000 detí, ktorí trpia ochorením diabetes mellitus. Podľa Svetovej zdravotníckej organizácie incidencia DM 1. typu stúpa každoročne o 3 % u detí školského veku a adolescentov a až o 5 % u detí predškolského veku. Prevalencia diabetes mellitus 1. typu u detí do 14 rokov bola v roku 1998 na Slovensku 51,7/100 000, incidencia 10,5/100 000 [1]. Alarmujúci je aj údaj o zvyšujúcej sa prevalencii 2. typu DM u adolescentov a detí, ktorý súvisí so zvyšujúcim sa výskytom obezity už v tomto veku.
Chronické diabetické komplikácie sú dôvodom častejšej chorobnosti, častejšej hospitalizácie diabetikov a podieľajú sa na skrátení predpokladanej dĺžky života o 25–50 %. Chronické komplikácie nie sú doménou len dospelého veku, v súvislosti s včasným nástupom diabetu sa s nimi stretávame aj u detí a adolescentov.
Jednou z najčastejších chronických komplikácií je diabetická neuropatia (DN), charakterizovaná funkčným až štrukturálnym poškodením nervových vlákien. Môže sa vyskytnúť ako polyneuropatia, mononeuropatia alebo autonómna neuropatia. Výskyt DN súvisí s dĺžkou trvania diabetu a s úrovňou metabolickej kompenzácie. Uvádza sa, že 40–90 % diabetikov s trvaním DM desať a viac rokov má určitú formu DN, dokonca 5–10 % diabetikov má známky neuropatie už rok po stanovení diagnózy DM [2]. Existujú prípady, keď známky DN sú prítomné už v čase stanovenia diagnózy diabetu, a to nie len v prípade 2. typu DM, ktorému často predchádza prediabetické štádium, ale aj v prípade 1. typu.
Na rozdiel od dospelých sú u detí častejšie subklinické formy neuropatie. Pomerne častou formou neuropatie v detskom veku je autonómna neuropatia, s príznakmi pokojovej tachykardie, ortostatickej hypotenzie, gastroparézy alebo asymptomatickej hypoglykémie. V prípade klinických foriem senzomotorickej DN ide napr. o pocit mravenčenia, pálenia prstov, poruchy pohyblivosti kĺbov a iné. Údaje v literatúre o výskyte DN u detí sa líšia podľa použitých kritérií, pohybujú sa od 40 do 80 % [3].
U diabetikov 1. typu sa uvádza výskyt diabetickej retinopatie v 2–7 % po dvoch rokoch od stanovenia diagnózy, v 50 % po 10 rokoch a až v 75 % pri trvaní DM 20 a viac rokov [2]. U detí je vývoj retinopatie veľmi pravdepodobný už o 6 rokov po diagnostikovaní DM s prevalenciou okolo 24 % [4]. U 30 % diabetikov s trvaním DM 20 a viac rokov sa objaví klinicky manifestná diabetická nefropatia. Adolescenti s DM 2. typu majú vyššie riziko vzniku mikroalbuminúrie a hypertenzie v porovnaní s rovesníkmi s 1. typom DM [5].
Patofyziológia
Patofyziológia DN je komplexná a v súčasnosti nie úplne objasnená. Dlhodobá hyperglykémia spúšťa kaskádu dejov, ktoré pôsobia vo vzájomnej interakcii [6]. Ide o neenzýmovú glykáciu proteínov, polyolovú cestu, oxidačný stres, zníženie množstva nervového rastového faktoru (NGF), zníženie C-peptidu, zníženie funkcie Na+K+ATP-ázy, aktiváciu proteín kinázy C a iné.
Produkty neenzýmovej glykácie proteínov (advanced glycation end products, AGEP´s) sú heterogénnou skupinou modifikovaných proteínov, lipidov a nukleových kyselín, ktoré vznikajú v podmienkach intracelulárnej hyperglykémie primárne neenzymatickou (Maillardovou) reakciou. Modifikované substráty strácajú svoju funkciu. Po naviazaní AGEP´s na receptory pre AGEP´s (RAGE) sa spúšťa kaskáda procesov – aktivácia nukleárneho faktora NF-κB, aktivácia cytokínov, pro-koagulačných a prozápalových faktorov, ktorá vedie k zvýšenej kapilárnej permeabilite.
Významným patofyziologickým faktorom je oxidačný stres. Reaktívne formy kyslíka, najmä superoxidový anión, prostredníctvom poškodenia endotelových buniek spôsobujú diabetickú mikroangiopatiu. V podmienkach hyperglykémie sú endotelové bunky vystavené väčšiemu obratu glukózy, čo má za následok väčší transport elektrónov cez mitochondriálnu membránu. Následne, elektrónovo preťažená mitochondria produkuje významné množstvo superoxidových aniónov, ktoré vedú k zníženiu oxidu dusnatého, k poškodeniu DNA, formácii produktov neenzýmovej glykácie proteínov, k aktivácii proteín kinázy C a k aktivácii polyolovej cesty.
Zvýšená intracelulárna koncentrácia glukózy zvyšuje aktivitu aldózoreduktázy (rýchlosť limitujúci enzým polyolovej cesty), ktorou je glukóza za využitia NADPH ako kofaktora redukovaná na sorbitol a následne na fruktózu. Za fyziologických podmienok má polyolová cesta dôležitú úlohu v redukcii toxických aldehydov na inaktívne alkoholy. Aldózoreduktáza má za podmienok euglykémie nízku afinitu ku glukóze. Zvýšením aktivity aldózoreduktázy sa signifikantne zníži koncentrácia NADPH, ktorý je potrebný aj pre aktivitu glutatiónreduktázy (významný enzým redukujúci oxidačný stres). Znížená hladina NADPH a následne znížená aktivita glutationreduktázy zvyšuje intracelulárny oxidačný stres a vedie k bunkovému poškodeniu. Okrem toho, akumulácia sorbitolu a fruktózy vedie k zníženiu myoinozitolu v nervových vláknach, k zníženiu aktivity membránovej Na+K+ATP-ázovej aktivity a k poškodeniu axonálneho transportu. Určité polymorfizmy enzýmu aldózoreduktázy vedú k rýchlejšiemu vzniku DN [7].
C-peptid sa tvorí v beta bunkách pankreasu spolu s inzulínom a keďže je len minimálne metabolizovaný pečeňou, používa sa ako marker endogénnej sekrécie inzulínu. Tvrdenia, že ide o metabolicky inaktívnu molekulu, sú v súčasnosti prekonané. V skutočnosti ide o biologicky veľmi aktívny peptid. Naviazanie C-peptidu na doteraz neidentifikovaný bunkový receptor má za následok aktiváciu G-proteínov, zvýšenie koncentrácie intracelulárneho vápnika Ca2+, zvýšenie aktivity proteínkinázy-C, MAP-kinázy, zvýšenie množstva transkripčných faktorov NF-κB, c-Fos, nukleárneho receptora PPARγ, antiapoptotického onkoproteínu Bc12. Na celulárnej úrovni zvýšením aktivity Na+K+ATP-ázy zlepšuje nervovú funkciu a deformabilitu erytrocytov, indukciou NO-syntázy zlepšuje endoteliálnu funkciu a zabraňuje vzniku mikroangiopatie vasa nervorum, inhibíciou expresie adhezívnych molekúl (P-selektínu a ICAM1) má antitrombotický efekt. C-peptid zvýšením koncentrácie Bc12 inhibuje apoptózu a v obličkách nie úplne objasneným mechanizmom znižuje glomerulárnu hyperfiltráciu.
Proteín-kináza C (PKC) patrí do rodiny kináz, ktoré sú zodpovedné za intracelulárnu signalizáciu v systéme kardiovaskulárnom, imunologickom či inom. Aktivátorom väčšiny z izoforiem PKC je diacylglycerol (DAG). De novo formácia DAG je zvýšená pri vyššej hladine intracelulárnej glukózy, čo má za následok zvýšenú aktivitu izoforiem PKC-β1/2 a PKC-δ. PKC môže byť aktivovaná aj cez niektoré rastové faktory, hyperglykémiou indukovaný superoxid a produkty neenzýmovej glykácie proteínov. Izoformy PKC-β1 a 2 zhoršujú krvný prietok retinou a obličkami, zvyšujú kapilárny únik, indukujú produkciu extracelulárnej matrix a aktivujú rôzne prozápalové cytokíny, čím prispievajú k mikrovaskulárnemu poškodeniu.
V patogenéze DN hrá úlohu aj nízka hladina nervového rastového faktora (NGF). Spoločným menovateľom patomechanizmov je dysfunkcia endotelových buniek s poruchou syntézy alebo uvoľňovania oxidu dusnatého (NO) a následná mikroangiopatia vasa nervovum, ktorá sa okrem priameho poškodenia nervových vlákien takisto podieľa na vzniku diabetickej neuropatie.
Rizikové faktory
Významnú úlohu kompenzácie diabetu na vývoj chronických diabetických komplikácií dokázala multicentrická randomizovaná štúdia Diabetes Control and Complication Trial (DCCT) v rokoch 1983–1993 [8]. Zapojilo sa do nej 1441 pacientov s DM 1. typu (s trvaním 1–15 rokov) rozdelených na dve skupiny, podľa liečby konvenčným alebo intenzifikovaným inuzlínovým režimom. Nezúčastnili sa jej deti mladšie ako 13 rokov, ale zahrnutých bolo 195 adolescentov. V skupine liečenej intenzifikovaným inzulínovým režimom bol signifikantne nižší výskyt mikro - aj makrovaskulárnych komplikácií oproti konvenčne liečenej skupine.
Väčšina pacientov sa zúčastnila následnej štúdie Epidemiology of Diabetes Interventions and Complications (EDIC), kde boli všetci liečení intenzifikovaným režimom. Po štyroch rokoch štúdie EDIC bol stále výrazne vyšší výskyt komplikácií u diabetikov liečených pôvodne konvenčne, napriek súčasnej dobrej kompenzácii. V podskupine adolescentov viedla intenzifikovaná terapia k zníženiu rizika vzniku retinopatie o 53 %, neuropatie o 60 % a mikroalbuminúrie o 60 %.
Pri ďalšom sledovaní adolescentov v rámci EDIC sa tieto rozdiely zvýraznili – v skupine liečenej od začiatku intenzívne bol o 74 % menší výskyt retinopatie, o 48 % nižší výskyt mikroalbuminúrie oproti pacientom liečeným v prvej fáze konvenčne. Táto štúdia ukázala tzv. „efekt metabolickej pamäti“, kedy každé obdobie zhoršenej kompenzácie môže mať negatívny dopad na prognózu diabetika. Niektoré štúdie s menším počtom pacientov nepotvrdili významnú asociáciu kompenzácie DM a chronických komplikácií [9].
Za významný rizikový faktor vývoja chronických komplikácií sa považuje trvanie DM. V najväčšej štúdii so zameraním na chronické diabetické komplikácie EURODIAB IDDM Complication Study [10], do ktorej sa zapojilo 3250 pacientov s DM 1. typu vo veku 15–60 rokov, bola potvrdená signifikantná korelácia medzi trvaním diabetu a autonómnou neuropatiou, ktorá bola stanovená na základe aspoň jedného patologického výsledku v dvoch kardiovaskulárnych testoch (variabilita srdcovej frekvencie, pokles systolického tlaku počas ortostázy). V niektorých štúdiách nebola potvrdená takáto korelácia [11], čo môže byť spôsobené rozdielnou metodikou a nižším počtom pacientov.
Boli identifikované aj ďalšie rizikové faktory – vzostup diastolického tlaku krvi ≥90 mmHg, zvýšená triacylglycerolémia >1,7 mmol/l, znížená hladina sérového HDL cholesterolu <1,0 mmol/l, mikroalbuminúria >20 μg/min, vyšší body mass index, prítomnosť retinopatie, fajčenia a obdobie puberty [12]. Kontrola diabetu v prepubertálnom období má nižší vply na rozvoj komplikácií v porovnaní s obdobím po gonadarché.
Adolescenti s diabetom majú vyššie riziko rozvoja do progresívnych štádií retinopatie v porovnaní s dospelými [13]. U mnohých adolescentov s DM 1. typu dochádza k zhoršeniu kompenzácie často kvôli endokrinným zmenám v puberte, ktoré vedú k vzostupu inzulínovej rezistencie (rastový faktor podobný inzulínu – IGF, sexuálne hormóny) [14], ale aj kvôli nadmernému príjmu potravy, nedostatku fyzickej aktivity, kvôli nedodržiavaniu inzulínového režimu a rizikovému správaniu (alkohol, fajčenie, drogy, antikoncepcia).
Okrem pretrvávajúcej hyperglykémie [15] je významným rizikovým faktorom genetická predispozícia jedinca na podklade génových polymorfizmov pre enzýmy zapojené do patomechanizmov vzniku a vývoja DN [7]. Pravdepodobne existujú ďalšie faktory – imunologické, epigenetické a iné, ktoré v súčasnosti nie sú objasnené. Týmto spôsobom by bola vysvetlená klinická skúsenosť, že niektorí pacienti napriek dlhému trvaniu DM a zlej kompenzácii známky DN nemajú, a naopak – u časti pacientov s dobrou kompenzáciou a krátkym trvaním DM je DN prítomná.
Diagnostika
Paleta diagnostických možností je rôznorodá, svojimi možnosťami presahuje zámer a rozsah tejto publikácie. Podľa odporúčania American Diabetes Association (ADA) z roku 1988 je pre diagnostiku DN nutná pozitivita aspoň jedného z piatich parametrov – symptómy, neurologické vyšetrenie, testovanie kvantitatívnych senzorických funkcií, kondukčné nervové vyšetrenie a kvantitatívne vyšetrenie autonómnych funkcií [16].
Podľa Českej diabetologickej spoločnosti pre diagnostiku senzitívno-motorickej DN svedčí prítomnosť troch kritérií – subjektívnych príznakov, objektívneho nálezu a elektrodiagnostiky, pričom v ambulancii diabetológa je postačujúce vyšetrenie prvých dvoch faktorov [17]. Zistenie subjektívnych príznakov môže uľahčiť špeciálny dotazník, na základe ktorého je možné vysloviť podozrenie na DN, avšak jeho špecificita a senzitivita je nízka.
Dôkladné klinické vyšetrenie zahŕňa vyšetrenie vibračnej citlivosti (128 Hz ladičkou), dotykovej citlivosti (10 g monofilamentom), vyšetrenie neurologických reflexov (Achillovej šľachy), teploty končatín [18]. Dôležité je vyšetrenie nôh – prítomnosť vredov, mozoľov, deformít a vylúčenie nediabetických príčin (hypovitaminózy, hypotyreózy, urémie, alkoholizmu). Vyšetrenie nôh je vysoko odporúčané aj v detskom veku. Podľa [19] až 532 z 557 diabetických detí trpelo určitými formami porúch – v 68,8 % išlo o reverzibilné zmeny kože a nechtov a v 31,2 % o štrukturálne muskuloskeletálne poruchy. Elektrofyziologické vyšetrenia (vyšetrenie rýchlosti nervovej konduktivity) sú nápomocné najmä pri diagnostike mononeuropatií.
Za zlatý štandard v diagnostike autonómnej neuropatie je považované vyšetrenie variability srdcovej frekvencie (VSF) [20, 21, 22]. Novým prístupom v diagnostike je stanovenie génových polymorfizmov, čím je možné stanoviť predispozíciu konkrétneho pacienta k vývoju DN a do budúcnosti dať základ pre terapiu „šitú na mieru“.
Terapeutické možnosti
Napriek početným experimentálnym a klinickým štúdiám zostáva terapia DN z veľkej miery nedostatočná. Jediným možným terapeutickým ovplyvnením, ktoré je zároveň aj klinicky overené, je dostatočná kompenzácia diabetu [23]. V najväčšej štúdii so zameraním na chronické diabetické komplikácie EURODIAB IDDM Complications Study bola potvrdená signifikantná korelácia medzi hladinou glykozylovaného hemoglobínu a kardiovaskulárnou autonómnou neuropatiou. Napriek tomu, že tento vzťah niektoré práce popierajú [9], je udržanie optimálnej glykémie silne odporúčané v prevencii vzniku diabetických komplikácií.
Detskí diabetickí pacienti sú od začiatku stanovenia diagnózy liečení intenzifikovaným inzulínovým režimom. Pacienti so zlou kompenzáciou sú plne indikovaní na liečbu inzulínovou pumpou, ktorá zatiaľ najlepšie napodobňuje prirodzenú sekréciu inzulínu pankreasom. K udržaniu euglykémie prispieva dostatočná fyzická aktivita, režimové a diétne opatrenia. Medzi jedlá, ktoré by diabetici mali požívať veľmi striedmo, patria nielen potraviny s vysokým obsahom rafinovaného cukru, ale aj jedlá so zvýšeným obsahom tuku a jedlá pripravované pri vysokej teplote (vyprážané, grilované), pretože sa vyznačujú nadmerným obsahom AGEP´s [24]. Naopak, ovocie, zelenina a jedlá upravené varom obsahujú menšie množstvo týchto produktov.
Podporná a doplnková liečba
U diabetikov s diagnostikovanou DN je zaužívané podávanie preparátov kyseliny thiooktovej (alfa-lipoovej) [25]. Ide o antioxidant, ktorý pôsobí ako koenzým oxidatívnej dekarboxylácie alfa-ketokyselín. V metabolizme sa ľahko premieňa z oxidatívnej formy na redukujúcu dihydroformu, z čoho vyplýva jej antioxidatívny potenciál. Metaanalýza 1258 pacientov preukázala zlepšenie neurologických symptómov DN po infúznej liečbe alfa-lipoovou kyselinou (600 mg i.v./deň) [26]. Na rozdiel od intravenózneho podávania, zlepšenie symptómov po perorálnom podaní nie je také jednoznačné. U 40 adolescentov s DM nebol zaznamenaný žiaden pokles kvantitatívnych markerov oxidačného stresu, zmeny v hladine glykozylovaného hemoglobínu ani mikroalbuminúrie [27] po trojmesačnom perorálnom podávaní kyseliny thiooktovej.
L-karnitín je bežne dostupný výživový doplnok. Jeho funkcia je v transporte mastných kyselín z cytoplazmy do mitochondrií, čím napomáha ich utilizácii. Má aj antioxidačný účinok – v prevencii lipooxidácie mastných kyselín. U 34 z 51 detských pacientov s DM typ 1 (priemerný vek 12 rokov) bola vyšetrením vodivosti nervovými vláknami zistená diabetická neuropatia. Po dvojmesačnom liečení týchto pacientov L-karnitínom (dávka 2 g/m2/deň) bolo zaznamenané 44% zlepšenie nervovej vodivosti u jedincov s včasným štádiom DN (bez neurologických príznakov) [28].
Z ostatných dostupných liečív sú ako doplnková liečba používané vitamíny skupiny B. Vitamín B6 (pyridoxamín) pôsobí ako vychytávač karbonylových skupín, čím znižuje vznik AGEP´s. Benfotiamín (vitamín B1) je derivát tiamínu rozpustný v tukoch, čím je dosiahnutá vyššia biologická dostupnosť [29]. Tiamín aj benfotiamín sú kofaktorom enzýmu transketolázy, ktorý je dôležitý enzým pentózo-fosfátovej cesty, pri ktorej sa odbúravajú niektoré produkty glykolýzy, čím sa predíde aktivácii metabolických ciest poškodzovania tkanív (formácia AGEP´s, aktivácia proteín kinázy C a iné).
Vhodné je aj podávanie oleja z boráka lekárskeho alebo pupalkového oleja s obsahom kyseliny gama linolénovej (omega 6 polynenasýtená esenciálna mastná kyselina), ktorá je významnou zložkou fosfolipidov v membráne a má protizápalový, antitrombotický a antiaterogénny účinok [30].
Klasické antioxidanty (vitamíny C, E) pôsobia primárne neenzymaticky, dokážu vychytávať len časť koncových produktov oxidačného stresu, čo vysvetľuje ich slabý účinok pri prevencii diabetických komplikácií.
Symptomatická liečba
Ďalšie možnosti liečby DN sú v zmysle liečenia jednotlivých symptómov. Podľa doporučenia ADA [18] bolestivú formu neuropatie je možné ovplyvniť tricyklickými antidepresívami (napr. amitryptilín, v dávke 25–100 mg). Kvôli vedľajším anticholinergným a centrálnym účinkom je ich použitie u niektorých jedincov limitované.
Zo skupiny antikonvulzív sú používané gabapentín (1,8 g/deň) a pregabalín [2]. Nesteroidné antiflogistiká (ibuprofen, naproxen, indometacín) sa doporučuje užívať kvôli ich nežiadúcim účinkom len krátkodobo.
U detských pacientov je bolestivá forma zriedkavá, preto aj použitie týchto liečív u detí nie je obvyklé. Príznaky diabetickej autonómnej neuropatie je možné zmierniť beta-blokátormi, ACE-inhibítormi. Ďalšia symptomatická liečba je uvedená v tabuľke 1.
Tab. 1. Symptomatická liečba diabetickej neuropatie. 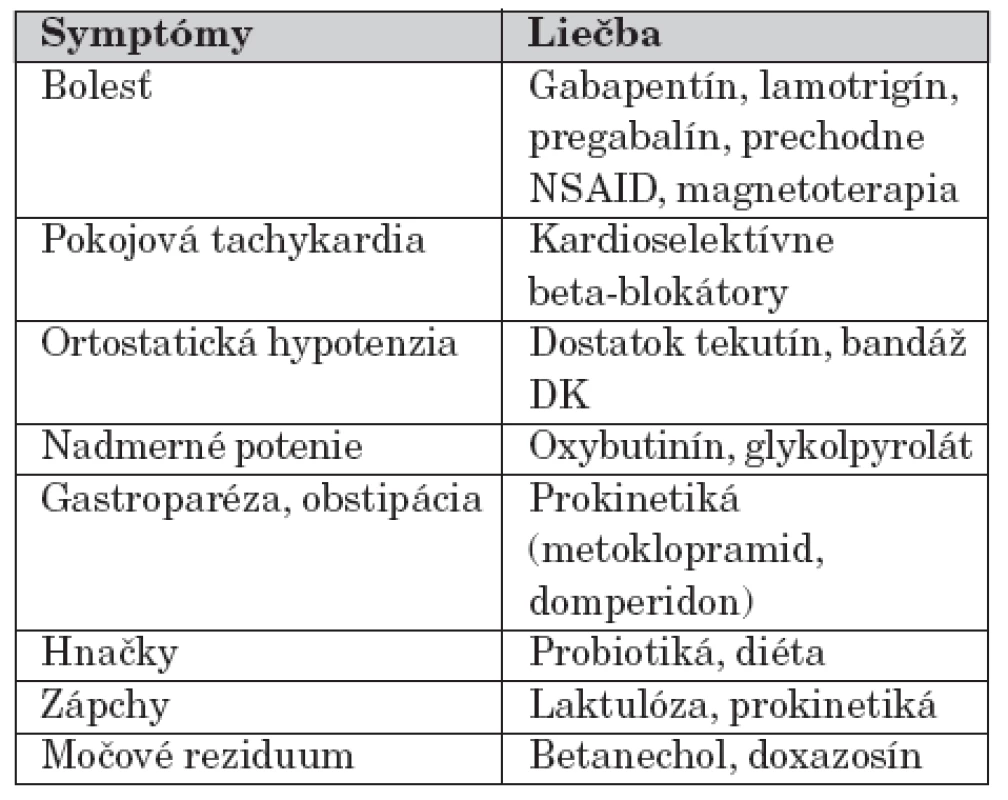
Terapia v klinických a experimentálnych štúdiách
Ďalšie terapeutické možnosti sú zatiaľ v rovine experimentálnej, v nasledujúcej časti je zhrnutý ich prehľad (tab. 2). Množstvo liečiv účinných na zvieracích modeloch nebolo aplikovaných humánne, preto nemožno jednoznačne dokázať ich liečivý efekt. Veľkým nedostatkom spomenutých štúdií je chýbanie klinického overovania na detskej populácii.
Tab. 2. Terapeutické možnosti ovplyvnenia diabetickej neuropatie podľa patofyziológie. 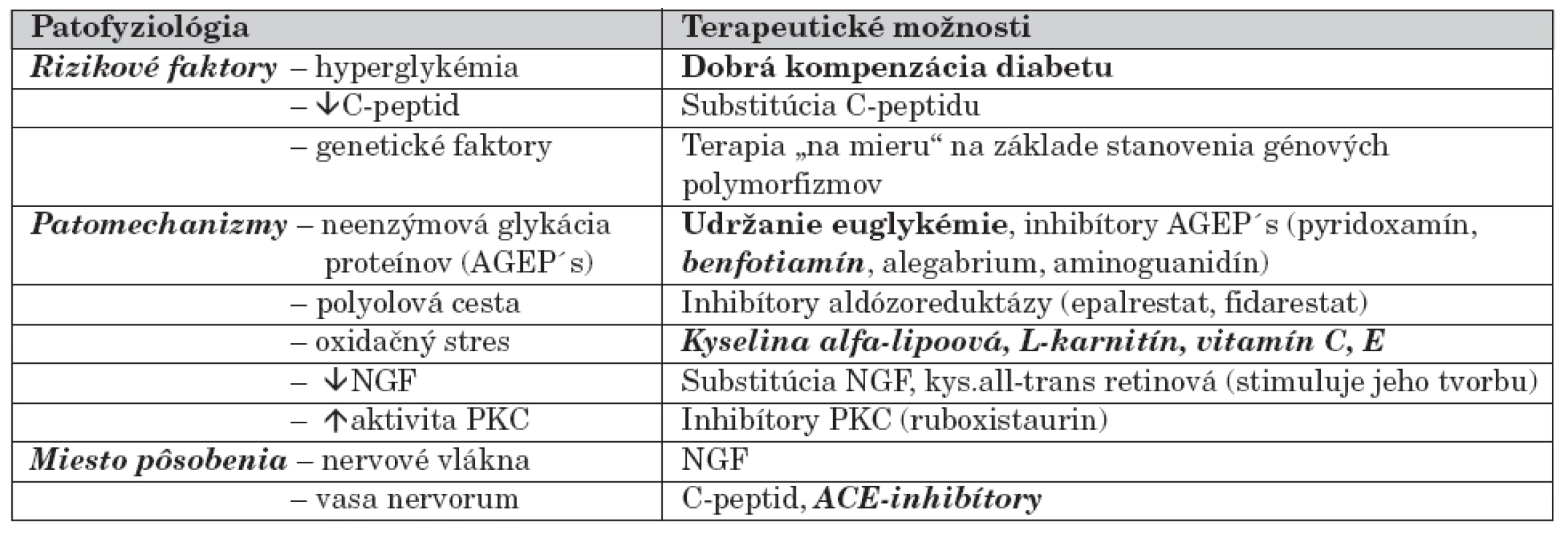
(písmo bold – overená účinnosť terapie, písmo bold a italica – podporná liečba s nejednoznačným účinkom, obyčajné písmo – liečivá v experimentálnych štúdiách) (AGEP´s – produkty neenzýmovej glykácie proteínov, PKC – proteín kináza C, NGF – nervový rastový faktor) Aminoguanidín je hydrazínový derivát, ktorý má schopnosť väzby reaktívnych karbonylových skupín, čím predchádza formácii AGEP´s [31]. Je dostupný na americkom trhu (obchodný názov Pimagidine, 75 mg) ako výživový doplnok proti starnutiu a proti vzniku diabetických komplikácií. Podľa dvojito-slepej randomizovanej štúdie [32], do ktorej sa zapojilo 690 diabetikov 1. typu, mal aminouanidín v dávke 150–300 mg počas 2–4 rokov priaznivý vplyv na vznik diabetickej nefropatie. Existujú štúdie, ktoré popierajú jeho terapeutický efekt [33].
Alagebrium chlorid (ALT-711) štiepi AGEP´s a kovalentné väzby medzi proteínmi a glukózou, čím podporuje odbúravanie AGEP´s [34]. V klinickej štúdii [35] po podávaní alagebria v dávke 210 mg p.o. denne 62 pacientom s arteriálnou hypertenziou došlo k signifikantnému vzrastu arteriálnej poddajnosti v porovnaní so skupinou hypertonikov liečených placebom. Peppa a kol. [36] vo svojej klinickej štúdii podávali diabetickým myšiam 1 mg/kg denne alagebrium, čo malo za následok zníženie produktov neenzýmovej glykácie proteínov v sére a zníženie mikroalbuminúrie. Predpokladaný je aj efekt na diabetickú neuropatiu, hoci je potrebný ďalší výskum na potvrdenie tohto účinku.
Nedávne štúdie ukázali prospešný vplyv substitúcie C-peptidu [37]. Dvojito-slepej placebom kontrolovanej štúdie sa zúčastnilo 46 dospelých pacientov s diabetes mellitus 1. typu s včasným štádiom DN. Po 3-mesačnej terapii C-peptidom (1,8 mg/deň) spolu s inzulínovou substitúciou došlo k zlepšeniu funkcií nervového systému.
Inhibítory aldózoreduktázy priamo zasahujú do patofyziologického procesu formácie sorbitolu a fruktózy polyolovou cestou. Epalrestat, ranirestat či fidarestat signifikantne zlepšujú periférnu neuropatiu u diabetikov [38, 39]. V klinickej štúdii [40] bolo 289 dospelých diabetikov (typ 1 aj 2) počas 3 rokov liečených epalrestatom (50 mg 3x denne p.o.). Oproti skupine 305 pacientov, ktorým bolo podávané placebo, došlo k signifikantnému zlepšeniu prejavov DN. Na bežnom trhu liek nie je dostupný.
Ruboxistaurín, selektívny PKC-β inhibítor, dokázateľne zlepšuje cirkulačné parametre sietnice a znižuje makulárny edém, redukuje mikroalbuminúriu a zlepšuje symptómy diabetickej neuropatie u pacientov s menej závažnou DN [41]. Podávanie 32 mg/deň ruboxistaurínu počas 6 mesiacov u 20 dospelých pacientov s DM 1. aj 2. typu malo za následok signifikantné zlepšenie symptómov neuropatie oproti kontrolnej skupine 20 diabetikov, ktorým bolo podávané placebo [42]. V Japonsku je ruboxistaurín farmaceuticky vyrábaný na liečbu diabetickej neuropatie, retinopatie a makulárneho edému. V Amerike a Európe je zatiaľ používaný v klinických štúdiách. V roku 2006 bol podaný návrh na schválenie jeho používania ako lieku, na schválenie sa stále čaká.
Apfel et al. [43] však vo svojej štúdii zistili, že subkutánne podávanie rekombinantného ľudského neurálneho rastového faktora (NGF) počas 48 týždňov nezlepšilo funkciu nervového systému u diabetikov.
Hernandez-Pedro et al. [44] v experimentálnych podmienkach zistili pozitívny výsledok podávaním kyseliny all-trans retinovej, ktorá stimuluje tvorbu NGF. Zaujímavou štúdiou je aj podávanie monosialického gangliozidu GM1, ktorý znižuje prozápalové cytokíny a zvyšuje NGF v pankreatických bunkách, čím predlžuje ich prežívanie [45].
Erytropoetín, pôvodne identifikovaný ako hematopoetický faktor, je exprimovaný aj v nervovom systéme a má pravdepodobne neuroprotektívny účinok. Chattopadhyay et al. [46] sa zaoberajú génovým transferom vektormi na báze HSV (herpes simplex virus), ktoré sa prirodzene replikujú v nervových vláknach. Zistili, že u myší s indukovaným diabetom došlo k signifikantnému zlepšeniu funkcií nervového systému po HSV-mediovanom transfere erytropoetínu.
Použitie angiogénneho rastového faktora je kontroverzné. Schratzberger et al. [47] po intramuskulárnom génovom transfere VEGF (vaskulárny endoteliálny rastový faktor) potkanom s indukovaným diabetom zistili vyššiu rýchlosť vedenia nervovými vláknami oproti kontrolnej skupine. Na druhej strane, VEGF je induktorom angiogenézy a neovaskularizácie retiny, čím spôsobuje diabetickú retinopatiu. Ranizumab a bevacizumab sú monoklonálne protilátky proti VEGF. Viaceré štúdie potvrdzujú ich úspešné použitie u pacientov s diabetickou retinopatiou s makulárnym edémom [48]. Vplyv na diabetickú neuropatiu nie je popísaný.
Neuropatickú bolesť je možné zmierniť aj použitím magnetoterapie. Weintraub et al. [49] vo svojej štúdii preukázali signifikantné zlepšenie po 3 až 4 mesiacoch nosenia magnetizovaných výstelok obuvi. Statické magnetické pole dokáže penetrovať do výšky 20 mm a ovplyvniť nociceptory v epiderme a derme. Nikolaeva et al. [50] u 45 detí vo veku 5–17 rokov s diabetickou neuropatiou popísali liečebný efekt dynamického magnetického poľa s následným zlepšením rýchlosti vedenia nervovými vláknami.
Záver
Napriek rozsiahlemu výskumu venovanému diabetickej neuropatii jediným overeným prostriedkom proti vzniku chronických komplikácií je udržanie dobrej kompenzovanosti diabetu. Používanie antioxidantov (kyseliny thiooktovej, L-karnitínu) a vitamínov skupiny B je pomerne rozšírené, avšak ich efekt je kontroverzný. Mnoho potenciálnych liečív zostáva vo fáze experimentálnych štúdií.
Reálnou nádejou DN je liečba substitúciou C-peptidu, príp. inhibítormi aldózoreduktázy. Sú však potrebné širšie klinické štúdie, ktorými sa potvrdí ich adekvátne terapeutické využitie v liečbe diabetickej neuropatie.
Práca je podporená projektom „Centrum experimentálnej a klinickej respirológie“, ktorý je spolufinancovaný zo zdojov ES.
MUDr. Jarmila Vojtková
Klinika detí a dorastu
Jesseniova lekárska fakulta Univerzity Komenského
a Martinská fakultná nemocnica
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: jarmilavojtkova@gmail.com
Zdroje
1. Mokáň M, Rozborilová E, Galajda P, et al. Vnútorné lekárstvo. 3. diel. 1. vyd. Bratislava: Vydavatelstvo UK, 2005 : 9-46.
2. Rybka J. Diabetes mellitus – komplikace a přidružená onemocnění. Diagnostické a léčebné postupy. 1. vyd. Praha: Grada Publishing, 2007 : 91–116.
3. Nordwall M, Hyllienmark L, Ludvigsson J. Early diabetic complications in a population of young patients with type 1 diabetes mellitus despite intensive treatment. J. Pediatr. Endocrinol. Metab. 2006; 19(1): 45–54.
4. Donaghue KC, Craig ME, Chan AK. Prevalence of diabetes complications 6 years after diagnosis in a incident cohort of childhood diabetes. Diabet. Med. 2005; 22(6): 711–718.
5. Eppens MC, Craig ME, Cusumano J, et al. Prevalence of diabetes complications in adolescents with type 2 compared with type 1 diabetes. Diabetes Care 2006; 29(6): 1300–1306.
6. Brownlee M. The pathobiology of diabetic complications: a unifying mechanism. Diabetes 2005; 54 : 1615–1625.
7. Donaghue KC, Margan SH, Chan AKF, et al. The association of aldose reductase gene (AKR1B1) polymorphisms with diabetic neuropathy in adolescents. Diabetic Medicine 2005; 12(10): 1315–1320.
8. DCCT Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes. N. Engl. J. Med. 1993; 329 : 977–986.
9. Javorka M, Javorkova J, Tonhajzerova I, et al. Parasympathetic versus sympathetic control of the cardiovascular system in young patients with diabetes mellitus type 1. Clin. Physiol. Funct. Imaging 2005; 25 : 270–274.
10. EURODIAB IDDM Complications Study Group. Microvascular and acute complications in IDDM patients: the EURODIAB IDDM Complication Study. Diabetologia 1994; 37(3): 278–285.
11. Scaramuzza A, Salvucci F, Leuzzi S, et al. Cardiovascular autonomic testing in adolescents with type 1 diabetes mellitus: an 18 month follow up study. Clin. Sci. 1998; 94 : 615–621.
12. Donaghue KC, Chiarelli F, Trotta D, et al. Microvascular and macrovascular complications associated with diabetes in children and adolescents. ISPAD Clinical Practice Consensus Guidelines 2009 Compendium. Pediatric Diabetes 2009; 10(Suppl 12): 195–203.
13. Maguire A, Chan A, Cusumano J, et al. The case for biennial retinopathy screening in children and adolescents. Diabetes Care 2005; 28(3): 509–513.
14. Court JM, Cameron FJ, Berg-Kelly K, et al. Diabetes in adolescence. Pediatric Diabetes 2008; 9(3): 255–262.
15. Edwards JL, Vincent AM, Cheng HT, et al. Diabetic neuropathy: Mechanisms to management. Pharmacol. Ther. 2008; 120(1): 1–34.
16. Consensus Statement. Report and recommendations of the San Antonio Conference on Diabetic neuropathy: American Diabetes Association/American Academy of Neurology. Diabetes Care 1988; 11 : 592–98.
17. Česká diabetologická společnost. Standardy diagnostiky a léčby diabetické neuropatie. Diabetologie, metabolismus, endokrinologie, výživa 2007; 10 : 215–220.
18. Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic neuropathies. A statement by the American Diabetes Association. Diabetes Care 2005; 28(4): 956–962.
19. Rasli MH, Zacharin MR. Foot problems and effectiveness of foot care education in children and adolescents with diabetes mellitus. Pediatr. Diabetes 2008; 9(6): 602–608.
20. Javorka M, Javorková J, Tonhajzerová I, et al. Heart rate variability in young patients with diabetes mellitus and healthy subjects explored by Poincaré and sequence plots. Clin. Physiol. Funct. Imaging 2005; 25(2): 119–127.
21. Tonhajzerová I, Javorka K, Petrášková M. Vývoj parametrov variability frekvencie srdca u mladých jedincov vo veku 15–19 rokov. Čes.-slov. Pediat. 1999; 8 : 421–424.
22. Javorka K, Javorka M, Javorková J. Variabilita frekvencie srdca a diabetes mellitus. In: Javorka K, et al. Variabitila frekvencie srdca. 1. vyd. Martin: Osveta, 2008 : 124–133.
23. Mokáň M, Martinka E., Galajda P, et al. Diabetes mellitus a vybrané metabolické ochorenia. 1. vyd. Turany: Vydavateľstvo P+M, 2009 : 1–1003.
24. Klenovicsová K, Saavedra G, Zumpe C, et al. Význam produktov Maillardovej reakcie v strave dojčiat. Čes.-slov. Pediat. 2008; 63(10): 565–573.
25. Ziegler D. Thioctic acid for patients with symptomatic diabetic polyneuropathy: a critical review. Treat. Endocrinol. 2004; 3(3): 173–189.
26. Ziegler D, Ametov A, Barinov A. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy. The SYDNEY 2 Trial. Diabetes Care 2006; 29 : 2365–2370.
27. Huang EA, Gitelman SE. The effect of oral alpha-lipoic acid on oxidative stress in adolescents with type 1 diabetes mellitus. Pediatric Diabetes 2008; 9 : 69–73.
28. Uzun N, Sarikava S, Uluduz D, et al. Peripheric and autonomic neuropathy in children with type 1 diabetes mellitus: the effect of L-carnitine treatment on the peripheral and autonomic nervous system. Electromyogr. Clin. Neurophysiol. 2005; 45(6): 343–351.
29. Haupt E, Ledermann H, Kopcke W. Benfotiamine in the treatment of diabetic polyneuropathy – a three-week randomized, controlled pilot study (BEDIP study). Int. J. Clin. Pharmacol. Ther. 2005; 43 : 71–77.
30. Scott JA, King GL. Oxidative stress and antioxidant treatment in diabetes. Ann. N. Y. Acad. Sci. 2004; 1031 : 204–213.
31. Thornalley PJ. Use of aminoguanidine (Pimagedine) to prevent the formation of advanced glycation endproducts. Arch. Biochem. Biophys. 2003; 419 : 31–40.
32. Bolton WK, Cattran DC, Williams ME, et al. Randomized trial of an inhibitor of formation of advenced glycation end products in diabetic nephropathy. Am. J. Nephrol. 2004; 24 : 32–40.
33. Birrell AM, Heffernan SJ, Ansselin AD, et al. Functional and structural abnormalities in the nerves of type I diabetic baboons: aminoguanidine treatment does not improve nerve function. Diabetologia 2000; 43(1): 110–116.
34. Little WC, Zile MR, Kitzman DW. The effect of alagebrium chloride (ALT-711), a novel glucose cross-link breaker, in the treatment of elderly patients with diastolic heart failure. J. Card. Fail. 2005; 11 : 191–195.
35. Kass DA, Shapiro EP, Kawaguchi M, et al. Improved arterial compliance by a novel advanced glycation end-product crosslink breaker. Circulation 2001; 104(13): 1464–1470.
36. Peppa M, Brem H, Cai W, et al. Prevention and reversal of diabetic nephropathy in db/db mice treated with alagebrium (ALT-711). Am. J. Nephrol. 2006; 26(5): 430–436.
37. Ekberg K, Brismar T, Johansson BL, et al. C-Peptide replacement therapy and sensory nerve function in type 1 diabetic neuropathy. Diabetes Care 2007; 30(1): 71–76.
38. Bril V, Buchanan RA. Long-term effects of ranirestat (AS-3201) on peripheral nerve function in patients with diabetic sensorimotor polyneuropathy. Diabetes Care 2006; 29 : 68–72.
39. Drel VR, Pachem P, Ali TK, et al. Aldose reductase inhibitor fidarestat counteracts diabetes-associated cataract formation, retina oxidative-nitrosative stress, glial activation, and apoptosis. Int. J. Mol. Med. 2008; 21(6): 667–676.
40. Hotta N, Akanuma Y, Kawamori R, et al. Long-term clinical effects of epalrestat, an aldose reductase inhibitor, on diabetic peripheral neuropathy: the 3-year, multicenter, comparative Aldose Reductase Inhibitor-Diabetes Complications Trial. Diabetes Care 2006; 29 : 1538–1544.
41. Aiello LP, Clermont A, Arora V, et al. Inhibition of PKC beta by oral administration of ruboxistaurin is well tolerated and ameliorates diabetes-induced retinal hemodynamic abnormalities in patients. Invest. Ophthalmol. Vis. Sci. 2006; 47 : 86–92.
42. Casellini CM, Barlow PM, Rice AL, et al. A 6-month, randomized, double-masked, placebo-controlled study evaluating the effects of the protein kinase C-beta inhibitor ruboxistaurin on skin microvascular blood flow and other measures of diabetic peripheral neuropathy. Diabetes Care 2007; 30(4): 896–902.
43. Apfel SC, Schwartz S, Adornato BT, et al. Efficacy and safety of recombinant human nerve growth factor in patients with diabetic polyneuropathy: A randomized controlled trial. JAMA 2000; 284 : 2215–2221.
44. Hernandez-Pedro N, Ordonez G, Ortiz-Plata A, et al. All-trans retinoic acid induces nerve regeneration and increases serum and nerve contents of neural growth factor in experimental diabetic neuropathy. Transl. Res. 2008; 152(1): 31–37.
45. Vieira KP, De Almeina E, Lima Zollner AR, et al. Ganglioside GM1 effects on the expression of nerve growth factor (NGF), Trk-A receptor, proinflammatory cytokines and on autoimmune diabetes onset in non-obese diabetic (NOD) mice. Cytokine 2008; 42(1): 92–104.
46. Chattopadhyay M, Wolfe DP, Krisky DM, et al. Gene therapy of diabetic neuropathy using HSV-mediated transfer of erythropoetin to dorsal root ganglion in vivo. Molecular Therapy 2005; 11 : 249.
47. Schratzberger P, Walter DH, Rittig K, et al. Reversal of experimental diabetic neuropathy by VEGF gene transfer. J. Clin. Invest. 2001; 107(9): 1083–1092.
48. Avery RL, Pearlman J, Pieramici DJ, et al. Intravitreal bevacizumab (Avastin) in the treatment of proliferative diabetic retinopathy. Ophthalmology 2006; 113 : 1–15.
49. Weintraub MI, Wolfe GI, Barohn RA, et al. Static magnetic field therapy for symptomatic diabetic neuropathy: A randomized, double-blind, placebo-controlled trial. Arch. Phys. Med. Rehabil. 2008; 84(5): 736–746.
50. Nikolaeva NV, Bolotova V, Lukianov VF, et al. Non-pharmacological treatment of microcirculation disturbance in children with diabetic polyneuropathy. Zh. Nevrol. Psikhiatr. Im. S. S. Korsakova 2008; 108(11): 43–46.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Syndrom třeseného dítěte
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2010 Číslo 4- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Modelování vývoje tělesné délky a výšky dětí s pomocí údajů o výšce rodičů
- Epidemiologie nefatálních úrazů a vývoj dětské úrazovosti v posledním desetiletí v České republice. Změna v dosavadním trendu?
- Syndrom třeseného dítěte
- Možnosti manažmentu diabetickej neuropatie v detskom veku
- Progresivní familiární intrahepatální cholestáza
- Významné životní jubileum docentky Jany Hamanové
- Za docentkou MUDr. Janou Varvařovskou, PhD., členkou britské Královské pediatrické společnosti (FRCPCH)
- Nedožitých 50 rokov RNDr. Libora Kozáka, CSc.
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Progresivní familiární intrahepatální cholestáza
- Syndrom třeseného dítěte
- Modelování vývoje tělesné délky a výšky dětí s pomocí údajů o výšce rodičů
- Nedožitých 50 rokov RNDr. Libora Kozáka, CSc.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



